用于将分子递送至细胞的细胞质中的构建体的制作方法
本发明涉及构建体,其包含(a)靶向性部分;(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;以及(c)待递送至细胞的细胞质中的分子。此外,本发明涉及药物组合物,其包含根据本发明的构建体和任选的药学上可接受的载体。此外,本发明涉及试剂盒,其包含衍生自登革热病毒糖蛋白e的一个或多个融合序列,所述融合序列包含seqidno:1所示的序列或与seqidno:1相比显示有1至8个取代、缺失或插入的序列。此外,本发明涉及衍生自登革热病毒糖蛋白e的一种或多种融合序列用于将治疗性部分、可检测部分、核酸分子(优选地是sirna)、载体分子(优选地是纳米颗粒、脂质体和病毒载体)递送进入细胞的细胞质中的用途。
在过去的十年中,核糖核酸酶a(rna酶a)超家族的成员已经崭露头角,成为用于癌症的抗体靶向治疗的潜在新类型的效应子化合物(newton等人,2001;delorenzo等人,2004;arndt等人,2005;chang等人,2010;liu等人,2014)。ranpirnase
尽管许多不同的因素可能有助于不同免疫rna酶的显著不同的细胞毒性特性,但是可以想象,对内体截留的克服程度(erickson等人,2006)是rna酶接近细胞溶质底物并最终导致细胞死亡的决定性因素之一。据报道,蛋白质治疗剂在内溶酶体区室中被截留是功效损失或甚至丧失的主要原因(erickson等人,2006;pirie等人,2011)。
开发用于有效和特异性递送靶向治疗剂的方法在生物治疗例如蛋白质和基因治疗中仍然是一个问题。任何生物制剂如dna、sirna和蛋白质进入细胞的主要吸收机制是内吞途径。细胞靶向试剂被截留在内体中并将受到溶酶体中的特定酶的降解。因此,有效的基于生物的治疗的先决条件是促进内体逃逸并确保治疗剂在细胞溶质内的递送。
已经评估了不同的方法以克服靶向融合蛋白的内体积累和溶酶体降解,例如,使用蛋白质转导结构域(snyder等人,2005)、渗漏诱导分子(weng等人,2012)或内体膜的光诱导破坏(weyergang等人,2011)。在这些策略中,病毒蛋白质转导结构域已被成功地用作分子载体,用于改善基于蛋白质的治疗剂的细胞溶质递送(chignola等人,1995;tolstikov等人,1997;hetzel等人,2008)。
近年来,包括病毒序列的蛋白质转导结构域(ptd)已经成功地被用于改善核糖核酸酶或基于毒素的免疫试剂的内体逃逸和抗肿瘤活性(chignola等人,1995;hetzel等人,2008)。可以容易地通过重组dna技术将ptd并入融合蛋白中。
因此,研究者们已对来自不同来源的内体逃逸剂进行研究以促进生物制剂的内体逃逸。
基于蛋白质和肽的试剂是内体逃逸试剂的主要类型,其衍生于数种病毒、细菌、植物和人/动物来源(也参见varkouhi等人,2011jcontr.release的综述文章)。此外,重组dna技术已能够生产具有精确组成、序列和长度的氨基酸重复区段的小分子量和大分子量多肽。此外,已经应用了化学试剂和光化学方法来破坏内体膜。
病毒已进化出几种精细的机制,以克服进入宿主细胞的障碍,因此是自然界中有效的膜穿透及内体逃逸的优秀实例。已有将病毒蛋白质的小肽结构域在抗体融合蛋白或抗体缀合物中用作蛋白质转导结构域或细胞穿透肽。研究最广泛的与膜有融合作用的病毒序列是来自hiv1转录激活蛋白tat的蛋白质转导结构域tat、来自乙型肝炎病毒表面抗原(tlm)的pres2结构域的基序、hsv-1结构蛋白vp22以及流感病毒的血凝素(ha)蛋白的ha2亚基的不同序列。
然而,融合蛋白的特异性可能会根据所使用的ptd有所减少,因为存在可以经由ptd的直接转导发生进入细胞的情况(bachran等人,2005)。因此,可观察到靶外细胞毒性,即非特异性毒性(fuchs等人,2013)。
为了避免这些脱靶效应,保持靶特异性是至关重要的。
因此,需要提供改进的手段和方法将分子递送到细胞的细胞质中,从而提高需递送到细胞质的分子的效率。
惊人地,本发明证明源自登革热病毒的融合序列可以用作连接细胞毒性部分与抗体部分的新连接子。该连接子含有糖蛋白e的推定融合肽的98-112号氨基酸残基,其参与与内体膜的融合,从而使得病毒核衣壳能够释放到细胞溶质中(melo等人,2009;huang等人,2010;zaitseva等人,2010)。在本发明的实施例中,该融合肽已经用于通过促进ranpirnase有效被转运到胞质溶胶中来特异性增强ranpirnase的细胞毒性。通过证明ranpirnase-den-scfv的细胞毒性远远优于缺乏融合连接子的ranpirnase-gs-scfv,本发明提供了证据,证明rna酶接近细胞溶质底物是促进抗肿瘤活性的关键步骤。
上述技术问题通过提供在权利要求中表征的实施方式得到解决。因此,本发明提供了构建体,其包含(a)靶向性部分;(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;以及(c)待递送到细胞的细胞质中的分子。
令人惊讶的是,本发明证明衍生自登革热病毒糖蛋白e的序列drgwgngcglfgkggi(seqidno:1)使得包含人源化抗egfrscfv和ranpirnase的免疫rna酶相比缺乏病毒序列的构建体,其特异性细胞毒性有显著改善,提高系数高达95,同时避免了脱靶效应(非特异性细胞毒性)。
这尤其令人惊讶,因为从其病毒蛋白的天然背景中对特定序列进行分离并且人工地在构建体中进行实施都是不可预测的,因为完全不能预测(i)相应的病毒序列是否在发挥介导“内体逃逸”的能力同时避免脱靶效应,即避免产生非特异性细胞毒性。
然而,如上所述,解决了提供用于将分子递送到细胞的细胞质中,从而提高待递送至细胞质的分子的效率的改进方式和方法的技术问题,本发明提供了一种构建体,其包含(a)靶向性部分;(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;以及(c)待递送到细胞的细胞质中的分子。
本发明的构建体优选包含三个主要模块,即靶向性部分;(b)由一个或多个融合序列组成的融合部分以及(c)待递送到细胞的细胞质中的分子(即,“货物”)。然而,还可以设想,该构建体也可以缺少这三个模块中的一个。因此,如下文进一步解释的,构建体还可缺少待递送到细胞的细胞质中的分子,因为可以想象靶向性部分本身代表“货物”,即为将要递送到细胞的细胞质中的分子。因此,在这种情况下,构建体仅包含两个主要模块,即靶向性部分;以及(b)由一个或多个融合序列组成的融合部分。
构建体的一个模块,即“靶向性部分”涉及能够将所连接的分子特异性递送至给定细胞类型的分子,并且优选能够与给定标记物(优选为与该细胞类型相关抗原)结合。因此,“靶向性部分”能够特异性地检测并结合至其靶标,即在特定的靶细胞中特异发现的细胞表面上的给定(标记物)结构。本发明关于“靶向性部分”不受限制,因为靶向性部分的性质取决于“货物”待递送到其细胞质中的期望细胞。因此,如下,进一步地,仅给出靶向性部分的非限制性实例。本领域技术人员了解对于给定细胞特异的“靶向性部分”(或相应的抗原)是什么。对细胞特异是指特定靶向性部分(或相应的抗原)专门地或至少主要地存在于给定(靶)细胞上,而其不存在于其它细胞上。
构建体的第二个模块,即由融合序列组成的融合部分是促进膜穿透和内体逃逸并由此介导给定分子从内体释放进入细胞的细胞质的部分或序列。
构建体的第三个模块,即“货物”或待递送到细胞的细胞质中的分子可以是任何所需的分子,例如不是天然发生/存在于细胞的细胞质中。因此,可以使用任何可想像到的“货物”,只要是期望将该分子导入某个细胞的细胞质。因此,本发明不限于某类“货物”,因此,下面进一步提供的仅为非限制性实例。
构建体可以以融合蛋白的形式存在,即通过表达由组合至少两种基因序列制备的杂交基因而形成的蛋白质。通常,如将在下文进一步更详细地解释的,可通过将cdna与现有基因同框克隆到表达载体中来实现这一点。因此,构建体可以是融合蛋白,即通过在一个模块的氨基末端和另一个分子的羧基末端之间的肽键连接两个或更多个多肽而形成的嵌合分子。以这种方式,上述至少两个模块,优选所有三个模块以融合蛋白的形式连接在一起,只要所述至少两个模块,优选地三个模块是蛋白质性质的即可。一旦被克隆至阅读框内,即可通过编码所述融合蛋白的相应核酸序列来重组表达该融合蛋白。
备选地,所述至少两个模块,优选地所有三个模块也可以通过化学缀合物共价偶联。因此,构建体的模块可以以共价键而化学偶联。
还可以想像,两个模块以融合蛋白的形式,而第三个模块以共价键而化学偶联。具体而言,在“货物”非蛋白质性质的情况下,其通过共价键与模块(a)和模块(b)化学偶联。
缀合物内的三个模块的排列没有具体限制。因此,融合部分/融合序列(b)可以位于靶向性部分(a)和待递送至细胞质的分子(即“货物”)(c)之间。然而,本发明的融合部分/融合序列也可能在其它位置。因此,融合部分/融合序列也可以位于任一端(即融合蛋白的情况下在n-或c-末端)。因此,构建体可具有(b)-(c)-(a)或(b)-(a)-(c)或(c)-(a)-(b)或(c)-(b)-(a)的排列。因此,模块(c)、(a)和(b)可分别位于其他模块(b)和(a),(b)和(c),(c)和(b)以及(c)和(a)之间。然而,优选地,所述融合部分/融合序列位于靶向性部分(a)和将递送至细胞的细胞质中的分子(c)之间,并因此,构建体可以具有(a)-(b)-(c)或(c)-(b)-(a)的排列。
构建体还可以缺少靶向性部分。因此,在这样的构建体中,融合部分/融合序列可以直接融合(或以共价键化学偶联)至待递送到细胞的细胞质中的分子。融合部分/融合序列的定位可以在任一端。
如上所述,构建体还可缺少“货物”,即待递送至细胞的细胞质的分子,因为靶向性部分自身可以同时是待递送至细胞的细胞质的分子。因此,在这样的构建体中,融合部分/融合序列可以直接融合(或以共价键化学偶联)至靶向性部分。在这种情况下,靶向性部分优选是下文进一步定义的抗体或抗原结合片段。融合部分/融合序列的定位可以在任一端。
本发明构建体的主要模块是由一个或多个融合序列组成的靶向性部分,所述融合序列衍生自登革热病毒糖蛋白e并且包含氨基酸序列drgwgngcglfgkggi(seqidno:1)。
“一个或多个”是指靶向性部分可以具有本发明的一个融合序列。靶向性部分还可以具有本发明的两个、三个或四个融合序列。备选地,靶向性部分还可以具有本发明的5个或甚至更多个融合序列。
登革热病毒糖蛋白e血清型2的全长序列是本领域已知的,并且具有如seqidno:21所示的序列。在所附实施例中虽然已使用的是登革热病毒糖蛋白e血清型2的96至114号氨基酸序列(即,氨基酸序列mvdrgwgngcglfgkggiv(seqidno:3)),但本发明的融合序列至少包含登革热病毒糖蛋白e血清型2的糖蛋白e的98至113号氨基酸核心区,即氨基酸序列drgwgngcglfgkggi(seqidno:1)。然而,优选地,衍生自登革热病毒糖蛋白e的融合序列包含氨基酸序列mvdrgwgngcglfgkggiv(seqidno:3)。
然而,本发明中使用的融合序列不具体限于上述特定序列,也可以是这样的融合序列,其包含与seqidno:1相比显示有1至8个取代、缺失或插入的序列。备选地,融合序列还可以是这样的序列,其包含与seqidno:3相比显示有1至8个取代、缺失或插入的序列。融合序列还可以是这样的序列,其包含与seqidno:1(或seqidno:3)相比显示有1至7个取代、缺失或插入的序列。融合序列还可以是这样的序列,其包含与seqidno:1(或seqidno:3)相比显示有1至6个取代、缺失或插入的序列。融合序列还可以是这样的序列,其包含与seqidno:1(或seqidno:3)相比显示有1至5个取代、缺失或插入的序列。融合序列还可以是这样的序列,其包含与seqidno:1(或seqidno:3)相比显示有1至4个取代、缺失或插入的序列。融合序列还可以是这样的序列,其包含与seqidno:1(或seqidno:3)相比显示有1至3个取代、缺失或插入的序列。融合序列还可以是这样的序列,其包含与seqidno:1(或seqidno:3)相比显示有1至2个取代、缺失或插入的序列。最优选地,融合序列还可以是这样的序列,其包含与seqidno:1(或seqidno:3)相比显示有1个取代、缺失或插入的序列。
优选地,与seqidno:1(或seqidno:3)相比,上述氨基酸取代、缺失或插入的位置在(a)seqidno:1(或seqidno:3)序列中与其它黄病毒科(flaviviridae)家族成员对应登革热病毒糖蛋白e序列的序列相比不那么保守的位置。已知本发明的序列在黄病毒科的成员中是高度保守的。
为了确定某一氨基酸位置是否较不保守,并能因此优选受到如上所述的修饰,本领域技术人员可以使用本领域熟知的方式和方法,例如,手动或通过使用本领域技术人员已知的计算机程序进行比对。这种比对可以例如使用本领域技术人员已知的方式和方法进行,例如,通过使用已知的计算机算法如lipman-pearson方法(science227(1985),1435)或clustal算法。优选地,在这种比对中,为氨基酸序列中存在的保守氨基酸残基分配最大同源性。优选地,使用clustalw2进行氨基酸序列的比较。在成对比较/比对的情况下,优选地选择以下设置:蛋白质重量矩阵:blosum62;缺口打开:10;缺口延伸:0.1。在多重比较/比对的情况下,优选地选择以下设置:蛋白质重量矩阵:blosum62;缺口打开:10;缺口延伸:0.2;缺口距离:5;无末端缺口。
那些被证明是“同一的”(即,在黄病毒科的成员中“保守的”)的位置优选地不进行取代、缺失或插入。根据本发明,在两个或更多个核酸或氨基酸序列的情况中,术语“同一的”或“百分比同一性”是指两个或更多个序列或子序列,它们是相同的,或它们具有指定百分比的氨基酸残基或核苷酸与seqidno:1或seqidno:3中相同。优选地,所描述的同一性存在于至少约19个氨基酸(即,上述登革热病毒糖蛋白e血清型2的96至114号氨基酸)的区域(即,氨基酸序列mvdrgwgngcglfgkggiv(seqidno:3))或至少约16个氨基酸的区域(即,上述登革热病毒糖蛋白e血清型2的糖蛋白e的98至113号氨基酸核心区域,即氨基酸序列drgwgngcglfgkggi(seqidno:1)中。本领域技术人员将知道如何使用例如基于本领域已知的clustalw计算机程序或fastdb(brutlagcomp.app.biosci.6(1990),237-245)的算法来确定序列之间的百分比同一性(thompsonnucl.acidsres.2(1994),4673-4680)。
尽管fastdb算法在其计算中通常不考虑序列中的内部不匹配缺失或添加,即缺口,但是可以手动校正以避免高估同一性%。然而,clustalw在其同一性计算中会考虑序列缺口。blast和blast2.0算法也是对本领域技术人员开放的(altschul,(1997)nucl.acidsres.25:3389-3402;altschul(1993)j.mol.evol.36:290-300;altschul(1990)j.mol.biol.215:403-410)。用于核酸序列的blastn程序默认使用字长(w)11,期望值(e)10,m=5,n=4并两条链都进行比较。对于氨基酸序列,blastp程序默认使用字长(w)3,期望值(e)10。blosum62评分矩阵(henikoff(1989)pnas89:10915)使用比对(b)50,期望值(e)10,m=5,n=4,并默认两条链都进行比较。
优选地,参比seqidno:1和3的序列的上述多至1、2、3、4、5、6、7或8个氨基酸取代为保守氨基酸取代。
这些“保守性氨基酸取代”是指蛋白质中氨基酸被具有相似特征(例如电荷,侧链大小,疏水性/亲水性,骨架构象和刚性等)的其它氨基酸的取代,这样可以经常作出变化而不改变蛋白质的生物活性。本领域技术人员认识到,一般而言,多肽的非必需区域中的单个氨基酸的取代基本上不改变生物活性(参见例如watsonmolecularbiologyofthegene,thebenjamin/cummingspub.co.4thed.(1987),224)。另外,结构上或功能上相似的氨基酸的取代更不会破坏生物学活性。在本发明的上下文中,本发明的融合序列包含这样的多肽链,其序列当与本文所公开的特定氨基酸序列例如seqidno:1或seqidno:3相比较时,包括至多0(无改变)、1、2、3、4、5、6、7或8个保守氨基酸取代。
根据如下表1所示的那些优选地制备这样的示例性取代:
表1
示例性保守氨基酸取代
与seqidno:1(或seqidno:3)相比具有一个或多个上述取代、缺失或插入的融合序列可以产生具有(在融合性质方面)相似能力的融合序列,优选具有比seqidno:1(或seqidno:3)更高的能力。与seqidno:1(或seqidno:3)相比的给定修饰的融合序列的特性/能力可以由本领域技术人员通过本领域已知的并在所附实施例中概述的方法容易地确定。因此,与seqidno:1(或seqidno:3)相比的给定修饰的融合序列的(融合)特性/能力涉及某一具体序列的活性,以具有能力来介导“内体逃逸”(即促进融合序列以允许膜穿透和内体逃逸,并因此调节给定分子从内体向细胞的细胞质中的释放),同时避免/减少脱靶效应,即,非特异性细胞毒性。“内体逃逸”和“非特异性细胞毒性”可以例如通过所附实施例中描述的并在下文概述的方法进行测定。
具有细胞毒性性质的靶蛋白的内体逃逸效率可以通过细胞活力测定来确定。使用该测定,可以测定使细胞活力降低50%所需的、包含融合序列(例如,免疫rnase融合蛋白)的靶蛋白的浓度(ic50),并与缺乏融合序列的对照靶蛋白的ic50进行比较。为此,将靶细胞接种在96孔平底板中并与不同浓度的靶蛋白或缓冲液(作为对照)在37℃,5%co2温育72小时,总体积为100μl。可以例如通过加入20μl的3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(mtt)溶液(稀释于pbs,5mg/ml)来测定细胞活力。在37℃,5%co2与mtt孵育4小时后,除去培养基并将细胞在每孔100μl裂解溶液(10%sds(w/v)和0.6%乙酸(v/v)亚砜)中裂解。将平板在室温下温育5分钟,然后温和搅拌5分钟以溶解释放的甲瓒晶体。通过使用酶标仪(例如infinitef200protecan)测量570nm处的吸光度(620nm作为参考)来确定甲瓒浓度。备选地,可以通过每孔加入10μl的
可使用上文描述的细胞活力测定证明针对非靶细胞(例如抗原阴性细胞)的非特异性细胞毒性。
然而,本发明中使用的融合序列不具体受限于上述特定序列和上述缺失、取代或插入,而是还可涉及融合序列,其包含与seqidno:1或seqidno:3相比显示有氨基酸添加的序列。氨基酸的添加可以在两侧或可以散在分布。因此,添加的氨基酸可以添加至本发明的融合序列的n-和/或c-末端。备选地,或除了这些在两侧添加的氨基酸之外,所添加的氨基酸也可以在本发明的融合序列的氨基酸序列内。所添加的氨基酸包含多至0个(无变化)、1、2、3、4、5、6、7、8、9或10个氨基酸,优选多至20个氨基酸或甚至更优选多至30个氨基酸的多肽链。鉴于氨基酸的添加不大可能改变本发明融合序列的上述功能特性的要求,氨基酸的添加长度也可以多至40、50、60、70、80、90或甚至100个氨基酸或甚至更多,多至200、300、400或500个氨基酸,只要这些序列具有与seqidno:1(或seqidno:3)相似的(在融合性上的)能力,优选具有比如上定义的seqidno:1(或seqidno:3)更高的能力。
在根据本发明的构建体中,所述融合序列自以下序列构成的组:
drgwgngcglfgkgsi(seqidno:5);
drgwgngcglfgkgsl(seqidno:6);
drgwgngcglfgkggv(seqidno:7);
drgwhngcglfgkgsi(seqidno:8);
drgwhngcgffgkgsi(seqidno:9);
drgwgngcglfgkgsm(seqidno:10);
drgwgngcglfgkgsy(seqidno:11);
drgwnngcglfgkgsl(seqidno:12);
nrgwnngcglfgkgdi(seqidno:13);
drgwgnhcglfgkgsi(seqidno:14);
drgwgnncglfgkgsi(seqidno:15);
drgwgngcalfgkgsi(seqidno:16);
drgwgnhcgffgkgsi(seqidno:17);
drgwdsgcfifgkgev(seqidno:18);
nrgwgtgcfkwgigfv(seqidno:19)及
nrgwgtgcfewglgqv(seqidno:20)。
然而,用于本发明的融合序列不具体受限于上述seqidno:5至20的特定序列,也可以是融合序列,其包含与seqidno:5至20相比分别显示有1至8个取代、缺失或插入的序列。在这方面,在取代、缺失或插入的程度上,如上文已经关于seqidno:1和seqidno:3所述的内容加以必要的修改同样适用于seqidno:5至20。此外,融合序列不限于上述seqidno:5至20,还可涉及融合序列,其包含与所述序列相比显示有氨基酸添加的序列。在这方面,关于所述氨基酸的添加,如上文已针对seqidno:1和seqidno:3所述的内容加以必要的修改同样适用。
本发明的融合序列可以通过本领域技术人员已知的方法重组产生或合成。更具体地,如下文进一步描述的,可以由本领域技术人员已知的方法重组产生本发明的融合肽,或者可以例如使用固相支持物和重复正交去保护并偶联的标准技术方便地在自动肽合成仪中合成。将后续用于进行部分或其它试剂的缀合的肽的游离氨基用标准保护基如boc基团将其保护是有利的,而n-末端残基可以被乙酰化以增加血清稳定性。这些保护基团是本领域技术人员公知的;参见greeneandwutsprotectivegroupsinorganicsynthesis,1999(johnwileyandsons,n.y.)。当制备肽后续用于本发明构建体中,有利地是将其从树脂上裂解以产生相应的c-末端酰胺,以抑制体内羧肽酶活性。
如上文提到的,构建体的一个模块,即“靶向性部分”涉及能够将连接的分子特异性递送至给定细胞类型并且优选能够与给定标记物(优选)结合的分子,所述标记物与该细胞类型相关。因此,“靶向性部分”能够特异性地检测并结合其靶标,即,在特定的靶细胞中发现的细胞表面的给定(标记物)结构。
如在本发明的上下文中使用的术语“结合至”定义为至少两个“抗原相互作用位点”彼此的结合(相互作用),即一方面是靶向性部分,另一方面是细胞表面上的相应的抗原或表位。根据本发明,术语“抗原相互作用位点”定义为靶向性部分的基序,优选为抗体或抗体片段的一部分或者细胞因子或配体,其显示与待靶向的细胞的特异性抗原或抗原的特异性基团的能力。所述结合/相互作用也被理解为定义了“特异性识别”。根据本发明,术语“特异性识别”是指靶向性部分能够与待靶向的细胞特异的至少一种表面结构特异性相互作用和/或结合。靶向性部分可以与待靶向的细胞上的(一个或多个)表位相互作用和/或结合,同时该结构、抗原或表位对于待靶向的细胞是特异性的。术语“特异性识别”涉及靶向性部分的特异性,即涉及其区分待靶向的细胞和不靶向的细胞的特定区域的能力,因此,不靶向的细胞不会具有特异于待靶向的细胞的结构、抗原或表位。本领域技术人员了解并且可以得到对于某些细胞是特异性的并且不存在于非靶细胞上的结构、表位、表面标志物和/或抗原,并且可以相应地容易地选择靶标。下面进一步给出非限制性实例。
根据本发明使用的术语“特异性相互作用”是指靶向性部分不与或基本上不与相似结构的(多)肽、结构、表位、表面标记物和/或抗原交叉反应。
可以例如通过在常规条件下评估所述靶向性部分对目标结构及多个或更多或更少(在结构上和/或功能上)密切相关的结构的结合来测试研究中的一组靶向性部分的交叉反应性(参见例如harlow和lane,antibodies:alaboratorymanual,coldspringharborlaboratorypress,(1988)和usingantibodies:alaboratorymanual,coldspringharborlaboratorypress,(1999))。只有那些结合至待靶向的细胞的某些选定结构(即,对所述细胞是特异性的结构),但不会或基本上不会结合任何其它结构的靶向性部分被认为是特异于所述目的细胞并被选择。这些方法尤其可以包括结合研究,用结构上和/或功能上密切相关的分子进行封闭和竞争研究。这些结合研究还包含facs分析、表面等离子体共振(spr,例如用
术语“结合至”不仅涉及线性结构,例如线性表位,而且还涉及构象表位、结构表位或由人靶分子或其部分的两个区域组成的不连续表位。在本发明的上下文中,构象表位由在一级序列中分开的两个或更多个不连续的氨基酸序列限定,当多肽折叠成天然蛋白质时,这些氨基酸在分子表面聚到一起(sela,science166(1969),1365和laver,cell61(1990),553-536)。此外,术语“结合至”在本发明的上下文中与术语“与...相互作用”或“识别”可交换使用。
因此,可以通过本领域已知的方法和本文所述的方法进行实验确定特异性。所述方法包括但不限于western印迹、elisa-、ria-、ecl-、irma-测试和肽扫描。
如上文提到的,本发明不限于“靶向性部分”,因为靶向性部分的性质取决于要将“货物”递送至其细胞质的所需细胞。本领域技术人员了解特异于给定细胞的“靶向性部分”或抗原。与上文一致,特异于某个细胞是指某个靶向性部分或抗原专门地或至少主要地存在于给定(靶)细胞上,而它不存在于其它细胞上。
因此,在根据本发明的构建体中,靶向性部分可以是抗体、抗体片段、设计的锚蛋白重复序列蛋白(darpin)、细胞因子或配体。
在本发明的上下文中的配体可以是某些细胞表面分子或结构(优选细胞表面受体(膜受体,跨膜受体))的对应物,即通常参与特定细胞和外界通讯的专门的整合膜蛋白质。细胞外信号传导分子(即细胞表面受体的相应配体,通常是激素、神经递质、细胞因子、生长因子或细胞识别分子)与受体结合,触发细胞功能的变化。这个过程称为信号转导。所述结合在膜的细胞内侧触发化学变化。以这种方式,受体在细胞通讯和信号转导中发挥独特和重要的作用。许多细胞表面受体对某种类型的细胞或细胞亚群是特异的,因此,就本发明而言,相应的配体可以是用于特异性靶向特定细胞的合适的靶向性部分。本领域技术人员熟知特异于给定细胞的配体,并且可以基于所要靶向的所需细胞选择某种配体。配体的氨基酸序列是本领域公知的,且任何这样的已知序列都可以在本发明的上下文中用作靶向性部分。技术人员了解关于配体序列的众多公共信息资源。例如,ncbi数据库含有大量配体的蛋白质和编码核酸序列。对于技术人员而言,选择和鉴定基本上适用于任何目的配体的氨基酸和/或核酸序列并将其用作根据本发明的靶向性部分是常规问题。
特异性配体可以是例如细胞因子。细胞因子是在细胞信号传导中重要的一类范围广泛和宽松的小蛋白质
如所提到的,靶向性部分也可以为特异性抗体或抗体片段。
术语抗体或抗体片段是本领域技术人员已知的,也称为免疫球蛋白(ig),其是由浆细胞产生的大y形蛋白,通常由免疫系统用于鉴别并中和外来物体如细菌和病毒。抗体识别外来靶标的独特部分,称为抗原。抗体的“y”的每个末端都包含对抗原上的一个特定表位特异的互补位(类似锁结构),允许这两个结构精确地结合在一起。因此,鉴于这种特异性,就本发明而言,抗体或抗体片段是最优选的靶向性部分,因为本领域技术人员可以容易地制备对待靶向的给定细胞上的特定结构/抗原/表位具有高度特异性的抗体或抗体片段。抗体是属于免疫球蛋白超家族的糖蛋白。抗体通常由基本结构单元形成,每个单元都具有两个大的重链和两个小的轻链。技术人员已知存在几种不同类型的抗体重链和几种不同种类的抗体,基于它们具有的重链将其分为不同的同种型。在哺乳动物中已知五种不同的抗体同种型,其执行不同的作用,并且有助于对其遇到的每种不同类型的异物诱导适当的免疫应答。
尽管所有抗体的通用结构是非常类似的,但这些蛋白质尖端的一小片区域是极度可变的,这样可存在数百万种抗体,其仅仅是尖端结构或抗原结合位点有轻微不同。此区域被称为超变区。这些变体中的每个都可以结合不同的抗原。抗体的这种巨大的可变性使得免疫系统能识别具有相同可变性的大量抗原并可在本发明的条件下用于制备能足够特异地靶向所需靶细胞的特异性抗体或抗体片段。这种针对几乎待靶向的细胞上任何可能的(特异性)结构生成可能的抗体或抗体片段的能力使抗体或抗体片段成为本发明条件下用作靶向性部分的最好选择。因此,由于这个原因,本发明的靶向性部分可以为抗体或抗体片段,用于将待递送至细胞的细胞质的分子的靶向递送。
用于本发明上下文中的抗体或其片段没有具体限制,只要其是能够特异性结合或特异性识别根据前述的待靶向细胞表面的结构,或与其相互作用的抗体或其抗原结合片段即可。
用作靶向性部分的抗体或其抗原结合片段可以是单克隆抗体或多克隆抗体。
本文使用的术语“单克隆抗体”是指获自基本上同质的抗体群的抗体,即组成群体的单个抗体是相同的,除了可能有少量的天然发生的可能突变。单克隆抗体是高度特异性的,针对的是单个抗原位点。单克隆抗体有利的是它们可以通过杂交瘤培养物合成,基本上不受其它免疫球蛋白污染。修饰的“单克隆”表示抗体的特征与基本上同质的抗体群相同,并且不应解释为需要通过任何特定方法来产生。如上所述,根据本发明使用的单克隆抗体可以通过kohler,nature256(1975),495描述的杂交瘤方法制备。
本文使用的术语“多克隆抗体”是指在一种或多种其它非同一性抗体当中或在所述其它抗体存在下产生的抗体。通常,多克隆抗体是在产生非同一性抗体的数种其它b淋巴细胞的存在下由某种b淋巴细胞产生。多克隆抗体经常直接获自经免疫的动物。
抗体还可以是“完全人源抗体”,指代仅包含人免疫球蛋白序列的抗体。如果所述完全人源抗体在小鼠、小鼠细胞或衍生自小鼠细胞的杂交瘤中产生,则可以包含鼠碳水化合物链。类似地,“小鼠抗体”或“鼠抗体”是指仅包含小鼠/鼠免疫球蛋白序列的抗体。备选地,如果“完全人源抗体”在大鼠、大鼠细胞,来源于大鼠细胞的杂交瘤中产生,则可以含有大鼠碳水化合物链。类似地,术语“大鼠抗体”是指仅包含大鼠免疫球蛋白序列的抗体。完全人源抗体也可以例如通过噬菌体展示产生,所述噬菌体展示是能够产生和筛选完全人源抗体的广泛使用的筛选技术。噬菌体抗体也可用于本发明的上下文中。噬菌体展示方法描述于例如us5,403,484、us5,969,108和us5,885,793中。能够开发完全人源抗体的另一种技术涉及小鼠杂交瘤技术的修饰。对小鼠进行转基因使其含有人免疫球蛋白基因座以交换其自身的小鼠基因(参见例如us5,877,397)。
抗体还可以是“嵌合抗体”,其指代抗体,其中本发明的可变区融合或嵌合于另一种人或非人物种(例如小鼠、马、兔、狗、牛、鸡)的抗体区(例如,恒定区)的。
术语抗体还涉及重组人源抗体、异源抗体和异源杂交抗体。术语“重组人源抗体”包括通过重组方法制备、表达、产生或分离的所有人源序列抗体,例如分离自针对人免疫球蛋白基因进行转基因的动物(例如小鼠)分离的抗体;使用转染到宿主细胞中的重组表达载体表达的抗体,分离自重组的组合人源抗体文库的抗体,或通过涉及将人免疫球蛋白基因序列剪接至其它dna序列的任何其它方法制备、表达、产生或分离的抗体。此类重组人抗体具有衍生自人种系免疫球蛋白序列的可变区和恒定区(如果存在恒定区)。然而,可以对这些抗体进行体外诱变(或当使用针对人ig序列进行转基因的动物时,进行体内体细胞诱变),并且因此重组抗体的vh和vl区的氨基酸序列是这样的序列,尽管其衍生自人类种系vh和vl序列并与之相关,但可以不在体内天然存在于人源抗体种系所有组成成分中。
抗体还可以相对于产生所述抗体的转基因非人生物体被定义为“异源抗体”。该术语指代具有对应于在不由转基因非人动物组成的生物体中发现的那些氨基酸序列或编码核酸序列的抗体,并且通常来自转基因非人动物以外的物种。
抗体也可以是“异源杂合抗体”,指代轻链和重链为不同生物来源的的抗体。例如,具有结合鼠轻链的人重链的抗体是异源杂合抗体。异源杂合抗体的实例包括嵌合和人源化抗体。
术语抗体也涉及人源化抗体。非人(例如鼠或兔)抗体的“人源化”形式是嵌合免疫球蛋白、免疫球蛋白链或其片段(例如fv、fab、fab'、f(ab')2或抗体的其他抗原结合子序列),其包含衍生自非人免疫球蛋白的最小化序列。通常,人源化抗体是这样的人免疫球蛋白(受体抗体),其中受体的互补决定区(cdr)的残基被来自非人物种(供体抗体)例如小鼠,大鼠或兔的cdr的残基取代,所述供体抗体具有所需的特异性、亲和力和功能。在一些例子下,人免疫球蛋白的fv框架残基被相应的非人残基取代。此外,人源化抗体可以包含在受体抗体和导入的cdr或框架序列中均未发现的残基。作出这些修饰可以进一步改进和优化抗体性能。通常,人源化抗体会包含至少一个,通常两个可变结构域中所有或基本上所有结构域,其中所有或基本上所有的cdr区都对应于非人免疫球蛋白的cdr区,并且所有或基本上所有的fr区都具有人免疫球蛋白共有序列。人源化抗体还可包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白的恒定区。详见:jonesnature321(1986),522-525;reichmannnature332(1998),323-327和prestacurropstructbiol2(1992),593-596。
用于抗体人源化的一种普及的方法涉及cdr植入,其中将来自非人“供体”抗体的功能性抗原结合位点植入到到人“受体”抗体上。cdr植入方法是本领域已知的,并且描述于例如us5,225,539、us5,693,761和us6,407,213中。另一种相关方法是从转基因动物产生人源化抗体,所述转基因动物经遗传工程化含有一个或多个能够进行基因重排和基因转化的人源化免疫球蛋白基因座(参见例如us7,129,084)。
因此,在本发明的上下文中,术语“抗体”涉及完全免疫球蛋白分子以及这些免疫球蛋白分子的部分(即,“其抗原结合片段”)。此外,如上所述,该术语涉及经修饰的和/或经改变的抗体分子。该术语还涉及重组地或合成地产生/合成的抗体。该术语还涉及完整抗体以及其抗体片段,如分离的轻链和重链、fab、fv、fab'、fab'-sh、f(ab')2。术语抗体还包括但不限于完全人源抗体、嵌合抗体、人源化抗体、cdr植入抗体和抗体构建体,如单链fv(scfv)或抗体融合蛋白。此外,靶向性部分可以是f(ab')2、f(ab)2、fab'、fv抗体片段、scfv、fab、vh、scfv-fc、sdfv、双链抗体、三链抗体、四链抗体、微小抗体(minibody)、串联scfv、串联scfv-fc、scfv-fc-scfv、fab-scfv、fab3、igg-scfv、scfv-igg、igg-vh或单结构域抗体,优选地sdab、来自骆驼的vhh片段或来自软骨鱼的vnar片段。
所述抗体可以为全长抗体,即常常被称为全抗体的完全免疫球蛋白分子。
在本发明的上下文中,“单链fv”或“scfv”抗体片段具有抗体的vh和vl结构域,其中这些结构域存在于单个多肽链中。通常,scfv多肽还包含vh和vl结构域之间的多肽连接子,其使得scfv形成抗原结合所需的结构。所描述的用于产生单链抗体的技术描述于例如plückthuninthepharmacologyofmonoclonalantibodies,rosenburgandmooreeds.springer-verlag,n.y.(1994),269-315。
如本文所用的,“fab片段”由一条轻链以及重链的ch1和可变区组成。fab分子的重链不能与另一个重链分子形成二硫键。
“fc”区域包含两个重链片段,其包含抗体的ch2和ch3结构域。所述两个重链片段是由两个或更多个二硫键及通过ch3结构域的疏水相互作用保持在一起。
“fab'片段”含有一条轻链和一条重链的一部分,该部分含有vh结构域和ch1结构域,以及ch1和ch2结构域之间的区域,使得可以在两个fab'片段的两条重链之间形成链间二硫键从而形成f(ab')2分子。
“f(ab')2片段”包含两条轻链和两条含有ch1和ch2结构域之间的部分恒定区的重链,使得在两条重链之间形成链间二硫键。因此,f(ab')2片段由通过两条重链之间的二硫键保持在一起的两个fab'片段组成。
“fv区”包含来自重链和轻链两者的可变区,但缺乏恒定区。
根据本发明使用的抗体、抗体构建体、抗体片段、抗体衍生物(均衍生自ig)或其相应的免疫球蛋白链可以使用本领域已知的常规技术进一步修饰,例如通过使用氨基酸缺失、插入、取代、添加和/或重组,和/或本领域已知的任何其它修饰,这些修饰可以单独使用或组合使用。向作为免疫球蛋白链的氨基酸序列基础的dna序列中引入所述修饰的方法是本领域技术人员熟知的;参见,例如,在引文中的sambrook(1989)。术语“ig衍生结构域”具体涉及包含至少一个cdr的(多)肽构建体。所述ig衍生结构域的片段或衍生物限定了这样的(多)肽,其为上述抗体分子的部分和/或其通过化学/生物化学或分子生物学方法得到修饰。相应的方法是本领域已知的,尤其在实验室手册中描述(参见sambrook等人,molecularcloning:alaboratorymanual;coldspringharborlaboratorypress,第2版(1989)和第3版(2001);gerhardt等人,methodsforgeneralandmolecularbacteriologyasmpress(1994);lefkovits,immunologymethodsmanual:thecomprehensivesourcebookoftechniques;academicpress(1997);golemis,protein-proteininteractions:amolecularcloningmanualcoldspringharborlaboratorypress(2002))。
本文提及的抗体或抗体片段可以具有特异性cdr,其决定靶向性部分针对待靶向的细胞的特异性。本文所用的术语“cdr”涉及“互补决定区”,其是本领域熟知的。cdr是免疫球蛋白中决定所述分子的特异性并与特异性配体发生接触的部分。cdr是分子中最可变的部分,并有助于这些分子的多样性。在每个v结构域中有三个cdr区——cdr1、cdr2和cdr3。cdr-h描述了可变重链的cdr区,cdr-l描述了可变轻链的cdr区。vh意指可变重链,vl意指可变轻链。ig衍生区域中cdr区可以如kabat“sequencesofproteinsofimmunologicalinterest”,第5版,nihpublicationno.91-3242departmentofhealthandhumanservices(1991年);chothiaj.mol.biol.196(1987),901-917或chothianature342(1989),877-883中所述方法测定。
因此,在本发明的上下文中,上文所述的抗体分子选自完全抗体(免疫球蛋白,如igg1、igg2、igg2a、igg2b、iga1、igga2、igg3、igg4、iga、igm、igd或ige)、f(ab)-、fab'-sh-、fv-、fab'-、f(ab')2-片段、嵌合抗体、cdr移植抗体、完全人源抗体、二价抗体构建体、抗体融合蛋白、合成抗体、二价单链抗体、三价单链抗体和多价单链抗体。
“人源化手段”在本领域中是熟知的,具体而言,是针对抗体分子(例如ig衍生分子)描述的。术语“人源化”指代非人(例如鼠)抗体或其片段(例如fv、fab、fab'、f(ab')、scfv或抗体的其他抗原结合部分序列)的人源化形式,其含有来源于非人抗体的序列的某些部分。人源化抗体包括这样的人免疫球蛋白,其中来自人免疫球蛋白的互补决定区(cdr)的残基被具有所需结合特异性、亲和力和功能的来自非人物种如小鼠、大鼠或兔的cdr的残基取代。通常,人源化抗体会包含至少一个,通常两个可变结构域中基本上所有的结构域,其中所有或基本上所有的cdr区对应于非人免疫球蛋白的cdr区,且所有或基本上所有的fr区具有人免疫球蛋白共有序列。人源化抗体最优还将包含免疫球蛋白恒定区(fc)的至少一部分,通常是人免疫球蛋白的fc;尤其可参见jones等人,nature321(1986),522-525,presta,curr.op.struct.biol.2(1992),593-596。对非人抗体进行人源化的方法是本领域熟知的。通常,人源化抗体具有从非人来源引入的仍保留抗体的原始结合活性的一个或多个氨基酸。用于人源化抗体/抗体分子的方法进一步在jones等人,nature321(1986),522-525;reichmann等人,nature332(1988),323-327;和verhoeyen等,science239(1988),1534-1536中详述。人源化抗体的具体实例是本领域已知的,例如针对epcam的抗体,参见例如,(lobuglio,proceedingsoftheamericansocietyofclinicaloncologyabstract(1997),1562和khor,proceedingsoftheamericansocietyofclinicaloncologyabstract(1997),847)。
因此,在本发明的上下文中,被人源化的抗体分子或其抗原结合片段被优选用作靶向性部分,并且可以成功地用于药物组合物中。
根据本发明的构建体是这样的构建体,其中靶向性部分靶向对癌症特异性的抗原、对感染性疾病特异性的抗原或对自身免疫性疾病特异性的抗原。本领域技术人员了解对癌症特异性的细胞特异性的细胞表面结构、表位或抗原,对感染性疾病特异性的抗原或对自身免疫性疾病特异性的抗原。因此,本领域技术人员可以基于待靶向的所需细胞选择并挑选合适的靶向性部分,以靶向对癌症特异性的抗原、对感染性疾病特异性的抗原或对自身免疫性疾病特异性的抗原。
不受理论的束缚,可将相应的靶向性部分并入本发明的构建体中用于将待递送到细胞的细胞质中的分子的靶向递送,所述细胞特征在于有对癌症特异性的抗原。作为实例,可以使用特异于癌症抗原的任何已知抗体、抗体片段、设计的锚蛋白重复序列蛋白质(darpin)、配体或细胞因子。作为实例,只要抗体或抗体片段能够靶向癌细胞并因此可以例如用于癌症治疗,则可以将任何已知的抗体或其抗体片段并入本发明的构建体中。因此,可以选择结合肿瘤相关抗原(tumorassociatedantigen,taa)的抗体或抗体片段。本领域已知多种肿瘤相关抗原,包括但不限于碳酸酐酶ix、cccl19、cccl21、csap、cd1、cd1a、cd2、cd3、cd4、cd5、cd8、cd11a、cd14、cd15、cd16、cd18、cd19、igf-1r、cd20、cd21、cd22、cd23、cd25、cd29、cd30、cd32b、cd33、cd37、cd38、cd40、cd40l、cd45、cd46、cd52、cd54、cd55、cd59、cd64、cd66a-e、cd67、cd70、cd74、cd79a、cd80、cd83、cd95、cd126、cd133、cd138、cd147、cd154、afp、psma、ceacam5、ceacam6、b7、纤连蛋白的ed-b、h因子、fhl-1、flt-3、叶酸受体、grob、hmgb-1、缺氧诱导因子(hif)、hm1.24、胰岛素样生长因子-1(ilgf-1)、ifn-γ、ifn-α、ifn-β、il-2、il-4r、il-6r、il-13r、il-15r、il-17r、il-18r、il-6、il-8、il-12、il-15、il-17、il-18、il-25、ip-10、mage、mcrp、mcp-1、mip-1a、mip-1b、mif、muc1、muc2、muc3、muc4、muc5ac、pam4抗原、nca-95、nca-90、ia、hm1.24、egp-1、egp-2、hla-dr、腱生蛋白、le(y)、rantes、t101、tac、tn抗原、thomson-friedenreich抗原、肿瘤坏死抗原、tnf-α、trail受体(r1和r2)、vegfr、egfr、plgf、补体因子c3、c3a、c3b、c5a、c5和癌基因产物。可以用于本发明的构建体中的示例性抗癌抗体可以为但不限于hr1(抗igf-1r,2009年1月20日提交的美国临时专利申请序列号61/145,896)、hpam4(抗muc1,美国专利号7,282,567)、ha20(抗cd20,美国专利号7,251,164)、ha19(抗cd19,美国专利号7,109,304)、himmu-31(抗afp,美国专利号7,300,655)、hll1(抗-cd74,美国专利号7,312,318)、hll2(抗-cd22,美国专利号7,074,403)、hmu-9(抗-csap,美国专利号7,387,773)、hl243(抗hla-dr,美国专利号7,612,180)、hmn-14(抗ceacam5,美国专利号6,676,924),hmn-15(抗ceacam6,美国专利申请号10/672,278)、hrs7(抗egp-1,美国专利号7,238,785)和hmn-3(抗-cea,美国专利号7,541,440)。技术人员将认识到,该列表不是限制性的,且任何其它已知的抗taa抗体都可以并入本发明的构建体中。
在根据本发明的构建体中,靶向性部分还可以为人源化抗-egfr抗体单链fv片段(scfv)。优选地,人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2)。
然而,只要抗体或抗体结合片段具有结合至egfr的能力,则如本发明所用的人源化抗-egfr抗体单链fv片段(scfv)不具体限制于以上的具体序列,还可以为结合egfr的其变体,所述变体包含如下氨基酸序列或由如下氨基酸序列组成,所述氨基酸序列与seqidno:2的序列有至少95%、90%、85%、75%、70%、65%、60%、55%或50%的序列同源性。如上文描述的,技术人员能够容易地生成这些抗体变体并用本领域已知的方法测试给定抗体、抗体片段或抗体单链fv片段(scfv)是否能够结合egfr。进一步地,所述抗体或其抗原结合片段或抗体单链fv片段(scfv)是包含如下氨基酸序列的分子,所述氨基酸序列参照seqidno:2序列具有多至0、1、2、3、4、5、6、7、8、9、10个或更多保守氨基酸取代。
在根据本发明的构建体中,靶向性部分还可以是人源化抗-cd22抗体单链fv片段(scfv)。所述人源化抗-cd22抗体的序列先前在us7,456,260b2(sgiii克隆)中描述。
优选地,所述人源化抗-cd22scfv(sgiii)抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24)。
然而,只要抗体或抗体结合片段具有结合至cd22的能力,则如本发明所用的人源化抗-cd22抗体单链fv片段(scfv)不具体限制于以上的具体序列,还可以为结合cd22的其变体,所述变体包含如下氨基酸序列或由如下氨基酸序列组成,所述氨基酸序列与seqidno:24的序列有至少95%、90%、85%、75%、70%、65%、60%、55%或50%的序列同源性。如上文描述的,技术人员能够容易地生成这些抗体变体并用本领域已知的方法测试它们是否给定抗体、抗体片段或抗体单链fv片段(scfv)能够结合cd22。进一步地,所述抗体或其抗原结合片段或抗体单链fv片段(scfv)是包含如下氨基酸序列的分子,所述氨基酸序列参照seqidno:24序列具有多至0、1、2、3、4、5、6、7、8、9、10个或更多保守氨基酸取代。
为了确定某一氨基酸位置是否与seqidno:2或seqidno:24序列具有特定程度的的同一性,本领域技术人员可以使用本领域熟知的方式和方法,例如,手动或通过使用本领域技术人员已知的计算机程序进行比对。这种比对可以例如使用本领域技术人员已知的方式和方法进行,例如,通过使用已知的计算机算法如lipman-pearson方法(science227(1985),1435)或clustal算法。优选地,在这种比对中,为氨基酸序列中存在的保守氨基酸残基分配最大同源性。在一个优选的实施方式中,使用clustalw2进行氨基酸序列的比较。在成对比较/比对的情况下,优选选择以下设置:蛋白质重量矩阵:blosum62;缺口开放:10;缺口延伸:0.1。在多重比较/比对的情况下,优选选择以下设置:蛋白质重量矩阵:blosum62;缺口打开:10;缺口延伸:0.2;缺口距离:5;无末端缺口。
根据本发明,在两个或更多核酸序列或氨基酸序列的情况下术语“同一的”或“同一性百分比”指代当在比较窗口上或在测量的指定区域上如使用本领域已知的序列比较算法或通过手动比对和目视检查进行比较并比对最大的对应性时,两个或更多序列或子序列与上文描述的能够结合至egfr的氨基酸或核酸序列相同或有特定百分比的氨基酸残基或核苷酸与之相同(例如60%或65%的同一性,优选70-95%的同一性,更优选至少95%的同一性)。具有例如60%至95%或更大的序列同一性的序列被认为基本上同一。这一定义也可应用于测试序列的互补序列。优选地,所述同一性存在于长度为至少约15至25个氨基酸或核苷酸的区域上,更优选地,在长度为约50至100个氨基酸或核苷酸的区域上。本领域技术人员将知道如何使用例如基于clustalw计算机程序(thompsonnucl.acidsres.2(1994),4673-4680)或fastdb(基于计算机程序)的算法来确定序列之间的同一性百分比/brutlagcomp.app.biosci.6(1990),237-245),这些是本领域已知的。
尽管fastdb算法通常在其计算中不考虑序列内部的不匹配删除或添加,即缺口,这一点可以手动纠正以避免对同一性%的高估。然而,clustalw确实在其同一性计算中考虑到序列缺口。本领域技术人员还可用的是blast和blast2.0算法(altschul,(1997)nucl.acidsres.25:3389-3402;altschul(1993)j.mol.evol.36:290-300;altschul(1990)j.mol.biol.215:403-410)。用于核酸序列的blastn程序使用默认字长(w)11,期望值(e)10,m=5,n=4并默认两条链都进行比较。对于氨基酸序列,blastp程序默认使用字长(w)3,期望值(e)10。blosum62评分矩阵(henikoff(1989)pnas89:10915)默认使用比对(b)50,期望值(e)10,m=5,n=4,并默认两条链都进行比较。
优选地,上述seqidno:2或seqidno:24中的(多个)氨基酸取代是“保守型取代”,指代蛋白质中氨基酸被具有相似特征(例如电荷,侧链大小,疏水性/亲水性,骨架构象和刚性等)的其它氨基酸的取代,这样可以频繁作出变化而不改变已经在上文详述的蛋白质的生物活性。
类似地,为了对待递送到特征在于具有对感染性疾病或对自身免疫性疾病特异性的抗原的细胞的细胞质中的分子进行靶向递送,可将相应的靶向性部分并入本发明的构建体中。作为实例,可以使用对感染性疾病或对自身免疫性疾病抗原特异性的任何已知抗体、抗体片段、设计的锚蛋白重复序列蛋白(darpin)、配体或细胞因子。本领域技术人员了解对感染性疾病或对自身免疫性疾病特异性对细胞的特异细胞表面结构、表位或抗原。
不受理论的束缚,为了对待递送到特征在于具有对自身免疫疾病特异性的抗原的细胞的细胞质中的分子进行靶向递送,可将相应的靶向性部分并入本发明的构建体中。作为实例,可以使用对自身免疫性疾病特异性的抗原的任何已知抗体、抗体片段、设计的锚蛋白重复序列蛋白(darpin)、配体或细胞因子。作为实例,任何已知的抗体或其抗体片段可以并入本发明的构建体中,只要抗体或抗体片段能够靶向受自身免疫性疾病影响的细胞,并且因此可以用于例如自身免疫性疾病的治疗。因此,可以选择结合例如对自身免疫性疾病特异性的抗原的抗体或抗体片段。已知的对自身免疫疾病特异性的抗原是ampa-glur3、nmda-nr1、nmda-nr2a/b、mglur1、mglur5、dsg1、dsg3、dsc、cd40、cd40l、cd19、cd32b、cd20、cd22、cd6或cd74。
类似地,为了对待递送到特征在于具有对感染性疾病特异性的抗原的细胞的细胞质中的分子进行靶向递送,可将相应的靶向性部分并入本发明的构建体中。作为实例,可以使用对感染性疾病抗原特异性的任何已知抗体、抗体片段、设计的锚蛋白重复序列蛋白(darpin)、配体或细胞因子。作为实例,任何已知的抗体或其抗体片段可以并入本发明的构建体中,只要抗体或抗体片段能够靶向受感染的细胞,并且因此可以用于例如感染性疾病的治疗。因此,可以选择结合例如对自身免疫性疾病特异性的抗原的抗体或抗体片段。在感染性疾病中,本领域技术人员已知的任何病毒表面蛋白质都可以为靶标蛋白质。
本发明构建体的第三个主要模块是(c)待递送至细胞的细胞质中的分子(即,“货物”)。“货物”,即待递送到细胞的细胞质中的分子可以被认为是在细胞中发挥所需功能的“效应子部分”。“货物”的性质在很大程度上取决于通过将相应的分子特异性递送到细胞质中要实现怎样的效果,因此并不受限制。基本上任何分子都可以用作效应子或“货物”,只要其具有待递送到细胞的细胞质中的功能/功能活性。
因此,根据本发明的构建体可以是这样的构建体,其中待递送到细胞质中的分子(即“货物”)选自治疗性部分、可检测部分、核酸分子(优选sirna)、载体分子(优选纳米颗粒)、脂质体和病毒载体。所述待递送到细胞质中的“货物”与上述模块(a)和(b)缀合,或者以如上所述并在下文进一步描述的共价键化学偶联的形式,或者通过如上所述并在下文进一步描述的重组方法学融合至上述模块(a)和(b)以融合蛋白的形式。
术语治疗性部分(或治疗剂)、可检测部分、核酸分子、sirna、载体分子、纳米颗粒、脂质体和病毒载体是本领域技术人员已知的,并且这些“货物”的性质在本发明的上下文中不受具体限制。这些“货物”的性质在很大程度上取决于通过将相应的分子特异性地递送到细胞质要实现怎样的效果。
如果例如期望在待靶向的细胞中发挥对特定化合物已知的药理学作用,则本领域技术人员可容易地挑选相应的治疗性部分或治疗剂。下文进一步给出治疗剂或治疗性部分的非限制性实例。通常,“治疗剂”或“治疗性部分”是可用于治疗疾病的原子、分子或化合物。治疗剂的实例包括但不限于抗体、抗体片段、肽、药物、毒素、酶、核酸酶、激素、免疫调制剂、反义寡核苷酸、小干扰rna(sirna)、螯合剂、硼化合物、光活性剂、染料和放射性同位素。在多种实施方式中、治疗性部分/试剂例如细胞毒性剂、抗血管生成剂、促凋亡剂、抗生素、激素、激素拮抗剂、趋化因子、药物、前药、毒素、酶或其它试剂可用作本文描述的干扰素-抗体dnltm构建体的附加疗法。可用药物例如具有的药物特性选自抗有丝分裂剂、抗激酶、烷化剂、抗代谢物、抗生素、生物碱、抗血管生成剂、促凋亡剂及其组合。
示例性的可用药物可以包括5-氟尿嘧啶、阿普立定、阿扎西平、阿那曲唑、蒽环霉素、苯达莫司汀、博来霉素、硼替佐米、苔藓抑素-1、白消安、卡利霉素、喜树碱(camptothecin)、卡铂、10-羟基喜树碱、卡莫司汀、塞来昔布、苯丁酸氮芥、顺铂(cddp)、cox-2抑制剂、伊立替康(cpt-11)、sn-38、卡铂、克拉屈滨、氯法拉滨、阿糖胞苷、喜树碱衍生物(camptothecans)、环磷酰胺、阿糖胞苷、达卡巴嗪、多西紫杉醇、更生霉素、柔红霉素、多柔比星、2-吡咯烷并多柔比星(2p-dox)、氰基-吗啉多柔比星、多柔比星葡糖苷酸、表柔比星葡萄糖苷酸、雌莫司汀、表鬼臼脂素、雌激素受体结合剂、依托泊苷(vp16)、依托泊苷葡糖苷酸、磷酸依托泊苷、氟尿苷(fudr)、3',5'-o-二油酰基-fudr(fudr-do)、氟达拉滨、氟他胺、法呢基蛋白转移酶抑制剂、酪氨酸激酶和布鲁顿激酶抑制剂、吉西他滨、羟基脲、伊达比星、异环磷酰胺、l-天冬酰胺酶、利奈唑胺、亚叶酸、洛莫司汀、氮芥、美法仑、巯基嘌呤、6-巯基嘌呤、甲氨蝶呤、米托蒽醌、光神霉素、丝裂霉素、米托坦、诺维本、亚硝基脲、普卡霉素、丙卡巴肼、紫杉醇、喷司他丁、psi-341、雷洛昔芬、司莫司汀、链佐星、他莫昔芬、紫杉醇、替马唑胺(dtic的水溶液形式)、反铂、沙利度胺、硫鸟嘌呤、噻替派、替尼泊苷、拓扑替康、尿嘧啶氮芥、长春瑞滨、长春碱、长春新碱和长春花生物碱。使用的酪氨酸激酶抑制剂可包括lfm-a13、达沙替尼、伊马替尼或尼罗替尼。
如下文更详细概述的,使用的毒素可以例如包括蓖麻毒素、相思豆毒素、α毒素、皂草素、核糖核酸酶(rna酶)(例如豹蛙抗瘤酶(onconase))、dna酶i、葡萄球菌肠毒素-a、美洲商陆抗病毒蛋白、白树毒素、白喉毒素、假单胞菌外毒素和假单胞菌内毒素。
使用的趋化因子可以包括rantes、mcaf、mip1-α、mip1-β和ip-10。在特定实施方式中可以为抗血管生成剂(例如血管抑素)、baculostatin、canstatin、乳腺丝氨酸蛋白酶抑制剂(maspin)、抗vegf抗体、抗plgf肽和抗体、抗血管生长因子抗体、抗flk-1抗体、抗flt-1抗体和肽、抗kras抗体、抗cmet抗体、抗mif(巨噬细胞迁移抑制因子)抗体、层粘连蛋白肽、纤连蛋白肽、纤溶酶原激活物抑制剂、组织金属蛋白酶抑制剂、干扰素、白细胞介素-12、ip-10、gro-β、血小板反应蛋白、2-甲氧基雌二醇、增生激素相关蛋白、羧基三唑、cm101、marimastat、戊聚糖多硫酸盐、血管生成素-2、干扰素-α、除莠霉素a、pnu145156e、16k催乳素片段、莱诺米特(roquinimex)、沙利度胺、己酮可可碱、染料木黄酮(genistein)、tnp-470、内皮抑制素、紫杉醇、accutin、血管抑制素、西多福韦、长春新碱、博来霉素、agm-1470、血小板因子4或米诺环素。其它有用的治疗剂可以包括寡核苷酸,尤其是优选针对致癌基因和癌基因产物如bcl-2或p53的反义寡核苷酸。治疗性寡核苷酸的优选形式是如下文进一步描述的sirna。
所述治疗剂或部分还可以是放射性核素。
术语“治疗性部分/试剂”还可更广义地理解,并包括“诊断剂/部分”。诊断剂或部分是可用于诊断疾病的原子、分子或化合物。有用的诊断剂或部分包括但不限于放射性同位素、染料(例如具有生物素-链霉亲和素复合物)、造影剂、荧光化合物或分子及用于磁共振成像(mri)的增强剂(例如顺磁离子)。诊断剂或部分优选地选自放射性核素、放射性造影剂、顺磁离子、金属、荧光标记、化学发光标记、超声造影剂和光活性剂。所述诊断剂是众所周知的,可以使用任何这样的已知诊断剂。诊断剂的非限制性实例可包括放射性核素例如110in、111in、177lu、18f、19f、52fe、62cu、64cu、67cu、67ga、68ga、86y、90y、89zr、94mtc、94tc、99mtc、120i、123i、124i、125i、131i、154-158gd、32p、11c、13n、15o、186re、188re、51mn、52mmn、55co、72as、75br、76br、82mrb、83sr或其它γ-、β-或正电子发射器。顺磁离子可以包括铬(iii)、锰(ii)、铁(iii)、铁(ii)、钴(ii)、镍(ii)、铜(ii)、钕(iii)、钐(iii)、镱(iii)、钆(iii)、钒(ii)、铽(iii)、镝(iii)、钬(iii)或铒(iii)。金属造影剂可以包括镧(iii)、金(iii)、铅(ii)或铋(iii)。超声造影剂可以包括脂质体,例如充气脂质体。不透射线诊断剂可以选自以下化合物:钡化合物、镓化合物和铊化合物。多种荧光标记物是本领域已知的,包括但不限于异硫氰酸荧光素、罗丹明、藻红蛋白、藻蓝蛋白、别藻蓝蛋白、邻苯二甲醛和荧光胺。使用的化学发光标记物可以包括鲁米诺、异鲁米诺、芳族吖啶酯、咪唑、吖啶鎓盐或草酸酯。
如下文将更详细示例性概述的,待递送至细胞的细胞质的分子(其是根据本发明构建体的一部分)还可包括一种或多种其他效应子,例如蛋白质、肽、免疫调制剂、细胞因子、白细胞介素、干扰素、结合蛋白、肽配体、载体蛋白、毒素、核糖核酸酶如onconase、抑制性寡核苷酸如sirna、抗原或异种抗原、聚合物如peg、酶、治疗剂、激素、细胞毒剂、抗血管生成剂、促凋亡剂或任何其它分子或聚集体。
可检测部分应理解为视觉可检测的或在光的非视觉范围内的化学部分。“视觉可检测的部分”是指该部分或染料可以简单地由个体的肉眼在染料的视觉范围内检测。这包括荧光可检测的染料,其也可以由本领域技术人员肉眼在荧光可检测染料吸收特定波长的光而发射特异波长的光时检测到。因此,在本发明的上下文中,可检测部分或染料可以是例如荧光可检测的部分。然而,可检测部分也可在光的非视觉范围内检测。在这方面,可使用放射性部分作为实例。
视觉可检测的部分和非视觉可检测部分对本领域技术人员已知,其通常应用于生物学领域,例如用于检测或定位特定细胞。本领域技术人员了解这些可检测部分的很多应用。不收理论限制,现有技术中优选并广泛知晓的是荧光可检测部分,包括例如eosiny(linf,fanw,wisege.analbiochem.1991aug1;196(2):279-83)、syproorange/red(steinbergth,joneslj,hauglandrp,singervl.analbiochem.1996aug1;239(2):223-37)、syproruby(berggrenk,steinbergth,lauberwm,carrollja,lopezmf,chernokalskayae,zieskel,diwuz,hauglandrp,pattonwf.analbiochem.1999dec15;276(2):129-43)、deeppurple/lightningfast(bellpj,karusop.jamchemsoc.2003aug6;125(31):9304-5;mackintoshja,choihy,baesh,vealda,bellpj,ferraribc,vandykdd,verrillsnm,paikyk,karusop.proteomics.2003dec;3(12):2273-88)及alexa染料(panchuk-voloshinan,hauglandrp,bishop-stewartj,bhalgatmk,millardpj,maof,leungwy,hauglandrp.jhistochemcytochem.1999sep;47(9):1179-88.)。
具体而言,可能期望将核酸分子递送到细胞的细胞质中。核酸分子的递送在基因治疗中有特别的重要性。在此方面,技术人员了解如何制备所需核酸分子的许多方法。优选地,核酸分子是sirna分子,其可以使用本领域技术人员已知的rna干扰机制用于特异性敲低具体基因的表达。
此外,核酸分子(优选sirna(构建体))可以以病毒载体的形式被递送到细胞的细胞质中。
待作为效应子或作为“货物”被递送到细胞的细胞质中的治疗性部分或治疗剂可以选自细胞毒性部分、抗体、抗体片段、药剂、化学治疗剂、小分子、酶、激素、反义寡核苷酸、sirna、rnai、放射性核素、硼化合物、光活性剂、抗血管生成剂和促凋亡剂。
细胞毒性部分/试剂/化合物是本领域技术人员已知的,并且涉及对细胞有毒性的物质。细胞毒性化合物可以例如导致多种细胞命运,例如坏死、细胞裂解和细胞凋亡。药剂可以是小分子,包括例如化疗剂(即化学物质),放射性核素(例如lu-177、y-90、in-111、i-131),来自植物、微生物或动物的毒素(其可以是小分子、肽或蛋白质),例如细胞毒素、氰基毒素、外毒素、神经毒素。已知促凋亡剂可诱导程序性细胞死亡。促凋亡剂是本领域已知的,bax、bak、galectin3和bbc3只是作为非限制性实例在此引用。
可以用作治疗性部分或治疗剂的酶是具有高度选择性的大分子生物催化剂,其通过将底物转化为不同的产物而起作用,因此可适于用作治疗性部分。用作治疗性部分或治疗剂的酶的性质不受限制,并取决于待治疗或预防的疾病或病症。可适于用作治疗性部分或治疗剂的非限制性的酶类可以是例如丝氨酸蛋白酶,dna酶或rna酶。
可用作治疗性部分或治疗剂的激素属于调节生理和行为(如代谢、生长和发育、排泄和/或消化)的一类信号传导分子。激素可以属于下列类别之一:胺类(例如去甲肾上腺素)、肽(例如催产素)、蛋白质(例如人生长激素)、类固醇(例如睾酮)。可用作治疗性部分或治疗剂的激素的性质不受限制,并取决于待治疗或预防的疾病或病症。
“货物”或效应子部分也可以是免疫调制剂。免疫调制剂是当其存在时会改变、抑制或刺激身体免疫系统的试剂。使用的免疫调制剂可包括细胞因子、干细胞生长因子、淋巴毒素、造血因子、集落刺激因子(csf)、干扰素(ifn)、促红细胞生成素、血小板生成素及其组合。特别有用的是淋巴毒素例如肿瘤坏死因子(tnf)、造血因子例如白细胞介素(il)、集落刺激因子例如粒细胞集落刺激因子(g-csf)或粒细胞巨噬细胞集落刺激因子(gm-csf)、干扰素(例如干扰素-α、干扰素-β、干扰素-γ或干扰素-λ)以及干细胞生长因子例如称为“s1因子”的干细胞生长因子。
因此,待递送到细胞的细胞质中的分子可以是细胞因子,例如淋巴因子、单核因子、生长因子和传统的多肽激素。细胞因子在上文“靶向性部分”的上下文中已经有所定义。然而,考虑到一旦递送到细胞的细胞质中,细胞因子由于具有如上所述的免疫调制剂的能力也可以根据本发明被用作“货物”或“效应子”,则在如上文关于“靶向性部分”的上下文中对细胞因子所阐述的内容加以必要修正同样适用于在“货物”和“效应子”的上下文中所阐述的细胞因子。蛋白质或肽免疫调制剂例如细胞因子的氨基酸序列是本领域熟知的,并且任何这样的已知序列都可用于本发明的上下文中。本领域技术人员知道关于细胞因子序列的众多资源,如上所述。此外,技术人员知道在上文作为“靶向性部分”的细胞因子的上下文中所已经提及的许多细胞因子的实例。
本发明的构建体还可以是这样的构建体,其中细胞毒性部分选自核糖核酸酶a家族成员、蓖麻毒素、相思豆毒素、α毒素、皂草素、dna酶i、葡萄球菌肠毒素-a、美洲商陆抗病毒蛋白、白树毒素、白喉毒素、假单胞菌外毒素和假单胞菌内毒素。
细胞毒性是对细胞有毒性的细胞毒性部分的能力。毒性是物质(即本发明条件下的细胞毒性部分)可对细胞或生物体损伤的程度。毒性可以指对整个生物体例如动物、细菌或植物的效应,以及对生物体亚结构,例如细胞(此时即为细胞毒性)或器官的效应。具体而言,在本发明的上下文中,毒性指代对细胞的毒性。通常,细胞毒性剂或部分可以是化学、生物或物理性质的。化学毒性剂包括例如无机物质如铅、汞和氢氟酸,以及有机化合物如甲醇,大多数药物和来自生物的毒物。放射性化学品由于其化学性质并不是有毒的,但是因为由核发射的辐射是高能的,并且破坏细胞和组织,放射性毒性在本发明条件下也可以被理解为“细胞毒性的”。生物毒性剂包括具有毒性作用的任何生物分子。下文会进一步给出实施例。物理毒性剂是由于其物理性质而干扰生物过程的物质。实例包括煤灰、石棉纤维或二氧化硅细粉,所有这些物质如果递送到生物体或细胞中都可能最终是致命的。
可通过本领域技术人员已知的方法测量对靶标(生物体、器官、组织,或优选直接对细胞)的效应而测量生物毒性。
毒素或细胞毒性部分是本领域技术人员公知的,并且本领域技术人员了解关于这些细胞毒性部分的众多公共信息资源。此外,技术人员知道这些细胞毒性部分的许多实例,并且可以容易地挑选细胞毒性部分。
如上文已经提到的,核糖核酸酶a(rna酶a)超家族的成员已经作为用于癌症的抗体靶向治疗的潜在新类型的效应子化合物而崭露头角(newton等人,2001;delorenzo等人,2004;arndt等人,2005;chang等人,2010;liu等人,2014)。因此,核糖核酸酶a(rna酶a)超家族的成员是优选的“货物”或效应子部分,即,待递送至细胞的细胞质中的分子。
rna酶a家族成员已知来源于多种生物体,并且可以用作优选的“货物”或效应子部分,即,待递送至细胞的细胞质中的分子。例如,可以使用两栖类rna酶a成员。两栖类rna酶a成员的非限制性实例是amphinase(衍生自豹蛙)和rc-rnase(衍生自牛蛙(ranacatesbeiana))。
作为其它实例,人类rnase可以用作优选的“货物”。可用作根据本发明的“货物”的人类rna酶a成员的非限制性实例是人胰腺rna酶(rna酶1或hp-rna酶;seqidno:22)、嗜酸性粒细胞衍生的神经毒素(rna酶2)、嗜酸性粒细胞阳离子蛋白(rna酶3)、人rna酶4、血管生成素(rna酶5;seqidno:23)、人rna酶7和人rna酶8。
作为另一些实例,可使用牛rna酶a。
所有以上rna酶的实例都参与蛋白质合成的rna代谢/抑制,并能以与本文上文和下文有较详细描述的ranpirnase
优选的rna酶超家族成员是ranpirnase
ranpirnase
q*dwltfqkkhitntrdvdcdnimstnlfhckdkntfiysrpepvkaickgiiasknvlttsefylsdcnvtsrpckyklkkstnkfcvtcenqapvhfvgvgsc,其中(*)代表焦谷氨酸盐;(seqidno:4)。
本发明不具体受限于上述ranpirnase
此外,具有上述所需功能的rna酶a的变体参考seqidno:4的序列可以具有多至0、1、2、3、4、5、6、7、8、9、10或更多,多至15、20、30、40或50个保守氨基酸取代。
优选的rna酶a超家族成员是人胰腺rna酶(rna酶1或hp-rna酶)。因此,根据本发明的构建体可以是这样的构建体,其中rna酶a家族成员是人胰腺rna酶(rna酶1)。
人胰腺rna酶(rna酶1)的序列在本领域熟知,且显示于下文seqidno:22:malekslvrllllvlillvlgwvqpslgkesrakkfqrqhmdsdsspsssstycnqmmrrrnmtqgrckpvntfvheplvdvqnvcfqekvtckngqgncyksnssmhitdcrltngsrypncayrtspkerhiivacegspyvpvhfdasvedst;(seqidno:22)。
本发明不具体受限于上述人胰腺rna酶(rna酶1)的特定序列。相反,rna酶a超家族成员可以为rna酶a变体,其包含如下氨基酸序列或由如下氨基酸序列组成,所述氨基酸序列与seqidno:22的序列有至少95%、90%、85%、75%、70%、65%、60%、55%或50%的序列同源性,只要具有所述氨基酸序列的所述蛋白质或肽具有的细胞毒性活性的与对人胰腺rna酶(rna酶1)描述的活性相当即可。因此,所述变体的细胞毒性能力或活性与人胰腺rna酶(rna酶1)的活性是相似的,或优选甚至更高。应用本领域已知的方法如在实施例中示例性说明的方法,本领域技术人员能制备相应的变体并能容易地确定给定变体是否具有相应的所需活性。
此外,具有上述所需功能的rna酶a的变体参考seqidno:22的序列可以具有多至0、1、2、3、4、5、6、7、8、9、10或更多,多至15、20、30、40或50个保守氨基酸取代。
优选的rna酶a超家族成员是血管生成素(rna酶5)。因此,根据本发明的构建体可以是这样的构建体,其中rna酶a家族成员是血管生成素(rna酶5)。
血管生成素(rna酶5)的序列在本领域熟知,且显示于下文seqidno:23:mvmglgvlllvfvlglgltpptlaqdnsrythfltqhydakpqgrddrycesimrrrgltspckdintfihgnkrsikaicenkngnphrenlriskssfqvttcklhggspwppcqyratagfrnvvvacenglpvhldqsifrrp;(seqidno:23)。
本发明不具体受限于上述血管生成素(rna酶5)的特定序列。相反,rna酶a超家族成员可以为rna酶a变体,其包含如下氨基酸序列或由如下氨基酸序列组成,所述氨基酸序列与seqidno:23的序列有至少95%、90%、85%、75%、70%、65%、60%、55%或50%的序列同源性,只要具有所述氨基酸序列的所述蛋白质或肽具有的细胞毒性活性的能力与对血管生成素(rna酶5)描述的活性相当即可。因此,所述变体的细胞毒性能力或活性与血管生成素(rna酶5)的活性相比是相似的,或优选甚至更高。应用本领域已知的方法如在实施例中示例性说明的方法,本领域技术人员能制备相应的变体并能容易地确定给定变体是否具有相应的所需活性。
此外,具有上述所需功能的rna酶a的变体参考seqidno:23的序列可以具有多至0、1、2、3、4、5、6、7、8、9、10或更多,多至15、20、30、40或50个保守氨基酸取代。
本发明涉及上文定义的(a)靶向性部分,(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和/或(c)“货物”,即待递送至细胞的细胞质中的分子。
本发明涉及的具体的优选构建体如下:
本发明涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子,其中所述衍生自豹蛙的rna酶为ranpirnase
q*dwltfqkkhitntrdvdcdnimstnlfhckdkntfiysrpepvkaickgiiasknvlttsefylsdcnvtsrpckyklkkstnkfcvtcenqapvhfvgvgsc,其中(*)代表焦谷氨酸盐;(seqidno:4)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由一个或多个融合序列组成的融合部分,所述融合序列选自:drgwgngcglfgkggi(seqidno:1),mvdrgwgngcglfgkggiv(seqidno:3),drgwgngcglfgkgsi(seqidno:5);drgwgngcglfgkgsl(seqidno:6);drgwgngcglfgkggv(seqidno:7);drgwhngcglfgkgsi(seqidno:8);drgwhngcgffgkgsi(seqidno:9);drgwgngcglfgkgsm(seqidno:10);drgwgngcglfgkgsy(seqidno:11);drgwnngcglfgkgsl(seqidno:12);nrgwnngcglfgkgdi(seqidno:13);drgwgnhcglfgkgsi(seqidno:14);drgwgnncglfgkgsi(seqidno:15);drgwgngcalfgkgsi(seqidno:16);drgwgnhcgffgkgsi(seqidno:17);drgwdsgcfifgkgev(seqidno:18);nrgwgtgcfkwgigfv(seqidno:19)及nrgwgtgcfewglgqv(seqidno:20),或与seqidno:1和seqidno:5至20相比分别显示有1至8个取代、删除或添加的序列;以及(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子,其中所述衍生自豹蛙的rna酶为ranpirnase
q*dwltfqkkhitntrdvdcdnimstnlfhckdkntfiysrpepvkaickgiiasknvlttsefylsdcnvtsrpckyklkkstnkfcvtcenqapvhfvgvgsc,其中(*)代表焦谷氨酸盐;(seqidno:4)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子,其中所述衍生自豹蛙的rna酶为ranpirnase
q*dwltfqkkhitntrdvdcdnimstnlfhckdkntfiysrpepvkaickgiiasknvlttsefylsdcnvtsrpckyklkkstnkfcvtcenqapvhfvgvgsc,其中(*)代表焦谷氨酸盐;(seqidno:4)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由一个或多个融合序列组成的融合部分,所述融合序列选自drgwgngcglfgkggi(seqidno:1),mvdrgwgngcglfgkggiv(seqidno:3);drgwgngcglfgkgsi(seqidno:5);drgwgngcglfgkgsl(seqidno:6);drgwgngcglfgkggv(seqidno:7);drgwhngcglfgkgsi(seqidno:8);drgwhngcgffgkgsi(seqidno:9);drgwgngcglfgkgsm(seqidno:10);drgwgngcglfgkgsy(seqidno:11);drgwnngcglfgkgsl(seqidno:12);nrgwnngcglfgkgdi(seqidno:13);drgwgnhcglfgkgsi(seqidno:14);drgwgnncglfgkgsi(seqidno:15);drgwgngcalfgkgsi(seqidno:16);drgwgnhcgffgkgsi(seqidno:17);drgwdsgcfifgkgev(seqidno:18);nrgwgtgcfkwgigfv(seqidno:19)和nrgwgtgcfewglgqv(seqidno:20),或与seqidno:1和seqidno:5至20相比分别显示有1至8个取代、删除或添加的序列;以及(c)衍生自豹蛙的rna酶作为待递送至细胞的细胞质中的分子,其中所述衍生自豹蛙的rna酶为ranpirnase
q*dwltfqkkhitntrdvdcdnimstnlfhckdkntfiysrpepvkaickgiiasknvlttsefylsdcnvtsrpckyklkkstnkfcvtcenqapvhfvgvgsc,其中(*)代表焦谷氨酸盐;(seqidno:4)。
本发明涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子,其中所述人胰腺rna酶(rna酶1或hp-rna酶)具有以下氨基酸序列seqidno:22:malekslvrllllvlillvlgwvqpslgkesrakkfqrqhmdsdsspsssstycnqmmrrrnmtqgrckpvntfvheplvdvqnvcfqekvtckngqgncyksnssmhitdcrltngsrypncayrtspkerhiivacegspyvpvhfdasvedst;(seqidno:22)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由一个或多个融合序列组成的融合部分,所述融合序列选自drgwgngcglfgkggi(seqidno:1),mvdrgwgngcglfgkggiv(seqidno:3),drgwgngcglfgkgsi(seqidno:5);drgwgngcglfgkgsl(seqidno:6);drgwgngcglfgkggv(seqidno:7);drgwhngcglfgkgsi(seqidno:8);drgwhngcgffgkgsi(seqidno:9);drgwgngcglfgkgsm(seqidno:10);drgwgngcglfgkgsy(seqidno:11);drgwnngcglfgkgsl(seqidno:12);nrgwnngcglfgkgdi(seqidno:13);drgwgnhcglfgkgsi(seqidno:14);drgwgnncglfgkgsi(seqidno:15);drgwgngcalfgkgsi(seqidno:16);drgwgnhcgffgkgsi(seqidno:17);drgwdsgcfifgkgev(seqidno:18);nrgwgtgcfkwgigfv(seqidno:19)和nrgwgtgcfewglgqv(seqidno:20),或与seqidno:1和seqidno:5至20相比分别显示有1至8个取代、删除或添加的序列;和(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子,其中所述人胰腺rna酶(rna酶1或hp-rna酶)具有以下氨基酸序列seqidno:22:
malekslvrllllvlillvlgwvqpslgkesrakkfqrqhmdsdsspsssstycnqmmrrrnmtqgrckpvntfvheplvdvqnvcfqekvtckngqgncyksnssmhitdcrltngsrypncayrtspkerhiivacegspyvpvhfdasvedst;(seqidno:22)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,其包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,其包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,其包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子,其中所述人胰腺rna酶(rna酶1或hp-rna酶)具有以下氨基酸序列seqidno:22:malekslvrllllvlillvlgwvqpslgkesrakkfqrqhmdsdsspsssstycnqmmrrrnmtqgrckpvntfvheplvdvqnvcfqekvtckngqgncyksnssmhitdcrltngsrypncayrtspkerhiivacegspyvpvhfdasvedst;(seqidno:22)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由一个或多个融合序列组成的融合部分,所述融合序列选自drgwgngcglfgkggi(seqidno:1),mvdrgwgngcglfgkggiv(seqidno:3),drgwgngcglfgkgsi(seqidno:5);drgwgngcglfgkgsl(seqidno:6);drgwgngcglfgkggv(seqidno:7);drgwhngcglfgkgsi(seqidno:8);drgwhngcgffgkgsi(seqidno:9);drgwgngcglfgkgsm(seqidno:10);drgwgngcglfgkgsy(seqidno:11);drgwnngcglfgkgsl(seqidno:12);nrgwnngcglfgkgdi(seqidno:13);drgwgnhcglfgkgsi(seqidno:14);drgwgnncglfgkgsi(seqidno:15);drgwgngcalfgkgsi(seqidno:16);drgwgnhcgffgkgsi(seqidno:17);drgwdsgcfifgkgev(seqidno:18);nrgwgtgcfkwgigfv(seqidno:19)和nrgwgtgcfewglgqv(seqidno:20),或与seqidno:1和seqidno:5至20相比分别显示有1至8个取代、删除或添加的序列;以及(c)人胰腺rna酶(rna酶1或hp-rna酶)作为待递送至细胞的细胞质中的分子,其中所述人胰腺rna酶(rna酶1或hp-rna酶)具有以下氨基酸序列seqidno:22:
malekslvrllllvlillvlgwvqpslgkesrakkfqrqhmdsdsspsssstycnqmmrrrnmtqgrckpvntfvheplvdvqnvcfqekvtckngqgncyksnssmhitdcrltngsrypncayrtspkerhiivacegspyvpvhfdasvedst;(seqidno:22)。
本发明涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子,其中所述血管生成素(rna酶5)具有氨基酸序列seqidno:23:
mvmglgvlllvfvlglgltpptlaqdnsrythfltqhydakpqgrddrycesimrrrgltspckdintfihgnkrsikaicenkngnphrenlriskssfqvttcklhggspwppcqyratagfrnvvvacenglpvhldqsifrrp;(seqidno:23)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗egfr抗体单链fv片段(scfv),其中所述人源化抗-egfrscfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfsltnygvhwvrqapgkglewlgviwsggntdyntpftsrftisrdnskntlylqmnslraedtavyycaraltyydyefaywgqgttvtvssggggsggggsggggsdiqltqspsflsasvgdrvtitcrasqsigtnihwyqqkpgkapkllikyasesisgvpsrfsgsgsgteftltisslqpedfatyycqqnnnwpttfgagtkleikr(seqidno:2);(b)由一个或多个融合序列组成的融合部分,所述融合序列选自drgwgngcglfgkggi(seqidno:1),mvdrgwgngcglfgkggiv(seqidno:3),drgwgngcglfgkgsi(seqidno:5);drgwgngcglfgkgsl(seqidno:6);drgwgngcglfgkggv(seqidno:7);drgwhngcglfgkgsi(seqidno:8);drgwhngcgffgkgsi(seqidno:9);drgwgngcglfgkgsm(seqidno:10);drgwgngcglfgkgsy(seqidno:11);drgwnngcglfgkgsl(seqidno:12);nrgwnngcglfgkgdi(seqidno:13);drgwgnhcglfgkgsi(seqidno:14);drgwgnncglfgkgsi(seqidno:15);drgwgngcalfgkgsi(seqidno:16);drgwgnhcgffgkgsi(seqidno:17);drgwdsgcfifgkgev(seqidno:18);nrgwgtgcfkwgigfv(seqidno:19)和nrgwgtgcfewglgqv(seqidno:20),或与seqidno:1和seqidno:5至20相比分别显示有1至8个取代、删除或添加的序列;和(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子,其中所述血管生成素(rna酶5)具有氨基酸序列seqidno:23:
mvmglgvlllvfvlglgltpptlaqdnsrythfltqhydakpqgrddrycesimrrrgltspckdintfihgnkrsikaicenkngnphrenlriskssfqvttcklhggspwppcqyratagfrnvvvacenglpvhldqsifrrp;(seqidno:23)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分,所述融合序列包含序列drgwgngcglfgkggi(seqidno:1)或与seqidno:1相比显示有1至8个取代、缺失或插入的序列;和(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子,其中所述血管生成素(rna酶5)具有以下氨基酸序列seqidno:23:
mvmglgvlllvfvlglgltpptlaqdnsrythfltqhydakpqgrddrycesimrrrgltspckdintfihgnkrsikaicenkngnphrenlriskssfqvttcklhggspwppcqyratagfrnvvvacenglpvhldqsifrrp;(seqidno:23)。
本发明还涉及构建体,其包含(a)作为靶向性部分的人源化抗cd22抗体单链fv片段(scfv),其中所述人源化抗-cd22scfv抗体具有以下氨基酸序列:
evqlvesggglvqpggslrlscaasgfafsiydmswvrqvpgkglewvsyissgggttyypdtvkgrftisrdnsrntldlqmnslrvedtavyycarhsgygssygvlfaywggingtlvtvssggggsggggsggggsdiqmtqspsslsasvgdrvtitcrasqdisnylnwlqqkpgkapklliyytsilhsgvpsrfsgsgsgteftltisslqpedfatyycqqgntlpwtfgqgtkleikr(seqidno:24);(b)由一个或多个融合序列组成的融合部分,所述融合序列选自drgwgngcglfgkggi(seqidno:1),mvdrgwgngcglfgkggiv(seqidno:3);drgwgngcglfgkgsi(seqidno:5);drgwgngcglfgkgsl(seqidno:6);drgwgngcglfgkggv(seqidno:7);drgwhngcglfgkgsi(seqidno:8);drgwhngcgffgkgsi(seqidno:9);drgwgngcglfgkgsm(seqidno:10);drgwgngcglfgkgsy(seqidno:11);drgwnngcglfgkgsl(seqidno:12);nrgwnngcglfgkgdi(seqidno:13);drgwgnhcglfgkgsi(seqidno:14);drgwgnncglfgkgsi(seqidno:15);drgwgngcalfgkgsi(seqidno:16);drgwgnhcgffgkgsi(seqidno:17);drgwdsgcfifgkgev(seqidno:18);nrgwgtgcfkwgigfv(seqidno:19)和nrgwgtgcfewglgqv(seqidno:20),或与seqidno:1和seqidno:5至20相比分别显示有1至8个取代、删除或添加的序列;以及(c)血管生成素(rna酶5)作为待递送至细胞的细胞质中的分子,其中所述血管生成素(rna酶5)具有以下氨基酸序列seqidno:23:
mvmglgvlllvfvlglgltpptlaqdnsrythfltqhydakpqgrddrycesimrrrgltspckdintfihgnkrsikaicenkngnphrenlriskssfqvttcklhggspwppcqyratagfrnvvvacenglpvhldqsifrrp;(seqidno:23)。
如上所述,根据本发明的构建体包含至少两个,优选上述三个主要模块,即(a)靶向性部分,(b)由一个或多个融合序列组成的融合部分和(c)待递送至细胞的细胞质中的分子。所有三个主模块可以(化学地或通过重组技术)单独合成,任选地经过纯化,然后通过共价键化学偶联。因此,根据本发明的构建体可以是这样的构建体,其中靶向性部分、由一个或多个融合序列组成的融合部分和待递送至细胞的细胞质中的分子由共价键化学偶联。备选地,模块(a)和(b)可以是融合蛋白,而模块(c)以共价键与包含模块(a)和(b)的所述融合蛋白化学偶联。在另一个备选方案中,模块(a)和(c)可以是融合蛋白,而模块(b)以共价键与包含模块(a)和(c)的所述融合蛋白化学偶联。在另一个备选方案中,模块(b)和(c)可以是融合蛋白,而模块(a)以共价键与包含模块(b)和(c)的所述融合蛋白化学偶联。
术语“以共价键化学偶联”涉及技术人员熟知的缀合技术。许多用于制备与蛋白质或肽(具体而言是与本发明的融合部分或融合序列/肽)的共价或非共价缀合物的方法是本领域已知的,并且任何这样的已知方法都可以使用。不受理论束缚,根据本发明的构建体可以通过使用异双功能交联剂如n-琥珀酰-3-(2-吡啶基二硫代)丙酸酯(spdp)来制备。yu等人,int.j.cancer56:244(1994)。这种缀合的一般技术是本领域公知的;参见例如wong,chemistryofproteinconjugationandcross-linking(crcpress1991);upeslacis等人,“modificationofantibodiesbychemicalmethods,”见monoclonalantibodies:principlesandapplications,birch等人(eds.),187-230页(wiley-liss,inc.1995);price,“productionandcharacterizationofsyntheticpeptide-derivedantibodies”,monoclonalantibodies:production,engineeringandclinicalapplication,ritter等人(eds.),第60-84页(cambridgeuniversitypress1995)。因此,考虑到用于将各部分彼此共价相连,优选连接至蛋白质/肽(其可以是“靶向性部分”,由一个或多个促融合序列组成的融合部分和/或根据本发明的“货物”)的方法是本领域技术人员熟知的事实,因此提供的实施例不是限制性的。对将染料(共价)偶联至蛋白质参比品的方法的概述参见例如brinkleym.bioconjugchem.1992jan-feb3(1):2-13的综述文章;和lopez-jaramillo等人的文章,第16章,题为“vinylsulfone:amulti-purposefunctioninproteomics”;biochemistry,geneticsandmolecularbiology“integrativeproteomics”一书,作者:hon-chiueastwoodleung,主题编辑:tsz-kwongman和ricardoj.flores,isbn978-953-51-0070-6,发表日期:2012年2月24日。
根据本发明的构建体不仅可以包含上述三个主模块(a),(b)和(c)。相反,还可能期望在单个模块(a)之间放置连接子部分/部分,其可以例如促进构建体的构建。
本发明的构建体还可以是融合蛋白。已知有多种方法可用于制备融合蛋白,包括核酸合成、杂交和/或扩增以产生编码目的融合蛋白的合成双链核酸。这样的双链核酸可以通过标准分子生物学技术插入到用于产生融合蛋白的表达载体中(参见例如sambrook等,molecularcloning,alaboratorymanual,第2版,1989)。
本发明还涉及编码本发明的融合蛋白形式的构建体的核酸分子。核酸是例如编码本发明的构建体的三个主要模块之一的dna。备选地,所述核酸(优选dna)编码如上所定义的框内连接的所有三个主要模块。因此,核酸分子也可以编码本发明的主要模块中的一个、两个或所有三个。本发明的上述核酸分子可以是天然核酸分子以及重组核酸分子。因此,本发明的核酸分子可以是天然来源的、合成的或半合成的。其可以包含dna、rna以及pna,并且其可以是其杂交体。
对于本领域技术人员显而易见的是,可将调控序列添加到本发明的核酸分子中。例如,可以使用允许本发明的多核苷酸进行诱导表达的启动子、转录增强子和/或序列。合适的诱导型系统为例如四环素调控的基因表达,例如由gossen和bujard,natl.acad.sci.usa89(1992),5547-5551)和gossen,trendsbiotech.12(1994),58-62)描述,或地塞米松诱导型基因表达系统,例如由crook,emboj.8(1989),513-519描述。
进一步地,所述核酸分子可以包含例如硫酯键和/或核苷酸类似物。所述修饰可用于使核酸分子针对细胞中的内切核酸酶和/或外切核酸酶进行稳定化。所述核酸分子可以通过含有允许所述核酸分子在细胞中转录的嵌合基因的合适载体进行转录。在本发明的上下文中,所述核酸分子受到标记。用于检测核酸的方法是本领域熟知的,例如southern和northern印迹、pcr或引物延伸等方法。
本发明的核酸分子可以是重组产生的嵌合核酸分子,其包含单独或组合的任何上述核酸分子。优选地,本发明的核酸分子是载体的一部分。
因此,本发明还涉及包含本发明的核酸分子的载体。本发明由此涉及载体,优选包含本发明的核酸的表达载体。
本发明的载体可以是例如常规用于遗传工程的质粒、粘粒、病毒、噬菌体或其它载体,并且可以包含其它的基因,例如标记物基因,其允许在合适的宿主细胞中和在合适的条件下对所述载体进行选择。
此外,除了本发明的核酸序列之外,本发明的载体可以包含表达控制元件,允许编码区在合适的宿主中得到适当表达。这样的控制元件是本领域技术人员已知的,可以包括启动子、剪接盒、翻译起始密码子及用于将插入片段引入载体的翻译和插入位点。优选地,本发明的核酸分子可操作地连接到允许其在真核或原核细胞中表达的所述表达控制序列。因此,本发明涉及包含本发明的核酸的载体,其中所述核酸可操作地连接至控制序列,当用该载体转染真核和/或原核(宿主)细胞宿主细胞是,宿主细胞可识别所述控制序列。
确保在真核和原核(宿主)细胞中表达的对照元件是本领域技术人员熟知的。如上文所述,它们通常包含确保转录起始的调控序列和任选的多聚a信号,后者确保转录终止和转录物的稳定。另外的调控元件可以包括转录和翻译增强子,及/或天然结合的或异源的启动子区。允许在例如哺乳动物宿主细胞中表达的可能的调控元件包括cmv-hsv胸苷激酶启动子、sv40、rsv-启动子(劳氏肉瘤病毒)、人延伸因子1α-启动子、糖皮质激素诱导型mmtv-启动子(小鼠乳腺肿瘤病毒)、金属硫蛋白或四环素诱导型启动子或增强子如cmv增强子或sv40增强子。为了在神经细胞中表达,预期可以使用神经纤维、pgdf-、nse-、prp-或thy-1-启动子。所述这些启动子是本领域已知的,并且尤其在charron,j.biol.chem.270(1995),25739-25745中得到描述。对于在原核细胞中的表达,已经描述有许多启动子,包括例如tac-lac-启动子或trp启动子。除了负责转录起始的元件之外,这些调控元件还可以包含在多核苷酸下游的转录终止信号,例如sv40多聚a位点或tk多聚a位点。在本文中,合适的表达载体是本领域已知的,诸如okayama-bergcdna表达载体pcdv1(pharmacia)、prc/cmv、pcdna1、pcdna3(invitrogene)、psport1(gibcobrl)、px(pagano,science255(1992),1144-1147),酵母双杂交载体如peg202和dpjg4-5(gyuris,cell75(1995),791-803)或原核表达载体例如λgt11或pgex(amersham-pharmacia)。除了本发明的核酸分子之外,所述载体还可以进一步包含编码分泌信号的核酸序列。这些序列是本领域技术人员熟知的。此外,根据所用表达系统,可将能够使本发明的肽导向细胞区室的前导序列加到本发明的核酸分子的编码序列上,这些前导序列也是本领域熟知的。在适当时期将所述(这些)前导序列与翻译、起始和终止序列组装,优选是能够指导将翻译后的蛋白质或其蛋白质分泌到周质空间或细胞外培养基中的前导序列。任选地,异源序列可以编码包括c-或n-末端识别肽的融合蛋白,其中所述识别肽赋予了期望特征例如使表达的重组产物稳定化或纯化简化。一旦载体已经并入合适的宿主中,将宿主维持于适合核苷酸序列高水平表达的条件下,如果需要,随后可以收集和纯化本发明的抗体分子或其片段。
此外,本发明的载体也可以是表达载体。本发明的核酸分子和载体可以设计为直接引入或通过脂质体、病毒载体(例如腺病毒,逆转录病毒)、电穿孔、发射(例如基因枪)或其它递送系统引入细胞中。另外,杆状病毒系统可以用作本发明的核酸分子的真核表达系统。
本发明还涉及包含本发明的载体的宿主细胞。因此,本发明涉及用本发明的载体转染或转化的宿主或携带本发明的载体的非人宿主,即,涉及经过根据本发明的核酸分子或包含所述核酸分子的载体的遗传修饰哦哦宿主细胞或宿主。术语“遗传修饰的”是指宿主细胞或宿主除了其天然基因组外还包含根据本发明的核酸分子或载体,其被引入细胞或宿主或者其前体/亲本中。核酸分子或载体可以作为基因组外部的独立分子,优选作为能够复制的分子存在于遗传修饰的宿主细胞或宿主中,或者其可以稳定地整合到宿主细胞或宿主的基因组中。用本发明的载体转化宿主细胞可以通过标准方法进行,例如sambrook和russell(2001),molecularcloning:alaboratorymanual,cshpress,coldspringharbor,ny,usa;methodsinyeastgenetics,alaboratorycoursemanual,coldspringharborlaboratorypress,1990。在满足所使用的特定宿主细胞的要求的营养培养基中培养宿主细胞,具体而言在ph值、温度、盐浓度、通气、抗生素、维生素、微量元素等方面满足要求。
本发明的宿主细胞可以是任何原核或真核细胞。合适的原核细胞是通常用于克隆的原核细胞,如大肠杆菌(e.coli)或枯草芽孢杆菌(bacillussubtilis)。此外,真核细胞包括例如真菌或动物细胞。合适的真菌细胞的实例是酵母细胞,优选酵母属,最优选酿酒酵母种属的那些细胞。合适的动物细胞是例如昆虫细胞、脊椎动物细胞,优选哺乳动物细胞,例如,hek293、nso、cho、cos-7、mdck、u2-os、hela、nih3t3、molt-4、jurkat、pc-12、pc-3、imr、nt2n、sk-n-sh、caski、c33a。这些宿主细胞,例如cho细胞可以为本发明的抗体分子提供翻译后(二级)修饰,包括去除前导肽,h和c链的折叠和装配、在正确的一侧对分子进行糖基化和功能分子的分泌。本领域已知的其它合适的细胞系可从细胞系保藏中心获得,例如德意志微生物和细胞培养物保藏中心(deutschesammlungvonmikroorganismenundzellkulturengmbh,dsmz)或美国典型培养物保藏中心(atcc)。根据本发明,进一步预期的是原代细胞/细胞培养物可以作为宿主细胞。所述细胞具体衍生自昆虫(如果蝇或蜚蠊种属的昆虫)或哺乳动物(如人、猪、小鼠或大鼠)。所述宿主细胞还可以包含来自和/或衍生自如神经母细胞瘤细胞系的细胞系的细胞。上述原代细胞在本领域中是熟知的,并且尤其包括原代星形胶质细胞、(混合)脊髓培养物或海马培养物。
本发明还涉及方法,通过在培养基中培养含有编码本发明的单个模块或本发明的融合蛋白的表达载体的宿主细胞用以生产本发明构建体,以及从所述宿主细胞或培养基中回收所述构建体/融合蛋白。本发明还可涉及生产本发明的构建体的方法,包括培养本发明的宿主细胞并从培养物中回收所述构建体。
宿主细胞,例如cho细胞可以对本发明的表达的结合化合物提供翻译后(二级)修饰。这些修饰尤其包括糖基化和磷酸化。
本发明的构建体的回收和/或随后进行纯化的方法是本领域技术人员已知的。
如上定义的构建体在医疗背景中特别有用。因此,本发明还涉及药物组合物,其包含本发明的构建体、本发明的核酸分子、本发明的载体或本发明的宿主细胞和任选的药学上可接受载体。
本文使用的术语“治疗”等通常是指获得期望的药理学和/或生理学效应。因此,本发明的治疗可涉及对某种疾病的(急性)状态的治疗,但在完全或部分地预防疾病或其症状条件下也可涉及预防性治疗。优选地,术语“治疗”被理解为在部分或完全治愈疾病和/或不良反应和/或归因于疾病的症状方面是治疗性的。在这方面,“急性”是指受试者表现出疾病的症状。换言之,待治疗的受试者实际上需要治疗,并且在本发明的上下文中的术语“急性治疗”涉及在疾病发作后或在疾病突然发生后对所述疾病实际采取的措施。治疗也可以是预防性或预防性治疗,即为了预防疾病而采取的措施,例如为了预防感染和/或疾病的发作。
本发明的药物组合物可以通过本领域技术人员已知的多种种类的施用形式进行施用,包括但不限于霜剂、泡沫剂、凝胶剂、洗剂和软膏剂。
如所提到的,本发明涉及药物组合物,其包含有效量的根据上文的本发明的构建体和至少一种药学上可接受的赋形剂或载体。
赋形剂或载体是与活性成分(即根据上述的本发明的构建体)配制在一起的无活性物质,用于使含有有效活性成分的制剂膨胀化。赋形剂通常被称为“膨胀剂”、“填充剂”或“稀释剂”。膨胀化允许在生产剂型时方便和准确地分配药物物质。它们还可以达到各种增强治疗的目的,例如促进药物吸收或溶解,或其它药代动力学的作用。除了有助于目的活性物质的体外稳定性,如防止其在期望的保质期内变性以外,赋形剂在制造过程中也可能有助于处理目的活性物质,例如通过促进粉末流动性或不粘的特性。合适的赋形剂的选择还取决于施用途径和剂型,以及活性成分和其它因素。
因此,与上述一致,包含有效量的本发明的构建体的药物组合物可以是固体、液体或气体形式,尤其可以是以下形式:(一种或多种)粉剂、(一种或多种)片剂、(一种或多种)溶液或(一种或多种)气雾剂。优选地,所述药物组合物任选地包含药学上可接受的载体和/或稀释剂。
合适的药物载体、赋形剂和/或稀释剂的实例是本领域熟知的,并且包括磷酸盐缓冲盐溶液、水、乳液例如油/水乳液、各种类型的润湿剂、无菌溶液等。包含这些载体的组合物可以可通过熟知的常规方法配制。这些药物组合物可以以合适的剂量,即“有效量”施用于受试者,其可以由本领域技术人员通过本领域已知的方法容易地确定。根据本发明,通过局部施用施用合适的药物组合物是有效的。剂量方案将由主治医师和临床因素确定。如在医学领域中熟知的,用于任何一个患者的剂量都取决于许多因素,包括患者或受试者的体型、体表面积、年龄、待施用的具体化合物、性别、施用时间和途径、总体健康状况和其他同时施用的药物情况。蛋白质性药物活性物质的存在量可以为每剂量1-20mg/kg体重;然而,低于或高于该示例性范围的剂量也是预期中的,特别是考虑到上述因素的时候。
因此,优选地,本发明的构建体以有效量包括在内。术语“有效量”是指足以在待施用药物组合物的受试者中诱导可检测的治疗性应答的量。根据上文,只要其可用于如上所述的治疗,本发明的构建体在药物组合物中的含量不受限制,但优选占每种总组合物重量的0.0000001-10%。进一步地,本文所述的构建体优选地在载体中使用。通常,在载体中使用适量的药学上可接受的盐以使组合物等渗。载体的实例包括但不限于生理盐水、林格氏溶液和葡萄糖溶液。优选地,可接受的赋形剂、载体或稳定剂在所使用的剂量和浓度下是无毒的,包括缓冲液例如柠檬酸盐、磷酸盐和其它有机酸溶液;成盐反离子例如钠和钾;低分子量(>10个氨基酸残基)多肽;蛋白质如血清白蛋白或明胶;亲水性聚合物如聚乙烯吡咯烷酮;氨基酸如组氨酸、谷氨酰胺、赖氨酸、天冬酰胺、精氨酸或甘氨酸;碳水化合物,包括葡萄糖、甘露糖或糊精;单糖;二糖;其它糖,例如蔗糖、甘露醇、海藻糖或山梨醇;螯合剂如edta;非离子表面活性剂,例如吐温、普朗尼克(pluronics)或聚乙二醇;抗氧化剂包括甲硫氨酸、抗坏血酸和生育酚;和/或防腐剂,例如十八烷基二甲基苄基氯化铵;六甲基氯化铵;苯扎氯铵、苄索氯铵;苯酚、丁醇或苄醇;烷基对羟基苯甲酸酯如甲基或丙基对羟基苯甲酸酯;儿茶酚;间苯二酚;环己醇;3-戊醇和和间苯甲酚)。合适的载体及其制剂更详细地描述于remington'spharmaceuticalsciences,17thed.,1985,mackpublishingco.。
可以通过定期评估监测进展情况。本发明的构建体或本发明的药物组合物可以是无菌水性或非水性溶液,悬浮液和乳液以及霜剂和栓剂。非水溶剂的实例是丙二醇、聚乙二醇、植物油如橄榄油及有机酯如油酸乙酯。水性载体包括水、醇/水溶液、乳液或悬浮液,包括生理盐水和缓冲介质。也可以存在防腐剂和其它添加剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。此外,根据药物组合物的预期用途,本发明的药物组合物可以包含其它试剂。所述试剂可以是例如吐温、edta、柠檬酸盐、蔗糖以及适合于药物组合物的预期用途的其它试剂,其为本领域技术人员所熟知。
根据本发明,术语“药物组合物”涉及用于施用于患者、优选人类患者的组合物。
本发明的药物组合物可用于治疗癌症、心血管疾病、病毒感染、免疫功能障碍、自身免疫疾病、神经系统疾病、遗传性代谢疾病或遗传性疾病。癌症的实例包括头颈癌、乳腺癌、肾癌、膀胱癌、肺癌、前列腺癌、骨癌、脑癌、宫颈癌、肛门癌、结肠癌、结肠直肠癌、阑尾癌、眼癌、胃癌、白血病、淋巴瘤、肝癌、皮肤癌、卵巢癌、阴茎癌、胰腺癌、睾丸癌、甲状腺癌、阴道癌、外阴癌、子宫内膜癌、心脏癌和肉瘤。
心血管疾病的实例包括动脉粥样硬化、冠心病、肺心病和心肌病。
免疫功能障碍和自身免疫疾病的实例包括但不限于风湿性疾病和哮喘。
病毒感染的实例包括但不限于人免疫缺陷病毒、单纯疱疹病毒、人乳头瘤病毒以及乙型和丙型肝炎病毒的感染。
神经病症的实例包括但不限于帕金森病、多发性硬化和痴呆。
遗传性代谢疾病的实例包括但不限于高雪氏病和苯丙酮尿症。
本发明还涉及用于治疗癌症、心血管疾病、病毒感染、免疫功能障碍、自身免疫性疾病、神经系统疾病、遗传性代谢疾病或遗传性疾病的方法。关于治疗方法的优选实施方案,如上文在构建体或药物组合物用于治疗癌症、心血管疾病、病毒感染、免疫功能障碍、自身免疫疾病、神经病症、遗传性代谢病症或如上定义的遗传病症的上下文中所阐述的那些经过必要的修正也同样适用。
在本发明中,优选的实施方案中受试者是哺乳动物,例如狗、猫、猪、牛、羊、马、啮齿动物(例如大鼠、小鼠和豚鼠)或灵长类动物(例如大猩猩、黑猩猩和人类)。在最优选的实施方案中,受试者是人。
本发明还涉及试剂盒,其包含由衍生自登革热病毒糖蛋白e的一个或多个融合序列组成的融合部分(所述融合序列包含seqidno:1所示的序列或与seqidno:1相比显示有1至8个取代、缺失或插入的序列)、根据本发明的构建体、根据本发明的核酸分子、根据本发明的载体或根据本发明的宿主细胞。关于优选的实施方案,上文在根据本发明的构建体、核酸分子、载体或宿主细胞的上下文中所阐述的那些经过必要的修正同样适用。有利地,本发明的试剂盒进一步任选地包含上述和下述用途和方法所需的(一种或多种)缓冲液、储存溶液和/或其他试剂或材料。进一步地,本发明的试剂盒的部分可以单独包装在小瓶或瓶中或者组合包装在容器或多容器单元中。本发明的试剂盒可以尤其有利地用于实施本发明的方法、制备本发明的构建体,并且可以用于本文提及的各种应用中,例如在上文和下文所概述的用途中。可以包括在试剂盒中的另一组分是对试剂盒使用者的使用说明书。试剂盒的制造优选地遵循本领域技术人员已知的标准程序。
最后,本发明还涉及由衍生自登革热病毒糖蛋白e的一种或多种融合序列组成的融合部分用于递送如上所定义的靶向性部分的用途。因此,本发明还涉及融合部分的用途,所述融合部分由一个或多个衍生自如上所定义的登革热病毒糖蛋白e的融合序列组成,用于将治疗剂、可检测部分、核酸分子优选sirna、载体分子(优选纳米颗粒,脂质体和病毒载体)递送进入细胞的细胞质中。关于用途的优选实施方案,如上文在构建体的上下文中所阐述的那些内容经过必要的修正同样适用。本发明还涉及上述用途,其中所述一种或多种源自登革热病毒糖蛋白e的融合序列包含seqidno:1所示的序列。优选地,本发明可以涉及上述用途,其中所述一个或多个融合序列是与seqidno:1相比显示有1至8个取代,缺失或插入的序列。同样,关于这些用途的优选实施方案,如上文在构建体的上下文中所述的内容经过必要的修正同样适用。
在本发明中,优选的实施方案中受试者是哺乳动物,例如狗、猫、猪、牛、羊、马、啮齿动物(例如大鼠、小鼠和豚鼠)或灵长类动物(例如大猩猩、黑猩猩和人类)。在最优选的实施方案中,受试者是人。
图1:显示了scfv(a)、ranpirnase-gs-scfv(b)和ranpirnase-den-scfv(c)的示意图。通过甘氨酸-丝氨酸连接子(b)或通过来自登革热病毒的融合肽(其序列如(c)所示)将ranpirnase与scfv片段的n末端融合。vh和vl:分别为衍生自西妥昔单抗的人源化scfv片段的重链和轻链的可变结构域。分别使用c-末端c-myc标签(c-myc)和六组氨酸标签(his6)进行检测和纯化目的。
图2:显示了对体外特异性抗肿瘤活性的评估。用指定浓度的scfv、ranpirnase、ranpirnase-gs-scfv或ranpirnase-den-scfv处理72小时后,测定egfr阳性(a)和egfr阴性(b)肿瘤细胞系的细胞活力。结果表示为相对于缓冲液处理的对照细胞的情况。数据描述了重复三次的代表性实验的平均值±se。
图3:显示了ranpirnase-den-scfv的抗原特异性细胞毒性。在加或不加摩尔量过量50倍的抗egfrscfv(1000nm)的情况下,用ranpirnase-den-scfv(20nm)处理hno211细胞。对于对照,仅用抗egfrscfv(1000nm)处理细胞。72小时后通过mtt测定法测定细胞活力。数据描绘了重复的代表性实验的平均值±se。
本发明的其它方面和优点将在以下实施例中描述,所述实施例是为了说明目的给出,而不是出于限制目的。本申请中引用的所有出版物、专利、专利申请或其它文献通过引用整体并入本文。
实施例
材料和方法
1.ranpirnase-gs-scfv和ranpirnase-den-scfv融合蛋白的克隆
合成ranpirnase基因(uniprotkb/swiss-prot:p22069.2)使其具有用作c-末端(g4s)3连接子和两侧限制性位点的附加基因区段,以用于在哺乳动物细胞中进行最佳表达(entelechon,badabbach,germany),并将其以apali/pvuii片段的形式克隆到亚克隆载体pmja-1b(krauss等人,2005a)中。为了生成免疫rna酶ranpirnase-gs-scfv基因,通过聚合酶链式反应(pcr)扩增由抗体c225生成的人源化抗表皮生长因子受体(egfr)scfvizi08(seifert等人,2012)的dna序列(goldstein等人,1995),其中使用esr-1s(5'-tatagaagtgcagctggttgaaagc-3')正向引物在vh结构域dna序列的5'端引入pvuii限制性位点以及esr-2as(5'-tataggatccacgtttaatttccag-3')反向引物在vl结构域dna序列的3'末端附加bamhi限制性位点。在将izi08基因插入含有ranpirnase基因的亚克隆载体中之前,引入沉默突变用于破坏序列其他的内部pvuii和bamhi位点。随后将抗egfrscfvizi08基因作为在ranpirnase基因下游的pvuii/bamhi片段克隆到含有编码c-myc标签和六组氨酸标签的dna序列的亚克隆载体pmja-1b中。通过重叠延伸pcr将rna酶和抗体部分之间的标准(g4s)3连接子的dna序列被编码登革热病毒血清型2的糖蛋白e的96-114号氨基酸的dna序列交换,得到ranpirnase-den-scfv盒亚克隆载体pden14。用ecori消化ranpirnase-gs-scfv和ranpirnase-den-scfv融合蛋白编码基因并克隆到哺乳动物细胞表达载体pee12.4(lonzabiologics,slough,uk)中。通过使用bamhi的限制性消化来证实dna插入片段方向的正确性。
2.细胞系和蛋白质
细胞系a431(人表皮样癌)、mcf7(人乳腺癌)和raji(人burkitt淋巴瘤)购自atcc(manassas,va,usa)。在得到患者知情同意后并通过海德堡大学医学院伦理委员会许可后,由人类头颈部鳞状细胞癌(hnscc)患者的手术标本建立hnscc细胞系hno97(来自口腔)、hno211(来自口咽)和hno410(来自下咽淋巴结转移)。在5%co2、37℃的加湿培养箱中用补充有10%胎牛血清(sigma-aldrich)、100u/ml青霉素和100μg/ml链霉素(sigma-aldrich)的dulbecco's改良的eagle's培养基(sigma-aldrich,taufkirchen,德国)培养a431、mcf7和hnscc细胞系。在相同条件下用补充有10%胎牛血清,100u/ml青霉素和100μg/ml链霉素的rpmi1640培养基(sigma-aldrich)培养raji细胞。在37℃,5%co2、速度120rpm的振荡培养箱中用补充有0.1%kolliphorp188(sigma-aldrich),4mm谷氨酰胺(invitrogen)和25μg/mlg418(carlroth,karlsruhe,germany)的f17培养基(invitrogen,lifetechnologies,darmstadt,germany)培养hek293-6e细胞(获自nationalresearchcouncil,biotechnologicalresearchinstitute,montreal,canada)。
用于对照的ranpirnase由kuslimashogen,alfacell公司友情提供。
3.scfv和免疫rna酶的表达和纯化
使用载体pab1(müller等人,2007)使抗egfrscfv可溶性表达进入大肠杆菌tg1细胞(stratagene,agilenttechnologies,santaclara,ca,usa)周质中,方法如前所述(diebolder等,2014)。在4℃下将含scfv的周质提取物对sp10缓冲液(20mmnah2po4,300mmnacl,10mm咪唑,ph8.0)进行充分透析,以通过固定化金属离子亲和色谱法(imac)进一步纯化。在悬浮生长于摇瓶中(falcon,bectondickinson,heidelberg,germany)的hek293-6e细胞中瞬时表达rna酶融合蛋白。分别在1/20的最终培养物体积的f17培养基(不含g418)中制备1μg无内毒素质粒dna和2μg聚乙烯亚胺(polysciences,warrington,pa,usa),将二者混合,室温孵育3min并加到细胞密度为1.7至2×106细胞/ml的hek293-6e细胞中。转染后一天,向细胞中补充加入0.5%(w/v)胰蛋白胨tn1(organotechnies.a.s,lacourneuve,france)。转染后5天后,收集含有蛋白质的上清液,并分别对sp20(20mmnah2po4,300mmnacl,10mm咪唑,ph8.0)进行透析用于ranpirnase-gs-scfv或对tris-hcl缓冲液(25mmtris,500mmnacl,ph8.2)进行透析用于ranpirnase-den-scfv,使用
4.核糖核酸分解活性的确定
通过监测荧光底物6-羧基荧光素-darudgda-black-hole-quencher-1(6-fam-darudgda-bhq-1)(biomers.net,ulm,germany)随时间的裂解情况来测量ranpirnase和免疫rna酶的核糖核酸分解活性。使用具有485/535nm(激发/发射)滤片组的infinitef200pro酶标仪(tecan,maennedorf,switzerland)在96孔黑色微量滴定板中测量荧光强度。在25℃下,在含有100mmnacl和6-fam-darudgda-bhq-1(5nm)的100mmmes-naoh缓冲液(ph6.0)中以进行反应,总反应体积为每孔200μl。将不含rna酶的缓冲液用作阴性对照,浓度过量的rna酶a用作阳性对照。进行至少三次独立的测定,每次包含三个复样。
使用以下公式计算kcat/km值:
该公式中,△f/△t代表起始反应速率,fmin是添加rna酶之前的起始荧光强度。fmax是过量rna酶a对底物进行完全裂解后的荧光强度,而[e]是rna酶浓度。
5.抗体结合
为确定平衡结合曲线,将a431细胞在系列稀释的纯化的抗-egfrscfv、ranpirnase-gs-scfv或ranpirnase-den-scfv中培养,均做三个复样。使用小鼠抗-c-myc单克隆抗体(克隆号9e10)(roche,penzberg,germany)和羊抗小鼠异硫氰酸荧光素(fitc)缀合物(jacksonimmunoresearch,suffolk,uk)进行结合抗体或免疫rna酶的检测。使用facsdiva软件(bectondickinson)在facscantoii流式细胞仪(bectondickinson)上测量染色细胞的荧光。用测量的荧光中值减去背景荧光,并使用graphpadprism5.0(graphpadsoftware,lajolla,ca,usa)通过非线性回归计算相对亲和力。
6.细胞活力测定和竞争分析
为了评估重组蛋白质的抗肿瘤功效,将细胞接种在96孔平底板(falcon)中,并在37℃,5%co2与不同浓度的蛋白质或缓冲液(作为对照)孵育72小时,总体积为110μl。对于贴壁细胞系(a431、hno97、hno211、hno410、mcf7),通过加入20μl的稀释在pbs中5mg/ml的3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(mtt)溶液来确定细胞活力。在37℃、5%co2与mtt孵育后4小时除去培养基,并将细胞在每孔100μl裂解溶液(10%sds(w/v)和0.6%乙酸(v/v)溶于二甲基亚砜)中裂解。将板在室温下孵育5分钟,然后温和搅拌5分钟以溶解释放的甲瓒晶体。通过使用infinitef200pro酶标仪(tecan)测量570nm处的吸光度(参考波长:620nm)来测定甲瓒浓度。为了测定悬浮细胞系raji的活力,将细胞与每孔10μl
细胞活力表示为蛋白质处理组相比缓冲液对照组的活细胞百分比。ic50定义为与缓冲液对照相比细胞活力降低50%的浓度。每个测定至少进行两次重复,其中每次测定含有三个复样。
对于竞争分析,将hno211细胞接种在96孔平底板(falcon)中,并且在加入ranpirnase-den-scfv(20nm)之前用浓度为1000nm的抗egfrscfvizi08预孵育3小时。对于对照,将细胞与单独的ranpirnase-den-scfv(20nm)或抗egfrscfv(1000nm)一起孵育。在37℃、5%co2孵育72小时后,使用如上所述的mtt测定法测定细胞活力。所有反应做三个复样。
实施例1:ranpirnase-gs-scfv和ranpirnase-den-scfv的生成
为了靶向杀死表达egfr的癌细胞,将ranpirnase通过柔性(g4s)3连接子与人源化scfv片段(其具有与临床建立的mab西妥昔单抗
实施例2:scfv和免疫rna酶的表达和纯化
在大肠杆菌中表达scfv片段并从周质空间将其分离,而在hek293-6e细胞中产生免疫rna酶ranpirnase-gs-scfv和ranpirnase-den-scfv,并通过采用igvh前导肽(krauss等人,2005a)使其分泌至细胞培养物上清。通过ni-nta柱纯化蛋白质,然后进行尺寸排阻色谱,产生纯度>95%的均质蛋白质制剂。完全纯化后的生产产量分别为scfv的1.9mg/l,ranpirnase-gs-scfv的0.9mg/l,ranpirnase-den-scfv的3.2mg/l。
实施例3:免疫rna酶的功能分析
通过流式细胞术在表达egfr的a431细胞上测定scfv、ranpirnase-gs-scfv和ranpirnase-den-scfv的细胞结合和表观平衡解离常数(kd)。如表i所示,两种免疫rna酶以与单独scfv相似的高亲和力结合靶抗原。
表i:流式细胞术分析结果:抗体构建物结合a431细胞的亲和力。
ranpirnase、ranpirnase-gs-scfv和ranpirnase-den-scfv的核糖核酸分解活性是通过其裂解匹配ranpirnase的核碱基特异性的荧光rna底物的能力来测量(lee和raines,2003)。与野生型ranpirnase相比,ranpirnase与scfv片段的n-末端通过柔性甘氨酸-丝氨酸连接子的融合轻微降低了其催化活性(表ii)。
表ii:ranpirnase和ranpirnase融合蛋白的核糖核酸裂解活性
*裂解6-fam-darudgda-bhq-1的kcat/km(±se)值如材料与方法章节中所述进行确定。
ranpirnase-den-scfv的催化活性与ranpirnase-gs-scfv相比是约2倍低,表明可能发生了ranpirnase的折叠和构象的连接子依赖性变化或与底物相互作用的空间位阻。
实施例4:体外细胞毒性
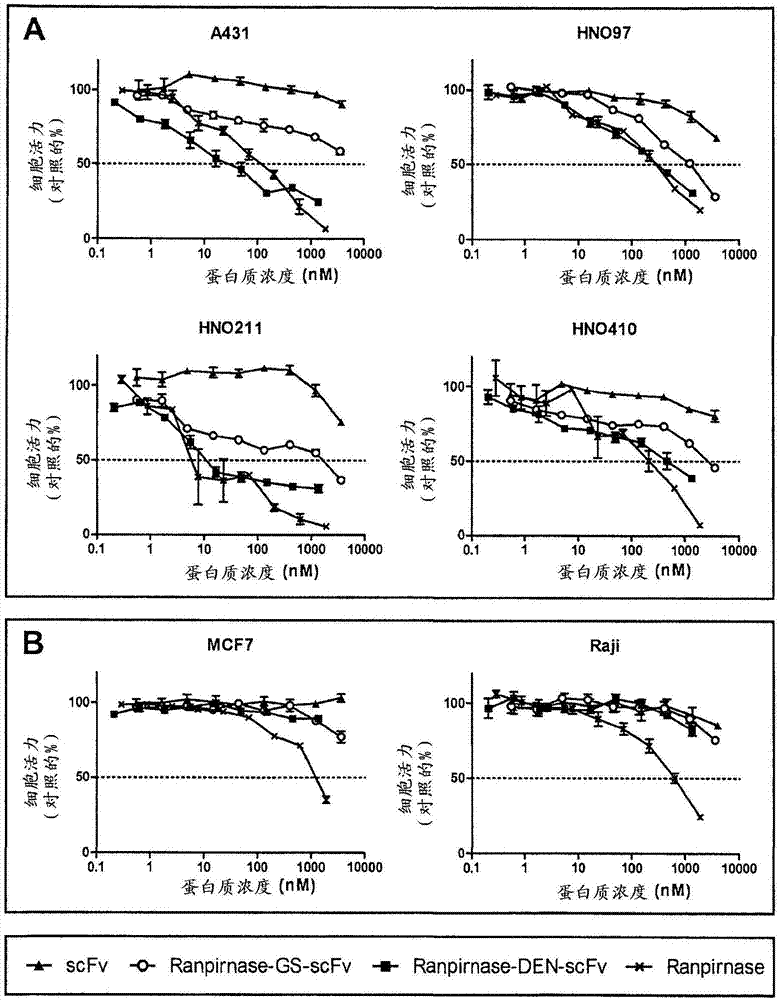
为了评价对表达egfr的癌细胞的特异性毒性,将scfv片段、ranpirnase-gs-scfv、ranpirnase-den-scfv和ranpirnase与egfr-过表达的表皮样癌细胞系a431和几种来自头颈部癌症患者的切除肿瘤的egfr阳性原代细胞系(hno97,hno211,hno410)一同孵育。用egfr阴性的乳腺癌细胞系mcf7和burkitt淋巴瘤细胞系raji作为阴性对照。如图2和表iii所示,单独的抗egfrscfv片段对细胞活力几乎没有影响。
表iii:测试的构建体对egfr阳性细胞系的体外抗肿瘤活性。ic50值表示为平均值±se,其来自至少两个独立的实验,每个实验以三个复样进行。
由于ranpirnase能够以不依赖egfr的方式进入细胞(rodriguez等人,2007),单独的ranpirnase对egfr阴性和egfr阳性细胞都具有细胞毒性(图2)。通过柔性甘氨酸-丝氨酸连接子将ranpirnase与scfv片段的n末端融合(ranpirnase-gs-scfv)导致其与单一药剂ranpirnase相比细胞毒性显著降低。相比之下,含有源自登革热病毒的融合肽的免疫rna酶(ranpirnase-den-scfv)表现出与单独ranpirnase对表达egfr的细胞类似的抗肿瘤功效,但即使在非常高的浓度下也不影响egfr阴性细胞(图2b)。ranpirnase-den-scfv对原代hno211细胞系显示出最强的细胞毒性,平均ic50值为18nm,对应与ranpirnase-gs-scfv相比效力79倍增加。
为了证明引入的病毒连接子序列对ranpirnase-den-scfv的特异性没有负面影响,我们在hno211细胞系上进行竞争测定。如图3所示,ranpirnase-den-scfv的细胞毒性可以在摩尔量过量50倍的scfv存在下完全消除,证实两种化合物结合相同的靶向表位,并且ranpirnase-den-scfv进入细胞是egfr特异性的,并且不由融合肽与质膜的非特异性相互作用介导。
参考文献
arndt,m.a.,krauss,j.,vu,b.k.,newton,d.l.andrybak,s.m.(2005)j.immunother.,28,245-251.
bachran,c.,heisler,i.,fuchs,h.andsutherland,m.(2005)biochem.biophys.res.commun.,337,602-609.
chang,c.h.,gupta,p.,michel,r.,loo,m.,wang,y.,cardillo,t.m.andgoldenberg,d.m.(2010)mol.cancerther.,9,2276-2286.
chang,c.h.,sapra,p.,vanama,s.s.,hansen,h.j.,horak,i.d.andgoldenberg,d.m.(2005)blood,106,4308-4314.
chignola,r.,anselmi,c.,dallaserra,m.,franceschi,a.,fracasso,g.,pasti,m.,chiesa,e.,lord,j.m.,tridente,g.andcolombatti,m.(1995)j.biol.chem.,270,23345-23351.
delorenzo,c.,arciello,a.,cozzolino,r.,palmer,d.b.,laccetti,p.,piccoli,r.andd'alessio,g.(2004)cancerres.,64,4870-4874.
diebolder,p.,keller,a.,haase,s.,schlegelmilch,a.,kiefer,j.d.,karimi,t.,weber,t.,moldenhauer,g.,kehm,r.,eis-hubinger,a.m.,etal.(2014)mabs,6,130-142.
erickson,h.a.,jund,m.d.andpennell,c.a.(2006)proteineng.des.sel.,19,37-45.
fuchs,h.,bachran,c.andflavell,d.j.(2013)antibodies,2,209-235.
goldstein,n.i.,prewett,m.,zuklys,k.,rockwell,p.andmendelsohn,j.(1995)clin.cancerres.,1,1311-1318.
goparaju,c.m.,blasberg,j.d.,volinia,s.,palatini,j.,ivanov,s.,donington,j.s.,croce,c.,carbone,m.,yang,h.andpass,h.i.(2011)oncogene,30,2767-2777.haigis,m.c.,kurten,e.l.andraines,r.t.(2003)nucleicacidsres.,31,1024-1032.
hetzel,c.,bachran,c.,fischer,r.,fuchs,h.,barth,s.andstocker,m.(2008)j.immunother.,31,370-376.
huang,c.y.,butrapet,s.,moss,k.j.,childers,t.,erb,s.m.,calvert,a.e.,silengo,s.j.,kinney,r.m.,blair,c.d.androehrig,j.t.(2010)virology,396,305-315.
krauss,j.,arndt,m.a.,vu,b.k.,newton,d.l.andrybak,s.m.(2005a)br.j.haematol.,128,602-609.
krauss,j.,arndt,m.a.,vu,b.k.,newton,d.l.,seeber,s.andrybak,s.m.(2005b)biochem.biophys.res.commun.,331,595-602.
lee,j.e.andraines,r.t.(2003)biochemistry,42,11443-11450.
liu,d.,cardillo,t.m.,wang,y.,rossi,e.a.,goldenberg,d.m.andchang,c.h.(2014)mol.cancer,13,53.
melo,m.n.,sousa,f.j.,carneiro,f.a.,castanho,m.a.,valente,a.p.,almeida,f.c.,dapoian,a.t.andmohana-borges,r.(2009)j.mol.biol.,392,736-746.
mikulski,s.,grossman,a.,carter,p.,shogen,k.andcostanzi,j.(1993)int.j.oncol.,3,57-64.
mikulski,s.m.,costanzi,j.j.,vogelzang,n.j.,mccachren,s.,taub,r.n.,chun,h.,mittelman,a.,panella,t.,puccio,c.,fine,r.,etal.(2002)j.clin.oncol.,20,274-281.
müller,d.,karle,a.,meissburger,b.,hofig,i.,stork,r.andkontermann,r.e.(2007)j.biol.chem.,282,12650-12660.
newton,d.l.,hansen,h.j.,mikulski,s.m.,goldenberg,d.m.andrybak,s.m.(2001)blood,97,528-535.
pirie,c.m.,hackel,b.j.,rosenblum,m.g.andwittrup,k.d.(2011)j.biol.chem.,286,4165-4172.
qiao,m.,zu,l.d.,he,x.h.,shen,r.l.,wang,q.c.andliu,m.f.(2012)cellres.,22,1199-1202.
rodriguez,m.,torrent,g.,bosch,m.,rayne,f.,dubremetz,j.f.,ribo,m.,benito,a.,vilanova,m.andbeaumelle,b.(2007)j.cellsci.,120,1405-1411.
saxena,s.k.,sirdeshmukh,r.,ardelt,w.,mikulski,s.m.,shogen,k.andyoule,r.j.(2002)j.biol.chem.,277,15142-15146.
schulenburg,c.,ardelt,b.,ardelt,w.,arnold,u.,shogen,k.,ulbrich-hofmann,r.anddarzynkiewicz,z.(2007)cancerbiol.ther.,6,1233-1239.
seifert,o.,plappert,a.,heidel,n.,fellermeier,s.,messerschmidt,s.k.,richter,f.andkontermann,r.e.(2012)proteineng.des.sel.,25,603-612.
snyder,e.l.,saenz,c.c.,denicourt,c.,meade,b.r.,cui,x.s.,kaplan,i.m.anddowdy,s.f.(2005)cancerres.,65,10646-10650.
sorkin,a.andgoh,l.k.(2009)exp.cellres.,315,683-696.
tolstikov,v.v.,cole,r.,fang,h.andpincus,s.h.(1997)bioconjug.chem.,8,38-43.
weng,a.,thakur,m.,vonmallinckrodt,b.,beceren-braun,f.,gilabert-oriol,r.,wiesner,b.,eichhorst,j.,bottger,s.,melzig,m.f.andfuchs,h.(2012)j.control.release,164,74-86.
weyergang,a.,selbo,p.k.,berstad,m.e.,bostad,m.andberg,k.(2011)laserssurg.med.,43,721-733.
zaitseva,e.,yang,s.t.,melikov,k.,pourmal,s.andchernomordik,l.v.(2010)plospathog.,6,e1001131.
序列表
<110>ruprecht-karls-universit?theidelberg
<120>用于将分子递送至细胞的细胞质中的构建体
<130>x1963pcts3
<150>ep14183990.2
<151>2014-09-08
<160>26
<170>bissap1.2
<210>1
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>1
aspargglytrpglyasnglycysglyleupheglylysglyglyile
151015
<210>2
<211>242
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>2
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglypheserleuthrasntyr
202530
glyvalhistrpvalargglnalaproglylysglyleuglutrpleu
354045
glyvaliletrpserglyglyasnthrasptyrasnthrprophethr
505560
serargphethrileserargaspasnserlysasnthrleutyrleu
65707580
glnmetasnserleuargalagluaspthralavaltyrtyrcysala
859095
argalaleuthrtyrtyrasptyrgluphealatyrtrpglyglngly
100105110
thrthrvalthrvalserserglyglyglyglyserglyglyglygly
115120125
serglyglyglyglyseraspileglnleuthrglnserproserphe
130135140
leuseralaservalglyaspargvalthrilethrcysargalaser
145150155160
glnserileglythrasnilehistrptyrglnglnlysproglylys
165170175
alaprolysleuleuilelystyralasergluserileserglyval
180185190
proserargpheserglyserglyserglythrgluphethrleuthr
195200205
ileserserleuglnprogluaspphealathrtyrtyrcysglngln
210215220
asnasnasntrpprothrthrpheglyalaglythrlysleugluile
225230235240
lysarg
<210>3
<211>19
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>3
metvalaspargglytrpglyasnglycysglyleupheglylysgly
151015
glyileval
<210>4
<211>104
<212>prt
<213>豹蛙
<220>
<221>mod_res
<222>1
<223>焦谷氨酸
<400>4
glnasptrpleuthrpheglnlyslyshisilethrasnthrargasp
151015
valaspcysaspasnilemetserthrasnleuphehiscyslysasp
202530
lysasnthrpheiletyrserargprogluprovallysalailecys
354045
lysglyileilealaserlysasnvalleuthrthrsergluphetyr
505560
leuseraspcysasnvalthrserargprocyslystyrlysleulys
65707580
lysserthrasnlysphecysvalthrcysgluasnglnalaproval
859095
hisphevalglyvalglysercys
100
<210>5
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>5
aspargglytrpglyasnglycysglyleupheglylysglyserile
151015
<210>6
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>6
aspargglytrpglyasnglycysglyleupheglylysglyserleu
151015
<210>7
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>7
aspargglytrpglyasnglycysglyleupheglylysglyglyval
151015
<210>8
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>8
aspargglytrphisasnglycysglyleupheglylysglyserile
151015
<210>9
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>9
aspargglytrphisasnglycysglyphepheglylysglyserile
151015
<210>10
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>10
aspargglytrpglyasnglycysglyleupheglylysglysermet
151015
<210>11
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>11
aspargglytrpglyasnglycysglyleupheglylysglysertyr
151015
<210>12
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>12
aspargglytrpasnasnglycysglyleupheglylysglyserleu
151015
<210>13
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>13
asnargglytrpasnasnglycysglyleupheglylysglyaspile
151015
<210>14
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>14
aspargglytrpglyasnhiscysglyleupheglylysglyserile
151015
<210>15
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>15
aspargglytrpglyasnasncysglyleupheglylysglyserile
151015
<210>16
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>16
aspargglytrpglyasnglycysalaleupheglylysglyserile
151015
<210>17
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>17
aspargglytrpglyasnhiscysglyphepheglylysglyserile
151015
<210>18
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>18
aspargglytrpaspserglycyspheilepheglylysglygluval
151015
<210>19
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>19
asnargglytrpglythrglycysphelystrpglyileglypheval
151015
<210>20
<211>16
<212>prt
<213>人工序列
<220>
<223>病毒融合序列
<400>20
asnargglytrpglythrglycyspheglutrpglyleuglyglnval
151015
<210>21
<211>495
<212>prt
<213>登革热病毒(糖蛋白e血清型2)
<400>21
metargcysileglyileserasnargaspphevalgluglyvalser
151015
glyglysertrpvalaspilevalleugluhisglysercysvalthr
202530
thrmetalalysasnlysprothrleuaspphegluleuilelysthr
354045
glualalyshisproalathrleuarglystyrcysileglualalys
505560
leuthrasnthrthrthralaserargcysprothrglnglyglupro
65707580
serleuasnglugluglnasplysargphevalcyslyshissermet
859095
valaspargglytrpglyasnglycysglyleupheglylysglygly
100105110
ilevalthrcysalametphethrcyslyslysasnmetgluglylys
115120125
valvalglnprogluasnleuglutyrthrilevalilethrprohis
130135140
serglyglugluasnalavalglyasnaspthrglylyshisglylys
145150155160
gluilelysvalthrproglnserserilethrglualagluleuthr
165170175
glytyrglythrvalthrmetglucysserproargthrglyleuasp
180185190
pheasnglumetvalleuleuglnmetgluasnlysalatrpleuval
195200205
hisargglntrppheleuaspleuproleuprotrpleuproglyala
210215220
aspthrglnglyserasntrpileglnlysgluthrleuvalthrphe
225230235240
lysasnprohisalalyslysglnaspvalvalvalleuglysergln
245250255
gluglyalamethisthralaleuthrglyalathrgluileglnmet
260265270
serserglyasnleuleuphethrglyhisleulyscysargleuarg
275280285
metasplysleuglnleulysglymetsertyrsermetcysthrgly
290295300
lysphelysvalvallysgluilealagluthrglnhisglythrile
305310315320
valileargvalglntyrgluglyaspglyserprocyslysilepro
325330335
phegluilemetaspleuglulysarghisvalleuglyargleuile
340345350
thrvalasnproilevalthrglulysaspserprovalasnileglu
355360365
alaglupropropheglyaspsertyrileileileglyvalglupro
370375380
glyglnleulysleusertrpphelyslysglyserserileglygln
385390395400
metphegluthrthrmetargglyalalysargmetalaileleugly
405410415
aspthralatrpasppheglyserleuglyglyvalphethrserile
420425430
glylysalaleuhisglnvalpheglyalailetyrglyalaalaphe
435440445
serglyvalsertrpthrmetlysileleuileglyvalvalilethr
450455460
trpileglymetasnserargserthrserleuservalserleuval
465470475480
leuvalglyvalvalthrleutyrleuglyvalmetvalglnala
485490495
<210>22
<211>156
<212>prt
<213>人
<220>
<223>人胰腺rna酶(rna酶1)
<400>22
metalaleuglulysserleuvalargleuleuleuleuvalleuile
151015
leuleuvalleuglytrpvalglnproserleuglylysgluserarg
202530
alalyslyspheglnargglnhismetaspseraspserserproser
354045
serserserthrtyrcysasnglnmetmetargargargasnmetthr
505560
glnglyargcyslysprovalasnthrphevalhisgluproleuval
65707580
aspvalglnasnvalcyspheglnglulysvalthrcyslysasngly
859095
glnglyasncystyrlysserasnsersermethisilethraspcys
100105110
argleuthrasnglyserargtyrproasncysalatyrargthrser
115120125
prolysgluarghisileilevalalacysgluglyserprotyrval
130135140
provalhispheaspalaservalgluaspserthr
145150155
<210>23
<211>147
<212>prt
<213>人
<220>
<223>人血管生成素(rna酶5)p03950
<400>23
metvalmetglyleuglyvalleuleuleuvalphevalleuglyleu
151015
glyleuthrproprothrleualaglnaspasnserargtyrthrhis
202530
pheleuthrglnhistyraspalalysproglnglyargaspasparg
354045
tyrcysgluserilemetargargargglyleuthrserprocyslys
505560
aspileasnthrpheilehisglyasnlysargserilelysalaile
65707580
cysgluasnlysasnglyasnprohisarggluasnleuargileser
859095
lysserserpheglnvalthrthrcyslysleuhisglyglyserpro
100105110
trpproprocysglntyrargalathralaglypheargasnvalval
115120125
valalacysgluasnglyleuprovalhisleuaspglnserilephe
130135140
argargpro
145
<210>24
<211>245
<212>prt
<213>人工序列
<220>
<223>人源化抗cd22scfv(sgiii)
<400>24
gluvalglnleuvalgluserglyglyglyleuvalglnproglygly
151015
serleuargleusercysalaalaserglyphealapheseriletyr
202530
aspmetsertrpvalargglnvalproglylysglyleuglutrpval
354045
sertyrileserserglyglyglythrthrtyrtyrproaspthrval
505560
lysglyargphethrileserargaspasnserargasnthrleuasp
65707580
leuglnmetasnserleuargvalgluaspthralavaltyrtyrcys
859095
alaarghisserglytyrglysersertyrglyvalleuphealatyr
100105110
trpglyglythrleuvalthrvalserserglyglyglyglysergly
115120125
glyglyglyserglyglyglyglyseraspileglnmetthrglnser
130135140
proserserleuseralaservalglyaspargvalthrilethrcys
145150155160
argalaserglnaspileserasntyrleuasntrpleuglnglnlys
165170175
proglylysalaprolysleuleuiletyrtyrthrserileleuhis
180185190
serglyvalproserargpheserglyserglyserglythrgluphe
195200205
thrleuthrileserserleuglnprogluaspphealathrtyrtyr
210215220
cysglnglnglyasnthrleuprotrpthrpheglyglnglythrlys
225230235240
leugluilelysarg
245
<210>25
<211>25
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..25
<223>/mol_type="unassigneddna"
/note="esr-1sfwd"
/organism="人工序列"
<400>25
tatagaagtgcagctggttgaaagc25
<210>26
<211>25
<212>dna
<213>人工序列
<220>
<221>来源
<222>1..25
<223>/mol_type="unassigneddna"
/note="esr-2asrev"
/organism="人工序列"
<400>26
tataggatccacgtttaatttccag25
- 还没有人留言评论。精彩留言会获得点赞!