右兰索拉唑药物制剂的制作方法
本发明属于医药制剂领域,具体涉及一种右兰索拉唑药物组合物及其制备方法。
背景技术:
右兰索拉唑的化学名称为(+)-2-[3-甲基-4-(2,2,2-三氟乙基)吡啶-2-基]甲基}亚磺酰基]-1h-苯并咪唑,其化学结构式如下:
右兰索拉唑为ppi类质子泵抑制剂,能高效快速抑制h+/k+-atp,达到抑制胃酸分泌的作用。武田公司2009年开发上市的“dexilant”为右兰索拉唑的双控制剂,内部含有两种不同包衣的延时颗粒,分两次释放药物,体内有两个吸收峰。研究表明,这种双相延时胶囊对非糜烂性或者糜烂性胃食管反流病有更高的治愈率。
原研武田公司的制剂专利cn101884629b公开了一种含有右兰索拉唑肠溶微丸的组合物,其中延时层材料由甲基丙烯酸共聚物s与甲基丙烯酸共聚物l组成,质量比为1:1或者3:1。
北京阜康仁生物制药科技有限公司cn103565770a公开了一种右兰索拉唑肠溶缓控释微丸片,其中肠衣材料包含甲基丙烯酸共聚物l和甲基丙烯酸共聚物s组成的混合物,质量比为2:1。
北京红太阳药业有限公司cn104523654a公开了一种右兰索拉唑缓释胶囊及其制备方法,其中缓释层包衣材料为甲基丙烯酸共聚物l10055和甲基丙烯酸共聚物s100的混合物,质量比为1:8~10。
山东省药学科学院的制剂专利cn104940169a公开了一种右兰索拉唑缓释胶囊,其中延时层材料只有甲基丙烯酸共聚物s100。
合肥华方医药科技有限公司cn104940168a公开了一种右旋兰索拉唑双相缓释胶囊制剂及其制备方法,其中延时层材料由甲基丙烯酸共聚物s与甲基丙烯酸共聚物l组成,质量比分别为0.4:1、1.3:1、2:1、2.5:1、3:1和6:1。
上述专利文献的延时层材料均采用甲基丙烯酸共聚物,存在以下问题:1、处方中甲基丙烯酸共聚物s100与甲基丙烯酸共聚物比例不合适,存在体内不吸收的问题;2、延时层单纯用甲基丙烯酸共聚物在包衣放大过程中,存在控酸效果差,需要更多的包衣增重以达到控释效果,因此急需开发一种控酸效果好、释药更加平稳、维持时间更长的右兰索拉唑制剂。
技术实现要素:
本发明的目的在于提供一种具有双相释药行为的右兰索拉唑药物组合物及其制备方法。
本发明所述具有双相释药行为的右兰索拉唑药物组合物包含两种微丸,一种为肠溶速释微丸,一种为肠溶延时微丸。
在本发明的一个实施方式中,所述具有双相释药行为的右兰索拉唑药物组合物,其中,所述肠溶速释微丸由内到外依次是含药微丸、隔离层与肠溶层组成;所述肠溶延时微丸由内到外依次是含药微丸、隔离层与延时层组成。
在本发明的一个实施方式中,所述具有双相释药行为的右兰索拉唑药物组合物,其中,所述肠溶速释微丸的含药微丸,包括空白丸芯、右兰索拉唑、填充剂、碱性稳定剂、崩解剂、粘合剂。
按重量百分比,各组分在含药微丸中所占比例分别为:
空白丸芯:10%~40%,优选24%~40%;
右兰索拉唑:10%~30%,优选12%~18%;
填充剂:10%~50%,优选24%~46%;
碱性稳定剂:5%~15%,优选8%~10%;
崩解剂:5%~10%,优选7%~9%;
粘合剂:0.1%~2%,优选0.6%~1.2%。
其中,空白丸芯为蔗糖型药用丸芯,粒径为500~710μm,优选600~710μm。
将右兰索拉唑进行微粉,控制粒径d90<30μm,优选d90<22μm。
填充剂选自蔗糖、乳糖、甘露醇、微晶纤维素、淀粉的一种或者几种组合,优选蔗糖。
碱性稳定剂选自碳酸镁(碱式碳酸镁)、氢氧化钠、碳酸钠、碳酸氢钠或磷酸氢二钠,优选碳酸镁。
崩解剂为制剂常用的崩解剂,例如低取代羟丙纤维素。
粘合剂选自羟丙甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、羟丙纤维素(hpc)或蔗糖水溶液,优选羟丙纤维素,更优选2%羟丙纤维素水溶液。
在本发明的一个实施方式中,所述具有双相释药行为的右兰索拉唑药物组合物,其中,所述肠溶速释微丸的隔离层,选自羟丙甲纤维素、羟丙基纤维素、聚乙烯吡咯烷酮中的一种或几种组合,或胃溶性配方包衣粉。
隔离层中可选择性的添加抗粘剂(例如:滑石粉)、遮光剂(例如:二氧化钛)。
在本发明的一个实施方式中,所述具有双相释药行为的右兰索拉唑药物组合物,其中,所述肠溶速释微丸的肠溶层,包括肠溶材料、增塑剂、抗粘剂,其中肠溶材料(固相)、增塑剂、抗粘剂的质量比为5~12:0.1~1.0:1,优选6.7~10.5:0.2~0.4:1。
其中肠溶材料选自羟丙甲纤维素邻苯二甲酸酯(hpmcp)、甲基丙烯酸共聚物l100-55、甲基丙烯酸共聚物l30d55或雅克宜,肠溶层包衣材料在不低于5.5的ph范围下溶解,优选甲基丙烯酸共聚物l30d55。
增塑剂选自柠檬酸三乙酯、枸橼酸三乙酯、peg6000、peg8000、吐温80的一种或者几种,优选枸橼酸三乙酯、peg8000或吐温80。
抗粘剂为滑石粉。
在本发明的一个实施方式中,所述具有双相释药行为的右兰索拉唑药物组合物,其中,所述肠溶延时微丸的含药微丸,包括空白丸芯、右兰索拉唑、填充剂、碱性稳定剂、崩解剂、粘合剂。
按重量百分比,各组分在含药微丸中所占比例分别为:
空白丸芯:10%~30%,优选20%~27%;
右兰索拉唑:20%~40%,优选25%~30%;
填充剂:20%~40%,优选25%~30%;
碱性稳定剂:5%~15%,优选8%~10%;
崩解剂:5%~15%,优选11%~13%;
粘合剂:0.1%~2%,优选0.3%~1%。
其中空白丸芯为蔗糖型药用丸芯,粒径为500~710μm,优选600~710μm。
将右兰索拉唑进行微分,控制粒径d90<30μm,优选粒径d90<25μm。
填充剂选自蔗糖、乳糖、甘露醇、微晶纤维素、淀粉的一种或者几种组合,优选蔗糖。
碱性稳定剂选自碳酸镁(碱式碳酸镁)、氢氧化钠、碳酸钠、碳酸氢钠或磷酸氢二钠,优选碳酸镁。
崩解剂为制剂常用的崩解剂,例如低取代羟丙纤维素。
粘合剂选自羟丙甲基纤维素(hpmc)、聚乙烯吡咯烷酮(pvp)、羟丙纤维素(hpc)或蔗糖水溶液等,优选羟丙纤维素(hpc),更优选2%羟丙纤维素水溶液。
在本发明的一个实施方式中,所述具有双相释药行为的右兰索拉唑药物组合物,其中,所述肠溶延时微丸的隔离层,选自羟丙甲纤维素、羟丙基纤维素、聚乙烯吡咯烷酮中的一种或几种组合,或胃溶性配方包衣粉。
隔离层中可选择性的添加抗粘剂(例如:滑石粉)、遮光剂(例如:二氧化钛)。
在本发明的一个实施方式中,所述具有双相释药行为的右兰索拉唑药物组合物,其中,所述肠溶延时微丸的延时层,包括延时材料、增塑剂、抗粘剂,其中延时材料、增塑剂、抗粘剂的质量比为2:0.2:1。所述延时层在ph≥6.0的范围内溶解从而释放药物。
其中延时材料由甲基丙烯酸共聚物s100与hpmcp按照一定比例组成,优选甲基丙烯酸共聚物s100:hpmcp的质量比为8~2:1,更优选5~3:1,最优选5~4:1。
增塑剂为柠檬酸三乙酯、枸橼酸三乙酯、peg6000、peg8000、吐温80的一种或者几种,优选枸橼酸三乙酯。
抗粘剂为滑石粉。
本发明所述具有双相释药行为的右兰索拉唑药物组合物可以制成口服制剂,优选胶囊,更优选延时胶囊。本发明肠溶速释微丸与肠溶延时微丸按照含右兰索拉唑质量比1:3填充于硬质胶囊壳内。
本发明还提供了一种制备右兰索拉唑药物组合物的方法。
本发明含药微丸由离心造粒法制备,隔离层、速释肠溶层及延时肠溶层由流化床包衣法制备。
在本发明的一个实施方式中,所述制备右兰索拉唑药物组合物的方法,包括如下步骤:
1)采用离心式造粒法制备含药微丸;
2)用流化床包衣技术制备肠溶速释微丸与肠溶延时微丸。
其中所述流化床包衣技术为底喷流化床包衣技术或切线喷包衣技术,优选hüttlin底喷流化床包衣技术。
在本发明的一个实施方式中,所述制备右兰索拉唑药物组合物的方法,具体包括如下步骤:
a)通过离心造粒法制备含药微丸,干燥,控制水分;
b)采用hüttlin底喷流化床包衣技术,在含药微丸上喷洒隔离包衣液构成隔离层,干燥,控制水分;
c)采用hüttlin底喷流化床包衣技术,在包过隔离层的含药微丸上喷洒肠溶速释包衣液,干燥,控制水分;
d)采用hüttlin底喷流化床包衣技术,在包过隔离层的含药微丸上喷洒肠溶延时包衣液,干燥,控制水分;
e)将步骤c与d中得到的小丸以一定比例灌装于硬脂胶囊壳内。
其中所述干燥温度为30℃~40℃,优选35℃。
所述水分为<10%,优选<5%。
在本发明的一个典型实施方式中,所述制备右兰索拉唑药物组合物的方法,具体包括如下步骤:
肠溶速释微丸制备工艺:
(1)通过离心造粒法制备含药微丸,干燥,控制<5%;
(2)采用hüttlin底喷流化床包衣技术,在含药微丸上喷洒隔离包衣液构成隔离层,35℃±5℃干燥,控制水分<5%;
(3)采用hüttlin底喷流化床包衣技术,在包过隔离层的含药微丸上喷洒肠溶速释包衣液,35℃±5℃干燥,控制水分<5%;
肠溶延时微丸制备工艺:
(1)通过离心造粒法制备含药微丸,干燥,控制<5%;
(2)采用hüttlin底喷流化床包衣技术,在含药微丸上喷洒隔离包衣液构成隔离层,35℃±5℃干燥,控制水分<5%;
(3)采用hüttlin底喷流化床包衣技术,在包过隔离层的含药微丸上喷洒肠溶延时包衣液,35℃±5℃干燥,控制水分<5%;
胶囊灌装:
将肠溶速释微丸与肠溶延时微丸以1:3比例,采用双工位胶囊灌装机灌装于硬脂胶囊壳内。
本发明提供的具有双相释药行为的右兰索拉唑药物组合物,通过肠溶速释微丸与肠溶延时微丸以特定比例混合,同时延时材料采用甲基丙烯酸共聚物s100与hpmcp的组合物,一方面使释药更加平稳,维持时间更长,可降低活性物质的给药剂量,减少不良反应,提高用药安全性;另一方面,合理控制药物在小肠的释放速度,增加生物利用度,提高治疗效果,节约成本。
本发明提供的右兰索拉唑药物组合物的制备方法,1)通过采用离心制粒法制备含药微丸,保证了制备过程中微丸的稳定性,同时该制备方法制备周期短,产量高,满足工业化生产要求;2)采用hüttlin流化床包衣技术制备肠溶速释微丸与肠溶延时微丸,干燥效率高、包衣效率高、工艺重现性好。
附图说明
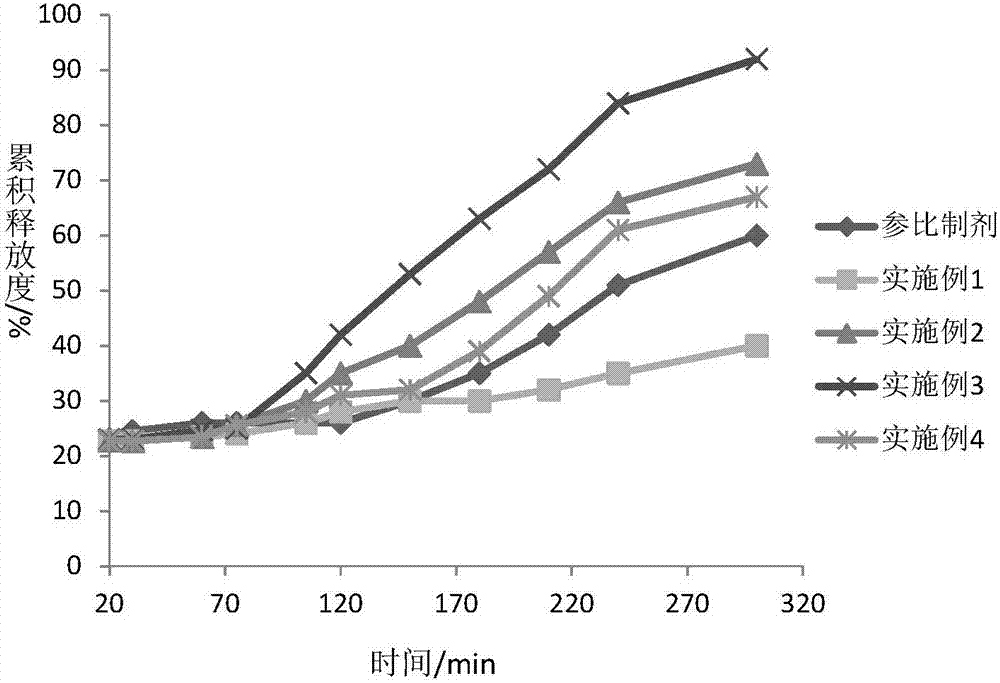
图1是本发明实施例1~4制备的延时胶囊与参比制剂在ph7.0的磷酸缓冲盐中的体外溶出度曲线对比;
图2是本发明实施例1~4制备的延时胶囊与参比制剂在ph6.5的磷酸缓冲盐中的体外溶出度曲线对比;
图3是实施例1、实施例3与原研
图4是实施例1、实施例3与原研
具体实施方式
为更好地说明本发明,下面将结合具体实施例对本发明做进一步阐述,但本发明的保护内容并非限定于实施例。
实施例1:一种右兰索拉唑延时胶囊组成及其制备方法
肠溶速释微丸:
延时微丸处方组成:
肠溶速释微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有羟丙甲纤维素的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷肠溶包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
肠溶延时微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有羟丙甲纤维素的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷肠溶延时包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
实施例2:一种右兰索拉唑延时胶囊组成及其制备方法
肠溶速释微丸:
延时微丸处方组成:
肠溶速释微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有羟丙甲纤维素的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,采用hüttlin底喷流化床包衣技术,预热至物料温度,开始喷肠溶包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
肠溶延时微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有hpmc的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷肠溶延时包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
实施例3:一种右兰索拉唑延时胶囊组成及其制备方法
肠溶速释微丸:
延时微丸处方组成:
肠溶速释微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有羟丙甲纤维素的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷肠溶包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
肠溶延时微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有羟丙甲纤维素的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷肠溶延时包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
实施例4:一种右兰索拉唑延时胶囊组成及其制备方法
肠溶速释微丸:
延时微丸处方组成:
肠溶速释微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有羟丙甲纤维素的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷肠溶包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
肠溶延时微丸制备工艺:(1)称取处方量右兰索拉唑、蔗糖、重质碳酸镁、羟丙纤维素混合均匀,置于饲料漏斗中,将药用蔗糖丸芯置于包衣造粒机内,以2%(w/w)羟丙纤维素水溶液为粘合剂,离心造粒法制得含药微丸。将含药微丸35℃±5℃干燥至水分<5%,筛取18目-24目间的微丸备用。
(2)将含药微丸置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷含有羟丙甲纤维素的水性包衣液,待包衣增重至8-15%,结束隔离层包衣,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
(3)将包过隔离层的含药微丸,置于流化床中,预热至物料温度,采用hüttlin底喷流化床包衣技术,开始喷肠溶延时包衣液,包衣结束后,筛取18目-24目间的微丸,35℃±5℃干燥至水分<5%,备用。
实施例5右兰索拉唑延时胶囊体外释放度考察
参考“dexilant”fda的溶出度数据库中的方法,拟定延时胶囊的体外释放方法为:
酸阶段:500ml0.1n的盐酸溶液,篮法,100rpm
取样方法:于2h取样5ml,样品过0.45μmpes水膜,续滤液在波长为306nm照紫外分光光度法测吸光度。
碱阶段:弃除各溶出杯内酸性溶液,更换为900ml磷酸缓冲液(内加0.15%的sds),篮法,100rpm
取样方法:于60min、120min、150min、180min、210min取样5ml,样品过0.45μmpes水膜,续滤液在波长为284nm照紫外分光光度法测吸光度。
体外释放曲线见图1、2。
实施例6右兰索拉唑延时胶囊体内研究
一、体内吸收考察:
选择18名健康男性青年,采用三周期、三制剂、三交叉试验试验,其中一组给予原研“dexilant”,另外两组分别给予本发明实施例1、实施例3中的自制缓释胶囊,用lc-ms-ms检测体内血药浓度。结果显示,本发明实施例1第二时相体内吸收峰低最低,体内维持时间最短,实施例3中制备的胶囊体内生物利用度比“dexilant”时间长,释药更加平稳,生物利用度高于“dexilant”,有更好的吸收效果,结果见图3。
在试验组分别给予“dexilant”、本发明实施例1和实施例3的自制延时胶囊的第五天,每隔15min检测受试者胃肠道ph值,并统计24h胃肠道ph值>4的百分比,结果显示给予实施例3胶囊的患者,其24h胃肠道ph>4的百分比高于参比制剂,见图4。而体内胃肠道ph值>4的维持时间延长,将会对糜烂性食管炎患者的治疗、尤其对于c与d级的糜烂性食管炎患者产生更好的效果。
二、机理解释:
延时微丸的体内吸收受到肠溶延时材料阻滞性质的影响。ph7.0的磷酸缓冲盐不能有效的模拟胶囊体内的吸收情况。
甲基丙烯酸共聚物s100为丙烯酸树脂b型高分子,其在ph>7.0的介质中缓慢溶解释放药物。实施例1延时材料仅选择甲基丙烯酸共聚物s100,实施例3选择甲基丙烯酸共聚物s100:hpmcp为4:1的组合物,两者制备的延时微丸可以通过调整合适的包衣增重,满足体外ph7.0的磷酸缓冲盐中释放相似(见图1)。
在更低ph如ph6.5的介质中,实施例1的药物释放速度远远慢于实施例4,同时慢于参比制剂“dexilant”体外释放。原因为甲基丙烯酸共聚物s100本身的溶解性受ph依赖,对ph值的变化很敏感,当介质ph值<7.0时,延时微丸的释放速度非常慢。
参比制剂选择甲基丙烯酸共聚物s100与甲基丙烯酸共聚物l100为3:1组合,理论上在ph>6.75的介质中才开始释放药物。因此在ph为6.5的缓冲介质中,释药速度仍然特别慢。而实施例3中,延时层组分加入了hpmcp,其在ph>5.5的介质中便可溶解,薄膜衣中加入hpmcp可起到一定的致孔作用,可满足在5.5<ph<7.0的介质中药物持续释放(见图2),因而体内释药曲线更为平稳,药物血药浓度维持时间延长,可达到更好的临床疗效。
- 还没有人留言评论。精彩留言会获得点赞!