一种肿瘤靶向细胞药物载体及其应用的制作方法
本发明属于生物医药领域,具体涉及一种肿瘤靶向细胞药物载体及其应用。
背景技术:
肿瘤是威胁人类健康的重大疾病,实现肿瘤的靶向治疗,降低治疗药物对正常组织和器官的伤害对攻克肿瘤疾病这一重大难题具有重大意义。化疗药物,放疗药物,光动力学治疗药物已经被广泛应用于肿瘤的治疗,能够在一定程度上抑制肿瘤的生长。但是,在肿瘤治疗的过程中使用的药物通常不具有选择性,为实现肿瘤的有效抑制,需要加大治疗药物的用量。而肿瘤治疗过程中的强毒副作用不仅极大的降低了肿瘤治疗的效果,同时也降低了肿瘤患者的生活质量。因此,实现肿瘤治疗药物的靶向运输,以达到对肿瘤的有效抑制,一直是生物医学和生物材料领域的研究热点。
肿瘤靶向药物运输一般可分为主动靶向和被动靶向。通过肿瘤细胞特异性表达的蛋白或者受体,利用抗体或者其他小分子靶向基团实现肿瘤细胞的运输称为主动靶向。利用肿瘤区域的“增强穿透和滞留”效应,纳米药物载体可以实现对肿瘤区域的富集成为被动靶向。但是,致密的肿瘤环境、肿瘤区域高渗透压以及人体的免疫系统将极大的限制传统靶向药物载体对肿瘤的靶向运输和穿透,从而使主动靶向和被动靶向都面临着极大的应用难题。
近年来,利用循环细胞作为药物载体,通过载体细胞对肿瘤环境的趋向性,避过免疫系统的清除,实现肿瘤的穿透,从而实现药物对肿瘤的靶向运输。传统的细胞药物载体是通过载体细胞对治疗药物的内吞和扩散实现药物的包载和释放的,极大的限制了这种细胞药物载体的应用意义。首先,这种细胞药物载体对细胞和药物的要求较高,所以通常只能用单核细胞或者巨噬细胞作为细胞载体,同时只能局限于光热治疗和某些化疗药物的运输;其次,药物对载体细胞的毒性导致载体细胞不能实现长时间的体内循环;再次,由于内吞药物处于复杂的细胞内环境,而载体细胞中诸如溶酶体和内涵体中的活性酶将导致药物在载体细胞中的降解,同时也难以实现药物从载体细胞亚细胞器中的逃逸;最后,药物的带电性质、亲疏水性也极大的影响细胞载体的载药率。因此,设计一种通用的细胞药物载体,可以同时实现对各种类和多种药物的肿瘤靶向运输,对实现肿瘤的协同治疗,精确治疗,降低毒副作用和实现个性化治疗具有重要意义。
技术实现要素:
为解决现有技术的不足,本发明的第一目的是提供一种肿瘤靶向细胞药物载体,所述的细胞药物载体由嵌细胞膜药物键合物和载体细胞组成,嵌细胞膜药物键合物嵌入载体细胞细胞膜,通过载体细胞对肿瘤的趋向性实现药物传递。
进一步地,本发明的另一个目的是提供一种嵌细胞膜药物键合物,由亲水性聚精氨酸、烷基链和键合药物组成,其化学结构式通式如式(Ⅰ)所示:
其中m=5-8;n=1-6;R为键合药物,是光动力学治疗光敏剂、化疗药物或者荧光分子的任意一种。
进一步地,本发明的另一个目的是提供一种嵌细胞膜药物键合物,其为棕榈酸-赖氨酸(喜树碱)-精氨酸-精氨酸-精氨酸-精氨酸、棕榈酸-赖氨酸(原卟啉)-精氨酸-精氨酸-精氨酸-精氨酸和棕榈酸-赖氨酸(荧光素)-精氨酸-精氨酸-精氨酸-精氨酸中的任意一种。
进一步地,本发明的另一个目的是提供一种肿瘤靶向细胞药物载体,所述的细胞药物载体由两种嵌细胞膜药物键合物和载体细胞组成,两种嵌细胞膜药物键合物同时嵌入载体细胞细胞膜,所述的两种嵌细胞膜药物键合物的键合药物为光动力学治疗光敏剂、化疗药物或者荧光分子中的任意两种。
进一步地,本发明的另一个目的是提供肿瘤靶向细胞药物载体的载体细胞为循环细胞。
进一步地,本发明的另一个目的是提供肿瘤靶向细胞药物载体的载体细胞,为红细胞,巨噬细胞,单核细胞,白细胞。
本发明提供的肿瘤靶向细胞药物载体在制备肿瘤成像的试剂中的应用。
本发明提供的肿瘤靶向细胞药物载体在制备化疗药物中的应用。
本发明提供的肿瘤靶向细胞药物载体在制备光动力学治疗光敏剂中的应用。
本发明提供的肿瘤靶向细胞药物载体在制备同时能够完成肿瘤成像和化疗的药物中的应用。
本发明提供的肿瘤靶向细胞药物载体在制备同时能够完成肿瘤光动力学治疗和化疗的药物中的应用。
本发明提供的肿瘤靶向细胞药物载体在制备同时能够完成肿瘤光动力学治疗和肿瘤成像的药物中的应用。
本发明的原理是:通过对细胞膜有嵌入作用的烷基链和对细胞膜有吸附作用的带正电多肽链段结合形成细胞膜嵌合物,将小分子药物通过化学键合到嵌合物侧基形成嵌细胞膜药物键合物。将嵌细胞膜药物键合物嵌入到循环细胞的细胞膜中,实现药物的运载。嵌细胞膜药物键合物嵌入到载体细胞细胞膜后将不会影响载体细胞对肿瘤的趋向性。同时,利用循环细胞对肿瘤的趋向性,实现药物对肿瘤的靶向运输。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物可以作为化疗药物在载体细胞上嵌入及运输,并在一定时间内具有一定的稳定性。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物可以作为光动力学治疗光敏剂在载体细胞上嵌入及运输,并在一定时间内具有一定的稳定性。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物可以作为荧光成像分子在载体细胞上嵌入及运输,并在一定时间内具有一定的稳定性。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物可以嵌入到巨噬细胞、干细胞及红细胞的细胞膜上。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物可以作为荧光成像分子和光动力学治疗光敏剂在载体细胞上同时嵌入及运输,从而实现肿瘤的成像和治疗。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物可以作为化疗药物和光动力学治疗光敏剂在载体细胞上的同时嵌入及运输,从而实现肿瘤的协同治疗。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,对载体细胞没有毒性,相对于内吞形式的运输更具生物相容性。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,光敏剂的载药量随嵌细胞膜光敏剂键合物与载体细胞的共培养时间增加而增大。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,光敏剂的载药量随载体细胞与共培养的嵌细胞膜光敏剂键合物的浓度增加而增大。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,载体细胞膜表面嵌入药物键合物后对,载体细胞对肿瘤细胞的趋向性不受影响。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,嵌膜细胞载体对肿瘤具有靶向性。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,嵌膜细胞载体治疗对肿瘤生长具有抑制效果。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,嵌膜细胞载体在肿瘤治疗过程中,小鼠体重不变,具有较小的毒副作用。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,嵌膜细胞载体治疗对肿瘤体积生长具有抑制效果。
本发明的一个实施例证实了肿瘤靶向细胞药物载体中嵌细胞膜药物键合物作为光动力学治疗光敏剂在载体细胞上的嵌入及运输,嵌膜细胞载体治疗对肿瘤重量生长具有抑制效果。
本发明的优点是:1)利用细胞膜药物嵌合物可以降低药物对于载体细胞的细胞毒性。2)该细胞膜嵌合物具有通用性,可以用作化疗药物,光敏剂以及荧光分子的运载。3)嵌膜细胞药物键合物对载体细胞的肿瘤趋向性没有影响。4)嵌膜细胞药物载体可以实现肿瘤的靶向运输。5)这种肿瘤靶向细胞药物载体中的细胞膜嵌合物制备简单,提纯容易,载体细胞的获得也较容易。6)这种嵌膜细胞载体可以实现对肿瘤同时进行诊断和治疗或协同治疗等。
附图说明
图1:嵌细胞膜喜树碱键合物对巨噬细胞的嵌膜及其对时间的稳定性图。
图2:嵌细胞膜原卟啉键合物对巨噬细胞的嵌膜及其对时间的稳定性图。
图3:嵌细胞膜键合物分别嵌入巨噬细胞,干细胞和红细胞以及嵌细胞膜荧光素键合物嵌入巨噬细胞对时间的稳定性图。
A嵌细胞膜喜树碱键合物、嵌细胞膜荧光素键合物,嵌细胞膜原卟啉键合物分别嵌入巨噬细胞图;
B嵌细胞膜喜树碱键合物、嵌细胞膜荧光素键合物,嵌细胞膜原卟啉键合物分别嵌入干细胞图;
C嵌细胞膜喜树碱键合物、嵌细胞膜荧光素键合物,嵌细胞膜原卟啉键合物分别嵌入红细胞图;
D嵌细胞膜荧光素键合物嵌入巨噬细胞对时间的稳定性图。
图4.嵌细胞膜荧光素键合物和嵌细胞膜原卟啉键合物对巨噬细胞的嵌膜图。
图5:嵌细胞膜喜树碱键合物和嵌细胞膜原卟啉键合物对巨噬细胞的嵌膜图。
图6:嵌细胞膜原卟啉键合物和原卟啉对巨噬细胞的细胞毒性图。
图7:嵌细胞膜原卟啉键合物对巨噬细胞细胞膜嵌膜能力随培养时间的变化图。
图8:嵌细胞膜原卟啉键合物对巨噬细胞细胞膜嵌膜能力随嵌细胞膜原卟啉键合物浓度梯度的变化图。
图9:嵌细胞膜原卟啉键合物巨噬细胞载体趋向性能力测试图。
图10:嵌细胞膜原卟啉键合物巨噬细胞载体对肿瘤的靶向能力图。
图11:各种条件下的肿瘤体积随时间的变化图。
图12:各种条件下的小鼠体重随时间变化图。
图13:各种条件下小鼠培养12天后剥离肿瘤的实物图。
图14:各种条件下小鼠培养12天后的肿瘤重量(克数)图。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。
【实施例1】嵌细胞膜键合物的合成
嵌细胞膜键合物(棕榈酸-赖氨酸(喜树碱)-精氨酸-精氨酸-精氨酸-精氨酸),(棕榈酸-赖氨酸(原卟啉)-精氨酸-精氨酸-精氨酸-精氨酸)和(棕榈酸-赖氨酸(荧光素)-精氨酸-精氨酸-精氨酸-精氨酸)的合成:
(1)往装有10mL重蒸过的N,N-二甲基甲酰胺的反应器中加入0.5g氯树脂(1.01mmol/g),待氯树脂在N,N-二甲基甲酰胺中溶胀2小时后抽除N,N-二甲基甲酰胺。
(2)将FMOC保护氨基和Pbf保护胍基的精氨酸(树脂活性位点的4倍当量)、N,N-二异丙基乙胺(氨基酸的8倍当量)溶于10mL N,N-二甲基甲酰胺中,再加到反应器中室温反应2小时将半胱氨酸键合到树脂上,抽除溶剂,N,N-二甲基甲酰胺洗涤2~4次。
(3)往反应器中加入20%(V/V)哌啶/N,N-二甲基甲酰胺(即哌啶与N,N-二甲基甲酰胺体积比为2:8)溶液10mL,室温反应15分钟后,抽除溶剂;重复加入哌啶/N,N-二甲基甲酰胺溶液进行反应以切落FMOC保护基,反应结束后,抽除溶剂,用N,N-二甲基甲酰胺洗涤树脂2~4次。
(4)将精基酸(树脂活性位点的4倍当量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(树脂活性位点的4.8倍当量)、1-羟基苯并三氮唑(树脂活性位点的4.8倍当量)、N,N-二异丙基乙胺(树脂活性位点的8倍当量)溶于N,N-二甲基甲酰胺中,加入反应器中室温反应2小时将赖氨酸键合上去,抽除溶剂,用N,N-二甲基甲酰胺洗涤树脂2~4次。
(5)将剩下的精氨酸,精氨酸按照步骤(3)(4)逐一依次键合上去。
(6)按照步骤(3)脱除FMOC保护基,将FMOC保护氨基和Dde保护侧基氨基的氨基酸(树脂活性位点的4倍当量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(树脂活性位点的4.8倍当量)、1-羟基苯并三氮唑(树脂活性位点的4.8倍当量)、N,N-二异丙基乙胺(树脂活性位点的8倍当量)溶于N,N-二甲基甲酰胺中,加入反应器中室温反应2小时将赖氨酸键合上去,抽除溶剂,用N,N-二甲基甲酰胺洗涤树脂2~4次。
(7)按照步骤(3)脱除FMOC保护基,将棕榈酸(树脂活性位点的4倍当量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(树脂活性位点的4.8倍当量)、1-羟基苯并三氮唑(树脂活性位点的4.8倍当量)、N,N-二异丙基乙胺(树脂活性位点的8倍当量)溶于N,N-二甲基甲酰胺中,加入反应器中室温反应2小时将赖氨酸键合上去,抽除溶剂,用N,N-二甲基甲酰胺洗涤树脂2~4次。
(8)脱除Dde保护基,往反应器中加入2%(V/V)水合肼/N,N-二甲基甲酰胺(即哌啶与N,N-二甲基甲酰胺体积比为2:98)溶液10mL,室温反应7分钟后,抽除溶剂;重复加入水合肼/N,N-二甲基甲酰胺以切落Dde保护基,反应结束后,抽除溶剂,用N,N-二甲基甲酰胺洗涤树脂2~4次。
(9)将原卟啉或者羧基化喜树碱或者5(6)-羧基荧光素(树脂活性位点的4倍当量)、苯并三氮唑-N,N,N',N'-四甲基脲六氟磷酸盐(树脂活性位点的4.8倍当量)、1-羟基苯并三氮唑(树脂活性位点的4.8倍当量)、N,N-二异丙基乙胺(树脂活性位点的8倍当量)溶于N,N-二甲基甲酰胺中,分别加入反应器中室温反应4小时光敏剂或者化疗药物或者荧光分子键合上去,抽除溶剂,用N,N-二甲基甲酰胺洗涤树脂2~4次。
(10)N,N-二甲基甲酰胺洗涤树脂2~4次,甲醇洗涤2~4次,二氯甲烷洗涤2~4次。
(11)往反应器中加入由如下体积百分含量的组分组成的溶液于室温下作用2h以切落氨树脂上的多肽键合物及侧基:95%三氟乙酸、5%水。
(12)收集切落液,旋蒸,真空干燥得到产物,于-20℃避光保存。
以下实施例2-12中均以实施例1中合成的嵌细胞膜键合物为例。
【实施例2】嵌细胞膜喜树碱键合物对巨噬细胞的嵌膜及其对时间的稳定性
将巨噬细胞以1×105个细胞/孔的密度接种,37℃条件下在1mL培养基中培养。24小时后,将嵌细胞膜喜树碱键合物溶解在培养基中,向巨噬细胞中加入1mL含有嵌细胞膜喜树碱键合物(30微摩尔/升)的培养基。培养2小时后,将含有嵌细胞膜喜树碱键合物的培养基吸出,有PBS缓冲溶液将细胞洗涤三次后加入新的培养基,用激光共聚焦显微镜观察细胞内的喜树碱的荧光强度。
结果如图1所示,嵌细胞膜喜树碱键合物能够有效的嵌入巨噬细胞细胞膜中,同时,培养时间增加,细胞膜表面的荧光强度只有较弱减少,证明了嵌细胞膜喜树碱键合物在细胞膜上的稳定性。
【实施例3】嵌细胞膜原卟啉键合物对巨噬细胞的嵌膜及其对时间的稳定性
将巨噬细胞以1×105个细胞/孔的密度接种,37℃条件下在1mL培养基中培养。24小时后,将嵌细胞膜原卟啉键合物溶解在培养基中,向巨噬细胞中加入1mL含有嵌细胞膜原卟啉键合物(30微摩尔/升)的培养基。培养2小时后,将含有嵌细胞膜原卟啉键合物的培养基吸出,有PBS缓冲溶液将细胞洗涤三次后加入新的培养基,用激光共聚焦显微镜观察细胞内的原卟啉的荧光强度。
结果如图2所示,嵌细胞膜原卟啉键合物能够有效的嵌入巨噬细胞细胞膜中,同时,培养时间增加,细胞膜表面的荧光强度只有较弱减少,证明了嵌细胞膜原卟啉键合物在细胞膜上的稳定性。
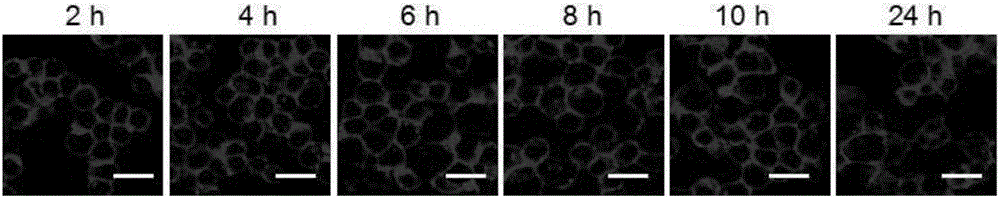
【实施例4】嵌细胞膜键合物分别嵌入巨噬细胞,干细胞和红细胞以及嵌细胞膜荧光素键合物嵌入巨噬细胞对时间的稳定性
将红细胞,巨噬细胞,干细胞分别以1×105个细胞/孔的密度接种,37℃条件下在1mL培养基中培养。24小时后,将嵌细胞膜荧光素键合物,嵌细胞膜原卟啉键合物,嵌细胞膜喜树碱键合物分别溶解在培养基中,分别向红细胞,巨噬细胞,干细胞中加入1mL含有嵌细胞膜荧光素键合物(30微摩尔/升),嵌细胞膜原卟啉键合物(30微摩尔/升),嵌细胞膜喜树碱键合物(30微摩尔/升)的培养基。培养2小时后,将含有嵌细胞膜键合物的培养基吸出,有PBS缓冲溶液将细胞洗涤三次后加入新的培养基,用激光共聚焦显微镜观察细胞内的荧光素的荧光强度。
结果如图3所示,嵌细胞膜键合物能够有效的嵌入红细胞,干细胞和巨噬细胞细胞膜中,证明了嵌细胞膜键合物的通用性。同时,培养时间增加,细胞膜表面的荧光强度只有较弱减少,证明了嵌细胞膜荧光素键合物在细胞膜上的稳定性。
【实施例5】嵌细胞膜荧光素键合物和嵌细胞膜原卟啉键合物同时对巨噬细胞的嵌膜及其对时间的稳定性
将巨噬细胞以1×105个细胞/孔的密度接种,37℃条件下在1mL培养基中培养。24小时后,将嵌细胞膜荧光素键合物和嵌细胞膜原卟啉键合物溶解在培养基中,向巨噬细胞中加入1mL含有嵌细胞膜荧光素键合物和嵌细胞膜原卟啉键合物(分别为30微摩尔/升)的培养基。培养2小时后,将含有嵌细胞膜荧光素键合物和嵌细胞膜原卟啉键合物的培养基吸出,有PBS缓冲溶液将细胞洗涤三次后加入新的培养基,用激光共聚焦显微镜观察细胞内的荧光素和原卟啉的荧光强度。
结果如图4所示,嵌细胞膜荧光素键合物和嵌细胞膜原卟啉键合物能够同时有效的嵌入巨噬细胞细胞膜中。证明了本发明肿瘤靶向细胞药物载体可以同时对肿瘤进行成像和治疗。
【实施例6】嵌细胞膜喜树碱键合物和嵌细胞膜原卟啉键合物对巨噬细胞的嵌膜及其对时间的稳定性
将巨噬细胞以1×105个细胞/孔的密度接种,37℃条件下在1mL培养基中培养。24小时后,将嵌细胞膜喜树碱键合物和嵌细胞膜原卟啉键合物溶解在培养基中,向巨噬细胞中加入1mL含有嵌细胞膜喜树碱键合物和嵌细胞膜原卟啉键合物(分别为30微摩尔/升)的培养基。培养2小时后,将含有嵌细胞膜喜树碱键合物和嵌细胞膜原卟啉键合物的培养基吸出,有PBS缓冲溶液将细胞洗涤三次后加入新的培养基,用激光共聚焦显微镜观察细胞内的喜树碱和原卟啉的荧光强度。
结果如图5所示,嵌细胞膜荧光素键合物和嵌细胞膜原卟啉键合物能够同时有效的嵌入巨噬细胞细胞膜中。证明了本发明肿瘤靶向细胞药物载体可以完成对肿瘤进行化疗和光动力学治疗的协同治疗。
【实施例7】嵌细胞膜原卟啉键合物和原卟啉对巨噬细胞的细胞毒性
巨噬细胞以6000个细胞/孔的密度接种在96孔板中,用100μL培养基培养24小时。然后,将用培养基配制的嵌细胞膜原卟啉键合物溶液和原卟啉溶液100μL分别加入到各孔中。所有细胞在避光条件下37摄氏度培养48小时。随后在每个孔中加入20μL 5mg/mL的MTT(MTT溶解在PBS缓冲液中)。共培养4h后,吸出培养基,加入150μL二甲亚砜(DMSO)。酶标仪测量每个孔中570纳米处的吸光值,计算细胞存活率,进而得到嵌细胞膜原卟啉键合物溶液和原卟啉对巨噬细胞的毒性。
结果如图6所示,嵌细胞膜原卟啉键合物溶液具有较小的毒性,较原卟啉有更好的生物相容性。
【实施例8】嵌细胞膜原卟啉键合物对巨噬细胞细胞膜嵌膜能力与培养时间的关系
将巨噬细胞以1×105个细胞/孔的密度接种,37℃条件下在1mL培养基中培养。24小时后,将嵌细胞膜原卟啉键合物溶解在培养基中,向巨噬细胞中加入1mL含有嵌细胞膜原卟啉键合物(30微摩尔/升)的培养基。分别培养0小时,0.5小时,1小时,2小时和6小时后,将含有嵌细胞膜原卟啉键合物的培养基吸出,有PBS缓冲溶液将细胞洗涤三次后加入新的培养基,用激光共聚焦显微镜观察细胞内的原卟啉的荧光强度。
结果如图7所示,嵌细胞膜原卟啉键合物在巨噬细胞膜上的原卟啉的荧光强度随培养时间增长而增加。证明了嵌细胞膜原卟啉键合物在巨噬细胞中的载药率可以通过嵌细胞膜原卟啉键合物与巨噬细胞的共培养时间来调控。
【实施例9】嵌细胞膜原卟啉键合物对巨噬细胞细胞膜嵌膜能力与嵌细胞膜原卟啉键合物浓度梯度的关系
将巨噬细胞以1×105个细胞/孔的密度接种,37℃条件下在1mL培养基中培养。24小时后,将嵌细胞膜原卟啉键合物溶解在培养基中,向巨噬细胞中加入1mL分别含有嵌细胞膜原卟啉键合物浓度为0微摩尔/升,5微摩尔/升,10微摩尔/升,15微摩尔/升和30微摩尔/升的培养基。培养2小时后,将含有嵌细胞膜原卟啉键合物的培养基吸出,有PBS缓冲溶液将细胞洗涤三次后加入新的培养基,用激光共聚焦显微镜观察细胞内的原卟啉的荧光强度。
结果如图8所示,嵌细胞膜原卟啉键合物在巨噬细胞膜上的原卟啉的荧光强度随嵌细胞膜原卟啉键合物浓度增大而增大。证明了嵌细胞膜原卟啉键合物在巨噬细胞中的载药率可以通过巨噬细胞与嵌细胞膜原卟啉键合物的浓度来调控。
【实施例10】嵌细胞膜原卟啉键合物巨噬细胞载体趋向性能力测试
将巨噬细胞,巨噬细胞,嵌细胞膜原卟啉嵌合的巨噬细胞,巨噬细胞,嵌细胞膜原卟啉嵌合的巨噬细胞分别以3000个细胞/孔的密度接种在穿透膜上层。在各接种细胞下层分别加入1mL新的MEM培养基,4T1细胞培养过的MEM培养基,新的DMEM培养基和COS7培养过的DMEM培养基,37℃条件下培养。分别在培养12小时,24小时,36小时和48小时后,用倒置显微镜观测穿透细胞的个数。
结果如图9所示,嵌细胞膜原卟啉键合物嵌膜巨噬细胞在4T1细胞培养过的MEM培养基条件下培养穿过穿透膜的细胞个数与巨噬细胞在4T1细胞培养过的MEM培养基条件下培养穿过穿透膜的细胞个数相当。证明了嵌细胞膜原卟啉键合物对巨噬细胞的趋向性影响较小。
【实施例11】小白鼠体内嵌细胞膜原卟啉键合物巨噬细胞载体对肿瘤的靶向能力检测
4~5周小白鼠(BALB/c)在小腿内侧皮下注射100μL(PBS)含细胞个数为1×106的4T1细胞悬液造瘤,当肿瘤体积长到约200mm2时。将嵌细胞膜原卟啉键合物嵌合巨噬细胞尾静脉注射到小白鼠体内。用小动物活体成像观测小鼠体内荧光分布和变化。
结果如图10所示,小鼠肿瘤区域材料荧光随时间增加而增长,从而证明嵌细胞膜原卟啉键合物嵌合巨噬细胞具有肿瘤靶向运输的能力。
【实施例12】嵌细胞膜原卟啉嵌合巨噬细胞载体对肿瘤的治疗效果
4~5周小白鼠(BALB/c)在小腿内侧皮下注射100μL(PBS)含细胞个数为1×106的4T1细胞悬液造瘤,当肿瘤体积长到约200mm2时。将小鼠随机分为6组。PBS和巨噬细胞、嵌细胞膜原卟啉嵌合巨噬细胞、嵌细胞膜原卟啉键合物、嵌细胞膜原卟啉嵌合巨噬细胞和原卟啉尾静脉注射。注射24小时和48小时后,用660nm He-Ne激光照射肿瘤,每只每次5min。每天测量肿瘤体积,肿瘤体积按照V=W2×L/2公式计算,其中W为较短的肿瘤宽度,L为较长的肿瘤宽度,通过相对肿瘤体积(V/V0,V为实时肿瘤体积,V0为治疗前肿瘤体积)来反映肿瘤体积的变化情况。
结果见图11,经嵌细胞膜原卟啉嵌合巨噬细胞治疗后的小鼠肿瘤生长受到抑制,并且相对于经嵌细胞膜原卟啉和原卟啉有更优越的肿瘤抑制作用,从而证明嵌细胞膜原卟啉嵌合巨噬细胞载体对肿瘤的治疗效果。与此同时,小鼠重量随治疗效果没有大幅变化,说明经嵌细胞膜原卟啉嵌合巨噬细胞治疗对小鼠没有强毒副作用(图12)。而肿瘤图片中肿瘤体积(图13)和重量(图14)变化进一步说明了嵌细胞膜原卟啉嵌合巨噬细胞优越的肿瘤抑制作用。
- 还没有人留言评论。精彩留言会获得点赞!
- 具有肿瘤细胞靶向性的超细磁性核壳纳米材料及其制备和应用的制作方法与工艺
- 具有肿瘤细胞靶向性的超细磁性核壳纳米材料及其制备和应用的制作方法与工艺
- 一种利用细胞通透性差异治疗皮肤癌的靶向药物的制作方法与工艺
- 一种基于细胞源性微囊泡的肿瘤靶向递送载体及制备方法和应用与流程
- 靶向CLDN6的免疫效应细胞及其制备方法和应用与流程
- 一种检测靶向CD33的CART细胞中CAR表达的荧光定量试剂盒的制作方法与工艺
- 靶向HBV核心启动子的抗HBV药物筛选细胞模型及其构建和应用的制作方法与工艺
- 一种响应过氧化氢杀灭肿瘤细胞的光敏感靶向抗肿瘤前药及其制备方法与应用与流程
- 靶向循环肿瘤细胞的长循环纳米粒及其制备和应用的制作方法与工艺
- 使用CRISPR/Cas9技术靶向敲除水稻矮杆基因SD1的方法与流程