盐酸普萘洛尔凝胶及其制备方法与流程
本发明涉及医药技术领域,具体涉及一种盐酸普萘洛尔凝胶及其制备方法。
背景技术:
婴幼儿血管瘤是婴幼儿常发的良性肿瘤,在新生儿中,其发病率为1.1%~2.6%,2/3发生于头颈部,其中1岁以下的婴幼儿患病率高达10%~12%,婴幼儿血管瘤发病率高,一般情况下症状轻、瘤体小的可能会自行消退,但发生在特殊部位的,如面部、口腔、眼、呼吸道等可能会导致毁容、功能损伤,有些情况下还会伴有溃疡、出血等并发症,甚至会危及生命,因此必须对其进行合理治疗。
传统上激素类药物、手术等在治疗婴幼儿血管瘤时产生较大的副作用,自1998年发现盐酸普萘洛尔口服制剂对婴幼儿血管瘤的治疗效果显著以来,逐渐取代激素等治疗手段,成为治疗婴幼儿血管瘤的一线药物。盐酸普萘洛尔(Propranolol Hydrochloride),化学结构式如下:
盐酸普萘洛尔为非选择性β-受体阻断剂,其治疗婴幼儿血管瘤的机制为:短期内促进血管收缩,中期通过抑制多条血管生成信号通路,长期通过诱导内皮细胞凋亡,最终导致瘤体消退。但近年来有研究表明其不良反应时常发生,如浅表皮肤出现褶皱,服药期间发生腹泻,溢奶,易激,四肢发凉等。
因此改变盐酸普萘洛尔的给药形式是治疗婴幼儿血管瘤的一个新突破。经皮给药系统可避免肝脏的首过效应和药物在胃肠道的灭活,药物的吸收不受胃肠道因素的影响。维持恒定有效血药浓度或生理效应,维持作用时间长,避免口服给药引起血药浓度的峰谷现象,降低毒副反应,使用方便,患者可以自主用药,也可以随时撤销用药等。
凝胶剂具有外观光滑,透明细腻,稠度、黏度适宜,易于涂布等优点,因此将盐酸普萘洛尔制成外用的凝胶剂对婴幼儿血管瘤的治疗具有良好的研发 价值。
中国发明专利CN200410008121.7,公开了一种经皮给药系统,.一种经皮给药系统,包括:一药物贮库、一吸附层和一隔离层,所述的药物贮库由药物、溶剂、透皮促进剂和凝胶化剂组成;所述的药物为盐酸普萘洛尔、盐酸维拉帕米或盐酸氯丙嗪;所述的透皮促进剂为丙二醇、油酸、月桂氮酮、聚乙二醇四种物质的混合物;所述的凝胶化剂为羟丙基甲基纤维素、聚乙烯醇的混合物,以注射用水作溶剂(授权公布号:CN100386073C)。
中国发明专利CN201210420731.2,公开了一种治疗婴幼儿浅表血管瘤的盐酸普萘洛尔凝胶,由盐酸普萘洛尔、凝胶基质、经皮促渗剂、防腐剂、保湿剂、表面活性剂等按一定比例制成,所述的经皮促渗剂选自橙花叔醇、松节油、法尼醇、四氢香叶醇、茴香脑和甘草酸二钾;所述的凝胶基质选自羟丙基甲基纤维素、羧甲基纤维素钠、卡波姆、透明质酸、聚乙烯醇、玻璃酸钠、海藻酸钠和甲基纤维素;所述的保湿剂为丙二醇或甘油;所述的表面活性剂为聚山梨酯-60或聚山梨酯-80(授权公布号:CN102871956B)。
中国发明专利CN201310647695.8,公开了一种盐酸普萘洛尔脂质体凝胶及其制备方法,所述的盐酸普萘洛尔脂质体凝胶,是由以下重量份的原料药和辅料制成的:盐酸普萘洛尔0.012%~0.075%,磷脂酰乙醇胺0.037%~0.150%,胆固醇0.012%~0.075%,三乙醇胺2.5%~5%,卡波姆1%~2%,余量为水(授权公布号:CN 103622903B)。
中国发明专利申请CN201510158251.7,公开了一种盐酸普萘洛尔外用凝胶制剂及其制备方法和用途,所述的盐酸普萘洛尔外用凝胶制剂,包含:至少3重量%的盐酸普萘洛尔,以及10-35重量%的凝胶基质、3-13重量%的透皮促渗剂、2-12重量%的保湿剂、0.02-0.2重量%的抑菌剂;以及余量的水。所述凝胶基质选自泊洛沙姆237、泊洛沙姆338、泊洛沙姆407;所述透皮促渗剂选自月桂氮卓酮、肉豆蔻酸异丙脂、薄荷脑;所述保湿剂选自丙二醇、甘油和山梨醇(申请公布号:CN 105434336A)。
中国发明专利申请CN201510159074.4,公开了一种盐酸普萘洛尔亚微乳凝胶及其制备方法和用途,所述的盐酸普萘洛尔亚微乳凝胶,包含盐酸普萘洛尔、油、表面活性剂、助表面活性剂、渗透促进剂、凝胶基质、pH值调节剂,以及余量的水。所述的表面活性剂选自聚氧乙烯失水山梨醇脂肪酸酯、聚氧乙烯脂肪酸酯、聚氧乙烯氢化蓖麻油、卵磷脂、聚氧乙烯脂肪醇醚、聚氧乙烯-聚氧丙烯共聚物和嵌段共聚物和二-(2-乙基己基)琥珀酸酯磺酸钠;所述的助 表面活性剂选自乙醇、丙二醇、异丙醇、丙三醇、正丁醇和三醋酸甘油酯;所述的凝胶基质选自卡波姆、纤维素衍生物、黄原胶、阿拉伯胶、角叉菜胶和海藻酸钠;所述的渗透促进剂选自氮酮、薄荷脑、冰片、樟脑和柠檬油精(申请公布号:CN 105434337A)。
但是,由于患者多为1岁以下的婴幼儿,所以对凝胶制剂的透皮吸收性能和皮肤无刺激性要求更高。盐酸普萘洛尔为水溶性药物,其透皮吸收性能极差,现有技术中,对透皮吸收性能的改善不明显;而且凝胶制剂中的常用经皮促渗剂薄荷脑、樟脑、冰片等挥发性和刺激性较强;松节油、茴香脑等具有一定的皮肤毒性,均易造成婴幼儿皮肤出现红肿、热痛等刺激性和过敏性反应,不适合婴幼儿使用。
技术实现要素:
本发明的目的在于提供一种透皮吸收性能好且对婴幼儿皮肤无刺激性、无过敏反应的盐酸普萘洛尔凝胶制剂,本发明的另一目的是提供上述的盐酸普萘洛尔凝胶制剂的制备方法,本发明的第三目的是提供上述的盐酸普萘洛尔凝胶制剂在制备治疗婴幼儿血管瘤药物中的应用。
经皮给药制剂最关键的问题是药物的透皮吸收,尤其是水溶性药物,透皮性能极差,因此促透技术成为制剂过程的关键技术之一。盐酸普萘洛尔为水溶性药物,本发明在水凝胶制剂的预实验中也发现处方中添加氮酮和丙二醇这两种促透剂的含量对体外透皮累积渗透量的影响最大。
继而,我们采用星点设计-效应面法对盐酸普萘洛尔凝胶的处方进行筛选,采用Design-Expert软件对数据进行处理,由效应面图和二项式回归模型得到的最优处方和累计渗透量与实测值的偏差较小,表明所建模型预测性良好。
本发明的第一方面,是提供一种盐酸普萘洛尔凝胶。
一种盐酸普萘洛尔凝胶,其主药和辅料的重量百分比为:
盐酸普萘洛尔1%~4.5%,
联合促透剂8%~12%,
防腐剂0.05%~0.15%,
保湿剂4%~11%,
凝胶基质10.5%~29%,
余量为水。
所述的联合促透剂为氮酮和丙二醇。
进一步地,所述盐酸普萘洛尔凝胶剂,优选地,
盐酸普萘洛尔2%~4%,
促透剂1--氮酮 3%~5%,
促透剂2--丙二醇 4%~6%,
防腐剂0.05%~0.10%,
凝胶基质15%~25%,
保湿剂5%~10%。
余量为水。
所述的凝胶基质为泊洛沙姆(P407、P188)、海藻酸钠,优选的,是泊洛沙姆(P407)。
所述的防腐剂为苯甲酸、山梨酸、羟苯乙酯,优选的,是羟苯乙酯。
所述的保湿剂为甘油、丙二醇,优选的,是甘油。
所述的水为纯化水、注射用水。
进一步地,所述盐酸普萘洛尔凝胶剂,优选地,
盐酸普萘洛尔2.8%~3.2%,最优为3%,
氮酮3.8%~4.2%,最优为4%,
丙二醇4.5%~5.8%,最优为5%,
羟苯乙酯0.08%~0.11%,最优为0.1%,
泊洛沙姆(P407)19%~21%,最优为20%,
甘油4%~6%,最优为5%,
余量为水。
本发明的第二方面,是提供上述的盐酸普萘洛尔凝胶的制备方法。
所述盐酸普萘洛尔的制备方法如下:
A、先将盐酸普萘洛尔和防腐剂(优选羟苯乙酯)用适量纯化水溶解、分散,备用;
B、向上述溶液中缓缓加入凝胶基质(优选泊洛沙姆P407),均匀搅拌使其全部没于水中,于4℃下充分溶胀;
C、24h后取出,在搅拌条件下加入保湿剂(优选甘油)、丙二醇、氮酮,搅匀后封存;于阴凉处过夜,分装,即得无色透明的凝胶制剂。
所述的缓缓加入,为凝胶基质分次均匀加入溶液中。
所述的搅拌速度为100~500rpm/min,搅拌时间为5~10min。
本发明的第三方面,是提供上述的盐酸普萘洛尔凝胶制剂在制备治疗婴幼 儿血管瘤药物中的应用。
本发明制备的盐酸普萘洛尔凝胶剂具有均匀细腻,黏性适宜,易于涂展,对皮肤无刺激等特点。本发明的水凝胶制剂中,氮酮的促透机制可能与扰乱角质层的有序结构、影响细胞膜的流动性有关,丙二醇可能是通过提高药物在角质层中的溶解性来促进药物的经皮吸收,两者起到联合、协同促透的作用。
本发明制备的盐酸普萘洛尔凝胶剂在治疗浅表层婴幼儿血管瘤时替代盐酸普萘洛尔凝胶剂口服制剂,不仅给药方便,避免肝脏首过效应,而且凝胶剂在皮肤形成药物贮库,起到缓释作用,同时患儿的顺应性更好。
附图说明
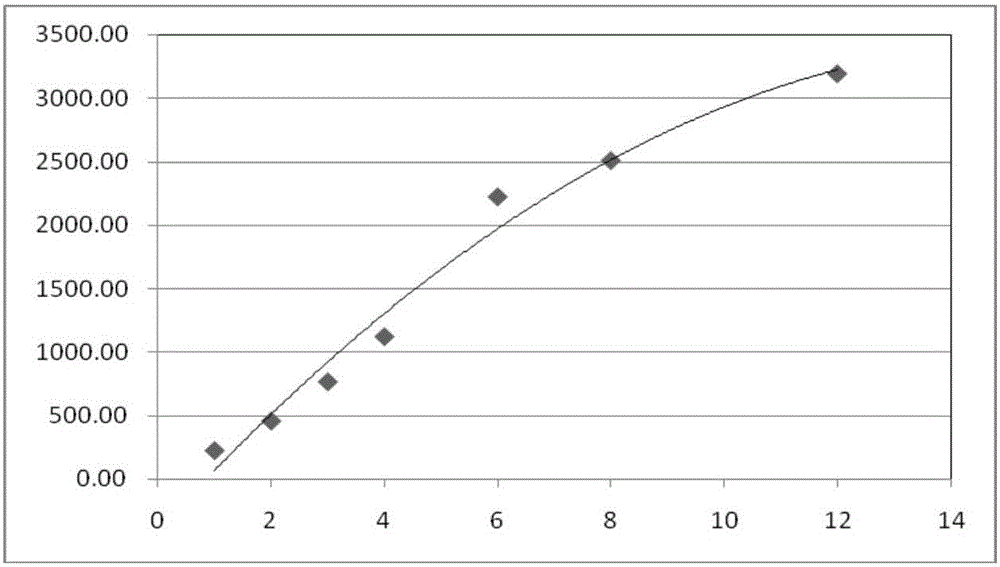
图1本发明的体外累积透皮渗透量—时间曲线图;
图2为标准品HPLC色谱图;
图3为供试品HPLC色谱图;
图4为氮酮百分含量和丙二醇百分含量对累积透皮量影响的三维效应面图;
图5为氮酮百分含量和丙二醇百分含量对累积透皮量影响的二维等高图。
具体实施方式
下面结合实施例对本发明提供的具体实施方式作详细说明。
材料:
盐酸普萘洛尔(批号:20150301,国药集团化学试剂有限公司);
1,2-丙二醇(批号:Lot.No.20140503,永华化学科技有限公司);
氮酮(批号:20131115,国药集团化学试剂有限公司);
泊洛沙姆P407(批号:20140713,上海昌力医药辅料技术有限公司);
甘油(批号,20130907,国药集团化学试剂有限公司);
羟苯乙酯(批号:20121104,上海凌峰化学试剂有限公司);
KM小鼠,雄性,体重20±2g,由第二军医大学动物实验中心提供。实验动物许可证号:SCXK(沪)2015-10-20。
实施例1
称取3g盐酸普萘洛尔,0.1g羟苯乙酯,加适量的纯化水溶解、分散,
向该溶液中缓慢地加入20g泊洛沙姆(P407),均匀搅拌该溶液,使泊洛沙姆全部没入水面以下,放置于4℃的冰箱内,使其充分溶胀。
24h后,取出溶胀好的溶液,边搅拌边加入5g丙二醇,4g氮酮,5g甘油, 搅拌均匀,即得无色透明的盐酸普萘洛尔凝胶制剂。
实施例2
称取3g盐酸普萘洛尔,0.1g山梨酸,加适量的纯化水溶解、分散,
向该溶液中缓慢地加入20g海藻酸钠,均匀搅拌该溶液,使海藻酸钠全部没入水面以下,放置于4℃的冰箱内,使其充分溶胀。
24h后,取出溶胀好的溶液,边搅拌边加入5g丙二醇,5g氮酮,5g甘油,搅拌均匀,即得无色透明的盐酸普萘洛尔凝胶制剂。
实施例3
称取3g盐酸普萘洛尔,0.1g羟苯乙酯加适量的纯化水溶解、分散,
向该溶液中缓慢地加入20g泊洛沙姆P188,均匀搅拌该溶液,使泊洛沙姆全部没入水面以下,放置于4℃的冰箱内,使其充分溶胀。
24h后,取出溶胀好的溶液,边搅拌边加入5g甘油,6g丙二醇,4g氮酮,搅拌均匀,即得无色透明的盐酸普萘洛尔凝胶制剂。
实施例4:体外透皮实验
离体皮肤的制备:将KM小鼠腹部脱毛,静养1d,保证腹部皮肤无损伤,处死后立即取其完整腹部脱毛皮肤,刮去皮肤上的多余脂肪、组织后,用生理盐水清洗干净,于4℃下浸泡于新鲜的生理盐水中。
采用Franz扩散池法进行:以32℃恒温水浴、匀速搅拌的生理盐水为接收液。将处理好的离体皮肤的角质层朝上固定于Franz扩散池上,均匀地涂上0.1g制备的盐酸普萘洛尔凝胶(实施例1制备的),用铝箔封好。分别于1,2,3,4,6,8,12h时取1ml接收液进行含量检测,并于接收池中加入1ml同温度的新鲜生理盐水。
体外透皮累积渗透量的计算:
由Q=[CnV+Σ(C×1)]/S计算单位面积药物的累积渗透量。其中,Q为单位面积的药物累积透皮渗透量,Cn为该取样点时接收液中的药物浓度,V为接收液体积,C为第1个取样点至上个取样点时接收液中的累计药物浓度,S为药物的有效透皮面积。
实验结果:在不同取样点的体外累积透皮渗透量如图1。
从图1可以看出,本发明的盐酸普萘洛尔外用凝胶制剂的体外透皮效果良 好,能够很好地透过皮肤屏障,为有效治疗婴幼儿血管瘤提供保障,且释药时间较长,减少给药次数。
实施例5:
取实施例1制备的盐酸普萘洛尔凝胶,临床治疗婴幼儿血管瘤患儿21例(上海长海医院整形外科),年龄<1周岁的12例,年龄1~6岁的患儿9例,经过4周的治疗,临床有效率85.7%,且对皮肤无刺激性,无明显不良反应发生。
实施例6:星点设计-效应面法对盐酸普萘洛尔凝胶的处方进行优化
1含量测定方法的建立
1.1色谱条件 色谱柱:ODS C18柱(250mm×4.6mm,5μm);流动相:甲醇-含0.1%庚烷磺酸钠的0.05mol/L磷酸二氢钾溶液(64:36);流速:1.0ml/min;检测波长:290nm;柱温:30℃;进样量:20μl[10]。
1.2溶液的制备
精密称取盐酸普萘洛尔对照品20mg于100ml容量瓶中,加适量纯化水溶解并定容,摇匀,即得盐酸普萘洛尔标准品溶液。
精密称取盐酸普萘洛尔凝胶0.9980g,加100ml纯化水溶解,取该溶液1ml用纯化水定容于于10ml容量瓶中,摇匀,即得盐酸普萘洛尔供试品溶液。
盐酸普萘洛尔标准品溶液和供试品溶液经0.45μm微孔滤膜过滤,在1.1项色谱条件下得到的色谱图见图2、图3。从色谱图可知标准品和凝胶剂中的盐酸普萘洛尔的峰形均良好,且凝胶剂中的其他成分对普萘洛尔的吸收无干扰。
1.3标准曲线的建立 精密吸取1.2项中标准品溶液0.5,1.0,1.5,2.0,2.5,3.0,3.5ml于10ml容量瓶中,以纯化水定容,得系列浓度,摇匀,按1.1项色谱条件进样,测定峰面积(A),以A对浓度(C)作线性回归,得回归方程:A=28775C-2160.7(r2=0.9997)。盐酸普萘洛尔的浓度线性范围为10.00~70.00μg/ml。
1.4精密度 取1.2项中的标准品溶液,按1.1项色谱条件重复进样6次,并记录峰面积,测定结果见表1,结果表明仪器测试的精密度良好。
表1精密度实验结果
1.5重复性 平行配制6份盐酸普萘洛尔凝胶供试品溶液(实施例1制备的样品),按1.1项色谱条件进样,测定结果见表2,结果表明该方法重复性良好。
表2重复性实验结果
1.6加样回收 在6份已知含量的盐酸普萘洛尔凝胶(实施例1制备的样品)中分别加入精密量取的对照品溶液适量,3份为1组,加适量纯化水溶解过滤,按1.1项色谱条件进样,记录峰面积,测定结果见表3。结果表明本方法回收率良好,制剂中其他成分对盐酸普萘洛尔的含量测定无干扰。
表3加样回收率实验结果
1.7含量测定 取3批3%盐酸普萘洛尔凝胶,按1.2项方法制备样品溶液,按1.1项色谱条件进样,记录峰面积,根据线性回归计算凝胶剂中盐酸普萘洛尔的含量。由表4中的测定结果表明,该测定方法符合含量测的要求。
表4 3批盐酸普萘洛尔凝胶样品含量测定结果
2普萘洛尔凝胶制备工艺
2.1盐酸普萘洛尔凝胶的处方组成 盐酸普萘洛尔3.0g,羟苯乙酯0.1g,泊洛沙姆(P407)20.0g,甘油5.0g,丙二醇10.0g,氮酮3.0g,加纯化水适量至100g。
2.2盐酸普萘洛尔凝胶的制备 先将盐酸普萘洛尔和羟苯乙酯用适量纯化水溶解、分散,再缓缓加入泊洛沙姆P407,均匀搅拌使其全部没于水中,于4℃下溶胀24h后取出,再在搅拌条件下依次加入甘油、丙二醇、氮酮,搅匀后封存。于阴凉处过夜,分装,即得无色透明的凝胶制剂。制得该凝胶制剂的pH 6.5~6.8。
3体外透皮实验
3.1离体皮肤的制备 将KM小鼠腹部脱毛,保证腹部皮肤无损伤。1d后将小鼠处死,立即取其完整腹部脱毛皮肤,刮去皮肤上的多余脂肪、组织后,用生理盐水清洗、浸泡,于4℃下短期保存,备用。
3.2体外透皮实验 采用Franz扩散池法进行。所用装置为Franz扩散池和自制的透皮扩散仪,有效扩散内径0.9cm,接收室体积为5ml,以生理盐水为接收液,于32℃恒温水浴中匀速搅拌。取3.1项下处理好的离体皮肤,用滤纸吸干表面上多余的水分,将角质层朝上固定于Franz扩散池上,将0.1g的盐酸普萘洛尔凝胶均匀地涂在小鼠皮肤上,用铝箔封好。分别于1,2,3,4,6,8,12h时取1ml接收液,并于接收池中加入1ml同温度的新鲜生理盐水。取出的接收液经0.45μm微孔滤膜过滤,按1.1项色谱条件进样,记录峰面积。
3.3体外累计渗透量的计算 由回归方程计算不同时间点接收池中盐酸普萘洛尔的含量,由Q=[CnV+Σ(C×1)]/S计算单位面积药物的累积渗透量。其中,Q为单位面积的药物累积透皮渗透量,Cn为该取样点时接收液中的药物浓度,V为接收液体积,C为第1个取样点至上个取样点时接收液中的累计药物浓度,S为药物的有效透皮面积。
4星点设计-效应面法优化处方
4.1星点设计
单因素考察发现,促透剂氮酮和丙二醇的含量对盐酸普萘洛尔凝胶体外透皮渗透量影响最为显著。在二水平析因设计的基础上,利用Design-Expert软件(8.0.5b原版)设计2因素5水平的处方优化实验。5个水平的代码分别为0,±1,±α,α=F1/4,F=2k,F为析因设计的部分试验次数,k为因素数。以氮酮含量(X1)和丙二醇含量(X2)为自变量,以透皮累积渗透量(Y)为因变量。因素水平设置和实验星点设计见表5,表6。
表5星点设计的因素水平表
表6星点设计实验表及结果
9~13号为重复实验,数值以平均值表示
4.2效应面法优化
利用Design-Expert软件(8.0.5b原版)进行回归分析,以置信度(P)作为模型判断的标准[12],建立二次多项式回归模型:Y=a1X1+a2X2+a3X1X2+a4X12+a5X22+a6。依据多项式回归方程绘制三维效应面和二维等高线图 [13],从效应值与考察因素关系中确定较佳的促透剂含量。
依据各因素水平的累积渗透量(见表6),得到的二次多项式回归方程为:Y=1606.595-556.426*X1-224.665*X2-44.926*X1*X2+212.211*X12+21.308*X22。由多项式回归方程绘制出三维效应面和二维等高线图,见图4、图5。
根据拟合方程和效应面综合评价,由软件得到的优化方案为X1=4%,X2=5%,Y=1287.11μg/cm2。
4.3最优处方验证
按照最优处方制备3批盐酸普萘洛尔凝胶剂,按照体外透皮实验方法进行透皮实验,由公式计算体外累积透皮渗透量。以偏差作为所建模型预测性良好与否的指标,偏差(%)=(实测值-预测值)/预测值×100%,将这3批制剂的平均累积透皮渗透量(1377.81μg/cm2)和预测值(1287.11μg/cm2)代入该偏差公式得该偏差为7.05%。由此表明本实验的可预测性良好。详见表7。
表7处方验证结果
实验结果表明:当盐酸普萘洛尔凝胶促透剂的最优配比为氮酮4%,丙二醇5%,12h的累积透皮渗透量为1377.81μg/cm2,与预测值具有良好的相符性。
以上已对本发明创造的较佳实施例进行了具体说明,但本发明创造并不限于所述实施例,熟悉本领域的技术人员在不违背本发明创造精神的前提下还可做出种种的等同的变型或替换,这些等同的变型或替换均包含在本申请权利要求所限定的范围内。
- 还没有人留言评论。精彩留言会获得点赞!