一种米根霉固态发酵提取物、制备方法及其抗癌功效的应用与流程
本发明属于发酵技术领域,具体涉及一种米根霉固态发酵提取物、制备方法及其在医药生物、保健品领域抗癌功效的应用。
背景技术:
癌症是一种由于身体控制细胞增殖的机制失常而引起的严重疾病。由于环境污染、生活压力大等多种因素的影响,目前癌症在全球的发病率迅速增长,严重影响了人们的健康生活。2011年American Cancer Society统计数据表明,2008年全球癌症新发病例约为1270万,因癌症死亡的人数为760万;新发病例中约有56%是来自发展中国家,并且因癌症死亡的人数中发展中国家占到了64%。目前,我国癌症发病率每年也在快速的增加,有资料表明在过去的30年里,我国癌症死亡率上升了80%。
目前对于癌症的治疗还没有非常有效的手段和药物,主要手段是化疗,而化疗药物对人体正常细胞也同样存在着很大的毒性,在治疗过程中常常产生严重的副作用,并且这些用于癌症化疗的药物往往价格比较昂贵,对于发展中国家病人来说难以承受。国内外的科学工作者努力从自然界寻找天然的抗肿瘤药物,目前已经筛选出多种具有良好效果的天然抗肿瘤药物,主要包括生物碱类、萜类以及一些生物多糖类化合物。另外,研究也发现在植物中广泛存在的一些类黄酮类化合物也同样具有良好的抗癌活性,如芹菜素、槲皮素等。而目前从微生物发酵产生的次生代谢产物中也发现多种具有抗肿瘤活性的化合物,并且由于微生物生长迅速、受自然条件因素影响较小等优点,微生物的次生代谢物已经成为研究工作者寻找抗肿瘤活性化合物的主要筛选对象。
谷物主要包括小麦、水稻、玉米、燕麦、黑麦、大麦、高粱和小米等,在我国南方主要食用水稻,而北方主要食用小麦,另外玉米、燕麦和小米也有较为广泛的食用。所有的谷物最外层都具有一层粗糙的保护结构,在这个结构之下是谷粒,谷粒主要包括麸皮、胚乳和胚芽三个部分。胚芽是植物胚胎所在之处,胚乳则是在种子发芽长苗时提供营养需求,而麸皮或者外层结构是保护谷粒免受环境伤害的结构。在胚乳中,大约50-75%是淀粉,是胚芽发芽是的主要能量提供者,麸皮富含膳食纤维、维生素及黄酮多酚等功能成分。然而全谷物中含有诸如植酸等抗营养成分,且一些功能成分处于结合态,不能有效的发挥作用。采用微生物发酵可以产生多种高活性的酶,如糖苷酶、酯酶、植酸酶以及木聚糖酶等,这些酶可以将食物中的淀粉、蛋白、纤维素、脂肪等大分子物质水解成寡糖和氨基酸等小分子物质,更有利于吸收,另外,可以将食物中的一些结合状态的功能成分释放出来。因此采用微生物发酵全谷物是提升全谷物营养价值和保健功效的有效途径。
当前采用微生物固态发酵谷物常见为红曲米、米醋和黄酒等。研究发现红曲米具有降血脂的功效,米醋具有保肝、控制血糖及保护心血管活性,黄酒则具有抗氧化和改善动脉粥样硬化的活性。米根霉是中国药和酒曲中的重要霉菌之一,尚无研究发现米根霉固态发酵谷物具有抗癌功效。
本研究的核心是发现了米根霉固态发酵谷物后所得的产物具有抗癌效果,可应用于医药生物保健品、药品制剂等领域。
技术实现要素:
本发明的目的是采用微生物发酵的方法改善全谷物的营养价值,发现其抗癌保健功效。研究发现米根霉固态发酵谷物萃取物具有很好的抗癌效果。
本发明的技术方案包括:
一种米根霉固态发酵谷物提取物,其特征在于:米根霉固态发酵谷物获得发酵产物,所述发酵产物经过有机醇提取、中等极性有机溶剂萃取纯化获得所述提取物,所述提取物最大吸收波长在200nm~400nm之间,所述提取物具有选择性杀灭癌细胞,促使癌细胞凋亡,抑制体内肿瘤生长的功能。
所述中等极性溶剂为乙酸乙酯、正丁醇、水饱和正丁醇。
所述有机醇为乙醇或甲醇。
所述固态发酵为有氧气流通环境下的固态发酵。
所述谷物为燕麦、小麦、水稻、玉米、黑麦、大麦、高粱或小米的一种或多种。
所述提取物最大吸收波长在250nm~350nm之间,优选在300nm~350nm之间。
本发明的技术方案还包括:
一种米根霉固态发酵谷物提取物的制备方法,其特征在于:米根霉固态发酵谷物获得发酵产物,所述发酵产物经过有机醇提取、中等极性有机溶剂萃取纯化获得所述提取物,所述提取物最大吸收波长在180nm~400nm之间,所述提取物具有选择性杀灭癌细胞,促使癌细胞凋亡,抑制体内肿瘤生长的功能。
本发明的技术方案还包括:
一种米根霉固态发酵谷物提取物在制备治疗肿瘤药物中的用途,其特征在于所述提取物可明显的选择性杀灭癌细胞,促使癌细胞凋亡,抑制体内肿瘤生长;所述提取物的制备方法为米根霉固态发酵谷物获得发酵产物,所述发酵产物经过有机醇提取、中等极性有机溶剂萃取纯化获得所述提取物,所述提取物最大吸收波长在180nm~400nm之间,所述萃取纯化溶剂为乙酸乙酯、正丁醇、水饱和正丁醇;所述有机醇提取溶剂为乙醇或甲醇,所述固态发酵为通氧固态发酵。
具体地制备步骤如下:
米根霉固态发酵:将谷物经过清洗、浸泡、晾干、粉碎、灭菌等工序后,采用米根霉固态发酵,在氧气流通、温湿度适宜的情况下发酵一定时间,所得的即为米根霉发酵产物。
注:发酵底物可使用谷物包括小麦、水稻、玉米、燕麦、黑麦、大麦、高粱和小米等。
发酵产物提取:对发酵产物采用乙醇进行超声破碎和离心去杂质后,旋转蒸发获得乙醇提取物。然后将乙醇提取物用甲醇溶解,用中性有机溶剂进行液液萃取,通过旋蒸、真空干燥后得到样品。
抗癌评价:本发明采用上述米根霉固态发酵产物处理HepG2、Hela、HT-29、MDA-MB-231以及3T3-L1和RPE等细胞检测细胞毒性,进一步采用米根霉固态发酵产物处理HepG2细胞检测细胞克隆形成情况、细胞凋亡水平及细胞周期变化。结果证实,此产物对于癌细胞具有选择性抑增殖作用,对正常细胞毒性小,可以抑制癌细胞克隆形成,促使癌细胞凋亡,阻滞癌细胞分裂周期进行。在此基础上,本发明采用荷瘤小鼠体内抗肿瘤试验证实中剂量(0.4mg/20g体重)和高剂量(0.8mg/20g体重)米根霉固态发酵产物具有较好的抗肿瘤效果,能显著降低肿瘤的重量和瘤体比,平均抑瘤率分别达到约58.4%和68.7%,能够抑制裸鼠体内肿瘤细胞的有丝分裂。综合证实米根霉固态发酵谷萃取物对于肿瘤具有良好的治疗效果。
本发明具有以下优点:
首次发现米根霉发酵谷物的中性有机溶剂萃取物具有广谱高效的抗癌活性,而对正常细胞的作用很弱。并发现该萃取物在裸鼠体内也具有很好的抗肿瘤活性,而对裸鼠体重和脏器没有显著的影响,具有潜在的食品、保健食品、药物的抗癌开发价值。
附图说明
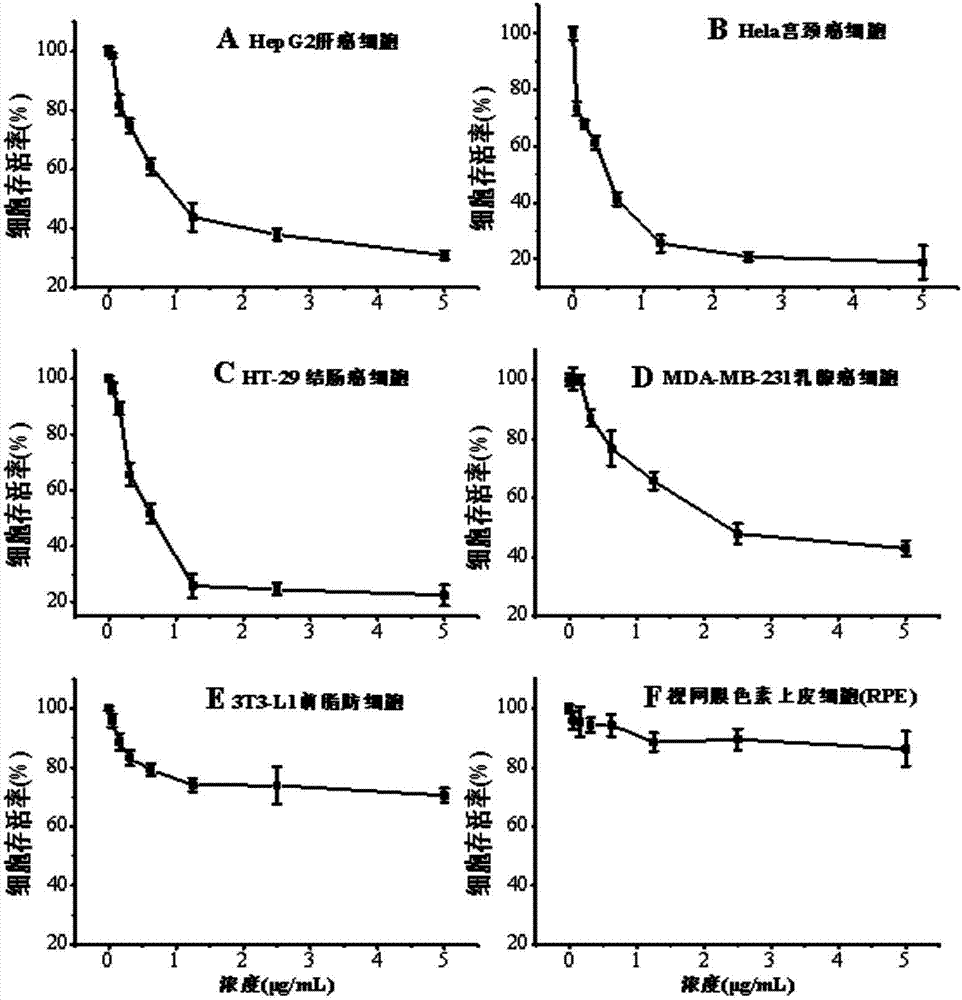
图1是米根霉发酵燕麦乙酸乙酯萃取物对HepG2、Hela、HT-29、MDA-MB-231以及3T3-L1和RPE细胞存活率的影响
图2是米根霉发酵燕麦水饱和正丁醇萃取物对HepG2细胞存活率的影响
图3是米根霉固态发酵糙米乙酸乙酯提取物对HepG2细胞存活率的影响
图4是米根霉发酵燕麦乙酸乙酯萃取物作用HepG2细胞48h后细胞凋亡率的变化
图5是米根霉发酵糙米乙酸乙酯萃取物作用HepG2细胞48h后细胞凋亡率的变化
图6是米根霉发酵燕麦乙酸乙酯萃取物作用HepG2细胞48h后细胞周期变化
图7是不同剂量米根霉发酵燕麦乙酸乙酯萃取物对裸鼠肿瘤重量、瘤体比、平均抑瘤率的影响
图8是肿瘤块的病理切片
图9是全波长扫描图谱
具体实施方式
实施例1米根霉固态发酵燕麦
称取燕麦1kg,清洗后,加水至刚好浸没燕麦,浸泡8h后将水滤去,然后将燕麦晾干,用粉碎机粉碎,使粒度小于30目。分装于玻璃罐中,每罐20g,透气膜封口后在115℃下采用高压灭菌锅蒸煮燕麦15min,晾凉后将米根霉(中国微生物菌种保藏管理委员会普通微生物总行保藏号3.2751)拌在燕麦中(106cfu/g接种量),装入玻璃罐,透气封口膜封口后于25℃、湿度60-80%培养箱中培养72h。
实施例2米根霉固态发酵糙米
将原料糙米用水清洗,加水浸泡数小时后将水滤去,晾干,并分装至玻璃罐内(50g/瓶),透气膜封口后在121℃高压蒸汽灭菌15min,晾冷,接种米根霉(中国微生物菌种保藏管理委员会普通微生物总行保藏号3.1179,浓度为5.7×107cfu/mL)和2%(质量浓度)的胰蛋白胨。接种完毕后放入25℃恒温培养箱培养约7d,每天进行摇瓶,以保证足够的透氧量。
实施例3米根霉固态发酵燕麦乙酸乙酯萃取物提取
对实施例1所得的发酵燕麦在45℃条件下用80%乙醇超声提取30min。等冷却到室温后,提取液以5000rpm离心15min,获得上清液。离心沉淀以相同条件再次提取,合并上清。45℃旋转蒸发后冷冻干燥,获得乙醇提取物。将干燥后的样品称重,按1:10的比例加入30%甲醇充分溶解。混匀后的样品用正己烷按1:1的比例萃取3次,每次萃取后的上层弃去,下层继续萃取,3次之后改用乙酸乙酯按1:1的比例萃取,乙酸乙酯萃取时收集上层,下层继续萃取,将3次萃取后的上层合并起来,40℃旋转蒸发,得到乙酸乙酯萃取物。将乙酸乙酯萃取物放入抽真空装置中进行干燥,充分除去乙酸乙酯组分,得到样品。干燥后的样品放在-80℃冰箱保存备用。
实施例4米根霉固态发酵燕麦水饱和正丁醇萃取物提取
对实施例1所得的发酵燕麦在45℃条件下用80%乙醇超声提取30min。等冷却到室温后,提取液以5000rpm离心15min,获得上清液。离心沉淀以相同条件再次提取,合并上清。45℃旋转蒸发后冷冻干燥,获得乙醇提取物。将干燥后的样品称重,按1:10的比例加入30%甲醇充分溶解。混匀后的样品用正己烷按1:1的比例萃取3次,每次萃取后的上层弃去,下层继续萃取,3次之后改用水饱和正丁醇按1:1的比例萃取,水饱和正丁醇萃取时收集上层,下层继续萃取,将3次萃取后的上层合并起来,40℃旋转蒸发,得到水饱和正丁醇萃取物。将萃取物放入抽真空装置中进行干燥,充分除去正丁醇组分,得到样品。
实施例5米根霉固态发酵糙米乙酸乙酯产物提取
将发酵后的糙米收集、切碎,每次称取250g样品,在45℃水浴条件下,按液料比1:5用80%乙醇超声提取30min,每250g样品提取两次。醇提后的混合物进行抽真空过滤,并收集所有滤液。收集的滤液在45℃水浴条件下旋转蒸发,从而得到乙醇提取物。为了充分除去提取物中的乙醇和水,将样品放入冷冻干燥机中冷冻干燥,得到干燥样品。将干燥后的样品称重,按料液比1:10的比例加入30%甲醇充分溶解。混匀后用正己烷按1:1的比例萃取,每次萃取后的上层弃去,下层继续萃取,3次之后改用乙酸乙酯按1:1的比例萃取,乙酸乙酯萃取时收集上层,下层继续萃取,将3次萃取后的上层合并起来,在40℃条件下旋转蒸发,从而得到乙酸乙酯萃取物。将旋蒸后的样品放入抽真空装置中进行抽真空干燥,以充分除去乙酸乙酯组分,得到样品。
实施例6米根霉发酵燕麦乙酸乙酯萃取物对HepG2、Hela、HT-29、MDA-MB-231以及3T3-L1和RPE细胞存活率的影响
将肝癌细胞(HepG2)、宫颈癌细胞(Hela)和结肠癌细胞(HT-29)置于含有10%胎牛血清及1%青链霉素的DMEM培养基中,乳腺癌细胞(MDA-MB-231)和小鼠前脂肪细胞(3T3-L1)置于含有10%胎牛血清及1%青链霉素的RPMI-1640培养基中,将人视网膜色素上皮细胞(RPE)置于含有10%胎牛血清及1%青链霉素的F12培养基中,于37℃、5%CO2培养箱中培养。显微镜下观察细胞贴壁生长,当细胞长满90%左右时进行传代。收集处于对数期生长的HepG2、Hela、HT-29以及MDA-MB-231等癌细胞及3T3-L1、RPE等正常细胞,制成单细胞悬液,以4×104个细胞/mL密度接种细胞于96孔板中,每孔200μL,于37℃、5%CO2培养箱中培养。待细胞生长面积达到50%-60%时,小心吸取并弃去上清液,每孔加入含有不同浓度的实施例3所得的米根霉发酵燕麦乙酸乙酯萃取物(终浓度分别为0.078、0.156、0.312、0.625、1.250、2.500、5.000μg/mL)的DMEM/F12/RPMI-1640完全培养基各200μL,每个浓度设6个平行孔,以不加药物的培养基为阴性对照,于37℃、5%CO2培养箱中培养48h。细胞培养结束后,弃去正常培养基和含药培养基,加入用不完全DMEM稀释的MTT(终浓度0.5mg/mL)150μL后,培养板放入培养箱内继续培养4h,弃去含MTT的培养基,然后加入DMSO(150μL/孔)以便溶解细胞中的甲臜。测定吸光度值(OD值):待DMSO充分溶解细胞中甲臜后,测定前将培养板充分震荡混匀,用酶标仪测定OD570值。以对照组细胞活力为100%,提取物对各细胞抑制率计算公式如下:抑制率=(OD对照-OD试验)/OD对照×100%。
结果如附图1所示,经过48h的作用,该萃取物对四种癌细胞均具有很好的抑制活性,在较低的浓度条件下就可以极显著地抑制各癌细胞的增殖,并且在浓度低于1.0μg/mL时,该萃取物对癌细胞的增殖抑制作用具有剂量效应,而当萃取物浓度在1.0-5.0μg/mL时,其剂量效应不明显,尤其是对Hela和HT-29这两种癌细胞来说,萃取物对其抑制达到80%左右,该抑制率将不再随萃取物浓度的升高而有明显的升高,而对MDA-MB-231的抑制率在5.0μg/mL时接近60%,说明萃取物在1.0-5.0μg/mL浓度范围内对癌细胞有一个最大的抑制率,并不能完全杀灭癌细胞。萃取物在对各癌细胞作用48h后IC50值:HepG2为0.75μg/mL,Hela为0.54μg/mL,HT-29为0.63μg/mL,MDA-MB-231为2.37μg/mL。从IC50值可以看出,在这四种癌细胞中,萃取物对Hela的作用最强,对MDA-MB-231的作用最弱。然而萃取物对两种正常细胞的毒性要远小于对四种癌细胞的毒性,尤其是对RPE细胞,在浓度不超过5μg/mL时,该萃取物没有表现出显著的毒性,并且在此浓度下对3T3-L1的抑制率也不到30%,说明该萃取物对癌细胞和正常细胞的毒性具有一定的选择性。
实施例7米根霉发酵燕麦水饱和正丁醇萃取物对HepG2细胞存活率的影响
将肝癌细胞(HepG2)置于含有10%胎牛血清及1%青链霉素的DMEM培养基中,收集处于对数期生长的HepG2,制成单细胞悬液,以4×104个细胞/mL密度接种细胞于96孔板中,每孔200μL,于37℃、5%CO2培养箱中培养。待细胞生长面积达到50%-60%时,小心吸取并弃去上清液,每孔加入含有不同浓度的实施例4所得的米根霉发酵燕麦水饱和正丁醇萃取物(终浓度分别为0.3125、0.625、1.250、2.500、5.000μg/mL)的DMEM完全培养基各200μL,每个浓度设6个平行孔,以不加药物的培养基为阴性对照,于37℃、5%CO2培养箱中培养48h。细胞培养结束后,弃去正常培养基和含药培养基,加入用不完全DMEM稀释的MTT(终浓度0.5mg/mL)150μL后,培养板放入培养箱内继续培养4h,弃去含MTT的培养基,然后加入DMSO(150μL/孔)以便溶解细胞中的甲臜。测定吸光度值(OD值):待DMSO充分溶解细胞中甲臜后,测定前将培养板充分震荡混匀,用酶标仪测定OD570值。以对照组细胞活力为100%,提取物对各细胞抑制率计算公式如下:抑制率=(OD对照-OD试验)/OD对照×100%。
结果如附图2所示,提取物对HepG2细胞有较好的抑制活性,在较低浓度下就能极显著地抑制HepG2肝癌细胞生长,且低浓度下呈现一定的剂量依赖效应。计算其IC50值为0.77μg/mL。
实施例8米根霉发酵糙米乙酸乙酯萃取物对HepG2细胞存活率的影响
将肝癌细胞(HepG2)置于含有10%胎牛血清及1%青链霉素的DMEM培养基中,收集处于对数期生长的HepG2,制成单细胞悬液,以4×104个细胞/mL密度接种细胞于96孔板中,每孔200μL,于37℃、5%CO2培养箱中培养。待细胞生长面积达到50%-60%时,小心吸取并弃去上清液,每孔加入含有不同浓度的实施例5所得的米根霉发酵糙米乙酸乙酯萃取物(终浓度分别为0.3125、0.625、1.250、2.500、5.000μg/mL)的DMEM完全培养基各200μL,每个浓度设6个平行孔,以不加药物的培养基为阴性对照,于37℃、5%CO2培养箱中培养48h。细胞培养结束后,弃去正常培养基和含药培养基,加入用不完全DMEM稀释的MTT(终浓度0.5mg/mL)150μL后,培养板放入培养箱内继续培养4h,弃去含MTT的培养基,然后加入DMSO(150μL/孔)以便溶解细胞中的甲臜。测定吸光度值(OD值):待DMSO充分溶解细胞中甲臜后,测定前将培养板充分震荡混匀,用酶标仪测定OD570值。以对照组细胞活力为100%,提取物对各细胞抑制率计算公式如下:抑制率=(OD对照-OD试验)/OD对照×100%。
结果如附图3所示,提取物对HepG2细胞有较好的抑制活性,在较低浓度下就能极显著地抑制HepG2肝癌细胞生长,且低浓度下呈现一定的剂量依赖效应。计算其IC50值为0.62μg/mL。
实施例9米根霉发酵燕麦乙酸乙酯萃取物对HepG2细胞凋亡的影响
具体操作步骤如下:在6孔板中,将4mL浓度为1×105/mL的HepG2接种在每孔中,待细胞长至50-60%左右的时候,小心吸取并弃去上清液,每孔加入含有不同浓度的实施例3所得的米根霉发酵燕麦乙酸乙酯萃取物(终浓度分别为0.2、0.4、0.8μg/mL)的DMEM完全培养基各1mL,每个浓度设6个平行孔,以不加药物的培养基为阴性对照,将细胞置于37℃、5%CO2培养箱中培养48h后,将上清液吸至离心管中,培养孔用PBS润洗后加入胰蛋白酶消化1min,再将3mL的完全DMEM培养基加入培养孔中终止消化。用移液器反复轻轻吹打后,将含有细胞的培养基转移至之前的离心管中,1000rpm离心5min后弃去上层培养基,收集细胞。用4℃预冷的PBS将离心后的细胞重悬,1000rpm离心5min后去除上清液,再以相同条件将细胞洗涤一次。用超纯水和10×结合缓冲液以9:1的比例进行混合后,稀释成1×结合缓冲液。加入300μL稀释后的结合缓冲液以便悬浮细胞,反复轻轻吹打后将分散均匀的细胞移至流式管。在避光条件下将5μL的Annexin V-FITC加入到分散均匀的细胞中充分混匀,在室温下孵育15min。在待测细胞上机前5min将5μL的PI加入流式管中,对待测细胞进行染色。上机测定时,每管再补加200μL稀释后的结合缓冲液,上机进行检测。
结果如附图4所示,经过低浓度样品(0.2μg/mL)处理48h后细胞的凋亡率与没有经过处理组的细胞相比有显著差异(p<0.05),而细胞经过中浓度(0.4μg/mL)和高浓度(0.8μg/mL)处理后,细胞的凋亡率与对照组相比,其差异性更加明显,具有极显著的差异(p<0.01)。HepG2在经过0.2、0.4和0.8μg/mL三种不同浓度作用48h后其细胞凋亡率分别达到22.6%、31.0%和51.3%。
实施例10米根霉发酵糙米乙酸乙酯萃取物对HepG2细胞凋亡的影响
具体操作步骤同实施例6,所不同的在于6孔板中加入含有不同浓度的实施例5所得的米根霉发酵糙米乙酸乙酯萃取物(终浓度分别为0.2、0.4、0.8μg/mL)的DMEM完全培养基各1mL。
结果如附图5所示,随着米根霉发酵糙米乙酸乙酯萃取物浓度的升高,凋亡率也显著升高(p<0.01),呈现一定剂量效应关系。高浓度处理组总凋亡率达到近50%。
实施例11米根霉发酵燕麦乙酸乙酯萃取物对HepG2细胞周期的影响
具体操作如下:在6孔板中,将4mL浓度为1×105/mL的HepG2细胞接种在每孔中,待细胞长至50-60%左右的时候,小心吸取并弃去上清液,每孔加入含有不同浓度的实施例3所得的米根霉发酵燕麦乙酸乙酯萃取物(终浓度分别为0.2、0.4、0.8μg/mL)的DMEM完全培养基各1mL,每个浓度设6个平行孔,以不加药物的培养基为阴性对照,处理完后将细胞放于37℃、5%CO2培养箱中培养48h,将上清液吸至无菌离心管中,然后用PBS润洗培养孔后加入胰蛋白酶消化1min,再加2mL的完全DMEM培养基终止胰酶消化,反复吹打后将细胞移至之前离心管中,1000rpm离心5min后弃去上层培养基,收集细胞。将PBS先预冷,然后加入3mL重悬离心的细胞,1000rpm离心5min,弃去上清液后再加入500μL的PBS,然后轻轻吹打重悬细胞,以便细胞充分分散,然后再往离心管内逐滴加入-20℃预冷的无水乙醇1.5mL,使得离心管内乙醇的终浓度为75%,然后将细胞放入-20℃过夜进行固定。经过固定的样品1000rpm离心5min,并弃去上清,然后加入3.0mL经过预冷的PBS以便重悬细胞,1000rpm离心5min并弃去上清(重复2次,以便将乙醇除尽)。加入5μL的RnaseA(用PBS稀释为250-500μg/mL)并重悬细胞,放入37℃孵育1h。再加入PI工作液10μL(PI的终浓度为10μg/mL),放入4℃避光染色30min后将样品转入流式检测管进行检测。
结果如附图6所示,相比于未处理组,处理组的sub G1期细胞数量随着处理浓度的升高而出现明显的增多,说明细胞凋亡数量随着样品处理浓度升高而增多。而G0/G1细胞数量随着样品处理浓度的升高而出现明显的下降。处于sub G1期的细胞比例从1.03%分别上升到9.6%、14.8%和21.8%(p<0.05),说明细胞经过48h样品处理已经出现大量的凋亡。G0/G1期的细胞出现显著的下降,从65.5%下分别下降到51.1%、34.3%和18.9%(p<0.05)。不同浓度处理组的S期细胞比例显著上升,分别从24.3%上升到37.3%、50.2%和61.3%(p<0.05),说明萃取物不仅仅阻断G2/M期,癌细胞中与S期调控相关的周期蛋白及因子也开始受到萃取物的影响,从而导致样品也开始表现出S期阻断的作用效果。
实施例12米根霉发酵燕麦乙酸乙酯萃取物对荷瘤小鼠皮下移植瘤的影响
具体操作步骤如下:
(1)HepG2细胞的培养:用于接种裸鼠体内的HepG2细胞在体外培养的方法同实施例4,待细胞在培养瓶中生长到80%左右时,将细胞传代扩大培养,于对数期收集细胞,并用不完全培养基将细胞稀释到合适的浓度,以保证0.2mL培养液中细胞超过2×106个,收集细胞后立即用于动物体内接种。
(2)荷瘤裸鼠构建:将收集好的处于对数生长期的HepG2细胞用无菌的微量注射器在SPF环境中皮下注射到裸鼠的腋下,每只小鼠注射的细胞量尽可能保持一致,以保证裸鼠体内的肿瘤生长较为均匀。接种完成的裸鼠每5只一笼,在SPF培养环境中饲养,每隔1天观察接种部位肿瘤的生长情况。
(3)成模裸鼠分组及操作:待接种的裸鼠体内肿瘤长到体积约100mm3左右时,开始进行抗肿瘤试验。剔除未构建成功的裸鼠后,按照肿瘤的大小随机将裸鼠分为4组,即正常对照组、低剂量组、中剂量组和高剂量组。所有组均采用腹腔注射给药方式,每天定时给药一次,样品均用玉米油进行溶解,注射剂量为0.2mL/20g体重。正常对照组注射相应体积的玉米油,不同剂量的给药组以亚急性毒理结果为参考,选择相应的给药剂量。试验周期为18天,所有裸鼠均处于相同的SPF饲养环境,自由饮水和采食,并每隔一段时间记录采食量变化。饲养房间内湿度控制在45%左右,温度控制在20℃左右。每天称量体重以调整给药剂量,并隔天测定肿瘤体积大小。试验结束后,摘眼球取血,并解剖裸鼠,取肿瘤和脾脏称重并用福尔马林溶液进行固定,然后将固定后的肿瘤和脾脏进行病理切片分析。
(4)指标测定:①裸鼠荷瘤大小及重量:在给药过程中,通过游标卡尺测定裸鼠腋下肿瘤的长径(a)和短径(b),然后按照下列公式计算肿瘤的体积:瘤体积(V)=1/2×a×b×b。在试验结束后处死裸鼠取出腋下肿瘤进行称重分析。②肿瘤组织病理切片:将所有裸鼠肿瘤组织和脾脏用10%福尔马林固定,石蜡包埋,4μm切片,并对每个切片进行HE染色后在解剖镜下进行观察。
实验结果如下:
(1)米根霉固态发酵燕麦萃取物能够抑制体内肿瘤的生长。抗肿瘤试验为期20天,第20天时,将所有裸鼠处死后取出肿瘤块,并分别对其称重,比较分析瘤块重量、瘤体比、平均抑瘤率、脾脏指数,结果附图7所示。从肿瘤体积测定结果判断出,不同剂量的萃取物均具有显著的抑制肿瘤增长作用,并表现出剂量效应,附图7A所示的是各组肿瘤重量的分析结果,从图中可以看出,各剂量组对肿瘤的重量具有一定的抑制作用,并且也呈现剂量效应,其中中剂量组和高剂量组的肿瘤重量与对照组之间具有显著的差异(p<0.05),而低剂量组与对照组相比虽然平均重量下降,但并没有表现出显著性(p>0.05)。附图7B表示的是肿瘤重量和裸鼠体重之间的比值(瘤体比),是抗肿瘤动物试验中用以反映供试药物抗肿瘤效果的一个常用指标,结果也同样表明,中、高剂量组的瘤体比与对照组相比显著下降(p<0.05),说明中、高剂量萃取物具有显著的抗肿瘤效果,而低剂量组的瘤体比的平均值与对照组相比,也同样表现出较大的下降,但统计结果并没有表现出显著性(p>0.05)。通过肿瘤的重量计算各剂量组的平均抑瘤率如附图7C所示,其结果表明,各剂量组均具有较好的抑瘤率并具有剂量效应,特别是高剂量组。
(2)米根霉固态发酵燕麦萃取物能够抑制裸鼠体内肿瘤细胞的有丝分裂,如附图8所示,对照组癌细胞成片分布,血窦丰富,清润周围骨骼肌组织和软骨组织,癌细胞呈圆形,胞浆丰富,细胞境界不清,核圆形或卵圆形,空泡核,有一明显的红核仁,核分裂像多见,说明癌细胞生长旺盛,有丝分裂快。低剂量组、中剂量组以及高剂量组的癌细胞核分裂像少见,并呈剂量效应,说明给药组的癌细胞生长缓慢,有丝分裂受到抑制,药物具有较好的抗癌效果。
实施例13米根霉发酵燕麦乙酸乙酯萃取物的全波长扫描
将实施例3所得样品溶解于乙酸乙酯,采用酶标仪于进行全波长扫描。
结果如附图9所示,提取物在200nm~400nm有吸收峰,最大吸收波长在300nm~350nm。
- 还没有人留言评论。精彩留言会获得点赞!