抗炎症剂、抗炎症用药物组合物、抗炎症用食品组合物的制作方法
本发明涉及抗炎症剂、抗炎症用药物组合物、抗炎症用食品组合物。
背景技术:
蛋白质是生物体中的肌肉、脏器等的主要构成成分。在生物体内,重复进行着蛋白质的同化(合成)和异化(分解)这样的循环,在正常情况下,同化与异化的平衡得以保持。
另一方面,在营养不良、进食障碍时及在侵入(手术、病原微生物的感染等)时,会发生蛋白质的异化的亢进(以下也称为“蛋白分解代谢亢进”。),上述的同化与异化的平衡倾向于异化。由于蛋白异化亢进而产生的多余蛋白源在肝脏被转化为糖质,进而,在营养不良、代谢异常状态下被过度转化的糖质可能会导致细胞病变和脏器病变。这样的细胞病变和脏器病变通过由糖质的代谢降低所致的高血糖等而促进免疫系统细胞的炎性细胞因子的产生。即,营养状态不良的状况、侵入时的蛋白异化亢进在体内进一步引起炎症,使生物体防御功能进一步降低。
对于用于抑制在体内引发的炎症的抗炎症剂,已知有各种抗炎症剂(例如,参照专利文献1、2等。)。
现有技术文献
专利文献
专利文献1:日本专利第4620014号说明书
专利文献2:日本专利第5395052号说明书
技术实现要素:
发明要解决的问题
然而,现有的抗炎症剂有可能存在副作用等问题,有可能不适于持续性的给药。进而,尚未对能够抑制蛋白异化亢进时的炎症(例如,由营养不良导致的蛋白异化亢进时的炎症、由侵入导致的蛋白异化亢进时的炎症)的抗炎症剂进行充分地研究。
本发明的目的在于提供即使持续给药、副作用的担心也少的抗炎症剂。
用于解决问题的方案
本发明人等发现中链脂肪酸出乎意料地具有抗炎症作用,特别是能够有效地抑制蛋白异化亢进时的炎症,而完成了本发明。具体而言,本发明提供以下方案。
(1)一种抗炎症剂,其包含中链脂肪酸作为有效成分。
(2)根据(1)所述的抗炎症剂,其中,作为前述中链脂肪酸,包含中链脂肪酸甘油三酯。
(3)根据(1)或(2)所述的抗炎症剂,其用于预防或治疗蛋白异化亢进时的炎症。
(4)根据(3)所述的抗炎症剂,其中,前述蛋白异化亢进时的炎症为由营养不良导致的蛋白异化亢进时的炎症和/或由侵入导致的蛋白异化亢进时的炎症。
(5)根据(1)~(4)中任一项所述的抗炎症剂,其用于预防或治疗脑内的炎症。
(6)一种抗炎症用药物组合物,其包含(1)~(5)中任一项所述的抗炎症剂。
(7)一种抗炎症用食品组合物,其包含(1)~(5)中任一项所述的抗炎症剂。
(8)一种抗炎症剂,其包含中链脂肪酸作为有效成分,通过抑制选自由il-1β、tnf-α和inos组成的组中的1种以上的表达而抑制蛋白异化亢进时的炎症。
(9)根据(8)所述的抗炎症剂,其中,前述蛋白异化亢进时的炎症为由营养不良导致的蛋白异化亢进时的炎症和/或由侵入导致的蛋白异化亢进时的炎症。
(10)根据(8)或(9)所述的抗炎症剂,其中,前述表达为脑内的表达。
发明的效果
根据本发明,提供即使持续给药、副作用的担心也少的抗炎症剂。
附图说明
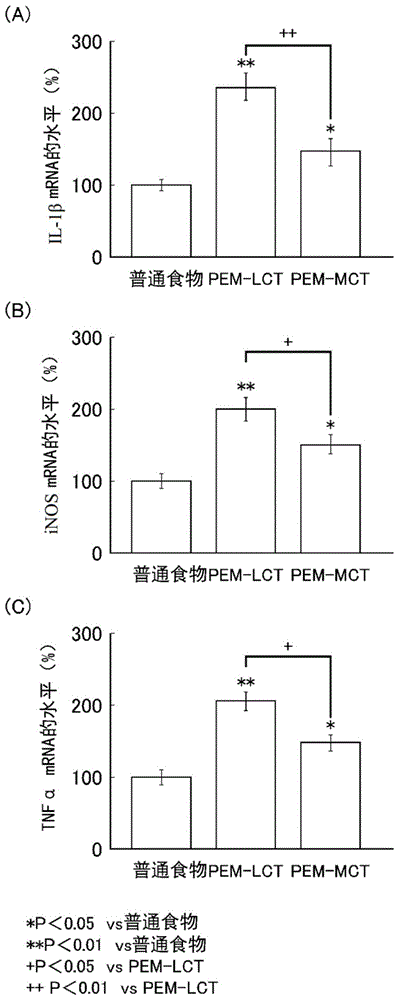
图1是示出本发明的抗炎症剂对3种炎症标志物((a)il-1β、(b)inos、(c)tnf-α)的表达所产生的影响的图。
具体实施方式
以下对本发明的实施方式进行详细地说明,但本发明不特别限定于此。
<抗炎症剂>
本发明的抗炎症剂包含中链脂肪酸作为有效成分。以下也将“中链脂肪酸”称为“mcfa”。“包含中链脂肪酸作为有效成分”是指:作为本发明的抗炎症剂中所含的生理活性物质,至少包含中链脂肪酸。
蛋白异化亢进(例如,在营养不良、进食障碍时等所发生的蛋白异化亢进、由侵入导致的蛋白异化亢进)促使细胞病变和脏器病变、进而促进免疫系统细胞的炎性细胞因子的产生。其结果,在体内的组织、神经引发炎症时,可能会发生神经病变(抑郁症、精神分裂症等)、伴随神经退行性疾病的疾病(帕金森氏病等)。因此,抑制蛋白异化亢进时的炎症对于维持生物体防御功能等尤为重要。特别是,抑制脑内的炎症关系到维持判断力等认知功能,因此成为需要护理状态、日常生活活动降低的预防。因此,本发明人等对如下药剂进行了研究,所述药剂不仅能够有效地抑制通常的炎症(例如,与营养状态、侵入无关的炎症),而且能够有效地抑制蛋白异化亢进时的炎症、进而在由营养不良导致的蛋白异化亢进时的炎症和/或由侵入导致的蛋白异化亢进时的炎症。
其结果,出乎意料地发现:通过包含中链脂肪酸作为有效成分的抗炎症剂,能够有效地抑制炎症、特别是蛋白异化亢进时的炎症,进而还能够有效地抑制由营养不良导致的蛋白异化亢进时的炎症和/或由侵入导致的蛋白异化亢进时的炎症。中链脂肪酸是广泛配混在食品等中的成分,且安全性高。因此,本发明的抗炎症剂即使进行持续给药、副作用的担心也低。需要说明的是,本发明中“持续给药”是指:在规定期间内连续或间断地向对象给予本发明的抗炎症剂。但是,本发明中,不排除向对象单次给予本发明的抗炎症剂的方式。
以下对本发明的抗炎症剂的构成进行详细说明。
(中链脂肪酸(mcfa))
mcfa是碳数6~12的直链饱和脂肪酸,是通常的食品等(例如,食用油脂、乳制品等)中所含的油脂成分。从容易得到安全性更高的抗炎症剂这样的观点出发,mcfa优选为碳数8~12的直链饱和脂肪酸,更优选为碳数8和/或10的直链饱和脂肪酸。作为具体的mcfa,可列举出:己酸(正己酸)、辛酸(正辛酸)、癸酸(正癸酸)、月桂酸。
mcfa可以通过将例如棕榈仁油、椰子油水解后精制而得到。另外,还可以使用市售品、试剂作为mcfa。
作为抗炎症剂中所含的mcfa的形态,没有特别限定,可以是中链脂肪酸本身,可以是在生物体内转换为中链脂肪酸的脂肪酸前体(例如,盐、酯(后述的酰基甘油酯等)),还可以是它们的混合物。
mcfa通常以脂肪酸前体、更具体而言以mcfa与甘油进行酯键合而成酰基甘油酯的形态被摄取至体内。已知的是:所摄取的酰基甘油酯在消化道内被分解吸收且释放mcfa,并在肝脏中进行能量化。从安全性等更高这样的观点出发,本发明的抗炎症剂中所含的mcfa的形态优选为酰基甘油酯。
酰基甘油酯具有脂肪酸与甘油进行酯键合而成的结构,根据与甘油键合的脂肪酸的个数不同,而以3种形态(单酰基甘油酯、二酰基甘油酯和三酰基甘油酯)中的任意形态存在。本发明中的酰基甘油酯可以是上述3种形态中的任意者,但其构成脂肪酸中的至少一个为mcfa。作为本发明中的酰基甘油酯,从接近通常的食品形态这样的观点出发,优选三酰基甘油酯。另外,本发明中,构成二酰基甘油酯和三酰基甘油酯的脂肪酸可以是相同种类,还可以不同的种类。由种类不同的脂肪酸构成的酰基甘油酯的情况,各自的脂肪酸与甘油的键合位置没有特别限定。另外,作为酰基甘油酯的构成脂肪酸,还可以包含除了mcfa以外的脂肪酸(例如,碳数14~22的长链脂肪酸等)。
本发明中的酰基甘油酯的全部构成脂肪酸中,mcfa所占的比例的下限值优选为10质量%以上,进一步优选为40质量%以上,更优选为80质量%以上。上限值优选为100质量%以下。若为上述范围,则能够更有效地发挥由mcfa带来的抗炎症作用。需要说明的是,在本发明的抗炎症剂中配混包含mcfa作为构成脂肪酸的酰基甘油酯时,还可以进一步配混在构成脂肪酸中不包含mcfa的酰基甘油酯。在上述情况下,抗炎症剂中配混的全部酰基甘油酯中,全部构成脂肪酸中的mcfa所占的比例为上述的范围即可。
酰基甘油酯的制造方法没有特别限定,例如可以通过使源自棕榈仁油、椰子油的mcfa与甘油发生酯化反应而得到。酯化反应例如可列举出如下方法:在加压下、无催化剂且无溶剂下进行反应的方法;使用甲醇钠等合成催化剂进行反应的方法;以及使用脂肪酶作为催化剂进行反应的方法等。
从容易得到安全性更高的抗炎症剂这样的观点出发,作为本发明中的酰基甘油酯,优选在构成脂肪酸中含有mcfa和长链脂肪酸(例如,碳数14~22的直链长链脂肪酸)的甘油三酯、即中长链脂肪酸甘油三酯。作为本发明中的酰基甘油酯,特别优选构成脂肪酸全部为mcfa的甘油三酯、即中链脂肪酸甘油三酯。以下也将“中长链脂肪酸甘油三酯”称为“mlct”,也将“中链脂肪酸甘油三酯”称为“mct”。作为本发明的抗炎症剂中所含的mcfa的形态,优选包含mlct和/或mct的形态,更优选仅包含mct的形态。本发明的抗炎症剂特别优选由mct构成。
本发明的抗炎症剂可以由mcfa(mcfa本身、mcfa的脂肪酸前体(mlct、mct等)、或它们的混合物)构成,但还可以包含mcfa及除了mcfa以外的成分。
本发明的抗炎症剂中包含除了mcfa以外的成分时,抗炎症剂中所含的mcfa(mcfa本身、mcfa的脂肪酸前体(mlct、mct等)、或者它们的混合物)的配混量的下限值相对于抗炎症剂优选为33质量以上%,进一步优选为50质量%以上。上限值优选为99质量%以下,进一步优选为90质量%以下。若为上述范围,则能够更有效地发挥由mcfa带来的抗炎症作用。
作为本发明的抗炎症剂中所含的除了mcfa以外的成分,只要不阻碍mcfa的作用就没有特别限定。作为这样的成分,可列举出:已知具有抗炎症作用的有效成分(凝血酸、乙酰水杨酸等)、抗氧化剂、乳化剂等。这些成分的种类、配混量可以根据想要得到的效果进行适宜设定。
本发明的抗炎症剂中所含的mcfa的含量可以利用气相色谱法来确定。
(抗炎症作用)
本发明的抗炎症剂能够用于预防或治疗炎症、特别是蛋白异化亢进(例如,在营养不良、进食障碍时等所发生的蛋白异化亢进、由侵入导致的蛋白异化亢进)时的炎症。本发明中“预防”是指例如抑制或延迟炎症的发病等,“治疗”是指例如炎症进行的延迟、以及症状的缓和、减轻、改善和治愈等。
本发明中,“炎症”是指:由于各种刺激、损伤、感染等而引起的各种反应机制。是否引发炎症可以使用公知的炎症标志物进行确定。作为炎症标志物,例如已知il-1β、inos、tnf-α、inf-γ、cox-2、nf-κb等。
本发明的抗炎症剂尤其对由营养不良导致的蛋白异化亢进时的炎症和/或由侵入导致的蛋白异化亢进时的炎症有效。
本发明中,“蛋白异化亢进”是指:生物体内的蛋白质的同化与异化的平衡倾向于异化的状态。
本发明中,“由营养不良导致的蛋白异化亢进”是指:如营养不良、进食障碍时那样摄取能量不充足,为了在体内产生糖质而蛋白质的分解处于亢进的状态。
本发明中,“由侵入导致的蛋白异化亢进”是指:由于手术、外伤、烧伤、病原微生物的感染、恶性肿瘤等,引起发生损伤的组织的修复等代谢变化,从而蛋白质的分解处于亢进的状态。
本发明中,“蛋白异化亢进时的炎症”和“由营养不良导致的蛋白异化亢进时的炎症和/或由侵入导致的蛋白异化亢进时的炎症”是指:在起因于上述叙述的各种主要原因的蛋白异化亢进时,由于各种刺激、损伤、感染等而引起的各种反应机制,出现发红、发热、肿胀、疼痛等症状。特别是,本发明中,“由营养不良导致的蛋白异化亢进时的炎症和由侵入导致的蛋白异化亢进时的炎症”是指:上述的由营养不良导致的蛋白异化亢进时的炎症和由侵入导致的蛋白异化亢进时的炎症同时发作的状态。
是否发生生物体内蛋白异化亢进可以使用血液标志物来确定。作为这样的血液标志物,可列举出:c反应蛋白(crp)、白蛋白(alb)、α1-抗胰蛋白酶(α1-at)、结合珠蛋白(hp)、血清淀粉样蛋白a(saa)、唾液酸(sa)、甲状腺素运载蛋白(ttr)等。
对于确定是否发生了生物体内蛋白异化亢进的方法,以下对使用了上述的血液标志物的例子进行说明。需要说明的是,下述的说明中,“基准值”是指各标志物的正常值的范围。
crp在蛋白异化亢进时上升。crp的通常的基准值为0.2~0.5mg/dl左右。随着crp的值上升为轻度(0.5~2.0mg/dl)、中度(2.0~10mg/dl)、高度(10~mg/dl),伴随感染症等的炎症状态变得显著。
另一方面,crp增加时alb降低。alb的降低是伴随在肝脏中的蛋白质合成抑制的降低时,怀疑起因于侵入、疾病等的炎症是原因之一。
α1-at在蛋白异化亢进时上升。α1-at的基准值根据性别、年龄而不同,例如,40~59岁的情况,男性为116~154mg/dl、女性为123~161mg/dl。α1-at的值为200mg/dl以上时,怀疑发生了蛋白异化亢进。
hp在蛋白异化亢进时上升。hp的基准值根据基因型(表型)而不同,认为在日本的表型中频率最高的2-2型为41~273mg/dl。hp的值为320mg/dl以上时,怀疑发生了蛋白异化亢进。
saa在蛋白异化亢进时上升。随着saa的值上升为轻度(10~50μg/ml)、中度(50~300μg/ml)、高度(300以上μg/ml),炎症状态变得显著。
sa在蛋白异化亢进时上升。sa的基准值为44~71mg/dl。sa上升的情况下,怀疑发生了炎症。
ttr在蛋白异化亢进时减少。ttr的值为22mg/dl以下时,怀疑发生了炎症。
另外,通过确定生物体是否为营养不良而能够确定是否发生了由营养不良导致的蛋白异化亢进。生物体是否存在营养不良可以使用血液标志物来确定。作为这样的血液标志物,可列举出:白蛋白(alb)、α1-抗胰蛋白酶(α1-at)、胆碱酯酶(che)、运铁蛋白(tf)、甲状腺素运载蛋白(ttr)、尿素氮(bun)、胆固醇(cho)等。
对于确定生物体是否为营养不良的方法,以下对使用了上述的血液标志物的例子进行说明。需要说明的是,下述的说明中,“基准值”是指各标志物的正常值的范围。
alb的通常基准值为3.7~4.9g/dl左右。随着alb的值上升为轻度(3.2~3.7g/dl)、中度(2.5~3.2g/dl)、高度(~2.5g/dl),怀疑营养状态为不良。
α1-at在营养不良时减少。α1-at的基准值为94~150mg/dl。α1-at的值为25mg/dl以下时,怀疑营养状态为不良。
che在营养不良时减少。关于che的基准值,男性为242~495u/l、女性为200~459u/l。
tf在营养不良时减少。关于tf的基准值,男性为190~300mg/dl、女性为200~340mg/dl。
ttr在营养不良时减少。ttr的基准值为22.0~40.0mg/dl。
bun在营养不良时减少。关于bun的基准值,男性为8~20mg/dl,女性以男性10%~20%左右的低值为基准值。bun的值为8mg/dl以下时,怀疑营养状态为不良。
cho在营养不良时减少。cho的基准值为150~220mg/dl。cho的值为150mg/dl以下时,怀疑营养状态为不良。
能适用本发明的抗炎症剂的部位没有限定,可以用于体内的任意的部位(脑、心血管、肝脏、肾脏等)。
本发明的抗炎症剂可以特别适宜地用于脑内(海马等)的炎症。已知的是脑内的炎症由于脑内的小胶质细胞的活化而与产生神经病变因子(炎性细胞因子、活性氧、一氧化氮等)相伴地发生。作为脑内炎症的具体症状,可列举出:神经细胞的线粒体功能异常、氧化应激增加、异常蛋白质的沉积等,这些症状对神经退行性疾病(帕金森氏病等)的发病产生影响。因此,本发明的抗炎症剂还对神经退行性疾病发挥效果。
根据本发明的抗炎症剂,特别是通过抑制炎症标志物(例如,选自由il-1β、tnf-α和inos组成的组中的1种以上)的表达(特别是,脑内的表达),从而抑制蛋白异化亢进时的炎症、更优选抑制由营养不良导致的蛋白异化亢进时的炎症和/或由侵入导致的蛋白异化亢进时的炎症。
<抗炎症用药物组合物>
本发明的抗炎症剂可以用于制造抗炎症用药物组合物。包含本发明的抗炎症剂的抗炎症用药物组合物(以下也称为“本发明的药物组合物”。)的副作用的担心少,可以作为适于持续给药的药品来适宜地使用。
作为本发明的药物组合物的形态,没有特别限定,可以制成经口给药用药物组合物或非经口给药用药物组合物中的任意者。从容易持续摄取这样的观点出发,本发明的药物组合物优选为经口给药用药物组合物。
作为经口给药用药物组合物的形态,例如可列举出:胶囊剂、片剂、丸剂、散剂、细粒剂、颗粒剂、液体制剂、糖浆剂等制剂。作为非经口给药用药物组合物的形态,可列举出:注射剂、输液剂等制剂。
本发明的药物组合物优选为包含本发明的抗炎症剂、以及药理上和制剂上允许的添加物的组合物。作为“药理上和制剂上允许的添加物”,通常可以使用在制剂领域中常用作赋形剂等且不与本发明的抗炎症剂中所含的有效成分发生反应的物质。
本发明的药物组合物的给药量可以根据给药目的(预防或治疗)、给药方法、给药期间、其它各种条件(例如,患者的症状、年龄、体重)进行适宜设定。
对于本发明的药物组合物的给药量,经口给药的情况,对于下限值,可以换算为mcfa的量,优选设定为0.02g/kg体重/天以上,进一步优选设定为0.08g/kg体重/天以上。对于上限值,可以换算为mcfa的量,优选设定为0.70g/kg体重/天以下,进一步优选设定为0.45g/kg体重/天以下。
对于本发明的药物组合物的给药量,经口给药的情况,对于下限值,可以换算为mct的量,优选设定为0.03g/kg体重/天以上,进一步优选设定为0.09g/kg体重/天以上。对于上限值,可以换算为mct的量,优选设定为1.00g/kg体重/天以下,进一步优选设定为0.50g/kg体重/天以下。
对于本发明的药物组合物的给药量,非经口给药的情况,对于下限值,可以换算为mcfa的量,优选设定为0.026g/kg体重/天以上,进一步优选设定为0.09g/kg体重/天以上。对于上限值,可以换算为mcfa的量,优选设定为0.72g/kg体重/天以下,进一步优选设定为0.56g/kg体重/天以下。
对于本发明的药物组合物的给药量,非经口给药的情况,对于下限值,可以换算为mct的量,优选设定为0.029g/kg体重/天以上,进一步优选设定为0.10g/kg体重/天以上。对于上限值,换算为mct的量,优选设定为0.80g/kg体重/天以下,进一步优选设定为0.60g/kg体重/天以下。需要说明的是,非经口给药的情况,优选用数小时(例如,用4~8小时)给予上述给药量。
本发明的药物组合物的副作用的担心少,而且发生与通常的有效成分的相互作用的可能性低,因此还可以与现有药(抗炎症剂、抗癌药、生活方式病(高血压、糖尿病、血脂异常等)治疗药等)组合来使用。与本发明的药物组合物组合的现有药为抗炎症剂时,由于能够降低现有药的用量,因此能够减少该现有药所具有的副作用。
本发明的药物组合物的副作用的担心少,因此适于持续给药。作为给药期间,没有特别限定,例如可以设定为3~10天。给药可以在上述期间内每数小时进行一次,或还可以隔开间隔(例如,1天~数天)进行给药。
<抗炎症用食品组合物>
本发明的抗炎症剂能够用于制造抗炎症用食品组合物。作为本发明的抗炎症剂的有效成分的mcfa不仅副作用的担心少,而且不易损害食品的风味、适口性。因此,包含本发明的抗炎症剂的抗炎症用食品组合物(以下也称为“本发明的食品组合物”。)可以作为容易摄取的食品来适宜地使用。
作为本发明的食品组合物的形态,可列举出:营养强化剂、一般食品、动物用食品、动物用饲料。
营养强化剂的形态没有特别限定,可以是固体制剂或液体制剂中的任意者。例如可列举出:片剂、包衣片剂、胶囊剂、颗粒剂、散剂、粉剂、缓释制剂、悬浮液、乳液剂、内服液、糖衣片、丸剂、细粒剂、糖浆剂、酏剂等制剂。
一般食品的形态没有特别限定,例如可列举出:面包/糖果类(面包、蛋糕、点心、饼干、多福饼、松饼、烤饼、巧克力、零食、搅打鲜奶油、冰激凌等)、饮料类(果汁饮料、营养饮料、运动饮料等)、汤类、调味加工食品(色拉调料、酱汁、蛋黄酱、黄油、人造奶油、调制人造奶油等)、低脂人造黄油、酥油、烘焙类预拌粉、搅拌油、煎炸油、油炸食品、加工肉制品、冷冻食品、油炸食品、面、蒸煮食品、液体食物、吞咽食物等。
为了制造一般食品而使用本发明的抗炎症剂时,优选以mlct和/或mct(更优选为mct)的形态追加在原材料中、或将原材料的油脂替换为mlct和/或mct(更优选为mct)来使用。
本发明的食品组合物的摄取量可以根据摄取目的(预防或治疗)、摄取期间、其它各种条件(例如,摄取者的症状、年龄、体重)进行适宜设定。
对于本发明的食品组合物的摄取量,对于下限值,可以换算为mcfa的量,优选设定为0.02g/kg体重/天以上,进一步优选设定为0.08g/kg体重/天以上。对于上限值,可以换算为mcfa的量,优选设定为0.70g/kg体重/天以下,进一步优选设定为0.45g/kg体重/天以下。
对于本发明的食品组合物的摄取量,对于下限值,可以换算为mct的量,优选设定为0.03g/kg体重/天以上,进一步优选设定为0.09g/kg体重/天以上。对于上限值,可以换算为mct的量,优选设定为1.00g/kg体重/天以下,进一步优选设定为0.50g/kg体重/天以下。
实施例
以下基于实施例对本发明进行更具体地说明,但本发明不限定于这些实施例。
准备以下的试验食物和模型小鼠,评价了炎症标志物的表达量。
<试验食物的制造>
依据ain-93g,制作了2种包含长链脂肪酸油(以下也称为“lct”。)、或包含mct和lct作为脂质的营养不良食物(pem食物)。以下将包含lct的pem食物也称为“pem-lct”,将包含mct和lct的pem食物也称为“pem-mct”。另外,还制作了对照组用的普通食物(ain-93g)。表1(表中的数值的单位:质量份)示出pem食物和普通食物的配方。将各试验食物制成颗粒状。lct是ain-93g等标准的饲料组成中所含的油脂。
需要说明的是,本实施例中使用的mct(nisshinoilliogroup,ltd.制造品)的构成脂肪酸为正辛酸(碳数8)和正癸酸(碳数10),其质量比为正辛酸:正癸酸=30:70。
[表1]
<模型小鼠的准备>
利用以下所示的方法准备了发生了蛋白异化亢进时的炎症(由营养不良导致的蛋白异化亢进时的炎症和由侵入导致的蛋白异化亢进时的炎症)的小鼠。首先,制作了营养状态处于不良的营养不良(pem)的模型小鼠。进而,针对该小鼠,作为侵入的处理将脂多糖(以下也称为“lps”。)进行腹腔内给药,而得到了目标小鼠。需要说明的是,lps是引发炎症的革兰氏阴性细菌细胞壁外膜来源的毒素。已知的是通过lps的给予,小鼠被诱导成蛋白异化亢进状态,不仅全身的各脏器引发炎症而且使脑海马等引发炎症。
依据公知的方法(参考文献:journalofnutritionalscienceandvitaminologyvol.54(2008)no.5p371-377)制作了pem的模型小鼠。具体而言,将14周龄的c57bl/6成体雄性小鼠12只(6只×2组(比较例和实施例))驯化喂养1周。接着,根据各组,给予表1所示的试验食物(“pem-lct”或“pem-mct”)并喂养(自由摄取试验食物和水)2周,得到pem的模型小鼠。在喂养期间,在温度23±1℃、湿度50±10%、12小时明暗循环(从上午8点至晚上8点进行照明。)的环境下在1个笼子里喂养1只。利用与上述同样的方法,准备了给予了普通食物的小鼠(6只)作为对照组。
需要说明的是,未观察到“pem-lct”摄取组和“pem-mct”摄取组的一天饲料摄取量与体重的平均值存在显著差异。
用各试验食物喂养2周后,在第二天(自给予试验食物起第15天),腹腔内给药每1kg体重1mg的lps(源自escherichiacoli0111:b4,sigma-aldrich公司)。在自给予试验食物起第17天(给药lps3天后),从小鼠采集脑海马。需要说明的是,在采集脑海马的1天前使各小鼠绝食,在采集脑海马的3小时前绝水。
在试验期间,各组的小鼠未观察到由试验食物摄取导致的副作用。
<炎症标志物的mrna的定量>
对于从各试验组采集的脑海马,测定了3种炎症标志物(il-1β、inos和tnf-α)的mrna表达量。通过测定这些炎症标志物的mrna表达量而能够确定脑海马的炎症程度。
(pcr用样品的制备)
由从各试验组采集到的脑海马,使用rna提取试剂盒(sepasolrnai、nacalaitesqueinc.)分离了总rna。接着,使用pcr装置(商品名“pc818”、astec公司制),并使用表2所示的试剂和引物测定了mrna的表达量。
[表2]
(结果)
将各试验组中的炎症标志物(il-1β、inos和tnf-α)的mrna表达量示于表3和图1。需要说明的是,对于mrna的表达量,将各试验组中的表达量的数值确定为将普通食物(对照)中的mrna的表达量的平均值设为100时的、相对值的平均值±标准误差(%)。需要说明的是,试行期间的显著差异检验使用tukey法。
[表3]
由表3和图1所理解的那样,“pem-lct”摄取组和“pem-mct”摄取组这两组与摄取了普通食物的组相比,任意的炎症标志物的mrna表达量均显著增加。该结果示出:pem小鼠与摄取了普通食物的小鼠相比,处于由营养不良导致的蛋白异化亢进状态、进而通过lps给药而同时发作由侵入导致的蛋白异化亢进状态,在脑海马中引发了显著的炎症。
然而,“pem-mct”摄取组与“pem-lct”摄取组相比,任意的炎症标志物的mrna表达量均显著降低。即,可知的是通过摄取mct而能够抑制由于营养不良食物和侵入处置而在脑海马中引发的炎症。
序列表
<110>日清奥利友集团株式会社(thenisshinoilliogroup,ltd.)
<120>抗炎症剂、抗炎症用药物组合物、抗炎症用食品组合物
<130>p2257
<160>6
<170>patentinversion3.5
<210>1
<211>20
<212>dna
<213>引物(primer)
<400>1
caggcaggcagtatcactca20
<210>2
<211>20
<212>dna
<213>引物(primer)
<400>2
aggccacaggtattttgtcg20
<210>3
<211>20
<212>dna
<213>引物(primer)
<400>3
acgagacggataggcagaga20
<210>4
<211>20
<212>dna
<213>引物(primer)
<400>4
agctggaagccactgacact20
<210>5
<211>20
<212>dna
<213>引物(primer)
<400>5
caaaccaccaagtggaggag20
<210>6
<211>20
<212>dna
<213>引物(primer)
<400>6
cggactccgcaaagtctaag20
- 还没有人留言评论。精彩留言会获得点赞!