溶酶体靶向的极性和粘度双响应荧光碳点、制备方法及应用与流程
本发明涉及荧光碳点和生物传感技术领域,具体涉及一种溶酶体靶向的极性和粘度双响应荧光碳点、制备方法及应用。
背景技术:
溶酶体作为细胞中酸性最高和粘度最大的消化器官,具有消化、信号传导、质膜修复、细胞内运输、体内平衡和自噬等多种功能,它的异常也可能导致多种疾病。因此,开发用于追踪和可视化溶酶体的方法具有重要意义。
癌症作为一种死亡率较高的疾病,大多数关于癌症的研究集中于癌症的早期诊断。其中,在癌症诊断和治疗的主要困难是癌细胞与正常细胞快速,敏感地分化。到目前为止,已经开发出多种临床检测方法,例如计算机断层扫描、x射线、磁共振成像、超声、原子力显微镜、调制拉曼光谱和生物标记物等。但是这些都存在低信噪比、辐射过量、受限的指定分子设计、繁琐的合成步骤、复杂的纯化步骤、高成本和过表达等的缺点。因此,迫切需要开发用于区分癌细胞与正常细胞的新工具。
近年来,利用碳点的荧光成像技术,由于其优异的的选择性、敏感性和时空分辨率,已成为研究生物分子,活细胞过程和癌症诊断的有力工具。虽然一些报道的碳点能用来区分癌细胞与正常细胞,但是还没有同时具备溶酶体靶点和癌症诊断的荧光碳点。
技术实现要素:
本发明提出了一种溶酶体靶向的极性和粘度双响应荧光碳点、制备方法及应用,利用溶酶体内极性低、粘度高的特点区分正常细胞与癌细胞,从而实现癌症诊断。
实现本发明的技术方案是:
一种溶酶体靶向的极性和粘度双响应荧光碳点的制备方法,将5-氨基-2-(羟甲基)苯基硼酸环单酯与酒石酸以摩尔比为1:1的比例溶解在超纯水中,溶液转移到聚四氟乙烯的内衬里,于真空干燥箱中180℃反应12h,冷却后离心以除去较大的颗粒,超滤以除去较小的原料,冷冻干燥得到碳点。
基于癌症诊断的荧光碳点合成路线如下:
所述荧光碳点通过在溶酶体中的极性和粘度双响应,区分正常细胞与癌细胞。随着极性的降低(极性值从0.3200到0.0205)或者粘度的增加(粘度值从0.8930到856.0),530nm处的荧光迅速增加,且呈现良好的线性。
上述应用具体包括:
分别测试碳点在不同极性溶液或不同粘度溶液里的荧光光谱的变化,荧光的激发波长为445nm,发射波长为530nm,随着极性的降低或者粘度的增加,530nm处的荧光迅速增加,且具有良好的响应。同时测试碳点在不同癌细胞和正常细胞中的亮度差异,达到区分癌细胞和正常细胞的目的。在生物医学研究和相关疾病的诊断中有很好的前景。
本发明的有益效果是:(1)碳点合成十分简单,便于操作;(2)本发明碳点能够内在地靶向溶酶体,不需要任何靶标配体,且对ph不敏感,对极性和粘度双响应;(3)本发明可以通过极性和粘度双响应,区分正常细胞与癌细胞。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
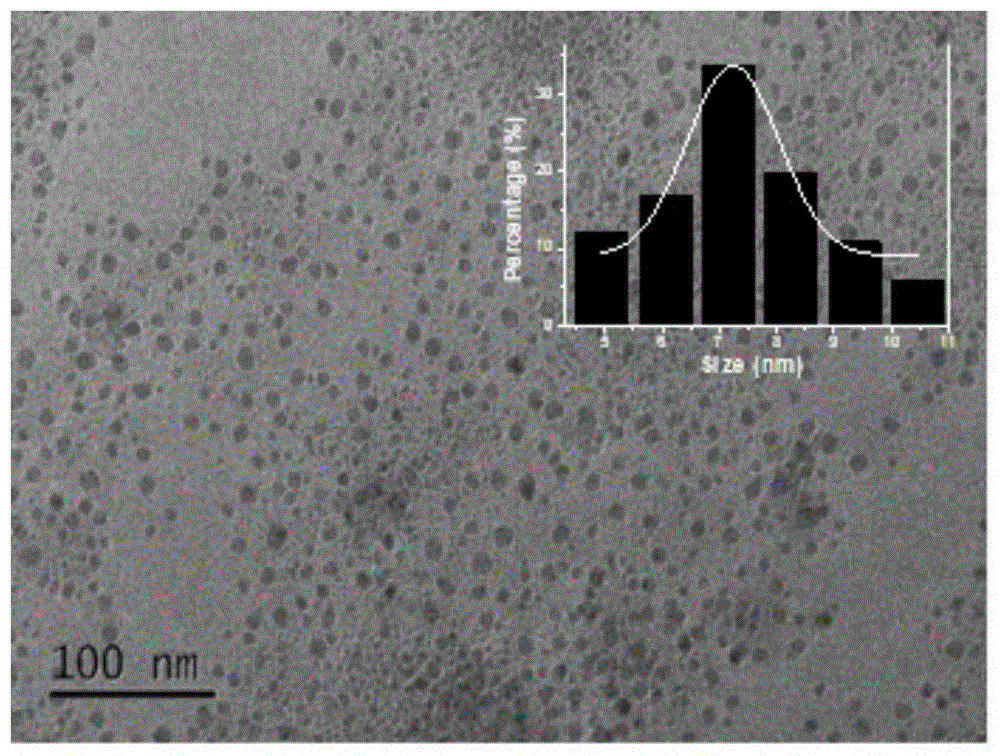
图1为实施例1碳点的tem图谱。
图2是实施例1碳点的xrd图谱。
图3是实施例1碳点的ftir图谱。
图4是实施例1碳点的xps图谱。
图5是实施例1碳点(50μg/ml)在pbs(10mmph=7.4)中的紫外和荧光光谱图。
图6是ph对实施例1碳点的荧光图谱。
图7是在pbs缓冲(10mm,ph=7.4)体系中,50µg/ml碳点分别与200µm不同的氨基酸、200µm不同的ros、1mm阳离子,反应后于530nm处的荧光强度随时间的变化的荧光光谱图。
图8是不同极性值溶液对实施例1碳点的荧光图谱和线性关系图。
图9是不同粘度溶液对实施例1碳点的荧光图谱和线性关系图。
图10是实施例1碳点在hela细胞中和商业溶酶体染料的共定位图。
图11是实施例1碳点在癌细胞和正常细胞中的对比图。(a-e)是癌细胞;(f-h)是正常细胞;(i)是荧光强度对比图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有付出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1
碳点的合成,步骤如下:
于20ml的称量瓶中,加入0.01g的5-氨基-2-(羟甲基)苯基硼酸环单酯和0.01g的酒石酸,并加入10ml超纯水,混合均匀后放入聚四氟乙烯的内衬里,于真空干燥箱中180℃反应12h,冷却至室温后,离心以除去较大的未反应的颗粒,超滤以除去较小的未反应的原料,冷冻干燥得到碳点。
图1为碳点的tem图谱,近似球形的结构,粒径统计大小为7.32nm,说明已经形成了碳点。
图2是碳点的xrd图谱,在21.3°附近显示一个宽的(002)衍射峰,对应于布拉格碳的布拉格反射平面,并揭示了非晶结构的存在。
图3是碳点的ftir图谱,3426、3222、1743、1620、1438、1295和1128cm-1,分别对应于-oh伸缩振动、n-h伸缩振动、-cooh伸缩振动、n-c=o/c=c伸缩振动、b-o伸缩振动、-oh变形振动和c-n/c-o/c-b伸缩振动,说明两种原料已经结合在一起,生成了碳点。
图4是碳点的xps图谱,b1s(192.6ev),c1s(285.0ev),n1s(402.0ev),o1s(532.5ev)的原子百分比分别为6.67%、65.02%、2.77%和25.53%,进一步说明了碳点的生成。
图5是碳点(50μg/ml)在pbs(10mmph=7.4)中的紫外和荧光光谱图,其中最大的吸收和发射分别是490nm和530nm。
图6是碳点在ph=4-8的pbs缓冲溶液中,530nm处的荧光图谱,表明ph对碳点基本没有影响。
图7是碳点50µg/ml与200µm不同的氨基酸、200µm不同的ros、1mm阳离子的反应。2ml的含有50µg/ml碳点的pbs缓冲(10mm,ph=7.4)体系中,分别加入20µl20mm的分析物:1:碳点;2:苏氨酸;3:精氨酸;4:甲硫氨酸;5:脯氨酸;6:甘氨酸;7:赖氨酸;8:亮氨酸;9:色氨酸;10:异亮氨酸;11:丙氨酸;12:组氨酸;13:谷氨酸;14:天冬氨酸;15:缬氨酸;16:丝氨酸;17:半胱氨酸;18:高半胱氨酸;19:谷胱甘肽;20:o2·-;21:h2o2;22:nano2;23:·oh;24:naclo;25:kcl;26:cacl2;27:nacl;28:mgcl2;29:alcl3;30:znso4;31:fecl3;32:fecl2;33:cuso4;34:nicl2;35:mncl2进行荧光光谱测定。同时对不同分析物在530nm处的荧光强度进行比较。实验数据表明碳点与这些分析物没有反应。
实施例2
图8是不同极性值溶液对实施例1碳点的荧光图谱(a)和线性关系图(b)。向比色皿中分别加入2ml不同比例的1,4-二氧六环和水(按1,4-二氧六环的含量从0%到99%,对应极性值从0.3200降低到0.0205时),加入10µl浓度为10mg/ml的碳点储存液,混匀后进行荧光光谱测试。实验结果显示随着溶剂极性值的降低,530nm处的荧光逐渐增加,线性关系为r2=0.9910,说明碳点对极性有良好的响应。
图9是不同粘度溶液对实施例1碳点的荧光图谱(a)和线性关系图(b)。向比色皿中分别加入2ml不同比例的甘油和水(按甘油的含量从0%到99%,对应粘度值0.8930增加到856.0),加入10µl浓度为10mg/ml的碳点储存液,混匀后进行荧光光谱测试。实验结果显示随着粘度的增加,530nm处的荧光逐渐增加,线性关系为r2=0.9633,说明碳点对粘度有良好的响应。
实施例3
图10是实施例1碳点在hela细胞中和商业溶酶体染料共定位图。hela细胞用50µg/ml碳点孵育20min,用商业溶酶体染料lysotrackertmdeepred(50nm),孵育15min,pbs洗三遍,在共聚焦显微镜中可观察到碳点与商业溶酶体探针重叠很好,说明碳点可以靶向溶酶体。
图11是实施例1碳点在癌细胞和正常细胞中的对比图。(a-e)是癌细胞;(f-h)是正常细胞;(i)是荧光强度对比图。hela细胞用50µg/ml碳点孵育20min,pbs洗三遍,共聚焦成像发现碳点在癌细胞中的亮度远大于正常细胞,说明碳点可以区分正常细胞与癌细胞。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法