一种体内活性氧水平失调动物模型的试剂盒的制作方法
本发明涉及一种体内活性氧水平失调动物模型的试剂盒,属于生物
技术领域:
。
背景技术:
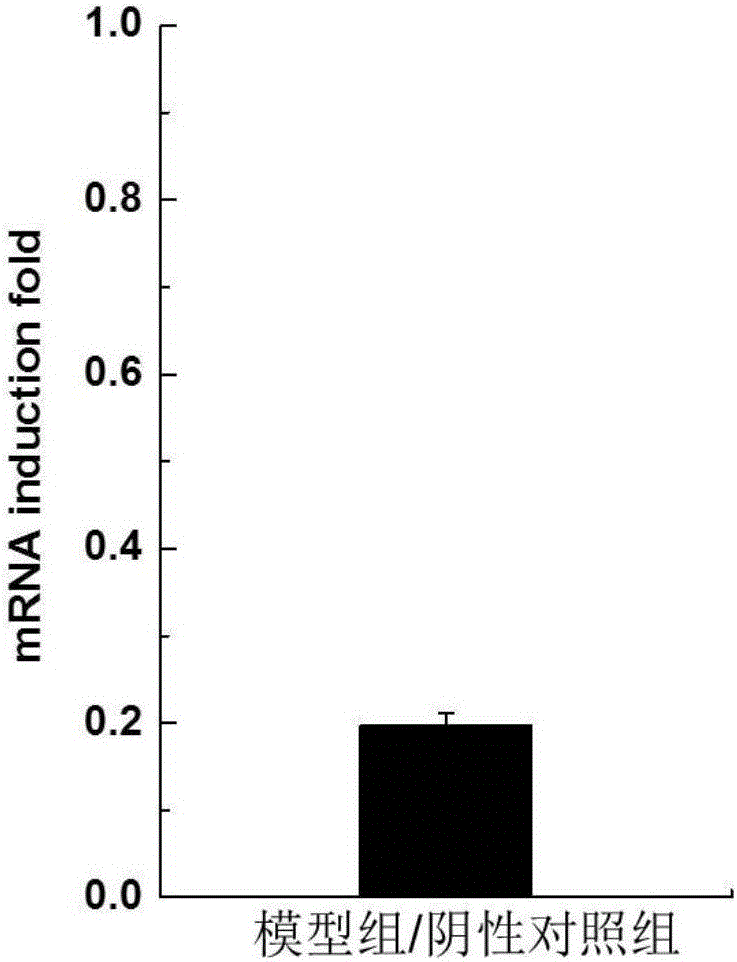
:已发现越来越多的的疾病与所谓的体内活性氧水平失调有关,但目前体内活性氧水平相关的动物模型多为小鼠,导致研究周期长、费用高,而且无法实现高通量。大家急需一种简便、低费用,且可实现高通量的体内活性氧水平失调动物模型试剂盒。新模式生物秀丽隐杆线虫的isp-1基因编码线粒体呼吸链复合体III的Rieske铁硫蛋白(Rieskeironsulphurprotein,ISP)催化亚基,该复合体主要催化电子由泛醌传递到细胞色素c(cytochromec,cytc),该基因部分功能缺失会引起电子传递减弱,体内活性氧水平下降,个体的寿命延长。该亚基的序列在所有线粒体及好氧细菌中高度保守。研究表明,isp-1基因RNAi后的秀丽隐杆线虫表现低耗氧,长寿,发育缓慢等特征。因此如果能建立以isp-1基因RNAi后的秀丽隐杆线虫为模型的试剂盒,则可建成一种简便、低费用,且可实现高通量的体内活性氧水平下降的动物模型试剂盒,这将极大方便科研人员研究相关体内活性氧水平失调疾病。本发明利用秀丽隐杆线虫作为模式生物,构建isp-1基因RNAi后的秀丽隐杆线虫体内活性氧水平失调动物模型的试剂盒。本发明建立的以秀丽隐杆线虫为体内活性氧水平失调动物模型的试剂盒,该试剂盒中的秀丽隐杆线虫可以模拟动物体内总活性氧含量降低的状态,可用于研究体内活性氧水平失调对机 体各种生理生化代谢过程的影响,为研究相关体内活性氧水平失调疾病的科研工作者提供了一种工具。技术实现要素:本发明主要提供一种体内活性氧水平失调动物模型的试剂盒,该试剂盒使用方法简单易行、成本低廉,本发明建立的以秀丽隐杆线虫为体内活性氧水平失调动物模型的试剂盒,该试剂盒中的秀丽隐杆线虫可以模拟动物体内活性氧含量降低的状态,可用于研究体内活性氧水平失调对机体各种生理生化代谢过程的影响,为研究相关体内活性氧水平失调疾病的科研工作者提供了一种工具。本发明的另外一个目的是提供上述体内活性氧水平失调动物模型试剂盒的使用方法,本发明利用isp-1基因RNAi后的秀丽隐杆线虫作为动物模型,操作简单、快速。本发明是通过以下技术方案实现的:一种体内活性氧水平失调动物模型的试剂盒,所述试剂盒包括的材料为:①isp-1基因RNAi后的秀丽隐杆线虫;②NGM培养基;③大肠杆菌OP50。所述的isp-1基因RNAi后的秀丽隐杆线虫是通过分子生物学手段将秀丽隐杆线虫isp-1基因片段插入到质粒载体上,并将其转化到宿主细胞中,构建克隆菌,诱导转化后的克隆菌表达isp-1的dsRNA,给秀丽隐杆线虫饲喂克隆菌,即建立isp-1基因RNAi后的秀丽隐杆线虫。其中,所述isp-1基因片段是用PCR的方法从秀丽隐杆线虫基因组DNA中扩增出来的。其中,所述质粒载体为质粒L4440(pPD129.36),宿主细胞为大肠杆菌 HT115(DE3)。其中,构建重组质粒的方法为:将isp-1基因片段插入到质粒L4440(pPD129.36)两个反向T7启动子之间的多克隆位点处构建重组质粒。其中,所述的诱导转化后的重组克隆菌时所用的诱导剂为异丙基硫代半乳糖苷(IPTG)。本发明还提供一种体内活性氧水平失调动物模型试剂盒在筛选治疗体内活性氧水平失调疾病药物中的应用,所述活性氧水平失调是由活性氧下降引起的。本发明还提供一种体内活性氧水平失调动物模型试剂盒在筛选治疗体内代谢异常药物中的应用,所述代谢异常是活性氧下降所引起的。本发明还提供一种体内活性氧水平失调动物模型试剂盒在研究体内活性氧升高对机体各种生理生化代谢过程的影响中的应用。另外,本发明还提供上述体内活性氧水平失调动物模型试剂盒的使用方法,将isp-1基因RNAi后的秀丽隐杆线虫用镍铬丝挑针分别转移到含有待测化合物的NGM培养基平板和不含有待测化合物的NGM培养基平板上,不含有待测化合物的NGM培养基平板作为空白对照组,每块平板上接种25条isp-1基因RNAi后的秀丽隐杆线虫,待测化合物组与空白对照组均设置3个平行,上述平板均接种大肠杆菌OP50作为秀丽隐杆线虫食物,每天计数待测化合物组与空白对照组的秀丽隐杆线虫的存活条数,直至平板上所有的秀丽隐杆线虫全部死亡,计算待测化合物组与空白对照组中秀丽隐杆线虫的寿命。同以前的方法相比,本发明存在以下优势:本发明利用秀丽隐杆线虫作为模式生物,构建isp-1基因RNAi后的秀丽隐杆线虫体内活性氧水平失调动物模型试剂盒,该药物试剂盒具有操作简单、 快速、高效的优点,为研究相关体内活性氧水平失调疾病的科研工作者提供了一种工具。附图说明图1为质粒L4440的图谱。图2为秀丽隐杆线虫isp-1基因RNAi后对应基因mRNA表达量的变化。图3秀丽隐杆线虫isp-1基因RNAi后体内活性氧含量的变化。图4为PQ对isp-1基因RNAi后秀丽隐杆线虫寿命的影响。图5为NAC对isp-1基因RNAi后秀丽隐杆线虫寿命的影响。图6为PQ对isp-1基因RNAi后秀丽隐杆线虫运动能力的影响。图7为NAC对isp-1基因RNAi后秀丽隐杆线虫运动能力的影响。图8为PQ对isp-1基因RNAi后秀丽隐杆线虫抗热胁迫能力的影响。图9为NAC对isp-1基因RNAi后秀丽隐杆线虫抗热胁迫能力的影响。具体实施方式以下提供具体实施例以实现本发明所述的一种体内活性氧水平失调动物模型的试剂盒,但不限于这些实施例。1.生物材料(1)秀丽隐杆线虫株系:秀丽隐杆线虫野生型N2,购自CaenorhabditisGeneticsCenter(CGC)。(2)大肠杆菌:E.coliHT115(DE3),作为重组质粒的宿主细胞,CaenorhabditisGeneticsCenter(CGC);E.coliOP50,作为秀丽隐杆秀丽隐杆线虫正常的食物,购自CaenorhabditisGeneticsCenter(CGC)。(3)质粒载体:L4440(pPD129.36),RNAi质粒载体,购于Addgene。2.试剂(1)50×TAEBuffer:242gTris碱,57mL乙酸,100mL0.5mol/L的EDTA(pH8.0),用蒸馏水定容至1000mL,使用时根据要求用蒸馏水进行稀释。(2)1%琼脂糖粉:将1g琼脂糖粉溶于100mL1×TAEBuffer中,用微波炉加热,使琼脂糖粉完全溶解,室温冷却至60℃左右时加入适量溴化乙锭(EB),充分混匀后倒入胶槽,插入合适的梳子,待凝胶完全凝固后拔去梳子即可使用。(3)盐酸四环素(TetracyclineHydrochloride,Tet):水溶,过滤除菌,母液浓度为25mg/mL,-20℃避光保存(生工生物工程(上海)股份有限公司)。(4)氨苄青霉素(Ampicillin,Amp):水溶,过滤除菌,母液浓度为100mg/mL,-20℃避光保存(生工生物工程(上海)股份有限公司)。(5)CaCl2:水溶,高温高压(121℃,20min)灭菌,储存浓度为1mol/L,4℃保存。(6)限制性内切酶:BglII、XhoI、HindIII(购自TaKaRa公司)(7)T4连接酶(购自TaKaRa)(8)DL-2000DNAmaker和DL-10000DNAmaker(购自TaKaRa)(9)6×LoadingBuffer(购自TaKaRa)(10)胆固醇(Cholesterol):醇溶,过滤除菌,储存浓度为5mg/mL,4℃避光保存(天津市光复精细化工研究所)。(11)MgSO4:水溶,高温高压(121℃,20min)灭菌,储存浓度为1mol/L,室温保存。(12)S基础液:NaCl0.585g,K2HPO40.1g,KH2PO40.6g,用蒸馏水 定容至100mL。(13)半饱和KCl溶液:向适量体积的蒸馏水中加入过量KCl,充分搅拌,使溶液达到饱和状态,过滤上清,将滤液与蒸馏水按照1:1(v:v)的比例混匀,即为半饱和KCl溶液。(14)连二亚硫酸钠:保险粉,分子式:NaO2SSO2Na。(15)4%Na2CO3溶液:4gNa2CO3溶解于100mL蒸馏水中,室温保存。(16)2%NaOH溶液:0.8gNaOH溶解于100mL蒸馏水中,室温保存。(17)0.04mol/LCuSO4溶液:1g硫酸铜(CuSO4·5H2O)溶解于100ml蒸馏水中,室温保存。(18)0.1mol/L酒石酸钾溶液:2g酒石酸钾溶解于100ml蒸馏水中,室温保存。(19)Folin-Ciocalteu’s:福林酚试剂(生工生物工程(上海)股份有限公司)。(20)M9缓冲液:NaCl5g,Na2HPO46g,KH2PO43g,MgSO4·7H2O0.25g,用蒸馏水定容至1000mL。(21)碱性硫酸铜溶液:(A)将0.1mol/L酒石酸钾溶液和0.04mol/LCuSO4溶液等体积混合均匀,(B)将4%Na2CO3溶液和2%NaOH溶液等体积混合均匀,然后将(A)液和(B)液按照50:1(v:v)的比例混合即可。现配现用。3.试剂盒(1)基因组提取试剂盒(购自天根生化科技(北京)有限公司)(2)质粒DNA小量提取试剂盒(PlasmidMiniKitI,TaKaRa)(3)DNA胶回收试剂盒(AgaroseGelDNAFragmentRecoveryKit,购自TaKaRa)(4)总RNA提取试剂盒(RNAisoPlus,购自TaKaRa)(5)反转录试剂盒(PrimeScriptTMRTreagentKit,购自TaKaRa)(6)荧光实时定量PCR试剂盒(PremixExTaqTMII,购自TaKaRa)4.培养基(1)NGM(NematodeGrowthMedium)培养基:配制如下(500mL):NaCl1.52gKH2PO48.52gK2HPO41.15g胰蛋白胨1.36g琼脂粉8.58g配制方法:称取上述物质(除琼脂粉之外)于锥形瓶中,加入500mL蒸馏水,使各组分充分溶解,再加入琼脂粉。高温高压(121℃,20min)灭菌,分别加入1mol/L的MgSO4500μL,1mol/L的CaCl2500μL,5mg/mL的胆固醇500μL,充分摇匀,待瓶内泡沫消失后倒板。如需NGM(RNAi诱导)培养基,在NGM培养基经高温高压(121℃,20min)灭菌后,分别加入500μL1mol/L的MgSO4,500μL1mol/L的CaCl2,500μL5mg/mL的胆固醇,待培养基冷却至60-70℃时加入100mg/mLAmp母液至终浓度为100μg/mL,25mg/mLTet母液至终浓度为5μg/mL,1mol/LIPTG母液至终浓度为0.1mmol/L,充分摇匀,待瓶内泡沫消失后倒板。(2)LB(Luria-Bertani)培养基:配置如下(50mL)NaCl0.50g胰蛋白胨0.50g酵母膏0.25g配制方法:称取上述物质于锥形瓶中,加入50mL蒸馏水,使各组分充分溶解,用1mol/L的NaOH调节pH至7.0,高温高压(121℃,20min)灭菌,4℃保存。如需LB固体培养基,按1.6-1.8%(w:v)的比例加入AgarPowder即可。如需LB(Amp+Tet)液体培养基,在LB液体培养基经高温高压(121℃,20min)灭菌后,冷却至60-70℃时加入100mg/mLAmp母液至终浓度为100μg/mL,25mg/mLTet母液至终浓度为5μg/mL。4℃保存。如需LB(Amp+Tet)固体培养基,在LB固体培养基经高温高压(121℃,20min)灭菌后,冷却至60-70℃时加入100mg/mLAmp母液至终浓度为100μg/mL,25mg/mLTet母液至终浓度为5μg/mL,充分摇匀,待瓶内泡沫消失后倒板。5.主要仪器超净工作台(苏州净化设备有限公司);高压灭菌锅(上海申安医疗器械厂);电子天平(北京赛多利斯仪器系统有限公司);台式离心机(日立);恒温培养摇床(上海一恒科技有限公司);微量移液器(Eppendorf);PCR仪(ABI公司);水平电泳仪(Bio-Rad公司);凝胶成像系统(GE公司);超纯水仪(Millipore);恒温金属浴(北京鼎昊源科技有限公司);连续变倍体视显微镜(上海一恒科学仪器有限公司);紫外-可见分光光度计(上海精科);液态氧电极(Hansatech公司);荧光实时定量PCR仪(Bio-Rad公司);实施例1秀丽隐杆线虫体内活性氧水平失调动物模型的建立1.线粒体呼吸链isp-1基因RNAi克隆菌的构建(1)引物设计根据Wormbase数据库中的相关序列信息设计合成isp-1基因的特异性的 引物。具体序列如下:表1目的基因片段扩增引物isp-1基因的预期扩增产物长度为1074bp,其余为酶切位点。(2)秀丽隐杆线虫基因组DNA的提取用基因组提取试剂盒提取秀丽隐杆线虫基因组DNA。具体操作步骤详见试剂盒说明书。(3)isp-1基因片段的扩增使用表1中的引物,利用PCR技术从秀丽隐杆线虫基因组DNA中扩增isp-1基因的片段。PCR反应体系如下:表2扩增isp-1基因片段的PCR反应体系PCR的反应程序如下:94℃3min;之后进入PCR循环,具体为:94℃30s,55℃30s,72℃1min,总共进行30个cycles;72℃5min;4℃保存。1.0%的Agarosegel电泳鉴定PCR后得到的isp-1基因片段的纯度和浓度。(4)isp-1基因片段的双酶切使用BglII和XhoI限制性内切酶对上一步骤中得到的isp-1基因片段进行双酶切。isp-1基因双酶切体系如下:表3isp-1基因片段的双酶切体系37℃进行酶切2小时,将双酶切的产物进行1.0%的Agarosegel电泳,再用DNA胶回收试剂盒(AgaroseGelDNAFragmentRecoveryKit,TaKaRa)回收酶切产物片段。(5)质粒L4440的制备将带有L4440质粒的E.coliHT115(DE3)菌株在LB(Amp+Tet)固体培养基上划线,37℃培养16h,挑取平板上培养出的单菌落于5mlLB(Amp+Tet)液体培养基中,37℃,220rpm,震荡培养16h,用质粒DNA小量提取试剂盒(PlasmidMiniKitI,TaKaRa)提取质粒。将提取的pPD129.36(L4440)质粒进行双酶切。isp-1基因为连接对象,双酶切体系如下:表4与isp-1基因片段连接的质粒L4440的双酶切体系37℃进行酶切2小时,将双酶切的产物进行1.0%的Agarosegel电泳,用DNA胶回收试剂盒(AgaroseGelDNAFragmentRecoveryKit,TaKaRa)回收酶切产物中的目的基因片段。(6)isp-1基因片段和质粒的连接通过1.0%的Agarosegel电泳鉴定质粒和目的片段之间的摩尔数关系,双酶切后回收的载体片段与回收的目的基因片段之间的摩尔数比以1:10为宜,然后在连接酶的作用下将载体与isp-1基因片段连接。连接体系如下:表5连接体系16℃连接4h即完成连接,得到连接产物。(7)E.coliHT115(DE3)感受态细胞的制备参照《精编分子生物学实验指南》,制备感受态细胞,具体操作如下:1、取HT115(DE3)菌液1.5ml于离心管中,4℃4000rpm离心5min,弃上清,重复此过程两次。2、向留有沉淀的试管中加入预冷的0.1mol/L的CaCl2溶液800μL,清洗菌体,4℃4000rpm离心5min。3、彻底除去残液,向试管内加入预冷的0.1mol/L的CaCl2溶液200μl,悬浮菌体。即感受态细胞制备完成。(8)连接产物转化E.coliHT115(DE3)、筛选阳性克隆及其鉴定将10μL连接产物加入到200μL冰浴上放置的E.coliHT115(DE3)感受态细胞溶液中,42℃热激90s,然后迅速冰浴2min。向试管中加入800μLLB液体培养基,37℃,150rpm复苏1h,再将培养物涂到LB(Amp+Tet)固体平板上,37℃培养16h,之后挑单菌落于1mlLB液体(Amp+Tet)培养基中培养,37℃,220rpm,振荡培养5h,进行菌液PCR鉴定。将得到的菌液进行菌液PCR。PCR反应体系如下:表6菌液PCR验证体系PCR的反应程序如下:94℃5mim;之后进入PCR循环,具体为:94℃15s,55℃15s,72℃1min,总共进行30个cycles;72℃15min;4℃保存。将上述鉴定的PCR阳性克隆菌液用质粒DNA小量提取试剂盒(PlasmidMiniKitI,TaKaRa)提取质粒,然后对质粒进行双酶切验证。不同基因阳性克隆的质粒使用不同的限制性内切酶。isp-1基因酶切体系如下:表7经菌液PCR鉴定的isp-1阳性克隆的质粒酶切验证体系1.0%Agarosegel电泳鉴定,分子量大小与理论推断相符合,将样品送出测序,经blast在线比对,结果表明测序结果与已知的isp-1序列一致。即证明RNAi克隆菌(L4440-isp-1-HT115)构建完成。isp-1测序结果AGATATACGACTCCTATAGGGAGACCGGCAGATCTACGTCCAGAAGCGTCGTAGTGAGATCCGTGACAAGGGCAGTAATAACCTCCGTAATCTCCAGCATCGGCTGAAAATTCAAAATATGATTTCAAAAATTCAGGAGAAAAAAGACTGCATACCAATTGGGACACATCCAAGATGGGTGCACACTCCAATGACAACGGACCATTCATCTTTCTGCACACGTTCGTCGTCATGTTGTGGATGACGGAGATCGGCGACAGGGACGGCCTTTTCCTTGGCAATCTCAGCCTTGGTACGATGTTTGACGAAGACTGGCTTTCCACGCCATTCGAATGTCTTTGTTTTTCCTTCTGGAATATCAGCCATGTTGATTTCGATCGAAGCCAAGGCACGTTGATCAGCTGCCATAGCCTGGAAAAATTAATTTAAAAACGGTGTAATGGAAATTCAACATACTTTGTAAGAAACAAGAGTCTGTACAACTTCCTTTCCGGCCCACAAAGATAGAACTCCTCCAGCTGTAATAAAACAATGTTTAGACCGAATAAAAAATAATTCGAACCTCCATAATACAGAGCAGTTGGAAGAGCACGACGTTGATCCTCGGTGTCACGGGCTGGCACTTGAGTGTTCTTTGTAGAATCACGACGATAGTTTGACATATCGGGGAATGTCACATCAGTGTGAGCCAAACGGCGAGAGGTGACTTAAAAATTAATGAATTAATATATTAAATTCAATTTCAAATACCATTGATTCCCTTGACAGCAAGTCCATTGGTGAAGACACCTCCGGTGCTGTGACTAACAGCGGCTTGACGAGCTTCAGCCGTGGAGAACTCAGCTGGAACATCGCGGAAAGCAGCGACCTGGATACTAGACAATAAAATAATATTCTGCAACTTTAAATACTTACATTATCGGCGGCTGGTGTTGCGGCAACAAAGTTTACATGTTGCTGGGATCCGCTGATCTGAAAGAAAACTATTTATAAACTATTGGACAAATTTTAGAACTGTAATCGATATCTTAATCATTTCGACACCGTCCAGTGTTTTGGAACGAGAATAGTTTAAACAAATACATTTTAAACAAAATTTTCGAACCGCGCTCGAGGGGGGGCCCGGTACCCAATT CGCCCTAAAGTGGAGTCGAAT2.秀丽隐杆秀丽隐杆线虫体内活性氧水平失调动物模型的建立(1)秀丽隐杆线虫的同步化①挑选成熟的秀丽隐杆线虫至装有1mlM9液的2ml离心管中,4000rpm离心5分钟,去上清;②向离心管中加入500μL1M氢氧化钠,500μL6.4%(V/V)次氯酸钠,震荡裂解;③去掉上清,向沉淀中加入1.5μLM9液,摇匀,4000rpm离心5分钟,重复该步骤三次;④向洗净的卵中加入500μLM9液,18℃24小时孵化成L1期秀丽隐杆线虫。(2)秀丽隐杆线虫的RNAi处理使用NGM(RNAi诱导)培养基,在培养基表面均匀涂布RNAi克隆菌(L4440-isp-1-HT115),37℃培养16h,然后将同步化的L1期N2秀丽隐杆线虫定量接到涂有RNAi克隆菌的NGM(RNAi诱导)平板上(秀丽隐杆线虫以大肠杆菌作为唯一食物),20℃培养至成虫,即得到体内活性氧水平失调的动物。(3)秀丽隐杆线虫总RNA的提取收集经RNAi处理的秀丽隐杆线虫,用M9缓冲液清洗秀丽隐杆线虫3次,尽量除去秀丽隐杆线虫体壁附着的RNAi克隆菌。然后按照总RNA提取试剂盒(RNAisoPlus,TaKaRa)的说明书提取秀丽隐杆线虫的总RNA,取2μL所提的总RNA样品,加2μLddH2O,1μL6×LoadingBuffer,共5μL加入点样空,1.0%的Agarosegel电泳。将本步骤中验证的阳性克隆样品进行测序。经blast在线比对,结果表明 测序结果与已知的isp-1序列一致。(4)cDNA的合成按照反转录试剂盒(PrimeScriptTMRTreagentKit,TaKaRa)的说明书将(3)中提取的秀丽隐杆线虫总RNA反转录为cDNA。共两个反应,即去除基因组DNA反应和反转录反应,反应程序按照说明书进行。将得到的反转录产物cDNA放在4℃保存。如需长期保存,可放在-20℃。(5)引物设计通过Wormbase数据库(www.wormbase.org)检索C.elegans的isp-1及内参β-actin基因的序列,用PrimerPremier5.0,根据引物设计原则,设计引物。所设计的引物序列见表8。表8实时荧光定量PCR基因扩增引物(6)标准曲线和溶解曲线的验证将秀丽隐杆线虫cDNA以10倍稀释倍数稀释六个浓度,10-1,10-2,10-3,10-4,10-5,10-6,并以这些梯度cDNA作为模板,用isp-1及β-actin的引物,做荧光实时定量PCR,得到对应基因的标准曲线。反应体系为:表9实时荧光定量PCR反应体系实时荧光定量PCR反应程序如下:1)STAGE1,95℃预变性2min2)STAGE2,95℃变性10s3)STAGE3,50℃退火30sSTAGE2和STAGE3循环38次,并检测荧光;4)STAGE4,60℃升温至95℃,每3s升温0.5℃;分析溶解曲线,记录荧光值;5)STAGE5,95℃10s6)STAGE6,60℃30s7)STAGE7,4℃∞结果表明:所有基因的扩增效率均达到100%±10%,其标准曲线的R2值也达到了实验要求。isp-1及内参基因β-actin的溶解曲线均为单一对称峰,无引物二聚体,扩增反应特异性良好。(7)荧光实时定量PCR检测对应基因的表达量以(4)得到的cDNA为模板,荧光实时定量PCR检测对应基因的表达量。(8)isp-1基因的相对表达量以处理组的cDNA为模板进行荧光实时定量PCR。β-actin作为内参基因,2-△△Ct计算方法计算基因mRNA的相对表达量。△△Ct法计算公式为:相对含量%=2-△△Ct△Ct=CT待测样品-CT对照样品△△Ct=△Ct靶基因-△Ct内参基因利用荧光实时定量PCR的方法检测秀丽隐杆线虫isp-1基因RNAi的效率。秀丽隐杆线虫RNAi空载体组为阴性对照组,isp-1基因表达量与喂食E.coliOP50的空白组秀丽隐杆线虫相关基因表达量相比无明显变化,这说明饲喂带有空载体L4440的E.coliHT115菌并不影响秀丽隐杆线虫中isp-1的基因表达。从图2中可以看出,isp-1基因被沉默之后,其mRNA的表达量只有阴性对照组的19.76%,干扰效率达到了80.24%。实施例2体内活性氧水平失调动物模型试剂盒的装配本发明所述的体内活性氧水平失调动物模型试剂盒,所述试剂盒包括的材料为:①isp-1基因RNAi后的秀丽隐杆线虫;②NGM培养基;③大肠杆菌OP50。其中,所述秀丽隐杆线虫的浓度为100条/20μl,大肠杆菌OP50的浓度为10mg/ml。将以上试剂分装于合适的容器中,放置到外包试剂盒中,其中M9缓冲液、S缓冲液、LB培养基详细记载于使用说明书中。实施例3秀丽隐杆线虫体内活性氧水平失调模型的验证1.秀丽隐杆线虫mev-1基因RNAi后总活性氧含量的测定(1)秀丽隐杆线虫体内总活性氧含量的检测取实施例1构建的体内活性氧水平失调的动物模型,用M9缓冲液清洗秀丽隐杆线虫3次,尽量洗去秀丽隐杆线虫虫体上的RNAi克隆菌。将每个处理组的秀丽隐杆线虫用S基础液进行稀释,使每20μL中含有25条秀丽隐杆线虫,将每个处理组的稀释好的秀丽隐杆线虫液准确转移至底透384微孔板中,每个 孔加40μL秀丽隐杆线虫液,每个处理组做3个复孔,然后在避光条件下加活性氧荧光染料H2DCF-DA,染料浓度为50mmol/L,每个孔准确加入10μL。暗室反应15min后,用荧光酶标仪检测每个孔的荧光强度,激发波长为504nm,发射波长为529nm,检测温度为28℃。秀丽隐杆线虫RNAi空载体组为阴性对照组,按上面方法做同样处理,测定总活性氧含量。(2)秀丽隐杆线虫isp-1基因RNAi后体内总活性氧含量的变化用ROS荧光探针H2DCF-DA检测秀丽隐杆线虫体内总活性氧含量的变化,结果如图3所示:isp-1基因被干扰之后,秀丽隐杆线虫体内活性氧含量显著降低(p<0.05)。实施例4体内活性氧水平失调动物模型试剂盒的使用方法和可靠性验证体内活性氧水平失调相关疾病研究的一个重要内容是筛选出能够回调体内活性氧水平的新化合物,这些化合物具有成为治疗体内活性氧水平失调相关疾病的潜力。本实施例就验证了体内活性氧水平失调动物模型试剂盒在这方面的应用。本实施例以抗氧化剂N-乙酰-L-半胱氨酸、氧化剂百草枯作为供试样品验证体内活性氧水平失调动物模型试剂盒的可靠性。1.试剂1)抗氧化剂:N-乙酰-L-半胱氨酸(N-Acetyl-L-cysteine,NAC):水溶,过滤除菌,储存浓度为1mol/L,-20℃避光保存(购自梯希爱(上海)化成工业发展有限公司)。2)氧化剂:百草枯(Paraquat,PQ):水溶,过滤除菌,储存浓度为50mmol/L,-20℃避光保存(购自Sigma公司)。1.实验方法:(1)PQ及NAC对RNAi后秀丽隐杆线虫寿命的影响将isp-1基因RNAi后的秀丽隐杆线虫用镍铬丝挑针分别转移到NGM(0.1mmol/LPQ),NGM(0.5mmol/LPQ),NGM(0.4mmol/LNAC),NGM(2.0mmol/LNAC)和NGM培养基上,不含有待测化合物的NGM培养基平板作为空白对照组,每块平板上接种25条isp-1基因RNAi后的秀丽隐杆线虫,待测化合物组与空白对照组均设置3个平行,每天计数待测化合物组与空白对照组的秀丽隐杆线虫的存活条数,直至平板上所有的秀丽隐杆线虫全部死亡,计算待测化合物组与空白对照组中秀丽隐杆线虫的寿命。为防止世代交替,在线虫产卵期期间每隔一天将秀丽隐杆线虫挑到新的处理板上。计算待测化合物组与空白对照组中秀丽隐杆线虫的寿命。同时设定L4440组,L4440组接入的秀丽隐杆线虫为转入空载体L4400(不含有isp-1基因片段)的N2秀丽隐杆线虫,将含有空载体L4400的N2秀丽隐杆线虫接入到NGM培养基(不含有待测物)上,其他操作同上。用SPSS软件进行Kaplan-Meier寿命分析,抗氧化剂NAC对isp-1RNAi后线虫的寿命无显著影响(p>0.05);氧化剂PQ可使isp-1RNAi秀丽隐杆线虫的寿命显著延长(p<0.05),两两比较(PairwiseComparisons)比较结果如下:表10PQ处理isp-1基因RNAi后秀丽隐杆线虫寿命结果两两比较L4440isp-1RNAiisp-1RNAi+0.1PQisp-1RNAi+0.5PQL4440isp-1RNAip=0.035isp-1RNAi+0.1PQp=0.000p=0.022isp-1RNAi+0.5PQp=0.000p=0.005p=0.925从表10中可以看出,isp-1RNAi处理组秀丽隐杆线虫的寿命明显大于L4440组,该结果与已有文献中的报道相符合。用PQ处理isp-1RNAi后的秀丽隐杆线虫,秀丽隐杆线虫的寿命相比isp-1RNAi处理组显著延长(p<0.05),在一定浓度范围内,这种作用与PQ的浓度呈现正相关。秀丽隐杆线虫经过isp-1RNAi处理之后,其中位生存时间和平均寿命都有所增加;PQ(0.1mmol/L和0.5mmol/L)能进一步延长isp-1RNAi秀丽隐杆线虫的中位生存时间和平均寿命。如表11所示,PQ(0.1mmol/L)使isp-1RNAi秀丽隐杆线虫的中位生存时间和平均寿命延长了30.0%和23.8%;PQ(0.5mmol/L)使isp-1RNAi线虫的中位生存时间和平均寿命大约延长了40.0%和29.7%。表11PQ作用isp-1基因RNAi秀丽隐杆线虫后寿命的中位生存时间和平均寿命组别中位生存时间平均寿命L44408.0±0.98.2±0.5isp-1RNAi10.0±1.210.1±0.7isp-1RNAi+0.1PQ13.0±0.912.5±0.8A%130.0123.8isp-1RNAi+0.5PQ14.0±0.813.1±0.7B%140.0129.7A%=(isp-1RNAi+0.1PQ)/isp-1RNAi;B%=(isp-1RNAi+0.5PQ)/isp-1RNAi(2)PQ及NAC对RNAi后秀丽隐杆线虫运动能力的影响将经过isp-1RNAi处理的N2成虫用镍铬丝挑针分别转移到NGM(0.1mmol/LPQ),NGM(0.5mmol/LPQ),NGM(0.4mmol/LNAC),NGM(2.0mmol/LNAC)和NGM培养基上,计数10日龄成虫的运动能力。运动能力的评价分为MotionA和MotionB两个等级,其中MotionA为线虫表现非常活跃,运动 轨迹呈正常的正弦曲线;MotionB为线虫在培养基上行动缓慢,用镍铬丝轻触线虫身体,线虫只是头部摆动。从图6和图7中可以看出,isp-1基因被干扰的线虫与L4440对照组相比,其运动能力倾向于正常。用PQ(0.1mmol/L和0.5mmol/L)处理干扰后的线虫,发现其运动能力相对干扰组的线虫倾向于提高。用NAC处理isp-1基因被干扰的线虫,各处理组之间没有明显变化,但是随着NAC浓度的升高,isp-1基因被干扰的线虫的运动能力有减弱的趋势。(3)PQ及NAC对RNAi后秀丽隐杆线虫抗热胁迫能力的影响将经过isp-1RNAi处理的N2成虫用镍铬丝挑针分别转移到NGM(0.1mmol/LPQ),NGM(0.5mmol/LPQ),NGM(0.4mmol/LNAC),NGM(2.0mmol/LNAC)和NGM培养基上,3天之后将线虫转移至35℃,8小时之后,每隔半小时观察对照组线虫的存活率,当对照组线虫的死亡率大于50%时,开始计数其他所有组别线虫的死亡率。每个处理组设3个平行,每个平行统计30条线虫。实验过程中,isp-1RNAi各处理组线虫的热胁迫时间为16.5h,此时L4440对照组的线虫已全部死亡,所以在图5中没有显示L4440对照组的结果。如图8和图9所示,PQ对isp-1基因被干扰的秀丽隐杆线虫抗热胁迫能力没有显著影响(p>0.05),而高浓度的NAC对isp-1基因被干扰的秀丽隐杆线虫抗热胁迫能力产生负影响。用PQ处理之后,发现线虫的寿命比空白对照组有所延长,在一定浓度范围内,线虫的寿命与PQ浓度成正相关,线虫第十天运动能力在PQ的作用下相比对照组也有增强的趋势,抗热胁迫能力也有所改进。用NAC处理之后,发现线虫的寿命相比对照组无明显变化,第十天运动能力随NAC浓度的升高有减弱的趋势。实验结果验证了PQ对体内活性氧水平异常的治疗效果,同时也证明了本发明公开的试剂盒的可靠性,能够用于筛选治疗体内活性氧水平失调相关疾病的药物。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1