用于肿瘤的Her-2多肽、组合物及制备方法和应用与流程
本发明涉及蛋白多肽领域,具体涉及一类用于肿瘤的her-2多肽、包含her-2多肽的组合物及其制备方法和应用,进一步来说应用于制备或治疗前列腺癌、淋巴癌、肺癌特别是乳腺癌等相关疾病或者相关药物。
背景技术:
her-2/neu基因于1985年首次被slamon和alex发现,1987年slamon等首次指出her-2/neu基因过度表达与乳腺癌复发及生存率有关,her-2/neu被确认为是一种新的肿瘤标记物(slamondj,clarkgm,wongsg,etal.science,1987,235(4785):177-82)。
her-2/neu是一种原癌基因,主要在胚胎发育时开始表达,成年后正常组织可检测到少量表达。人类许多肿瘤,如20%-30%的乳腺癌、20%的软巢癌、非小细胞肺癌、胃癌、口腔癌等,常因her-2/neu基因扩增和(或)转录异常而导致p185her2过度表达,这与肿瘤的复发、转移和生存期短密切相关。对26例骨肉瘤患者的研究发现,虽无her-2/neu的扩增和突变,但有42%的患者表达her-2/neu,这种表达与早期转移和低存活有关,说明her-2/neu基因在肿瘤的发生与发展中起重要作用。
热休克蛋白gp-96是一种高度保守和呈单态性的蛋白质,是内质网中最丰富的蛋白质之一。gp-96具有分子伴侣功能,能够和细胞内的许多抗原肽非共价结合。gp-96是抗原提呈的重要蛋白质。有研究表明,gp-96参与mhci类抗原的提呈途径。动物实验亦证实,应用从肿瘤细胞中分离的gp-96制备免疫小鼠可产生抗相应肿瘤的特异性保护性细胞免疫应答。人粒细胞-巨噬细胞集落刺激因子(rhgm-csf)是一种14kd的糖蛋白细胞因子,为造血祖细胞体外生存、增值与分化所必需的。实验表明rhgm-csf能显著提高抗肿瘤和促进骨髓造血的作用。her-2/neu是研制单克隆抗体治疗乳腺癌的一个重要的靶标分子。目前国际上已有两种针对her-2/neu的单克隆抗体被广泛用于her-2/neu阳性乳腺癌的治疗,可以单独应用或与化疗药联合应用。
技术实现要素:
本发明所解决的现有技术的问题是:现有肿瘤疫苗存在表位不一、免疫原性不强及治疗效果不好的缺点。
本发明的目的是提供一类her-2多肽及含有her-2多肽的组合物,能够诱发免疫应答,攻击肿瘤细胞。此类化合物可增强细胞免疫系统从而攻击并阻止肿瘤细胞的增长和扩散,或癌症的增长和扩散。
具体而言,本发明提供了如下技术方案:
本发明提供了一种用于肿瘤细胞的her-2多肽,所述her-2多肽的序列选自以下序列中的一种:
seqidno.1,seqidno.2,seqidno.3,seqidno.4。
优选的,所述的her-2多肽为天然氨基酸或经保护基团修饰的氨基酸。
优选的,所述的保护基团选自叔丁氧羰基、氧叔丁基、叔丁基、三苯甲基、2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基、烯丙基中的一种或几种以上。
优选的,所述的her-2多肽包括链状多肽或环状多肽。
优选的,所述的环状多肽为分子内成环,其成环方式选自s-s、co-s、co-nh键中的一种或几种。
本发明还提供了一种用于肿瘤细胞的her-2多肽的制备方法,包括如下步骤:
(1)采用固相合成法,依照her-2多肽的连接次序在偶联剂和反应溶剂的作用下,依次进行氨基酸的偶联,合成具有全保护的her-2多肽;
(2)裂解得到her-2多肽。
优选的,所述偶联剂选自以下几种组合中的一种:(1)n,n′-二异丙基碳二亚胺和1-羟基苯并三唑,
(2)六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷、1-羟基苯并三唑和n,n′-二异丙基乙胺,
(3)2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和n,n′-二异丙基乙胺,
(4)六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷、1-羟基苯并三唑和n-甲基吗啡啉,
(5)2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和n-甲基吗啡啉;
所述反应溶剂选自n,n′-二甲基甲酰胺、二氯甲烷、n-甲基吡咯烷酮、二甲基亚砜中的一种或几种以上。
同时,本发明还提供了一种用于肿瘤细胞的组合物,所述组合物含有her-2多肽,还含有选自以下蛋白中的一种或几种以上:gp-96蛋白、rhgm-csf蛋白或针对her-2/neu的单克隆抗体。
优选的,所述her-2多肽的序列选自以下序列中的一种:
seqidno.1,seqidno.2,seqidno.3,seqidno.4。
优选的,所述her-2多肽与所述gp-96蛋白的质量比为0.5:1~2:1。
更优选的,所述her-2多肽与所述gp-96蛋白的质量比为1:1。
优选的,所述her-2多肽与所述rhgm-csf蛋白的质量比为0.5:1~2:1。
更优选的,所述her-2多肽与所述rhgm-csf蛋白的质量比为1:1。
优选的,所述her-2多肽与所述针对her-2/neu的单克隆抗体质量比为0.5:1~2:1。
更优选的,所述her-2多肽与所述针对her-2/neu的单克隆抗体的质量比为1:1。
优选的,所述的针对her-2/neu的单克隆抗体选自曲妥珠单抗或帕妥珠单抗中的一种。
优选的,所述组合物为疫苗组合物。
本发明还提供了一种药物组合物,该药物组合物包含有效量的游离形式或可药用盐形式的以上任一项所述的her-2多肽或以上任一项所述的组合物作为活性成分,还包含一种或多种药用载体物质和/或稀释剂。
其中,本发明用到的药学上可接受的盐包括盐酸盐、氢溴酸盐、硫酸盐、磷酸盐、硝酸盐以及醋酸盐、草酸盐或酒石酸盐、其中优选醋酸盐。
同时,本发明还提供了以上任一项所述的her-2多肽、或以上任一项所述的疫组合物、或所述的药物组合物在用于制备预防和/或治疗抗癌症药物中的用途。
以上任一项所述的her-2多肽、或以上任一项所述的组合物、或所述的药物组合物在用于预防和/或治疗癌症领域中的用途。
优选的,所述的癌症包括乳腺癌、前列腺癌、淋巴癌、肺癌,优选为乳腺癌。
本发明取得的有益效果为:本发明通过her-2/neu原癌基因家族的研究发现一系列多肽,将其单独或者与gp-96蛋白、rhgm-csf蛋白等联用,得到的疫苗组合物,能够刺激细胞毒性t淋巴细胞(ctl)来破坏癌细胞,用作预防和治疗肿瘤或癌症的药物,特别适用于乳腺癌。本发明的her-2多肽或者含有her-2多肽的组合物对于制备疗效更为显著、副作用更低的治疗癌症及其相关疾病的药物将是有用的。
附图说明
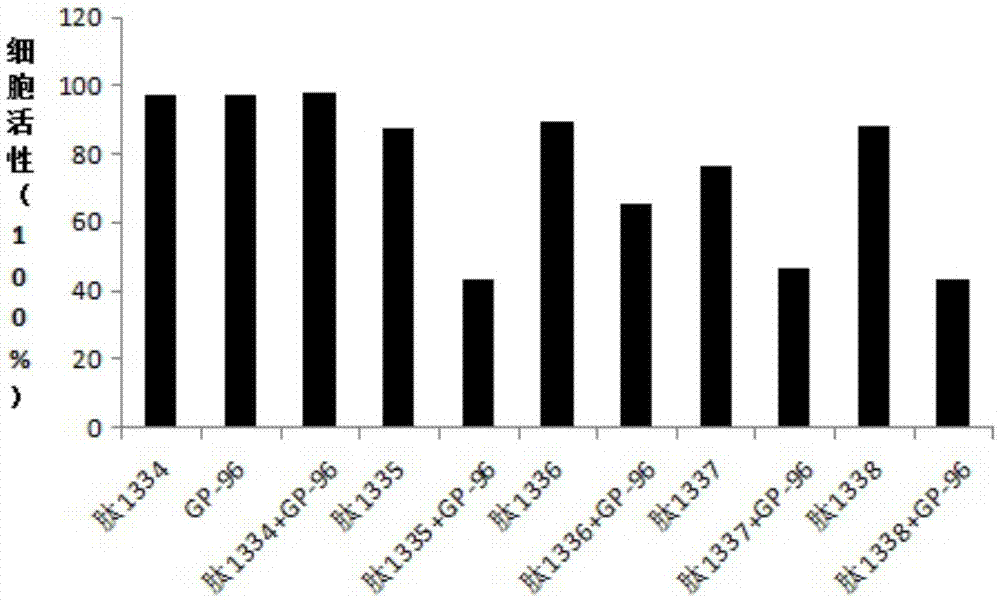
图1为her2-gp96诱导的细胞毒性t细胞(ctl)体外对raji的杀伤活性图。
图2为her2-gp96诱导的细胞毒性t细胞(ctl)体外对mcf-7的杀伤活性图。
图3为her2-gp96诱导的细胞毒性t细胞(ctl)体外对pc3的杀伤活性图。
图4为her2-gp96诱导的细胞毒性t细胞(ctl)体外对sbc-5的杀伤活性图。
图5为her2-gp96诱导的细胞毒性t细胞(ctl)体外对hek293的杀伤活性图。
具体实施方式
如上所述,本发明的目的在于:提供一种用于肿瘤的her-2多肽,含有her-2多肽的组合物及其制备方法和应用。
其中,在本发明的一种优选实施方式中,本发明提供了一种用于肿瘤的her-2多肽,其序列为seqidno.1。
在本发明的另一种优选实施方式中,本发明提供了一种用于肿瘤的her-2多肽,其序列为seqidno.2。
在本发明的又一种优选实施方式中,本发明提供了一种用于肿瘤的her-2多肽,其序列为seqidno.3。
在本发明的再一种优选实施方式中,本发明提供了一种用于肿瘤的her-2多肽,其序列为seqidno.4。
同时,本发明还提供了一种组合物,其含有以上任一序列的her-2多肽和gp-96蛋白。
以上所述的her-2多肽或者组合物可以用于治疗肿瘤相关的疾病或者用于制备同肿瘤相关的药物,尤其是淋巴癌、乳腺癌、前列腺癌和肺癌。
本发明所述her-2短肽来源于her-2/neu原癌基因家族序列,通过计算机分析her-2/neu原癌基因家族序列,进行辅助筛选获得长度为16肽的her-2短肽,通过进一步研究发现上述多肽与gp-96蛋白、rhgm-csf蛋白或针对her-2/neu的单克隆抗体等的联用在抑制肿瘤细胞的增长和扩散上具有高活性,her-2短肽序列如下:
seqidno.1:srmardpqrfvviqne;
seqidno.2:cahykdppfcvarcps;
seqidno.3:yglgmehlrevravts;
seqidno.4:avenpeyltpqggaap;
本发明中一些常用的缩写具有以下含义;
fmoc:芴甲氧羰基
fmoc-aa:芴甲氧羰基保护的氨基酸
dic:n,n′-二异丙基碳二亚胺
dcc:n,n′-二环己基碳二亚胺
pybop:六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷
hatu:2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯
hobt:1-羟基苯并三唑
tbu:叔丁基
otbu:氧叔丁基
trt:三苯甲基
otbu:叔丁氧基
pbf:2,2,4,6,7-五甲基二氢苯并呋喃-5-磺酰基
ser:丝氨酸
arg:精氨酸
met:蛋氨酸
ala:丙氨酸
asp:天冬氨酸
pro:脯氨酸
gln:谷氨酰胺
phe:苯丙氨酸
val:缬氨酸
ile:异亮氨酸
asn:天冬酰胺
glu:谷氨酸
dmf:n,n′-二甲基甲酰胺
meoh:甲醇
dcm:二氯甲烷
nmp:n-甲基吡咯烷酮
dmso:二甲基亚砜
tfa:三氟醋酸
piperidine:六氢吡啶
dmap:4-二甲氨基吡啶
diea:n,n′-二异丙基乙胺
tmp:2,4,6-三甲基吡啶。
为此本发明提供了her-2短肽的合成方法,其步骤如下:
步骤1,在活化剂系统的存在下,由树脂固相载体和fmoc-glu(otbu)-oh偶联得到fmoc-glu(otbu)-树脂;
步骤2,通过固相合成法,按照her-2/neu原癌基因家族序列肽主链肽序依次偶联具有n端fmoc保护且侧链保护的氨基酸;
步骤3,裂解,纯化,冻干,得到her-2/neu原癌基因家族序列肽及其类似物。
其中,步骤1所述树脂固体载体采用2-ctc树脂,所述活化剂系统选自diea、tmp或nmm,所述fmoc-glu(otbu)-树脂为0.30~0.70mmol/g取代度的fmoc-glu(otbu)-ctc树脂,可以自己合成,也可以直接通过购买得到。
其中,步骤1所述树脂固体载体采用王树脂,所述活化剂系统由dic、hobt和dmap组成,所述fmoc-glu(otbu)-树脂为0.30~0.70mmol/g取代度的fmoc-glu(otbu)-王树脂,可以自己合成,也可以直接通过购买得到。
其中,步骤2所述的固相合成方法,
1)采用由体积比为1:4的哌啶和dmf组成的去保护液脱除fmoc-glu(otbu)-树脂上的fmoc保护基,得到h-glu(otbu)-树脂;
2)在偶联剂系统的存在下,h-glu(otbu)-树脂和fmoc保护且侧链保护的天冬酰胺偶联得到fmoc-asn(trt)-glu(otbu)-树脂;
3)重复步骤1)、2),按照her-2/neu原癌基因家族序列肽主链肽序依次进行氨基酸的偶联,偶联氨基酸顺序为:
fmoc-gln(trt)-oh、fmoc-ile-oh、fmoc-val-oh、fmoc-val-oh、
fmoc-phe-oh、fmoc-arg(pbf)-oh、fmoc-gln(trt)-oh、fmoc-pro-oh、fmoc-asp(otbu)-oh、fmoc-arg(pbf)-oh、fmoc-ala-oh、fmoc-met-oh、fmoc-arg(pbf)-oh、fmoc-ser(tbu)-oh;
所述偶联剂系统包括缩合剂和反应溶剂,所述偶联剂包括缩合剂和反应溶剂,所述缩合剂选自以下几种组合中的一种:(1)n,n′-二异丙基碳二亚胺和1-羟基苯并三唑,
(2)六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷、1-羟基苯并三唑和n,n′-二异丙基乙胺,
(3)2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和n,n′-二异丙基乙胺,
(4)六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷、1-羟基苯并三唑和n-甲基吗啡啉,
(5)2-(7-偶氮苯并三氮唑)-n,n,n',n'-四甲基脲六氟磷酸酯和n-甲基吗啡啉;
所述反应溶剂选自n,n′-二甲基甲酰胺、二氯甲烷、n-甲基吡咯烷酮、二甲基亚砜中的一种或几种以上。
所述的疫苗组合物,其中her-2短肽与gp-96蛋白、rhgm-csf蛋白或针对her-2/neu的单克隆抗体的含量比例为1:1。
下面结合附图和具体的实施例对本发明作进一步的详细的说明。但是,这些实施例仅是用于说明本发明,而不是对本发明范围的限制。
其中,本发明中实施例中所用的试剂均为本领域常规的市售试剂和仪器的厂商型号如下:
fmoc保护氨基酸原料、2-ctc树脂和王树脂均为常规的市售试剂,购自吉尔生化(上海)有限公司,化学纯;
氨基酸树脂,购自吉尔生化(上海)有限公司;
二甲基甲酰胺,购自浙江江山化工股份有限公司;
dic,购自淄博天堂山化工有限公司;
hobt,购自苏州昊帆生物科技有限公司;
n,n’-二异丙基乙胺(diea),购自苏州吴帆生物科技有限公司;
质谱仪,型号maldi-tof4700,厂商absciex;
制备型高效液相色谱仪,型号lc3000,厂商北京创新通恒科技有限公司。
实施例中提到的真空干燥和冷冻干燥用到的冻干设备型号及生产厂家说明如下:
冻干设备:冻干机fd-3(北京博医康实验仪器有限公司);
冻干条件:将冻干盘放入冰箱冷冻室(-20℃)中,预冻6h。开启冻干机,打开制冷,预冷30min以上,设置冻干曲线如下:
第一段:在-27℃运行16h;第二段:在-5℃运行4h;第三段:在5℃运行2h;第四段:在30℃运行16h。
(一)her2短肽的制备
实施例一
seqidno.1:
h-ser-arg-met-ala-arg-asp-pro-gln-arg-phe-val-val-ile-gln-asn-glu-oh的合成
(1)称取0.1mmol取代度为0.61mmol/g的fmoc-glu(otbu)-ctc树脂,加入固相反应柱中,用dmf洗涤1次,用dmf溶胀fmoc-glu(otbu)-ctc树脂30分钟后,用dmf:吡啶体积比为4:1的混合溶液脱去fmoc保护,然后用dmf洗涤6次,称取fmoc-asn(trt)-oh0.5mmol、hobt0.5mmol,加入体积比为1:1的dcm和dmf混合溶液,冰水浴下加入80μldic(0.5mmol)活化后,加入上述装有树脂的反应柱中,室温下反应2小时后,以茚三酮法检测判断反应终点,如果树脂无色透明,则表示反应完全;树脂显色,则表示反应不完全,需要再反应1小时,此判断标准适用于后续氨基酸偶联中以茚三酮法检测判断反应终点。
(2)重复上述脱除fmoc保护和加入相应氨基酸偶联的步骤,依次完成fmoc-gln(trt)-oh、fmoc-ile-oh、fmoc-val-oh、fmoc-val-oh、fmoc-phe-oh、fmoc-arg(pbf)-oh、fmoc-gln(trt)-oh、fmoc-pro-oh、fmoc-asp(otbu)-oh、fmoc-arg(pbf)-oh、fmoc-ala-oh、fmoc-met-oh、fmoc-arg(pbf)、fmoc-ser(tbu)-oh的偶联。偶联完毕,将肽树脂用dmf洗涤3次,dcm洗涤3次,meoh洗涤3次,dcm洗涤3次,meoh洗涤3次,抽干得到0.527g粗肽树脂。
(3)裂解:称取0.527g全保护的肽树脂,加入到25ml的三口圆底烧瓶中,按tfa:苯甲醚:苯甲硫醚=95:3:2的体积比配置裂解液10ml,将裂解液加入上述树脂中,室温反应2小时,过滤,用少量tfa洗涤裂解后的树脂3次,合并滤液,浓缩,将浓缩后的液体加入到冰乙醚中沉淀1小时,离心,无水乙醚离心洗涤6次,真空干燥,得到粗肽182.7mg。
(4)纯化:将粗肽用50ml水溶解后。而后通过c18柱2次纯化、转盐、冷冻干燥后得到目标产物(16.9mg,8.68%),用maldi-tof分析产物,发现质子化的分子离子峰的m/z值为1945.87(理论量为1945)。其中c18柱具体的纯化条件:第一次纯化条件:流动相为:a相:0.1%tfa;b相:乙腈,检测波长220nm,收集目的峰馏分。第二次纯化条件:流动相为:a相:0.3%乙酸;b相:乙腈。检测波长220nm,收集目的峰馏分。转盐操作:转盐条件:流动相:a相:20mm乙酸铵-水溶液;b相:乙腈;检测波长220nm。收集目的峰馏分,旋蒸浓缩,冻干得到目标产物。
实施例二
seqidno.2:
h-cys-ala-his-tyr-lys-asp-pro-pro-phe-cys-val-ala-arg-cys-pro-ser-oh的合成
(1)称取0.1mmol取代度为0.57mmol/g的fmoc-ser(tbu)-ctc树脂,加入固相反应柱中,用dmf洗涤1次,用dmf溶胀fmoc-ser(tbu)-ctc树脂30分钟后,用dmf:吡啶体积比为4:1的混合溶液脱去fmoc保护,然后用dmf洗涤6次,称取fmoc-pro-oh0.5mmol、hobt0.5mmol加入体积比为1:1的dcm和dmf混合溶液,冰水浴下加入80μldic(0.5mmol)活化后,加入上述装有树脂的反应柱中,室温下反应2小时后,以茚三酮法检测判断反应终点,如果树脂无色透明,则表示反应完全;树脂显色,则表示反应不完全,需要再反应1小时,此判断标准适用于后续氨基酸偶联中以茚三酮法检测判断反应终点。
(2)重复上述脱除fmoc保护和加入相应氨基酸偶联的步骤,依次完成fmoc-cys(trt)-oh、fmoc-arg(pbf)-oh、fmoc-ala-oh、fmoc-val-oh、fmoc-cys(trt)-oh、fmoc-phe-oh、fmoc-pro-oh、fmoc-pro-oh、fmoc-asp(otbu)-oh、fmoc-lys(boc)-oh、fmoc-tyr(tbu)-oh、fmoc-his(trt)-oh、fmoc-ala-oh、fmoc-cys(trt)-oh的偶联。偶联完毕,将肽树脂用dmf洗涤3次,dcm洗涤3次,meoh洗涤3次,dcm洗涤3次,meoh洗涤3次,抽干得到0.578g粗肽树脂。
(3)称取0.578g全保护的肽树脂,加入到25ml的三口圆底烧瓶中,按tfa:苯甲醚:苯甲硫醚=95:3:2的体积比配置裂解液10ml,将裂解液加入上述树脂中,室温反应2小时,过滤,用少量tfa洗涤裂解后的树脂3次,合并滤液,浓缩,将浓缩后的液体加入到冰乙醚中沉淀1小时,离心,无水乙醚离心洗涤6次,真空干燥,得到粗肽164.7mg。
(4)将粗肽用50ml水溶解后。而后通过c8柱2次纯化、转盐、冷冻干燥后得到目标产物(17.8mg,9.92%),用maldi-tof分析产物,发现质子化的分子离子峰的m/z值为1793.95(理论量为1793)。
实施例三
seqidno.3:
h-tyr-gly-leu-gly-met-glu-his-leu-arg-glu-val-arg-ala-val-thr-ser-oh的合成
(1)称取0.1mmol取代度为0.65mmol/g的fmoc-ser(tbu)-ctc树脂,加入固相反应柱中,用dmf洗涤1次,用dmf溶胀fmoc-ser(tbu)-ctc树脂30分钟后,用dmf:吡啶体积比为4:1的混合溶液脱去fmoc保护,然后用dmf洗涤6次,称取fmoc-thr(tbu)-oh0.5mmol、hobt0.5mmol加入体积比为1:1的dcm和dmf混合溶液,冰水浴下加入80μldic(0.5mmol)活化后,加入上述装有树脂的反应柱中,室温下反应2小时后,以茚三酮法检测判断反应终点,如果树脂无色透明,则表示反应完全;树脂显色,则表示反应不完全,需要再反应1小时,此判断标准适用于后续氨基酸偶联中以茚三酮法检测判断反应终点。
(2)重复上述脱除fmoc保护和加入相应氨基酸偶联的步骤,依次完成fmoc-val-oh、fmoc-ala-oh、fmoc-arg(pbf)-oh、fmoc-val-oh、fmoc-glu(otbu)-oh、fmoc-arg(pbf)-oh、fmoc-leu-oh、fmoc-his(trt)-oh、fmoc-glu(otbu)-oh、fmoc-met-oh、fmoc-gly-oh、fmoc-leu-oh、fmoc-gly-oh、fmoc-tyr(tbu)-oh的偶联。偶联完毕,将肽树脂用dmf洗涤3次,dcm洗涤3次,meoh洗涤3次,dcm洗涤3次,meoh洗涤3次,抽干得到0.578g粗肽树脂。
(3)称取0.578g全保护的肽树脂,加入到25ml的三口圆底烧瓶中,按tfa:苯甲醚:苯甲硫醚=95:3:2的体积比配置裂解液10ml,将裂解液加入上述树脂中,室温反应2小时,过滤,用少量tfa洗涤裂解后的树脂3次,合并滤液,浓缩,将浓缩后的液体加入到冰乙醚中沉淀1小时,离心,无水乙醚离心洗涤6次,真空干燥,得到粗肽164.7mg。
(4)将粗肽用50ml水溶解后。而后通过c18或c8柱2次纯化、转盐、冷冻干燥后得到目标产物(17.8mg,9.92%),用maldi-tof分析产物,发现质子化的分子离子峰的m/z值为1793.95(理论量为1793)。
实施例四
seqidno.4:
h-ala-val-glu-asn-pro-glu-tyr-leu-thr-pro-gln-gly-gly-ala-ala-pro-oh的合成
(1)称取0.1mmol取代度为0.63mmol/g的fmoc-pro-ctc树脂,加入固相反应柱中,用dmf洗涤1次,用dmf溶胀fmoc-pro-ctc树脂30分钟后,用dmf:吡啶体积比为4:1的混合溶液脱去fmoc保护,然后用dmf洗涤6次,称取fmoc-ala-oh0.5mmol、hobt0.5mmol加入体积比为1:1的dcm和dmf混合溶液,冰水浴下加入80μldic(0.5mmol)活化后,加入上述装有树脂的反应柱中,室温下反应2小时后,以茚三酮法检测判断反应终点,如果树脂无色透明,则表示反应完全;树脂显色,则表示反应不完全,需要再反应1小时,此判断标准适用于后续氨基酸偶联中以茚三酮法检测判断反应终点。
(2)重复上述脱除fmoc保护和加入相应氨基酸偶联的步骤,依次完成fmoc-ala-oh、fmoc-gly-oh、fmoc-gly-oh、fmoc-gln(trt)-oh、fmoc-pro-oh、fmoc-thr(tbu)-oh、fmoc-leu-oh、fmoc-tyr(tbu)-oh、fmoc-glu(otbu)-oh、fmoc-pro-oh、fmoc-asn(trt)-oh、fmoc-glu(otbu)-oh、fmoc-val-oh、fmoc-ala-oh的偶联。偶联完毕,将肽树脂用dmf洗涤3次,dcm洗涤3次,meoh洗涤3次,dcm洗涤3次,meoh洗涤3次,抽干得到0.596g粗肽树脂。
(3)称取0.596g全保护的肽树脂,加入到25ml的三口圆底烧瓶中,按tfa:苯甲醚:苯甲硫醚=95:3:2的体积比配置裂解液10ml,将裂解液加入上述树脂中,室温反应2小时,过滤,用少量tfa洗涤裂解后的树脂3次,合并滤液,浓缩,将浓缩后的液体加入到冰乙醚中沉淀1小时,离心,无水乙醚离心洗涤6次,真空干燥,得到粗肽172.3mg。
(4)将粗肽用50ml水溶解后。而后通过c18或c8柱2次纯化、转盐、冷冻干燥后得到目标产物(16.1mg,9.98%),用maldi-tof分析产物,发现质子化的分子离子峰的m/z值为1613.75(理论量为1613)。
实施例五
通过计算机模拟筛选出评分最差的多肽,将其作为对照品,其序列为seqidno.5,其中seqidno.5:
h-asn-pro-leu-val-lys-ser-pro-asn-gly-val-lys-ile-ser-asp-phe-trp-oh(对照品)的合成
(1)称取0.1mmol取代度为0.60mmol/g的fmoc-trp(boc)-ctc树脂,加入固相反应柱中,用dmf洗涤1次,用dmf溶胀fmoc-trp(boc)-ctc树脂30分钟后,用dmf:吡啶体积比为4:1的混合溶液脱去fmoc保护,然后用dmf洗涤6次,称取fmoc-phe-oh0.5mmol、hobt0.5mmol加入体积比为1:1的dcm和dmf混合溶液,冰水浴下加入80μldic(0.5mmol)活化后,加入上述装有树脂的反应柱中,室温下反应2小时后,以茚三酮法检测判断反应终点,如果树脂无色透明,则表示反应完全;树脂显色,则表示反应不完全,需要再反应1小时,此判断标准适用于后续氨基酸偶联中以茚三酮法检测判断反应终点。
(2)重复上述脱除fmoc保护和加入相应氨基酸偶联的步骤,依次完成fmoc-asp(otbu)-oh、fmoc-ser(tbu)-oh、fmoc-ile-oh、fmoc-lys(boc)-oh、fmoc-val-oh、fmoc-gly-oh、fmoc-asn(trt)-oh、fmoc-pro-oh、fmoc-ser(tbu)-oh、fmoc-lys(boc)-oh、fmoc-val-oh、fmoc-leu-oh、fmoc-pro-oh、fmoc-asn(trt)-oh的偶联。偶联完毕,将肽树脂用dmf洗涤3次,dcm洗涤3次,meoh洗涤3次,dcm洗涤3次,meoh洗涤3次,抽干得到0.527g粗肽树脂。
(3)称取0.527g全保护的肽树脂,加入到25ml的三口圆底烧瓶中,按tfa:苯甲醚:苯甲硫醚=95:3:2的体积比配置裂解液10ml,将裂解液加入上述树脂中,室温反应2小时,过滤,用少量tfa洗涤裂解后的树脂3次,合并滤液,浓缩,将浓缩后的液体加入到冰乙醚中沉淀1小时,离心,无水乙醚离心洗涤6次,真空干燥,得到粗肽194.3mg。
(4)将粗肽用50ml水溶解后。而后通过c18或c8柱2次纯化、转盐、冷冻干燥后得到目标产物(17.0mg,9.44%),用maldi-tof分析产物,发现质子化的分子离子峰的m/z值为1800.95(理论量为1800)。
(二)多肽的活性检测
将实施例制备得到的多肽分别检测其对肿瘤细胞的杀伤活性,同时将它们分别与gp-96蛋白联用,检测其对肿瘤细胞的杀伤活性。其中,所用到的试剂均为本领域通过常规即可购买得到的试剂,所用到的检测方法也是本领域成熟的检测方法。
其中,试剂和仪器及厂家如下:
肿瘤细胞,购自:atcc
cona-sepharose和亲层析填料,购自:北京诺博莱德科技有限公司
g25过滤层析填料,购自:上海仁凯生物技术有限公司
deae-sepharose离子交换层析填料,购自:瑞典ampharmacia公司
gm-csf,购自:购自:上海谱振生物科技有限公司
il-4,购自:购自:上海谱振生物科技有限公司
酶标仪,购自:thermo
raji(淋巴瘤),mcf-7(乳腺癌),pc-3(前列腺癌),sbc-5(小细胞肺癌),hek-293(人胚肾上皮细胞)均购于atcc。
t淋巴细胞,购自:赛齐(上海)生物工程有限公司
rpmi-1640培养基,购自:北京拜尔迪生物技术有限公司
1、her2多肽的制备
her2多肽:将实施例一到五制备得到的目标多肽分别编号如下,1334(实施例五),1335(实施例一),1336(实施例二),1337(实施例三),1338(实施例四),纯度达95%以上。其中肽1334做为对照品。
2、gp-96蛋白的制备
将肿瘤细胞(购自atcc)置于42℃环境中培养25min,检测gp-96的浓度。利用反复冻融使肿瘤细胞裂解释放gp-96蛋白,采用cona-sepharose和亲层析、g25过滤层析和deae-sepharose离子交换层析收集,nacl盐溶液洗脱,脱盐分离纯化gp-96蛋白,并经sds-page及westernblot鉴定。
3、树突状细胞(dc)的培养
取人外周血100ml,低渗破除红细胞后密度梯度离心分离白膜,以含10%小牛血清的rpmi-1640培养基培养,获得贴壁单个核细胞,将细胞调至1x106/ml后,加入含gm-csf100ng/ml、il-420ng/ml的培养液,培养板中培养3天后做细胞形态学观察和s-100染色,获得树突状细胞。
4、树突细胞(dc)的诱导
将纯化的肽1334添加到树突状细胞培养液中至终浓度为500μg/ml,继续培养3天,将未成熟的树突状细胞诱导为成熟的树突状细胞。
将1334+gp-96添加到树突状细胞培养液中至终浓度为500μg/ml,继续培养3天,将未成熟的树突状细胞诱导为成熟的树突状细胞。
将纯化的gp-96添加到树突状细胞培养液中至终浓度为500μg/ml,继续培养3天,将未成熟的树突状细胞诱导为成熟的树突状细胞。
将her2短肽(肽1335,肽1336,肽1337,肽1338)分别添加到树突状细胞培养液中至终浓度为500μg/ml,继续培养3天,将未成熟的树突状细胞诱导为成熟的树突状细胞。
将her2短肽(肽1335,肽1336,肽1337,肽1338)分别和gp-96混合,混合比例是1:1(质量比),然后分别将其添加到树突状细胞培养液中至终浓度为500μg/ml,继续培养3天,将未成熟的树突状细胞诱导为成熟的树突状细胞。
5、抗肿瘤效应检测
(1)靶细胞准备
raji(淋巴瘤),mcf-7(乳腺癌),pc-3(前列腺癌),sbc-5(小细胞肺癌),hek-293(人胚肾上皮细胞)均购于atcc。
(2)效应细胞的制备培养
树突状细胞与t淋巴细胞结合后,可以激发t细胞增殖,诱导特异性细胞毒性t淋巴细胞的生成。将上述准备的各组成熟dc细胞与t淋巴细胞按细胞个数为1:5比例共同培养3天后,收集悬浮细胞作为细胞毒性t细胞(ctl)。
(3)ctl对肿瘤细胞杀伤活性的检测
分别收集对数生长期的raji淋巴瘤,mcf-7乳腺癌细胞,pc-3前列腺癌细胞,sbc-5小细胞肺癌细胞,hek-293细胞,然后分别调整细胞浓度为1×105/ml,以100μl/孔接种于96孔细胞培养板上,作为靶细胞。
将上述制备的各组效应细胞按照效靶比(e/t)为20:1与五组靶细胞混合,同时设置只加入t淋巴细胞的作为实验对照组,37℃,5%co2条件下培养6h,吸去上清,加入pbs漂洗除去悬浮细胞后,重新加入200μl新鲜培养基,加入mtt溶液(5mg/ml),继续培养4h后,吸去上清,加入dmso终止反应,570nm波长处测吸光度(od值),计算杀伤活性,每组均设置5个复孔。
6、测定结果
表1her2-gp96诱导的细胞毒性t细胞体外对不同细胞的杀伤活性(%)
注:数据均用平均值表示,n=5。
其中,将表1中的数据绘制成柱状图,如图1到图5所示。
7、结论
从表1中的数据以及图1到图5的柱状图可以看出,对照组多肽1334、gp-96以及肽1334+gp-96诱导成熟的树突状细胞对各种靶细胞均无明显的杀伤作用;试验组her2短肽(肽1335,肽1336,肽1337,肽1338)和her2短肽(肽1335,肽1336,肽1337,肽1338)+gp-96联合诱导成熟的树突状细胞均表现出杀伤肿瘤细胞(raji,mcf-7,pc-3,sbc-5)的作用,且her2短肽(肽1335,肽1336,肽1337,肽1338)+gp-96组的杀伤作用远高于her2短肽组,同时各试验组诱导成熟的树突状细胞对非肿瘤细胞hek-293均无明显的杀伤作用。各试验组相对于对照组,p<0.05,表明her2-gp96在体外具有诱导ctl杀伤肿瘤细胞的作用,而且对非肿瘤细胞并不表现出杀伤作用,具有肿瘤特异性,且不表现出毒副作用。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!