阿洛酮糖差向异构酶和使用它生产阿洛酮糖的方法与流程
本发明涉及能将果糖转变为D-阿洛酮糖的新的阿洛酮糖差向异构酶,由重组菌株生产阿洛酮糖差向异构酶的方法,用它从果糖生产D-阿洛酮糖的方法等。
背景技术:
D-阿洛酮糖是果糖碳-3位置的差向异构体,与食糖相比具有70%的甜度(Oshima2006),但它是功能性单糖,可用作减肥食品中的低卡路里甜味剂,其能量只有0.3%(Matsuo et al.2002)。而且,D-阿洛酮糖可以通过抑制葡萄糖的吸收来抑制葡萄糖,可用于糖尿病患者的食物、援助食物(receiving food)等,并可用于抑制与肝脏中脂类合成有关的酶活性,以抑制腹部脂肪的积聚,可用在各种功能性食品例如保健食品中(Matsuo et al.2001;Iida et al.2008;Hayashi et al.2010;Hossain et al.2011)。
由于具有上述特点,阿洛酮糖是一种能够替代食糖的良好来源,但是阿洛酮糖属于稀少糖,它是在自然界中很少存在的单糖,因此,需要能有效生产阿洛酮糖的方法,以应用于食品工业。作为现有的生产阿洛酮糖的方法,阿洛酮糖主要是通过化学工艺生产的。Bilik等提出使用钼酸盐离子的催化作用使果糖转变为阿洛酮糖的方法。McDonald通过3-步骤的化学处理工艺从1,2:4,5-二-δ-异亚丙基-β-D-吡喃果糖生产阿洛酮糖。进一步,Doner将果糖与乙醇和三甲胺一起加热来生产阿洛酮糖。但是,其缺点是在化学生产方法中成本消耗很大,而其效率相对低,并且产生许多副产品。
作为阿洛酮糖的生物学生产方法,通过微生物的细胞反应从半乳糖醇、D-塔格糖、D-塔罗糖醇等生产阿洛酮糖的方法已被提出(Ken Izumori)。但是该方法难以应用于工业生产,因为底物是稀少糖。工业化的最有效方法是在D-酮糖3-差向异构酶群组中寻找用于将果糖转变为阿洛酮糖的酶。根据现有报道的内容,通过使用在大肠杆菌中表达的D-塔格糖3-差向异构酶从果糖生产阿洛酮糖,所述大肠杆菌通过将来自Clostridium celluloticum H(10)(Mu et al.2011)、根癌农杆菌(Agrobacterium tumefaciens)(Kim et al.2006)、菊苣假单胞菌(Pseudomonas cichorii)(Itoh et al.1994)、球形根瘤菌(Rhizobium spheroides)(Zhang et al.2009)的D-塔格糖3-差向异构酶插入并转化到大肠杆菌中而被转化。关于使用酶从果糖生产阿洛酮糖的技术,在韩国专利登记号10-0744479中,公开了利用来自根癌农杆菌的阿洛酮糖差向异构酶生产阿洛酮糖的方法,在韩国专利登记号10-0832339中,公开了中华根瘤菌(Sinorhizobium)YB-58KCTC10983BP和利用它将果糖转变为阿洛酮糖的方法,所述中华根瘤菌YB-58KCTC10983BP具有将果糖转变为阿洛酮糖的活性,在韩国专利登记号10-1106253中,公开了包含编码根癌农杆菌C58的阿洛酮糖3-差向异构酶的多核苷酸的大肠杆菌,和使用它从果糖生产阿洛酮糖的方法,所述阿洛酮糖3-差向异构酶具有催化果糖转变为阿洛酮糖的活性,在韩国专利登记号10-1339443(韩国专利申请公开号10-2008-0071176)中,公开了来自根瘤菌属(Rhizobium)微生物的酮糖3-差向异构酶和使用它将果糖转变为阿洛酮糖的方法,在韩国专利登记号10-1318422中,公开了来自Clostridiuim scindens的D-阿洛酮糖3-差向异构酶和使用它从果糖生产阿洛酮糖的方法。
但是,根据现有的其功能已知的酶催化方法,生产阿洛酮糖的方法在中温和碱性条件pH值下是最佳的。在碱性条件下,反应引起非特异性反应和糖的褐变,因此不适于工业化。而且,存在的问题是,现有的酶由于稳定性差或者在高温下反应速率慢,因此具有一些在阿洛酮糖的工业化生产中增加生产成本的因素。因此,需要开发新的D-阿洛酮糖3-差向异构酶,其中产品产率、温度、pH和阿洛酮糖的反应速率适合于工业化。关于此,在韩国专利申请公开号10-2014-0021974中,公开了来自Treponema primitia ZAS-1的D-阿洛酮糖3-差向异构酶,通过在基因水平上诱导突变,它具有快速的阿洛酮糖转化速率,并且在高温下具有稳定性,在韩国专利登记号10-1203856中,公开了阿洛酮糖差向异构酶变体,它是由来自根癌农杆菌的野生型阿洛酮糖差向异构酶突变获得的,具有提高的热稳定性。
技术问题
本发明的第一个目的是提供新的D-阿洛酮糖3-差向异构酶,它具有将果糖转变为阿洛酮糖的活性,在相对高的温度或小于或等于中性的pH下具有最大活性,并且具有极好的热稳定性。
本发明的第二个目的是提供生产新的D-阿洛酮糖3-差向异构酶的方法或生产新的D-阿洛酮糖3-差向异构酶所需的各种要素。
本发明的第三个目的是提供从果糖生产阿洛酮糖的方法或从果糖生产阿洛酮糖所需的各种要素。
技术方案
本发明的发明人发现来自Flavonifractor plautii的酶具有将果糖转变为阿洛酮糖的高活性、极好的热稳定性、以及在高温范围内和相应于中性或弱酸性的pH值范围内的最佳活性,由此完成了本发明。
为了实现第一个目的,本发明的一个方面提供阿洛酮糖差向异构酶(psicose epimerase),它由SEQ ID NO:1的氨基酸序列组成。
为了实现第二个目的,本发明的另一个方面提供编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。本发明还提供引物对,所述引物对用于合成编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。本发明还提供重组载体,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。本发明还提供重组菌株,所述重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。本发明还提供生产阿洛酮糖差向异构酶的方法,其中所述方法包括下述步骤:通过培养重组菌株表达阿洛酮糖差向异构酶,所述重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成;以及从具有表达的阿洛酮糖差向异构酶的重组菌株的裂解物分离阿洛酮糖差向异构酶。
为了实现第三个目的,本发明的另一个方面提供用于生产阿洛酮糖的组合物,其包含阿洛酮糖差向异构酶,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。本发明还提供用于生产阿洛酮糖的组合物,其包含重组菌株、重组菌株的培养物或重组菌株的裂解物,所述重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。本发明还提供生产阿洛酮糖的方法,其中所述方法包括使果糖与阿洛酮糖差向异构酶或包含阿洛酮糖差向异构酶的组合物反应,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。本发明还提供生产阿洛酮糖的方法,其中所述方法包括使果糖与重组菌株、重组菌株的培养物、重组菌株的裂解物或包含它们的一种或多种的组合物反应,所述重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。
有益效果
根据本发明,新的阿洛酮糖差向异构酶具有使果糖的碳-3位置差向异构化以产生阿洛酮糖的活性,并且在相对高的温度和小于或等于中性的pH值条件下具有将果糖转变为阿洛酮糖的最大活性,具有极好的热稳定性,并且能够在短时间内以高产率从果糖大量生产阿洛酮糖。因此,根据本发明的阿洛酮糖差向异构酶在阿洛酮糖的工业生产中是有益的,由此生产的阿洛酮糖可用于功能糖工业中并用作使用阿洛酮糖的保健食品、药物、化妆品等的材料。
附图说明
图1是重组表达载体pET-FDPE的切割图谱。
图2是对本发明实施例2中通过His标签亲和色谱纯化的D-阿洛酮糖3-差向异构酶进行SDS-PAGE的结果。
图3是说明本发明的D-阿洛酮糖3-差向异构酶的活性与加入的金属离子种类的关系的图。在图3中,每种金属离子处理情况下的酶活性以相对值表示,将对照组的酶活性设定为100。
图4是说明对于每一种加入的金属离子和每一个处理浓度,本发明的D-阿洛酮糖3-差向异构酶的活性的图。
图5是说明对于每一个反应pH,本发明的D-阿洛酮糖3-差向异构酶的活性的图。在图5中,酶活性以相对值表示,将最大活性设定为100。
图6是说明对于每一个反应温度,本发明的D-阿洛酮糖3-差向异构酶的活性的图。在图6中,酶活性以相对值表示,将最大活性设定为100。
图7是说明对于每一种底物,本发明的D-阿洛酮糖3-差向异构酶的活性的图。在图7中,酶活性以相对值表示,将使用阿洛酮糖作为底物的反应的酶活性设定为100。
具体实施方式
下面对本发明进行详细描述。
本发明涉及新的D-阿洛酮糖3-差向异构酶(下文中称为阿洛酮糖差向异构酶),它能够将果糖转变为阿洛酮糖。该阿洛酮糖差向异构酶来自于Flavonifractor plautii,在相对高的温度和小于或等于中性的pH条件下具有将果糖转变为阿洛酮糖的最大活性,具有极好的热稳定性,并能够在短时间内以高产率从果糖大量生产阿洛酮糖。该阿洛酮糖差向异构酶可以通过这样的方法获得:通过聚合酶反应扩增Flavonifractor plautii基因组DNA中存在的多种DNA中的特定DNA,将扩增的特定DNA插入到表达载体中制备重组表达载体,用重组表达载体转化宿主菌株产生重组菌株,然后培养和表达重组菌株。根据本发明的阿洛酮糖差向异构酶优选具有30-34kDa的分子量,最佳活性温度在55-67℃范围内,最佳活性pH值在6.5-8范围内。根据本发明的阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,但是根据本发明的阿洛酮糖差向异构酶的等同范围不限于此。例如,在根据本发明的阿洛酮糖差向异构酶的等同范围内,只要保持将果糖转变为阿洛酮糖的活性,SEQ ID NO:1的一些氨基酸可以被替换、插入、和/或删除。优选地,可以通过保守氨基酸替换进行氨基酸的替换,其中蛋白质的特性不改变。进一步,可以通过糖基化、乙酰化、磷酸化等进行氨基酸的修饰。进一步,根据本发明的阿洛酮糖差向异构酶的等同范围可以包括通过氨基酸序列的突变或修饰而具有增加的对热、pH值等的结构稳定性的蛋白质,或者具有将果糖转变为阿洛酮糖的增加的活性的蛋白质。而且,根据本发明的阿洛酮糖差向异构酶的等同范围可以包括与SEQ ID NO:1的氨基酸序列具有70%或更多、80%或更多、90%或更多、95%或更多、或99%或更多的同源性的氨基酸序列。下述表1列举了可以通过保守氨基酸替换方式替换蛋白质中的氨基酸的氨基酸。
表1
本发明的另一个示例性的实施方案涉及生产新的阿洛酮糖差向异构酶的方法或者生产新的阿洛酮糖差向异构酶所需的各种要素。生产新的阿洛酮糖差向异构酶所需的各种要素包括多核苷酸、引物对、重组载体、重组菌株等。
所述多核苷酸是编码差向异构酶的多核苷酸,所述差向异构酶由SEQ ID NO:1的氨基酸序列组成,所述多核苷酸优选由SEQ ID NO:2的碱基序列组成。在本发明中,术语“多核苷酸”指所有未修饰的或修饰的多聚核糖核苷酸(RNA)或多聚脱氧核糖核苷酸(DNA)。多核苷酸包括单链或双链DNA、单链和双链区域混合的DNA、单链和双链RNA、单链和双链区域混合的RNA、或它们的杂交分子,但不限于此。进一步,编码差向异构酶的多核苷酸的等同范围包括与SEQ ID NO:2的碱基序列基本上相同的序列。基本上相同是指任何其它序列以最大程度地相应于SEQ ID NO:2的碱基序列的方式排列,并且通过分析其序列,所述任何其它序列与SEQ ID NO:2的碱基序列具有70%或更多、90%或更多、或98%或更多的序列同源性。所属领域的技术人员容易理解,通过本领域已知的基因重组技术,可以替换、添加、或删除多核苷酸的碱基序列的一个或多个碱基,以产生编码具有相同活性的酶的多核苷酸,所述具有相同活性的酶具有基本上相同的同源性。可以使用市售的计算机程序计算两个或更多个序列之间的同源性百分比(%),来进行同源性的比较。
进一步,引物对是为了合成编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,并且所述引物对优选由具有SEQ ID NO:3的碱基序列的正向引物和具有SEQ ID NO:4的碱基序列的反向引物组成。
进一步,重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。重组载体可以以如下方式提供:将编码阿洛酮糖差向异构酶的多核苷酸通过已知的标准方法插入到克隆载体或表达载体中。在本发明中,术语“克隆载体”被定义为可以将DNA片段输送到宿主细胞中并复制所述DNA片段的材料。在本发明中,克隆载体可以进一步包含多腺苷酸化信号、转录终止序列和多克隆位点。在这种情况下,多克隆位点包括至少一个核酸内切酶限制性酶切位点。进一步,克隆载体可以进一步包含启动子。作为一个实例,在本发明中,编码阿洛酮糖差向异构酶的多核苷酸可以位于多腺苷酸化信号和转录终止序列的上游,并且至少一个核酸内切酶限制性酶切位点可以位于多腺苷酸化信号和转录终止序列的上游。进一步,在本发明中,术语“表达载体”被定义为将克隆的DNA在合适的宿主中转录和翻译所需的DNA序列。进一步,在本发明中,术语“表达载体”指包含必需的调节元件的基因构建体,所述调节元件与插入序列可操作地连接,以在目的细胞中表达所述插入序列。表达载体可以通过标准重组DNA技术产生和纯化。表达载体的种类没有特别限制,只要表达载体能在不同的宿主细胞,例如原核细胞和真核细胞中表达所期望的基因,并实现产生所希望的蛋白的功能,但优选是这样的载体:它能够大量生产类似于自然状态形式的外来蛋白,同时具有表现出强活性和强表达能力的启动子。表达载体优选包含至少启动子、起始密码子、编码所期望蛋白的基因和终止密码子。此外,表达载体可以适当地包含编码信号肽、其它表达调节序列、所期望基因的5'端和3'端的非翻译区、选择性标记区域、复制单元等的DNA。“启动子”指足以启动转录的最小序列。而且,可以包括足以表达依赖于调节性启动子的基因的启动子结构(promoter configuration),该结构(configuration)可以位于基因的5'或3',该基因被细胞类型特异性信号或外部信号诱导。保守启动子和诱导启动子二者都包括在内。启动子序列可以来自于原核生物、真核生物或病毒。术语“可操作连接”指通过在一条多核苷酸上与多核苷酸序列相连,使得一个功能由另一个对象调节。例如,在启动子可以控制编码序列的表达的情况下(即,编码序列在启动子的转录调节下),如果启动子与编码序列连接以操作,或者存在核糖体结合位点以促进翻译,则核糖体结合位点与编码序列连接并操作。编码序列可以以有义方向或反义方向与调节序列连接并操作。在根据本发明的表达载体中,重组载体优选是表达载体,表达载体优选具有图1的切割图谱。
进一步,重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列。在本发明中,术语“重组菌株”指将编码一种或多种靶蛋白的多核苷酸或者具有该多核苷酸的表达载体引入宿主细胞而转化的细胞。将表达载体引入宿主细胞产生转化体的方法包括:化学处理方法,包括瞬时转染、微注射、转导、细胞融合、磷酸钙沉淀、脂质体介导的转染、DEAE右旋糖酐介导的转染、聚凝胺介导的转染、电穿孔、电注射、PEG等;使用基因枪等的方法,诸如此类,但不限于此。在本发明中,只要能够被表达载体转化的宿主细胞是本领域已知的,例如原核细胞、植物细胞、昆虫细胞和动物细胞等,其种类基本没有限制。优选地,通常使用具有高DNA引入效率和对引入的DNA具有高表达效率的宿主。例如,宿主细胞可以是大肠杆菌。大肠杆菌包括BL21、JM109、K-12、LE392、RR1、DH5α或W3110等,但不限于此。此外,宿主细胞可以是选自由芽孢杆菌(Bacillus)菌株如枯草芽孢杆菌(Bacillus subtilis)和苏云金芽孢杆菌(Bacillus thuringiensis),棒杆菌(Coryne)菌株如谷氨酸棒杆菌(Corynebacterium glutamicum),沙门氏菌(Salmonella)菌株如鼠伤寒沙门氏菌(Salmonella typhimurium),其它粘质沙雷氏菌(Serratia marcescens),和肠杆菌(Enterobacteriaceae)菌株如各种假单胞菌(Pseudomonas species)组成的组的菌株。
进一步,生产阿洛酮糖差向异构酶的方法包括以下步骤:通过培养重组菌株表达阿洛酮糖差向异构酶,所述重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成;以及从表达阿洛酮糖差向异构酶的重组菌株的裂解物分离阿洛酮糖差向异构酶。可以使用异丙基-1-硫代-β-D-半乳糖苷(IPTG)作为诱导因子诱导宿主细胞表达蛋白,可以调整诱导时间以使得蛋白的量达到最大。在本发明中,可以从重组菌株的裂解物收集阿洛酮糖差向异构酶。蛋白表达中使用的细胞可以通过各种物理或化学方法裂解,例如重复冻融、超声处理、机械破碎或细胞裂解剂,并且可以通过通常的生物化学分离技术分离或纯化(Sambrook et al.,Molecular Cloning:A laborarory Manual,2nd Ed.,Cold Spring Harbor Laboratory Press,1989;Deuscher,M.,Guide to Protein Purification Methods Enzymology,Vol.182.Academic Press.Inc.,San Diego,CA,1990)。例如,分离或纯化由宿主细胞表达的蛋白的方法包括电泳、离心、凝胶过滤、沉淀、透析、色谱(离子交换色谱、亲和色谱、免疫吸附亲和色谱、反相HPLC和凝胶渗透HPLC)、等点聚焦和它们的各种改良方法或复合方法,但不限于此。同时,在本发明中,从重组菌株的裂解物中分离阿洛酮糖差向异构酶优选可以通过使用肽标签的亲和色谱来进行。对于肽标签,可以使用各种已知的标签,例如HA标签、FLAG标签、His标签、生物素羧基载体蛋白(BCCP)、c-myc标签、V5标签、谷胱甘肽-S-转移酶(GST)或麦芽糖结合蛋白(MBP),其中优选使用His标签。带有His标签的蛋白在镍-次氮基三乙酸(Ni-NTA)树脂的柱上被特异地捕获,并可以通过EDTA或咪唑释放。
本发明的另一个示例性的实施方案涉及从果糖生产阿洛酮糖的方法或者从果糖生产阿洛酮糖所需的各种要素。作为从果糖生产阿洛酮糖所需的各种要素,涉及用于生产阿洛酮糖的组合物。
用于生产阿洛酮糖的组合物的一个实例包括阿洛酮糖差向异构酶,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。进一步,用于生产阿洛酮糖的组合物的另一个实例包括重组菌株、重组菌株的培养物或重组菌株的裂解物,所述重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。在这种情况下,优选地,用于生产阿洛酮糖的组合物可以进一步包括一种或多种选自由锰离子、镍离子和钴离子组成的组的物质,并且更优选地,可以进一步包括镍离子或钴离子。根据本发明的新的阿洛酮糖差向异构酶具有金属酶特性,其中由金属离子调节其活化,并且在存在特定金属离子,例如镍离子或钴离子的条件下进行酶反应,以提高阿洛酮糖的生产产量。
进一步,从果糖生产阿洛酮糖的方法的一个实例包括使果糖与阿洛酮糖差向异构酶或包含阿洛酮糖差向异构酶的组合物反应,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。进一步,从果糖生产阿洛酮糖的方法的另一个实例包括使果糖与重组菌株、重组菌株的培养物、重组菌株的裂解物或包含它们的一种或多种的组合物反应,所述重组菌株用编码阿洛酮糖差向异构酶的多核苷酸转化,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成,或者用重组载体转化,所述重组载体包含编码阿洛酮糖差向异构酶的多核苷酸,所述阿洛酮糖差向异构酶由SEQ ID NO:1的氨基酸序列组成。进一步,从果糖生产阿洛酮糖的方法可以另外包括加入的金属离子,金属离子的种类如上所述。作为一个实例,金属离子可以被加入到底物果糖中,或者被加入到酶和果糖的混合物中。进一步,作为另一个实例,金属离子可以被加入到固定有酶的载体中(在加入果糖之前),被加入到固定有酶的载体和果糖的混合物中(在加入果糖之后),或者在加入果糖时以和果糖的混合物的形式被加入。在使用重组菌株的情况下,金属离子可以被加入到培养物中,或者可以在添加有金属离子的培养基中进行培养。进一步,在从果糖生产阿洛酮糖的方法中,阿洛酮糖差向异构酶或重组菌株优选被固定在载体中。载体可以建立一种环境,在其中可以长时间保持固定化酶的活性,并且载体可以选自所有已知的可用于酶固定化的载体。例如,可以使用海藻酸钠作为载体。海藻酸钠是天然的胶质多糖,在藻类的细胞壁中含量丰富,由β-D-甘露糖醛酸和α-L-葡糖酸组成。在其组成上,海藻酸钠通过随机形成β-1,4键而形成,菌株或酶被稳定地固定化,因此它对于获得优异的阿洛酮糖产量来说是有益的。作为一个实例,为了进一步提高阿洛酮糖的产量,浓度为1.5-4.0%(w/v)的海藻酸钠溶液(例如海藻酸钠水溶液),优选浓度为大约2.5%(w/v)的海藻酸钠溶液可用于固定重组菌株。进一步,在从果糖生产阿洛酮糖的方法中,当考虑酶的稳定性时,反应温度在55-67℃,优选55-65℃,更优选55-60℃的范围内,并且反应pH值在6.5-8,优选6.5-7.5,更优选6.5-7的范围内。进一步,在从果糖生产阿洛酮糖的方法中,果糖的浓度没有特别限制,但考虑到生产率和经济性,优选是按全部反应物计35-75%(w/w),更优选是40-70%(w/w)。进一步,在从果糖生产阿洛酮糖的方法中,所使用的酶的量可以是按全部反应物计0.001-0.1mg/ml,优选0.01-0.1mg/ml,更优选0.02-0.05mg/ml。进一步,在使用重组菌株从果糖生产阿洛酮糖的情况下,重组菌株的宿主菌株优选是细胞学安全的菌株。细胞学安全的菌株是一般认为安全(generally accepted as safe,GRAS)的菌株,其一般被认为是安全的,例如可以是棒杆菌菌株。棒杆菌菌株是工业微生物,它生产在饲料、药物、食品等领域具有不同用途的化学物质,包括L-赖氨酸、L-苏氨酸和各种核酸。棒杆菌菌株是GRAS菌株,它具有易于基因操作和大量培养的菌株特性。进一步,棒杆菌菌株是一种在各种处理条件下都具有高稳定性的菌株,并且与其它细菌相比具有相对坚实的细胞膜结构,因而具有这样的生物学特性:甚至是在由高糖浓度引起的高渗透压的情况下,该菌株也能以稳定状态存在。棒杆菌菌株的具体实例包括谷氨酸棒杆菌(Corynebacterium glutamicum)等。
下面,将通过实施例对本发明做更详细描述。但是,下述实施例仅仅是为了清楚说明本发明的技术特征,本发明的范围不限于此。
实施例1:生产D-阿洛酮糖3-差向异构酶的重组菌株的制备
从得自韩国典型培养物保藏中心(Korean Collection for Type Cultures)的Flavonifractor plautii KCTC 5970提取基因组DNA并用作模板,使用引物和Ex-Taq(TAKARA)聚合酶进行聚合酶链式反应(PCR),克隆编码D-阿洛酮糖3-差向异构酶的基因(SEQ ID NO:2的多核苷酸)。下述表2列出了从Flavonifractor plautii的基因组DNA克隆编码D-阿洛酮糖3-差向异构酶的基因使用的引物。下述表2中列出的引物由Bioneer co.,KR制备。
表2
之后,使用凝胶提取试剂盒(Qiagen)从PCR产物中分离出唯一的所期望的靶DNA,然后连接到easy T-vector(Promega)中。委托Bioneer co.,KR对分离的靶DNA进行碱基序列分析。结果证实通过PCR扩增的靶DNA相应于SEQ ID NO:2的多核苷酸。之后,使用限制性内切酶NdeI和XhoI,将通过PCR反应扩增的靶DNA插入到表达载体pET15b载体(Novagen)的相同的限制性识别位点上,制备重组表达载体pET-FDPE。图1是重组表达载体pET-FDPE的切割图谱。然后,用重组表达载体pET-FDPE通过电穿孔转化感受态细胞BL21(制造商:RBC,台北,台湾)大肠杆菌,制备重组菌株。
实施例2:D-阿洛酮糖3-差向异构酶的表达和纯化
将转化的重组菌株的单克隆接种到15ml LB-氨苄青霉素培养基(Difco)中,然后在37℃和200rpm的条件下预培养大约6hrs。之后,将预培养的溶液接种到500ml LB-氨苄青霉素培养基中,在37℃和200rpm的条件下摇动培养。之后,当培养物溶液的吸收值(在600nm)为0.5时,加入IPTG至浓度为0.1mM,以诱导靶酶的过表达。在这种情况下,将过表达诱导时间的培养物转至16℃和150rpm的条件下保持大约16hrs。之后,将重组菌株的培养物溶液在13,000rpm离心2mins,移除上清,收集重组菌株的菌株细胞。
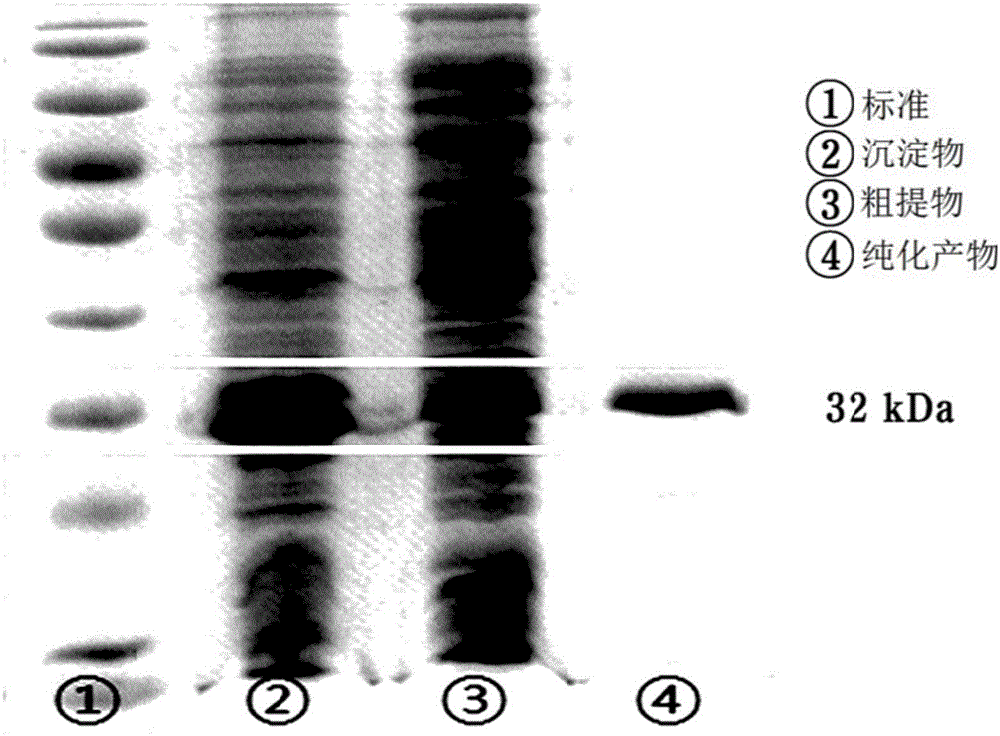
将收集的重组菌株的菌株细胞重悬于裂解缓冲液(50mM Tris_HCl 300mM NaCl pH8.0,10mM咪唑)中,然后通过超声处理进行裂解。将细胞裂解物在13,000rpm离心10mins,只收集上清,然后将其加到用裂解缓冲液预平衡的Ni-NTA柱(Bio-Rad,Profinia)上,使在50mM Tris_HCl 300mM NaCl pH 8.0中含有20mM咪唑和200mM咪唑的缓冲溶液顺序流过。最后,使50mM Tris_HCl 300mM NaCl pH 8.0和200mM咪唑流过以洗脱靶蛋白。下文描述的实验结果证实洗脱的蛋白是D-阿洛酮糖3-差向异构酶。然后将洗脱的蛋白储存在缓冲溶液(PIPES,pH 7.5)中,测量酶活性,以用于下一个实验中。进一步,对洗脱的蛋白进行SDS-PAGE,由此证实洗脱蛋白的大小是32kDa。图2是对本发明的实施例2中通过His标签亲和色谱纯化的D-阿洛酮糖3-差向异构酶进行SDS-PAGE的结果。
实施例3:D-阿洛酮糖3-差向异构酶的特性的验证
(1)D-阿洛酮糖3-差向异构酶的金属离子需求分析
检查金属离子对于实施例2中获得的D-阿洛酮糖3-差向异构酶是否具有效果。
将ZnSO4、CaCl2、MnSO4、NiSO4、CoCl2、MgSO4、CuSO4、CaCO3和FeSO4分别加到纯化酶缓冲溶液(PIPES,pH 7.5)中,至1mM,然后使金属离子与酶结合大约1hr。之后,将结合有金属离子的酶与100mM底物果糖水溶液按重量比1:1混合,制备获得混合物,其中酶浓度为0.025ml/mg,果糖浓度为50mM,在60℃反应10mins。然后向其中加入盐酸溶液终止反应。另外,在对照组中,使用未经金属离子处理的酶(无)进行相同的实验。之后,测量产生的阿洛酮糖的量(mM)并除以酶量和反应时间,以计算酶活性。通过HPLC分析阿洛酮糖的量。进行HPLC分析,使用87C(BIO-RAD)柱,用100%(v/v)水作为流动相,在80℃以0.6ml/min的流速流过,用折光率检测器(Agilent 1260TID)检测阿洛酮糖,以分析产生的阿洛酮糖的量。图3是说明本发明的D-阿洛酮糖3-差向异构酶的活性与加入的金属离子种类的关系的图。在图3中,每种金属离子处理情况下的酶活性以相对值表示,将对照组的酶活性设定为100。如图3所示,在实施例2中获得的D-阿洛酮糖3-差向异构酶中,通过加入锰离子、镍离子和钴离子,将果糖转变为阿洛酮糖的活性提高,特别是,镍离子和钴离子的活性的提高是显著的。
之后,在纯化的D-阿洛酮糖3-差向异构酶溶液中用不同浓度的MnSO4、NiSO4和CoCl2处理,然后进行相同的实验。图4是说明对于每一种加入的金属离子和每一个处理浓度,本发明的D-阿洛酮糖3-差向异构酶的活性的图。如图4所示,锰离子、镍离子和钴离子在不同的浓度范围提高D-阿洛酮糖3-差向异构酶的活性。
(2)D-阿洛酮糖3-差向异构酶活性与pH值或温度改变的关系的分析
为了检查实施例2中获得的D-阿洛酮糖3-差向异构酶的最适pH值,使用MES缓冲液、PIPES缓冲液、EPPS缓冲液和CHES缓冲液制备不同pH值的测试溶液。具体来说,在纯化酶的缓冲溶液中用浓度为1mM的NiSO4处理,然后与100mM果糖水溶液按重量比1:1混合,制备不同pH值的测试溶液,所述测试溶液的缓冲液浓度为50mM,酶浓度为0.025ml/mg,果糖浓度为50mM。之后,测试溶液在60℃反应10mins,加入盐酸溶液终止反应。之后,用HPLC分析和测量产生的阿洛酮糖的量(mM)并除以酶量和反应时间,计算酶活性。图5是说明对于每一个反应pH,本发明的D-阿洛酮糖3-差向异构酶的活性的图。在图5中,酶活性以相对值表示,将最大活性设定为100。如图5所示,本发明的D-阿洛酮糖3-差向异构酶在pH 6.5-8,优选在pH 6.5-7.5具有高活性,在pH 7具有最大活性。
进一步,在纯化酶的缓冲溶液(PIPES,pH 7.5)中用浓度为1mM的NiSO4处理,然后与100mM果糖水溶液按重量比1:1混合,制备测试溶液,所述测试溶液pH值为7.0,酶浓度为0.025ml/mg,果糖浓度为50mM。之后,测试溶液在不同温度反应10mins,然后加入盐酸溶液终止反应。之后,用HPLC分析和测量产生的阿洛酮糖的量(mM)并除以酶量和反应时间,计算酶活性。图6是说明对于每一个反应温度,本发明的D-阿洛酮糖3-差向异构酶的活性的图。在图6中,酶活性以相对值表示,将最大活性设定为100。如图6所示,本发明的D-阿洛酮糖3-差向异构酶在55-67℃的温度下具有高活性,在65℃具有最大活性。
(3)D-阿洛酮糖3-差向异构酶的底物特异性分析
分析实施例2中获得的D-阿洛酮糖3-差向异构酶对于不同底物例如阿洛酮糖、果糖和塔格糖的反应活性。
在纯化酶的缓冲溶液(PIPES,pH 7.5)中用浓度为1mM的NiSO4处理,然后与100mM底物水溶液按重量比1:1混合,制备测试溶液,所述测试溶液pH值为 7.0,酶浓度为0.025ml/mg,底物浓度为50mM。之后,测试溶液在65℃反应10mins,然后加入盐酸溶液终止反应。之后,用HPLC分析和测量相应于底物的差向异构酶的量(mM)并除以酶量和反应时间,计算酶活性。图7是说明对于每一种底物,本发明的D-阿洛酮糖3-差向异构酶的活性的图。在图7中,酶活性以相对值表示,将使用阿洛酮糖作为底物的反应的酶活性设定为100。如图7所示,证明本发明的D-阿洛酮糖3-差向异构酶对阿洛酮糖和果糖具有高活性,特别是,与现有的D-阿洛酮糖3-差向异构酶相比,本发明的D-阿洛酮糖3-差向异构酶将果糖转变为阿洛酮糖的活性非常高。因此,使用本发明的D-阿洛酮糖3-差向异构酶可以以高产率从果糖生产D-阿洛酮糖。
(4)D-阿洛酮糖3-差向异构酶的热稳定性分析
将实施例2中获得的D-阿洛酮糖3-差向异构酶用50mM PIPES缓冲溶液制备成0.05mg/ml浓度,然后,将得到的溶液放置并储存在温度分别设定为55℃、60℃、65℃和70℃的水浴中加热。在每个储存时间取纯化酶的缓冲溶液,用浓度为1mM的NiSO4处理,然后与100mM底物水溶液按重量比1:1混合,制备测试溶液,所述测试溶液pH值为 7.0,酶浓度为0.025ml/mg,底物浓度为50mM。之后,测试溶液在65℃反应10mins,然后加入盐酸溶液以终止反应。之后,用HPLC分析和测量产生的阿洛酮糖的量(mM)并除以酶量和反应时间,计算酶活性。结果,虽然纯化酶的缓冲溶液在55℃加热了250mins,酶活性仍然保持不变。进一步,当纯化酶的缓冲溶液在60℃加热大约200mins时,酶活性与加热处理之前相比减少了大约80%。通常认为大部分D-阿洛酮糖3-差向异构酶在50℃的半衰期(酶活性为加热处理之前的50%时的加热处理时间)为大约一个小时,本发明的D-阿洛酮糖3-差向异构酶具有非常好的热稳定性。
(5)D-阿洛酮糖3-差向异构酶在高浓度果糖下的活性分析
将700μl浓度为70wt%的果糖在60℃预热并向其加入280μl PIPES缓冲溶液,所述缓冲溶液中含有实施例2中获得的D-阿洛酮糖3-差向异构酶,浓度为0.1mg/ml,然后得到的反应物在60℃进行反应。在每个反应时间取10μl反应产物并稀释25倍。向稀释的产物加入盐酸溶液终止反应。之后,用HPLC分析和测量产生的阿洛酮糖的量(mM)并除以底物果糖的量,以计算转化率。在每个反应时间从果糖向阿洛酮糖的转化率列在下述表3中。如表3所列出的,当本发明的D-阿洛酮糖3-差向异构酶与高浓度的果糖反应时,仅仅经过约18个小时转化率就达到超过33%的最大转化率。
表3
如上所述,本发明通过实施例进行描述,但并不一定限于此,在不背离本发明的范围和精神的情况下可以形成各种修改的实施方案。因此,应当理解,本发明的范围包括属于本发明所附权利要求的所有实施方案。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种查尔酮基荧光传感器及其制备方法与应用与流程
- 一种含咔唑基的查尔酮与乙酰乙酸乙酯Micheal加成产物及其制备方法与流程
- 一种查尔酮类似物及其制备方法和用途与流程
- 一种制备4-溴-1,8-二氮萘的方法与制造工艺
- 一种利用磁性固相萃取吸附材料富集检测喜树碱的方法与制造工艺
- 拟南芥At‐UGE2基因及其过表达突变株和缺失突变株在调节植物性状中的应用的制造方法与工艺
- 一种马来酸顺反异构酶的热稳定性改造及其应用的制造方法与工艺
- 一种改进的基于加权图的超密集异构网络干扰协调方法与制造工艺
- 一种自旋标记骆驼宁碱A化合物、制备方法及其用途与制造工艺
- 一种顺‑4‑(2‑甲基‑3‑对叔戊基苯基丙酰基)‑2,6‑二甲基吗啉合成方法与制造工艺