用于控制鞘翅目害虫HUNCHBACK基因亲代RNAI抑制的制作方法
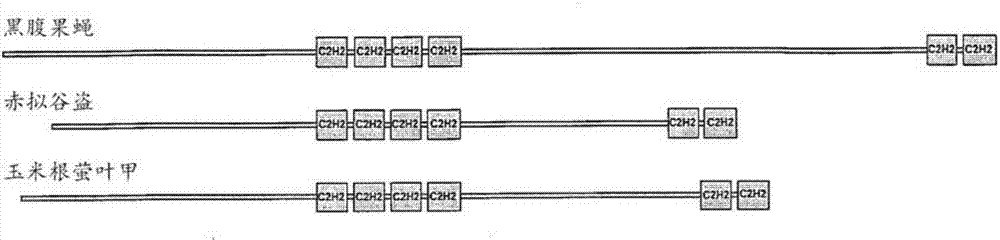
优先权声明本申请要求2014年12月16日提交的题为“parentalrnaisuppressionofhunchbackgenetocontrolcoleopteranpests”的美国临时专利申请系列号62/092,772、以及2015年6月2日提交的题为“parentalrnaisuppressionofhunchbackgenetocontrolhemipteranpests”美国临时专利申请系列号62/170,079的申请日的利益,在此将二者全体并入本文。本发明一般性地涉及由鞘翅目害虫引起的植物损害的遗传控制。在特定的实施方案中,本发明涉及目标编码和非编码多核苷酸的鉴定、及其重组dna技术在鞘翅目害虫细胞中转录后阻遏或抑制目标编码多核苷酸和非编码多核苷酸表达从而提供植保作用的用途。背景西方玉米根虫(wcr)(diabroticavirgiferavirgiferaleconte,玉米根萤叶甲)是北美的一种破坏性最大的玉米根虫物种,在美国中西部玉米种植区受到特别关注。北方玉米根虫(ncr)(巴氏根萤叶甲)是与wcr共栖大致相同范围的近缘物种。有几种叶甲属的其他相关亚种是美洲的严重害虫:墨西哥玉米根虫(mcr)[墨西哥玉米根萤叶甲(d.virgiferazeaekrysanandsmith)];南方玉米根虫(scr)(十一星根萤叶甲);黄瓜条根萤叶甲(d.balteataleconte);d.undecimpunctatatenella;南美叶甲(d.speciosagermar)、和d.u.undecimpunctatamannerheim。美国农业部已估计玉米根虫每年造成10亿美元收入损失,包括8亿美元产量损失和2亿美元处理成本。wcr和ncr两者都以卵的形式在夏季期间潜伏在土壤中。这些昆虫在整个冬季都停留在卵阶段。卵是椭圆的、白色、且长度小于1mm。幼虫在5月下旬或6月上旬孵出,卵孵化的精确时间由于温度差异和位置而在各年间有所变化。新孵出的幼虫是白色的蠕虫,长度小于3.18mm。一旦孵出,幼虫便开始以玉米根为食。玉米根虫经历三个幼虫龄。在进食几周后,幼虫蜕皮,进入若虫阶段。它们在土壤中化蛹,然后它们在7月和8月中以成虫从土壤出现。成体根虫长度约6.35mm。玉米根虫幼虫在玉米和几种其他禾本科物种上完成发育。在黄色狗尾草上饲养的幼虫较晚出现,并且作为成虫比玉米上饲养的幼虫具有更小的头壳尺寸。ellsbury等人,(2005)environ.entomol.34:627-34。wcr成虫以玉米穗丝、花粉、和暴露的穗尖上的籽粒为食。当优选的穗丝和花粉变得可得到时,成虫会快速向其移动。ncr成虫也以玉米植物的生殖组织为食。wcr雌虫通常交配一次。bransonetal.(1977)ann.entom.soc.america70(4):506-8。玉米中的大部分根虫损伤由幼虫进食引起。新孵出的根虫最初以细的玉米根毛为食,并钻入根尖中。随着幼虫长得更大,它们以初生根为食并钻入其中。在有大量玉米根虫时,幼虫啮食往往导致根部被一直修剪到玉米杆基部。严重的根损伤干扰根将水和养分转运到植物中的能力,降低植物生长,并导致籽粒产生减少,由此经常急剧降低总产量。严重的根损伤还经常导致玉米植物的倒伏,其使收获变得更难,并进一步降低产量。此外,成虫以玉米生殖组织为食可以导致穗尖的穗丝修剪。如果这种“穗丝剪切”在花粉脱落期间足够严重,则传粉可能受到破坏。可以通过作物轮作、化学杀虫剂、生物杀虫剂(例如,孢子形成革兰氏阳性细菌苏云金芽孢杆菌)、表达bt毒素的转基因植物、或这些手段的组合来尝试控制玉米根虫。作物轮作的缺陷是限制了农田的用途。此外,一些根虫物种可以在玉米之外的作物田间产卵,或者长期的滞育(diapause)可导致卵孵化经历多年,因此会降低用玉米和其他作物实施的作物轮作的效率。化学杀虫剂是最为人们所倚重的实现玉米根虫控制的手段。然而,使用化学杀虫剂并不是完美的玉米根虫控制策略;如果把化学杀虫剂的成本与使用杀虫剂后仍可能发生的根虫害所致的产量损失的成本相加,则美国每年由于玉米根虫可能损失超过10亿美元。大的幼虫群体、大雨、和不适当的杀虫剂应用均可导致玉米根虫控制不充分。此外,杀虫剂的连续使用可能选择杀虫剂抗性根虫品系,并且由于它们对非靶物种有毒性,有严重的影响环境之虞。rna干扰(rnai)是一种利用内源细胞途径的方法,由此对足够大小的整个或任何部分靶基因特异性的干扰rna(irna)分子(例如,双链rna(dsrna)分子)导致由其编码的mrna的降解。在最近几年,在许多物种和实验系统,例如线虫秀丽隐杆线虫、植物、昆虫胚胎、和组织培养物中的细胞中,已经使用rnai进行基因“敲低”。参见,例如fire等人,(1998)nature391:806-11;martinez等人,(2002)cell110:563-74;mcmanus和sharp(2002)naturerev.genetics3:737-47。rnai通过包括切丁酶(dicer)蛋白质复合物的内源途径完成mrna的降解。切丁酶将长的dsrna分子切割成约20个核苷酸的短片段,称作小干扰rna(sirna)。sirna解旋成两个单链rna:乘客链(passengerstrand)和引导链(guidestrand)。乘客链被降解,引导链则被整合到rna诱导的沉默复合物(risc)中。微核糖核酸(mirna)在结构上是非常近似的分子,从前体分子切割而来,前体分子包含连接杂交的乘客链和引导链的多核苷酸“环”,微核糖核酸可以类似地并入risc中。当引导链与互补的mrna分子特异性结合并诱导risc复合物的催化成分argonaute被切割时,发生转录后基因沉默。已知该过程遍布在一些真核生物,例如植物、线虫和一些昆虫的体内,尽管最初的sirna和/或mirna的浓度有限。只有与sirna和/或mirna互补的转录本才会被切割和降解,因此mrna表达的敲低是序列特异性的。在植物中,存在切丁酶基因的几种官能团。rnai的基因沉默效应持续数天,在实验条件下可导致目标转录物的丰度下降90%以上,导致相应的蛋白质水平的降低。在昆虫中,至少有两种切丁酶基因,其中切丁酶1促进argonaute1的mirna指导性降解。leeetal.(2004)cell117(1):69-81。切丁酶2促进argonaute2的sirna引导的降解。美国专利7,612,194和美国专利公开文本2007/0050860、2010/0192265、和2011/0154545披露了自玉米根萤叶甲若虫分离的9112种表达序列标签(est)序列的文库。在美国专利7,612,194和美国专利公开号2007/0050860中提出将与其中披露的玉米根萤叶甲液泡型h+-atp酶(v-atp酶)的几个特定部分序列之一互补的核酸分子与启动子可操作连接,以在植物细胞中表达反义rna。美国专利公开文本no.2010/0192265提出将启动子与核酸分子可操作连接以在植物细胞中表达反义rna,所述核酸分子与具有未知且未公开的功能的玉米根萤叶甲基因的特定部分序列互补(该部分序列据称与秀丽隐杆线虫中的c56c10.3基因产物58%相同)。美国专利公开文本no.2011/0154545提出将启动子与核酸分子可操作连接以在植物细胞中表达反义rna,所述核酸分子与玉米根萤叶甲外被体(coatomer)beta亚单位基因的两个特定部分序列互补。此外,美国专利7,943,819公开了自玉米根萤叶甲幼虫、若虫、和切开的中肠分离的906种表达序列标签(est)序列的文库,并且提出了将启动子与核酸分子可操作连接以在植物细胞中表达双链rna,所述核酸分子与玉米根萤叶带电的多泡体蛋白4b基因的特定部分序列互补。除了v-atp酶的几个特定部分序列和未知功能的基因的特定部分序列之外,在美国专利7,612,194和美国专利公开文本2007/0050860、2010/0192265和2011/0154545中没有进一步提出使用其中列出的超过9000个序列中的任何特定序列进行rna干扰。此外,美国专利7,612,194、以及美国专利公开文本2007/0050860、2010/0192265、和2011/0154545都没有教示提供的超过9000个序列中哪些其他序列在用作dsrna或sirna时在玉米根虫物种中会是致命的、甚至没有教示其有任何其他方面的用处。除了带电多泡体蛋白4b基因的特定部分序列之外,美国专利7,943,819没有提出使用其文中的超过900个序列的任何特定序列进行rna干扰。此外,美国专利7,943,819没有教示其提供的超过900个序列中哪些其他序列在用作dsrna或sirna时在玉米根虫物种中会是致命的、甚至没有教示其有任何其他方面的用处。美国专利申请公开文本u.s.2013/040173和pct申请公开文本wo2013/169923描述了源自玉米根萤叶甲snf7基因的序列在玉米中进行rna干扰的用途。(还公开于bolognesi等人,(2012)plosone7(10):e47534.doi:10.1371/journal.pone.0047534)。与玉米根虫dna互补的绝大多数序列(如上述)用作dsrna或sirna时不提供对玉米根虫物种的植保作用。例如,baum等人(2007,naturebiotechnology25:1322-1326)描述了rnai对几个wcr基因靶的抑制作用。这些作者报告,在超过520ng/cm2的极高irna(例如,dsrna)浓度下,他们测试的26个靶基因中有8个不能提供实验上显著的鞘翅目害虫死亡率。美国专利7,612,194和美国专利申请公开2007/0050860的作者们首次报道了在玉米植株中靶向西方玉米根虫的植物体内(inplanta)rnai。baumetal.(2007)nat.biotechnol.25(11):1322-6。这些作者们描述了一种高通量体内饵食rnai系统,用来筛选用于开发转基因rnai玉米的潜在靶基因。在290种靶物的初始基因池中,只有14种基因展现了幼虫控制潜力。最有效的双链rna(dsrna)中之一靶向了编码囊泡性atp酶亚单位a(v-atpase)的基因,导致相应的内源mrna的迅速阻遏,并以低浓度的dsrna引发了特异性的rnai应答。由此,这些作者首次记录了植物体内rnai作为害虫管理工具的潜力,同时证明,有效的靶物是无法先验地准确鉴定的,即使从较小的一组候选基因鉴定亦然。rnai用于昆虫控制的另一个潜在应用涉及亲代rnai(prnai)。最先描述的prnai是在秀丽隐杆线虫中,通过将dsrna注入体腔(或通过摄取施用dsrna)鉴定,导致后代胚胎中的基因无活性,从而鉴定了prnai。fireetal.(1998)同上;timmonsandfire(1998)nature395(6705):854。在鞘翅目模式生物赤拟谷盗(triboliumcastaneum)中描述了类似的过程,其中对雌性蛹注射了控制胚胎发育过程中分节的三个独特基因的相应dsrna,导致后代胚胎中的合子基因的敲低。bucheretal.(2002)curr.biol.12(3):r85-6。该研究中几乎所有的后代幼虫在注射后一周均显示了基因特异性表型。尽管功能基因组学研究中dsrna的注射在各种昆虫中已经取得成功,但要使得rnai成为害虫管理的有效工具,需要从肠道环境中通过口服暴露于dsrna来摄取dsrna,随后下调必需基因。auerandfrederick(2009)trendsbiotechnol.27(11):644-51。亲代rnai已经被用于描述许多昆虫种类中的胚胎基因的功能,包括跳虫(springtail),orchesellacincta(konopovaandakam(2014)evodevo5(1):2);褐飞虱(nilaparvatalugens);芜菁叶蜂(athaliarosae)(yoshiyamaetal.(2013)j.insectphysiol.59(4):400-7);德国小蠊(blattellagermanica)(piulachsetal.(2010)insectbiochem.mol.biol.40:468-75);和豌豆蚜(acyrthosiphonpisum)(maoetal.(2013)archinsectbiochemphysiol84(4):209-21)。在所有这些情况下,prnai反应通过将dsrna注射到亲代雌性的血腔中来实现。公开本文中公开了用于控制鞘翅目害虫的核酸分子(例如,靶基因、dna、dsrna、sirna、shrna、mirna、和hprna)及其使用方法,所述鞘翅目害虫包括,例如,鞘翅目害虫,诸如玉米根萤叶甲(d.virgiferaleconte)(西方玉米根虫,“wcr”);巴氏根萤叶甲(d.barberismithandlawrence,北方玉米根虫,“ncr”);十一星根萤叶甲(d.u.howardibarber;南方玉米根虫,“scr”);墨西哥玉米根萤叶甲(d.v.zeaekrysanandsmith,墨西哥玉米根虫,“mcr”);黄瓜条根萤叶甲(d.balteataleconte);d.u.tenella;南美叶甲(d.speciosagermar);和d.u.undecimpunctatamannerheim。在具体的实例中,公开了示例性核酸分子,其与鞘翅目害虫中的一个或多个天然核酸序列的至少一部分可以同源。在一些实施方案中,通过降低现有世代的产生下一代害虫的能力来控制鞘翅目害虫。在某些实例中,将核酸分子递送给鞘翅目害虫并不会导致对害虫的显著死亡,而是减少由其产生的可存活后代的数量。在这些和进一步的实例中,天然核酸可以是靶基因,其产物可以,例如但不限于:涉及代谢过程;涉及生殖过程;和/或涉及胚胎和/或幼虫发育。在一些实例中,借助于包含与靶基因同源的多核苷酸的核酸分子进行靶基因的表达转录后抑制,可导致鞘翅目害虫的存活力、生长和/或生殖的降低。在具体的实例中,选择一种hunchback基因作为转录后沉默的靶基因。在具体实例中,有用于转录后抑制的靶基因是本文称为叶甲属(diabrotica)hunchback的新基因(seqidno:1)。因此本文中公开了包含:seqidno:1、seqidno:1的互补物、和/或前述任一者的片段(例如seqidno:3和67)的分离的核酸分子。还公开了包含编码与靶基因产物内的氨基酸序列(例如hunchback基因的产物)至少约85%相同的多肽的多核苷酸的核酸分子。例如,核酸分子可以包含编码与seqidno:2(叶甲属hunchback)和/或叶甲属hunchback的产物内的氨基酸序列至少85%相同的多肽的多核苷酸。进一步公开了包含编码这样的多核苷酸的核酸分子,所述多核苷酸是编码与靶基因产物内的氨基酸序列至少85%相同的多肽的多核苷酸的反向互补物。还公开了用于产生irna(例如,dsrna、sirna、shrna、mirna、和hprna)分子的cdna多核苷酸,所述irna与鞘翅目害虫靶基因(例如hunchback基因)的全部或部分互补。在特定的实施方案中,dsrna、sirna、shrna、mirna、和/或hprna可以在体外产生,或由遗传修饰的生物(如植物或细菌)在体内产生。在特定的实例中,公开了可用于产生与自叶甲属hunchback(seqidno:1)转录的mrna的全部或部分互补的irna分子。进一步公开了用于抑制鞘翅目害虫中必需基因的表达的手段、以及用于保护植物不受害于鞘翅目害虫的手段。用于抑制鞘翅目害虫中必需基因表达的手段是由选自下组的多核苷酸构成的单链或双链rna分子:seqidno:70、seqidno:71、seqidno:72、以及它们的互补物。用于抑制鞘翅目害虫中的必需基因表达的手段的功能等同物包括与自包含seqidno:1的wcr基因转录的mrna的全部或部分基本上同源的单链或双链rna分子。保护植物不受害于鞘翅目害虫的手段是这样的dna分子,其包含与启动子可操作连接的、编码用于抑制鞘翅目害虫中的必需基因的表达的手段的多核苷酸,其中所述dna分子能够整合到玉米植物的基因组中。公开了控制鞘翅目害虫群体的方法,所述方法包括向鞘翅目害虫提供irna(例如,dsrna、sirna、shrna、mirna、和hprna)分子,所述irna分子在被所述害虫摄取之后发挥作用而抑制该害虫体内的生物功能,其中所述irna分子包含选自以下的多核苷酸的全部或部分(例如至少15个连续核苷酸):seqidno:1;seqidno:1的互补物;seqidno:3;seqidno:3的互补物;seqidno:67;seqidno:67的互补物;叶甲属生物(例如wcr)的包含seqidno:1、seqidno:3、和/或seqidno:67的全部或部分的天然编码多核苷酸;叶甲属生物的包含seqidno:1、seqidno:3、和/或seqidno:67的全部或部分的天然编码多核苷酸的互补物;叶甲属生物转录为包含seqidno:1、seqidno:3、和/或seqidno:6全部或部分的天然rna分子的天然非编码多核苷酸;以及叶甲属生物转录为包含seqidno:1、seqidno:3、和/或seqidno:6全部或部分的天然rna分子的天然非编码多核苷酸的互补物。在具体实例中,公开了用于控制鞘翅目害虫的群体的方法,包括对鞘翅目害虫提供irna(例如dsrna、sirna、shrna、mirna和hprna)分子,所述irna分子一旦被该害虫摄取则发挥作用以抑制该害虫体内的生物学功能,其中该irna分子包含选自下组的多核苷酸:seqidno:70的全部或部分;seqidno:70的全部或部分的互补物;seqidno:71;seqidno:71的互补物;seqidno:73;以及seqidno:73的互补物;与包含seqidno:1、3、和/或67的叶甲属生物(例如wcr)的天然编码多核苷酸杂交的多核苷酸;以及与包含seqidno:1、3、和/或67的叶甲属生物(例如wcr)的天然编码多核苷酸杂交的多核苷酸的互补物。本文中还公开了方法,其中可将dsrna、mirna、sirna、shrna、和/或hprna在基于饵食的测定中(diet-basedassay)提供给鞘翅目害虫,或提供在表达dsrna、sirna、shrna、mirna、和/或hprna的遗传修饰的植物细胞中。在这些和另外的实例中,dsrna、sirna、shrna、mirna、和/或hprna可被鞘翅目害虫摄入。然后,本发明的dsrna、sirna、shrna、mirna、和/或hprna的摄入可在该害虫中导致rnai,进而可导致对于该鞘翅目害虫的代谢过程、生殖过程、和/或幼虫发育必需的基因的沉默。因此,公开了方法,其中给鞘翅目害虫提供的多核苷酸,所述核酸分子包含可用于对鞘翅目害虫的亲代控制的示例性核酸序列。在特定的实例中,通过使用本发明的核酸分子控制的鞘翅目害虫可以是wcr、ncr或scr。在一些实例中,将核酸分子递送给鞘翅目害虫并不导致害虫的显著死亡,但是可减少由其产生的可存活的后代的数量。在一些实例中,将核酸分子递送到鞘翅目害虫可导致害虫的显著死亡,并且还可减少由其产生的可存活的后代的数量。参考下文结合附图进行的对若干实施方案的详细说明,前述的特征以及其他特征将会更加自明。附图简述图1包括用于使用用单一一对引物从单个转录模板生成dsrna(图1a)、以及从两个转录模板生成dsrna(图1b)的策略的描述。图2包括对黑腹果蝇,赤拟谷盗和玉米根萤叶甲hunchback蛋白序列的结构域组织的描述。黑腹果蝇、赤拟谷盗和玉米根萤叶甲的hunchback蛋白含有六个c2h2型锌指,使用smart数据库注释。图3包括显示特定dsrna对wcr产卵和生存力的影响的数据的汇总。描绘了每个wcr雌性成虫产卵的卵数(图3a)和孵出的卵的百分比(图3b)。数据是平均值加/减sem。具有相同字母的条棒没有显著差异(p>0.05,n=6)。图4包括在不同实验条件下解剖wcr卵以检查胚胎发育的代表性照片。用gfpdsrna处理的雌性产的卵(图4a)显示正常发育。用hunchbackdsrna处理的雌性产生的卵(图4a-4b)显示不完全胚胎发育和畸形幼虫。图5包括:数据汇总,显示收集自在经处理的人工饵食中暴露于dsrna的wcr雌性的卵中hunchback的相对表达;相对于gfp和水对照(图5a)。还显示了在经处理的人工饵食中暴露于dsrna的雌性成虫中的hunchback的相对表达,相对于gfp和水对照(图5b),在经处理的人工饵食中暴露于dsrna的幼虫中的hunchback的相对表达,相对于gfp和水对照(图5c),以及在经处理的人工饵食中暴露于dsrna的雄性成虫中的hunchback的相对表达,相对于gfp和水对照(图5d)。相同字母的条棒没有显著差异(p>0.05;n=3个生物学重复,每个重复10个卵或幼虫,以及每个样品2个技术重复)。图6包括模型数据的汇总,其显示了prnai效应对从“避难所缀块”(即,在转基因作物中未表达杀虫irna或重组蛋白质的缀块)羽化的雌性wcr成虫的影响的相对幅度,当避难所植物表达杀虫蛋白和亲代活性irna时,对杀虫蛋白(r)和rnai(y)的抗性的等位基因频率增加速率的影响。图7包括模型数据的汇总,其显示了prnai效应对从“避难所缀块”(即,在转基因作物茬中未表达杀虫irna或重组蛋白质的缀块,所述转基因植物包含对玉米根虫幼虫有活性的干扰dsrna以及对玉米根虫有活性的杀虫蛋白的组合)出现的雌性wcr成虫的影响的相对幅度,当非避难所植物所述表达杀虫蛋白以及对幼虫活性的irna和对亲代活性的irna分子二者时,对杀虫蛋白(r)和rnai(y)的抗性的等位基因频率增加速率的影响。图8a示出了显示每个雌虫回收的卵数量的数据的汇总,8b分别显示了在交配前暴露于0.67μg/μl的hunchback或gfp6次、交配后立即暴露6次、以及在交配后六天暴露6次之后,孵化的幼虫的占总数的百分比的结果。比较用dunnett检验进行,*表示p<0.1的显著性,**表示p<0.05的显著性,***表示p<0.001的显著性。图9示出了显示在交配前暴露于0.67μg/μl的hunchback或gfp6次、交配后立即暴露6次、以及交配后6天暴露6次之后,测量的hunchback相对表达的数据的总结。比较用dunnett检验进行,**表示p<0.05的显著性,***表示p<0.001的显著性。图10.在玉米根萤叶甲中使用hunchbackdsrna时,暴露持续时间对prnai应答的影响。用经dsrna处理的饵食喂养雌虫;t表示雌虫接受dsrna(0.67μg/μl)的次数,饵食每隔一天提供,持续12天。10a.产卵:从dsrna喂养的雌虫收集的卵,在最后一次喂食暴露后收集的卵。10b.孵化百分比:以10a产生的卵的数目为基础,孵化的卵数。10c.对于暴露持续时间的相对hunchback转录物表达。比较用dunnett检验进行,*表示p<0.05的显著性。**表示p<0.001的显著性。图11显示了玉米根萤叶甲雌性中浓度反应的相对hunchback转录物。比较用dunnett检验进行,**表示p<0.05的显著性,***表示p<0.001的显著性。序列表使用如37c.f.r.§1.822规定的核苷酸碱基的标准字母缩写,示出了所附序列表中标明的核酸序列。所列出的核酸和氨基酸序列定义了具有以所记载的方式排列的核苷酸和氨基酸单体的分子(即分别为多核苷酸和多肽)。每个列出的核酸和氨基酸序列也定义了包含以所记载的方式排列的核苷酸和氨基酸单体的多核苷酸或多肽的类属(genus)。鉴于遗传密码的冗余,可以理解的是,某个包含编码序列的核苷酸序列同样可还描述一个多核苷酸类属,其中的多核苷酸和由参考序列组成的多核苷酸编码相同的多肽。还应当理解,某个氨基酸序列可描述编码该多肽的多核苷酸orf的类属。对于每个核酸序列仅显示了一条链,仅显示每个核酸序列的一条链,任何对所展示的链的提述应理解为包括对互补链。由于一级核酸序列的互补序列和反向互补序列必然被该一级序列所公开,所以对核酸序列的任何提述也包括核酸序列的互补序列和反向互补序列,但另有明确说明或者从该序列出现的上下文可以明确看出并非如此的除外。此外,如本领域所知,rna链的核苷酸序列决定于转录该rna的dna的序列(除了胸腺嘧啶(t)被尿嘧啶(u)核碱基替换之外),对于某个rna序列而言,任何对编码它的dna序列的提述也包括了该序列。在所附序列表中:seqidno:1显示一个重叠群,其包含来自一个示例性的叶甲属hunchbackdna:gttagatagtggtggtcacatgacattgttatcagtgattttaatacgtgtttttgaggaatgaaaataatagttggattatttctaatacagactttgattcttaccgtgaaatgagaggaggtgtttctgacgatatgacttcaacttgcgttcaaggaggaattagaccaattggacgatatcaaccaaacatgcttatggaaccatcgtctcctcaatctgcctggcagtttcacccagccatgccgaaacgagaacccgtcgatcatgatggcagaaatgactccggcttagcatctggaggtgaatttatttcatcttcaccaggaagtgacaatagtgaacacttcagcgcttcctattcatctccaaccagttgccatacagtaatttctactaatacttattatcccaccaatctaagaagaccttcacaggcgcagacgagtattccaacgcacatgatgtacaccggcgatcacaaccccttaactcccccgaattcggaacctatgatttcgcccaaaagcgtgttatcaagaaacaacgaaggtgaacatcaaactactctgacgccttgtgcgtctcctgaggatgcttctgttgatgctacagacagcgttaattgcgacggtgctttaaaaaaattacaagcgacttttgaaaaaaatgcttttagtgaaggttctggggatgacgataccaaatctgatggagaggcagaagaatacgacgaacaaggactaagagttccaaaagttaactctcatggaaaaattaaaactttcaagtgtaagcaatgtgattttgtggccattactaaactagtcttctgggaacataccaagttacatattaaagctgacaaactccttaaatgccccaagtgtccttttgtcaccgaatataagcaccatttagaatatcaccttagaaatcattatggttcaaaaccatttaaatgtaaccagtgtagttactcttgtgtaaacaaatcaatgcttaattcacatttaaaatctcactctaatatttaccaataccgctgttctgactgcagttatgccacaaaatattgtcattcgctgaaattgcatcttagaaaatactcgcacaaacctgctatggtactaaacccagatggaacaccaaatccgttgcccataatcgatgtttatggtacaaggagaggaccaaagatgaagtcagaacaaaaatcatctgaggaaatgtctccgaaacccgaacaagttctaccattcccatttaaccagtttctaccccaaatgcagttaccattcccaggatttccattatttggaggttttccaggtggcattccaaatcctttgttattgcaaaacttggaaaaactagcccgagaaaggcgtgaatccatgaactcttcagaacgtttttctcccgcacaatcagaacaaatggataccgatgcaggcgttcttgatctcagtaaaccagatgactcttcccagacaaaccgacgaaaagattcagcttacaaactttcaactggtgataattcttcagatgaagaagacgatgaggcaactacaacaatgttcggtaatgttgaagttgttgaaaataaagaactagaagatacttcatcggggaaacagacaccaactagtgctaaaaaggatgactactcgtgccaatactgtcagataaatttcggggaccccgttttgtatactatgcatatgggttaccacggatacaagaatccatttatttgcaacatgtgcggtgaggaatgtaatgataaagtgtctttcttcttgcacattgcacgaaatcctcattcttaaaaatatcaataagactgaattcaaggttagcatttttatatattatattcacactgaaacttttttaatattcaatatttggttgcgtaacatttacgcatatctatactttatttcacgseqidno:2显示由示例性的叶甲属hunchbackdna编码的叶甲属hunchback多肽的氨基酸序列:mrggvsddmtstcvqggirpigryqpnmlmepsspqsawqfhpampkrepvdhdgrndsglasggefissspgsdnsehfsasyssptschtvistntyyptnlrrpsqaqtsipthmmytgdhnpltppnsepmispksvlsrnnegehqttltpcaspedasvdatdsvncdgalkklqatfeknafsegsgdddtksdgeaeeydeqglrvpkvnshgkiktfkckqcdfvaitklvfwehtklhikadkllkcpkcpfvteykhhleyhlrnhygskpfkcnqcsyscvnksmlnshlkshsniyqyrcsdcsyatkychslklhlrkyshkpamvlnpdgtpnplpiidvygtrrgpkmkseqksseemspkpeqvlpfpfnqflpqmqlpfpgfplfggfpggipnplllqnleklarerresmnsserfspaqseqmdtdagvldlskpddssqtnrrkdsayklstgdnssdeeddeatttmfgnvevvenkeledtssgkqtptsakkddyscqycqinfgdpvlytmhmgyhgyknpficnmcgeecndkvsfflhiarnphsseqidno:3显示示例性的叶甲属hunchbackdna,在本文中一些地方称为hunchbackreg1,其在某些实施例中用于产生dsrna:aagtgtaagcaatgtgattttgtggccattactaaactagtcttctgggaacataccaagttacatattaaagctgacaaactccttaaatgccccaagtgtccttttgtcaccgaatataagcaccatttagaatatcaccttagaaatcattatggttcaaaaccatttaaatgtaaccagtgtagttactcttgtgtaaacaaatcaatgcttaattcacatttaaaatctcactctaatatttaccaataccgctgttctgactgcagttatgccacaaaatattgtcattcgctgaaattgcatcttagaaaatactcgcacaaacctgctatggtactaaacccagatggaacaccaaatccgttgcccataatcgatgtttatggtacaaggagaggseqidno:4显示t7噬菌体启动子的核苷酸序列。seqidno:5-8显示用于扩增叶甲属hunchback基因或gfp基因的基因区的引物(包括所有引物都有的t7启动子taatacgactcactataggg)。seqidno:9显示gfp基因。seqidno:10显示示例性的yfp基因。seqidno:11显示膜联蛋白区域1的dna序列。seqidno:12显示膜联蛋白区域2的dna序列。seqidno:13显示β血影蛋白2区域1的dna序列。seqidno:14显示β血影蛋白2区域2的dna序列。seqidno:15显示mtrp-l4区域1的dna序列。seqidno:16显示mtrp-l4区域2的dna序列。seqidno:17-44显示用于扩增膜联蛋白、β血影蛋白2、mtrp-l4、以及yfp的基因区用于dsrna合成的引物。seqidno:45显示包含st-ls1内含子的示例性dna。seqidno:46显示编码叶甲属hunchbackv1发夹形成rna的示例性dna;其含有有义多核苷酸、包含内含子(加有下划线)的环多核苷酸、以及反义多核苷酸(粗体):caataccgctgttctgactgcagttatgccacaaaatattgtcattcgctgaaattgcatcttagaaaatactcgcacaaacctgctatggtactaaacccagatggaacaccaaatccgttgcccataatcgatgtttatggtacaaggagaggagactagtaccggttgggaaaggtatgtttctgcttctacctttgatatatatataataattatcactaattagtagtaatatagtatttcaagtatttttttcaaaataaaagaatgtagtatatagctattgcttttctgtagtttataagtgtgtatattttaatttataacttttctaatatatgaccaaaacatggtgatgtgcaggttgatccgcggttaseqidno:47显示t20vn引物寡核苷酸的核苷酸序列。seqidno:48-52显示用于dsrna转录物表达分析的引物和探针。seqidno:53显示了用于二元载体骨架检测的specr编码区的一部分的核苷酸序列。seqidno:54显示用于基因组拷贝数分析的aad1编码区的核苷酸序列。seqidno:55-66显示用于基因拷贝数确定和二元载体骨架检测的dna寡核苷酸的核苷酸序列。seqidno:67显示了在一些实例中用于产生dsrna的示例性叶甲属hunchback(v1)dna:caataccgctgttctgactgcagttatgccacaaaatattgtcattcgctgaaattgcatcttagaaaatactcgcacaaacctgctatggtactaaacccagatggaacaccaaatccgttgcccataatcgatgtttatggtacaaggagaggaseqidno:68和69显示了在一些实例中用于产生dsrna的hunchbackv1序列的pcr扩增的引物。seqidno:70-73显示了从包含示例性的hunchback多核苷酸及其片段的核酸转录的示例性rna。用于实施发明的模式i.若干实施方案的概览我们开发了rna干扰(rnai)作为昆虫害虫管理的工具,使用表达dsrna的转基因植物的最有可能的靶标害虫物种之一:西方玉米根虫。到目前为止,大多数被建议用作根虫幼虫rnai靶标的基因没有达到其目的,而已鉴定的有用靶标涉及到在幼虫期致死的靶标。在这里,我们描述了在西方玉米根虫中rnai介导的hunchback(hb)的敲低,据显示,例如,当通过提供给成年雌性hunchbackdsrna而递送irna分子时,hunchback的敲低可破坏胚胎发育。当hunchbackdsrna通过口服施用给雌性成虫时,雌性成虫与hunchbackdsrna的接触不影响成虫的寿命。然而,从暴露于hunchbackdsrna的雌性收集的卵几乎完全没有孵化。在本文的实施方案中,通过喂养成年昆虫递送hunchbackdsrna的能力赋予对昆虫(例如鞘翅目)害虫管理非常有用的prnai效应。此外,影响幼虫和成虫根虫的多个目标序列的潜力可能会增加开发涉及rnai技术的可持续的昆虫害虫管理途径的机会。本文中公开了用于遗传控制鞘翅目害虫侵染的方法和组合物。还提供了用于鉴定对于鞘翅目害虫的生命周期必需的一个或多个基因(例如对正常的生殖能力和/或胚胎和/或幼虫发育而言必需的基因),作为靶基因用于rnai介导的鞘翅目害虫群体控制的方法。可设计编码rna分子的dna质粒载体来抑制生长、存活、发育、和/或生殖所必需的靶基因。在一些实施方案中,所述rna分子可能能够形成dsrna分子。在一些实施方案中,提供了通过与昆虫害虫中靶基因的编码或非编码序列互补的核酸分子来转录后阻抑靶基因表达或抑制靶基因的方法。在这些和另外的实施方案中,鞘翅目害虫可以摄取一种或多种从与靶基因的编码或非编码序列互补的核酸分子的全部或部分转录的dsrna、sirna、shrna、mirna、和/或hprna分子,由此提供植物保护效果。一些实施方案涉及使用与靶基因的编码和/或非编码序列互补的dsrna、sirna、shrna、mirna、和/或hprna)对靶基因产物的表达进行序列特异性抑制,以实现对鞘翅目害虫的至少部分控制。公开了一组分离纯化的核酸分子,其包含,例如,如seqidno:1列出的多核苷酸及其片段。在一些实施方案中,可以从这些多核苷酸、其片段、或包含这些多核苷酸中一种或多种的基因表达稳定化的dsrna分子,用于靶基因的转录后沉默或抑制。在某些实施方案中,分离和纯化的核酸分子包含seqidno:1;3;和67的全部或部分。其他实施方案涉及在其基因组中具有编码至少一种irna(例如,dsrna)分子的至少一种重组dna的重组宿主细胞(例如,植物细胞)。在特定的实施方案中,dsrna分子可以在被鞘翅目害虫摄取时产生,使该害虫或该害虫的后代中的靶基因发生转录后沉默或抑制其表达。重组dna可以包含,例如:seqidno:1、3和67中任一者;seqidno:1、3和67中任一者的片段;由包含seqidno:1、3和67中一者的基因的部分序列组成的多核苷酸;和/或其互补物。一些实施方案涉及重组宿主细胞,所述细胞在其基因组中具有重组dna,所述重组dna具有编码至少一种irna(例如,dsrna)分子,所述irna分子包含seqidno:70的全部或部分(例如,选自seqidno:70-73的至少一个多核苷酸)。当被鞘翅目害虫摄入时,irna分子可以在该害虫或该害虫的后代中沉默或抑制靶hunchback基因(例如包含选自seqidno:1、3、67的多核苷酸的全部或部分的dna)的表达,从而导致该害虫的生殖的停止,和/或该害虫的后代中生长、发育和/或进食停止。在其他实施方案中,在其基因组中具有编码至少一种能够形成dsrna分子的rna分子的至少一种重组dna的重组宿主细胞可以是转化的植物细胞。一些实施方案涉及包含这样的转化的植物细胞的转基因植物。除了这样的转基因植物之外,还提供了任何转基因植物世代的后代植物、转基因种子、和转基因植物产品,它们均包含重组dna。在特定的实施方案中,可以在转基因植物细胞中表达能够形成dsrna分子的rna分子。因此,在这些和其他实施方案中,可以从转基因植物细胞分离dsrna分子。在特定的实施方案中,转基因植物是选自下组的植物,包括:玉米(zeamays)、大豆(glycinemax)、棉花、和禾本科(poaceae)的植物。一些实施方案涉及用于调控鞘翅目害虫细胞中靶基因表达的方法。在这些和其他实施方案中,可以提供核酸分子,其中所述核酸分子包含编码能够形成dsrna分子的rna分子的多核苷酸。在特定的实施方案中,编码能够形成dsrna分子的rna分子的多核苷酸可与启动子可操作连接,并且还可与转录终止序列可操作连接。在特定的实施方案中,用于调控鞘翅目害虫细胞中靶基因表达的方法可包括:(a)用包含编码能够形成dsrna分子的rna分子的多核苷酸的载体转化植物细胞;(b)在足以容许形成包含多个转化的植物细胞的植物细胞培养物的条件下培养所述转化的植物细胞;(c)选择已将载体整合到其基因组中的转化的植物细胞;和(d)确定选择的转化的植物细胞包含由载体的所述多核苷酸序列编码的、能够形成dsrna分子的rna分子。可以从基因组中整合有载体、且包含由载体的所述多核苷酸编码的dsrna分子的植物细胞再生植物。还公开了在其基因组中整合有载体的转基因植物,所述载体具有编码能够形成dsrna分子的rna分子的多核苷酸,其中转基因植物包含由所述载体的所述多核苷酸编码的dsrna分子。在特定的实施方案中,植物中能够形成dsrna分子的rna分子的表达足以调控接触了所述转化的植物或植物细胞(例如通过以转化的植物、植物的一部分(例如,根)或植物细胞为食)的鞘翅目害虫细胞中、或者接触了经转化的植物或植物细胞的鞘翅目害虫的后代(例如通过亲代传播)的细胞中靶基因的表达,使得害虫的生殖被抑制。本文中公开的转基因植物可以展现出对鞘翅目害虫侵染的耐受性和/或保护作用。特定的转基因植物可以展现出对一种或多种选自下组的鞘翅目害虫的保护作用和/或增强的保护作用:wcr、ncr、scr、mcr、玉米根萤叶甲、d.u.tenella、南美叶甲、和d.u.undecimpunctatamannerheim。本文中还公开了用于将控制剂(如irna分子等)投送给鞘翅目害虫的方法。这样的控制剂可以直接或间接地阻碍鞘翅目害虫群体进食、生长或以其他方式致害宿主的能力。在一些实施方案中,提供了这样的方法,包括将稳定化的dsrna分子递送至鞘翅目害虫以抑制该害虫或其后代中的至少一种靶基因,从而导致亲代rnai并减少或消除害虫宿主中的植物损害。在一些实施方案中,抑制鞘翅目害虫中靶基因表达的方法可以导致害虫中生殖的停止、和/或害虫的后代中生长、发育、和/或进食的停止。在一些实施方案中,该方法可以显著减少侵染中后续的害虫世代的大小,而不直接导致与irna分子接触的害虫的死亡。在一些实施方案中,该方法可以显著减少侵染中后续的害虫世代的大小,同时也导致接触irna分子的害虫的死亡。在一些实施方案中,提供了包含irna(例如,dsrna)分子的组合物(例如,局部用组合物),供用于植物、动物、和/或植物或动物的环境以消除或降低鞘翅目害虫的侵染。在一些实施方案中,提供了包含原核生物的组合物,所述原核生物包含编码irna分子的dna;例如,转化的细菌细胞。在具体实例中,这种转化的细菌细胞可以用作常规的农药制剂。在特定的实施方案中,组合物可以是要喂给鞘翅目害虫的营养组合物或资源,或食物来源。一些实施方案包括使害虫可得到所述营养组合物或食物来源。包含irna分子的组合物的摄入可导致所述分子被鞘翅目害虫的一个或多个细胞摄取,进而可导致害虫或其后代的细胞中至少一种靶基因表达的抑制。通过在害虫的宿主中提供一种或多种包含irna分子的组合物,可以在任何存在鞘翅目害虫的宿主组织或环境之中或之上限制或消除该害虫侵染对植物或植物细胞的摄入或损伤。本文中公开的组合物和方法可与针对其他用于控制鞘翅目害虫所示损害的方法和组合物联用。例如,本文中所描述的用于针对鞘翅目害虫保护植物的irna分子可以在这样的方法中使用,所述方法包括另外使用一种或多种针对鞘翅目害虫有效的化学剂、针对这样的害虫有效的生物杀虫剂、作物轮作、展现出与rnai介导的方法和rnai组合物的特征不同的特征(例如,在植物中重组产生对于鞘翅目害虫有害的蛋白质(例如,bt毒素))的重组遗传技术、和/或重组表达非亲代irna分子(例如可导致摄取该irna分子的鞘翅目害虫中生长、发育和/或进食停止的致命性irna分子)。ii.缩写dsrna双链核糖核酸gi生长抑制gfp绿色荧光蛋白ncbi美国国家生物技术信息中心gdna基因组脱氧核糖核酸irna抑制性核糖核酸orf开放阅读框rnai核糖核酸干扰mirna微小核糖核酸sirna小抑制性核糖核酸hprna发夹核糖核酸shrna短发夹核糖核酸prnai亲代rna干扰utr非翻译区wcr西方玉米根虫(玉米根萤叶甲)ncr北方玉米根虫(巴氏根萤叶甲)mcr墨西哥玉米根虫(墨西哥玉米根萤叶甲)pcr聚合酶链式反应qpcr定量聚合酶链式反应riscrna诱导的沉默复合物rh相对湿度scr南方玉米根虫(十一星根萤叶甲)sem均值标准误snrna小细胞核核糖核酸yfp绿色荧光蛋白iii.术语在以下描述和表中,使用了许多术语。为了提供对说明书和权利要求书的清楚且一致的理解,包括要赋予此类术语的范围,提供了以下定义:鞘翅目害虫:如本文中使用的,术语“鞘翅目害虫”指以农业作物和作物产品,包括玉米和其它真正的禾本科为食的、属于鞘翅目(coleoptera)的害虫昆虫,包括属于叶甲属的害虫。在具体的例子中,鞘翅目害虫选自下列清单,包括:玉米根萤叶甲(wcr);巴氏根萤叶甲(ncr);十一星根萤叶甲(scr);墨西哥玉米根萤叶甲(mcr);黄瓜条根萤叶甲;d.u.tenella;和d.u.undecimpunctatamannerheim。(与生物)接触:如本文中使用的,与生物(例如,鞘翅目害虫)“接触”或被生物“摄取”等术语,就核酸分子而言,包括核酸分子内化到生物中,例如但不限于:生物摄取分子(例如,通过进食);使生物与包含核酸分子的组合物接触;以及用包含核酸分子的溶液浸泡生物。重叠群:如本文中使用的,术语“重叠群”指从一组来源于单一遗传来源的重叠dna区段重建的dna序列。玉米植物:如本文中使用的,术语“玉米植物”指物种玉蜀黍(玉米)的植物。术语“玉米植物”和“玉蜀黍”在本文中可互换使用。表达:如本文中使用的,编码多核苷酸(例如,基因或转基因)的“表达”是指这样的过程,通过该过程,核酸转录单元(包括,例如gdna或cdna)的编码信息被转化为细胞的操作部分、非操作部分、或结构部分(常常包括蛋白质的合成)。基因表达可能受到外部信号的影响,例如细胞、组织、或生物暴露于增加或降低基因表达的物质。基因表达也可以在从dna到rna再到蛋白质的途径中的任何位置受到调节。例如,通过控制对转录、翻译、rna运输和加工、中间分子比如mrna的降解的作用,或通过在特异性蛋白分子已经产生之后的活化、失活、区室化、或降解,或它们的组合,由此发生基因表达的调节。通过本领域已知的任何方法,包括但不限于,northern印迹、rt-pcr、western印迹,或体外、原位或体内蛋白活性测定,可以在rna水平或蛋白质水平测量基因表达。遗传物质:如本文中使用的,术语“遗传物质”包括所有基因和核酸分子,诸如dna和rna。抑制:如本文中使用的,术语“抑制”在用于描述对编码多核苷酸(例如基因)的影响时是指从编码多核苷酸转录的mrna和/或编码多核苷酸的肽、多肽、或蛋白质产物的细胞水平的可测量的降低。在一些实例中,抑制编码多核苷酸的表达可以使得表达大致消失。“特异性抑制”是指在实现特异性抑制的细胞中对靶编码多核苷酸的抑制不对其他编码多核苷酸(例如,基因)的表达产生影响。分离的:“分离的”生物学组分(诸如核酸、肽或蛋白质)是已经从该组分所天然存在的生物细胞中的其他生物学组分(即,其他染色体和染色体外的dna和rna、和蛋白质)实质性分开、分开产生、或纯化出来,同时实现组分中的化学或功能变化(例如,核酸可以通过断开将核酸连接到染色体中的其余dna的化学键而从染色体分离)。已经“分离的”核酸分子和蛋白质包括通过标准纯化方法纯化的核酸分子和蛋白质。该术语还包括通过在宿主细胞内重组表达制备的核酸分子和蛋白质,以及化学合成的核酸分子、蛋白质和肽。核酸分子:如本文中使用的,术语“核酸分子”可以是指核苷酸的聚合物形式,可包括rna、cdna、gdna的有义和反义链,以及上述情形的合成形式和混合聚合物。核苷酸或核碱基可以是指核糖核苷酸、脱氧核糖核苷酸、或这两种类型核苷酸的任一者的修饰形式。如本文中使用的“核酸分子”与“核酸”和“多核苷酸”是同义词。除非另外指明,核酸分子通常在长度上具有至少10个碱基。根据惯例,核酸分子的核苷酸序列从分子的5’至3’端阅读。核酸分子的“互补物”(即互补序列)是指具有可以与该核酸分子的核碱基形成碱基对(即,a-t/u,和g-c)的核碱基的多核苷酸。一些实施方案包括包含转录为rna分子的模板dna的核酸,所述rna分子是mrna分子的互补序列。在这些实施方案中,转录为mrna分子的核酸的互补物以5'至3'方向存在,使得rna聚合酶(其以5'至3'方向转录dna)将从互补物转录出可以与mrna分子杂交的核酸。因此,除非另有明确说明或者从上下文中可以清楚地看出另有所指,术语“互补物”是指具有可以与特定核苷酸序列的核碱基形成碱基对的从5'至3'的核碱基的多核苷酸。类似地,除非另有明确说明或者从上下文中可以清楚地看出另有所指,核酸的“反向互补物”是指相反取向的互补物。前述内容在以下图示中示出:atgatgatg多核苷酸tactactac该多核苷酸的“互补物”catcatcat该多核苷酸的“反向互补物”本发明的一些实施方案可包括形成发夹rna的rnai分子。在这些rnai分子中,rna干扰的靶核酸的互补物和反向互补物可以出现在同一分子中,使得单链rna分子在包含互补和反向互补的多核苷酸的区域上可以“回折”并与自身杂交。“核酸分子”包括所有多核苷酸,例如:dna的单链和双链形式;rna的单链形式;和rna的双链形式(dsrna)。术语“核苷酸序列”或“核酸序列”是指作为个别单链或在双链体中的核酸有义和反义链两者。术语“核糖核酸”(rna)包括irna(抑制性rna)、dsrna(双链rna)、sirna(小干扰rna)、shrna(小发夹rna)、mrna(信使rna)、mirna(微小rna)、hprna(发夹rna)、trna(转运rna)(无论是装载还是卸下相应的酰化氨基酸)、和crna(互补rna)。术语“脱氧核糖核酸”(dna)包括cdna、gdna、和dna-rna杂交体。术语“多核苷酸”、“核酸”、及其“片段”,如本领域技术人员将理解的,是包括gdna、核糖体rna、转运rna、信使rna、操纵子、和较小的工程化多核苷酸的术语,其编码或可适用于编码肽、多肽、或蛋白质。寡核苷酸:寡核苷酸是短的核酸聚合物。寡核苷酸可通过切割较长核酸区段、或通过使单独的核苷酸前体聚合而形成。自动合成仪能够合成长度多达几百个碱基的寡核苷酸。由于寡核苷酸可与互补的核酸结合,因此它们可用作检测dna或rna的探针。由dna(寡脱氧核糖核苷酸)组成的寡核苷酸可以用于pcr,pcr是一种用于扩增dna的技术。在pcr中,寡核苷酸一般被称为“引物”,其允许dna聚合酶延伸寡核苷酸并复制互补链。核酸分子可以包括天然存在的核苷酸和/或修饰核苷酸,它们通过天然存在和/或非天然存在的核苷酸连接而连接在一起。本领域技术人员易于理解,核酸分子可被化学修饰或生物化学修饰,或者可以含有非天然的或衍生化的核苷酸碱基。这些修饰包括,例如,标记物、甲基化、用类似物取代一个或多个天然存在的核苷酸、核苷酸间修饰(例如,如不带电连接(unchargedlinkage)的修饰:例如甲基膦酸盐、磷酸三酯、氨基磷酸酯、氨基甲酸酯等;带电连接(chargedlinkage)的修饰:例如,硫代磷酸酯、二硫代磷酸酯等;悬垂部分的修饰:例如肽类;嵌入剂修饰:例如吖啶、补骨脂素等;螯合剂修饰;烷化剂(alkylator)修饰;和修饰的连接:例如α异头核酸等)。术语“核酸分子”还包括任何拓扑结构,包括单链的、双链的、部分双链体的、三链体的、发夹形的(hairpinned)、圆形的、挂锁形的结构。如本文中使用的,就dna而言,术语“编码多核苷酸”、“结构多核苷酸”、或“结构核酸分子”是指这样的多核苷酸,当被置于适当的调节元件控制下时,其通过转录和mrna最终翻译成多肽。就rna而言,术语“编码多核苷酸”指翻译成肽、多肽或蛋白质的多核苷酸。编码多核苷酸的边界由5’端的翻译起始密码子和3’端的翻译终止密码子所界定。编码多核苷酸包括但不限于:gdna;cdna;est;和重组多核苷酸。如本文所用的,“转录的非编码多核苷酸”是指mrna分子的区段,例如不被翻译成肽、多肽或蛋白质的5'utr、3'utr和内含子片段。此外,“转录的非编码多核苷酸”是指转录成在细胞中起作用的rna的核酸,例如结构rna(例如,核糖体rna(rrna),其实例有5srrna、5.8srrna、16srrna、18srrna、23srrna和28srrna等);转运rna(trna);和snrna诸如u4,u5,u6等。转录的非编码多核苷酸还包括例如但不限于小rna(srna),该术语通常用于描述小细菌非编码rna;小核仁rna(snorna);微rna;小干扰rna(sirna);piwi相互作用rna(pirna);和长非编码rna。此外,“转录的非编码多核苷酸”是指可以在核酸中作为基因内“接头”本身存在并且被转录成rna分子的多核苷酸。致死性rna干扰:如本文所用的,术语“致死性rna干扰”是指可导致受试者个体死亡或存活力降低的rna干扰,所述受试者个体被递送了例如dsrna,mirna,sirna,shrna和/或hprna。亲代rna干扰:如本文所用,术语“亲代rna干扰”(prnai)是指可以在受试者(例如,鞘翅目害虫)的后代中观察到的rna干扰表型,所述受试者个体被递送了例如dsrna、mirna、sirna、shrna和/或hprna。在一些实施方案中,prnai包括将dsrna递送至鞘翅目昆虫,其中该害虫产生可存活后代的能力由此被降低。启动prnai的核酸可以增加,也可以不增加被递送了该核酸的群体中的死亡发生率。在某些实例中,启动prnai的核酸不增加被递送了该核酸的群体中的死亡发生率。例如,某个鞘翅目害虫群体可以被饲以一种或多种启动prnai的核酸,其中这些害虫存活并交配,但其产生的卵比未被饲以所述核酸的相同物种的害虫所产的卵相比,孵化出可存活的后代的能力较低。在prnai的一种机制中,递送到雌性的亲代rnai能够敲除雌性后代胚胎中的合子基因表达。bucheretal.(2002)curr.biol.12(3):r85-6。基因组:如本文中所使用的,术语“基因组”是指存在于细胞核内的染色体dna,并且也指存在于细胞的亚细胞组成部分内的细胞器dna。在本发明的一些实施方案中,可以将dna分子导入植物细胞中,使得dna分子整合到植物细胞的基因组中。在这些和另外的实施方案中,dna分子可以整合到植物细胞的核dna中,或整合到植物细胞的叶绿体或线粒体的dna中。术语“基因组”在其应用于细菌时,指细菌细胞内的染色体和质粒两者。在本发明的一些实施方案中,可以将dna分子导入细菌中,使得dna分子整合到细菌的基因组中。在这些和另外的实施方案中,dna分子可以整合于染色体,或者作为稳定的质粒定位或位于稳定的质粒中。序列同一性:如本文中使用的术语“序列同一性”或“同一性”,在两个多核苷酸或多肽的情况下,是指在指定比较窗口上以最大对应性比对时,这两个分子的序列中相同的残基。如本文中使用的,术语“序列同一性百分比”可以是指通过在比较窗口上比较分子的两个最优比对序列(例如,核酸序列或多肽序列)确定的值,其中为了实现这两个序列的最优比对,该比较窗口中的序列部分相比于参考序列(其不包含添加或缺失)可以包含添加或缺失(即,空位)。通过确定在两个序列中出现相同核苷酸或氨基酸残基的位置的数目而产生匹配位置数,用该匹配位置数除以比较窗口中位置的总数,将结果乘以100而产生序列同一性的百分比,从而计算出该百分比。每个位置与参考序列相比均相同的序列被认为是与参考序列是100%相同的,反之亦然。用于比较的序列比对方法是本领域技术人员熟知的。各种程序和比对算法例如描述于smith和waterman(1981)adv.appl.math.2:482;needleman和wunsch(1970)j.mol.biol.48:443;pearson和lipman(1988)proc.natl.acad.sci.u.s.a.85:2444;higgins和sharp(1988)gene73:237-44;higgins和sharp(1989)cabios5:151-153;corpet等人,(1988)nucleicacidsres.16:10881-90;huang等人,(1992)comp.appl.biosci.8:155-65;pearson等人,(1994)methodsmol.biol.24:307-31;tatiana等人(1999)femsmicrobiol.lett.174:247-50。序列比对方法和同源性计算的详细考虑事项可见于例如,altschul等人,(1990)j.mol.biol.215:403-10。美国国家生物技术信息中心(ncbi)基本局部比对搜索工具(blasttm;altschul等人(1990))可在几个来源访问,包括美国国家生物技术信息中心(bethesda,md)、以及在互联网上,其与几种序列分析程序结合使用。怎样使用该程序确定序列同一性的描述可在互联网上blasttm的“帮助”部分获得。为了比较核酸序列,可以采用利用默认参数的默认blosum62矩阵集的blasttm(blastn)程序的“blast2序列”函数。在用这种方法评估时,与参考多核苷酸的序列具有较大序列相似性的核酸将显示出同一性百分比的增加。可特异性杂交/特异性互补:如本文中使用的,术语“可特异性杂交”和“特异性互补”是表明互补性的足够程度的术语,该互补性足以使得在核酸分子与靶核酸分子之间发生稳定且特异的结合。在两个核酸分子之间的杂交两种涉及核酸分子的核碱基之间的反平行比对的形成。然后,两个分子能够与相反链上的相应碱基形成氢键以形成双链体分子,如果该双链体分子足够稳定,则可使用本领域中熟知的方法检出。多核苷酸与其可特异性杂交的靶核酸不一定是100%互补的。然而,对于特异性杂交而言必须存在的序列互补性的量依赖所使用的杂交条件而变化。导致特定严格程度的杂交条件会根据选择的杂交方法的性质和杂交的核酸的组成和长度而变化。通常,杂交的温度和杂交缓冲液的离子强度(尤其是na+和/或mg++浓度)将决定杂交严格性,虽然洗涤次数也会影响严格性。关于获得特定严格性程度所需要的杂交条件的计算是本领域普通技术人员已知的,并且论述于例如sambrook等人(编辑)molecularcloning:alaboratorymanual,2nded.,vol.1-3,coldspringharborlaboratorypress,coldspringharbor,ny,1989,chapters9and11;以及hames和higgins(编辑)nucleicacidhybridization,irlpress,oxford,1985。关于核酸杂交的进一步详细说明和指导例如可见于tijssen,"overviewofprinciplesofhybridizationandthestrategyofnucleicacidprobeassays,"inlaboratorytechniquesinbiochemistryandmolecularbiology-hybridizationwithnucleicacidprobes,parti,chapter2,elsevier,ny,1993;以及ausubel等人编辑,currentprotocolsinmolecularbiology,chapter2,greenepublishingandwiley-interscience,ny,1995。如本文中使用的,“严格条件”涵盖仅在杂交分子的序列与靶核酸分子内的同源多核苷酸之间存在的错配小于20%时才发生杂交的条件。“严格条件”包括另外的特定严格性水平。因此,如本文中使用的,“中等严格性”条件为具有超过20%的以上序列错配的分子将不会杂交的条件;“高严格性”条件为具有超过10%的错配的序列将不会杂交的条件;并且“极高严格性”条件为具有超过5%的错配的序列将不会杂交的条件。以下是代表性的非限制性杂交条件:高严格性条件(检测出共享至少90%序列同一性的多核苷酸):在5xssc缓冲液中在65℃杂交16小时;在2xssc缓冲液中在室温下洗涤两次,每次15分钟;并且在0.5xssc缓冲液中在65℃洗涤两次,每次20分钟。中等严格性条件(检测出共享至少80%序列同一性的多核苷酸):在5x到6xssc缓冲液中在65--70℃杂交16-20小时;在2xssc缓冲液中在室温下洗涤两次,每次5-20分钟;并且在1xssc缓冲液中在55-70℃洗涤两次,每次30分钟。非严格对照条件(共享至少50%序列同一性的多核苷酸会杂交):在6xssc缓冲液中在室温到55℃杂交16-20小时;在2x到3xssc缓冲液中在室温到55℃洗涤至少两次,每次20-30分钟。如本文中使用的,术语“基本上同源”或“实质同源性”就核酸而言是指具有这样的连续核碱基的多核苷酸,所述连续核碱基在严格条件下与参考核酸杂交。例如,与seqidno:1、3、46和67中任一个的参考核酸序列基本上同源的序列的核酸是在严格条件(例如,上文列出的中等严格性条件)下与seqidno:1、3、46和67中任一个的参考核酸杂交的那些核酸。基本上同源的多核苷酸可以具有至少80%序列同一性。例如,基本上同源的多核苷酸可以具有约80%到100%序列同一性,诸如约79%;80%;约81%;约82%;约83%;约84%;约85%;约86%;约87%;约88%;约89%;约90%;约91%;约92%;约93%;约94%;约95%;约96%;约97%;约98%;约98.5%;约99%;约99.5%;和约100%。实质性同源性的特性与特异性杂交紧密相关。例如,当存在足够的互补程度时,核酸分子可特异性地杂交,以便避免核酸在特异性结合是期望的情况下(例如,在严格杂交条件下)与非靶多核苷酸的非特异性结合。如本文中使用的,术语“直系同源物”是指两种或更多种物种中已经从共同的祖先核酸进化并且可以在所述两种或更多种物种中保留相同功能的基因。如本文中使用的,当一个多核苷酸以5’至3’方向阅读的每个核苷酸与另一多核苷酸以3’至5’方向阅读时的每个核苷酸序列互补时,两个核酸分子被认为展现出“完全互补性”。与参考多核苷酸互补的多核苷酸将展现出与参考多核苷酸的反向互补物相同的序列。这些术语和描述是本领域中定义明确的,并且是本领域普通技术人员容易理解的。可操作(地)连接:当第一多核苷酸与第二多核苷酸处于功能性关系中时,则第一多核苷酸与第二多核苷酸是可操作连接的。当以重组方式产生时,可操作连接的多核苷酸通常是连续的,并且在需要将两个蛋白质编码区连接在一起的场合,二者在同一个阅读框内(例如,在翻译融合的orf中)。然而,可操作连接的核酸不一定是连续的。在有关调节性遗传元件和编码多核苷酸的语境下使用时,术语“可操作连接”意味着该调节元件影响该连接的编码序列的表达。“调节元件”或“控制元件”是指影响转录的周期和水平/量、rna加工或稳定性、或相关编码多核苷酸的翻译的多核苷酸。调节元件可以包括启动子;翻译前导;内含子;增强子;茎环结构;阻抑物结合多核苷酸;具有终止序列的多核苷酸;具有多腺苷酸化识别序列的多核苷酸等。特定的调节元件可位于与其可操作连接的编码多核苷酸的上游和/或下游。并且,与编码多核苷酸可操作连接的特定调节序列可位于双链核酸分子的相关互补链上。启动子:如本文中使用的,术语“启动子”是指可以在转录起始上游的、且可能涉及rna聚合酶与其他蛋白质的识别和结合而启动转录的dna区域。启动子可与用于在细胞中表达的编码多核苷酸可操作连接,或者启动子可与编码信号序列的多核苷酸可操作连接,所述多核苷酸可与用于在细胞中表达的编码多核苷酸可操作连接。“植物启动子”可以是能够启动植物细胞转录的启动子。在发育控制下的启动子的实例包括优先启动某些组织中的转录的启动子,所述组织例如叶、根、种子、纤维、木质部导管、管胞、或厚壁组织。这样的启动子称为“组织优先”启动子。仅启动某些组织中的转录的启动子被称为“组织特异性”启动子。“细胞类型特异性”启动子主要驱动一个或多个器官中某些细胞类型(例如,根或叶中的维管细胞)中的表达。“诱导型”启动子可以是可以在环境控制之下的启动子。可通过诱导型启动子启动转录的环境条件的实例包括厌氧条件和光的存在。组织特异性启动子、组织优先启动子、细胞类型特异性启动子、和诱导型启动子构成“非组成型”启动子类别。“组成型”启动子是可在大多数环境条件下或在大多数组织或细胞类型中有活性的启动子。在本发明的一些实施方案中可以使用任何诱导型启动子。参见ward等人,(1993)plantmol.biol.22:361-366。利用诱导型启动子,转录速率响应于诱导剂而增加。诱导型启动子的实例包括但不限于:来自响应于铜的acei系统的启动子;响应于苯磺酰胺除草剂安全剂的来自玉米的in2基因启动子;来自tn10的tet阻抑物;和来自类固醇激素基因的诱导型启动子,其转录活性可通过糖皮质激素诱导(schena等人,(1991)proc.natl.acad.sci.usa88:0421)。示例性的组成型启动子包括,但不限于:来自植物病毒的启动子,例如来自花椰菜花叶病毒(camv)的35s启动子;来自水稻肌动蛋白基因的启动子;泛素启动子;pemu;mas;玉米h3组蛋白启动子;和als启动子,欧洲油菜als3结构基因5'的xba1/ncoi片段(或与所述xba1/ncoi片段相似的多核苷酸)(国际pct公布号美国专利wo96/30530)。另外,在本发明的一些实施方案中可以利用任何组织特异性或组织优先启动子。用包含与组织特异性启动子可操作连接的编码多核苷酸的核酸分子转化的植物可唯一地或优先地在特异性组织中产生所述编码多核苷酸的产物。示例性的组织特异性或组织优先启动子包括但不限于:种子特异性启动子,如来自菜豆蛋白基因的启动子;叶特异性和光诱导型启动子,如来自cab或rubisco的启动子;花药特异性启动子,如来自lat52的启动子;花粉特异性启动子,如来自zm13的启动子;以及小孢子优先启动子,如来自apg的启动子。大豆植物:如本文中使用的,术语“大豆植物”是指属于大豆属物种(glycinesp.)的植物,例如大豆(glycinemax)。转化:如本文中使用的,术语“转化”或“转导”是指将一个或多个核酸分子转移到细胞中。当核酸分子通过核酸分子并入细胞基因组中、或通过附加型复制而由该细胞稳定复制时,细胞被转导到该细胞中的核酸分子“转化”。如本文中使用的,术语“转化”涵盖可将核酸分子导入这种细胞中的所有技术。实例包括但不限于:用病毒载体转染;用质粒载体转化;电穿孔(fromm等人,(1986)nature319:791-3);脂质体转染(felgner等人,(1987)proc.natl.acad.sci.usa84:7413-7);显微注射(mueller等人,(1978)cell15:579-85);土壤杆菌介导的转移(fraley等人,(1983)proc.natl.acad.sci.usa80:4803-7);直接dna摄取;和微粒轰击(klein等人,(1987)nature327:70)。转基因:外源核酸。在一些实例中,转基因可以是编码rna的dna,所述rna能够形成dsrna分子的一条或两条链,包含与存在于鞘翅目害虫中的核酸分子互补的多核苷酸。在另外的实例中,转基因可以是反义多核苷酸,其中反义多核苷酸的表达抑制靶核酸的表达,从而产生亲代rnai表型。在又另外的实例中,转基因可以为基因(例如除草剂耐性基因、编码工业或药学上有用的化合物的基因、或编码期望的农业性状的基因)。在这些和其他实例中,转基因可以含有与转基因的编码多核苷酸可操作连接的调节元件(例如,启动子)。载体:引入到细胞中,例如产生转化的细胞的核酸分子。载体可以包含允许其在宿主细胞中复制的遗传元件,诸如复制起点。载体的实例包括但不限于:质粒;粘粒;噬菌体;和携带外源dna或rna进入细胞中的病毒。载体还可包括一种或多种基因、包括产生反义分子的基因、和/或选择标志物基因和本领域已知的其他遗传元件。载体可以转导、转化或感染细胞,由此引起细胞表达核酸分子和/或由该载体编码的蛋白质。任选地,载体包括辅助核酸分子实现进入细胞中的物质(例如脂质体、蛋白质包衣等)。产量:相对于在相同生长位置在相同时间且在相同条件下生长的检验品种的产量,约100%或更大的稳定化产量。在特定的实施方案中,“提高的产量”或“提高产量”意指相对于在含有相当大密度的对该作物有害的鞘翅目害虫(本申请的组合物和方法以所述害虫为目标)的相同生长位置在相同时间且在相同条件下生长的检验品种的产量,具有105%或更大的稳定化产量的栽培种。除非特别指明或暗示,如本文中使用的术语“一个”、“一种”和“该”表示“至少一个/种”。除非另外特别地解释,本文中使用的全部技术术语和科学术语具有与属于本公开的领域之内的普通技术人员通常所理解的相同的含义。可以在以下出版物中找到分子生物学中常见术语的定义:例如,lewin’sgenesx,jones&bartlettpublishers,2009(isbn100763766321);krebs等人(编辑),theencyclopediaofmolecularbiology,blackwellscienceltd.,1994(isbn0-632-02182-9);和meyersr.a.(编辑),molecularbiologyandbiotechnology:acomprehensivedeskreference,vchpublishers,inc.,1995(isbn1-56081-569-8)。除非另有说明,所有百分比均以重量计,所有溶剂混合物比例以体积计。所有温度以摄氏度计。iv.包含鞘翅目害虫多核苷酸的核酸分子a.概述本文中描述了可用于控制鞘翅目害虫的核酸分子。描述的核酸分子包括靶多核苷酸(例如,天然基因、和非编码多核苷酸)、dsrna、sirna、shrna、hprna、和mirna。例如,在一些实施方案中描述了dsrna、mirna、sirna、shrna和/或hprna分子,其可与鞘翅目害虫中的一种或多种天然核酸的全部或部分特异性地互补。在这些和另外的实施方案中,天然核酸可以是一种或多种靶基因,其产物可以例如但不限于:涉及生殖过程或涉及幼虫发育。本文中描述的核酸分子在导入包含至少一种与该核酸分子特异性互补的天然核酸的细胞中时(例如通过亲代传播),可以在细胞中启动rnai,随后降低或消除该天然核酸的表达。在一些实例中,借助于与靶基因特异性互补的核酸分子降低或消除靶基因表达,可导致鞘翅目害虫的生殖停止,和/或该害虫的后代中生长、发育和/或进食停止。这些方法可能显著地减少侵袭中后续害虫世代的大小,例如不导致接触该irna分子的害虫的死亡。在一些实施方案中,可以选择鞘翅目害虫中的至少一种靶基因,其中靶基因包含hunchback多核苷酸。在具体的实例中,选自鞘翅目害虫中的靶基因,其中该靶基因包含选自seqidno:1、3和67的多核苷酸。西方玉米根虫hunchback代表1955bp和573个氨基酸(hunchback蛋白)的序列。在该序列内,预测位置226-248、255-277、283-305、311-335、520-542和548-572处有六个c2h2型锌指结构域,与其作为锌指转录因子的功能一致。参见例如tautzetal.(1987)nature327:383-9。当使用blastp算法在ncbi数据库中进行搜索时,最相似的序列来自赤拟谷盗,它仅显示53%的序列同一性。在一些实施方案中,靶基因可以是包含这样的多核苷酸的核酸分子,该多核苷酸能够在计算机上逆翻译成包含连续氨基酸序列的多肽:所述连续氨基酸序列与hunchback多核苷酸的蛋白质产物的氨基酸序列至少约85%相同(例如,至少84%、85%、约90%、约95%、约96%、约97%、约98%、约99%、约100%、或100%相同)。靶基因可以是鞘翅目害虫中的任何核酸,对该序列的转录后抑制会对该害虫的产生可存活的后代的能力造成有害影响,从而,例如,给植物提供针对该害虫的保护效益。在具体的实例中,靶基因是这样的核酸分子,其包含能够在计算机上反向翻译为多肽的多核苷酸,所述多肽包含与作为seqidno:2的计算机翻译产物的氨基酸序列至少约85%相同、约90%相同、约95%相同、约96%相同、约97%相同、约98%相同、约99%相同、约100%相同、或100%相同的连续氨基酸序列。依照一些实施方案提供了dna,其表达生成包含这样的多核苷酸的rna分子,该多核苷酸与由鞘翅目害虫中的编码多核苷酸编码的天然rna分子的全部或部分特异性地互补。在一些实施方案中,在鞘翅目害虫摄入表达的rna分子后,可以获得该害虫细胞中,或该害虫的后代的细胞中编码多核苷酸的下调。在特定的实施方案中,鞘翅目害虫细胞中编码多核苷酸的下调导致该害虫的生殖和/或增殖的减少或停止,和/或该害虫的后代中生长、发育和/或进食的减少或停止。在一些实施方案中,靶多核苷酸包括转录的非编码性rna,诸如5’utr;3’utr;剪接前导;内含子;末端内含子(outron)(例如,随后在反式剪接中修饰的5'utrrna);donatron(例如,提供反式剪接的供体序列需要的非编码rna);和鞘翅目害虫靶基因的其他非编码转录rna。这样的多核苷酸可以衍生自单顺反子和多顺反子基因两者。因此,本文中结合一些实施方案还描述了包含至少一种多核苷酸的irna分子(例如,dsrna、mirna、sirna、shrna和hprna),所述多核苷酸与鞘翅目害虫中的靶核酸的全部或部分特异性地互补。在一些实施方案中,irna分子可以包含与多个靶核酸,例如2、3、4、5、6、7、8、9、10、或更多个靶核酸的全部或部分互补的多核苷酸。在特定的实施方案中,irna分子可以在体外产生,或通过遗传修饰的生物(如植物或细菌)在体内产生。还公开了cdna,其可以用于产生与鞘翅目害虫中的靶核酸的全部或部分特异性地互补的dsrna分子、sirna分子、mirna分子、shrna分子、和/或hprna分子。进一步描述了在实现特定宿主靶标的稳定转化中使用的重组dna构建体。转化的宿主靶标可以从重组dna构建体表达有效水平的dsrna、sirna、mirna分子、shrna分子、和/或hprna分子。因此,还描述了植物转化载体,其包含与在植物细胞中功能性的异源启动子可操作连接的至少一个多核苷酸,其中多核苷酸的表达生成包含与鞘翅目害虫中的靶核酸的全部或部分特异性地互补的连续核碱基串的rna分子。在特定实例中,可用于控制鞘翅目害虫的核酸分子可以包括:从叶甲属分离的包含hunchback多核苷酸(例如seqidno:1、3和67中任一者)的天然核酸的全部或部分;dna,其在表达时生成这样的rna分子:所述rna分子包含与由hunchback编码的天然rna分子的全部或部分特异性地互补的多核苷酸;irna分子(例如,dsrna、mirna、sirna、shrna和hprna),所述irna分子包含与hunchback编码的rna分子的全部或部分特异性地互补的至少一个多核苷酸;可用于产生dsrna分子、sirna分子、mirna、shrna和/或hprna分子的cdna,所述分子与hunchback编码的rna分子的全部或部分特异性地互补;以及用于在实现特定宿主靶标的稳定转化中使用的重组dna构建体,其中转化的宿主靶标包含一种或多种前述的核酸分子。b.核酸分子本发明提供了,除其他事项外,抑制鞘翅目害虫的细胞、组织、或器官中的靶基因表达的irna(例如,dsrna、mirna、sirna、shrna和hprna)分子;和能够在细胞或微生物中表达为irna分子以抑制鞘翅目害虫的细胞、组织、或器官中的靶基因表达的dna分子。本发明的一些实施方案提供了分离的核酸分子,其包含至少一个(例如,一个、两个、三个、或更多个)选自下组的多核苷酸:seqidno:1;seqidno:1的互补物;seqidno:1的至少15个连续核苷酸(例如至少19个连续核苷酸)的片段(例如seqidno:3和seqidno:67);seqidno:1的至少15个连续核苷酸的片段的互补物;叶甲属生物(例如wcr)的包含seqidno:1的天然编码多核苷酸;叶甲属生物的包含seqidno:1的天然编码多核苷酸的互补物;叶甲属生物的包含seqidno:1的天然编码多核苷酸的至少15个连续核苷酸的片段,和叶甲属生物的包含seqidno:1的天然编码多核苷酸的至少15个连续核苷酸的片段的互补物。在特定实施方案中,所述分离的多核苷酸与鞘翅目害虫接触或被所述鞘翅目害虫摄取抑制该害虫的生长、发育、生殖、和/或进食。在一些实施方案中,本发明的分离的核酸分子可以包含选自以下的至少一种(例如,一种,两种,三种或更多种)多核苷酸:seqidno:70;seqidno:70的互补物;seqidno:71;seqidno:71的互补物;seqidno:72;seqidno:72的互补物;seqidno:73;seqidno:73的互补物;seqidno:70,71和73中任一个的至少15个连续核苷酸的片段;seqidno:70,71和73中任一个的至少15个连续核苷酸的片段的互补物;在叶甲属生物中从包含seqidno:1的基因转录的天然多核糖核苷酸;在叶甲属生物中从包含seqidno:1的基因转录的天然多核糖核苷酸的互补物;在叶甲属生物中从包含seqidno:1的基因转录的天然多核糖核苷酸的至少15个连续核苷酸的片段;以及在叶甲属生物中从包含seqidno:1的基因转录的天然多核糖核苷酸的至少15个连续核苷酸的片段的互补物。在具体实施方案中,分离的多核苷酸与鞘翅目害虫的接触或摄取抑制害虫的生长,发育,生殖和/或进食。在其他实施方案中,本发明的核酸分子可以包含至少一个(例如,一个、两个、三个、或更多个)dna,其能够在细胞或微生物中表达为irna分子以抑制鞘翅目害虫的细胞、组织、或器官中的靶基因表达。这样的dna可以与在包含该dna分子的细胞中具备功能的启动子可操作连接,以启动或增强编码的能够形成dsrna分子的rna的转录。在一个实施方案中,所述至少一个(例如,一个、两个、三个、或更多个)dna可衍生自seqidno:1的多核苷酸。seqidno:1的衍生物包括seqidno:1的片段。在一些实施方案中,这样的片段可包含例如seqidno:1的至少约15个连续核苷酸,或其互补物。因此,这样的片段可包括,例如seqidno:1的15,16,17,18,19,20,21,22,23,24,25,26,27,28,29,30,40,50,60,70,80,90,100,110,120,130,140,150,160,170,180,190,200或更多个连续核苷酸,或其互补物。因此,这样的片段可包含,例如,seqidno:1的至少19个连续核苷酸(例如,19、20、21、22、23、24、25、26、27、28、29或30个连续核苷酸),或其互补物。一些实施方案包括将部分或完全稳定化的dsrna分子导入鞘翅目害虫中以抑制鞘翅目害虫的细胞、组织或器官中靶基因的表达。当表达为irna分子(例如,dsrna、mirna、sirna、shrna、和hprna)并被鞘翅目害虫摄取时,包含seqidno:1、3和67的一个或多个片段的多核苷酸可以引起下列一项或多项:鞘翅目害虫的死亡、发育停止、生长抑制、性别比变化、产卵量(broodsize)减少、感染停止、和/或进食停止。在具体实例中,包含seqidno:1、3和67中任一者的一个或多个片段(例如,包括约15至约300个核苷酸的多核苷酸)及其互补序列的多核苷酸导致害虫的现有世代产生下一代害虫的能力降低。在某些实施方案中,本发明提供的dsrna分子包含与来自包含seqidno:1、3、46和/或67的靶基因的转录物互补的多核苷酸,和/或与seqidno:1、3、46和/或67的片段互补的多核苷酸,所述靶基因在鞘翅目害虫中的抑制导致对于该害虫或该害虫的后代的生长、发育、或其他生物学功能必需的蛋白质或多核苷酸物质的减少或消除。选择的核苷酸序列可以与下列各项展现出约80%到约100%序列同一性:seqidno:1、3、46和/或67;seqidno:1、3、46和/或67的连续片段;或前述任一者的互补物。例如,选定的多核苷酸可以与下列任一项展现出79%、80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约98.5%、约99%、约99.5%、或约100%的序列同一性:seqidno:1、3、46和/或67;seqidno:1、3、46和/或67的连续片段;和前述任一者的互补物。在一些实施方案中,能够在细胞或微生物中表达为irna分子以抑制靶基因表达的dna分子可以包含与存在于一个或多个靶鞘翅目害虫物种(例如鞘翅目或半翅目害虫物种)中的天然多核苷酸的全部或部分特异性地互补的单个多核苷酸,或者dna分子可以是从多个这样的特异性互补多核苷酸构建而成的嵌合体。在其他实施方案中,核酸分子可以包含以“接头”分开的第一和第二多核苷酸。接头可以是任何包含促进第一和第二多核苷酸之间的二级结构形成(在期望的情况下)的核苷酸序列的区域。在一个实施方案中,接头是mrna的有义或反义编码多核苷酸的一部分。或者,接头可以包含能够与核酸分子可操作连接的核苷酸或其同源物的任何组合。在一些实例中,接头可以包含内含子(例如作为st-ls1内含子)。例如,在一些实施方案中,dna分子可以包含编码一种或多种不同rna分子的多核苷酸,其中每种不同rna分子分别包含第一多核苷酸和第二多核苷酸,其中第一和第二多核苷酸彼此互补。第一和第二多核苷酸在rna分子内可以通过间隔物连接。接头可以构成第一多核苷酸或第二多核苷酸的一部分。包含第一和第二多核苷酸的rna分子的表达可以通过第一和第二多核苷酸的特异性分子内碱基配对而导致本发明的dsrna分子的形成。第一多核苷酸或第二多核苷酸可以与对于鞘翅目害虫而言天然的多核苷酸(例如,靶基因、或转录的非编码多核苷酸)、其衍生物、或其互补多核苷酸基本上相同。dsrna核酸分子包含聚合核糖核苷酸的双链,并且可以包含对磷酸-糖主链或核苷的修饰。可以适宜调整rna结构的修饰以使得特异性抑制能够发生。在一个实施方案中,可以通过普遍存在的酶促过程来修饰dsrna分子,以便能够生成sirna分子。此酶促过程可以利用体外或体内的rna酶iii酶,如真核生物中的切丁酶。参见elbashir等人,(2001)nature411:494-8;以及hamilton和baulcombe(1999)science286(5441):950-2。切丁酶或功能等效的rna酶iii酶将较大的dsrna链和/或hprna分子切割成较小的寡核苷酸(例如,sirna),每个所述寡核苷酸长度为约19-25个核苷酸。由这些酶生成的sirna分子具有2到3个核苷酸3’突出物、和5’磷酸和3’羟基末端。由rna酶iii酶生成的sirna分子在细胞中解旋,并分成单链rna。然后,sirna分子与从靶基因转录的rna特异性地杂交,并且这两种rna分子随后通过固有的细胞rna降解机制而被降解。这个过程可以导致由靶生物中的靶基因编码的rna的有效降解或消除。结果导致靶向基因的转录后沉默。在一些实施方案中,通过内源rna酶iii酶从异源核酸分子产生的sirna分子可以有效介导鞘翅目害虫中靶基因的下调。在一些实施方案中,本发明的核酸分子可以包括至少一种可被转录成单链rna分子的非天然存在的多核苷酸,所述单链rna分子能够在体内通过分子间杂交形成dsrna分子。这样的dsrna常常进行自组装,并且可以在鞘翅目害虫的营养来源中提供,以实现靶基因的转录后抑制。在这些和另外的实施方案中,本发明的核酸分子可以包含两种不同的非天然存在的核苷酸序列,其中每种序列与鞘翅目害虫中的不同靶基因特异性地互补。当向鞘翅目害虫以dsrna分子的形式提供这样的核酸分子时,dsrna分子抑制害虫中至少两种不同靶基因的表达。c.获得核酸分子可以使用鞘翅目害虫中的多种多核苷酸作为靶标来设计本发明的核酸分子,如irna和编码irna的dna分子。然而,天然多核苷酸的选择并非是直截了当的过程。鞘翅目害虫的天然多核苷酸中仅有少数会是有效的靶标。例如,特定的天然多核苷酸是否可以被本发明的核酸分子有效下调,抑或特定的天然多核苷酸的下调是否会对鞘翅目害虫的生长、存活力、增殖、和/或生殖具有有害影响,都是无法肯定地预测的。绝大多数的鞘翅目害虫天然多核苷酸,如自这些害虫分离的est(例如,如美国专利7,612,194中所列出的鞘翅目害虫多核苷酸),对害虫的生长、存活力、增殖、和/或生殖没有有害影响。同样无法预测的是,在可以对害虫具有有害影响的天然多核苷酸中哪些能够在重组技术中使用,从而在宿主植物中表达与这样的天然多核苷酸互补的核酸分子,并且在进食后对害虫造成有害影响,同时不对宿主植物引起损害。在一些实施方案中,本发明的核酸分子(例如,要在鞘翅目害虫的宿主植物中提供的dsrna分子)被选择为靶向这样的cdna,其编码对于鞘翅目害虫生殖和/或发育必需的蛋白质或蛋白质部分(如涉及代谢或分解代谢生物化学途径、细胞分裂、生殖、能量代谢、胚胎发育、幼虫发育、转录调控等的多肽)。如本文中描述的,靶生物摄入含有一种或多种dsrna——所述dsrna的至少一个区段与靶害虫生物细胞中产生的rna的至少一个基本上相同的区段特异地互补——的组合物,可以导致交配、产卵、或产生可存活后代的失败或能力降低。可以使用从鞘翅目害虫衍生的多核苷酸(dna或rna)来构建对该害虫侵染有抗性的植物细胞。例如,可以转化鞘翅目害虫的宿主植物(例如,玉米),使其含有从鞘翅目害虫衍生的如本文中提供的多核苷酸中的一种或多种。转化到宿主中的多核苷酸可以编码一种或多种rna,其在转化的宿主内的细胞或生物学流体中形成dsrna结构,这样,如果/当害虫与转基因宿主形成营养关系时,就有dsrna可用。这可以导致害虫细胞中一种或多种基因表达的阻抑,最终导致生殖和/或发育的抑制。在备选的实施方案中,靶向实质参与鞘翅目害虫的生长、发育和生殖的基因。本发明中使用的其他靶基因可以包括例如那些在鞘翅目害虫的存活力、运动、迁移、生长、发育、感染性、和进食位置的建立中发挥重要作用的靶基因。因此,靶基因可以是管家基因或转录因子。另外,本发明中使用的天然鞘翅目害虫多核苷酸也可以从植物、病毒、细菌或昆虫基因的同源物(例如,直系同源物)衍生,所述同源物的功能对于本领域技术人员是已知的,且其多核苷酸与害虫的基因组中的靶基因可特异性地杂交。通过杂交鉴定已知核苷酸序列的基因同源物的方法是本领域技术人员已知的。在一些实施方案中,本发明提供了用于获得包含用于产生irna(例如,dsrna、mirna、sirna、shrna、和hprna)分子的多核苷酸的核酸分子的方法。一种这样的实施方案包括:(a)对一种或多种靶基因分析其在鞘翅目害虫中在dsrna介导的基因阻抑后的表达、功能和表型;(b)用探针探查cdna或gdna文库,所述探针包含来自靶向的鞘翅目害虫的多核苷酸的全部或部分或其同源物,所述靶向的鞘翅目害虫在dsrna介导的阻抑分析中展现出改变的(例如,降低的)生殖或发育表型;(c)鉴定与探针特异性杂交的dna克隆;(d)分离步骤(b)中鉴定的dna克隆;(e)对包含步骤(d)中分离的克隆的cdna或gdna片段测序,其中测序的核酸分子包含rna的全部或大部分或其同源物;和(f)化学合成基因的全部或大部分、mirna、sirna、hprna、mrna、shrna、或dsrna。在另外的实施方案中,用于获得包含用于产生大部分的irna(例如,dsrna、mirna、sirna、shrna、和hprna)分子的多核苷酸的核酸片段的方法包括:(a)合成第一和第二寡核苷酸引物,其与来自靶向的鞘翅目害虫的天然多核苷酸的一部分特异性地互补;和(b)使用步骤(a)的第一和第二寡核苷酸引物扩增克隆载体中存在的cdna或gdna插入物,其中扩增的核酸分子包含mirna、sirna、mrna、hprna、shrna或dsrna分子的大部分。本发明的核酸可以通过多种途径分离、扩增、或产生。例如,可以通过pcr扩增从gdna或cdna文库衍生的靶多核苷酸(例如,靶基因或靶转录的非编码多核苷酸)、或其部分而获得irna(例如,dsrna、mirna、sirna、shrna、和hprna)分子。可以从靶生物提取dna或rna,并且可以使用本领域普通技术人员已知的方法从其制备核酸文库。可使用自靶生物生成的gdna或cdna文库进行靶基因的pcr扩增和测序。可以使用确认的pcr产物作为体外转录的模板以在最低限度的启动子的情况下生成有义和反义rna。或者,可以使用标准化学,如亚磷酰胺化学,通过许多技术(参见,例如ozaki等人,(1992)nucleicacidsresearch,20:5205-5214;和agrawal等人,(1990)nucleicacidsresearch,18:5419-5423),包括使用自动化dna合成仪(例如,p.e.biosystems,inc.(fostercity,calif.)392或394型dna/rna合成仪)的任一者来合成核酸分子。参见,例如,beaucage等人,(1992)tetrahedron,48:2223-2311;美国专利4,980,460、4,725,677、4,415,732、4,458,066、和4,973,679。也可以采用备选化学,其生成非天然主链基团,如硫代磷酸酯、氨基磷酸酯,等等。本发明的rna、dsrna、mirna、sirna、shrna、或hprna分子可以由本领域技术人员可以通过手动或自动反应以化学或酶促方式产生,或者在包含含有编码rna、dsrna、mirna、sirna、shrna、或hprna分子的多核苷酸的核酸分子的细胞中体内产生。还可以通过部分或完全有机合成产生rna,可以通过体外酶促或有机合成引入任何经修饰的核糖核苷酸。可以通过细胞rna聚合酶或噬菌体rna聚合酶(例如,t3rna聚合酶、t7rna聚合酶、和sp6rna聚合酶)合成rna分子。可用于克隆和表达多核苷酸的表达构建体是本领域中已知的。参见,例如,国际pct公布号wo97/32016;及美国专利5,593,874、5,698,425、5,712,135、5,789,214、和5,804,693。可以在导入细胞中之前纯化化学合成或通过体外酶促合成合成的rna分子。例如,可以通过用溶剂或树脂提取、沉淀、电泳、色谱法、或其组合从混合物纯化rna分子。或者,可以在不纯化或最小程度纯化的情况下使用化学合成或通过体外酶促合成而合成的rna分子,例如,以避免由于样品加工所致的损失。可以将rna分子干燥贮存或溶解在水溶液中。溶液可以含有缓冲剂或盐以促进dsrna分子双链体链的退火和/或稳定化。在实施方案中,可以通过单一自身互补的rna链或者从两条互补rna链形成dsrna分子。dsrna分子可以在体内或在体外合成。细胞的内源rna聚合酶可以在体内介导一条或两条rna链的转录,或者可以使用克隆的rna聚合酶在体内或在体外介导转录。通过宿主器官、组织、或细胞类型中的特异性转录(例如,通过使用组织特异性启动子进行);刺激宿主中的环境条件(例如,通过使用响应于感染、胁迫、温度、和/或化学诱导物的诱导型启动子);和/或在宿主的某个发育阶段或年龄人工造成转录(例如,通过使用发育阶段特异性启动子),在鞘翅目害虫中靶基因的转录后抑制可以是宿主靶向性的。形成dsrna分子的rna链(不论是体外还是体内转录的)可以也可以不是多聚腺苷酸化的,并且可以能够也可以不能被细胞翻译机制翻译成多肽。d.重组载体和宿主细胞转化在一些实施方案中,本发明还提供了用于导入细胞(例如,细菌细胞、酵母细胞、或植物细胞)中的dna分子,其中dna分子包含这样的多核苷酸,该多核苷酸在表达为rna并被鞘翅目害虫摄取后,可实现对害虫的细胞、组织或器官中靶基因的阻抑。因此,一些实施方案提供了重组核酸分子,其包含能够在植物细胞中表达为irna(例如,dsrna、mirna、sirna、shrna、和hprna)分子以抑制鞘翅目害虫中靶基因表达的多核苷酸。为了启动或增强表达,这样的重组核酸分子可以包含一种或多种调节元件,所述调节元件可以与能够表达为irna的多核苷酸可操作连接。在植物中表达基因阻抑分子的方法是已知的,并且可以用于表达本发明的多核苷酸。参见,例如,国际pct公开号wo06/073727;和美国专利公开号2006/0200878a1)。在具体的实施方案中,本发明的重组dna分子可以包含编码可形成dsrna分子的rna的多核苷酸。这样的重组dna分子可以编码可形成dsrna分子的rna,其被摄取后能够抑制鞘翅目害虫细胞中内源靶基因的表达。在许多实施方案中,转录的rna可以形成dsrna分子,所述dsrna分子可以以稳定化形式提供;例如,以发夹和茎和环结构的形式提供。在某些实施方案中,dsrna分子的一条链可以通过从与rna基本上同源的多核苷酸转录而形成,所述rna由选自下组的多核苷酸编码:seqidno:1、3、46和67;seqidno:1、3、46和/或67的互补物;seqidno:1、3、46和/或67的至少15个连续核苷酸的片段;seqidno:1、3、46和/或67的至少15个连续核苷酸的片段的互补物;叶甲属生物(例如wcr)的包含seqidno:1、3和/或67的天然编码多核苷酸;叶甲属生物的包含seqidno:1、3和/或67的天然编码多核苷酸的互补物;叶甲属生物的包含seqidno:1、3和/或67的天然编码序列的至少15个连续核苷酸的片段;及叶甲属生物的包含seqidno:1、3和/或67的天然编码序列的至少15个连续核苷酸的片段的互补物。在特定的实施方案中,编码可形成dsrna分子的重组dna分子可包含编码区,其中至少两个多核苷酸如此排列,使得相对于至少一个启动子,一个多核苷酸处于有义取向,另一多核苷酸处于反义取向,其中该有义多核苷酸和该反义多核苷酸通过接头连接或联接,所述接头具有,例如,约5个(~5)至约一千个(~1000)核苷酸。接头可以在有义和反义多核苷酸之间形成环。有义多核苷酸或反义多核苷酸可以与由靶基因(例如,包含seqidno:1的hunchback基因)或其片段编码的rna基本上同源。然而,在一些实施方案中,重组dna分子可以编码可以形成没有接头的dsrna分子的rna。在实施方案中,有义编码多核苷酸和反义编码多核苷酸可以是不同的长度。通过在本发明的重组核酸分子中创建适当的表达盒,可以容易地将鉴定为对鞘翅目害虫具有有害影响或者针对该害虫的植物保护效果的多核苷酸掺入表达的dsrna分子中。例如,可以通过如下步骤将这样的多核苷酸表达为具有茎和环结构的发夹:采用对应于由靶基因多核苷酸(例如,包含seqidno:1的hunchback基因,或其片段)编码的rna的第一区段;将此多核苷酸与第二区段接头区连接,所述第二区段接头区与第一区段不是同源或互补的;并将这与第三区段连接,其中第三区段的至少一部分与第一区段基本上互补。这样的构建体通过第一区段与第三区段的分子内碱基配对而形成茎和环结构,其中环结构形式包含第二区段。参见,例如,美国专利公开文本2002/0048814和2003/0018993;以及国际pct公开文本wo94/01550和wo98/05770。可以例如以双链结构诸如茎环结构(例如,发夹)形式生成dsrna分子,由此通过共表达靶基因的片段(例如在另外的植物表达盒上的靶基因的片段)增强靶向天然鞘翅目害虫序列的sirna的产生,这可导致sirna产生增强,或者降低甲基化以防止dsrna发夹启动子的转录基因沉默。本发明的实施方案包括将本发明的重组核酸分子导入植物中(即,转化)以实现一种或多种irna分子的鞘翅目害虫保护水平的表达。重组dna分子可以例如是载体,如线性或闭合环状质粒。载体系统可以是单一载体或质粒,或者共同含有要导入宿主基因组中的总dna的两个或更多个载体或质粒。另外,载体可以是表达载体。可以例如将本发明的核酸适当地插入载体中,在一种或多种宿主中发挥功能以驱动连接的编码多核苷酸或其他dna元件表达的合适启动子控制下。许多载体可用于此目的,适当载体的选择主要将取决于要插入载体中的核酸的大小和要用载体转化的特定宿主细胞。每种载体含有不同的组分,根据其功能(例如,dna扩增或dna表达)及与其相容的特定宿主细胞而定。为了对转基因植物赋予对鞘翅目害虫的保护,例如可以在重组植物的组织或流体内将重组dna转录成irna分子(例如,形成dsrna分子的rna分子)。irna分子可包含与可引起宿主植物物种损害的鞘翅目害虫内的相应转录多核苷酸基本上同源且可特异性杂交的多核苷酸。例如,鞘翅目害虫可以通过摄取包含irna分子的转基因宿主植物的细胞或流体而接触在转基因宿主植物细胞中转录的irna分子。因此,靶基因的表达在侵染转基因宿主植物的鞘翅目害虫内受到irna分子阻抑。在一些实施方案中,对靶鞘翅目害虫中靶基因表达的阻抑可以导致植物对害虫攻击有抗性。为了使irna分子能够被投送给与已经用本发明的重组核酸分子转化的植物细胞存在营养关系的鞘翅目害虫,需要在植物细胞中表达(即,转录)irna分子。因此,重组核酸分子可以包含与一种或多种调节元件(诸如在宿主细胞中发挥功能的异源启动子元件)可操作连接的本发明的多核苷酸,所述宿主细胞诸如其中要扩增核酸分子的细菌细胞,或其中要表达核酸分子的植物细胞。适合于用于本发明的核酸分子的启动子包括诱导型、病毒的、合成的、或组成型的那些启动子,它们都是本领域中熟知的。描述这样的启动子的非限制性实例包括美国专利6,437,217(玉米rs81启动子);5,641,876(水稻肌动蛋白启动子);6,426,446(玉米rs324启动子);6,429,362(玉米pr-1启动子);6,232,526(玉米a3启动子);6,177,611(组成型玉米启动子);5,322,938、5,352,605、5,359,142、和5,530,196(camv35s启动子);6,433,252(玉米l3油质蛋白启动子);6,429,357(水稻肌动蛋白2启动子和稻肌动蛋白2内含子);6,294,714(光诱导型启动子);6,140,078(盐诱导型启动子);6,252,138(病原体诱导型启动子);6,175,060(磷缺乏诱导型启动子);6,388,170(双向启动子);6,635,806(γ薏苡辛(coixin)启动子);及美国专利公开号2009/757,089(玉米叶绿体醛缩酶启动子)。其他启动子包括胆脂碱合酶(nos)启动子(ebert等人,(1987)proc.natl.acad.sci.usa84(16):5745-9)和章鱼碱合酶(ocs)启动子(两者都在根癌土壤杆菌的肿瘤诱导质粒上携带);花椰菜花叶病毒组(caulimovirus)启动子,如花椰菜花叶病毒(camv)19s启动子(lawton等人,(1987)plantmol.biol.9:315-24);camv35s启动子(odell等人,(1985)nature313:810-2;玄参花叶病毒35s启动子(walker等人,(1987)proc.natl.acad.sci.usa84(19):6624-8);蔗糖合酶启动子(yang和russell(1990)proc.natl.acad.sci.usa87:4144-8);r基因复合物启动子(chandler等人,(1989)plantcell1:1175-83);叶绿素a/b结合蛋白基因启动子;camv35s(美国专利5,322,938、5,352,605、5,359,142、和5,530,196);fmv35s(美国专利6,051,753和5,378,619);pclsv启动子(美国专利5,850,019);scp1启动子(美国专利6,677,503);和agrtu.nos启动子(genbanktm登录号v00087;depicker等人,(1982)j.mol.appl.genet.1:561-573;bevan等人,(1983)nature304:184-7)。在特定的实施方案中,本发明的核酸分子包含组织特异性启动子,如根特异性启动子。根特异性启动子驱动专门或优先在根组织中表达可操作连接的编码多核苷酸。根特异性启动子的实例是本领域中已知的。参见,例如,美国专利5,110,732;5,459,252和5,837,848;opperman等人,(1994)science263:221-3;和hirel等人,(1992)plantmol.biol.20:207-18。在一些实施方案中,可以在两个根特异性启动子之间克隆依照本发明的用于鞘翅目害虫控制的多核苷酸或片段,所述根特异性启动子相对于所述多核苷酸或片段以相反的转录方向排布,在转基因植物细胞中可操作,并且在转基因植物细胞中表达以在转基因植物细胞中产生rna分子,rna分子随后可形成dsrna分子,如上文所述。鞘翅目害虫可以摄取植物组织中表达的irna分子,从而实现对靶基因表达的阻抑。其他可任选地与感兴趣的核酸分子可操作连接的调节元件包括5'utr,5'utr作为位于启动子元件和编码多核苷酸之间的翻译前导元件发挥功能。翻译前导元件存在于完全加工的mrna中,并且其可以影响初级转录物的加工和/或rna的稳定性。翻译前导元件的例子包括玉米和矮牵牛热休克蛋白前导物(美国专利no.5,362,865)、植物病毒外壳蛋白前导序列、植物rubisco前导序列等。参见,例如,turner和foster(1995)molecularbiotech.3(3):225-36。5'utr的非限制性实例包括gmhsp(美国专利no.5,659,122);phdnak(美国专利5,362,865);atant1;tev(carrington和freed(1990)j.virol.64:1590-7);和agrtunos(genbanktm登录号v00087;和bevan等人,(1983)nature304:184-7)。其他任选地与感兴趣的核酸分子可操作连接的调节元件还包括3'非翻译元件、3'转录终止区、或多腺苷酸化区。这些是位于多核苷酸下游的遗传元件,并且包括提供多腺苷酸化信号的多核苷酸、和/或能够影响转录或mrna加工的其他调节信号。多腺苷酸化信号在植物中发挥功能,导致多腺苷酸化的核苷酸被添加至mrna前体的3'端。多腺苷酸化元件可以源自多种植物基因或t-dna基因。3'转录终止区的一个非限制性实例是胆脂碱合酶3'区(nos3';fraley等人,(1983)proc.natl.acad.sci.usa80:4803-7)。在ingelbrecht等人,(1989)plantcell1:671-80中提供了使用不同3'非翻译区的实例。多腺苷酸化信号的非限制性实例包括来自豌豆rbcs2基因的信号(ps.rbcs2-e9;coruzzi等人,(1984)emboj.3:1671-9)和agrtu.nos(登录号e01312)。一些实施方案可以包括植物转化载体,该植物转化载体包含分离纯化的dna分子,该dna分子包含与本发明的一种或多种多核苷酸可操作连接的至少一种上文描述的调节元件。在表达时,一种或多种多核苷酸生成一种或多种包含多核苷酸的rna分子,所述多核苷酸与鞘翅目害虫中的天然rna分子的全部或部分特异性地互补。因此,多核苷酸可以包含编码靶向的鞘翅目害虫rna转录物内存在的多核糖核苷酸的全部或部分的区段,并且可以包含被靶向的害虫转录物的全部或部分的反向重复。植物转化载体可以含有与超过一种靶多核苷酸特异性互补的多核苷酸,由此容许产生超过一种dsrna以抑制靶鞘翅目害虫的一个或多个群体或物种的细胞中两种或更多种基因的表达。可以将与不同基因中存在的多核苷酸特异性互补的多核苷酸区段组合成单一复合核酸分子,以便在转基因植物中表达。这样的区段可以是连续的或者由接头分开。在其他实施方案中,可以通过在同一质粒中依次插入另外的多核苷酸来修饰已经含有本发明的至少一个多核苷酸的本发明质粒,其中所述另外的多核苷酸与原有的至少一个多核苷酸可操作连接于相同的调节元件。在一些实施方案中,核酸分子可以设计为抑制多种靶基因。在一些实施方案中,要抑制的多种基因可以获自相同的鞘翅目害虫物种,这样做可以增强核酸分子的有效性。在其他实施方案中,基因可以来自不同的昆虫(例如鞘翅目)害虫,这样可以拓宽药剂有效的害虫的范围。当靶向多种基因以实现阻抑、或表达和阻抑的组合时,可以工程化多顺反子dna元件。本发明的重组核酸分子或载体可以包含赋予转化的细胞,诸如植物细胞可选择表型的选择标志物。也可以使用选择标志物来选择包含本发明的重组核酸分子的植物或植物细胞。标志物可以编码杀生物剂抗性、抗生素抗性(例如,卡那霉素、遗传霉素(g418)、博来霉素、潮霉素,等等)、或除草剂耐性(例如,草甘膦等)。选择标志物的实例包括但不限于编码卡那霉素抗性并且可以使用卡那霉素、g418等选择的neo基因;编码双丙氨磷抗性的bar基因;编码草甘膦耐性的突变体epsp合酶基因;赋予对溴苯腈的抗性的腈水解酶基因;赋予咪唑啉酮或磺酰脲耐性的突变体乙酰乳酸合酶基因(als);和甲氨蝶呤抗性dhfr基因。可用多种选择标志物,其赋予对氨苄青霉素、博来霉素、氯霉素、庆大霉素、潮霉素、卡那霉素、林可霉素、甲氨蝶呤、膦丝菌素、嘌呤霉素、大观霉素、利福平、链霉素和四环素等的抗性。这样的选择标志物的实例展示于,例如美国专利5,550,318;5,633,435;5,780,708和6,118,047。本发明的重组核酸分子或载体还可以包含可筛选标志物。可以使用可筛选标志物来监测表达。示例性筛选标志物包括β-葡糖醛酸糖苷酶或uida基因(gus),其编码已知的多种生色底物的酶(jefferson等人,(1987)plantmol.biol.rep.5:387-405);r基因座基因,其编码调节植物组织中花色素苷色素(红色)产生的产物(dellaporta等人,(1988)"molecularcloningofthemaizer-njallelebytransposontaggingwithac."收录于18thstadlergeneticssymposium,p.gustafson和r.appels编辑,(newyork:plenum),pp.263-82);β-内酰胺酶基因(sutcliffe等人,(1978)proc.natl.acad.sci.usa75:3737-41);编码已知多种生色底物的酶(例如,padac,一种生色头孢菌素)的基因;萤光素酶基因(ow等人,(1986)science234:856-9);xyle基因,其编码能转化生色儿茶酚的儿茶酚双加氧酶(zukowski等人,(1983)gene46(2-3):247-55);淀粉酶基因(ikatu等人,(1990)bio/technol.8:241-2);酪氨酸酶基因,其编码能够将酪氨酸氧化为dopa和多巴醌(dopaquinone)(其继而缩合成黑色素)的酶(katz等人,(1983)j.gen.microbiol.129:2703-14));和α-半乳糖苷酶。在一些实施方案中,在用于创建转基因植物和在植物中表达异源核酸的方法中,可以使用如上文所描述的重组核酸分子来制备表现出对鞘翅目害虫的易感性降低的转基因植物。例如,可以通过将编码irna分子的核酸分子插入植物转化载体中,并将这些导入植物中来制备植物转化载体。用于宿主细胞转化的适合方法包括任何能将dna导入细胞中的方法,如通过原生质体转化(参见,例如,美国专利5,508,184),通过干燥/抑制介导的dna摄取(参见,例如,potrykus等人.(1985)mol.gen.genet.199:183-8),通过电穿孔(参见,例如,美国专利5,384,253),通过用碳化硅纤维搅拌(参见,例如,美国专利5,302,523和5,464,765),通过土壤杆菌介导的转化(参见,例如,美国专利5,563,055;5,591,616;5,693,512;5,824,877;5,981,840;和6,384,301),以及通过加速dna包被的颗粒(参见,例如,美国专利5,015,580、5,550,318、5,538,880、6,160,208、6,399,861、和6,403,865),等。特别可用于转化玉米的技术描述于例如美国专利7,060,876和5,591,616;以及国际pct公布wo95/06722中。通过应用诸如此类的这些技术,几乎任何物种的细胞都可被稳定转化。在一些实施方案中,转化dna被整合到宿主细胞的基因组中。在多细胞物种的情况下,转基因细胞可再生为转基因生物。可以使用任何这些技术来产生转基因植物,例如在转基因植物的基因组中包含编码一种或多种irna分子的一种或多种核酸。用于将表达载体导入植物中的广泛使用的方法是基于土壤杆菌的天然转化系统。根癌土壤杆菌和发根土壤杆菌是将植物细胞遗传转化的植物致病性土壤细菌。根癌土壤杆菌和发根土壤杆菌的ti和ri质粒分别携带负责植物遗传转化的基因。ti(诱导肿瘤)-质粒含有被称为t-dna的大片段,其被转移到转化的植物中。ti质粒的另一个片段,vir区,负责t-dna的转移。t-dna区的边界为末端重复序列。在修饰的二元载体中,肿瘤诱导基因已缺失,vir区的功能用于转移以t-dna边界元件为界的外来dna。t区还可含有用于转基因细胞和植物有效恢复的选择标志物、以及插入用于转移诸如编码核酸的dsrna之类多核苷酸的多克隆位点。因此,在一些实施方案中,植物转化载体来源于根癌土壤杆菌的ti质粒(参见,例如,美国专利4,536,475、4,693,977、4,886,937、和5,501,967;以及欧洲专利no.ep0122791)或发根土壤杆菌的ri质粒。其他的植物转化载体包括,例如但不限于,由herrera-estrella等人,(1983)nature303:209-13;bevan等人,(1983)nature304:184-7;klee等人,(1985)bio/technol.3:637-42;以及在欧洲专利no.ep0120516中所描述的那些载体,以及从任何前述文献来源的那些载体。可以修饰天然地与植物相互作用的其他细菌,如中华根瘤菌属、根瘤菌属、和中慢生根瘤菌属,以介导到许多各种各样的植物中的基因转移。通过获取卸甲ti质粒和适合的二元载体,可以使这些植物相关的共生细菌能够胜任基因转移。在提供外源dna到受体细胞的递送之后,通常鉴定出转化的细胞用于进一步培养和植物再生。为了提高鉴定转化细胞的能力,人们可能期望采用如前提出的选择或筛选标志物基因,与用来再生转化体的转化载体一道使用。在采用选择标志物的情况下,通过使细胞暴露于选择剂或药剂,鉴定出在潜在转化的细胞群中的转化细胞。在采用筛选标志物的情况下,可针对期望的标志物基因性状来筛选细胞。暴露于选择剂后存活的细胞、或者在筛选测定中已被评分为阳性的细胞,可以在支持植物再生的介质中进行培养。在一些实施方案中,可通过包含其他物质,如生长调节剂来改良任何适合的植物组织培养基(例如,ms和n6培养基)。可将组织维持在具有生长调节剂的基本培养基上,直到可得到足够的组织用于启动植物再生工作时为止,或者在重复多轮的手动选择之后,直到组织形态适合于再生时为止(例如,至少2周),然后转移到有助于芽形成的介质中。定期转移培养物,直到已经出现充分的芽形成时为止。一旦形成芽,将它们转移到有助于根形成的介质中。一旦形成足够的根,可将植物转移到土壤中,以便进一步生长和成熟。为了证实再生植物中感兴趣核酸分子(例如,编码一种或多种irna分子的dna,所述irna分子抑制鞘翅目害虫中的靶基因表达)的存在,可以进行多种测定法。这样的测定法例如包括:分子生物学测定,如southern和northern印迹、pcr、和核酸测序;生物化学测定,如检测蛋白质产物的存在,例如通过免疫学手段(elisa和/或western印迹)或借助于酶功能;植物部分测定,如叶或根测定;和再生的全植物的表型分析。可例如通过使用对感兴趣核酸分子特异的寡核苷酸引物进行pcr扩增来分析整合事件。pcr基因分型应当理解为包括但不限于,来源于分离的宿主植物愈伤组织的gdna的聚合酶链反应(pcr)扩增,所述愈伤组织预期含有整合到基因组中的感兴趣核酸分子,然后进行标准克隆和pcr扩增产物的序列分析。pcr基因分型方法已被很好地描述(例如rios,g等人,(2002)plantj.32:243-53),并可应用于来源于任何植物物种(例如,玉米)或组织类型(包括细胞培养物)的gdna。采用依赖于土壤杆菌的转化方法形成的转基因植物一般含有插入一个染色体中的单个重组dna。该单个重组dna的多核苷酸被称为“转基因事件”或“整合事件”。这样的转基因植物对于插入的外源多核苷酸而言是杂合的。在一些实施方案中,通过含有单个外源基因的独立分离的转基因植物与自身(例如t0植物)有性交配(自交)以产生tl种子,可获得相对于转基因为纯合的转基因植物。所产生的tl种子的四分之一相对于所述转基因是纯合的。萌发tl种子产生的植物可用于测试杂合性,所述测试一般使用snp测定或热扩增测定,使得允许在杂合子和纯合子之间进行区分(即,接合型测定)。在特定的实施方案中,在植物细胞中产生具有鞘翅目害虫保护效果的至少2、3、4、5、6、7、8、9种或10种或更多种不同irna分子。可以从引入不同转化事件中的多种核酸、或从引入单一转化事件中的单一核酸表达irna分子(例如,dsrna分子)。在一些实施方案中,在单一启动子的控制下表达多个irna分子。在其他实施方案中,在多个启动子的控制下表达多个irna分子。可以表达包含多个多核苷酸的单一irna分子,所述多核苷酸各自与在相同鞘翅目害虫物种的不同群体中或在不同的鞘翅目害虫物种中的一个或多个鞘翅目害虫内的不同基因座(例如由seqidno:1、3和67定义的基因座)同源。除了用重组核酸分子直接转化植物之外,可通过使具有至少一个转基因事件的第一植物与缺乏这种事件的第二植物杂交来制造转基因植物。例如,可将包含编码irna分子的多核苷酸的重组核酸分子导入易于转化的第一植物品系中而产生转基因植物,其中转基因植物可与第二植物品系杂交而使编码irna分子的多核苷酸渗入到第二植物品系中。本发明还包括含有本发明的一种或多种多核苷酸的商业产品。具体的实施方案包括自含有本发明一种或多种多核苷酸的重组植物或种子产生的商业产品。包含本发明的一种或多种多核苷酸的商业产品意在包括,但不限于:植物的粕、油类、碾碎的或完整的籽粒或种子,或包含含有本发明的一种或多种多核苷酸的重组植物或种子的任何粕、油、或碾碎的或完整的籽粒的任何食物产品。在一种或多种商品或商业产品中的检出本发明的一种或多种多核苷酸,事实上证明该商品或商业产品是由为了利用dsrna介导的基因阻遏方法来控制害虫的目的而设计为表达本发明的一种或多种多核苷酸的转基因植物生产的。在一些方面,包括由自转化的植物细胞衍生的转基因植物产生的种子和商业产品,其中种子或商业产品包含可检出量的本发明的核酸。在一些实施方案中,例如,可以通过获得转基因植物并从它们制备食物或饲料来生产这样的商业产品。包含本发明的一种或多种多核苷酸的商业产品包括例如但不限于:植物的粕、油类、碾碎的或完整的籽粒或种子,和包含含有本发明的一种或多种核酸的重组植物或种子的任何粕、油、或碾碎的或完整的籽粒的任何食物产品。在一种或多种商品或商业产品中的检出本发明的一种或多种核酸,事实上证明该商品或商业产品是由为了控制鞘翅目害虫的目的,设计为表达本发明的一种或多种irna分子的转基因植物生产的。在其他实施方案中,包含本发明的核酸分子的转基因植物或种子也可在其基因组中包含至少一个其他的转基因事件,包括但不限于:自其转录靶向鞘翅目害虫中与由seqidno:1、3和67定义的基因座不同的基因座的irna分子的转基因事件;自其转录靶向与鞘翅目害虫不同的生物(例如,植物寄生性线虫)中的基因的irna分子的转基因事件;编码杀虫蛋白(例如,苏云金芽孢杆菌杀虫蛋白)的基因;除草剂耐性基因(例如提供对草甘膦耐性的基因);以及促成转基因植物中的期望表型的基因,所述期望表型例如产量增加、脂肪酸代谢改变、或细胞质雄性不育的恢复。在特定的实施方案中,可以在植物中将编码本发明irna分子的多核苷酸与其他昆虫控制和疾病性状组合以实现增强的植物疾病和昆虫损害的期望性状。例如,由于对所述性状的抗性的概率在田间将发生降低,组合采用独特作用模式的昆虫控制性状可以对受保护的转基因植物提供优越的持久性,该持久性优于含有单一控制性状的植物。v.鞘翅目害虫中的靶基因阻抑a.概述在本发明的一些实施方案中,可以对鞘翅目害虫提供至少一种可用于控制鞘翅目害虫的核酸分子,其中所述核酸分子在害虫中导致rnai介导的基因沉默。在特定的实施方案中,可以对鞘翅目害虫提供irna分子(例如,dsrna、mirna、sirna、shrna、和hprna)。在一些实施方案中,可以通过使核酸分子与害虫接触来对鞘翅目害虫提供可用于控制鞘翅目害虫的核酸分子。在这些和另外的实施方案中,可以在鞘翅目害虫的进食基质,例如营养组合物中提供可用于控制鞘翅目害虫的核酸分子。在这些和另外的实施方案中,可以通过摄取被鞘翅目害虫摄取的包含核酸分子的植物材料来提供可用于控制鞘翅目害虫的核酸分子。在某些实施方案中,核酸分子通过表达导入植物材料中的重组核酸而存在于植物材料中,所述导入例如通过用包含重组核酸的载体转化植物细胞,并从转化的植物细胞再生植物材料或全植物来进行。b.rna介导的靶基因阻抑在具体实施方案中,本发明提供了irna分子(例如,dsrna、mirna、sirna、shrna、和hprna),可以设计此类分子使之靶向鞘翅目害虫(例如wcr或ncr)的转录组中的必需天然多核苷酸(例如,必需基因),例如设计有至少一条链包含与靶多核苷酸特异性互补的多核苷酸的irna分子。如此设计的irna分子的序列可以与靶多核苷酸相同,或者可以含有不会阻止irna分子与其靶多核苷酸之间的特异性杂交的错配。本发明的irna分子可以在用于鞘翅目害虫中基因阻抑的方法中使用,由此降低由害虫对植物(例如,包含irna分子的受保护的转化植物)引起的损害水平或发生率。如本文中使用的,术语“基因阻抑”是指用于降低由于基因转录成mrna及随后mrna翻译而产生的蛋白质水平,包括降低基因或编码多核苷酸的蛋白质表达,包括任何公知的转录后抑制表达和转录阻抑表达的方法。通过从靶向阻抑的基因转录的mrna的全部或部分与用于阻抑的相应irna分子之间的特异性同源性而介导转录后抑制。另外,转录后抑制是指通过核糖体结合的细胞中可用的mrna量的实质性且可测量的降低。在其中rnai分子是dsrna分子的特定实施方案中,切丁酶这种酶可以将dsrna分子切割成短sirna分子(大约20个核苷酸长)。借助于切丁酶对dsrna分子的活性而生成的双链sirna分子可以分成两个单链sirna:“乘客链”和“引导链”。乘客链可以被降解,而引导链可以掺入risc中。通过引导链与mrna分子的特异性互补多核苷酸的特异性杂交,随后通过酶argonaute(risc复合物的催化组分)切割而发生转录后抑制。在本发明的一些实施方案中,可以使用任何形式的irna分子。本领域技术人员会理解的是,在制备过程中及在对细胞提供irna分子的步骤过程中,dsrna分子一般比单链rna分子更稳定,并且一般在细胞中也是更稳定的。因此,例如,虽然在一些实施方案中sirna和mirna分子可能是同等有效的,但是dsrna分子可以由于其稳定性而被选用。在特定的实施方案中,提供了包含多核苷酸的核酸分子,所述多核苷酸可以在体外表达以产生irna分子,所述irna分子与由鞘翅目害虫基因组内的多核苷酸编码的核酸分子基本上同源。在某些实施方案中,体外转录的irna分子可以是包含茎环结构的稳定化的dsrna分子。在鞘翅目害虫接触体外转录的irna分子后,可以发生对该鞘翅目害虫中靶基因(例如,必需基因)的转录后抑制。在本发明的一些实施方案中,在用于对鞘翅目害虫中靶基因的转录后抑制的方法中利用自包含多核苷酸的至少15个连续核苷酸(例如至少19个连续核苷酸)的核酸分子的irna表达,其中所述多核苷酸选自下组:seqidno:1;seqidno:1的互补物;seqidno:3;seqidno:3的互补物;seqidno:67;seqidno:67的互补物;seqidno:1的至少15个连续核苷酸的片段;seqidno:1的至少15个连续核苷酸的片段的互补物;seqidno:3的至少15个连续核苷酸的片段;seqidno:3的至少15个连续核苷酸的片段的互补物;seqidno:67的至少15个连续核苷酸的片段;seqidno:67的至少15个连续核苷酸的片段的互补物;seqidno:1的至少15个连续核苷酸的片段;seqidno:1的至少15个连续核苷酸的片段的互补物;叶甲属生物的包含seqidno:1的天然编码多核苷酸;叶甲属生物的包含seqidno:1的天然编码多核苷酸的互补物;叶甲属生物的包含seqidno:3的天然编码多核苷酸;叶甲属生物的包含seqidno:3的天然编码多核苷酸的互补物;叶甲属生物的包含seqidno:67的天然编码多核苷酸;叶甲属生物的包含seqidno:67的天然编码多核苷酸的互补物;叶甲属生物的包含seqidno:1的天然编码多核苷酸的至少15个连续多核苷酸的片段;叶甲属生物的包含seqidno:1的天然编码多核苷酸的至少15个连续多核苷酸的片段的互补物;叶甲属生物的包含seqidno:3的天然编码多核苷酸的至少15个连续多核苷酸的片段;叶甲属生物的包含seqidno:3的天然编码多核苷酸的至少15个连续多核苷酸的片段的互补物;叶甲属生物的包含seqidno:67的天然编码多核苷酸的至少15个连续多核苷酸的片段;叶甲属生物的包含seqidno:67的天然编码多核苷酸的至少15个连续多核苷酸的片段的互补物。在某些实施方案中,可以使用与前述任一项至少约80%相同(例如,79%,约80%、约81%、约82%、约83%、约84%、约85%、约86%、约87%、约88%、约89%、约90%、约91%、约92%、约93%、约94%、约95%、约96%、约97%、约98%、约99%、约100%、和100%)的核酸分子的表达。本发明的一些实施方案的重要特征在于,rnai转录后抑制系统能够容忍靶基因中预期由于遗传突变、株系多态性、或进化趋异而可能发生的序列变异。导入的核酸分子可以不必与靶基因的初级转录产物或完全加工的mrna绝对同源,只要导入的核酸分子与靶基因的初级转录产物或完全加工的mrna可特异性杂交即可。而且,相对于靶基因的初级转录产物或完全加工的mrna,导入的核酸分子可以不必是全长的。使用本文的irna技术抑制靶基因是序列特异性的;即,靶向与irna分子基本上同源的多核苷酸进行遗传抑制。在一些实施方案中,可以使用包含具有与靶基因的一部分相同的核苷酸序列的多核苷酸的rna分子进行抑制。在这些和另外的实施方案中,可以使用包含相对于靶多核苷酸具有一个或多个插入、缺失和/或点突变的多核苷酸的rna分子。在特定的实施方案中,irna分子和靶基因的一部分可以共享例如至少约80%、至少约81%、至少约82%、至少约83%、至少约84%、至少约85%、至少约86%、至少约87%、至少约88%、至少约89%、至少约90%、至少约91%、至少约92%、至少约93%、至少约94%、至少约95%、至少约96%、至少约97%、至少约98%、至少约99%、至少约100%、和100%的序列同一性。或者,dsrna分子的双链体区可以与靶基因转录物的一部分可特异性地杂交。在可特异性杂交的分子中,展现出较大同源性的小于全长的多核苷酸可补偿较长的、同源性较低的多核苷酸。dsrna分子的双链体区中与靶基因转录物的一部分相同的多核苷酸的长度可以是至少约15、25、50、100、200、300、400、500个、或至少约1000个碱基。在一些实施方案中,可以使用大于20个到100个核苷酸的多核苷酸;例如,可以使用100-200或300-500个核苷酸的多核苷酸。在特定的实施方案中,可以使用大于约200个到300个核苷酸的多核苷酸。在特定的实施方案中,根据靶基因的大小,可以使用大于约500个到1000个核苷酸的多核苷酸。在某些实施方案中,可以将鞘翅目害虫中靶基因的表达在害虫细胞内抑制至少10%;至少33%;至少50%;或至少80%,使得发生显著抑制。显著抑制是指高于阈值的抑制,所述抑制导致可检出的表型(例如,生长、生殖、进食、发育等的停止),或与所抑制的靶基因对应的rna和/或基因产物的可检出降低。虽然在本发明的某些实施方案中,在害虫的基本上所有细胞中均发生抑制,但在其他实施方案中,仅在表达靶基因的细胞的一个子集中发生抑制。在一些实施方案中,细胞中的转录阻抑由细胞中展现出与启动子dna或其互补物的实质性序列同一性的dsrna分子的存在所介导,从而产生所谓的“启动子反式阻抑”。基因阻抑可以在可以摄取或接触此类dsrna分子的鞘翅目害虫中针对靶基因发挥效果,例如通过害虫摄取或接触含有dsrna分子的植物材料。在启动子反式阻抑中使用的dsrna分子可以特异性地设计为抑制或阻抑鞘翅目害虫细胞中一种或多种同源或互补多核苷酸的表达。美国专利5,107,065;5,759,829;5,283,184;和5,231,020中公开了通过反义或有义取向的rna进行转录后基因阻抑以调节植物细胞中的基因表达。c.对鞘翅目害虫提供的irna分子的表达可以许多体外或体内形式的任一种进行表达用于在鞘翅目害虫中rnai介导的基因抑制的irna分子。然后,可以对鞘翅目害虫提供irna分子,例如通过使irna分子与害虫接触,或通过引起害虫摄取或以别的方式内在化irna分子。本发明的一些实施方案包括鞘翅目害虫的经转化的宿主植物、经转化的植物细胞、和经转化的植物的后代。经转化的植物细胞和经转化的植物可以工程化改造为,例如,在异源启动子控制下表达一种或多种irna分子,以提供害虫保护效果。因此,当在鞘翅目害虫在进食期间食用转基因植物或植物细胞时,害虫可以摄取转基因植物或细胞中表达的irna分子。也可以将本发明的多核苷酸导入广泛而多样的原核和真核微生物宿主中以产生irna分子。术语“微生物”包括原核和真核物种,如细菌和真菌。基因表达的调变可以包括对此类表达的部分或完全阻抑。在另一个实施方案中,用于阻抑鞘翅目害虫中基因表达的方法包括在害虫宿主的组织中提供基因阻抑量的至少一种如本文中所描述的多核苷酸在转录后形成的dsrna分子,其至少一个区段与害虫细胞内的mrna互补。鞘翅目害虫所摄取的依照本发明的dsrna分子,包括其修饰的形式,如mirna、sirna、shrna、或hprna分子,可以与自hunchbackdna分子(例如包含选自seqidno:1、3和67的多核苷酸的hunchbackdna分子)转录的rna分子至少约80%、81%、82%、83%、84%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、或约100%相同。因此,提供了用于提供本发明的dsrna分子的分离的且基本上纯化的核酸分子,包括但不限于非天然存在的多核苷酸和重组dna构建体,其在导入鞘翅目害虫时阻抑或抑制其中的内源编码多核苷酸或靶编码多核苷酸的表达。特定的实施方案提供了用于递送irna分子以转录后抑制鞘翅目植物害虫中的一种或多种靶基因并控制该植物害虫群体的递送系统。在一些实施方案中,所述递送系统涉及包括对宿主转基因植物细胞或包含在宿主细胞中转录的rna分子的宿主细胞内容物的摄取。在这些和另外的实施方案中,创建转基因植物细胞或转基因植物,其含有可提供本发明的稳定化dsrna分子的重组dna构建体。包含编码特定irna分子的核酸的转基因植物细胞和转基因植物可以如下产生:采用重组dna技术(这些基础技术是本领域中熟知的)构建包含编码本发明的irna分子(例如,稳定化的dsrna分子)的多核苷酸的植物转化载体;以此转化植物细胞或植物;并以此生成含有转录的irna分子的转基因植物细胞或转基因植物。为了对转基因植物赋予针对鞘翅目害虫的保护,可以例如将重组dna分子转录成irna分子,如dsrna分子、sirna分子、shrna分子、mirna分子、或hprna分子。在一些实施方案中,从重组dna分子转录的rna分子可以在重组植物的组织或流体内形成dsrna分子。这样的dsrna分子可以包含在多核苷酸的一部分中,所述多核苷酸与可侵染宿主植物的类型的鞘翅目害虫内的dna转录的相应多核苷酸相同。鞘翅目害虫内靶基因的表达被所述dsrna分子所阻抑,并且该害虫中靶基因表达的阻抑导致该转基因植物对该害虫有抗性。已经显示dsrna分子的调控作用可适用于害虫中表达的多种基因,包括例如负责细胞分裂、染色体重塑、以及细胞代谢或细胞转化的内源基因,包括管家基因;转录因子;蜕皮相关基因;和编码涉及细胞代谢或正常生长和发育的多肽的其他基因。为了从体内转基因或表达构建体转录,可以在一些实施方案中使用调节区(例如,启动子、增强子、沉默子、和多聚腺苷酸化信号)以转录一条或多条rna链。因此,在一些实施方案中,如上文提出的,在产生irna分子中使用的多核苷酸可以与在植物宿主细胞中有功能的一种或多种启动子元件可操作连接。启动子可以是通常驻留于宿主基因组中的内源启动子。在可操作连接的启动子元件控制下的本发明的多核苷酸可以进一步被其他有利地影响其转录和/或所得转录物的稳定性的元件所侧翼。这样的元件可以位于可操作连接启动子的上游、表达构建体3'端的下游、并且可以同时存在于启动子的上游和表达构建体3'端的下游。在实施方案中,靶基因(例如,hunchback基因)的抑制导致亲代rnai表型;在与irna分子接触的受试者(例如,鞘翅目害虫)的后代中可观察到的表型。在一些实施方案中,prnai表型包括害虫产生可存活的后代的能力被降低。在prnai的具体实例中,启动prnai的核酸不增加被递送该核酸的群体(例如,在包括幼虫的总群体中的成虫群体)中死亡的发生率。在prnai的其它实例中,启动prnai的核酸也增加被递送该核酸的群体中的死亡的发生率。在一些实施方案中,令鞘翅目害虫群体与irna分子接触,从而导致prnai,其中害虫存活并交配,但是所产生的卵孵化出可存活后代的能力小于未被提供该核酸的相同物种的害虫产生的卵。在某些例子中,这样的害虫不产卵,或者其产卵少于未与该irna分子接触的相同物种的害虫中可观察到的产卵。在一些实例中,由这样的害虫产卵不能孵化,或者孵化的速率显著低于未与该irna分子接触的相同物种的害虫中可观察到的速率。在一些实例中,从这样的害虫产的卵孵化的幼虫的存活力低于从未与该irna分子接触的相同物种的害虫中可观察到的存活力。产生可保护其免受昆虫摄食的物质的转基因作物易于遭到目标昆虫种群的适应,从而难以持久受益于昆虫保护物质。传统上,通过下述手段实现对转基因作物的虫害适应的延迟:(1)种植“避难所”(不包含杀虫物质的作物,因此允许对杀虫物质敏感的昆虫的存活),和/或(2)将杀虫物质与针对目标害虫的多种作用方式相结合,使得对一种作用模式有抗性的个体被另一种作用模式杀死。在一些实例中,irna分子(例如,从宿主植物中的转基因表达的)提供新的作用模式,以供与苏云金芽孢杆菌杀虫蛋白技术昆虫和/或致死rnai技术组合成为昆虫抗性管理基因金字塔(insectresistancemanagementgenepyramids),以减轻昆虫群体对这两种控制技术中任一者发生抗性。亲代rnai在某些实施方案中可以导致一种类型的害虫控制,此类型不同于通过致死性rnai获得的控制,并且可以与致死性rnai组合以产生协同性的害虫控制。因此,在具体实施方案中,用于在鞘翅目植物害虫中的一个或多个靶基因的转录后抑制的irna分子可以与其他irna分子组合以提供冗余的rnai靶向和协同的rnai效应。导致卵死亡或卵活力丧失的亲代rnai(prnai)有可能为利用rnai和其他机制进行昆虫保护的转基因作物带来更多的耐久性益处。prnai可防止暴露的昆虫产生后代,因此可防止它们将其携带的任何赋予对杀虫物质的抗性的等位基因传递到下一代。prnai当与一种或多种可提供对相同害虫种群的保护的其他杀虫物质组合时,对于延长受保护的转基因作物的耐久性特别有用。此类另外的杀虫物质在一些实施方案中可以包括例如:dsrna;对幼虫有活性的dsrna;杀虫蛋白(如来自苏云金芽孢杆菌或其他生物的那些);和其他杀虫物质。这种益处的产生是因为,在转基因作物中对杀虫物质具有抗性的昆虫在群体中出现的比例高于避难所作物中。如果当prnai存在时,传递给下一代的抗性等位基因与易感等位基因的比例比prnai不存在时低,则抗性的演化将会延迟。例如,prnai可能不会减少对表达irna分子的植物造成损害的第一害虫世代中的个体数量。然而,这样的害虫维持后续世代侵染的能力可能会降低。相反,致死性rnai可能会杀死已经正在侵染植物的害虫。当prnai与致死性rnai组合时,与亲代irna分子接触的害虫可以来自系统外部的未与irna接触的害虫繁育,然而,这种交配的后代可能无法存活或存活力低,因此可能无法侵染植物。同时,与致死性irna分子接触的害虫也可能直接受到影响。这两种效应的结合可能是协同性的;即prnai和致死性rnai的组合效应可以大于prnai和致死性rnai的独立效应之和。prnai可例如通过如下方式与致死性rnai组合:提供表达致死性irna分子和亲代irna分子的植物;通过在同一位置提供表达致死性irna分子的第一植物和表达亲代irna分子的第二植物;和/或通过使雌性和/或雄性害虫与prnai分子接触,随后将接触过的害虫释放到植物环境中,使得它们可以与植物害虫非生产性地交配。一些实施方案提供了用于降低由以植物为食的鞘翅目害虫引起的对宿主植物(例如,玉米植物)的损害的方法,其中所述方法包括在宿主植物中提供表达本发明的至少一种核酸分子的转化植物细胞,其中所述核酸分子在被害虫摄取后发挥功能以抑制该害虫内靶多核苷酸的表达,该表达抑制除了导致该害虫死亡和/或生长降低之外,还例如导致该害虫生殖降低,由此降低由该害虫引起的对宿主植物的损害。在一些实施方案中,核酸分子包含dsrna分子。在这些和另外的实施方案中,核酸分子包含dsrna分子,所述dsrna分子各自包含超过一种与鞘翅目害虫细胞中表达的核酸分子可特异性地杂交的多核苷酸。在一些实施方案中,核酸分子由一种多核苷酸组成,所述多核苷酸与鞘翅目害虫细胞中表达的核酸分子可特异性地杂交。在其他实施方案中,提供了用于提高玉米作物产量的方法,其中所述方法包括将本发明的至少一种核酸分子导入玉米植物中;并栽培玉米植物以容许表达包含核酸的irna分子,其中包含所述核酸的irna分子的表达可抑制鞘翅目害虫损害和/或生长,由此降低或消除由于鞘翅目害虫侵染所致的产量损失。在一些实施方案中,irna分子是dsrna分子。在这些和另外的实施方案中,核酸分子包含dsrna分子,所述dsrna分子各自包含超过一种与鞘翅目害虫细胞中表达的核酸分子特异性可杂交的多核苷酸。在一些实施方案中,所述核酸分子由与鞘翅目害虫细胞中表达的核酸分子可特异性地杂交的多核苷酸组成。在一些实施方案中,提供了用于提高植物作物产量的方法,其中所述方法包括将至少一种本发明的核酸分子引入雌性鞘翅目害虫(例如通过注射、通过摄取、喷雾和通过自dna表达);并将该雌性害虫释放到作物中,其中包括该雌性害虫的配对(matingpair)无法产生可存活的后代或产生可存活后代的能力降低,从而减少或消除由于鞘翅目害虫侵袭引起的产量损失。在具体实施方案中,这种方法提供对所述害虫的后续世代的控制。在类似的实施方案中,该方法包括将本发明的核酸分子引入雄性鞘翅目昆虫,并将该雄性害虫释放到作物中(例如,其中prnai雄性害虫比未处理的对照产生的精子少)。例如,鉴于wcr雌性通常只交配一次,可以用这些prnai雌性和/或雄性进行竞争,以在求偶时对天然wcr昆虫形成压倒性优势。在一些实施方案中,核酸分子是表达产生irna分子的dna分子。在一些实施方案中,核酸分子是dsrna分子。在这些和进一步的实施方案中,核酸分子包含dsrna分子,每个dsrna分子包含多于一个与在鞘翅目有害生物细胞中表达的核酸分子可特异性杂交的的多核苷酸。在一些实施方案中,核酸分子由与鞘翅目害虫细胞中表达的核酸分子可特异性杂交的一个多核苷酸组成。在一些实施方案中,提供了用于调变鞘翅目害虫中靶基因表达的方法,所述方法包括:用包含编码本发明的至少一种irna分子的多核苷酸的载体转化植物细胞,其中所述多核苷酸与启动子和转录终止元件可操作连接;在足以容许形成包含多个转化植物细胞的植物细胞培养物的条件下培养经转化的植物细胞;选择已经将核酸分子整合到其基因组中的转化植物细胞;对转化植物细胞筛选由整合的核酸分子编码的irna分子的表达;选择表达irna分子的转基因植物细胞;并且用选择的转基因植物细胞喂养鞘翅目害虫。也可以从表达由整合的核酸分子编码的irna分子的转化植物细胞再生植物。在一些实施方案中,irna分子是dsrna分子。在这些和另外的实施方案中,核酸分子包含dsrna分子,所述dsrna分子各自包含超过一种与鞘翅目害虫细胞中表达的核酸分子可特异性地杂交的多核苷酸。在一些实例中,核酸分子由与鞘翅目害虫细胞中表达的核酸分子可特异性地杂交的多核苷酸组成。可以将本发明的irna分子作为来自掺入植物细胞基因组中的重组基因的表达产物、或者掺入应用于种植前种子的包衣或种子处理中而掺入植物物种(例如,玉米)的种子之内。包含重组基因的植物细胞被视为转基因事件。本发明的实施方案中还包括用于将irna分子投送给鞘翅目害虫的递送系统。例如,可以将本发明的irna分子直接导入害虫的细胞中。用于导入的方法可以包括将irna直接混合到鞘翅目害虫的饵食中(例如通过与该害虫的宿主的植物组织混合),以及对宿主植物组织应用包含本发明的irna分子的组合物。例如,可将irna分子喷雾到植物表面上。或者,可以通过微生物表达irna分子,并且可以将微生物施加到植物表面上,或通过物理手段诸如注射导入根或茎中。如上文论述的,也可以对转基因植物进行遗传工程改造,使其以足以杀死已知侵染植物的鞘翅目害虫的量表达至少一种irna分子。通过化学或酶促合成产生的irna分子也可以以符合常见农业实践的方式配制,并且作为喷雾产品使用以控制鞘翅目害虫所致的植物损害。配制剂可以包含有效的叶覆盖需要的适当辅料(例如粘着剂(sticker)和湿润剂),以及保护irna分子(例如,dsrna分子)免于uv损伤的uv保护剂。这样的添加剂通常在生物杀虫剂产业中使用,并且是本领域技术人员熟知的。这样的应用可以与其他喷雾杀虫剂应用(基于生物学的或其他方面)组合以增强针对害虫的植物保护。本文中所讨论的所有参考文献,包括本文引用的出版物,专利和专利申请,均通过引用并入本文,只要与本公开的明确细节不冲突,如同单独地和具体地明示将每篇参考文献通过引用并入本文一样。本文所讨论的参考文献仅为其在本申请的申请日之前的公开内容而提供。本文中任何内容不应被解释为承认发明人无权凭借在先发明而先于这些公开。提供以下实施例以展示某些具体特征和/或方面。这些实施例不应被理解为将本公开限于本文中描述的具体特征或方面。实施例实施例1:材料和方法用于叶甲属幼虫进食测定的样品制备和生物测定使用rnai试剂盒(lifetechnologies)或t7体外转录试剂盒合成并纯化了若干dsrna分子(包括对应于hunchback的那些)。将纯化的dsrna分子准备在te缓冲液中,并且所有生物测定均包含由该缓冲液组成的对照处理,用作wcr的死亡率或生长抑制的背景检查。使用nanodroptm8000分光光度计(thermoscientific,wilmington,de)测量生物测定缓冲液中dsrna分子的浓度。在使用饲喂人工昆虫饵食的新生昆虫幼虫的生物测定中测试样品的昆虫活性。wcr卵获自cropcharacteristics,inc(farmington,mn)。生物测定在特别为昆虫生物测定设计的128孔塑料托盘(c-dinternational,pitman,nj)中进行。每个孔含有约1.0ml设计用于鞘翅目昆虫生长的饵食。通过移液管将60μl等份的dsrna样品递送到每个孔的1.5cm2饵食表面(40μl/cm2)。dsrna样品浓度作为孔中每平方厘米(ng/cm2)表面积的dsrna量来计算。将处理的托盘保持在通风橱中,直到饵食表面上的液体蒸发或吸收到饵食中。在破壳后的几个小时内,用湿润的骆驼毛刷拾取幼虫个体,并且将其放置在处理的饵食(每孔一个或两个幼虫)上。然后用透明塑料粘合片密封128孔塑料托盘上带虫的孔,并通气以允许气体交换。将生物测定盘在受控环境条件(28℃,~40%相对湿度,16:8(光照:黑暗))下保持9天,而后记录暴露于每个样品的昆虫总数、死亡的昆虫数、和存活昆虫的重量。计算每个处理的百分比死亡率、平均生存重量、以及生长抑制。生长受阻(stunting)定义为平均生存重量的减少。生长抑制(gi)计算如下:gi=[1-(twit/tnit)/(twibc/tnibc)],其中twit是处理中活昆虫的总重量;tnit是处理中的昆虫总数;twibc是背景检查中的活昆虫的总重量(缓冲液对照);和tnibc是背景检查中的昆虫总数(缓冲液对照)。gi50规定为gi值为50%时饵食中样品的浓度。lc50(50%致死浓度)作为50%的测试昆虫被杀死时的样品浓度记录。统计学分析使用jmptm软件(sas,cary,nc)进行。实施例2:来自叶甲属的候选靶基因的鉴定选择来自wcr(玉米根萤叶甲)的多个发育期的昆虫进行汇集的转录组分析,以提供通过rnai转基因植物保护技术控制的候选靶基因序列。在一个范例中,从约0.9gm的完整第一龄wcr幼虫(孵化后4到5天;保持在16℃)分离总rna,并使用下述基于苯酚/tri的方法(molecularresearchcenter,cincinnati,oh)进行纯化。将幼虫于室温在具有10mltri的15ml匀浆器中均质化,直到获得均匀的悬浮液时为止。在室温温育5分钟后,将匀浆分配到1.5ml微量离心管中(每管1ml),添加200μl氯仿,并将混合物强力振摇15秒。在室温提取10分钟之后,通过在4℃以12,000xg离心分离各个相。将上层相(包含约0.6ml)小心转移到另一个无菌的1.5ml管中,并添加等体积的室温异丙醇。在室温温育5到10分钟之后,将混合物在12,000xg(4℃或25℃)离心8分钟。将上清液小心取出并弃去,并将rna离心沉淀通过用75%乙醇涡旋振荡洗涤两次,在每次洗涤后通过在7,500xg(4℃或25℃)离心5分钟回收。小心去除乙醇,让离心沉淀风干3至5分钟,然后溶解在无核酸酶的无菌水中。通过在260nm和280nm测量吸光度(a)测定rna浓度。从约0.9gm幼虫的典型提取产生超过1mg的总rna,其中a260/a280比为1.9。如此提取的rna在80℃贮存,直到进一步处理。通过使等份跑1%琼脂糖凝胶确定rna质量。在经高温灭菌的容器中,使用经depc(焦碳酸二乙酯)处理的水稀释的高温灭菌的10xtae缓冲液(tris乙酸盐edta;1x浓度为0.04mtris乙酸盐,1mmedta(乙二胺四乙酸钠盐,ph8.0)制成琼脂糖凝胶溶液。使用1xtae作为运行缓冲液。在使用前,用rnaseawaytm(invitrogeninc.,carlsbad,ca)清洁电泳槽和造孔梳。将2μlrna样品与8μlte缓冲液(10mmtrishclph7.0;1mmedta)和10μlrna样品缓冲液(目录号70606;emd4bioscience,gibbstown,nj)混合。将样品于70℃加热3分钟,冷却至室温,每孔上样5μl(含有1μg到2μgrna)。将市售的rna分子量标记物在分离的孔中同时运行以进行分子大小比较。在60伏特下跑胶2小时。由服务提供商(eurofinsmwgoperon,huntsville,al)利用随机引发从幼虫总rna制备标准化的cdna文库。在eurofinsmwgoperon通过gsflx454titaniumtm系列化学以1/2板的规模对标准化的幼虫cdna文库进行测序,其产生具有平均读段长度348bp的超过600,000个读段。将350,000个读段装配成超过50,000个重叠群。使用公众可访问的程序f0rmatdb(可在ncbi访问)将未装配的读段和重叠群两者都转换成可blast的数据库。类似地从其他wcr发育期收获的材料制备了总rna和标准化的cdna文库。合并代表各个发育期的cdna文库成员,构建了用于靶基因筛选的汇集的转录组文库。利用关于其他昆虫如果蝇属(drosophila)和拟谷盗属(tribolium)中的致死性效应的信息选择了用于rnai靶向的候选基因。例如,选择了间隙基因hunchback,一种在早期胚胎发育中建立前-后极性所必需的转录因子,选择的基础是hunchback功能在果蝇属和拟谷盗属中的保守(brizuelaetal.(1994)genetics137(3):803-13;schroder(2003)nature422(6932):621-5;marques-souzaetal.(2008)development135(5):881-8)。使用候选蛋白质编码多核苷酸针对含有未装配的叶甲属序列读段或已装配的重叠群的可blast数据库进行tblastn搜索。对于与叶甲属序列的显著命中(定义为:对于重叠群同源性,好于e-20;对于未装配的序列读段同源性,好于e-10),使用blastx针对ncbi非冗余数据库加以确认。此blastx搜索的结果确认,在tblastn搜索中鉴定的叶甲属同源物候选基因序列确实包含叶甲属基因,或者是在叶甲属序列中可用的对非叶甲属候选基因序列的最佳命中。在大多数情况下,被注释为编码蛋白质的拟谷盗属候选基因呈现出明确的与叶甲属转录物组序列中的一种或多种序列的序列同源性。在少数情况下可明显看出,某些基于与非叶甲属候选基因的同源性选择的叶甲属重叠群或未装配的序列读段有重叠,而且重叠群的装配未能连接起这些重叠。在这些情况下,使用sequenchertmv4.9(genecodescorporation,annarbor,mi)将序列装配成更长的重叠群。玉米根萤叶甲的其他转录组测序先前已经有描述。eyunetal.(2014)plosone9(4):e94052。在另一个示例中,使用illuminatm配对末端和454titanium测序技术,从由卵制备的cdna(15,162,017个经过滤的illuminatm末端配对读段)、由新生虫制备的cdna(721,697,288个经过滤的illuminatm末端配对读段)和由三龄幼虫的中肠制备的cdna(44,852,488个illuminatm末端配对读段和415,742个roche454读段,两者都经过过滤)测序了总共约700吉碱基(gigabases)。使用trinity(grabherretal.(2011)nat.biotechnol.29(7):644-52)对三个样品中的每一个,以及对汇集的数据集进行了从头转录组装配。汇集组合产生了163,871个重叠群,平均长度为914bp。使用果蝇属或拟谷盗属的hunchback的氨基酸序列作为查询序列,用tblastn以10-5的截止e值搜索根虫转录组和基因组数据库(未发表)。将推导的氨基酸序列用clustalxtm比对并用genedoctm软件编辑。鉴定了一个可能导致鞘翅目害虫死亡,或wcr中的生长、发育或生殖抑制的候选靶基因,其包括转录物seqidno:1,以及子序列seqidno:3和seqidno:67。这些序列编码一种hunchback蛋白或其子区域,对应于一种c2h2型锌指蛋白家族转录因子,该c2h2型锌指蛋白家族转录因子又被定义为间隙基因(gapgene),该基因的丢失导致躯体模式(bodyplan)中产生间隙。在wcrhunchback序列中,使用smart数据库(可在万维网上interproscan访问)在这种具有573个氨基酸的蛋白质的第226-248、255-277、283-305、311-335、520-542、和548-572位处预测了6个c2h2型锌指结构域,这与其作为锌指转录因子的作用一致。图2。seqidno:1的多核苷酸是新的。该序列未提供在公共数据库中,并且没有在wo/2011/025860;美国专利申请号20070124836;美国专利申请号20090306189;美国专利申请号us20070050860;美国专利申请no.20100192265;或美国专利7,612,194中公开。在genbank中检索未找到显著的同源性核苷酸序列。叶甲属hunchback氨基酸序列(seqidno:2)的最接近的同源物是一种赤拟谷盗蛋白,其genbank登录号为np_001038093.1(66%相似,在同源性区域上53%相同)。利用叶甲属候选hunchback基因的全长序列或部分克隆产生pcr扩增子用于dsrna合成。还从一个包含黄色荧光蛋白(yfp)编码区(seqidno:10;shaginetal.(2004)mol.biol.evol.21:841-850)的dna克隆中扩增了dsrna。实施例3:来自叶甲属的靶基因的扩增设计引物来通过pcr扩增每个靶基因的编码区部分。参见表1。在适当的情况下,将t7噬菌体启动子元件(taatacgactcactataggg;seqidno:4)引入扩增的有义或反义链的5'端。参见表1。从wcr提取总dna,并使用相反向的引物,使用第一链cdna作为模板进行pcr反应,引物的位置可扩增天然靶基因序列的全部或部分。表1.用于扩增示例性hunchback和yfp靶基因的编码区部分的引物和引物对实施例4:rnai构建体通过pcr制备模板和dsrna合成。用于为hunchbackdsrna产生提供特定模板的策略如图1a和图1b所示。分别通过使用引物对1和引物对2(表1)和(作为pcr模板的)由总rna制备的第一链cdna,通过pcr制备了准备用于hunchbackreg1或hunchbackv1dsrna合成的模板dna。对于hunchbackreg1和hunchbackv1的选定的靶基因区域,进行了两个分别的pcr扩增。图1。第一个pcr扩增在扩增出的有义链的5'末端引入t7启动子序列。第二个反应将t7启动子序列纳入反义链的5'末端。然后将目标基因的每个区域的两个pcr扩增片段以大约相等的量混合,并将该混合物用作dsrna产生的转录模板。图1。用特异性引物扩增的hunchbackreg1dsrna模板序列如seqidno:3所公开。用特定引物扩增的hunchbackv1dsrna模板序列如seqidno:67所公开。对于yfp阴性对照,进行单次pcr扩增。图1b。pcr扩增在扩增出的有义链和反义链的5'端引入t7启动子序列。然后将目标基因的每个区域的两个pcr扩增片段以大约相等的量混合,并将该混合物用作dsrna产生的转录模板。图1b。使用引物对3(表1)和yfp编码区的dna克隆作为模板产生阴性对照yfp编码区的dsrna(seqidno:10)。使用引物对4(表1)从pizt/v5-his表达载体(invitrogen)扩增了gfp阴性对照。使用megascript高产转录试剂盒(appliedbiosystemsinc.,fostercity,ca),将为hunchback和gfp而扩增的pcr产物用作体外合成dsrna的模板。使用rneasymini试剂盒(qiagen,valencia,ca)或rnai试剂盒,大体上按制造商的说明书规定纯化合成的dsrna。使用nanodroptm8000分光光度计(thermoscientific,wilmington,de)或等效手段定量dsrna制备物,并通过凝胶电泳分析以确定纯度。实施例5:在叶甲属幼虫中筛选候选靶基因重复的生物测定表明,在基于饵食的测定中,在实施例2中鉴定的来源于hunchbackreg1靶基因序列的合成dsrna制备物的摄取导致了西方玉米根虫幼虫的死亡和生长抑制。表2。表2.暴露于单剂量dsrna9天后的wcr幼虫的基于饵食的进食生物测定结果。方差分析发现平均%死亡率(mort.)和平均%增长抑制(gi)有一些显著差异。使用tukey-kramer检验,各平均值是分离的。*sem-均值标准误。括号中的字母指示统计学水平。不连接相同字母的水平是显著差异的(p<0.05)。**te-trishcl(1mm)加edta(1mm)缓冲液,ph7.2。***yfp-黄色荧光蛋白以前曾经有人提出,叶甲属某些物种的某些基因可用于rnai介导的昆虫控制。参见美国专利公开号2007/0124836,其中公开了906个序列,和美国专利7,614,924,其中公开了9,112个序列。然而,许多被建议用于rnai介导的昆虫控制的基因被确定在控制叶甲属方面是无效的。还确定了,与其他被建议可用于rnai介导的昆虫控制的基因相比,hunchbackreg1提供了对叶甲属的惊人和意想不到的控制。例如,美国专利7,614,924中提出了膜联蛋白、β血影蛋白2和mtrp-l4,以在rnai介导的昆虫控制中有效。seqidno:11是膜联蛋白区域1的dna序列,seqidno:12是膜联蛋白区域2的dna序列。seqidno:13是β血影蛋白2区域1的dna序列,seqidno:14是β血影蛋白2区域2的dna序列,seqidno:15是mtrp-l4区域1的dna序列,seqidno:16是mtrp-l4区域2的dna序列。通过实施例4(图1)的双引物对方法,将上述每个序列用于产生dsrna,并且将这些dsrna分别通过上述基于饵食的生物测定法加以测试。yfp序列(seqidno:10)也用于产生dsrna作为阴性对照。表3列出了用于产生膜联蛋白、β血影蛋白2、mtrp-l4和yfpdsrna分子的引物序列。表4显示了暴露于这些dsrna分子9天后wcr幼虫基于饵食的进食生物测定的结果。重复的生物测定表明摄入这些dsrna导致西方玉米根虫幼虫的死亡或生长抑制高于te缓冲液、yfpdsrna或水等对照样品所见。表3.用于扩增基因的编码区的部分的引物和引物对表4.西方玉米根虫幼虫获得的饵食进食测定的结果实施例6:用于叶甲属成虫进食测定的样品制备和生物测定法通过将对应于hunchback目标基因序列区段的dsrna加入到妊娠成年雌性中,进行西方玉米根虫的亲本rna干扰(rnai)。成虫根虫(羽化后<48小时)获自cropcharacteristics,inc.(farmington,mn)。成虫饲养在23±1℃,相对湿度>75%,所有生物测定的光:暗周期为8小时:16小时。昆虫饲养饵食借鉴自bransonandjackson(1988),j.kansasentomol.soc.61:353-55。向包含2.9%琼脂和5.6ml甘油的双蒸水的溶液中加入干成分(48gm/100ml)。此外,每100ml饵食中加入0.5ml含有47%丙酸和6%磷酸溶液的混合物以抑制微生物生长。将琼脂溶于沸水中,加入干成分、甘油和丙酸/磷酸溶液,充分混合,倒至约2mm的深度。用1号软木凿子从饵食中切下固化的饵食小栓(直径约4mm,高2mm;25.12mm3)。6个雄性和雌性成虫(24至48小时龄)用未经处理的人工饵食维持,并在带排气盖的16孔盘(5.1cm长×3.8cm宽×2.9高)中令它们交配4天。在第五天,将雄性从容器中取出,并将雌性饲养在用3μlhunchbackreg1(seqidno:3)基因特异性dsrna(2μg/饵食小栓;约79.6ng/mm3)处理的人工饵食表面小栓上。对照处理由暴露于用相同浓度的gfpdsrna(seqidno:9)或相同体积水处理的饵食的妊娠雌性组成。如上所述使用在其5'末端具有t7启动子序列(seqidno:7和8)的相反引物产生gfpdsrna。在整个实验中每隔一天提供用dsrna处理的新鲜人工饵食。在第11天,将雌性转移到产卵笼(7.5cm×5.5cm×5.5cm)(showman箱,althorproducts,wilton,ct)中,笼中有60目筛子过筛的高压灭菌的粉质粘土壤土(jackson(1986)rearingandhandlingofdiabroticavirgiferaanddiabroticaundecimpunctatahowardi.收录于l.krysanandt.a.miller,eds.methodsforthestudyofpestdiabrotica.springer-verlag,newyork,第25-47页)。允许雌性产卵4天,卵在产卵箱内土壤中27℃孵化10天,然后通过用60目筛网清洗产卵土壤将卵从土壤中取出。用甲醛(500μl甲醛在5ml双蒸水中)和甲基-(丁基氨基甲酰)-2-苯并咪唑氨基甲酸酯(0.025g在50ml双蒸水中)的溶液处理卵以防止真菌生长。从产卵箱中取出的雌性和每次处理的卵的子样品(subsamples)在液氮中快速冷冻,用于后续通过定量rt-pcr进行表达分析(见实施例7)。用dino-litepro数字显微镜(torrance,ca)拍摄各皿,并使用imagej软件的细胞计数器功能计数总卵数(schneider等(2012)nat.methods9:671-5)。将收获的卵保持在培养皿中28℃的湿滤纸上,并监测15天以确定卵活力。分别在不同的日子运行六个重复,每个包含三到六个雌性。每天记录每次处理的幼虫孵化次数,直至不再观察到孵化。wcr雌性成虫摄取hunchbackreg1dsrna分子证明对卵活力有惊人的、剧烈的、可重复的影响。暴露于hunchbackdsrna的经交配的雌性所产的卵数与暴露于未处理的饵食或用gfpdsrna处理的饵食的雌性产的卵数大致相等(图3a;表5)。然而,从暴露于hunchbackdsrna的雌性中收集的卵是无存活力的(图3b;表5)。暴露于hunchbackdsrna的雌性成虫有<3%的卵孵化。图3a和3b以图形方式总结了表5关于dsrna处理对卵产量和卵活力的影响的数据。表5.在摄入经处理的人工饵食11天后,hunchbackdsrna对wcr产卵和卵活力的影响。使用成对比较,各平均值是分离的。*sem-均值标准误。括号中的字母指定统计学水平。连接有不相同字母的水平是差异显著的(p<0.05)。解剖来自每个处理的未孵化的卵,以检查胚胎发育并估计亲代rnai(prnai)的表型应答。用gfpdsrna处理的wcr雌性产的卵显示正常发育。图4a。相比之下,用hunchbackreg1dsrna处理的雌性产的卵在卵内显示出一些胚胎发育,但是当被解剖时,其被明显缩短,并且似乎缺少许多腹节和胸节,尽管应答在个体幼虫之间有差异。图4b。因此,本发明的一个意想不到且令人惊奇的发现是,摄入的hunchbackdsrna对幼虫具有致死或生长抑制作用。令人惊讶和意想不到的是,妊娠wcr雌性成虫摄取hunchbackdsrna显著地影响了卵生产和卵活力,而对雌性成虫本身没有可觉察的剧烈影响。上述结果清楚地记录了西方玉米根虫幼虫和成虫中rnai的全身性性质,以及实现亲代效应的潜力,在该亲代效应中,在暴露于dsrna的雌性的卵中,与胚胎发育相关的基因被敲低。重要的是,这是西方玉米根虫中摄入dsrna的prnai应答的首例报道。基于在消化道(这里发生着dsrna的暴露和摄取)以外的组织中的观察到敲低现象,来指示全身性应答。由于一般而言昆虫——具体说是根虫——缺乏与植物和线虫中的全身性反应相关的rna依赖性rna聚合酶,我们的结果证实dsrna可以被肠组织吸收并转运到其他组织(例如,发育中的卵巢管)。人们能够敲除涉及胚胎发育的基因的表达,使得卵不孵化,这为实现和改善西方玉米根虫的控制提供了独特的机会。因为成虫容易取食地上生殖组织(如玉米丝和玉米缨),根虫成虫可以通过dsrna的转基因表达暴露于irna控制剂,以通过防止卵孵化而在下一代获得根保护。通过在玉米植物中通过dsrna的转基因表达或通过与表面施加的irna的接触来递送dsrna,为直接靶向幼虫并提高害虫管理策略的总体耐久性的其他转基因方法提供了重要的堆叠伙伴。实施例7:实时pcr分析使用rneasyminikit(qiagen,valencia,ca),根据制造商的建议,从成年雌性、雄性、被处理的雌性孵化的幼虫和卵的全体分离总rna。在转录反应开始之前,使用quantitech逆转录试剂盒(qiagen,valencia,ca)用dna酶处理总rna,以去除任何gdna。总rna(500ng)用于合成第一链cdna作为实时定量pcr(qpcr)模板。通过分光光度法在260nm定量rna,并通过琼脂糖凝胶电泳评估纯度。用于qpcr分析的引物使用beacon设计软件(premierbiosoftinternational,paloalto,ca)设计。使用5倍连续稀释度(1:1/5:1/25:1/125:1/625)一式三份地评价引物对的效率。对于本研究中使用的所有qpcr引物对,扩增效率均高于96.1%。本研究中使用的所有引物组合显示cdna模板量与pcr产物量之间呈线性相关。所有相关系数均大于0.99。用7500fastsystemsdsv2.0.6软件(appliedbiosystems)确定斜率、相关系数和效能。使用三个生物复制,每个具有两个技术重复,用于qpcr分析。使用sybrgreen试剂盒(appliedbiosystemsinc.,fostercity,ca)和7500fastsystem实时pcr检测系统(appliedbiosystemsinc.,fostercity,ca)进行qpcr。qpcr循环参数包括40个循环,每个循环由95℃3秒、58℃30秒组成,如制造商的方案(appliedbiosystemsinc.,fostercity,ca)所述。在每个pcr反应结束时,产生熔融曲线以确认单峰,并排除引物二聚体和非特异性产物形成的可能性。使用比较2-δδct方法计算转录物的相对定量,并将其对β-肌动蛋白归一化为。图5(a-d)以图形方式总结了表6的数据,其显示了与水对照相比,卵、雌性成虫、幼虫和雄性成虫中的hunchback和gfp的相对转录水平的数据。成虫(雄性和雌性)和卵的转录水平有惊人的下降。从被处理过的雌性孵出的幼虫的转录物没有减少。表6.相对于gfp和水对照,在处理的人工饵食中暴露于dsrna的卵、雌性成虫、雄性成虫、和幼虫中hunchback的相对表达。利用成对比较,各平均值是分离的。*sem-均值标准误。括号中的字母指定统计学水平。不连接相同字母的水平差异显著(p<0.05);n=3次生物重复,每次重复10个卵或幼虫或成虫个体,2次技术重复/样品)。实施例8:植物转化载体的构建使用化学合成片段的组合(dna2.0,menlopark,ca)和标准分子克隆方法组装入门载体,入门载体包含用于dsrna发夹形成的靶基因构建体,其包含hunchback(seqidno:1)、hunchbackreg1(seqidno:3)、和/或hunchbackv1(seqidno:67)的区段。通过在彼此相反取向的两个拷贝的靶基因片段(在单个转录单位内)布置两个片段,两个区段由接头序列(例如st-ls1内含子,seqidno:45;vancanneyt等人(1990)mol.gen.genet.220:245-250))分隔,帮助rna初级转录物的分子内发夹形成。因此,初级mrna转录物包含两个hunchback基因区段序列,二者彼此是对方的大反向重复,由接头序列分开。一个拷贝的启动子(例如玉米泛素1,美国专利5,510,474;来自花椰菜花叶病毒(camv)的35s;来自水稻肌动蛋白基因的启动子;泛素启动子;pemu;mas;玉米h3组蛋白启动子;als启动子;菜豆蛋白基因启动子;cab;rubisco;lat52;zm13和/或apg)用于驱动初级mrna发夹转录物的产生,并利用包含3'非翻译区的片段,例如但不限于玉米过氧化物酶5基因(zmper53'utrv2;美国专利6,699,984),atubi10,atef1或stpinii,来终止发夹rna表达基因的转录。入门载体包括hunchbackv1发夹rna构建体(seqidno:46),其包含hunchback(seqidno:1)的区段、hunchbackreg1(seqidno:3)和hunchbackv1(seqidno:67)。将如上所述的入门载体与典型的二元目的载体一起进行标准重组反应,产生hunchback发夹rna表达转化载体,以供用于土壤杆菌介导的玉米胚转化。阴性对照二元载体包含表达yfp发夹dsrna的基因,它是用典型的二元目的载体和入门载体通过标准的重组反应构建的。入门载体包含在玉米泛素1启动子(如上)的表达控制下的yfp发夹序列和包含来自玉米过氧化物酶5基因的3'非翻译区的片段(如上所述)。二元目的载体包含在植物可操作的启动子(例如,甘蔗杆菌病毒(scbv)启动子(schenk等人(1999)plantmol.biol.39:1221-30)或zmubi1(美国专利5,510,474))调控下的除草剂耐受性基因(芳氧基链烷酸酯双加氧酶;(aad-1v3,美国专利7,838,733和wright等人(2010)proc.natl.acad.sci.usa107:20240-5))。5'utr和来自这些启动子的内含子位于启动子区段的3'端和aad-1编码区的起始密码子之间。包含来自玉米脂肪酶基因(zmlip3'utr;美国专利7,179,902)的3'非翻译区的片段用于终止aad-1mrna的转录。另一个阴性对照二元载体,其包含表达yfp蛋白的基因,是通过与典型的二元目的载体和入门载体的标准重组反应构建的。所述二元目的载体包含在玉米泛素1启动子(如上)的表达调节下的除草剂耐受性基因(芳氧基亚乙酰双加氧酶;aad-1v3)(如上所述)和包含来自玉米脂肪酶基因的3'非翻译区的片段(zmlip3'utr;如上)。入门载体包含玉米泛素1启动子(如上)的表达控制下的yfp编码区和包含来自玉米过氧化物酶5基因的3'非翻译区的片段(如上所述)。seqidno:46显示了一种hunchbackv1发夹形成序列。实施例9:包含杀虫dsrna的转基因玉米组织土壤杆菌介导的转化.在土壤杆菌介导的转化之后,制成了通过表达稳定地整合到植物基因组中的嵌合基因而产生一种或多种杀虫dsrna分子(例如,至少一种dsrna分子,其包含靶向包含hunchback(seqidno:1),hunchbackreg1(seqidno:3)及hunchbackv1(seqidno:67)的区段的基因)的转基因玉米细胞、组织、和植物。采用超二元或二元转化载体的玉米转化方法是本领域中已知的,正如例如美国专利号8,304,604中(在此通过提述并入其全部内容)所描述。通过转化的组织在含吡氟氯禾灵的培养基上生长的能力选择它们,并视情况适宜筛选其dsrna产生。可以将一部分这样的转化的组织培养物提供给新生玉米根虫幼虫以进行生物测定,基本上如实施例1中所描述。土壤杆菌培养启动.将包含上述(实施例4)二元转化载体pdab109819或pdab114245的土壤杆菌菌株dat13192细胞(wo2012/016222a2)的甘油储划线接种在含有适当抗生素的ab基本培养基平板(watson等人,(1975)j.bacteriol.123:255-264)上,并在20℃培养3天。然后将培养物划线接种在含有相同抗生素的yep平板(g/l:酵母提取物10;蛋白胨10;nacl,5)上,并在20℃温育1天。土壤杆菌培养.在实验当天,以适合于实验中的构建体数目的体积制备接种培养基和乙酰丁香酮的储液,并将其移液到无菌的一次性250ml烧瓶中。接种培养基(frame等人,(2011)genetictransformationusingmaizeimmaturezygoticembryos.收录于plantembryoculturemethodsandprotocols:methodsinmolecularbiology.t.a.thorpeande.c.yeung,(eds),springerscienceandbusinessmedia,llc.pp327-341)含有:2.2gm/lms盐;1xisu改良的ms维生素(frame等人,(2011));68.4gm/l蔗糖;36gm/l葡萄糖;115mg/l脯氨酸;和100mg/l肌醇;ph为5.4)。将乙酰丁香酮以200μm的终浓度(从100%二甲亚砜中的1m储液)添加到含有接种培养基的烧瓶中,并充分混合溶液。对于每种构建体,来自yep平板的1或2个满接种环的土壤杆菌悬浮在一次性50ml无菌离心管内15ml的接种培养基/乙酰丁香酮储液中,在分光光度计中在550nm(od550)处测量溶液的光密度。然后使用另外的接种培养基/乙酰丁香酮混合物将悬液稀释到0.3到0.4的od550。然后将土壤杆菌悬液的管水平放置在设置为在室温下约75rpm的平台摇床上,并在进行胚切开的同时振摇1到4小时。玉米棒消毒和胚分离.未成熟玉米胚从玉米近交系b104(hallauer等人,(1997)cropscience37:1405-1406)植物获得,所述植物在温室中培养,并进行自花授粉或近亲授粉以产生玉米棒。在授粉后大约10到12天收获玉米棒。在实验当天,将玉米棒脱壳,并通过浸没在20%市售漂白剂(ultragermicidalbleach,6.15%次氯酸钠;加两滴吐温tm20)的溶液中并振摇20到30分钟进行表面消毒,随后在层流罩内在无菌去离子水中冲洗三次。从每个玉米棒无菌切下未成熟合子胚(1.8到2.2mm长)并随机分配到微量离心管中,每根微量离心管含有2.0ml的液体接种培养基中的适当土壤杆菌细胞的悬液,其中含200μm乙酰丁香酮,并添加了2μl的10%s233表面活性剂(evonikindustries;essen,germany)。对于一套给定的实验,每次转化均使用来自汇集的玉米棒的胚。土壤杆菌共培养.在分离之后,将胚在摇动平台上放置5分钟。然后将管的内容物倾倒到共培养基的平板上,所述培养基含有4.33gm/lms盐;1xisu改良的ms维生素;30gm/l蔗糖;700mg/ll-脯氨酸;在koh中的3.3mg/l的麦草畏(3,6-二氯-o-茴香酸或3,6-二氯-2-甲氧基苯甲酸);100mg/l肌醇(myo-inositol);100mg/l酪蛋白酶水解物;15mg/lagno3;200μm溶于dmso中的乙酰丁香酮;和3gm/lgelzantm,ph为5.8。用无菌一次性移液管移除液态土壤杆菌悬液。然后借助于显微镜,使用无菌镊子使胚定向为盾片面向朝上。盖上平板,用3mtmmicroporetm医用胶带密封,并放置在具有大约60μmolm-2s-1的光合有效辐射(par)的连续光照的25℃培养箱中。愈伤组织选择和转基因事件的再生.在共培养期之后,将胚转移到静息培养基上,静息培养基的组成为:4.33gm/lms盐;1xisu改良的ms维生素;30gm/l蔗糖;700mg/ll-脯氨酸;溶于koh中的3.3mg/l的麦草畏;100mg/l肌醇;100mg/l酪蛋白酶水解物;15mg/lagno3;0.5g/lmes(2-(n-吗啉代)乙磺酸一水合物;phytotechnologieslabr.;lenexa,ks);250mg/l羧苄青霉素;和2.3gm/lgelzantm;ph为5.8。将不超过36个胚移到每个平板上。将平板放置在透明的塑料盒中,在27℃下在大约50μmolm-2s-1par的连续光照下温育7到10天。然后将愈伤的胚转移(<18个/板)到选择培养基i上,所述培养基由具有100nm吡氟氯禾灵酸(r-haloxyfopacid)(0.0362mg/l;用于选择包含aad-1基因的愈伤组织)的静息培养基(上文)构成。将平板返回到透明盒中,在27℃下在大约50μmolm-2s-1par的连续光照下温育7天。然后将愈伤的胚转移(<12个/板)到选择培养基ii上,所述培养基由具有500nm吡氟氯禾灵酸(0.181mg/l)的静息培养基组成。将平板返回到透明盒中,在27℃下在大约50μmolm-2s-1par的连续光照下温育14天。这一选择步骤允许转基因愈伤组织进一步增殖和分化。将增殖中的胚性愈伤组织转移到(<9个/板)预再生培养基上。预再生培养基含有4.33g/lms盐;1xisu改良的ms维生素;45gm/l蔗糖;350mg/ll-脯氨酸;100mg/l肌醇;50mg/l酪蛋白酶水解物;1.0mg/lagno3;0.25gm/lmes;溶于naoh中的0.5mg/l萘乙酸;溶于乙醇中的2.5mg/l脱落酸;1mg/l6-苄氨基嘌呤;250mg/l羧苄青霉素;2.5gm/lgelzantm;和0.181mg/l吡氟氯禾灵酸;ph为5.8。将平板保存在透明盒中,在27℃下在大约50μmolm-2s-1par的连续光照下温育7天。然后将再生中的愈伤组织转移到(<6个/板)phytatraystm(sigma-aldrich)中的再生培养基上,在28℃以每天16小时光照/8小时黑暗(以大约160μmolm-2s-1par)温育14天,直到发出芽和根为止。再生培养基含有4.33gm/lms盐;1xisu改良的ms维生素;60gm/l蔗糖;100mg/l肌醇;125mg/l羧苄青霉素;3gm/lgellantm胶;和0.181mg/l吡氟氯禾灵酸;ph为5.8。然后分离具有主根的小芽,并不经选择直接转移到伸长培养基上。伸长培养基含有4.33gm/lms盐;1xisu改良的ms维生素;30gm/l蔗糖;和3.5gm/lgelritetm:ph为5.8。通过它们在含有吡氟氯禾灵的培养基上生长的能力而选择出转化植物芽,将所述芽从phytatraystm移栽到填充有生长培养基(promixbx;premiertechhorticulture)的小盆中,小盆用杯子或humi-domes(arcoplastics)覆盖,然后在convirontm生长室中炼苗(27℃昼/24℃夜,16小时光周期,50-70%rh,200μmolm-2s-1par)。在一些情况下,分析推定的转基因小植物的转基因相对拷贝数,这使用设计用于检测整合到玉米基因组中的aad1除草剂耐受基因的引物通过定量实时pcr测定来完成。此外,利用rnaqpcr测定来检测在推定的转化体表达的dsrna中接头序列的存在。然后将选定的转化小植物移动到温室中,以便进一步生长和测试。转移t0植物和在温室中定植以进行生物测定和产生种子.当植物达到v3-v4期时,将其移栽到iecustomblend(profile/metromix160)土壤混合物中,在温室中(光曝露类型:光或同化作用;高光限值:1200par;16-小时昼长;27℃昼/24℃夜)培植至开花。将要用于昆虫生物测定的植物从小盆移栽到tinustm350-4(spencer-lemaireindustries,acheson,alberta,canada)(每每事件一个植物)。在移栽到约四天后,将植物用于生物测定。通过对t0转基因植物的穗丝授粉,其中花粉从非转基因良种近交系b104或其他适当的花粉供体采集而来,并种植所得的种子而获得t1代植物。在可能时进行互交。实施例10:成体叶甲属植物进食生物测定将表达用于亲代rnai靶标和gfp对照的dsrna的转基因玉米叶(v3-4)冻干,并用研钵和杵研磨成细粉,并过600μm筛,以便在将其掺入人工饵食之前达到均匀的粒度。人工饵食与之前用于亲代rnai实验的饵食是相同的,只是水量加倍(20mlddh2o,0.40g琼脂,6.0g饵食预混物,700μl甘油,27.5μl霉菌抑制剂)。在固化之前,以40mg/ml饵食的速率将冻干的玉米叶组织掺入饵食中,并充分混合。然后将饵食倒在塑料培养皿的表面上至约4mm的深度并使其固化。从饵食中切下饵食小栓,并用与前面描述的亲代rnai实验相同的方法利用这些小栓暴露西方玉米根虫成虫。令prnait0或t1事件在温室中生长,直到植物产生穗轴、穗和丝。每株植物上总共释放25只新羽化的根虫成虫,并给整株植物加罩,以防止成虫逃逸。释放两周后,从每株植物中回收雌性成虫,并维持在实验室内以收集卵。根据亲代rnai靶标和预期表型,记录每个雌虫的卵数、卵孵化率和幼虫死亡率等参数,并与对照植物进行比较。实施例11:转基因玉米的叶甲属幼虫进食生物测定昆虫生物测定.通过生物测定方法来证实在植物细胞中产生的本主题发明的dsrna的生物活性。人们能够例如通过在受控的饲喂环境下给靶昆虫喂食来源于产生杀虫dsrna的植物的各种植物组织或组织片来证实效力。或者,从来源于产生杀虫dsrna的植物的各种植物组织制备提取物,并将提取的核酸分配在用于如以前在本文中描述的生物测定的人工饵食上面。将这样的饲喂测定的结果与类似方式进行的采用来自不产生杀虫dsrna的宿主植物的适当对照组织、或其他对照样品的生物测定进行比较。关于转基因玉米事件的昆虫生物测定.选择从经洗涤的卵孵化的两条西方玉米根虫幼虫(1到3日龄)并将其置于生物测定托盘的每个孔中。然后将这些孔用“拉-揭”(pulln’peel)护盖(bio-cv-16,bio-serv)覆盖,并置于具有18小时/6小时光照/黑暗周期的28℃培养箱中。在初始侵染9日之后,评估幼虫死亡率,其按照死亡昆虫占的每次处理中昆虫总数的百分比来计算。将昆虫样品在-20℃冷冻两天,然后汇集来自每个处理的昆虫幼虫并称重。生长抑制百分比按照实验处理的平均重量除以两个对照孔处理的平均重量的均值来计算。数据表示为(阴性对照的)生长抑制百分比。将超过对照平均重量的平均重量归一化为零。温室中的昆虫生物测定.从cropcharacteristics(farmington,mn)收到带有西方玉米根虫(wcr,玉米根萤叶甲)卵的土壤。在28℃温育wcr卵10到11天。洗掉卵上的土壤,将卵置于0.15%琼脂溶液中,浓度调节至每0.25ml等份大约75个到100个卵。将一份卵悬浮液加入培养皿中以设置孵化平板,用于监测孵化速率。用150到200个wcr卵侵染中生长的玉米植物周围的土壤。允许昆虫摄食2周,在这段时间之后,对每个植物给出“根评级”。利用一个节损伤量表进行分级,大体上如oleson等人,(2005,j.econ.entomol.98:1-8)所述。将通过了这个生物测定的植物移栽到18.9升的盆中供产生种子。用杀虫剂处理移植物以防止进一步根虫损害和昆虫释放到温室中。将植物人工授粉以产生种子。保存由这些植物产生的种子以评估植物的t1和后续世代。温室生物测定包括两种阴性对照植物。转基因阴性对照植物通过用包含设计为产生黄色荧光蛋白(yfp)的基因或yfp发夹dsrna的载体转化而生成(参见实施例4)。非转化的阴性对照植物从品系b104的种子培植而来。在两个不同的日期进行生物测定,其中每一组植物材料中均包括阴性对照。实施例12:转基因玉米组织的分子分析对来自叶和根的样品进行玉米组织的分子分析(例如rnaqpcr),所述样品在评估根进食损伤的同一天从温室生长的植物收集。用于per53'utr的rnaqpcr测定的结果用于验证发夹转基因的表达。(预期在非转化的玉米植物中会检测到低水平的per53'utr,因为内源性per5基因通常在玉米组织中表达)。针对重复序列之间的插入序列(其对于形成dsrna发夹分子是不可缺的)的rnaqpcr测定结果用于验证发夹转录物的存在。测量转基因rna相对于内源玉米基因的rna水平的表达水平。通过dnaqpcr分析检测gdna中aad1编码区的一部分,用来估计转基因插入拷贝数。用于这些分析的样品是从在环境室中生长的植物中收集的。将结果与设计用于检测单拷贝天然基因的一部分的测定的dnaqpcr结果进行比较,并且将简单事件(具有一个或两个拷贝的转基因)推进用于在温室中进一步研究。另外,设计用于检测一部分壮观霉素抗性基因(specr,位于t-dna外的二元载体质粒上)的qpcr测定法,用于确定转基因植物是否含有外来整合的质粒骨架序列。发夹rna转录物表达水平:per53'utrqpcr.通过实时定量pcr(qpcr)分析愈伤组织细胞事件或转基因植物的per53'utr序列,以确定全长发夹转录物与内部玉米基因(例如,genbank登录号bt069734)的转录水平相比的相对表达水平,所述内部玉米基因编码tip41样蛋白(即genbank登录号at4g34270的玉米同系物;具有74%同一性的tblastx得分)。使用rnaeasytm96试剂盒(qiagen,valencia,ca)分离rna。洗脱后,根据试剂盒的建议方案对总rna进行dnasei处理。然后在nanodrop8000分光光度计(thermoscientific)上定量rna,并将浓度归一化至25ng/μl。使用highcapacitycdnasynthesiskit(invitrogen),基本上根据制造商推荐的方案,在具有5μl变性rna的10μl反应体积中制备第一链cdna。该方案稍微修改为包括加入10μl的100μmt20vn寡核苷酸(idt)(tttttttttttttttttttnn,其中v为a,c或g,n为a,c,g或t;seqidno:47)到1ml随机引物储液预混物管中,以制备混合有随机引物和寡聚dt的工作储液。cdna合成后,样品用无核酸酶水1:3稀释,保存在-20℃直至测定。在10μl反应体积中,在lightcyclertm480(rochediagnostics,indianapolis,in)上各别进行per53'utr和tip41样转录物的实时pcr测定。对于per53'utr测定,使用引物p5u76s(f)(seqidno:48)和p5u76a(r)(seqidno:49)和rocheuniversalprobetm(upl76;目录号4889960001;用fam标记)。对于tip41样参考基因测定,使用用hex(六氯荧光素)标记的引物tipmxf(seqidno:50)和tipmxr(seqidno:51)和探针hxtip(seqidno:52)。所有测定包括无模板的阴性对照(仅预混物)。对于标准曲线,来源板中还包括一个空白(来源孔中的水),以检查样品交叉污染。引物和探针序列列于表7中。表8中公开了检测各种转录物的反应组分配方,pcr反应条件总结在表9中。在465nm激发fam(6-羧基荧光素亚磷酰胺)的荧光部分,在510nm测量荧光;hex(六氯荧光素)荧光部分的相应值为533nm和580nm。表7.用于转基因玉米转录水平分子分析的寡核苷酸序列。*tip41样蛋白**nav序列无法从供应商获得表8.用于转录物检测的pcr反应配方表9.rnaqpcr的热循环仪条件使用lightcyclertm软件v1.5,通过使用二阶导数最大算法进行相对量化来分析数据,以根据供应商的建议计算cq值。对于表达分析,使用δδct方法(即2-(cq靶-cq参比))计算表达值,其依赖于两个目标之间的cq值的差异的比较,基于下述假设选择基础值为2:对于优化的pcr反应,每个周期产物加倍。发夹转录物大小和完整性:northern印迹测定。在某些情况下,通过使用northern印迹(rna印迹)分析来确定转基因植物表达hunchback发夹dsrna的转基因发夹rna的分子大小,可获得对转基因植物的更多分子表征。所有材料和设备在使用前用rnasezap(ambion/invitrogen)进行处理。将组织样品(100mg至500mg)收集在2mlsafelockeppendorf管中,利用kleckotm组织粉碎机(garciamanufacturing,visalia,ca),在1mltrizol(invitrogen)中用三个钨珠破碎5分钟,然后在室温(rt)下温育10分钟。任选地,将样品在4℃以11,000rpm离心10分钟,并将上清液转移到新的2mlsafelockeppendorf管中。将200μl氯仿加入到匀浆中,通过颠倒混合2至5分钟,在室温下温育10分钟,并在4℃下以12,000xg离心15分钟。将顶层转移到无菌的1.5mleppendorf管中,加入600μl的100%异丙醇,然后在室温下温育10分钟至2小时,然后在4℃至25℃下以12,000xg离心10分钟。弃去上清液,将rna沉淀用1ml70%乙醇洗涤两次,各次洗涤之间在4℃至25℃以7,500×g离心10分钟。弃去乙醇,将沉淀短暂空气干燥3至5分钟,然后重新悬浮于50μl无核酸酶的水中。使用(thermo-fisher)定量总rna,样品标准化至5μg/10μl。然后将10μl乙二醛(ambion/invitrogen)加入到每个样品中。将5至14ng的digrna标准预混物(rocheappliedscience,indianapolis,in)分配并加入到等体积的乙二醛中。将样品和标记rna在50℃变性45分钟并储存在冰上,直到加载到northernmax10x乙二醛运行缓冲液(ambion/invitrogen)中的1.25%seakemgold琼脂糖(lonza,allendale,nj)凝胶上。rna通过65伏特/30ma的电泳分离2小时15分钟。电泳后,将凝胶在2×ssc中漂洗5分钟,并在geldoc工作站(biorad,hercules,ca)上成像,然后将rna在室温下过夜被动地转移到尼龙膜(millipore),使用10xssc作为转移缓冲液(20xssc由3m氯化钠和300mm柠檬酸三钠组成,ph7.0)。转移后,将膜在2×ssc中漂洗5分钟,将rna与膜(agilent/stratagene)uv交联,并将膜在室温下干燥最多2天。将膜在ultrahyb缓冲液(ambion/invitrogen)中预杂交1至2小时。探针由通过rocheappliedsciencedig程序用地高辛标记的含有感兴趣序列(例如,视情况,seqidno:46的反义序列部分)的pcr扩增产物组成。在杂交管中的推荐的缓冲液中在60℃的温度下杂交过夜。杂交后,将印迹进行dig洗涤,包裹,暴露于胶片1至30分钟,然后通过dig试剂盒供应商推荐的方法显影该胶片。转基因拷贝数确定.在96孔收集板(qiagen)中收集大约相当于2个叶冲孔块的玉米叶片。使用kleckotm组织粉碎机(garciamanufacturing,visalia,ca)在含有一个不锈钢珠的biosprint96ap1裂解缓冲液(由biosprint96plantkit;qiagen提供)中进行组织破坏。在组织浸渍后,使用biosprint96plantkit和biosprint96提取机器人以高通量模式分离gdna。在设置qpcr反应之前,将gdna稀释为2:3dna:水。qpcr分析.水解探针测定法转基因检测通过使用480系统的实时pcr来进行。使用探针设计软件2.0来设计在水解探针测定中要用来检测接头序列(例如st-ls1;seqidno:45)或检测specr基因的一部分(即,携带于二元载体质粒的壮观霉素抗性基因;seqidno:53;表10中的spc1寡核苷酸)的寡核苷酸。此外,使用primerexpress软件(appliedbiosystems)设计用于检测aad-1除草剂耐受基因的区段(seqidno:54;表10中的gaad1寡核苷酸)的水解探针测定中使用的寡核苷酸。表10显示了引物和探针的序列。测定中加入用于内源性玉米染色体基因(转化酶;genbank登录号:u16123;本文称为ivr1)的试剂,其用作内部参考序列以确保每个测定中存在gdna。为了扩增,在含有0.4μm每种引物和0.2μm每种探针的10μl体积多重反应中,以1x最终浓度制备480探针master预混物(rocheappliedscience)(表11)。如表12所示进行两步扩增反应。fam-和hex-标记的探针的荧光团活化和发射如上所述;cy5缀合物在650nm处最大激发,并且在670nm处最大地发荧光。使用拟合点算法(software版本1.5)和相对quant模块(基于δδct方法)从实时pcr数据确定cp得分(荧光信号跨越背景阈值的点)。数据如前所述(上文;rnaqpcr)处理。表10.用于基因拷贝数确定和二元载体质粒骨架检测的引物和探针(带荧光缀合物)的序列。cy5=花青-5表11.用于基因拷贝数分析和质粒骨架检测的反应组分组分量(μl)储液终浓度2x缓冲液5.02x1x合适的正向引物0.410μm0.4合适的反向引物0.410μm0.4合适的探针0.45μm0.2ivr1-正向引物0.410μm0.4ivr1-反向引物0.410μm0.4ivr1-探针0.45μm0.2h2o0.6na*nagdna2.0nd**nd总量10.0*na=不适用**nd=未测定表12.用于qpcr的热循环仪条件实施例13:包含鞘翅目害虫序列的转基因玉米如实施例8中所述生成10个到20个转基因t0玉米植物。获得另外的10--20个表达针对rnai构建体的发夹dsrna的t1玉米独立品系用于玉米根虫攻击。发夹dsrna可自seqidno:1、seqidno:3和seqidno:67所示的序列衍生。更多的发夹dsrna衍生自例如鞘翅目害虫序列,例如像caf1-180(美国专利申请公开号2012/0174258)、vatpasec(美国专利申请公开号2012/0174259)、rho1(美国专利申请公开号2012/0174260)、vatpaseh(美国专利申请公开号2012/0198586)、ppi-87b(美国专利申请公开号2013/0091600)、rpa70(美国专利申请公开号2013/0091601)、rps6(美国专利申请公开号2013/0097730),brahma(ussn),和kruppel(ussn)。这些通过rt-pcr或其他分子分析方法得以证实。来自选定的独立t1系的总rna制备物任选地用于qpcr,其中引物被设计为在每个rnai构建体中的发夹表达盒的接头中结合。另外,用于rnai构建体中每个靶基因的特异性引物任选地用于扩增在植物内sirna产生所需要的预加工mrna,并用于确认所述预加工mrna的产生。对于每个靶基因的期望条带的扩增可确认每个转基因玉米植物中发夹rna的表达。随后任选地利用rna印迹杂交在独立转基因系中确认靶基因的dsrna发夹加工成sirna。而且,与靶基因具有80%以上序列同一性、具有错配序列的rnai分子对玉米根虫的影响类似于与靶基因具有100%序列同一性的rnai分子。错配序列与天然序列的配对在同一个rnai构建体中形成发夹dsrna,由此产生出能够影响摄食中的鞘翅目害虫的生长、发育和生存力的植物加工的sirna。对应于靶基因的dsrna、sirna、或mirna的植物体内递送以及被鞘翅目害虫进食后的摄取,导致鞘翅目害虫中的靶基因由于rna介导的基因沉默而下调。当靶基因在发育的一个或多个阶段发挥重要作用的时候,鞘翅目害虫的生长、发育和生殖受到影响,而且在wcr、ncr、scr、mcr、黄瓜条根萤叶甲、d.u.tenella、南美叶甲、和d.u.undecimpunctatamannerheim的至少一者的情况下,会导致鞘翅目害虫无法成功侵染、进食、发育、和/或生殖,或导致其死亡。然后通过靶基因的选择和rnai的成功应用来控制鞘翅目害虫。转基因rnai品系和非转化玉米的表型比较.选用于创建发夹dsrna的靶鞘翅目害虫基因或序列与任何已知的植物基因bn序列都没有相似性。因此不期望靶向这些鞘翅目害虫基因或序列的构建体的(全身性)rnai的产生或活化对转基因植物会有任何有害影响。然而,将转基因系的发育和形态特征与非转化植物、以及用没有发夹表达基因的“空”载体转化的那些转基因系进行比较。比较了植物根、芽、叶和生殖特征。转基因植物和非转化植物在根长和生长模式上没有可观察到的差异。植物地上部特征,诸如高度、叶数和大小、开花时间、花大小和外观之类,是相似的。总的来说,在体外以及在温室土壤中培养时,在转基因系和没有表达靶irna分子的那些株系之间没有可观察的形态差异。实施例14:包含鞘翅目害虫序列和另外的rnai构建体的转基因玉米转基因玉米植物在其基因组中包含异源编码多核苷酸,所述异源编码多核苷酸被转录成靶向鞘翅目害虫之外的生物的irna分子,对这样的转基因植物通过土壤杆菌或whiskerstm方法(参见petolino和arnold(2009)methodsmol.biol.526:59-67)进行二次转化,以产生一种或多种杀虫dsrna分子(例如,至少一种dsrna分子,包括靶向包含seqidno:1、seqidno:3或seqidno:67的基因的dsrna分子)。基本上如实施例7中所述制备植物转化质粒载体,经由土壤杆菌或whiskerstm-介导的转化方法递送到获自转基因hiii或b104玉米植物的玉米悬浮细胞或未成熟玉米胚中,所述玉米植物在其基因组中包含异源编码多核苷酸,所述异源编码多核苷酸被转录成靶向鞘翅目害虫之外的生物的irna分子。实施例15:包含rnai构建体和另外的鞘翅目害虫控制序列的转基因玉米转基因玉米植物在其基因组中包含被转录成靶向鞘翅目害虫生物的irna分子的异源编码多核苷酸(例如,至少一种dsrna分子,包括靶向包含seqidno:1、seqidno:3或seqidno:67的基因的dsrna分子),对于这样的转基因玉米植物,通过土壤杆菌或whiskerstm方法(参见petolino和arnold(2009)methodsmol.biol.526:59-67)进行二次转化以产生一种或多种杀虫蛋白分子,例如,cry1b、cry1i、cry2a、cry3、cry7a、cry8、cry9d、cry14、cry18、cry22、cry23、cry34、cry35、cry36、cry37、cry43、cry55、cyt1a和cyt2c杀虫蛋白。基本上如实施例7中所述制备植物转化质粒载体,经由土壤杆菌或whiskerstm-介导的转化方法递送到获自转基因b104玉米植物的玉米悬浮细胞或未成熟玉米胚中,所述玉米植物在其基因组中包含被转录成靶向鞘翅目害虫生物的irna分子的异源编码多核苷酸。获得产生用于控制鞘翅目害虫的irna分子和杀虫蛋白的双重转化植物。实施例16:prnai介导的昆虫保护可导致卵死亡或卵存活力丧失的亲代rnai为使用rnai和其他昆虫保护机制的转基因作物带来更多的耐久性益处。使用基本的双缀块模型(two-patchmodel)来演示这一用处。一个缀块含有表达杀虫成分的转基因作物,另一个缀块含有不表达杀虫成分的避难所作物。将卵根据其相对比例“产”在两个模型的缀块中。在这个例子中,转基因缀块占景观的95%,避难所缀块占5%。转基因作物表达对玉米根虫幼虫有活性的杀虫蛋白质。玉米根虫对杀虫蛋白质的抗性被模拟为单基因,具有两个可能的等位基因:一个等位基因(s)赋予敏感性,另一个等位基因(r)赋予抗性。杀虫蛋白质根据模型推导可导致以其为食的纯合易感(ss)玉米根虫幼虫的死亡率达到97%。假定对抗性等位基因(rr)为纯合的玉米根虫幼虫没有死亡。假定对杀虫蛋白质的抗性是不完全隐性的,因而功能优势(functionaldominance)为0.3(以该转基因作物为食的、对该蛋白质的抗性为杂合子(rs)的幼虫的死亡率为67.9%)。转基因作物还表达了亲代活性dsrna,这些dsrna通过rna干扰作用(prnai)可导致暴露于转基因作物的成年雌性玉米根虫的卵无存活力。玉米根虫对prnai的抗性也被认为是单基因性的,具有两个可能的等位基因:一个(x)赋予成年雌性对rnai的易感性,另一个(y)赋予成年雌性对rnai的抗性。假设有高水平的dsrnas暴露,prnai根据模型推导可导致纯合易感(xx)雌性产生的99.9%的卵无存活力。该模型假定prnai对由纯合抗性(yy)雌性产生的卵的存活力没有影响。假定对dsrna的抗性是隐性的,由此功能优势是0.01(对于dsrna的抗性为杂合子(xy)的雌性产生的卵98.9%是无存活力的)。在该模型中,在两个缀块中存活下来的成虫之间都有根据其相对比例的随机交配以及随机产卵。可存活的后代的基因型频率遵循两基因座遗传系统的孟德尔遗传学。prnai的作用需要成年雌性以表达亲代活性dsrna的植物组织为食。从避难所作物羽化的成年雌性与从转基因作物羽化的成年雌性相比,卵发育所受的干扰可能较低;预计玉米根虫经过幼虫发育后在某个缀块中羽化,它们就会在那个缀块中更广泛地进食。因此,就从避难所缀块羽化的雌性玉米根虫成虫而言,作用于其上的prnai效应的相对幅度是变化的,其中prnai效应的比例为0(prnai对从避难所缀块羽化的成年雌性没有影响)至1(prnai对从避难所缀块羽化的成年雌性的影响与从转基因缀块羽化的成年雌性的影响相同)不等。当prnai效应(还)通过以表达亲代活性dsrna的植物组织喂养成年雄性来实现时,可以容易地调整该模型来演示这种情形。计算各个世代中的两种抗性等位基因的频率。两个抗性等位基因(r和y)的初始频率假定为0.005。结果以每个抗性等位基因的频率达到0.05所需的昆虫世代数表示。为了检查由prnai引起的抗性延迟,将包含prnai的模拟与不包括prnai的模拟进行比较,但是其他所有方面都相同。图6。还修改了该模型以包括对玉米根虫幼虫有活性的干扰dsrna与转基因作物中玉米根虫活性杀虫蛋白质的组合。其中,给幼虫rnai赋予导致纯合rnai敏感玉米根虫幼虫(基因型xx)97%的幼虫死亡率的效力,而对纯合rnai抗性(yy)的玉米根虫幼虫没有效力。对rnai抗性(xy)为杂合的玉米根虫幼虫死亡率为67.9%。假设同一抗性机制适用于玉米根虫中的幼虫活性rnai和prnai二者。如前所述,对从避难所缀块羽化的成年雌性的prnai效应相对于对从转基因缀块羽化的成年雌性的prnai效应从0到1变化。如前所述,为了检查由prnai引起的抗性延迟,将包括prnai的模拟与不包括prnai的模拟进行比较,但是所有其他方面(包括幼虫rnai)相同。图7。与从转基因缀块出现的成虫的效应量值相比,当从避难所缀块出现的雌性玉米根虫成虫的卵存活力的prnai效应量值降低时,观察到prnai的明显的抗性管理益处。与仅产生杀虫蛋白质的转基因作物相比,除了杀虫蛋白质之外还产生亲代活性dsrna的转基因作物更耐久。类似地,与仅产生杀虫蛋白质和幼虫活性dsrna的转基因作物相比,除了杀虫蛋白质和幼虫活性dsrna之外还产生亲代活性dsrna的转基因作物更耐久。在后一种情况下,耐久性益处适用于杀虫蛋白质和杀虫干扰dsrna。实施例17:亲代rnai对wcr雄性的影响将新羽化的未交配过的wcr雄性(cropcharacteristic;farmington,mn)暴露于以prnaidsrna(hunchback)处理过的人工饵食历时7天,期间连续喂食dsrna。然后将存活的雄性与未交配过的雌性配对,并允许它们交配4天。将雌性分离到产卵室中,用未经处理的饵食维持,以基于卵的活力确定交配是否成功。此外,在产卵10天后解剖雌性以确定精子细胞的存在。包括gfpdsrna和水的对照。每个处理进行三个重复,每个重复10个雄性和10个雌性。各个重复在3个不同日期用新羽化的成虫完成。每次处理的每次处理含有10个雄性/处理/重复,并放置在托盘的一个孔中。每个孔包括用水或dsrna(gfp(seqidno:9)或hunchback(seqidno:3))处理的12个饵食小栓。每个饵食小栓在3μl水中用2μgdsrna处理。将托盘转移到温度为23±1℃、相对湿度>80%,l:d16:8的生长室中。在第3、5、7天,将雄性转移到新托盘中,新托盘的每个孔中加有12个经处理的饵食小栓。在第7天,如实施例7所述,将每个处理的每个复制的三只雄性快速冷冻用于qpcr分析。在第8天,将十只雌性和十只处理的雄性一起放在一个容器中以允许交配。每个容器包括22个未经处理的饵食小栓。在第10天,将昆虫转移到具有22个未处理的饵食小栓的新托盘中,在第12天将雄性移出并使用荧光染色技术测量精子活力。每隔一天将雌性转移到一个放有12个未经处理的饵食小栓的新托盘,直到第22天。在第16天,将雌性转移到含有高压消毒土壤的卵笼中以供产卵。在第22天,将所有的雌性从土壤笼中取出并冷冻以检查精子的存在。将土壤笼转移到温度为27±1℃、相对湿度>80%,24小时黑暗的新生长室。在第28天,使用#60筛洗涤土壤以从每个笼子中收集卵。用甲醛(500μl甲醛在5ml双蒸水中)和甲基-(丁基氨基甲酰基)-2-苯并咪唑氨基甲酸酯(0.025g在50ml双蒸水中)的溶液处理卵以防止真菌污染,并置于放有滤纸的培养皿中。对每个培养皿拍摄照片,以供使用imagej软件的细胞计数器功能(schneider等人(2012)nat.methods9:671-5)进行卵计数。将带卵的培养皿转移到温度为27±1℃,相对湿度>80%,黑暗24小时的小生长室。从第29-42天,每天监测幼虫的孵化。精子活力.将未交配过的西部玉米根虫雄性暴露于用亲代rnai基因hunchback的dsrna处理过的人工饵食7天。每隔一天提供经处理的饵食。,每次重复每次处理使用四只雄性来检测精子活力,精子活力的检测使用荧光技术,以便区分活精子和死精子,如collins和donoghue(1999)所述。livedeadspermviabilitykittm(lifetechnologies,carlsbadca)含有sybr14,一种膜透性核酸染色剂,以及碘化丙啶,后者可染色死细胞。将wcr雄性在冰上麻醉,剖出睾丸和精囊,置于10μl缓冲液(hepes10mm,nacl150mm,bsa10%,ph7.4)中,并用高压消毒的牙签粉碎。立即用livedeadspermviabilitykittm评估精子活力。加入1μlsybr14(0.1mm,在dmso中),在室温下温育10分钟,然后加入1μl碘化丙啶(2.4mm),并在室温下再次温育10分钟。将10μl精子染色的溶液转移到玻璃微玻片中并用盖玻片覆盖。使用配备nikona1共聚焦和nis-elements软件的nikontmeclipse90i显微镜对样品进行评估。以10x可视化样品,以488激发,对于活精子(sybr14)500-550nm带通,对死精子(碘化丙锭)663-738nm带通同时进行。每个样品记录五个视野的数字图像。使用imagej软件的细胞计数器功能评估活(绿)和死(红)精子的数量。schneider等人(2012)nat.methods9:671-5。喂食hunchbackdsrna7天的雄性产生的总精子和死精子均少于仅摄取gfpdsrna或水的雄性。表20。各处理之间活精子的平均数没有显著差异。与已经同摄入了dsrna处理的雄性交配的雌性相比,每个雌性的卵数或卵孵化率没有统计学差异。表21。对于暴露于hunchbackdsrna4次的雄性,转录物表达没有统计学差异。表20.hunchbackdsrna对wcr成年雄性精子生产和摄入7天后对经处理的人工饵食的活力的影响。使用dunnett检验,各平均值是分离的。sem-均值标准误*表明p值≤0.1的显著性.**表明p值≤0.05的显著性.表21.仅雄性摄入dsrna处理过的人工饵食7日后hunchbackrna对wcr卵产生和卵存活力的影响sem-均值标准误.对未交配过的雄性,除了将dsrna的暴露增加至总共6次以外,如上所述进行处理。在第3、5、7、9和11天,将雄性转移到每个孔中有12个经处理的饵食小栓的新托盘。然后将存活的雄性与未交配过的雌性配对,并允许其交配4天。将雌性分离到产卵室中,并用未经处理的饵食维持,以基于卵活力确定交配是否成功。表22.仅由雄性摄入dsrna处理的人工饵食hunchbackdsrna对摄入7天后的wcr卵产量和卵活力的影响。使用dunnett检验,各平均值是分离的。sem-均值标准误.雄性中的相对表达如实施例7中所述确定。表23.暴露于经处理的人工饵食中的hunchbackdsrna6次的成年雄性中hunchback相对于gfp和水对照的相对表达。雄性成虫中转录物的水平有降低。使用dunnett检验,各平均值是分离的。sem-均值标准误.*表示p<0.05的显著性.实施例18:有效浓度将交配后的雌性暴露于4种暴露条件的hunchbackdsrna以确定有效浓度。从cropcharacteristics(farmington,mn)收到新羽化的(<48小时)的成年雄性和雌性。处理包括每个饵食小栓的2、0.2、0.02、和0.002μg的hunchback(seqidno:3)dsrna。2μg的gfp和水作为对照。将10只雄性和10只雌性放在一个含有20粒未经处理的人工饵食的孔中。将托盘转移到生长室,并保持在23±1℃,相对湿度>80%和16:8l:d光周期。在第5天将雄性从实验中移除。每隔一天提供新鲜处理的饵食至第13天。在第14天,将雌性转移到含有高压灭菌土壤的卵笼中,并提供新的经处理的人工饵食(每笼11个小栓)。将卵笼放回生长室。在第16天,如上所述提供新的经处理的饵食。将所有雌性在第18天从土壤笼中取出,并迅速冷冻用于qpcr。将土壤笼转移到新生长室,其中温度为27±1℃,相对湿度>80%,24小时黑暗。在第24天,使用#60筛子洗涤土壤以从每个笼子中收集卵。用甲醛(500μl甲醛在5ml双蒸水中)和甲基-(丁基氨基甲酰)-2-苯并咪唑氨基甲酸酯(0.025g在50ml双蒸水中)的溶液处理卵以防止真菌污染,并置于含滤纸的小培养皿中。对每个培养皿拍摄照片,用于使用imagej软件的细胞计数器功能(schneider等人(2012)nat.methods9:671-5)进行卵计数。将带卵的培养皿转移到温度为27±1℃,相对湿度>80%,黑暗24小时的小生长室。每天监测幼虫孵化历时15天。每天计数幼虫并将它们从培养皿中取出。在2和0.2μg/饵食小栓处理中,卵孵化率显著降低(表24),但是在测试的任何剂量和对照之间,每个雌性产卵数量没有差异。表24.hunchbackdsrna浓度对摄入经处理的人造饵食后wcr产卵和卵存活力的影响。各平均值使用dunnett检验是分离的。*sem-均值标准误。括号中的字母表明统计学水平。不连接相同字母的水平是显著不同(p<0.05)。用浓度为2、0.2和0.02处理的玉米根萤叶甲雌性的相对的hunchback表达显著低于对照(水和gfp)(图11)。比较用dunnett检验进行。实施例19:暴露时间以3个不同时间开始将雌性暴露于2μghunchbackdsrna6次,以确定产生亲代rnai效应所必需的暴露时间。雌性在交配前暴露于dsrna6次,交配后立即暴露6次,以及在交配后6天暴露。对于每个暴露时间,完成三个重复,每个重复10只雌性和10只雄性。从cropcharacteristics(farmington,mn)收到wcr成虫。交配前的dsrna喂食.将10只雌性放在一个孔中,其中有11粒经处理的人工饵食(每粒2μgdsrna)。将托盘转移到温度为23±1℃、相对湿度>80%、和16:8l:d光周期的生长室。每隔一天将雌性转移到含有新鲜的经处理饵食的托盘中,历时10天。在第12天,将雌性与10只雄性配对,并提供22个未经处理的饵食的小栓。4天后,移出雄性。每隔一天提供新鲜的未经处理的饵食,历时8天。在第22天,将雌性转移到含有11个未经处理的人工饵食小栓的高压灭菌土壤的卵笼中。将卵笼放回生长室,并在第24天更换饵食。第26天,从土壤笼中取出雌性,并快速冷冻用于qpcr。将土壤笼转移到温度为27±1℃,相对湿度>80%,24小时黑暗的生长室中。4天后,使用#60筛洗涤土壤,以从每个笼子中收集卵。用甲醛(500μl甲醛在5ml双蒸水中)和甲基-(丁基氨基甲酰基)-2-苯并咪唑氨基甲酸酯(0.025g在50ml双蒸水中)的溶液处理卵,以防止真菌污染,并将卵置于放有滤纸的小培养皿中。对每个培养皿拍照,以便使用imagej软件的细胞计数器功能进行卵计数。将带卵的培养皿转移到温度27±1℃,相对湿度>80%,24小时黑暗的小生长室。每天监测幼虫孵出情况,历时15天。每天计数幼虫并从培养皿中取出幼虫。图8a示出了显示每只雌性回收的卵数量的数据的汇总,图8b分别显示了在交配前暴露于0.67μg/μl的hunchback或gfp6次,交配后立即暴露6次、以及交配6天后暴露6次后,孵出的总幼虫百分比的结果。比较用dunnett检验进行,*表示p<0.1的显著性,**表示p<0.05的显著性,***表示p<0.001的显著性。图9示出了显示在交配前6次暴露于0.67μg/μl的hunchback或gfp,交配后立即暴露6次,以及交配6日后暴露6次后测量的相对hunchback表达的数据的总结。用dunnett检验进行的比较**表示p<0.05的显著性,***表示p<0.001的显著性。在交配后立即喂食dsrna.使用类似于上述方法的方法,除了在研究开始时,将10只雄性和10只雌性与22粒未处理的人工饵食颗粒放在一个孔中。将托盘如上所述转移到生长室。在第3天提供新鲜的未处理的饵食,并且在第5天取出雄性。然后将雌性转移到经处理的人工饵食并保持在生长室中。每隔一天提供新鲜处理的饵食历时6天。在第12天,将雌性转移到含有11个经处理的人工饵食小栓的高压灭菌土壤的卵笼中。将卵笼放回生长室,并在第14天提供新鲜处理的饵食。在第16天,将所有雌性从土壤笼中取出并快速冷冻用于qpcr。在6天后如上所述进行土壤笼和卵洗涤。拍摄每只培养皿的照片用于卵计数。每天监测幼虫孵出,历时15天。每只雌性的卵的结果如图8a所示。图8b示出了孵化的总幼虫百分比的结果。在接受6次dsrna后测量雌性的相对hunchback表达,如图9所示。交配后的dsrna喂养.遵循与交配后立即进行dsrna喂养的方法类似的方法,不同之处是昆虫每隔一天接受未经处理的人工饵食直到第11天,在第11天将雌性转为经处理的饵食。在第12天,将雌性转移到含有11个经处理的人工饵食小栓的高压灭菌土壤的卵笼中。将卵笼放回生长室。从12-20天开始每隔一天提供新鲜的经处理的饵食。在第22天,将所有雌性从土壤笼中取出,并迅速冷冻用于qpcr。如上所述,在6天后进行土壤笼和卵的清洗。拍摄每只培养皿的照片用于卵计数。每天监测幼虫孵出,历时15天。每天从培养皿中计数并取出幼虫。每只雌性的卵的结果如图8a所示,孵化的总幼虫百分比的结果示于图8b。测量相对hunchback表达,如图9所示。在整个研究中,对于所有处理,每隔一天记录雌性死亡率。实施例20:暴露持续时间使用未经处理的饵食令未交配过的雄性和雌性配对4天,之后令交配过的雌性暴露于2μg的hunchbackdsrna。为了评估暴露持续时间的影响,使昆虫暴露于hunchback或gfpdsrna1,2,4或6次(在图10和10b中显示为t1,t2,t4或t6)。每次处理完成了四个重复,每个重复10只雌性和10只雄性。成年雌性和雌性从cropcharacteristics(farmington,mn)收到。将10只雌性和10只雄性与20粒未经处理的人工饵食放在一个孔中。将托盘保持在温度为23±1℃,相对湿度>80%和16:8l:d光周期的生长室中。在第3天提供新的未处理的人工饵食。在第5天移除雄性,并将雌性转移到每个孔含有11个饵食小栓的新盘中,并进行相应的处理。在第7天,将雌性转移到具有新的处理的人工饵食的托盘中,并记录死亡率。将来自第1次(t1)暴露的雌性转移到未经处理的饵食。在第10天和第12天,雌性被转移到具有新的经处理的人工饵食的新托盘,记录死亡率。将来自t1和t2的雌性转移到未经处理的饵食。在第14天,将雌性转移到含有高压灭菌土壤的卵笼中,并提供新的经处理的人工饵食。对来自t1,t2和t4的雌性提供未经处理的饵食。在第16天,除去旧的饵食,加入新的经处理饵食。对来自t1,t2和t4的雌性提供未经处理的饵食。18天后,将所有雌性从土壤笼中取出,并迅速冷冻用于qpcr。将土壤笼子转移到生长室,温度为27±1℃,相对湿度>80%,24小时黑暗。洗涤卵,并根据暴露的时间指示对每只培养皿拍摄照片。计数孵出的幼虫,每天从每个培养皿中取出孵出的幼虫,历时15天。每只雌性产卵的百分比的结果如图10a所示。孵出的总幼虫百分比的结果如图10b所示。测量雌性的相对hunchback表达,如图10c所示。实施例21:卵巢发育在如暴露时间所示的交配之前和交配后立即暴露于用hunchbackdsrna处理的人工饵食的雌性中,对玉米根萤叶甲卵巢发育进行评估。雌性暴露于2μg的hunchback或gfpdsrna或水6次。每个处理在最后一次dsrna暴露后一天收集五只雌性,并储存在70%乙醇中用于随后的卵巢解剖。所有存活雌性的子宫解剖均在立体显微镜下进行。使用olympusszx16显微镜,olympussdfplapo2xpfc镜头和olympuscellsensdimensions软件(日本东京)获取图像。玉米根萤叶甲解剖显示,用水、gfp或hunchbackdsrna处理的雌性相互之间卵巢发育没有明显的差异;对于未交配的雌性以及交配后立即被解剖的雌性都是如此。序列表<110>美国陶氏益农公司及内布拉斯加大学董事会b·齐格弗里德k·e·纳尔瓦k·阿罗拉s·e·沃登c·卡朱里亚e·菲什里维奇n·p·斯托勒m·弗雷r·哈姆a·m·威莱斯阿朗戈<120>parentalrnaisuppressionofhunchbackgenetoconferresistancetocoleopteranpests<130>2971-p12202.4us(74840-us-np)<150>62/092,772<151>2014-12-16<160>73<170>patentinversion3.5<210>1<211>1955<212>dna<213>diabroticavirgifera<400>1gttagatagtggtggtcacatgacattgttatcagtgattttaatacgtgtttttgagga60atgaaaataatagttggattatttctaatacagactttgattcttaccgtgaaatgagag120gaggtgtttctgacgatatgacttcaacttgcgttcaaggaggaattagaccaattggac180gatatcaaccaaacatgcttatggaaccatcgtctcctcaatctgcctggcagtttcacc240cagccatgccgaaacgagaacccgtcgatcatgatggcagaaatgactccggcttagcat300ctggaggtgaatttatttcatcttcaccaggaagtgacaatagtgaacacttcagcgctt360cctattcatctccaaccagttgccatacagtaatttctactaatacttattatcccacca420atctaagaagaccttcacaggcgcagacgagtattccaacgcacatgatgtacaccggcg480atcacaaccccttaactcccccgaattcggaacctatgatttcgcccaaaagcgtgttat540caagaaacaacgaaggtgaacatcaaactactctgacgccttgtgcgtctcctgaggatg600cttctgttgatgctacagacagcgttaattgcgacggtgctttaaaaaaattacaagcga660cttttgaaaaaaatgcttttagtgaaggttctggggatgacgataccaaatctgatggag720aggcagaagaatacgacgaacaaggactaagagttccaaaagttaactctcatggaaaaa780ttaaaactttcaagtgtaagcaatgtgattttgtggccattactaaactagtcttctggg840aacataccaagttacatattaaagctgacaaactccttaaatgccccaagtgtccttttg900tcaccgaatataagcaccatttagaatatcaccttagaaatcattatggttcaaaaccat960ttaaatgtaaccagtgtagttactcttgtgtaaacaaatcaatgcttaattcacatttaa1020aatctcactctaatatttaccaataccgctgttctgactgcagttatgccacaaaatatt1080gtcattcgctgaaattgcatcttagaaaatactcgcacaaacctgctatggtactaaacc1140cagatggaacaccaaatccgttgcccataatcgatgtttatggtacaaggagaggaccaa1200agatgaagtcagaacaaaaatcatctgaggaaatgtctccgaaacccgaacaagttctac1260cattcccatttaaccagtttctaccccaaatgcagttaccattcccaggatttccattat1320ttggaggttttccaggtggcattccaaatcctttgttattgcaaaacttggaaaaactag1380cccgagaaaggcgtgaatccatgaactcttcagaacgtttttctcccgcacaatcagaac1440aaatggataccgatgcaggcgttcttgatctcagtaaaccagatgactcttcccagacaa1500accgacgaaaagattcagcttacaaactttcaactggtgataattcttcagatgaagaag1560acgatgaggcaactacaacaatgttcggtaatgttgaagttgttgaaaataaagaactag1620aagatacttcatcggggaaacagacaccaactagtgctaaaaaggatgactactcgtgcc1680aatactgtcagataaatttcggggaccccgttttgtatactatgcatatgggttaccacg1740gatacaagaatccatttatttgcaacatgtgcggtgaggaatgtaatgataaagtgtctt1800tcttcttgcacattgcacgaaatcctcattcttaaaaatatcaataagactgaattcaag1860gttagcatttttatatattatattcacactgaaacttttttaatattcaatatttggttg1920cgtaacatttacgcatatctatactttatttcacg1955<210>2<211>573<212>prt<213>diabroticavirgifera<400>2metargglyglyvalseraspaspmetthrserthrcysvalglngly151015glyileargproileglyargtyrglnproasnmetleumetglupro202530serserproglnseralatrpglnphehisproalametprolysarg354045gluprovalasphisaspglyargasnaspserglyleualasergly505560glyglupheileserserserproglyseraspasnsergluhisphe65707580seralasertyrserserprothrsercyshisthrvalileserthr859095asnthrtyrtyrprothrasnleuargargproserglnalaglnthr100105110serileprothrhismetmettyrthrglyasphisasnproleuthr115120125proproasnsergluprometileserprolysservalleuserarg130135140asnasngluglygluhisglnthrthrleuthrprocysalaserpro145150155160gluaspalaservalaspalathraspservalasncysaspglyala165170175leulyslysleuglnalathrpheglulysasnalapheserglugly180185190serglyaspaspaspthrlysseraspglyglualagluglutyrasp195200205gluglnglyleuargvalprolysvalasnserhisglylysilelys210215220thrphelyscyslysglncysaspphevalalailethrlysleuval225230235240phetrpgluhisthrlysleuhisilelysalaasplysleuleulys245250255cysprolyscysprophevalthrglutyrlyshishisleuglutyr260265270hisleuargasnhistyrglyserlysprophelyscysasnglncys275280285sertyrsercysvalasnlyssermetleuasnserhisleulysser290295300hisserasniletyrglntyrargcysseraspcyssertyralathr305310315320lystyrcyshisserleulysleuhisleuarglystyrserhislys325330335proalametvalleuasnproaspglythrproasnproleuproile340345350ileaspvaltyrglythrargargglyprolysmetlysserglugln355360365lyssersergluglumetserprolysprogluglnvalleuprophe370375380propheasnglnpheleuproglnmetglnleupropheproglyphe385390395400proleupheglyglypheproglyglyileproasnproleuleuleu405410415glnasnleuglulysleualaarggluargargglusermetasnser420425430sergluargpheserproalaglnsergluglnmetaspthraspala435440445glyvalleuaspleuserlysproaspaspserserglnthrasnarg450455460arglysaspseralatyrlysleuserthrglyaspasnserserasp465470475480glugluaspaspglualathrthrthrmetpheglyasnvalgluval485490495valgluasnlysgluleugluaspthrserserglylysglnthrpro500505510thrseralalyslysaspasptyrsercysglntyrcysglnileasn515520525pheglyaspprovalleutyrthrmethismetglytyrhisglytyr530535540lysasnpropheilecysasnmetcysglygluglucysasnasplys545550555560valserphepheleuhisilealaargasnprohisser565570<210>3<211>404<212>dna<213>diabroticavirgifera<400>3aagtgtaagcaatgtgattttgtggccattactaaactagtcttctgggaacataccaag60ttacatattaaagctgacaaactccttaaatgccccaagtgtccttttgtcaccgaatat120aagcaccatttagaatatcaccttagaaatcattatggttcaaaaccatttaaatgtaac180cagtgtagttactcttgtgtaaacaaatcaatgcttaattcacatttaaaatctcactct240aatatttaccaataccgctgttctgactgcagttatgccacaaaatattgtcattcgctg300aaattgcatcttagaaaatactcgcacaaacctgctatggtactaaacccagatggaaca360ccaaatccgttgcccataatcgatgtttatggtacaaggagagg404<210>4<211>20<212>dna<213>人工序列<220><223>t7噬菌体启动子<400>4taatacgactcactataggg20<210>5<211>39<212>dna<213>人工序列<220><223>hunchback_t7f正向引物<400>5taatacgactcactatagggaagtgtaagcaatgtgatt39<210>6<211>38<212>dna<213>人工序列<220><223>hunchback_t7r反向引物<400>6taatacgactcactatagggcctctccttgtaccataa38<210>7<211>41<212>dna<213>人工序列<220><223>gfp_t7f正向引物<400>7taatacgactcactatagggggtgatgctacatacggaaag41<210>8<211>38<212>dna<213>人工序列<220><223>gfp_t7r反向引物<400>8taatacgactcactatagggttgtttgtctgccgtgat38<210>9<211>370<212>dna<213>人工序列<220><223>gfp编码区<400>9aagtgatgctacatacggaaagcttacccttaaatttatttgcactactggaaaactacc60tgttccatggccaacacttgtcactactttctcttatggtgttcaatgcttttcccgtta120tccggatcatatgaaacggcatgactttttcaagagtgccatgcccgaaggttatgtaca180ggaacgcactatatctttcaaagatgacgggaactacaagacgcgtgctgaagtcaagtt240tgaaggtgatacccttgttaatcgtatcgagttaaaaggtattgattttaaagaagatgg300aaacattctcggacacaaactcgagtacaactataactcacacaatgtatacatcacggc360agacaaacaa370<210>10<211>503<212>dna<213>人工序列<220><223>yfp编码区区段<400>10caccatgggctccagcggcgccctgctgttccacggcaagatcccctacgtggtggagat60ggagggcaatgtggatggccacaccttcagcatccgcggcaagggctacggcgatgccag120cgtgggcaaggtggatgcccagttcatctgcaccaccggcgatgtgcccgtgccctggag180caccctggtgaccaccctgacctacggcgcccagtgcttcgccaagtacggccccgagct240gaaggatttctacaagagctgcatgcccgatggctacgtgcaggagcgcaccatcacctt300cgagggcgatggcaatttcaagacccgcgccgaggtgaccttcgagaatggcagcgtgta360caatcgcgtgaagctgaatggccagggcttcaagaaggatggccacgtgctgggcaagaa420tctggagttcaatttcaccccccactgcctgtacatctggggcgatcaggccaatcacgg480cctgaagagcgccttcaagatct503<210>11<211>218<212>dna<213>diabroticavirgifera<400>11tagctctgatgacagagcccatcgagtttcaagccaaacagttgcataaagctatcagcg60gattgggaactgatgaaagtacaatmgtmgaaattttaagtgtmcacaacaacgatgaga120ttataagaatttcccaggcctatgaaggattgtaccaacgmtcattggaatctgatatca180aaggagatacctcaggaacattaaaaaagaattattag218<210>12<211>424<212>dna<213>diabroticavirgifera<220><221>misc_feature<222>(393)..(395)<223>n为a、c、g或t<400>12ttgttacaagctggagaacttctctttgctggaaccgaagagtcagtatttaatgctgta60ttctgtcaaagaaataaaccacaattgaatttgatattcgacaaatatgaagaaattgtt120gggcatcccattgaaaaagccattgaaaacgagttttcaggaaatgctaaacaagccatg180ttacaccttatccagagcgtaagagatcaagttgcatatttggtaaccaggctgcatgat240tcaatggcaggcgtcggtactgacgatagaactttaatcagaattgttgtttcgagatct300gaaatcgatctagaggaaatcaaacaatgctatgaagaaatctacagtaaaaccttggct360gataggatagcggatgacacatctggcgactannnaaaagccttattagccgttgttggt420taag424<210>13<211>397<212>dna<213>diabroticavirgifera<400>13agatgttggctgcatctagagaattacacaagttcttccatgattgcaaggatgtactga60gcagaatagtggaaaaacaggtatccatgtctgatgaattgggaagggacgcaggagctg120tcaatgcccttcaacgcaaacaccagaacttcctccaagacctacaaacactccaatcga180acgtccaacaaatccaagaagaatcagctaaacttcaagctagctatgccggtgatagag240ctaaagaaatcaccaacagggagcaggaagtggtagcagcctgggcagccttgcagatcg300cttgcgatcagagacacggaaaattgagcgatactggtgatctattcaaattctttaact360tggtacgaacgttgatgcagtggatggacgaatggac397<210>14<211>490<212>dna<213>diabroticavirgifera<400>14gcagatgaacaccagcgagaaaccaagagatgttagtggtgttgaattgttgatgaacaa60ccatcagacactcaaggctgagatcgaagccagagaagacaactttacggcttgtatttc120tttaggaaaggaattgttgagccgtaatcactatgctagtgctgatattaaggataaatt180ggtcgcgttgacgaatcaaaggaatgctgtactacagaggtgggaagaaagatgggagaa240cttgcaactcatcctcgaggtataccaattcgccagagatgcggccgtcgccgaagcatg300gttgatcgcacaagaaccttacttgatgagccaagaactaggacacaccattgacgacgt360tgaaaacttgataaagaaacacgaagcgttcgaaaaatcggcagcggcgcaagaagagag420attcagtgctttggagagactgacgacgttcgaattgagagaaataaagaggaaacaaga480agctgcccag490<210>15<211>330<212>dna<213>diabroticavirgifera<400>15agtgaaatgttagcaaatataacatccaagtttcgtaattgtacttgctcagttagaaaa60tattctgtagtttcactatcttcaaccgaaaatagaataaatgtagaacctcgcgaactt120gcctttcctccaaaatatcaagaacctcgacaagtttggttggagagtttagatacgata180gacgacaaaaaattgggtattcttgagctgcatcctgatgtttttgctactaatccaaga240atagatattatacatcaaaatgttagatggcaaagtttatatagatatgtaagctatgct300catacaaagtcaagatttgaagtgagaggt330<210>16<211>320<212>dna<213>diabroticavirgifera<400>16caaagtcaagatttgaagtgagaggtggaggtcgaaaaccgtggccgcaaaagggattgg60gacgtgctcgacatggttcaattagaagtccactttggagaggtggaggagttgttcatg120gaccaaaatctccaacccctcatttttacatgattccattctacacccgtttgctgggtt180tgactagcgcactttcagtaaaatttgcccaagatgacttgcacgttgtggatagtctag240atctgccaactgacgaacaaagttatatagaagagctggtcaaaagccgcttttgggggt300ccttcttgttttatttgtag320<210>17<211>46<212>dna<213>人工序列<220><223>引物寡核苷酸ann-f1_t7<400>17ttaatacgactcactatagggagagctccaacagtggttccttatc46<210>18<211>29<212>dna<213>人工序列<220><223>引物寡核苷酸ann-r1<400>18ctaataattcttttttaatgttcctgagg29<210>19<211>22<212>dna<213>人工序列<220><223>引物寡核苷酸ann-f1<400>19gctccaacagtggttccttatc22<210>20<211>53<212>dna<213>人工序列<220><223>引物寡核苷酸ann-r1_t7<400>20ttaatacgactcactatagggagactaataattcttttttaatgttcctgagg53<210>21<211>48<212>dna<213>人工序列<220><223>引物寡核苷酸ann-f2_t7<400>21ttaatacgactcactatagggagattgttacaagctggagaacttctc48<210>22<211>24<212>dna<213>人工序列<220><223>引物寡核苷酸ann-r2<400>22cttaaccaacaacggctaataagg24<210>23<211>24<212>dna<213>人工序列<220><223>引物寡核苷酸ann-f2<400>23ttgttacaagctggagaacttctc24<210>24<211>48<212>dna<213>人工序列<220><223>引物寡核苷酸ann-r2t7<400>24ttaatacgactcactatagggagacttaaccaacaacggctaataagg48<210>25<211>47<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-f1_t7<400>25ttaatacgactcactatagggagaagatgttggctgcatctagagaa47<210>26<211>22<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-r1<400>26gtccattcgtccatccactgca22<210>27<211>23<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-f1<400>27agatgttggctgcatctagagaa23<210>28<211>46<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-r1_t7<400>28ttaatacgactcactatagggagagtccattcgtccatccactgca46<210>29<211>46<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-f2_t7<400>29ttaatacgactcactatagggagagcagatgaacaccagcgagaaa46<210>30<211>22<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-r2<400>30ctgggcagcttcttgtttcctc22<210>31<211>22<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-f2<400>31gcagatgaacaccagcgagaaa22<210>32<211>46<212>dna<213>人工序列<220><223>引物寡核苷酸betasp2-r2_t7<400>32ttaatacgactcactatagggagactgggcagcttcttgtttcctc46<210>33<211>51<212>dna<213>人工序列<220><223>引物寡核苷酸l4-f1_t7<400>33ttaatacgactcactatagggagaagtgaaatgttagcaaatataacatcc51<210>34<211>26<212>dna<213>人工序列<220><223>引物寡核苷酸l4-r1<400>34acctctcacttcaaatcttgactttg26<210>35<211>27<212>dna<213>人工序列<220><223>引物寡核苷酸l4-f1<400>35agtgaaatgttagcaaatataacatcc27<210>36<211>50<212>dna<213>人工序列<220><223>引物寡核苷酸l4-r1_t7<400>36ttaatacgactcactatagggagaacctctcacttcaaatcttgactttg50<210>37<211>50<212>dna<213>人工序列<220><223>引物寡核苷酸l4-f2_t7<400>37ttaatacgactcactatagggagacaaagtcaagatttgaagtgagaggt50<210>38<211>25<212>dna<213>人工序列<220><223>引物寡核苷酸l4-r2<400>38ctacaaataaaacaagaaggacccc25<210>39<211>26<212>dna<213>人工序列<220><223>引物寡核苷酸l4-f2<400>39caaagtcaagatttgaagtgagaggt26<210>40<211>49<212>dna<213>人工序列<220><223>引物寡核苷酸l4-r2_t7<400>40ttaatacgactcactatagggagactacaaataaaacaagaaggacccc49<210>41<211>47<212>dna<213>人工序列<220><223>引物寡核苷酸yfp-f_t7<400>41ttaatacgactcactatagggagacaccatgggctccagcggcgccc47<210>42<211>23<212>dna<213>人工序列<220><223>引物寡核苷酸yfp-r<400>42agatcttgaaggcgctcttcagg23<210>43<211>23<212>dna<213>人工序列<220><223>引物寡核苷酸yfp-f<400>43caccatgggctccagcggcgccc23<210>44<211>47<212>dna<213>人工序列<220><223>引物寡核苷酸yfp-r_t7<400>44ttaatacgactcactatagggagaagatcttgaaggcgctcttcagg47<210>45<211>222<212>dna<213>人工序列<220><223>st-ls1内含子<400>45gactagtaccggttgggaaaggtatgtttctgcttctacctttgatatatatataataat60tatcactaattagtagtaatatagtatttcaagtatttttttcaaaataaaagaatgtag120tatatagctattgcttttctgtagtttataagtgtgtatattttaatttataacttttct180aatatatgaccaaaacatggtgatgtgcaggttgatccgcgg222<210>46<211>537<212>dna<213>人工序列<220><223>diabroticahunchbackv1发夹形成dnasequence<400>46caataccgctgttctgactgcagttatgccacaaaatattgtcattcgctgaaattgcat60cttagaaaatactcgcacaaacctgctatggtactaaacccagatggaacaccaaatccg120ttgcccataatcgatgtttatggtacaaggagaggagactagtaccggttgggaaaggta180tgtttctgcttctacctttgatatatatataataattatcactaattagtagtaatatag240tatttcaagtatttttttcaaaataaaagaatgtagtatatagctattgcttttctgtag300tttataagtgtgtatattttaatttataacttttctaatatatgaccaaaacatggtgat360gtgcaggttgatccgcggttatcctctccttgtaccataaacatcgattatgggcaacgg420atttggtgttccatctgggtttagtaccatagcaggtttgtgcgagtattttctaagatg480caatttcagcgaatgacaatattttgtggcataactgcagtcagaacagcggtattg537<210>47<211>22<212>dna<213>人工序列<220><223>t20vn引物<220><221>misc_feature<222>(22)..(22)<223>n为a、c、g或t<400>47ttttttttttttttttttttvn22<210>48<211>19<212>dna<213>人工序列<220><223>引物寡核苷酸p5u76s(f)<400>48tgtgatgttggtggcgtat19<210>49<211>24<212>dna<213>人工序列<220><223>引物寡核苷酸p5u76a(r)<400>49tgttaaataaaaccccaaagatcg24<210>50<211>20<212>dna<213>人工序列<220><223>引物寡核苷酸tipmxf<400>50gagggtaatgccaactggtt20<210>51<211>24<212>dna<213>人工序列<220><223>引物寡核苷酸tipmxr<400>51gcaatgtaaccgagtgtctctcaa24<210>52<211>32<212>dna<213>人工序列<220><223>引物寡核苷酸hxtip(hex-probe)<400>52tttttggcttagagttgatggtgtactgatga32<210>53<211>151<212>dna<213>人工序列<220><223>specr编码区<400>53gaccgtaaggcttgatgaaacaacgcggcgagctttgatcaacgaccttttggaaacttc60ggcttcccctggagagagcgagattctccgcgctgtagaagtcaccattgttgtgcacga120cgacatcattccgtggcgttatccagctaag151<210>54<211>69<212>dna<213>人工序列<220><223>aad1编码区<400>54tgttcggttccctctaccaagcacagaaccgtcgcttcagcaacacctcagtcaaggtga60tggatgttg69<210>55<211>25<212>dna<213>人工序列<220><223>引物寡核苷酸st-ls1-f<400>55gtatgtttctgcttctacctttgat25<210>56<211>29<212>dna<213>人工序列<220><223>引物寡核苷酸st-ls1-r<400>56ccatgttttggtcatatattagaaaagtt29<210>57<211>34<212>dna<213>人工序列<220><223>探针寡核苷酸st-ls1-p(fam)<400>57agtaatatagtatttcaagtatttttttcaaaat34<210>58<211>20<212>dna<213>人工序列<220><223>引物寡核苷酸gaad1-f<400>58tgttcggttccctctaccaa20<210>59<211>22<212>dna<213>人工序列<220><223>引物寡核苷酸gaad1-r<400>59caacatccatcaccttgactga22<210>60<211>24<212>dna<213>人工序列<220><223>探针寡核苷酸gaad1-p(fam)<400>60cacagaaccgtcgcttcagcaaca24<210>61<211>18<212>dna<213>人工序列<220><223>引物寡核苷酸ivr1-f<400>61tggcggacgacgacttgt18<210>62<211>19<212>dna<213>人工序列<220><223>引物寡核苷酸ivr1-r<400>62aaagtttggaggctgccgt19<210>63<211>26<212>dna<213>人工序列<220><223>探针寡核苷酸ivr1-p(hex)<400>63cgagcagaccgccgtgtacttctacc26<210>64<211>19<212>dna<213>人工序列<220><223>引物寡核苷酸spc1a<400>64cttagctggataacgccac19<210>65<211>19<212>dna<213>人工序列<220><223>引物寡核苷酸spc1s<400>65gaccgtaaggcttgatgaa19<210>66<211>21<212>dna<213>人工序列<220><223>探针寡核苷酸tqspec(cy5)<400>66cgagattctccgcgctgtaga21<210>67<211>156<212>dna<213>diabroticavirgifera<400>67caataccgctgttctgactgcagttatgccacaaaatattgtcattcgctgaaattgcat60cttagaaaatactcgcacaaacctgctatggtactaaacccagatggaacaccaaatccg120ttgcccataatcgatgtttatggtacaaggagagga156<210>68<211>45<212>dna<213>人工序列<220><223>hunchbackv1_f正向引物<400>68ttaatacgactcactatagggagacaataccgctgttctgactgc45<210>69<211>48<212>dna<213>人工序列<220><223>hunchbackv1_r反向引物<400>69ttaatacgactcactatagggagatcctctccttgtaccataaacatc48<210>70<211>1955<212>rna<213>diabroticavirgifera<400>70guuagauagugguggucacaugacauuguuaucagugauuuuaauacguguuuuugagga60augaaaauaauaguuggauuauuucuaauacagacuuugauucuuaccgugaaaugagag120gagguguuucugacgauaugacuucaacuugcguucaaggaggaauuagaccaauuggac180gauaucaaccaaacaugcuuauggaaccaucgucuccucaaucugccuggcaguuucacc240cagccaugccgaaacgagaacccgucgaucaugauggcagaaaugacuccggcuuagcau300cuggaggugaauuuauuucaucuucaccaggaagugacaauagugaacacuucagcgcuu360ccuauucaucuccaaccaguugccauacaguaauuucuacuaauacuuauuaucccacca420aucuaagaagaccuucacaggcgcagacgaguauuccaacgcacaugauguacaccggcg480aucacaaccccuuaacucccccgaauucggaaccuaugauuucgcccaaaagcguguuau540caagaaacaacgaaggugaacaucaaacuacucugacgccuugugcgucuccugaggaug600cuucuguugaugcuacagacagcguuaauugcgacggugcuuuaaaaaaauuacaagcga660cuuuugaaaaaaaugcuuuuagugaagguucuggggaugacgauaccaaaucugauggag720aggcagaagaauacgacgaacaaggacuaagaguuccaaaaguuaacucucauggaaaaa780uuaaaacuuucaaguguaagcaaugugauuuuguggccauuacuaaacuagucuucuggg840aacauaccaaguuacauauuaaagcugacaaacuccuuaaaugccccaaguguccuuuug900ucaccgaauauaagcaccauuuagaauaucaccuuagaaaucauuaugguucaaaaccau960uuaaauguaaccaguguaguuacucuuguguaaacaaaucaaugcuuaauucacauuuaa1020aaucucacucuaauauuuaccaauaccgcuguucugacugcaguuaugccacaaaauauu1080gucauucgcugaaauugcaucuuagaaaauacucgcacaaaccugcuaugguacuaaacc1140cagauggaacaccaaauccguugcccauaaucgauguuuaugguacaaggagaggaccaa1200agaugaagucagaacaaaaaucaucugaggaaaugucuccgaaacccgaacaaguucuac1260cauucccauuuaaccaguuucuaccccaaaugcaguuaccauucccaggauuuccauuau1320uuggagguuuuccagguggcauuccaaauccuuuguuauugcaaaacuuggaaaaacuag1380cccgagaaaggcgugaauccaugaacucuucagaacguuuuucucccgcacaaucagaac1440aaauggauaccgaugcaggcguucuugaucucaguaaaccagaugacucuucccagacaa1500accgacgaaaagauucagcuuacaaacuuucaacuggugauaauucuucagaugaagaag1560acgaugaggcaacuacaacaauguucgguaauguugaaguuguugaaaauaaagaacuag1620aagauacuucaucggggaaacagacaccaacuagugcuaaaaaggaugacuacucgugcc1680aauacugucagauaaauuucggggaccccguuuuguauacuaugcauauggguuaccacg1740gauacaagaauccauuuauuugcaacaugugcggugaggaauguaaugauaaagugucuu1800ucuucuugcacauugcacgaaauccucauucuuaaaaauaucaauaagacugaauucaag1860guuagcauuuuuauauauuauauucacacugaaacuuuuuuaauauucaauauuugguug1920cguaacauuuacgcauaucuauacuuuauuucacg1955<210>71<211>404<212>rna<213>diabroticavirgifera<400>71aaguguaagcaaugugauuuuguggccauuacuaaacuagucuucugggaacauaccaag60uuacauauuaaagcugacaaacuccuuaaaugccccaaguguccuuuugucaccgaauau120aagcaccauuuagaauaucaccuuagaaaucauuaugguucaaaaccauuuaaauguaac180caguguaguuacucuuguguaaacaaaucaaugcuuaauucacauuuaaaaucucacucu240aauauuuaccaauaccgcuguucugacugcaguuaugccacaaaauauugucauucgcug300aaauugcaucuuagaaaauacucgcacaaaccugcuaugguacuaaacccagauggaaca360ccaaauccguugcccauaaucgauguuuaugguacaaggagagg404<210>72<211>537<212>rna<213>人工序列<220><223>diabroticahunchbackv1发夹形成rna<400>72caauaccgcuguucugacugcaguuaugccacaaaauauugucauucgcugaaauugcau60cuuagaaaauacucgcacaaaccugcuaugguacuaaacccagauggaacaccaaauccg120uugcccauaaucgauguuuaugguacaaggagaggagacuaguaccgguugggaaaggua180uguuucugcuucuaccuuugauauauauauaauaauuaucacuaauuaguaguaauauag240uauuucaaguauuuuuuucaaaauaaaagaauguaguauauagcuauugcuuuucuguag300uuuauaaguguguauauuuuaauuuauaacuuuucuaauauaugaccaaaacauggugau360gugcagguugauccgcgguuauccucuccuuguaccauaaacaucgauuaugggcaacgg420auuugguguuccaucuggguuuaguaccauagcagguuugugcgaguauuuucuaagaug480caauuucagcgaaugacaauauuuuguggcauaacugcagucagaacagcgguauug537<210>73<211>156<212>rna<213>diabroticavirgifera<400>73caauaccgcuguucugacugcaguuaugccacaaaauauugucauucgcugaaauugcau60cuuagaaaauacucgcacaaaccugcuaugguacuaaacccagauggaacaccaaauccg120uugcccauaaucgauguuuaugguacaaggagagga156当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1