一株假小链双歧杆菌及其制备共轭亚油酸或共轭亚麻酸的应用的制作方法
本发明涉及一株分离自新生儿粪便的假小链双歧杆菌(Bifidobacterium pseudocatenulatum)CCFM748,以及所述菌株在制备共轭亚油酸或共轭亚麻酸中的应用。
背景技术:
共轭亚油酸(Conjugated linoleic acid,CLA)是一种含有共轭双键的十八碳二烯酸总称,是亚油酸(Linoleic acid,18:2)的位置异构体和几何异构体。最丰富、最常见的异构体是顺9,反11-CLA(c9,t11-CLA),亦被称为瘤胃酸(Rumenic acid)。此外,反10,顺12-CLA(t10,c12-CLA)也是自然界含量相对较高的异构体。共轭亚油酸因其生物功能而受到关注,其生理活性主要包括:抗癌、抗炎、减缓动脉粥样硬化、减肥、缓解糖尿病及促进骨骼生长及免疫调节等。不同的异构体具有不同的生理功能,其中c9,t11-CLA和t10,c12-CLA是被公认的最具生理活性的共轭亚油酸异构体,c9,t11-CLA最主要的功能在于抗癌、抗炎及免疫调节等方面,而t10,c12-CLA对于减肥和脂质代谢方面的影响是非常显著的。此外,t9,t11-CLA也被报道具有抗炎等活性。
共轭亚麻酸(Conjugated linolenic acid,CLNA)是由亚麻酸(Linolenic acid,LNA)衍生而来具有共轭双键的十八碳三烯酸多种位置与几何异构体的总称,它具有多种营养和保健功能,如抗癌、抗糖尿病、抗动脉粥样硬化、降低体脂含量、胰岛素抵抗、调节机体免疫等多种营养和保健功能,已成为医学、化学、营养学等领域的研究热点。在共轭亚麻酸的各种立体异构体中,c9,t11,c15-CLNA(CLNA1)、t9,t11,c15-CLNA(CLNA2)、t10,c12,c15-CLNA和c6,c9,t11-CLNA等是被认为最具生物活性的异构体。
天然的共轭亚油酸主要存在于瘤胃动物牛、羊等的乳脂及肉制品中,每克乳脂中含量从2mg-25mg不等,且CLA含量随奶牛年龄增长而增加。CLA的非天然来源主要通过人工合成的方法获得,人工合成的CLA则因其原料和方法不同,各异构体的含量相差甚远。自然界的一些植物种子诸如石榴籽、油桐籽、苦瓜籽、金盏花籽、栝楼和蓝花楹籽等富含共轭亚麻酸。在众多含有共轭亚麻酸的植物种子中仅栝楼籽可直接食用,且植物种籽中的油脂成分很复杂,实现共轭亚麻酸的分离与纯化十分困难。
此外,现有技术通过碱处理亚麻酸异构化法也可产生共轭亚麻酸,但该方法产率较低,且产品中有试剂残留难以投入实际应用,故至今尚未实现共轭亚麻酸的工业化生产。
目前有研究发现通过微生物转化CLA、CLNA,特别有些乳酸菌具有共轭亚油酸和共轭亚麻酸转化能力,例如Gorissen等对30多株双歧杆菌生物转化CLA和共轭亚麻酸进行了研究,在36株双歧杆菌中发现6株可以产CLA或CLNA,6株双歧杆菌中对两种共轭脂肪酸的转化率最高的分别为53%、78%(Gorissen L,et al.Production of conjugated linoleic acid and conjugatedlinolenic acid isomers by Bifidobacterium species[J].Appl Microbiol Biotechnol,2010,87(6):2257-2266.)。然而,所得根据其记载,所得脂肪酸的异构体并非以最具有生物活性的c9,t11-CLA和t10,c12-CLA或c9,t11,c15-CLNA和t9,t11,c15-CLNA为主。
技术实现要素:
本发明的目的是克服现有技术缺陷,获得共轭亚油酸、共轭亚麻酸产量更高、转化率更高、且产物中以c9,t11-CLA和t10,c12-CLA或c9,t11,c15-CLNA和t9,t11,c15-CLNA为主要异构体的假小链双歧杆菌。
本发明还提供上述菌株在制备共轭亚油酸或共轭亚麻酸中的应用。
为了实现上述目的,本发明提供一株假小链双歧杆菌CCFM748该菌株已于2016年6月12日在中国微生物菌种保藏管理委员会普通微生物中心保藏,其保藏号为CGMCC No.12603。
本发明的假小链双歧杆菌CCFM748是新分离、筛选获得,通过细菌基因组DNA提取、16S rDNA特异引物PCR扩增、扩增产物纯化、DNA测序、序列比对等步骤细菌16S rDNA序列测序法进行种属鉴定,鉴定为假小链双歧杆菌,并命名为假小链双歧杆菌CCFM748。
本发明的假小链双歧杆菌CCFM748具有下述生物学特性:
菌体特征:菌体呈乳白色。
菌落特征:在mMRS固体平板上菌落突起,光滑、圆形、乳白色、半透明、直径为1~2mm。
生长特性:在37℃恒温厌氧的条件下,假小链双歧杆菌CCFM748在mMRS培养基中培养约24h达到对数末期。
假小链双歧杆菌是双歧杆菌属中的一种。双歧杆菌属共包含35个种,包括青春双歧杆菌、动物双歧杆菌动物亚种、动物双歧杆菌乳酸亚种(即乳双歧杆菌)、两歧双歧杆菌、熊峰双歧杆菌、布姆双歧杆菌、短双歧杆菌、链双歧杆菌、豚双歧杆菌、棒状双歧杆菌、家兔双歧杆菌、齿双歧杆菌、没食子双歧杆菌、鸡双歧杆菌、长双歧杆菌长亚种、长双歧杆菌婴儿亚种、大双歧杆菌、最小双歧杆菌、假小链双歧杆菌、假长双歧杆菌假长亚种、假长双歧杆菌球旋虫亚种、小鸡双歧杆菌、细长双歧杆菌、嗜热双歧杆菌等。
由于双歧杆菌属种类繁多,同属不同种的双歧杆菌在形态、化学生理特性、代谢及生理功能等多方面存在显著差异,目前为止,尚未有研究发现假小链双歧杆菌能够转化共轭脂肪酸,仅少数同属不同种的菌株具备较低转化率。目前,学界也尚未有研究确定导致这种功能差异的原因或机理。
发明还提供所述假小链双歧杆菌CCFM748在制备共轭亚油酸中的应用,特别地将亚油酸转化为共轭亚油酸,特别是转化为c9,t11-CLA和t10,c12-CLA,并具有突出的转化率。
本发明还提供所述假小链双歧杆菌CCFM748在制备共轭亚麻酸中的应用,特别地将亚麻酸转化为共轭亚麻酸,特别是转化为c9,t11,c15-CLNA和t9,t11,c15-CLNA,并具有突出的转化率。
本发明还提供所述假小链双歧杆菌PA作为食品添加剂的应用。
假小链双歧杆菌(Bifidobacterium pseudocatenulatum)CCFM748,该菌株于2016年6月12日在中国微生物菌种保藏管理委员会普通微生物中心保藏,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏号为CGMCC No.12603。
【附图说明】
图1为本发明中假小链双歧杆菌的分离、纯化及保藏操作流程图;
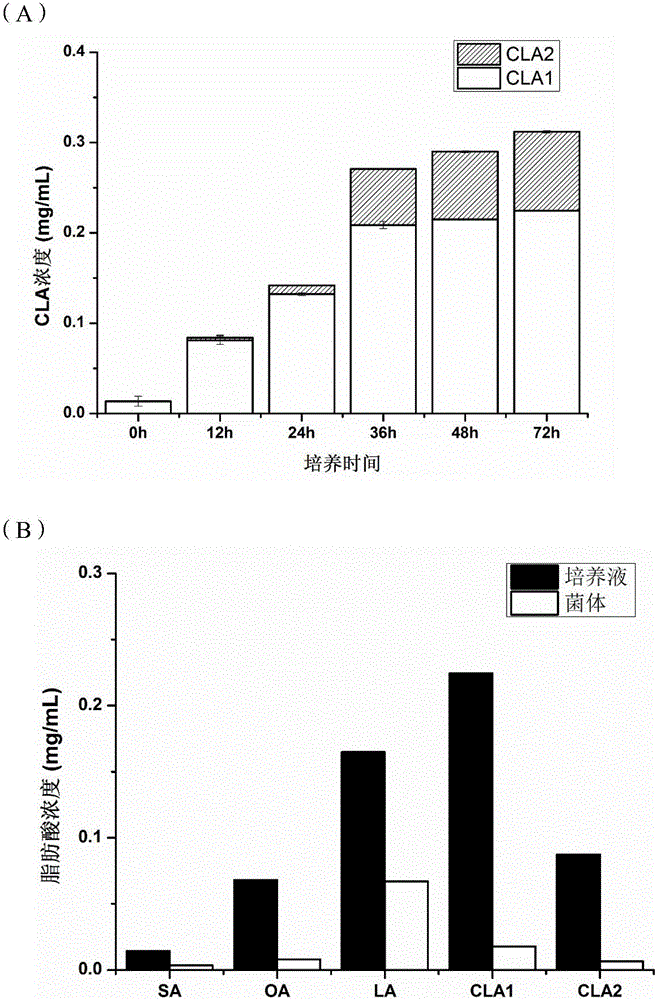
图2为本发明假小链双歧杆菌CCFM748共轭亚油酸的转化率;
(A)共轭亚油酸总浓度随培养时间的变化;
(B)培养72小时后培养液、胞内的共轭亚油酸的分布
图3为本发明假小链双歧杆菌CCFM748共轭亚麻酸的转化率;
(A)共轭亚麻酸总浓度随培养时间的变化;
(B)培养72小时后培养液、胞内的共轭亚麻酸分布
图中:SA:硬脂酸,VA:异油酸,OA:油酸,LA:亚油酸,CLA1:c9,t11-CLA,CLA2:t9,t11-CLA
【具体实施方式】
通过下述实施例将能够更好地理解本发明,但不限制性地解释本发明的技术方案。
在本发明中,如无特殊说明,用于说明浓度或比例的“%”或百分比均为重量百分比。
本发明涉及以下培养基:
mMRS液体培养基:胰蛋白胨10g、牛肉浸膏10g、酵母粉5g、葡萄糖20g、柠檬酸氢二铵2g、醋酸钠5g、磷酸氢二钾2g、七水硫酸镁0.5g、一水合硫酸锰0.25g,吐温80 1mL与0.5g半胱氨酸,加水至1000mL。
mMRS固体培养基是在以上基础添加以液体培养基总重计1.5%琼脂得到的。
实施例1:样品的采集和双歧杆菌的分离鉴定
取1g新生儿粪便样品,梯度稀释后涂布于mMRS固体培养基,置于厌氧环境下在37℃下培养72h,观察记录菌落形态,挑去菌落划线纯化,然后在MMRS液体培养基中在37℃下培养48h,所得菌落进行革兰氏染色并记录菌株形态,弃除菌落中的革兰氏阴性菌株和革兰氏阳性球菌,挑选得到革兰氏阳性杆菌,经过过氧化氢酶分析后弃除过氧化氢酶阳性菌株,保留过氧化氢酶阴性菌株,以果糖-6-磷酸激酶检测以弃除阴性菌株,所得均经过16S rDNA测序鉴定为假小链双歧杆菌,命名为假小链双歧杆菌CCFM748。所得假小链双歧杆菌进行传代培养,收集菌体置于离心管中3000r/min离心10min洗涤,重复3次,所得菌体加入基体保护剂中进行冻存。
16S rDNA扩增条件:95℃ 5min;35个循环(95℃ 30s,55℃ 30s,72℃ 2min);72℃ 10min
扩增引物:
27F:(5’-AGAGTTTGATCCTGGCTCAG-3’)
1492R:(5’-TACGGCTACCTTGTTACGACTT-3’
扩增产物纯化和序列比对过程按文献(Turroni F et al.Exploring the Diversity of the Bifidobacterial Population in the Human Intestinal Tract[J].Appl Environ Microb.2009;75(6):1534–45.)记载的方法进行。
双歧杆菌的鉴定:分离纯化的双歧杆菌,经16S rDNA序列分析的方法鉴定为假小链双歧杆菌,其基本特性见表1。
表1Bifidobacterium pseudocatenulatum CCFM748的基本特性
实施例2:假小链双歧杆菌CCFM748生物转化共轭亚油酸
具体实验如下:
1、菌株活化
从-80℃冰箱取出保有假小链双歧杆菌CCFM748的甘油管,取菌液划线于mMRS固体培养基上,厌氧环境下37℃培养48h。挑取长出的单菌落并接种于mMRS液体培养基中,厌氧环境下37℃培养48h,连续活化3代。
2、亚油酸母液的配制
称取300mg亚油酸(LA)和200mg Tween-80溶于水并定容至10mL,充分搅拌乳化后,经0.45μm无菌滤膜过滤除菌后保存于-20℃避光保存。
3、与亚油酸共培养
将步骤1中活化好的菌液按照2%(v/v)接种量接种至含0.528mg/mL LA的10mL mMRS液体培养基中,厌氧环境下37℃培养0、12、24、48、72h,同时以添加等量亚油酸而不添加菌液的培养基为对照。培养后,分别将菌液移至离心管中,5000rpm离心5min,每份培养物取3份3mL发酵液至干净离心管待用。
4、脂肪酸提取
发酵液中脂肪酸的提取:向3mL发酵液中添加十七烷酸(C17:0)至终浓度为0.075mg/mL作为内标,然后添加2mL异丙醇,充分振荡30s;再添加3mL正己烷,充分振荡30s;5000rpm离心3min。吸收正己烷层至干净提脂瓶中,氮气吹干。
菌体中脂肪酸的提取:前述离心所得菌体用2mL盐溶液(含0.137mol/L NaCl、7.0mmol/L K2HPO4和2.5mmoL/L KH2PO4)洗涤,4000rpm离心5min,重复洗涤步骤。将菌体重悬于2mL的前述盐溶液中,添加十七烷酸(C17:0)至终浓度为0.0575mg/mL,按发酵液相同的方法进行脂肪酸提取及氮气吹干,提取得到菌体中的脂肪酸。
5、脂肪酸甲酯化
向前述发酵液脂肪酸、菌体脂肪酸分别用氮气吹干后中加入400μL甲醇,充分振荡混匀后以150μL重氮甲烷试剂直接进行甲酯化,氮气吹干后用1mL正己烷回溶,转移至气相瓶,待进行GC-MS检测。
6、GC-MS检测
岛津气相色谱仪(GC 2010plus),气相柱Rtx-wax(30m×0.25mm×0.25μm),质谱仪(岛津Ultra QP2010)。程序升温条件:初始150℃,以5℃/min的速率升温至200℃,保持10min,后以4℃/min升温至230℃,保持18min。采用分流进样,进样量1μL,分流比50∶1,氦气为载气。进样器温度和检测器温度均为240℃。离子源220℃,强度为70eV。
7、实验结果
所得脂肪酸含有:硬脂酸0.0144mg/mL、油酸0.0682mg/mL、亚油酸0.1649mg/mL、CLA0.3118mg/mL。
CLA的积累过程中,假小链双歧杆菌CCFM748在含有0.528mg/mL LA的mMRS中生长12h时开始产生CLA,随着菌体生长,共轭亚油酸的含量逐渐增加(24h、36h),培养36h后发酵液中共轭亚油酸的浓度趋于饱和,如图2所示。该菌对LA的最大转化率为培养72h左右,CLA的总浓度达到了0.3118mg/mL,以底物LA总量计算得到CLA的总转化率为59.05%。
经过脂肪酸成分分析,从CLA各异构体含量来看,产物中仅含CLA1(c9,t11-CLA)和CLA2(t10,c12-CLA)两种异构体。菌株在培养12h后开始转化CLA1。随着菌体生长,异构体CLA1在12h到36h内快速累积,其含量在菌株培养36h后趋于饱和,而CLA2在菌株开始积累CLA时(24h)含量较低,随着培养时间的延长,CLA2的浓度也进一步增加。培养72h后,CLA1的浓度高达为0.223mg/mL,占总CLA的72.02%。
分析培养72h后假小链双歧杆菌CCFM748发酵液及菌体脂肪酸组成可知,该菌对LA的吸收与转化率均极高,均高于现有技术。发酵液中仅剩少量的底物LA且菌体内几乎未残留尚未被转化的LA。所得CLA绝大多数处于发酵液中,菌体内存留量也非常少。该结果表明绝大多数的产物不在胞内积累,而是被转运至胞外,且CLA在发酵液中占总脂肪酸的比例达到55.7%,纯度显著高于现有技术,因为能够简化后期对发酵液中CLA的分离的纯化。
实施例3:假小链双歧杆菌CCFM748生物转化共轭亚麻酸
1、菌株活化
同实施例2。
2、亚麻酸母液的配制
称取300mgα-亚麻酸(α-LNA)和200mg Tween-80溶于水并定容至10mL,充分搅拌乳化后,经0.45μm无菌滤膜过滤除菌后保存于-20℃避光保存。
3、与亚麻酸共培养
将活化好的菌液按照2%(v/v)接种量接种至含0.3759mg/mLα-LNA的10mL mMRS液体培养基中,厌氧环境下37℃培养0、12、24、36、48、72h,并以添加等量亚麻酸而不添加菌液的培养基为对照。培养后,将菌液移至离心管中,5000rpm离心5min;对每份培养物取3份3mL发酵液至干净离心管待用。
4、脂肪酸提取
发酵液中脂肪酸的提取:向3mL发酵液中添加十七烷酸(C17:0)至终浓度为0.0767mg/mL作内标,再添加2mL异丙醇,充分振荡30s;再添加3mL正己烷,充分振荡30s;5000rpm离心3min,吸收正己烷层至干净提脂瓶;氮气吹干,得到发酵液中的脂肪酸。
菌体中脂肪酸的提取:前述离心所得菌体用2mL盐溶液(含0.137mol/L NaCl、7.0mmol/L K2HPO4和2.5mmoL/L KH2PO4)洗涤,4000rpm离心5min,重复进行洗涤。将菌体重悬于2mL盐溶液中,添加十七烷酸(C17:0)至终浓度为0.0575mg/mL,按发酵液相同的方法进行脂肪酸提取及氮气吹干,得到提取得到菌体中的脂肪酸。
5、脂肪酸甲酯化
分别向前述获得脂肪酸氮气吹干后加入400μL甲醇,充分振荡混匀后以150μL重氮甲烷试剂直接进行甲酯化,氮气吹干后用1mL正己烷回溶,转移至气相瓶,待进行GC-MS检测。
6、GC-MS检测
岛津气相色谱仪(GC 2010plus),气相柱Rtx-wax(30m×0.25mm×0.25μm),质谱仪(岛津Ultra QP2010)。程序升温条件:初始150℃,以5℃/min的速率升温至200℃,保持10min,再以4℃/min升温至230℃,保持18min。采用分流进样,进样量1μL,分流比50∶1,氦气为载气。进样器温度和检测器温度均为240℃。离子源220℃,强度为70eV。
7、实验结果
假小链双歧杆菌CCFM748在含有0.3759mg/mLα-LNA的mMRS中生长12h时开始产生CLNA,随着菌体生长共轭亚麻酸的含量逐渐增加(24h、36h),培养36h后共轭亚麻酸的含量增加渐缓。该菌对LNA的最大转化率为培养72h左右,CLNA的总含量达到了0.3402mg/mL(此外产物中还含有极少量异油酸、油酸、亚油酸和底物α-LNA),以底物α-LNA总量计得其转化率为90.5%,显著优于现有技术。
根据脂肪酸分析,从CLNA各异构体含量来看,该菌的发酵产物中仅有CLNA1和CLNA2两种异构体,为公认的生物活性最高的两种异构体。菌株在培养12h后开始转化共轭亚麻酸,随着菌体生长,异构体CLNA1在12h到36h内快速累积,其含量在菌株培养36h后趋于饱和,而CLNA2在菌株开始积累CLNA时(24h)含量较低,随着培养时间的延长,该异构体的浓度也进一步增加。在所转化的CLNA异构体中,CLNA1占绝对主导地位,最终浓度达0.3267mg/mL,占总CLNA含量的96%。
从培养72h后双歧杆菌CCFM748发酵液及菌体脂肪酸组成可以发现,该菌株对LNA的吸收与转化率均极高,显著优于现有技术,其发酵液中几乎没有底物LNA剩余,且菌体内也仅剩极少量的LNA尚未被转化。此外,所转化的CLNA而言,其绝大多数均处于发酵液中,菌体内存留的量也非常少。此外,CLNA1和CLNA2在发酵液与菌体内的分布情况基本一致,该结果也表明绝大多数的产物均不在胞内积累,而是被转运至胞外,因此有利于后期的进一步分离与纯化。
- 还没有人留言评论。精彩留言会获得点赞!