一种多肽及其应用和药物组合物的制作方法
本发明涉及多肽药物技术领域,特别涉及一种多肽及其应用和药物组合物。
背景技术:
表观遗传修饰例如组蛋白的甲基化、乙酰化和泛素化等在基因的转录表达中扮演着重要的角色。表观遗传修饰的异常和多种疾病,例如癌症有着重要相关性。此外,在炎症、代谢性疾病以及在再生医学中也有着相当重要的作用。
近年来,人们逐渐鉴定出了一系列组蛋白甲基化修饰位点。组蛋白的甲基化修饰主要发生在赖氨酸(K)和精氨酸(R)残基上。赖氨酸甲基化修饰通常发生在组蛋白H3赖氨酸4位、9位、27位、36位、79位残基(H3K4、H3K9、H3K27、H3K36、H3K79),以及组蛋白H4 20位赖氨酸残基(H4K20)上。通常认为H3K4、H3K36、H3K79的甲基化修饰介导基因转录活化,而H3K9、H3K27、H4K20的甲基化修饰介导转录抑制。
目前发现的可以催化H3K4位点甲基化的酶主要为MLL(Mixed lineage leukemia)家族蛋白,混合谱系白血病(Mixed Lineage Leukemia,MLL)蛋白是由MLL基因所编码的一类蛋白,也是第一个被发现的组蛋白H3的4位赖氨酸的甲基化转移酶,包括MLL1、MLL2、MLL3、MLL4、SET1A、SET1B以及ASH1。人类有至少6种不同的H3K4甲基化酶,包括:SET1A和SET1B,均为COMPASS的一部分,而MLL(MLL1),MLL2,MLL3,MLL4能够形成不同的COMPASS类似物。根据现有的研究报道,可与甲基化H3K4修饰结合的效应蛋白主要有TAF3、ING家族、CHD1、BPTF、WDR5、JMJD2A和BHC80。
研究发现组蛋白H3K4甲基化酶的异常表达与多种癌症如白血病、乳腺癌、肺癌等的发生有关。其中,WDR5蛋白是WD40蛋白的一种,是人类MLL和SET1组蛋白H3K4甲基化酶的蛋白复合物的重要一员。近期研究显示SET1蛋白和所有的MLL蛋白都可以通过它们的WDR5结合区(Win motif)结合于WDR5蛋白。WDR5蛋白与MLL蛋白间的相互作用对MLL蛋白复合物的形成和活性发挥着至关重要的作用。因此,WDR5蛋白是抗肿瘤药物开发的重要靶点,而WDR5抑制剂在抗肿瘤,尤其是白血病药物领域具有非常好的市场前景。
技术实现要素:
有鉴于此,本发明提供了一种多肽及其应用和药物组合物。该多肽可抑制WDR5和MLL1蛋白的结合,抑制MLL1蛋白复合物甲基转移酶活性,从而可有效抑制肿瘤细胞的生长,具备潜在的生物医药开发价值。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了一种如式I所示的多肽,或其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体及其混合物,或其药学上可接受的盐以及它的前药;
其特征在于,A独立选自Thr或Val;
B独立选自Asp、Asn、Glu、Thr、His、Leu、Ala或Ile,或没有氨基酸;
C独立选自Pro、His、Asp、Met、Ser、Ala、Ile、Leu或Val,或没有氨基酸;
D独立选自Pro、Tyr、Glu、Met、Asn、Trp、Ala、Val、Ile或Cys,或没有氨基酸;
E独立选自Met、Tyr、His、Trp、Asn、Pro、Ala、Nal或Phe,或没有氨基酸;
F独立选自His、Asn、Ser、Gln、Thr、Asp、Ala、Leu或Cys,或没有氨基酸;
X1为氨基酸A1、B1、C1、D1、E1中的一种或几种组成的片段,至少包含一个氨基酸,其中,
A1独立选自Ile、Leu、Phe或Val;
B1独立选自Tyr、Ser或Thr;
C1独立选自Ala、Ile、Leu、Phe或Val;
D1独立选自Ser、Gly或Ala;
E1独立选自Val、Ala、Leu、Asp、Ser、Met或Cys;
X2为A2、B2、C2、D2中的一种或几种组成的片段,或没有氨基酸,其中,
A2独立选自Gly、Trp、Thr、Ser或Cys;
B2独立选自Ala、Ile、Leu、Ser或Lys;
C2独立选自Leu、Phe、Val或Arg;
D2独立选自Asn、Asp、Glu或Gln。
在本发明提供的实施例中,多肽为线状多肽,多肽的序列为Ser-Val-Arg-Thr,多肽编号为SEQ ID NO:1;
或者为Ac-Ala-Arg-Thr-Asp-Pro-Ala-Met-His-Trp-Ser-Arg,多肽编号为SEQ ID NO:2;
或者为Ser-Val-Arg-Thr-Asp-Pro-Ala-Met-His-Trp-Ser-Arg,多肽编号为SEQ ID NO:3;
或者为Leu-Arg-Thr-Asp-Leu-Val-His-Asn-Ser-Leu-Val-Gln,多肽编号为SEQ ID NO:4;
或者为Gly-Ala-Arg-Thr-Glu-Val-Pro-Phe-Leu-Thr-Ile-Phe,多肽编号为SEQ ID NO:5;
或者为Ser-Ala-Ala-Ser-Arg-Thr-Ile-Asp-Met-Trp-Ala-Thr,多肽编号为SEQ ID NO:6;
或者为Asp-Arg-Thr-Thr-His-Tyr-Tyr-Leu-Gly-Lys-Leu-Glu,多肽编号为SEQ ID NO:7;
或者为Ser-Ala-Arg-Val-Ala-Ile-Glu-Tyr-Asn-Thr-Ala-Arg,多肽编号为SEQ ID NO:8;
或者为Ile-Ser-Ala-Ser-Met-Arg-Thr-Thr-Met-Asn-Asn-Ser,多肽编号为SEQ ID NO:9;
或者为Gly-Ala-Arg-Thr-Glu-Val-Pro-1-Nal-Leu-Thr-Ile-Phe,多肽编号为SEQ ID NO:10;
或者为Cys-Arg-Thr-Ala-Pro-Met-Pro-His-Cys,多肽编号为SEQ ID NO:11;
或者为Ac-Cys-Arg-Thr-Ala-Pro-Met-Pro-His-Cys,多肽编号为SEQ ID NO:12。
本发明还提供了一种如式I所示的多肽中两个或两个以上的氨基酸残基环化所得到的多肽,优选地,环化通过二硫键或酰胺键形成。但本领域技术人员认为可行的环化方式均在本发明的保护范围之内。
在本发明提供的实施例中,环化通过二硫键形成。
在本发明提供的实施例中,环状多肽的序列为:
多肽编号为SEQ ID NO:13;
或者为多肽编号为SEQ ID NO:14;
或者为多肽编号为SEQ ID NO:15;
或者为多肽编号为SEQ ID NO:16;
或者为多肽编号为SEQ ID NO:17;
或者为多肽编号为SEQ ID NO:18;
或者为多肽编号为SEQ ID NO:19;
或者为多肽编号为SEQ ID NO:20。
本发明还提供了一种如式I所示多肽的氨基酸序列中取代、缺失或添加一个或多个氨基酸残基所得到的多肽,且该多肽为具有抑制WDR5与MLL1蛋白结合活性的多肽。
本发明还提供了一种如式I所示多肽的氨基酸序列N末端被磷酸化、酰胺化、烷基化、、泛素化、聚乙二醇化修饰,或氨基酸序列C末端被酯化、酰胺化修饰所得到的多肽,且该多肽为具有抑制WDR5与MLL1蛋白结合活性的多肽。
本发明还提供了一种如式I所示多肽的氨基酸序列中连接荧光标记或放射性标记所得到的多肽,优选地,荧光标记为FITC或FAM。但本领域技术人员认可的荧光标记均在本发明的保护范围之内。
本发明还提供了如式I所示多肽在制备抑制WDR5和MLL1蛋白结合活性、抑制MLL1蛋白复合物的甲基转移酶活性或治疗细胞增殖相关疾病药物中的应用。
在本发明提供的实施例中,细胞增殖相关疾病是癌症。
在本发明提供的实施例中,癌症为白血病。
本发明还提供了一种药物组合物,包括如式I所示的多肽。
本发明提供了一种多肽及其应用和药物组合物。该多肽如式I所示,或其互变异构体、内消旋体、外消旋体、对映异构体、非对映异构体及其混合物,或其药学上可接受的盐以及它的前药。本发明具有如下有益效果:
本发明SEQ ID NO:1~20所示线性多肽和环肽包含了保守的RT或RV序列,IC50在0.8~200μM之间,其中一些多肽(SEQ ID NO:1~3、5、7、8、10、12~14)可以在纳摩尔到较低的微摩尔级别的浓度下抑制WDR5和MLL1蛋白结合的活性,具备潜在的生物医药开发价值;
本发明提供的多肽可抑制MLL1蛋白复合物甲基转移酶活性,尤其是SEQ ID NO:3、SEQ ID NO:5、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:13所示多肽可显著抑制MLL1蛋白复合物甲基转移酶活性;
本发明提供的多肽可有效抑制肿瘤细胞的生长,具备潜在的生物医药开发价值。
附图说明
图1示不同多肽化合物的对MLL蛋白复合物甲基化转移酶的抑制百分比;
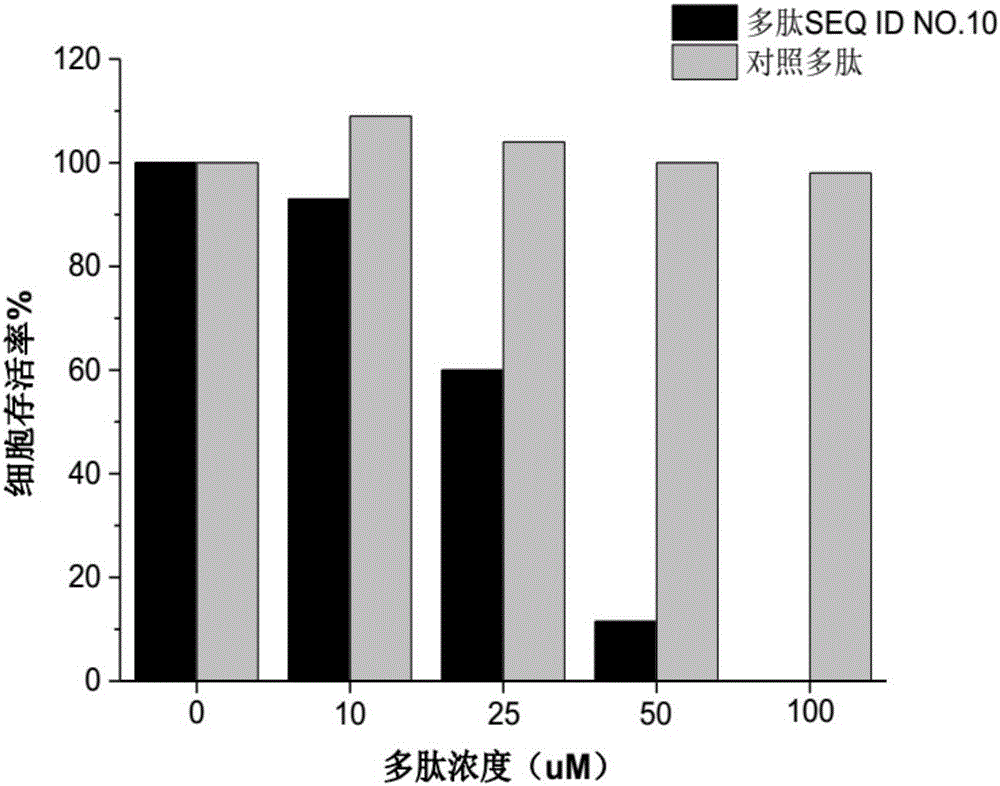
图2示多肽化合物SEQ ID NO.10对肿瘤细胞活性的抑制作用。
具体实施方式
本发明公开了一种多肽及其应用和药物组合物,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明提供的多肽及其应用和药物组合物中所用氨基酸原料或药物均可由市场购得。其中部分试剂名称与缩写的对应如下:
DMF:N,N-二甲基甲酰胺;
DCM:二氯甲烷;
DIC:N,N-二异丙基碳二亚胺;
HOBt:1-羟基苯并三氮唑;
PIP:哌啶;
Boc:叔丁氧羰基;
Pbf:2,2,4,6,7-五甲基苯并呋喃-5-磺酰基;
tBu:叔丁基;
Acm:乙酰氨甲基。
下面结合实施例,进一步阐述本发明:
实施例1线性多肽化合物的合成
WDR5的抑制剂SEQ ID NO:2的氨基酸序列为:Ac-Ala-Arg-Thr-Asp-Pro-Ala-Met-His-Trp-Ser-Arg采用Fmoc固相合成法按下列步骤合成。具体步骤如下:
称取714mg替代度为0.28mmol/g的Rink Amide-MBHA树脂于固相反应器中,加入DCM溶胀30min,随后加入20%PIP/DMF溶液脱保护2次,分别反应5min和20min。分别用DCM与DMF洗涤多次,抽干。向固相反应器中加入Fmoc-Arg(Pbf)-OH(649mg,1mmol),HOBt(135mg,1mmol),DIC(126mg,1mmol),DMF(6mL),室温反应2h。将树脂洗涤抽干,即得Fmoc-Arg(Pbf)-Rink Amide-MBHA树脂。偶联完成后使用Kaiser测试检测,检测通过后进行下一步反应。加入20%PIP/DMF溶液反应分别为5+20min脱除Fmoc保护基,分别用DCM,与DMF洗涤3次,得NH2-Arg(Pbf)-Rink Amide-MBHA树脂。
向固相反应器中加入Fmoc-Ser(tBu)-OH(383mg,1mmol),HOBt(135mg,1mmol),DIC(126mg,1mmol),DMF(6mL),室温反应2h。偶联完成后使用Kaiser测试检测,检测通过后进行下一步反应。将树脂洗涤抽干,即得Fmoc-Ser(tBu)-Arg(Pbf)-Rink Amide-MBHA树脂。以此方法依次偶联剩余的氨基酸,得到侧链全保护多肽树脂。
于固相反应器中加入醋酐:DIEA:DCM(1:1:1)的混合溶液6mL。反应30分钟。分别用DCM与DMF洗涤多次,抽干。
向固相反应器中加入冷冻的8mL裂解液(体积比为三氟乙酸:苯硫醚:水=95:2.5:2.5),室温反应2h。裂解反应结束,过滤树脂,二氯甲烷洗涤树脂,合并滤液和洗液,旋蒸浓缩。加入10mL冷冻的乙醚溶液,析出白色沉淀,离心后收集白色固体,真空干燥得粗肽175mg。粗肽使用制备型HPLC纯化,将制备得到的液体冷冻干燥得到目标化合物MS(m/z):1368.6346[M+H]+。
本实施例中WDR5蛋白线性多肽抑制剂的氨基酸序列如表1所示,除SEQ ID NO:2以外的序列按照上述方法合成。
表1 WDR5蛋白线性多肽抑制剂的氨基酸序列
实施例2环状多肽化合物的合成
WDR5的环肽抑制剂SEQ ID NO:13的氨基酸序列为:Cyclo(Cys-Arg-Thr-Ala-Pro-Met-Pro-His-Cys)采用Fmoc固相合成法按下列步骤合成。
称取714mg替代度为0.28mmol/g的Rink Amide-MBHA树脂于固相反应器中,加入DCM溶胀30min,随后加入20%PIP/DMF溶液脱保护2次,分别反应5min和20min。分别用DCM与DMF洗涤多次,抽干。向固相反应器中加入Fmoc-Cys(Acm)-OH(414mg,1mmol),HOBt(135mg,1mmol),DIC(126mg,1mmol),DMF(6mL),室温反应2h。将树脂洗涤抽干,即得Fmoc-Cys(Acm)-Rink Amide-MBHA树脂。偶联完成后使用Kaiser测试检测,检测通过后进行下一步反应。
加入20%PIP/DMF溶液反应5+20min脱除Fmoc保护基,分别用DCM,与DMF洗涤3次,得NH2-Cys(Acm)Rink Amide-MBHA树脂。以此方法依次偶联剩余的氨基酸,得到侧链全保护多肽树脂。
向固相反应器中加入DMF(2mL),碘粒(506mg,2mmol)的DMF/H2O4:1(3mL)溶液,室温反应40min。分别用DMF洗涤三次,2%的抗化血酸的DMF溶液洗涤两次,DCM与DMF洗涤多次,抽干。
向固相反应器中加入冷冻的8mL裂解液(体积比为三氟乙酸:苯硫醚:水=95:2.5:2.5),室温反应2h。裂解反应结束,过滤树脂,二氯甲烷洗涤树脂,合并滤液和洗液,旋蒸浓缩。加入冷冻的乙醚溶液,析出白色沉淀,离心后收集白色固体,冷冻干燥得粗肽。
粗肽使用制备型HPLC纯化,将制备得到的液体冷冻干燥得到目标化合物MS(m/z):1012.4082[M+H]+。
WDR5蛋白环状多肽抑制剂的氨基酸序列如表2所示,除SEQ IDNO:13序列外的序列按照上述方法合成。
表2 WDR5蛋白环状多肽抑制剂的氨基酸序列
实施例3生物学活性
1.活性测试——荧光偏振竞争实验
荧光极化实验使用黑色96孔板(Greiner,Sigma),荧光极化值在微孔板检测器上检测。实验中,先加入稀释于PBS缓冲溶液中的500nM FITC标记的来源于MLL3win片段的多肽(荧光探针)和不同浓度的WDR5蛋白(1nM-10μM),荧光探针与蛋白结合之后,使总体积为100μL。铝箔纸封好后,室温避光条件下孵育3小时。荧光偏振竞争实验检测多肽分子与WDR5蛋白的结合能力时,使用500nM FITC标记的来源于MLL3的探针分子与500nM的WDR5蛋白结合后与不同浓度的抑制剂多肽分子混合。活性数据用IC50表示。IC50定义为能够50%竞争掉荧光探针分子与WDR5蛋白结合时所需要的多肽分子浓度。结果见表3。
表3 本发明多肽分子的活性
由表3可知,SEQ ID NO:1~20所示线性多肽和环肽包含了保守的RT序列。其中一些多肽可以在纳摩尔至较低的微摩尔级别的浓度下抑制WDR5和MLL1蛋白的结合,具备潜在的生物医药开发价值。
2.甲基转移酶活性实验
甲基转移酶活性实验可测试抑制剂多肽对MLL1蛋白复合物甲基转移酶活性的影响。挑选本申请中有代表性的数条抑制剂多肽进一步在该实验中进行了测试。实验中,7μg的MLL蛋白复合物(MLL1,WDR5,RbBP5,Ash2L)与250μMS-腺苷基甲硫氨酸(S-adenosylmethionine,SAM)以及10μM的组蛋白H3多肽(N端1-20氨基酸),不同浓度的抑制剂多肽(0-1mM)在15℃的缓冲液(50mM Tris-HCl(pH 9.0),200mM NaCl,3mM DTT,1μM氯化锌,5%甘油,pH 9.0)中孵育。反应12小时后,用0.5%的三氟乙酸溶液终止。终止后的混合溶液用α-氰基-4-羟基肉桂酸(α-Cyano-4-hydroxycinnamic acid,CHCA)稀释至四分之一。使用MALDI-TOF质谱(Bruker AutoFlex mass spectrometer)检测终止液的分子量。不同多肽的甲基转移酶活性实验结果见图1。图1表示不同化合物对MLL复合物甲基化转移酶的抑制百分比。
由图1可知,SEQ ID NO:3、SEQ ID NO:5、SEQ ID NO:7、SEQ ID NO:8、SEQ ID NO:13都具有较好的抑制蛋白复合物甲基化的活性,说明了这些抑制剂多肽可以抑制MLL1复合物的酶活性,所得结果与荧光偏振竞争实验一致。
3.肿瘤细胞活性实验
本实验选择与MLL1蛋白活性密切相关的急性淋巴细胞白血病细胞系RS4;11进行肿瘤细胞的活性实验。实验中,RS4;11细胞以每孔5000个布板于96孔板,后加入不同浓度的抑制剂多肽(SEQ ID NO:10)。于37℃、5%CO2浓度下培养96小时,取出并加入进行测试。实验结果如图2所示。
图2的实验结果显示,多肽SEQ ID NO.10在25μM的浓度下即可抑制肿瘤细胞的活性。说明抑制剂多肽SEQ ID NO.10具有潜在的抑制肿瘤生长的作用。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!