一株脱除钙离子和镁离子的拟胶质菌及其用途的制作方法
本发明涉及微生物领域,具体涉及一株脱除钙离子和镁离子的拟胶质菌及其用途。
背景技术:
近年来,各种工业废水和生活废水处理问题已成为人们非常关注的焦点,而去除废水中的金属离子(如钙离子、镁离子)又是其中的一个研究热点。目前,脱除工业废水中的钙离子和镁离子一般采用传统的三联箱工艺:中和、絮凝和沉降。中和为先将pH值调至11左右,再加入有机硫、絮凝剂等,就可以将钙离子和镁离子沉淀下来,这种方法存在的主要问题是Mg(OH)2可以絮凝,但是很难沉降,无法像CaCO3一样变成固体,而且成本比较高,大概为50-60元/吨污水。此外,还可以在工业废水中加入可溶性磷酸盐引入磷酸根,产生磷酸钙、磷酸铵镁的晶型沉淀,这个方法对pH值的要求较为严格,且试剂价格昂贵。因此,寻找一种沉降效果好、处理成本低的废水净化可行技术以及经济合理、效果显著的净化工艺势在必行。
微生物沉降钙离子、镁离子形成碳酸盐矿物的现象在自然界广泛存在,许多研究人员应用各种微生物进行了钙镁离子成矿研究,如在实验室中采用蓝细菌沉降钙离子诱导出了方解石和文石。若能使用微生物对含镁离子和/或钙离子的废水进行处理使之矿化生成镁或钙的碳酸盐矿物,则既处理了废水,同时也实现废物利用,满足了人们对于碳酸盐矿物的需求。
拟胶质菌(Mucilaginibacter gossypii)一般由于能够预防病虫害、促进作物生长,在农业生产上有广泛的应用前景。若能将拟胶质菌制作成水处理剂来脱除钙离子和镁离子从而达到治理水环境污染的目的,将会节约大量的人力、财力和物力,同时还是一种绿色环保无污染的新方法。
技术实现要素:
本发明所要解决的技术问题是如何脱除水中的钙离子和镁离子。
为解决上述技术问题,本发明提供了一株可以脱除钙离子和镁离子的细菌。
本发明所提供的细菌是拟胶质菌(Mucilaginibacter gossypii)HFF1,该菌株已于2016年06月27日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为CGMCC No.12708。拟胶质菌(Mucilaginibacter gossypii)HFF1CGMCC No.12708简称拟胶质菌HFF1。
本发明还提供一种菌剂,该菌剂的活性成分为拟胶质菌HFF1。
所述菌剂的用途可为下述a1)、a2)、a3)或a4):a1)脱除钙离子和/或镁离子;a2)脱除水中钙离子和/或镁离子;a3)沉降钙离子和/或镁离子;a4)沉降水中钙离子和/或镁离子。
所述菌剂的制备方法包括如下步骤:将拟胶质菌HFF1接种至细菌培养基并进行培养,获得OD600nm值为0.85的菌液,即为所述菌剂。
所述细菌培养基可为液体纯化培养基。所述液体纯化培养基的制备方法具体可如下:将牛肉膏5g、胰蛋白胨10g和氯化钠5g溶于1L蒸馏水,调节pH值至7.2。
所述菌剂的制备方法中,所述培养的具体条件具体可为:37℃、130r/min振荡培养1d。
除了活性成分,所述菌剂还可以包括载体。所述载体可为固体载体或液体载体。所述固体载体可为矿物材料、植物材料或高分子化合物;所述矿物材料可为粘土、滑石、高岭土、蒙脱石、白碳、沸石、硅石和硅藻土中的至少一种;所述植物材料可为玉米粉、豆粉和淀粉中的至少一种;所述高分子化合物可为聚乙烯醇和/或聚二醇。所述液体载体可为有机溶剂、植物油、矿物油或水;所述有机溶剂可为癸烷和/或十二烷。所述菌剂中,所述活性成分可以以被培养的活细胞、活细胞的发酵液、细胞培养物的滤液或细胞与滤液的混合物的形式存在。所述组合物的剂型可为多种剂型,如液剂、乳剂、悬浮剂、粉剂、颗粒剂、可湿性粉剂或水分散粒剂。
根据需要,所述菌剂中还可添加表面活性剂(如吐温20、吐温80等)、粘合剂、稳定剂(如抗氧化剂)、pH调节剂等。
拟胶质菌HFF1或上述任一所述菌剂在脱除钙离子和/或镁离子中的应用也属于本发明的保护范围。
拟胶质菌HFF1或上述任一所述菌剂在脱除水中钙离子和/或镁离子中的应用也属于本发明的保护范围。
拟胶质菌HFF1或上述任一所述菌剂在沉降钙离子和/或镁离子中的应用也属于本发明的保护范围。
拟胶质菌HFF1或上述任一所述菌剂在沉降水中钙离子和/或镁离子中的应用也属于本发明的保护范围。
上述应用中,所述水可为含有钙离子和/或镁离子的硬水。
上述应用中,所述水可为生活废水或工业废水。
上述应用中,所述钙离子的存在形式可为Ca2+。
上述应用中,所述镁离子的存在形式可为Mg2+。
上述应用中,所述含有钙离子和/或镁离子的硬水可为含有0.005~0.015mol/L Ca2+和0.02~0.20mol/L Mg2+的水。
上述应用中,所述含有钙离子和/或镁离子的硬水具体可为含有0.01mol/L Ca2+和0.03~0.12mol/L Mg2+的水。所述含有钙离子和/或镁离子的硬水可为含有0.01mol/L Ca2+和0.03mol/L Mg2+的水。所述含有钙离子和/或镁离子的硬水具体可为含有0.01mol/L Ca2+和0.06mol/L Mg2+的水。所述含有钙离子和/或镁离子的硬水具体可为含有0.01mol/L Ca2+和0.09mol/L Mg2+的水。所述含有钙离子和/或镁离子的硬水具体可为含有0.01mol/L Ca2+和0.12mol/L Mg2+的水。
本发明还提供了一种获得方解石和/或球霰石的方法。
本发明所提供的获得方解石和/或球霰石的方法,包括如下步骤:向含有0.005~0.015mol/L Ca2+的液相体系中加入拟胶质菌HFF1。
本发明还提供了一种获得三水菱镁矿的方法。
本发明所提供的获得三水菱镁矿的方法,包括如下步骤:向含有0.02~0.20mol/L Mg2+的液相体系中加入拟胶质菌HFF1。
所述获得方解石和/或球霰石的方法,或,所述获得三水菱镁矿的方法中,还包括加入拟胶质菌HFF1后进行培养的步骤。
所述获得方解石和/或球霰石的方法,或,所述获得三水菱镁矿的方法中,所述培养的条件可为35℃~39℃、110~150r/min培养10~20d。
所述获得方解石和/或球霰石的方法,或,所述获得三水菱镁矿的方法中,所述培养的条件具体可为37℃、130r/min培养13d。
上文中,所述含有0.005~0.015mol/L Ca2+的液相体系、或、所述含有0.02~0.20mol/L Mg2+的液相体系中均可含有碳酸根离子和/或碳酸氢根离子。
所述碳酸根离子在上述任一所述液相体系中的浓度可为0.01~0.06mol/L。
所述碳酸根离子在上述任一所述液相体系中的浓度具体可为0.04mol/L。
所述碳酸氢根离子在上述任一所述液相体系中的浓度可为0.01~0.06mol/L。
所述碳酸氢根离子在上述任一所述液相体系中的浓度具体可为0.03mol/L。
上文中,所述含有0.005~0.015mol/L Ca2+的液相体系具体可为含有0.01mol/L Ca2+的液相体系。
上文中,所述含有0.02~0.20mol/L Mg2+的液相体系可为含有0.03~0.12mol/L Mg2+的液相体系。所述含有0.02~0.20mol/L Mg2+的液相体系具体可为含有0.03mol/L Mg2+的液相体系。所述含有0.02~0.20mol/L Mg2+的液相体系具体可为含有0.06mol/L Mg2+的液相体系。所述含有0.02~0.20mol/L Mg2+的液相体系具体可为含有0.09mol/L Mg2+的液相体系。所述含有0.02~0.20mol/L Mg2+的液相体系具体可为含有0.12mol/L Mg2+的液相体系。
所述含有0.02~0.20mol/L Mg2+的液相体系还可包括0.005~0.015mol/L Ca2+。
所述含有0.02~0.20mol/L Mg2+的液相体系具体还可包括0.01mol/L Ca2+。
实验证明,本发明提供的拟胶质菌HFF1在沉降钙离子和镁离子中起至关重要的作用,在废水处理方面具有广阔的应用前景。
附图说明
图1为拟胶质菌HFF1在高分辨率透射电镜下的形态。
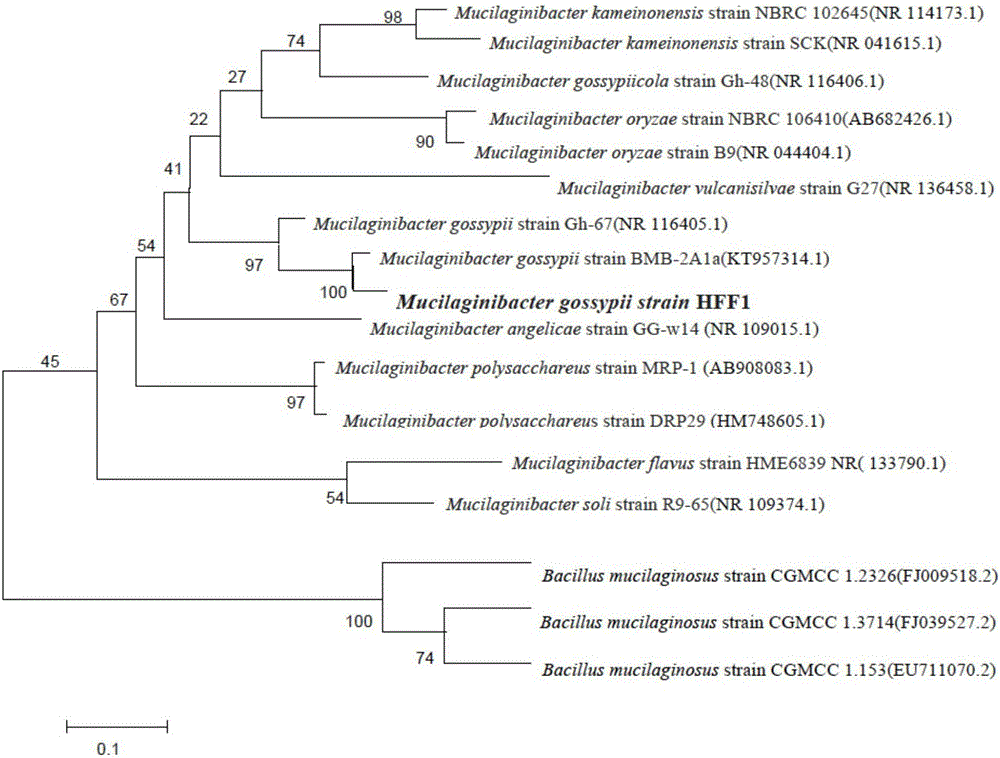
图2为拟胶质菌HFF1的系统发育树图。
图3为不同钙镁浓度的培养基中拟胶质菌HFF1的生长曲线。
图4为不同钙镁浓度的培养基中拟胶质菌HFF1的pH值变化曲线。
图5为矿物沉淀的X射线衍射分析。
图6为对照组在培养基甲中产生的矿物沉淀的扫描电镜图和能谱分析。
图7为对照组在培养基乙中产生的矿物沉淀的扫描电镜图和能谱分析。
图8为对照组在培养基丙中产生的矿物沉淀的扫描电镜图和能谱分析。
图9为对照组在培养基丁中产生的矿物沉淀的扫描电镜图和能谱分析。
图10为对照组在培养基戊中产生的矿物沉淀的扫描电镜图和能谱分析。
图11为实验组在培养基甲中产生的矿物沉淀的扫描电镜图和能谱分析。
图12为实验组在培养基乙中产生的矿物沉淀的扫描电镜图和能谱分析。
图13为实验组在培养基丙中产生的矿物沉淀的扫描电镜图和能谱分析。
图14为实验组在培养基丁中产生的矿物沉淀的扫描电镜图和能谱分析。
图15为实验组在培养基戊中产生的矿物沉淀的扫描电镜图和能谱分析。
保藏说明
菌种名称:拟胶质菌
拉丁名:Mucilaginibacter gossypii
菌株编号:HFF1
保藏机构:中国微生物菌种保藏管理委员会普通微生物中心
保藏机构简称:CGMCC
地址:北京市朝阳区北辰西路1号院3号
保藏日期:2016年06月27日
保藏中心登记入册编号:CGMCC No.12708
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中所用的培养基如下:
富集培养基的溶质及其浓度为K2HPO4 0.5g/L,NH4Cl 1.0g/L,CaCl2 0.1g/L,MgSO4·7H2O 2.0g/L,酵母浸粉1.0g/L,Na2SO4 0.5g/L,Fe(NH4)2(SO4)2 0.5g/L,抗坏血酸0.5g/L,L-Cys 0.5g/L,60%的乳酸钠溶液6mL/L;溶剂为蒸馏水;pH6.0~8.0;其中Fe(NH4)2(SO4)2、抗坏血酸和L-Cys需先用蒸馏水配制成母液,再用0.22μm滤膜过滤除菌,然后用于制备富集培养基;60%的乳酸钠溶液为国药集团化学试剂有限公司产品,产品目录号为30168018。
固体纯化培养基:将牛肉膏5g、胰蛋白胨10g、氯化钠5g和琼脂15g溶于1L蒸馏水,调节pH值至7.2。
液体纯化培养基:将牛肉膏5g、胰蛋白胨10g和氯化钠5g溶于1L蒸馏水,调节pH值至7.2。
基本培养基:将牛肉膏5g、胰蛋白胨10g和NaCl 5g溶于1L蒸馏水,调节pH值至7.2。
培养基甲:向基本培养基中加入1.0mol/L CaCl2水溶液,使体系中的Ca2+浓度为0.01mol/L,得到培养基甲。培养基甲中镁钙离子摩尔比为0。
培养基乙:向培养基甲中加入2.0mol/L的MgCl2水溶液,使体系中的Mg2+浓度为0.03mol/L,得到培养基乙。培养基乙中镁钙离子摩尔比为3:1。
培养基丙:向培养基甲中加入2.0mol/L的MgCl2水溶液,使体系中的Mg2+浓度为0.06mol/L,得到培养基丙。培养基丙中镁钙离子摩尔比为6:1。
培养基丁:向培养基甲中加入2.0mol/L的MgCl2水溶液,使体系中的Mg2+浓度为0.09mol/L,得到培养基丁。培养基丁中镁钙离子摩尔比为9:1。
培养基戊:向培养基甲中加入2.0mol/L的MgCl2水溶液,使体系中的Mg2+浓度为0.12mol/L,得到培养基戊。培养基戊中镁钙离子摩尔比为12:1。
X射线衍射分析使用转靶X射线衍射仪,其为日本理学电器公司产品,产品型号为D/Max-RC。扫描电镜分析使用日本日立公司产品,产品型号为Hitachi S-4800。能谱分析使用美国伊达克斯有限公司产品,产品型号为GENESIS能谱仪。高分辨率透射电镜分析使用日本电子株式会社公司产品,产品型号为JEM-2100。
实施例1、拟胶质菌(Mucilaginibacter gossypii)HFF1CGMCC No.12708的分离、鉴定和保藏
一、硫酸盐还原菌HFF1的分离
1、在100mL无菌蒸馏水中加入10g土壤样品(采自中国青岛墨水河底部的污泥),搅拌均匀,静止放置10min,然后取20mL上清液加入200mL富集培养基中,并用无菌液体石蜡封闭瓶内液面,置于恒温培养箱,37℃静置培养、观察。培养至第7d,富集培养基颜色变黑,可见硫酸盐还原菌富集成功(富集培养基中的Fe(NH4)2(SO4)2中的亚铁离子能与富集培养基中的S2-反应生成黑色的硫化亚铁)。
2、完成步骤1后,取上清液接种至含0.5g/L Fe(NH4)2(SO4)2的固体纯化培养基上,37℃厌氧培养箱中培养、观察。培养至第7d,产生黑色的单菌落。挑取单菌落,反复纯化3次以上。将筛选到的一株硫酸盐还原菌菌株命名为硫酸盐还原菌HFF1。
二、硫酸盐还原菌HFF1的鉴定
1、形态学鉴定
将硫酸盐还原菌HFF1接种到固体纯化培养基上,37℃培养,3d后观察单菌落的形态。结果表明,硫酸盐还原菌HFF1的菌落圆形,表面凸起,分布较为分散,边缘整齐,呈半透明状,表面光滑水润,菌落与固体培养基连接较为松散,培养24h时菌落直径为2-4mm。
硫酸盐还原菌HFF1经染色后,鉴定为革兰氏阳性菌。通过高分辨率透射电镜分析硫酸盐还原菌HFF1,实验结果见图1。结果表明,硫酸盐还原菌HFF1的大小约1.3μm×0.8μm,细菌为短杆形,单独存在。
2、16S rDNA序列同源性分析
硫酸盐还原菌HFF1的16S rDNA如序列表中的序列1所示。
通过Clustal X软件将序列表中的序列1与GenBank中的序列进行比对,采用邻接法(N-J法)构建系统发育树。系统发育树的实验结果见图2。
硫酸盐还原菌HFF1与拟胶质菌(Mucilaginibacter gossypii)同源性最高。
3、生理生化鉴定
参考《常见细菌系统鉴定手册》(东秀珠,蔡妙英.常见细菌系统鉴定手册.北京:科学出版社,2011.)和《微生物学实验》(沈萍,范秀容,李广武.微生物学实验(第三版).北京:高等教育出版社,1999.)测定上述硫酸盐还原菌HFF1的生理生化特征,并和Mucilaginibacter gossypii sp.nov.(记载于如下文献中:Kim,B.C.,Poo,H.,Lee,K.H.,Kim,M.N.,Kwon,O.Y.,&Shin,K.S.(2012).Mucilaginibacter angelicae sp.nov.,isolated from the rhizosphere of Angelica polymorpha Maxim.International journal of systematic and evolutionary microbiology,62(1),55-60.)的生理生化特征进行对比。
所述硫酸盐还原菌HFF1和Mucilaginibacter gossypii sp.nov.的生理生化特征测定结果如表1所示。
表1.生理生化特征测定结果
综合上述各个鉴定结果,硫酸盐还原菌HFF1为拟胶质菌(Mucilaginibacter gossypii)。
三、硫酸盐还原菌HFF1的保藏
拟胶质菌(Mucilaginibacter gossypii)HFF1已于2016年06月27日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称CGMCC,地址为:北京市朝阳区北辰西路1号院3号),保藏编号为CGMCC No.12708。硫酸盐还原菌HFF1的全称为拟胶质菌(Mucilaginibacter gossypii)HFF1CGMCC No.12708,简称为拟胶质菌HFF1或HFF1。
实施例2、制备拟胶质菌HFF1菌剂
将拟胶质菌HFF1在固体纯化培养基上活化,然后挑取单菌落接种于装有100mL液体纯化培养基的250mL锥形瓶中,37℃、130r/min的恒温摇床上培养1d,得到OD600nm值约为0.85的拟胶质菌HFF1菌剂。拟胶质菌HFF1菌剂在下文简称为HFF1菌剂。
实施例3、拟胶质菌HFF1的特性
本实施例研究不同钙镁浓度的培养基中拟胶质菌HFF1的生长曲线和pH值变化曲线。
分别采用培养基(培养基甲、培养基乙、培养基丙、培养基丁或培养基戊)进行如下操作:
取6个250mL的锥形瓶,每个锥形瓶装入200mL培养基,然后121℃高压灭菌20min;待培养基冷却至室温后,将6个锥形瓶分为实验组和对照组,每组3个锥形瓶;向实验组的锥形瓶中接种HFF1菌剂2mL(即接种比例为1:100),向对照组的锥形瓶中接种等体积无菌超纯水;接种完毕后,将锥形瓶置于恒温振荡培养箱,37℃、130r/min培养。接种完毕时取样4mL,然后每3小时取样4mL,测量菌浓度和pH值。
进行三次试验,结果取平均值。
实验组中HFF1的生长曲线见图3。HFF1在各个培养基中的生长过程均包括延滞期(0~6h)、对数期(6~25h)和稳定期(25~50h)三个阶段,其中延滞期为细菌正在适应培养基内的生长环境的阶段,对数期为细菌处于活跃的分裂状态的阶段,稳定期为由于培养基内的营养物质被消耗以及有毒代谢产物的逐渐积累,细菌的生长速率逐渐减慢下来但总生物量仍维持不变的阶段。由于对照组中接种的是无菌超纯水而不是菌液,所以对照组中均无HFF1的生长曲线。
实验组中HFF1的pH值变化曲线见图4。HFF1在各个培养基中的pH值变化均包括上升期、缓慢下降期和缓慢上升期三个阶段,其中上升期的pH值从7.3左右持续上升至8.6左右,缓慢下降期的pH值从8.6左右降至8.4左右,缓慢上升期的pH值从8.4左右持续上升至9.0左右。
实施例4、微生物的矿化培养和矿物沉淀分析
一、微生物的矿化培养
分别采用培养基(培养基甲、培养基乙、培养基丙、培养基丁或培养基戊)进行如下操作:
1、取6个250mL的锥形瓶,每个锥形瓶装入150mL培养基,121℃高压灭菌20min。待培养基冷却至室温后,每个锥形瓶中加入3mL的2mol/L Na2CO3水溶液和5mL的1mol/L NaHCO3水溶液(Na2CO3和NaHCO3溶液用孔径为0.22微米的滤膜过滤除菌后再用),用NaOH调节pH值至7.2。
2、完成步骤1后,将6个锥形瓶分为实验组和对照组,每组3个锥形瓶。向实验组的每个锥形瓶中接种实施例2制备的HFF1菌剂1.5mL(即接种比例为1:100),向对照组的每个锥形瓶中接种1.5mL的无菌超纯水。接种完毕后,将所有锥形瓶置于恒温振荡培养箱,37℃、130r/min培养13d。
二、矿物沉淀分析
1、X射线衍射(X-ray diffraction,XRD)分析
(1)取步骤一中培养13d的培养基的底部沉淀,置于1.5mL离心管,静置5min,弃上清液,得到沉淀1。
(2)向盛有沉淀1的离心管中加入1mL的蒸馏水进行洗涤,静置5min,弃上清,得到沉淀2。
(3)向盛有沉淀2的离心管中加入1mL的蒸馏水进行洗涤,静置5min,弃上清,得到沉淀3。
(4)向盛有沉淀3的离心管中加入1mL的蒸馏水进行洗涤,静置5min,弃上清,得到沉淀4。
进行上述步骤(2)-(4)的目的为除去各种盐离子。将沉淀自然干燥后进行XRD分析。XRD扫描角度为10°-90°,步长为0.02,扫描速度8°/min。
实验结果见图5(a为对照组,b为实验组,其中Mg/Ca=0、Mg/Ca=3、Mg/Ca=6、Mg/Ca=9和Mg/Ca=12分别代表培养基甲、培养基乙、培养基丙、培养基丁和培养基戊中的矿物沉淀,1为方解石,2为球霰石,3为三水菱镁矿)和表2。结果表明,拟胶质菌HFF1与产生三水菱镁矿矿物沉淀有密切联系。在实验组中,培养基甲产生的矿物沉淀中,有方解石对应的衍射峰,同时还有3个球霰石对应的衍射峰,所以培养基甲中生成的矿物为方解石和球霰石;培养基乙、培养基丙、培养基丁和培养基戊产生的矿物沉淀中,均有三水菱镁矿的衍射峰,所以培养基乙、培养基丙、培养基丁或培养基戊中生成的矿物为三水菱镁矿。在对照组中,培养基甲产生的矿物沉淀中,有方解石对应的衍射峰,同时还有3个球霰石对应的衍射峰,所以培养基甲中生成的矿物为方解石和球霰石;培养基乙、培养基丙、培养基丁和培养基戊产生的矿物沉淀中,均有方解石的衍射峰,所以培养基乙、培养基丙、培养基丁或培养基戊中生成的矿物为方解石。
对照组和实验组中生成矿物的种类有很大差异,说明在拟胶质菌HFF1的作用下碳酸盐的种类和形貌均发生了明显的变化。
表2.XRD分析矿物沉淀
2、矿物沉淀的扫描电镜和能谱分析
(1)取步骤一中培养13d的培养基的底部沉淀,置于1.5mL离心管,静置5min,弃上清液,得到沉淀1。
(2)向盛有沉淀1的离心管中加入1mL的蒸馏水进行洗涤,静置5min,弃上清,得到沉淀2。
(3)向盛有沉淀2的离心管中加入1mL的蒸馏水进行洗涤,静置5min,弃上清,得到沉淀3。
(4)向盛有沉淀3的离心管中加入1mL的蒸馏水进行洗涤,静置5min,弃上清,得到沉淀4。
进行上述步骤(2)-(4)的目的为除去各种盐离子。向盛有沉淀4的离心管中加入100μL的无水乙醇进行悬浮,得到样品。取部分样品置于载物台上,自然干燥后喷金,置于扫描电镜下观察,然后进行能谱分析。
图6为对照组在培养基甲中产生的矿物沉淀的扫描电镜图和能谱分析,实验结果如下:(1)A显示矿物的形貌是菱面体;(2)将A中方框选中的区域进一步放大,得到B,由图可知,A所示的矿物表面是由大小为50nm的小颗粒紧密排列在一起形成的;(3)C显示矿物的形貌是球体;(4)将C中方框选中的区域进一步放大,得到D,由图可知,C所示的矿物表面是由许多大小不一的小球靠在一起形成的不规则形貌,比较疏松;(5)将A中方框选中的区域进行能谱分析,实验结果见E,结果表明,A所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。(6)将C中方框选中的区域进行能谱分析,实验结果见F,结果表明,C所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
图7为对照组在培养基乙中产生的矿物沉淀的扫描电镜图和能谱分析,A和C显示矿物沉淀的形态,将A中方框选中的区域进一步放大得到B,将C中方框选中的区域进一步放大得到D。实验结果如下:
(1)矿物的形貌主要是圆球状和菱面体,还有两个球状对在一起的哑铃状、三个球状对在一起的三叶草状、四个球状对在一起的花菜状,且表面粗糙;矿物表面是由许多个不规则的小颗粒或许多个小球紧密的堆叠在一起形成的;矿物上附着着大量的菌体,菌体死亡后呈现中空的自身矿化的状态。
(2)将A中方框选中的区域进行能谱分析,实验结果见E,结果表明,A所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
(3)将C中方框选中的区域进行能谱分析,实验结果见F,结果表明,C所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Pt元素,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
图8为对照组在培养基丙中产生的矿物沉淀的扫描电镜图和能谱分析,A、B、C和D显示矿物沉淀的形态。实验结果如下:
(1)矿物的形貌与对照组在培养基乙中产生的矿物形貌相似:矿物的形貌主要是圆球状,还有两个球状对在一起的哑铃状、三个球状对在一起的三叶草状、四个球状对在一起的花菜状,且表面粗糙。
(2)将A中方框选中的区域进行能谱分析,实验结果见E,结果表明,A所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Mg元素、Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Mg元素可能来源于培养液中的MgCl2。这一实验结果与X射线衍射结果完全一致。
(3)将B中方框选中的区域进行能谱分析,实验结果见F,结果表明,B所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Mg元素、Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Mg元素可能来源于培养液中的MgCl2。这一实验结果与X射线衍射结果完全一致。
图9为对照组在培养基丁中产生的矿物沉淀的扫描电镜图和能谱分析,A和C显示矿物沉淀的形态,将A中方框选中的区域进一步放大得到B,将C中方框选中的区域进一步放大得到D。实验结果如下:
(1)矿物的形貌与对照组在培养基乙中产生的矿物形貌相似:矿物的形貌主要是两个球状对在一起的哑铃状且表面粗糙;矿物表面是由许多个不规则的小颗粒或许多个小球紧密的堆叠在一起形成的。
(2)将A中粗线方框选中的区域进行能谱分析,实验结果见E,结果表明,A中粗线方框选中的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Mg元素、Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Mg元素可能来源于培养液中的MgCl2。这一实验结果与X射线衍射结果完全一致。
(3)将A中细线方框选中的区域进行能谱分析,实验结果见F,结果表明,A中细线方框选中的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Mg元素、大量的Al元素和少量的Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Mg元素可能来源于培养液中的MgCl2。这一实验结果与X射线衍射结果完全一致。
图10为对照组在培养基戊中产生的矿物沉淀的扫描电镜图和能谱分析,A和D显示矿物沉淀的形态,将A中粗线方框选中的区域进一步放大得到B,将A中细线方框选中的区域进一步放大得到C。实验结果如下:
(1)A显示矿物的形貌是圆球状、两个球状对在一起的哑铃状;
(2)B图表明,A所示的矿物表面是中空的,可能是矿物上附着着大量的菌体,菌体死亡后呈现中空的自身矿化的状态;
(3)C图表明矿物表面由不规则矿物颗粒组成;
(4)D图中矿物是由许多不规则的层片状结构堆积而成的。
(5)将A中粗线方框选中的区域进行能谱分析,实验结果见E,结果表明,A所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Mg元素、Na元素、Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Na元素可能来源于培养液中的NaCl,Mg元素可能来源于培养液中的MgCl2。这一实验结果与X射线衍射结果完全一致。
(6)将D中方框选中的区域进行能谱分析,实验结果见F,结果表明,D所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Mg元素、Na元素、Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Na元素可能来源于培养液中的NaCl,Mg元素可能来源于培养液中的MgCl2。这一实验结果与X射线衍射结果完全一致。
图11为实验组在培养基甲中产生的矿物沉淀的扫描电镜图和能谱分析,A和C显示矿物沉淀的形态,将A中方框选中的区域进一步放大得到B,将C中方框选中的区域进一步放大得到D,实验结果如下:
(1)矿物沉淀的形态为球状和哑铃状,表面比较粗糙且含有大量的孔隙,矿物由许多纳米级颗粒状矿物组成,矿物上附着有大量的包裹有致密碳酸钙层的杆状菌体。
(2)将A中方框选中的区域进行能谱分析,实验结果见E,结果表明,A所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
(3)将C中方框选中的区域进行能谱分析,实验结果见F,结果表明,C所示的矿物主要含有C、O和Ca这三种元素,说明形成的矿物为CaCO3;此外还含有少量的Mg元素、Na元素、Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Na元素可能来源于培养液中的NaCl,Mg元素可能来源于培养液中的MgCl2。这一实验结果与X射线衍射结果完全一致。与对照组相比,在培养基甲中,拟胶质菌HFF1可诱导矿物沉淀的生成,且形成的矿物沉淀的体积明显增大,拟胶质菌HFF1自身会发生矿化。
图12为实验组在培养基乙中产生的矿物沉淀的扫描电镜图和能谱分析,A、B、C、D和E显示矿物沉淀的形态。实验结果如下:
(1)矿物的形貌大多数是长杆状,形状比较规则,表面比较粗糙;还有少量矿物的形貌是球状的,两个球状对在一起形成类似哑铃状,矿物上附着大量的菌体。矿物表面存在较多明显的0.2~0.4μm的印痕,推测是菌体冲洗后遗留下来的,说明菌体参与了矿物晶格的形成。
(2)将A中方框选中的区域进行能谱分析,实验结果见F,结果表明,A所示的矿物主要含有C、O和Mg这三种元素,说明形成的矿物为MgCO3;此外还含有Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
图13为实验组在培养基丙中产生的矿物沉淀的扫描电镜图和能谱分析,A、B、C、D显示矿物沉淀的形态。实验结果如下:
(1)矿物的形貌和实验组在培养基乙中产生的矿物沉淀的形貌基本一致。
(2)将A中细线方框选中的区域进行能谱分析,实验结果见E,结果表明,细线方框选中的矿物主要含有C、O和Mg这三种元素,说明形成的矿物为MgCO3;此外还含有Al元素、Pt元素、Na元素和Ca元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理;Na元素可能来源于培养液中的NaCl,Ca元素可能来源于培养液中的CaCl2。这一实验结果与X射线衍射结果完全一致。
(3)将A中粗线方框选中的区域进行能谱分析,实验结果见F,结果表明,粗线方框选中的矿物主要含有C、O和Mg这三种元素,说明形成的矿物为MgCO3;此外还含有少量的Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
图14为实验组在培养基丁中产生的矿物沉淀的扫描电镜图和能谱分析,A、B和C显示矿物沉淀的形态。实验结果如下:
(1)矿物的形貌和实验组在培养基乙中产生的矿物沉淀的形貌基本一致。
(2)将B中方框选中的区域进行能谱分析,实验结果见D,结果表明,B所示的矿物主要含有C、O和Mg这三种元素,说明形成的矿物为MgCO3;此外还含有Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
图15为实验组在培养基戊中产生的矿物沉淀的扫描电镜图和能谱分析,A、B、C和D显示矿物沉淀的形态。实验结果如下:
(1)矿物的形貌和实验组在培养基乙中产生的矿物沉淀的形貌基本一致。
(2)将A中方框选中的区域进行能谱分析,实验结果见E,结果表明,A所示的矿物主要含有C、O和Mg这三种元素,说明形成的矿物为MgCO3;此外还含有少量的Al元素和Pt元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理。这一实验结果与X射线衍射结果完全一致。
(3)将B中方框选中的区域进行能谱分析,实验结果见F,结果表明,B所示的矿物主要含有C、O和Mg这三种元素,说明形成的矿物为MgCO3;此外还含有Al元素、Pt元素和Ca元素,Al元素来源于载物台,因为扫描电镜的载物台是铝制的,Pt元素是因为做扫描电镜之前要对样品进行喷铂金处理,Ca元素可能来源于培养液中的CaCl2。这一实验结果与X射线衍射结果完全一致。
- 还没有人留言评论。精彩留言会获得点赞!