一类喹吖啶酮衍生物及其制备方法与应用与流程
本发属于新材料技术领域,具体涉及一类喹吖啶酮衍生物及其制备方法及其应用。
(二)
背景技术:
有机荧光材料被广泛应用于光学电子器件、DNA诊断、光化学传感器、染料、荧光增白剂、荧光涂料、激光染料、有机电致发光器件(OELD)等领域。与传统的无机材料相比,有机非线性光学材料具有优异的光学性能、原料获取广泛、制备低成本、良好的可加工性等无可比拟的优势,引起了很多人的关注,具有很大的潜在实用价值。
喹吖啶酮,因其分子中苯环、羰基和sp2杂化氮原子共同存在,整个分子呈现出具有高度共轭的大π键的平面结构,这作为非线性光学材料是十分有利的。其次,共轭的大π键和平面刚性结构造成分子间存在强的π-π相互作用,使得该分子具有稳定的物理性质,为其作为一种潜在的荧光材料创造了条件。另一方面,喹吖啶酮分子具有多个活性位点,可以通过N烷基化引入合适的烷烃链增加其在常见溶剂中的溶解性。采用给电性基团或吸电性基团对喹吖啶酮母体结构进行修饰,延长p-π共轭体系使其衍生物呈现出推-拉型结构易发生分子内电子转移,从而使目标化合物表现出理想的性质。喹吖啶酮本身是一类荧光性物质,对分子结构进行特定的修饰可以在一定发射波长范围内调节其最大发射波长,使其显示如橙色、红色、亮黄色等不同颜色的荧光。基于喹吖啶酮其独特的电化学和光学特性,以及在光电信息、通讯和集成光学等高技术领域的潜在应用价值,已经引起了研究者的广泛兴趣,并迅速成为功能材料研究领域的一个热点。
(三)
技术实现要素:
本发明的目的是提供一类喹吖啶酮衍生物,是一类光学性能优异、稳定性好的有机荧光材料。本发明以喹吖啶酮作为共轭单元,对其结构进行修饰得到了一类在可 450-700nm范围内具特定吸收的喹吖啶酮衍生物。
本发明采用的技术方案是:
本发明提供一类式(Ⅰ)所示吖啶酮衍生物:
式(I)中:R1为卤素、取代苯乙烯基或取代苯乙炔基;R2为C4‐C12的直链或支链烷基;R3为氧或二氰基乙烯基。所述取代苯乙烯基或取代苯乙炔基芳环上的取代基为一个或多个,取代基选自下列之一:硝基、卤素、羟基、C1-C12的直链或支链烷基、C1-C12的直链或支链烷氧基和氨基。
本发明的第二个目的是提供一种制备上述喹吖啶酮衍生物(式Ⅰ所示化合物)的方法,所述制备方法包括如下步骤:
(1)N烷基化反应
在碱A和相转移催化剂的存在下,式(II)所示的喹吖啶酮与卤代烷烃在溶剂A中,于10-30℃下发生N烷基化反应得到如式(III)所示化合物;
其中,R2为C4-C12的直链或支链烷基;
(2)溴化反应
式(III)所示化合物加入溶剂B中,于50-100℃下、氮气保护下,与溴化剂NBS反应24小时,得到式(IV)所示的喹吖啶酮衍生物;
式(III)或式(IV)中,R2为C4-C12的直链或支链烷基;
(3)偶联反应
在碱B和钯催化剂的存在下,氮气氛中,式(IV)所示的化合物与式(V)所示的苯乙烯衍生物或式(VI)所示的苯乙炔衍生物于为80-120℃发生偶联反应,得到式(VII)所示的喹吖啶酮衍生物;
其中,R1为卤素、取代苯乙烯基或取代苯乙炔基;R2为C4-C12的直链或支链烷基;R4为氢、卤素或甲氧基;反应式如下:
(4)缩合反应
将式(VII)所示的喹吖啶酮衍生物加入吡啶中,在钛催化剂存在下与丙二氰进行Knoevenagel缩合反应,得到式(VIII)所示的喹吖啶酮衍生物
式中,R1为卤素、取代苯乙烯基、取代苯乙炔基;R2为C4-C12的直链或支链烷基。
作为优选,步骤(1)中所述溶剂A为四氢呋喃、N,N’-二甲基甲酰胺、N,N’-二甲基乙酰胺、二甲基亚砜、甲苯或1,4-二氧六环,碱A为氢氧化钠、氢氧化钾或碳酸铯,所述溶剂A、碱A与式(II)所示喹吖啶酮的摩尔比为10-30:2-30:1,式(II)所示的喹吖啶酮与C4-C9的卤代烷烃的摩尔比为2-4:1。
作为优选,步骤(1)中所述相转移催化剂为四丁基氯化铵、四丁基溴化铵、四丁基氟化铵或四丁基碘化铵,所述相转移催化剂的质量为式(II)所示喹吖啶酮质量的0.1-0.3倍。
作为优选,步骤(2)中所述溶剂B为氯仿、四氯化碳、N,N’-二甲基甲酰胺、N,N’-二甲基乙酰胺或1,4-二氧六环,所述式(III)所示化合物、溶剂B和溴化剂NBS质量的1:10-30:2-5。
作为优选,步骤(3)中所述溶剂C为N,N’-二甲基甲酰胺、N,N’-二甲基乙酰胺、甲苯或1,4-二氧六环;碱B为碳酸钠、碳酸钾、三乙胺或碳酸铯;催化剂为四三苯基膦钯或醋酸钯;所述式(IV)所示的化合物、溶剂C、碱B和催化剂的质量比为1:10-30:2-30:0.1-0.5。
作为优选,步骤(4)中所述钛催化剂为四氯化钛、四溴化钛或四碘化钛,所述式(VII)所示化合物、吡啶和钛催化剂的质量比为1:10-50:2-10。
本发明的第三个目的为提供所述喹吖啶酮衍生物在荧光材料中的应用。
本发明的有益效果:
本发明以喹吖啶酮作为共轭单元,对其结构进行修饰,得到了一类在可450-700nm范围内具特定吸收的喹吖啶酮衍生物,所得喹吖啶酮衍生物光学性能优异、稳定性好,能应用于荧光材料领域。
(四)附图说明
图1为实施例1-4中制备的喹吖啶酮衍生物在二氯甲烷中的紫外-可见吸收谱图。
图2为实施例1-4中制备的喹吖啶酮衍生物在二氯甲烷中的荧光光谱图。
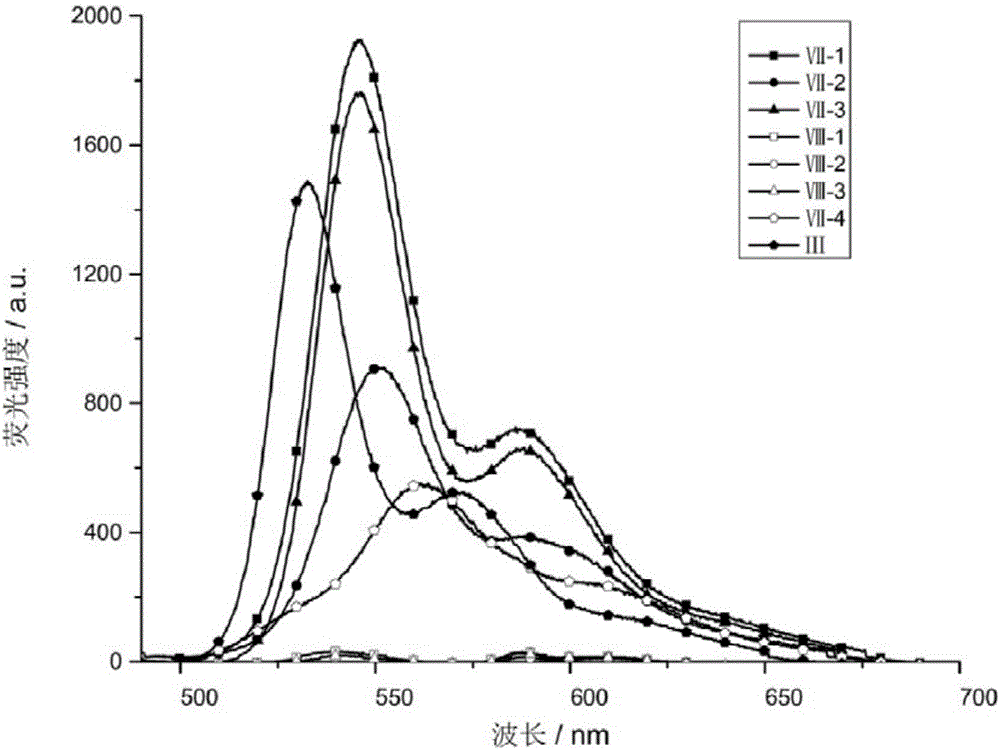
图3为实施例中1-4制备的喹吖啶酮衍生物在二氯甲烷中添加了四丁基溴化铵并放置了24h的荧光光谱图。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1
(1)N烷基化反应
向100mL单口烧瓶中,加入喹吖啶酮(1.5616g,5mmol),四丁基溴化铵(TBAB)(0.323mg,1mmol),碳酸铯(0.326,10mol)和30mL的二甲基亚砜(DMSO)作为溶剂。常温(25℃左右)搅拌4h后,加入1-溴代辛烷(3.863g,20mmol),TLC跟踪监测,直至喹吖啶酮消失即反应完全。停止反应,将反应液倒入饱和食盐水中析出固体,抽滤,滤饼洗涤后溶于二氯甲烷,过滤除去未反应原料,滤液减压蒸馏除去溶剂,粗产品上硅胶柱提纯,得到红色固体式(Ⅲ)所示化合物,产率约为85%(以化合物的物质的量计)。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m,4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H).
(2)溴化反应:
向50mL的Schlenk管中加入式(Ⅲ)所示化合物(1.0735g,2mmol)和N-溴代丁二酰亚胺(0.30g,7mmol),在氮气保护的条件下注入10mL N,N’-二甲基甲酰胺,并在90℃下避光反应24h。待反应液冷却后,缓慢加入饱和碳酸氢钠溶液,待固体完全析出后,过滤,用水洗去溶剂,烘干后,用二氯甲烷重结晶,过滤干燥后得到红色固体如(IV)所示的喹吖啶酮衍生物,产率约为79%。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m,4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H).
(3)偶联反应:
将化合物(IV)(0.2431g,0.35mmol)置于50mL三颈烧瓶中,加入碘化亚铜(0.0405g,0.035mmol),四三苯基膦钯(0.0405g,0.035mmol),在氮气保护条件下加入20mL三乙胺和10mL N,N’-二甲基甲酰胺。反应液于80℃下搅拌1h,缓慢滴加苯乙炔(0.1072g,1.05mmol),再升温至90℃反应20h后停止反应。待反应液冷却后,倒入饱和食盐水中待固体析出,过滤,粗产品上硅胶柱提纯,得到红色固体为式(Ⅶ-1)所示的喹吖啶酮衍生物,产率约为75%。
1H NMR(500MHz,CDCl3)δ8.49(s,2H),8.46(d,J=2.1Hz,2H),7.71(dd,J=8.9,2.1Hz,2H),7.64–7.57(m,4H),7.43–7.36(m,6H),7.33(d,J=9.1Hz,2H),4.50–4.35(m,4H),2.01–1.88(m,4H),1.67–1.58(m,J=15.3,7.6Hz,4H),1.53–1.45(m,J=15.1,6.9Hz,4H),1.44–1.30(m,12H),0.93(t,J=6.9Hz,6H).
(4)缩合反应:在100mL三颈烧瓶中加入(Ⅶ-1)所示喹吖啶酮衍生物(0.1474mg,0.2mmol),在氮气保护的条件下加入干燥的吡啶30mL,缓慢滴加四氯化钛(0.1517g,0.80mmol),在常温下搅拌约4h,缓慢滴加丙二腈(0.3964g,6mmol)溶解在4mL吡啶中,搅拌30min后,升温至吡啶的沸点,搅拌回流3h,再将反应液冷却至室温。 反应液用甲醇和水的混合液淬灭,抽滤后,粗产品上硅胶柱提纯,得到深蓝色固体为式(Ⅷ-1)所示的喹吖啶酮衍生物,产率约为85%。
1H NMR(500MHz,CDCl3)δ8.65(d,J=1.7Hz,2H),8.57(s,2H),7.81(dd,J=8.9,1.8Hz,2H),7.54(dd,J=6.5,3.1Hz,4H),7.44–7.34(m,8H),4.66–3.63(m,4H),2.10–1.95(m,4H),1.71–1.61(m,J=15.0,7.5Hz,4H),1.57–1.47(m,J=14.5,6.8Hz,4H),1.47–1.32(m,12H),0.96(t,J=6.8Hz,6H).
实施例2
(1)N烷基化反应
化合物(Ⅲ)的合成方法及后处理步骤同实施例1(1)相同,不同的是相转移催化剂为四丁基氯化铵(TBAC)(0.2779mg,1mmol),碱为氢氧化钠(1.6g,40mol),溶剂为40mL的N’N-二甲基甲酰胺(DMF)。硅胶柱提纯,得到红色固体(Ⅲ),产率约为75%(以化合物的物质的量计)。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m,4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H).
(2)溴化反应
喹吖啶酮衍生物(IV)的合成方法及后处理步骤与实施例1(2)相同,不同的是将溶剂改为10mL四氯化碳,重结晶得到红色固体(IV),产率约为74%。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m, 4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H).
(3)偶联反应
喹吖啶酮衍生物(Ⅶ-2)的合成方法及后处理步骤与实施例1(3)相同,不同的是将加入的原料苯乙炔改为4-甲氧基苯乙炔(0.1388g,1.05mmol),将溶剂改为10mLN,N’-二甲基乙酰胺,将碱改为碳酸钾(0.1935g,1.4mmol)。通过柱层析提纯得到红色固体(Ⅶ-2),产率为70%
1H NMR(500MHz,CDCl3)δ8.41(s,2H),8.35(d,J=2.1Hz,2H),7.59(dd,J=8.9,2.1Hz,2H),7.49(d,J=8.6Hz,4H),7.24(d,J=9.1Hz,2H),6.90(d,J=8.7Hz,4H),4.46–4.29(m,4H),3.86(s,6H),1.97–1.88(m,4H),1.67–1.58(m,J=15.1,7.6Hz,4H),1.52–1.45(m,J=14.8,6.8Hz,4H),1.40–1.32(m,12H),0.93(t,J=6.8Hz,6H).
(4)缩合反应
喹吖啶酮衍生物(Ⅷ-2)的合成方法及后处理步骤与实施例1(4),只是将加入的原料(Ⅶ-1)改为(Ⅶ-2)(0.1594g,0.2mmol),将钛催化加改为四溴化钛(0.294g,0.80mmol)。通过柱层析提纯得到深蓝色固体(Ⅷ-2),产率为87%。
1H NMR(500MHz,CDCl3)δ8.52(d,J=14.1Hz,4H),7.68(d,J=8.8Hz,2H),7.39(d,J=8.5Hz,4H),7.30–7.23(m,2H),6.82(d,J=8.5Hz,4H),4.40–4.22(m,4H),3.80(s,6H),2.13–1.90(m,4H),1.73–1.60(m,4H),1.56–1.49(m,4H),1.47–1.35(m,12H),0.97(t,J=6.7Hz,6H).
实施例3
(1)N烷基化反应
化合物(Ⅲ)的合成方法及后处理步骤同实施例1(1)相同,,只是将相转移催化剂溶剂改为四丁基氟化铵(TBAF)(0.2615mg,1mmol),将碱改为氢氧化钾(2.24g,40mol),将溶剂改为40mL的四氢呋喃(THF)。硅胶柱提纯,得到红色固体(Ⅲ),产率约为75%(以化合物的物质的量计)。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m,4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H).
(2)溴化反应
喹吖啶酮衍生物(IV)的合成方法及后处理步骤与实施例1(2)相同,,只是将溶剂改为10mL氯仿,重结晶得到红色固体(IV),产率约为70%。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m,4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H)。
(3)偶联反应
喹吖啶酮衍生物(Ⅶ-3)的合成方法及后处理步骤与实施例1(3)相同,只是将加入的原料苯乙炔改为4-氯苯乙炔(0.1434g,1.05mmol),将溶剂改为10mL 1,4-二氧六环,将碱改为碳酸钠(0.1162g,1.4mmol)。通过柱层析提纯得到红色固体(Ⅶ-3),产率为65%。
1H NMR(500MHz,CDCl3)δ8.84–8.63(m,2H),7.91–7.71(m,2H),7.59–7.46(m,2H),7.37(d,J=7.4Hz,2H),7.32–7.24(m,4H),4.83–4.13(m,4H),2.13–1.88(m,4H),1.65–1.51(m,4H),1.41–1.18(m,16H),0.92–0.78(m,6H).
(4)缩合反应
喹吖啶酮衍生物(Ⅷ-3)的合成方法及后处理步骤与实施例1(4)只是将加入的原料(Ⅳ-1)改为(Ⅳ-3)(0.1594g,0.2mmol),将钛催化加改为四碘化钛(0.4444g,0.80mmol)。通过柱层析提纯得到深蓝色固体(Ⅷ-3),产率为75%。
1H NMR(500MHz,CDCl3)δ8.84–8.63(m,2H),7.91–7.71(m,2H),7.59–7.46(m,2H),7.37(d,J=7.4Hz,2H),7.32–7.24(m,4H),4.83–4.13(m,4H),2.13–1.88(m,4H),1.65–1.51(m,4H),1.41–1.18(m,16H),0.92–0.78(m,6H).
实施例4
(1)N烷基化反应
化合物(Ⅲ)的合成方法及后处理步骤同实施例1(1)相同,,只是将溶剂改为40mL的1,4‐二氧六环。硅胶柱提纯,得到红色固体(Ⅲ),产率约为70%(以化合物的物质的量计)。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m, 4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H).
(2)溴化反应
喹吖啶酮衍生物(IV)的合成方法及后处理步骤与实施例1(2)相同,只是将溶剂改为15mL 1,4‐二氧六环,重结晶得到红色固体(IV),产率约为65%。
1H NMR(500MHz,CDCl3)δ8.69(s,2H),8.52(dd,J=8.0,1.6Hz,2H),7.70(ddd,J=8.6,6.9,1.6Hz,2H),7.46(d,J=8.8Hz,2H),7.22(t,J=7.4Hz,2H),4.61–4.27(m,4H),2.07–1.88(m,4H),1.62(dt,J=15.4,7.6Hz,4H),1.47(dt,J=15.2,6.9Hz,4H),1.42–1.26(m,12H),0.91(t,J=6.9Hz,6H)。
(3)偶联反应
将化合物(IV)(0.2084g,0.3mmol),碳酸钾(0.4146g,3mmol),醋酸钯(0.0135g,0.06mmol)和四丁基溴化铵(0.1934g,0.6mmol)置于50mL三颈烧瓶中,在氮气保护下加入20mL二甲基甲酰胺。反应液先于80℃搅拌1h,在滴加苯乙烯(0.1406g,1.35mmol),然后升温至120℃反应24h。待反应液降至室温后,倒入饱和的食盐水,过滤,粗产品上硅胶柱提纯,得到红色固体化合物(Ⅶ-4),产率约为45%。
1H NMR(500MHz,CDCl3)δ8.27(s,2H),8.09(d,J=2.0Hz,2H),7.53(dd,J=9.0,2.0Hz,2H),7.43(d,J=7.4Hz,4H),7.36(t,J=7.5Hz,4H),7.28(t,J=7.2Hz,2H),7.18(d,J=9.0Hz,2H),6.89(q,J=16.3Hz,4H),4.47–4.17(m,4H),1.98–1.87(m,4H),1.66(dt,J=15.1,7.6Hz,4H),1.52(dt,J=15.0,6.8Hz,4H),1.46–1.33(m,12H),0.96(t,J=6.8Hz,6H).
实施例5
化合物(Ⅶ-2)的光电性能检测
实施例1-4中制备的喹吖啶酮衍生物在二氯甲烷中的紫外-可见吸收谱图见附图1,在二氯甲烷中的荧光光谱图见附图2:将化合物配成浓度为1×10-5M的溶液,溶剂为二氯甲烷,使用的仪器是Shimadzu UV-1800分光光度计。将化合物配成浓度为2×10-7M的溶液,溶剂为二氯甲烷,使用的仪器是Shimadzu RF-6000PC光谱仪。循环伏安:以Pt作为工作电极,铂丝为对电极,Ag/Ag+为参比电极,)四丁基铵六氟磷酸盐作为支持电解质,氧化电势在无水二氯甲烷中测得,还原电势在四氢呋喃中测得,使用的电化学工作站是IVIUM V63126,扫描速度为100mV·s-1。(Ⅶ-2)的测试性能如表1所示:
表1 喹吖啶酮衍生物(Ⅶ-2)光电学性能参数
λabs表示吸收波长;、λem表示发射波长;Δ表示斯托克斯位移;ΦPL表示荧光量子产率.
化合物(Ⅶ-2)具有比较大的紫外可见吸收波长,能显示出较强的橙色荧光,斯托克斯位移为1777cm-1,荧光量子产率为0.46,是一类很好的光学材料,其能带隙为1.827eV,有利于电子的分子内转移,是一类很有潜力的非线性光学材料。
实施例6
将化合物Ⅲ,Ⅶ-1,Ⅶ-2,Ⅶ-3,Ⅶ-4,Ⅷ-1,Ⅷ-2,Ⅷ-3配成浓度为1×10-5M的溶液,溶剂为四氢呋喃,加入四丁基六氟磷酸铵为以上化合物质量的10‐50倍,测8个化合物的荧光发射光谱见图3,发现原本呈现橙色荧光的化合物Ⅳ,Ⅶ‐1,Ⅶ‐2,Ⅶ‐3,其荧光逐渐被淬灭;化合物Ⅷ-1,Ⅷ-2,Ⅷ-3原本在25℃没有荧光,再加入了四丁基 六氟磷酸铵后显示出荧光。该现象表明该类物质可以作为荧光探针使用。
以上仅列举了本发明的优选实施方案,本发明的保护范围并不限制于此,本领域技术人员在本发明权利要求范围内所作的任何改变均落入本发明保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!