改造抗体‑应激蛋白融合物的制作方法
本申请是申请日为2007年2月2日的中国专利申请200780010776.x“改造抗体-应激蛋白融合物”的分案申请。
政府支持
本发明部分在由accelerateddrugandvaccinedevelopmentwithformersovietunioninstitutionsinsupportoftheu.s.departmentofstatebioindustryinitiative授予的departmentofstategrants-lmaqm-04-gr-164的政府支持下进行。因此,美国政府在本发明中拥有某些权利。
本发明涉及融合蛋白。具体涉及改造抗体-应激蛋白融合多肽。
背景技术:
经典单克隆抗体通常在哺乳动物细胞中生产,这种生产方法的缺点包括生产和选择合适的克隆的困难,和培养哺乳动物细胞的费用。“下一代”单克隆抗体在大肠杆菌(e.coli)中进行改造。近来,由多肽接头栓系在一起的vh和vl结构域的微生物表达已造成了产生改造的“小型抗体(mini-antibodies)”的能力。这些小型抗体可以在大肠杆菌中以实际上组合的方式来产生。这些人工生成的fab或单链fv(scfv)可以连接在一起以形成多聚体,例如双抗体、三链抗体和四抗体(tetrabodies)。尽管它们能够以几乎抗体样的效率与抗原结合,但这些改造的、fc缺陷的小型抗体缺乏与抗原呈递细胞相互作用的能力并且是弱免疫原性的。
改造抗体的免疫原性缺乏的现有解决方案涉及指导抗原结合部位之一与免疫细胞直接结合。这使它们对合(inapposition),但不导致相同的mhci类致敏(priming),如对于单克隆抗体观察到的。
技术实现要素:
在一个方面,提供了改造抗体例如fab或scfv与应激蛋白例如hsp70的融合物。应激蛋白在将抗原呈递给抗原呈递细胞且引起t细胞应答方面非常有效。它们在通过这种途径引发细胞介导的免疫和体液免疫应答方面特别有效。
因此,融合分子以高亲和力与抗原结合,是高免疫原性的,显示mhci类致敏,引起t细胞应答并且能够在非哺乳动物系统例如大肠杆菌中生产。融合分子因此适合于用作高免疫原性疫苗用于预防或治疗传染性、炎性、自身免疫性或恶性病。
因此,提供了包含至少一种改造抗体和至少一种应激蛋白的融合多肽。这些包含改造抗体的融合多肽可以是多价的,即它们可以是二价、三价、四价、五价的等。此外,它们可以是单特异性或多特异性的。
还提供了编码改造抗体-应激蛋白融合多肽的核酸和载体、包含核酸和载体的宿主细胞以及用于生产改造抗体-应激蛋白融合多肽的方法。抗原组合位点或改造抗体片段可以快速且以高亲和力产生,并且可以廉价地与应激蛋白融合。
进一步提供了包含主题改造抗体-应激蛋白融合多肽的药物和疫苗组合物。此种组合物可以进一步包含佐剂或其他试剂。还提供了预防或治疗患者中的传染性、炎性、自身免疫性或恶性病的方法,其包括给有此需要的患者施用有效量的任何一种前述组合物。
用于实践该方法的试剂盒也在本文中得到描述。
其他特征和优点由于下述详细描述和权利要求将是显而易见的。
附图说明
图1描述了示例性改造抗体-应激蛋白融合多肽,其包含四价tandab(改造抗体)和hsp70(应激蛋白)。
图2描述了分别来自结核分枝杆菌(mycobacteriumtuberculosis)hsp70和牛分枝杆菌(mycobacteriumbovus)hsp70的hsp70的全长多肽序列。
图3描述了如实施例1中描述的12%paag的结果,所有蛋白质在变性(dtt)条件下以4μg/道装载。
图4。od450nm。用于包被的抗原以溶于pbs的浓度1μg/ml获取。第一抗体在pbs中与系列稀释的0.2%bsa和0.05%tween20一起温育。使用与hrp缀合的第二抗小鼠抗体。
具体实施方式
为了方便起见,在进一步描述本发明前,在说明书、实施例和附加权利要求中使用的某些术语在此处进行定义。
除非上下文另有明确说明,单数形式“一个(a)”、“一种(an)”和“该(the)”包括复数参考。
术语“施用”包括本发明的化合物(包括但不限于药物组合物或治疗剂)递送到受试者的系统内或者受试者中或其上的特定区域的任何方法。如本文所使用的,短语“全身施用”、“全身地施用”、“外周施用”和“外周地施用”意指化合物、药物或其他材料除直接方式外进入中枢神经系统内的施用,从而使得它进入患者的系统且因此进行代谢和其他类似过程,例如皮下施用。“肠胃外施用”和“肠胃外地施用”意指除肠和局部施用外的施用模式,通常经由注射,且包括但不限于,静脉内、肌内、动脉内、鞘内、囊内、眶内、心内、真皮内、腹膜内、经气管、皮下、表皮下、关节内、囊下、蛛网膜下、脊柱内和胸骨内注射和输注。
术语“氨基酸”意欲包含无论是天然的还是合成的所有分子,这包括氨基功能性和酸功能性,并且能够包括在天然存在的氨基酸的聚合物中。示例性氨基酸包括天然存在的氨基酸;其类似物、衍生物和同源物(congener);具有不同侧链的氨基酸类似物;和任何前述的所有立体异构体。天然氨基酸的名称在本文中依照iupac-iub的建议进行缩写。
术语“抗体”指免疫球蛋白、其维持特异性结合能力的衍生物、和具有与免疫球蛋白结合结构域同源或很大程度上同源的结合结构域的蛋白质。这些蛋白质可以衍生自天然来源、或部分或全部合成产生。抗体可以是单克隆或多克隆的。抗体可以是来自任何物种的任何免疫球蛋白类别的成员,包括人类别中的任何一种:igg、igm、iga、igd和ige。在示例性实施方案中,本文描述的方法和组合物使用的抗体是igg类别的衍生物。
术语“抗体片段”指小于全长的抗体的任何衍生物。在示例性实施方案中,抗体片段保留全长抗体的特异性结合能力的至少显著部分。抗体片段的例子包括但不限于,fab、fab′、f(ab′)2、scfv、fv、dsfv双抗体和fd片段。抗体片段可以通过任何方式进行生产。例如,抗体片段可以通过完整抗体的断裂而酶促或化学生产,它可以由编码部分抗体序列的基因重组生产,或它可以是全部或部分合成生产。抗体片段可以任选是单链抗体片段。可替代地,片段可以包含例如通过二硫键连接在一起的多条链。片段还可以任选是多分子复合物。功能抗体片段一般将包含至少约50个氨基酸,并且更一般地将包含至少约200个氨基酸。
术语“抗原结合部位”指特异性结合抗原上的表位的抗体区域。
术语“包含”以包括在内的、开放意义使用,意指可能包括另外的要素。
术语“有效量”指足以达到所需结果的化合物、材料或组合物的量。化合物的有效量可以在一次或多次施用中进行施用。
术语“改造抗体”指包含至少抗体片段且可能任选包含来自任何ig类别(例如iga、igd、ige、igg、igm和igy)抗体的可变和/或恒定结构域的完整或部分的重组分子,所述抗体片段包含衍生自抗体的重链和/或轻链的可变结构域的抗原结合部位。
术语“表位”指抗体与之优先且特异性结合的抗原的区域。单克隆抗体与可以分子限定的分子的单个特异性表位优先结合。在本发明中,多个表位可以由多特异性抗体识别。
“融合蛋白”或“融合多肽”指包含来自至少2种不同多肽的多肽部分的杂交多肽。部分可以来自相同生物的蛋白质,在这种情况下融合蛋白被说成是“种内的”、“基因内的”等。在各种实施方案中,融合多肽可以包含与第一种多肽连接的一种或多种氨基酸序列。在其中超过一种氨基酸序列与第一种多肽融合的情况下,融合序列可以是相同序列的多个拷贝,或可替代地,可以是不同的氨基酸序列。第一种多肽可以与第二种多肽的n末端、c末端或n和c末端融合。此外,第一种多肽可以插入第二种多肽的序列内。
术语“fab片段”指包含通过用木瓜蛋白酶切割抗体产生的抗原结合部位的抗体片段,所述木瓜蛋白酶在h链间二硫键n末端的铰链区处切割且产生来自1个抗体分子的2个fab片段。
术语“f(ab′)2片段”指包含通过用胃蛋白酶切割抗体分子产生的2个抗原结合部位的抗体片段,所述胃蛋白酶在h链间二硫键c末端的铰链区处切割。
术语“fc片段”指包含其重链的恒定结构域的抗体片段。
术语“fv片段”指包含其重链和轻链的可变结构域的抗体片段。
“基因构建体”指核酸,例如载体、质粒、病毒基因组等,其包括关于多肽的“编码序列”或可以以其他方式转录成生物活性rna(例如反义、诱饵、核酶等),可以转染到细胞内,例如在某些实施方案中,哺乳动物细胞,并且可以引起编码序列在用构建体转染的细胞中表达。基因构建体可以包括与编码序列可操作地连接的一种或多种调节元件,以及内含子序列、聚腺苷酸化位点、复制起点、标记基因等。
“宿主细胞”指可以用特定转移载体转导的细胞。细胞任选地选自体外细胞,例如衍生自细胞培养的那些,先体外后体内细胞,例如衍生自生物的那些,和体内细胞,例如在生物中的那些。应当理解此种术语不仅指特定主题细胞还指此种细胞的后代或潜在后代。因为某些修饰可以由于突变或环境影响而在随后的代中发生,所以此种后代事实上可能不等同于亲代细胞,但仍包括在如本文所使用的术语的范围内。
如本文所使用的,术语“包括”意指“包括但不限于”。“包括”和“包括但不限于”可互换使用。
术语“免疫原性”指物质引发免疫应答的能力。“免疫原性组合物”或“免疫原性物质”是引发免疫应答的组合物或物质。“免疫应答”指受试者对抗原的存在的反应,这可以包括下述中的至少一种:制备抗体、发展免疫、发展对抗原的过敏性、和发展耐受性。
术语“分离的多肽”指这样的多肽,其可以由重组dna或rna制备,或具有合成来源、其一些组合,或可以是天然存在的多肽,所述多肽(1)不与其在自然界中与之通常结合的蛋白质结合,(2)从其中它天然存在的细胞中分离,(3)基本上不含来自相同细胞来源的其他蛋白质,(4)由来自不同物种的细胞表达,或(5)在自然界中不存在。
术语“分离的核酸”指基因组、cdna、合成、或天然来源或其一些组合的多核苷酸,所述多核苷酸(1)不与“分离的核酸”在自然界中在其中发现的细胞结合,或(2)与其在自然界中不与之连接的多核苷酸可操作地连接。
术语“接头”是领域公认的,并且指连接2种化合物例如2种多肽的分子或分子组。接头可以包含单个连接分子或可以包含连接分子和意欲使连接分子和化合物隔开特定距离的间隔区分子。
术语“多价抗体”指包含超过一个抗原识别位点的抗体或改造抗体。例如,“二价”抗体具有2个抗原识别位点,而“四价”抗体具有4个抗原识别位点。术语“单特异性”、“双特异性”、“三特异性”、“四特异性”等指多价抗体中存在的不同抗原识别位点特异性的数目(与抗原识别位点的数目相反)。例如,“单特异性”抗体的抗原识别位点全都结合相同表位。“双特异性”抗体具有结合第一种表位的至少一个抗原识别位点,和结合与第一种表位不同的第二种表位的至少一个抗原识别位点。“多价单特异性”抗体具有全都结合相同表位的多个抗原识别位点。“多价双特异性”抗体具有多个抗原识别位点,其中一些数目结合第一种表位和其中一些数目结合与第一种表位不同的第二种表位。
术语“核酸”指聚合形式的核苷酸,核糖核苷酸或脱氧核苷酸,或经修饰形式的任一类型的核苷酸。该术语还应理解为包括,作为等价物,由核苷酸类似物制备的rna或dna类似物,和如可应用于描述的实施方案,单链(例如有义或反义)和双链多核苷酸。
“蛋白质”(如果是单链的)、“多肽”和“肽”在本文中当提及例如如可以由编码序列编码的基因产物时可互换使用。在本文中当提及“多肽”时,本领域技术人员将认识到除非上下文另有明确说明,可以使用蛋白质代替。“蛋白质”还指一种或多种多肽的结合。“基因产物”意指由于基因转录产生的分子。基因产物包括由基因转录的rna分子,以及由此种转录物翻译的蛋白质。
术语“多肽片段”或“片段”当关于特定多肽使用时,指与参考多肽自身相比较,其中氨基酸残基被缺失但剩余氨基酸序列通常等同于参考多肽的那种的多肽。此种缺失可以在参考多肽的氨基末端或羧基末端,或可替代地两者上发生。片段一般长度为至少约5、6、8或10个氨基酸,长度为至少约14个氨基酸,长度为至少约20、30、40或50个氨基酸,长度为至少约75个氨基酸,或者长度为至少约100、150、200、300、500或更多氨基酸。片段可以保留参考多肽的一种或多种生物活性。在各种实施方案中,片段可以包含参考多肽的酶促活性和/或相互作用位点。在另一个实施方案中,片段可以具有免疫原性性质。
“患者”或“受试者”或“宿主”指人或非人动物。
短语“药学上可接受的”在本文中用于指那些化合物、材料、组合物和/或剂型,其在合理的医学判断范围内,适合于与人类和动物的组织接触使用,而无过量毒性、刺激、变应性应答、或其他问题或并发症,与合理的利益/风险比相称。
如本文所使用的,“药学上可接受的载体”意指药学上可接受的材料、组合物或媒介物,例如液体或固体充填剂、稀释剂、赋形剂或溶剂被囊化材料,涉及从身体的一个器官或部分携带或转运主题化合物到身体的另一个器官或部分。每种载体在与制剂的其他成分相容的意义上必须是“可接受的”和对患者无害的。可以充当药学上可接受的载体的材料的一些例子包括:(1)糖,例如乳糖、葡萄糖和蔗糖;(2)淀粉,例如玉米淀粉和马铃薯淀粉;(3)纤维素及其衍生物,例如羧甲基纤维素钠、乙基纤维素和乙酸纤维素;(4)粉状西黄蓍胶;(5)麦芽;(6)明胶;(7)滑石;(8)赋形剂,例如可可脂和栓剂蜡;(9)油,例如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;(10)甘醇,例如丙二醇;(11)多元醇,例如甘油、山梨糖醇、甘露糖醇和聚乙二醇;(12)酯,例如油酸乙酯和月桂酸乙酯;(13)琼脂;(14)缓冲剂例如氢氧化镁和氢氧化铝;(15)藻酸;(16)无致热原水;(17)等渗盐水;(18)林格液;(19)乙醇;(20)ph缓冲溶液;(21)聚酯、聚碳酸酯和/或聚酐;和(22)药物制剂中使用的其他无毒的相容的物质。
“药学上可接受的盐”指化合物的相对无毒的、无机和有机酸加成盐。
术语“单链可变片段或scfv”指其中重链结构域和轻链结构域连接的fv片段。一个或多个scfv片段可以与其他抗体片段(例如重链或轻链的恒定结构域)连接,以形成具有一个或多个抗原识别位点的抗体构建体。
如本文所使用的,“应激蛋白”,也称为“热激蛋白”或“hsp”,是由应激基因编码,且因此一般在应激物与生物接触或暴露后以明显更大的量生产的蛋白质。如本文所使用的,术语“应激蛋白”意欲包括应激蛋白的此种部分和肽。如本文所使用的,“应激基因”,也称为“热激基因”,指由于生物(包含基因)与应激物或某些苯醌安沙霉素接触或暴露而激活或以其他方式可检测地上调的基因,所述应激物例如热激、低氧、葡萄糖缺乏、重金属盐、能量代谢和电子传递抑制剂、和蛋白质变性剂。nover,l.,heatshockresponse,crcpress,inc.,bocaraton,fl(1991)。“应激基因”还包括在已知应激基因家族内的同源基因,例如hsp70和hsp90应激基因家族内的某些基因,即使此种同源基因自身不由应激物诱导。如本说明书中所使用的,术语应激基因和应激蛋白各自可以包括在另一个内,除非上下文另有说明。
“治疗”受试者中的疾病或“治疗”具有疾病的受试者指对受试者实施药物处理,例如施用药物,从而使得疾病的程度得到减少或预防。处理包括(但不限于)施用组合物,例如药物组合物,并且可以预防地,或在病理事件起始后进行。
术语“疫苗”指引发免疫应答且还对受试者赋予保护性免疫的物质。
“载体”指能够转运它与之连接的另一种核酸的核酸分子。一种类型的优选载体是附加体,即能够染色体外复制的核酸。优选载体是能够自主复制和/或表达它们与之连接的核酸的那些。能够指导它们与之可操作地连接的基因表达的载体在本文中称为“表达载体”。一般而言,用于重组dna技术中的表达载体通常为“质粒”的形式,所述质粒一般指环状双链dna环,其以其载体形式不与染色体结合。在本说明书中,“质粒”和“载体”可互换使用,因为质粒是最常用形式的载体。然而,如本领域技术人员将理解的,本发明意欲包括此种其他形式的表达载体,所述表达载体发挥等价功能且随后变得本领域已知的。
1.改造抗体-应激蛋白融合多肽
提供了包含改造抗体和应激蛋白的融合多肽。改造抗体可以包含例如至少一个scfv、至少一个fab片段、至少一个fv片段等。它可以是单价的或它可以是多价的。在其中改造抗体是多价的实施方案中,它可以是二价、三价、四价的等。多价抗体可以是单特异性或多特异性的,例如双特异性、三特异性、四特异性等。多价抗体可以是任何形式,例如双抗体、三链抗体、四抗体等。在某些实施方案中,改造抗体是tandab。应激蛋白可以包含任何应激蛋白。在某些实施方案中,应激蛋白包含hsp70,例如结核分枝杆菌hsp70或牛分枝杆菌hsp70。结核分枝杆菌hsp70或牛分枝杆菌hsp70的全长多肽序列分别在图2中作为seqidno:1和2得到描述。
关于可以掺入主题融合多肽内的改造抗体和应激蛋白的进一步细节在下文提供。
a.改造抗体
天然抗体自身是二聚体,且因此是二价的。如果生产不同抗体的2种杂交瘤细胞进行人工融合,那么由杂种杂交瘤生产的一些抗体由具有不同特异性的2种单体组成。此种双特异性抗体还可以通过使2种抗体化学缀合来生产。天然抗体及其双特异性衍生物相对较大且对于生产是昂贵的。小鼠抗体的恒定结构域也是人抗小鼠抗体(hama)应答的主因,这阻止其广泛用作治疗剂。由于其结合fc-受体,它们还可以引起不合需要的效应。由于这些原因,分子免疫学家已集中于在微生物中生产小得多的fab和fv片段。这些较小片段不仅更易于生产,它们的免疫原性也较小,没有效应子功能,并且由于其相对小的尺寸,它们能够更好地穿透组织和肿瘤。在fab片段的情况下,与可变结构域邻近的恒定结构域在稳定化重链和轻链二聚体中起主要作用。因此,尽管全长或接近全长的改造抗体可以包含主题融合多肽,但较小的、单结构域改造抗体(其可以是多价和多特异性的)优选用于融合多肽中。
fv片段更不稳定,且肽接头因此可以引入重和轻链可变结构域之间以增加稳定性。这种构建体称为单链fv(scfv)片段。为了额外的稳定性,二硫键有时引入2个结构域之间。迄今,基于四价scfv的抗体已通过与额外的聚合结构域例如形成四聚体的链霉抗生物素蛋白单体,和两亲性α螺旋融合进行生产。然而,这些额外的结构域可以增加四价分子的免疫原性。
二价和双特异性抗体可以仅使用抗体可变结构域进行构建。相当有效和相对简单的方法是制备vh和vl结构域之间如此短的接头序列,从而使得它们不能在彼此上折叠和结合。接头长度减少至3-12个残基阻止了scfv分子的单体构型,且支持分子间vh-vl配对,形成60kda非共价scfv二聚体“双抗体”(holliger等人,1993,proc.natl.acad.sci.usa90,6444-6448)。双抗体形式还可以用于产生重组双特异性抗体,其通过2个单链融合产物的非共价结合而获得,由通过短接头与另一种抗体的vl结构域连接的来自一种抗体的vh结构域组成。接头长度再进一步减少至3个残基以下可以导致三聚体(“三链抗体”,约90kda)或四聚体(“四抗体”,约120kda)的形成(legall等人,1999,febsletters453,164-168)。关于改造抗体特别是单结构域片段的综述,参见holliger和hudson,2005,naturebiotechnology,23:1126-1136。所有此种改造抗体可以在本文提供的融合多肽中使用。
可以包含主题融合多肽的其他多价改造抗体在lu等人,2003,j.immunol.meth.279:219-232(双-双抗体(di-diabodies)或四价双特异性抗体);美国公开申请20050079170(多聚体fv分子或“flexibodies”)、以及wo99/57150和kipriyanov等人,1999,j.mol.biol.293:41-56(串联双抗体、或“tandabs”)中得到描述。
上述多价改造抗体中的任何一种可以由本领域技术人员使用常规重组dna技术进行开发,例如下述参考文献中描述的:pct国际申请号pct/us86/02269;欧洲专利申请号184,187;欧洲专利申请号171,496;欧洲专利申请号173,494;pct国际公开号wo86/01533;美国专利号4,816,567;欧洲专利申请号125,023;better等人(1988)science240:1041-1043;liu等人(1987)proc.natl.acad.sci.usa84:3439-3443;liu等人(1987)j.immunol.139:3521-3526;sun等人(1987)proc.natl.acad.sci.usa84:214-218;nishimura等人(1987)cancerres.47:999-1005;wood等人(1985)nature314:446-449;shaw等人(1988)j.natl.cancerinst.80:1553-1559);morrison(1985)science229:1202-1207;oi等人(1986)biotechniques4:214;美国专利号5,225,539;jones等人(1986)nature321:552-525;verhoeyan等人(1988)science239:1534;beidler等人(1988)j.immunol.141:4053-4060;和winter和milstein,nature,349,第293-99页(1991))。优选地非人抗体通过使非人抗原结合结构域与人恒定结构域连接进行“人源化”(例如cabilly等人,美国专利号4,816,567;morrison等人,proc.natl.acad.sci.u.s.a.,81,第6851-55页(1984))。
改造抗体的抗原识别位点或整个可变区可以衍生自针对任何目的抗原的一种或多种亲代抗体。亲代抗体可以包括天然存在的抗体或抗体片段,由天然存在的抗体修改的抗体或抗体片段,使用已知对于目的抗原特异的抗体或抗体片段序列从头构建的抗体。可以衍生自亲代抗体的序列包括其重和/或轻链可变区和/或cdrs、构架区或其他部分。
多价、多特异性抗体可以包含含有2个或更多可变区的重链和/或含有一个或多个可变区的轻链,其中至少2个可变区识别相同抗原上的不同表位。
用于包括在融合多肽中的候选改造抗体,或融合多肽自身可以使用多种已知测定就活性进行筛选。例如,测定结合特异性的筛选测定是本领域众所周知的和常规实践的。关于此种测定的广泛讨论,参见harlow等人(编辑),antibodies:alaboratorymanual;coldspringharborlaboratory;coldspringharborn.y.,1988,第6章。
进一步提供了选择候选的改造抗体的方法。例如,候选物可以衍生自人scfv和其他抗体文库。因此,提供了抗体细菌展示文库。文库优选包含多个细菌,其中细菌展示平均具有至少一个scfv或vh或vl拷贝;文库包含多个种类的scfv或vh或vl。在优选实施方案中,细菌展示平均包含至少3个、至少4个、或至少5个scfv或vh或vl拷贝/细菌。特别优选的文库平均包含至少约106、优选地至少约107、更优选地至少约108个不同种类的scfv或vh或vl。在最优选的实施方案中,抗体由其为质粒或噬菌粒载体部分的核酸编码。在另外一个实施方案中,本发明提供了编码如细菌展示抗体文库的核酸文库。核酸文库包含至少约106、更优选地至少约107、和最优选地至少约108个不同的质粒或噬菌粒载体。
胞吞的细菌可以通过2种不同方法进行选择。一种方法是使这些哺乳动物细胞裂解且在包含合适的抗生素标记的细菌培养基上铺平板,但当必须筛选>108个变体的大型文库时,此种程序是繁琐和费力的。另一种方法是在大肠杆菌中表达荧光蛋白质例如gfp,并且一旦被胞吞,哺乳动物细胞就是荧光的,并且可以通过facs进行分离。gfp是新型荧光标记以由于下述特征选择胞吞的细菌:a)gfp是具有低毒性的细胞质蛋白质(chalfie等人,science263:802,1994);因此,gfp的存在应对细菌细胞表面动力学具有最低限度的作用;b)gfp可以是连续合成的,这使在细菌复制期间荧光信号稀释的作用降到最低;和c)gfp是易于成像和定量的(wang和hazelrigg,nature369:400,1994)。此外,单个哺乳动物细胞的荧光强度和与之结合的细菌数目成正比(valdivia等人,gene173:47,1996)。因此,与宿主细胞结合的gfp生产性细菌的流式细胞术分析提供了细菌粘附和侵染的快速和方便的测量。已显示a)基因gfp被表达,且功能性荧光gfp在不同细菌系统例如大肠杆菌、假结核病耶尔森氏菌(yersiniapseudotuberculosis)、鼠伤寒沙门氏菌(salmonellatyphimurium)和海分枝杆菌(mycobacteriummarinum)中进行生产,b)gfp的生产不改变3种病原体与其各自的宿主细胞的相互作用,c)生产gfp的细胞内细菌性病原体可以与活细胞和组织结合进行成像,和d)gfp生产可以通过流式细胞术进行检测,且用于测量细菌与哺乳动物细胞结合的程度(valdivia等人,同上)。
在受体介导的胞吞作用后通过从哺乳动物细胞内回收内在化细菌可以从大型非免疫或免疫细菌展示文库中直接选择内在化抗体候选物。因此,在一个实施方案中,本发明提供了选择内在化到特定靶细胞内的多肽或抗体结构域的方法。该方法涉及a)使一种或多种靶细胞与细菌展示文库的一个或多个成员接触;b)在其中展示文库的成员可以进行内在化的条件下培养靶细胞;和c)如果细菌展示文库的成员内在化到一个或多个靶细胞内,那么鉴定细菌展示文库的内在化成员。优选地,该方法另外涉及使细菌展示文库的成员与相减细胞系的细胞接触;和随后洗涤靶细胞以去除相减细胞系的细胞;和去除与靶细胞非特异性结合或弱结合的细菌展示文库的成员。在优选实施方案中,细菌展示文库是抗体细菌展示文库,更优选地展示单链抗体(scfv)的抗体细菌展示文库,或轻(vl)或重(vh)链的可变结构域。
在优选实施方案中,鉴定步骤包括回收内在化细菌和再次重复该方法的步骤,以进一步选择内在化的结合部分。在一个实施方案中,回收步骤涉及使靶细胞裂解以释放内在化细菌,和传代培养细菌以生产细菌用于后续选择轮次。回收步骤可以涉及回收传染性细菌,和/或回收编码细菌展示抗体的核酸和/或选择表达选择标记的细菌。鉴定步骤可以涉及检测报道基因的表达,检测特定核酸的存在或量,或经由选择标记选择细菌。鉴定步骤还可以涉及通过facs分选具有内在化细菌的哺乳动物细胞。在优选方法中,相减细胞系的细胞以超过靶细胞至少2倍过量呈现。在优选方法中,靶细胞系与组织培养板贴壁生长且在单个培养瓶中与相减细胞系悬浮共温育。在特别优选的方法中,与相减细胞系的接触在低于内在化培养条件(例如,37℃)的温度(例如,4℃)下进行。在特别优选的实施方案中,细菌表达选择标记和/或报道基因。优选的选择标记包括但不限于,编码荧光蛋白质(例如,gfp)的基因(或cdnas)、和生色基因或cdna(例如,β内酰胺酶、萤光素酶和β半乳糖苷酶)。在某些实施方案中,靶细胞可以包括超表达特定受体的细胞、cdna表达文库的成员、超表达趋化因子受体的细胞、转化细胞系的细胞、用编码特定表面靶受体的基因或cdna转化的细胞。合适的相减细胞系包括但不限于,正常人成纤维细胞、正常人乳腺细胞、胰细胞和心肌细胞。
涉及受体介导的胞吞作用的细胞表面受体可以从头进行鉴定(gao等人,j.immunol.meth.274:185,2003)。在第一个步骤中,通过相减法,肿瘤特异性内在化scfvs通过使scfv文库顺次暴露于各种人细胞和随后最终暴露于所需细胞类型进行分离。作为下一个步骤,所选择的scfvs用作探针用于通过免疫沉淀、质谱分析法和数据库搜索随后鉴定其同源受体。基于这个程序,选择对前列腺肿瘤细胞中的运铁蛋白受体,和胰腺癌细胞中存在的α3β1整联蛋白特异的scfvs(gao等人,同上)。此种相减法已成功地用于选择在人乳腺和胰癌细胞系上(fransson等人,cancerlett.208:235,2004)以及在前列腺癌细胞上(liu等人,cancerres.64:704,2004)的内在化受体。
因此,本发明的方法还可以用于鉴定内在化受体。鉴定仅存在于肝细胞(hepatocyte)(肝细胞(livercell))中且不存在于任何其他细胞类型中的胞吞受体是一个此种例子。该方法一般涉及用于鉴定内在化抗体的任何方法,或鉴定的多肽用于探测原始靶细胞或不同细胞。因为内在化抗体或多肽这样结合,所以它们允许分离具有内在化受体的细胞和分离受体和/或受体表位自身。因此,在一个实施方案中,该方法涉及a)使一种或多种靶细胞与细菌展示文库的一个或多个成员接触,b)任选地,但优选地,使细菌展示文库的成员与相减细胞系的细胞接触,c)任选地,但优选地,洗涤靶细胞以去除相减细胞系的所述细胞,和去除与所述靶细胞非特异性结合或弱结合或弱结合的细菌展示文库的成员,d)在其中所述细菌展示文库的成员若与内在化标记结合则可以内在化的条件下培养细胞,e)如果细菌展示文库的成员内在化到一个或多个靶细胞内,那么鉴定细菌展示文库的内在化成员,f)使相同或不同靶细胞与步骤(e)鉴定的内在化成员或由其繁殖的成员接触,由此成员与所述靶细胞的表面结合。该方法可以进一步涉及分离成员与之结合的相同或不同靶细胞的组分。在一些方法中,“鉴定”步骤涉及回收内在化细菌和重复步骤(a-e)以进一步选择内在化受体。接触、洗涤、培养和鉴定步骤优选如本文描述的进行,且相减细胞系包括心肌细胞、正常和癌性乳腺细胞。
其他蛋白质展示技术可以在上述方法中使用。掺入其他展示技术的此种方法的修饰是本领域技术人员众所周知的。可以在本方法中使用的示例性蛋白质展示技术的综述在下文提供。
蛋白质展示技术:
抗体改造在开发具有优良的药物代谢动力学和药物动力学性质的抗体疗法中起关键作用(burks等人,proc.natl.acad.sci.usa94:412,1997;uspatent:6,180,341)。定向进化涉及,首先使用分子生物学技术产生具有随机序列的蛋白质表达克隆的重组文库,和其次,使用筛选技术用于分离显示最增强的活性的蛋白质变体。大型文库的筛选要求在基因、其编码的蛋白质和所需功能中的物理联系。此种联系可以通过使用已证明无价的多种体内展示技术来确定(wittrup,naturebiotechnol.18:1039,2000;hayhurst和georgiou,curr.opin.chem.biol.5:683,2001)。
蛋白质展示技术共同代表用于蛋白质改造的最有力工具之一(olsen等人,curr.opin.biotechnol.11:331,2000)。为了展示目的,蛋白质与多肽序列的c或n末端融合,所述多肽序列使所得到的嵌合体靶向生物颗粒例如病毒、细菌和酵母表面上。文库一般通过称为“淘选”的方法经由一系列吸附-解吸循环就配体结合进行筛选。淘选已成功地用于筛选通过克隆哺乳动物抗体谱和在噬菌体上展示其而制备的高度复杂的文库(最高达1011个克隆)。对于稍微较不多样的文库(最高达109个克隆),在与流式细胞术偶联的细菌或酵母上展示是用于发现具有特别高的配体结合亲和力的蛋白质的有力工具(chen等人,naturebiotechnol.19:537,2001)。尽管展示技术的重要性对于蛋白质改造是无异议的,但使靶多肽锚定在生物颗粒表面上的需要强加了许多限制,所述限制可以显著减少相对于可以以可溶形式在细胞内生产的蛋白质全体的文库多样性。首先,蛋白质展示需要目的蛋白质作为c或n末端融合物进行表达,这个过程可以不利地影响蛋白质功能和/或稳定性。其次,蛋白质展示受与蛋白质输出和呈递相关的生物约束的影响,这可以损害病毒或细胞的生存力。第三,展示可以引入筛选假象例如在噬菌体中的抗体亲抗原性效应(o’connell等人,j.mol.biol.321:49,2002)。
候选改造抗体可以通过蛋白质展示技术的组合进行选择,特别是细菌展示技术-涉及构建在细菌周质中锚定的周质表达(apex)文库以及在细菌细胞质中表达的文库,从而使得候选改造抗体在细胞溶胶的生理学还原环境下正确折叠且是功能活性的。
已的一种方法是从噬菌体展示文库中分离scfvs,随后为就在大肠杆菌中表达或在哺乳动物细胞中起作用筛选大量克隆(lecerf等人,proc.natl.acad.sci.usa98:4764,2001;gennari等人,j.mol.biol.335:193,2004;emadi等人,biochemistry43:2871,2004)。其他人已使用双杂交系统以分离改造抗体(tes等人,j.mol.biol.317:85,2002;tanaka等人,emboj.22:1025,2003),但这不允许微调抗体生物物理学性质例如亲和力和表达。
a:噬菌体展示文库:
在m13噬菌体上展示是最古老和最广泛使用的蛋白质文库筛选法(marks等人,j.mol.biol.222:581,1991;marks等人,j.biol.chem.267:16007,1992;rodi和makowski,curr.opin.biotechnol.10:87,1999)。噬菌体抗体文库已变成用于开发治疗抗体的重要资源(bradbury和marks,j.immunol.meth.290:29,2004)。大型非免疫文库充当单罐资源用于快速产生针对广泛范围的自身和非自身抗原的人mabs(humabs),包括肿瘤生长因子受体(li等人,cancergenether.8:555,2001;liu等人,cancerres.64:704,2004)。从在噬菌体上表达的组合文库中分离的大多数mabs已使用固定化在人工表面上的纯化的抗原或肽进行选择。这种方法可以选择在生理学背景中不识别天然蛋白质,特别是具有大分子量细胞表面受体的mabs。已试图使用细胞裂解物(parren等人,j.virol.70:9046,1996;sanna等人,proc.natl.acad.sci.usa92:6439,1995;sawyer等人,j.immunol.meth.204:193,1997)或活细胞(andersen等人,proc.natl.acad.sci.usa93:1820,1996;osbourn等人,immunotechnol.3:293,1998)选择天然构象的抗原。由于原材料的异质性,此种方法要求精细规程,包括相减步骤以避免选择无关抗体。对异源材料进行的少数成功选择一般使用来自免疫来源的小型文库来完成。免疫文库的使用限制可以潜在地得自相同文库和一般产生鼠抗体的抗原特异性谱。仅存在使用大型非免疫文库对细胞成功选择的3篇报道(dekruif等人,proc.natl.acad.sci.usa92:3938,1995;marks等人,biotechnology11:1145,1993;vaughan等人,naturebiotechnol.14:309,1996)。
限制通过细胞淘选从大型首次用于实验的文库选择结合剂的步骤看起来是非特异性噬菌体相对高的背景结合和特异性噬菌体相对低的结合(becerril等人,biochem.biophys.res.comm.255:386,1999;pereira等人,j.immunol.meth.203:11,1997;watters等人,immunotechnol.3:21,1997)。特异性噬菌体的低结合与多克隆制剂中低浓度的给定结合噬菌体部分相关(在1x1013颗粒/ml的噬菌体制剂中对于109文库的单个成员约1.6x10-17m)。低浓度同时限制普通结合剂的相减和特定结合剂的富集的效率。为了克服这种限制,求助于利用正常细胞表面受体生物学。许多受体在配体结合后经历胞吞作用。假定在严格去除来自细胞表面的非特异性噬菌体后,通过从细胞溶胶中回收胞吞的噬菌体抗体可以显著增加特异性结合剂的富集比(poul等人,j.mol.biol.301:1149,2000)。
b:酵母表面展示文库:
酵母表面展示(ysd;boder和wittrup,naturebiotechnol.15:553,1997)是另一种已证明用于蛋白质改造的工具。在ysd中,目的蛋白质表达为与酵母交配蛋白质aga2p的融合物,所述aga2p靶向酵母细胞壁。一旦在酵母表面上表达,蛋白质性质例如稳定性和亲和力就可以使用荧光标记的试剂和流式细胞术进行定量测量。此外,突变体文库可以使用荧光激活细胞分选术(facs)就所需性质进行分选。ysd已成功地应用于抗体改造的几个方面:从非免疫humab文库中分离针对特定抗原的新型abs(feldhaus等人,naturebiotechnol.21:163,2003);亲和力成熟,从而导致迄今为止报道的最高亲和力的抗体(boder等人,proc.natl.acad.sci.usa97:10701,2000);以及稳定性和细胞外表达最优化(shusta等人,naturebiotechnol.18:754,2000)。此外,ysd是用于抗体结合部位(互补位)的结构域水平分析,和功能性抗体改造的有用工具(colby等人,j.mol.biol.342:901,2004)。在鉴定具有优良表达和细胞内功能的最低限度抗体片段的尝试中,ysd用于通过亲和力成熟和结合部位分析将细胞内无功能的scfv改造成功能性的单结构域vl抗体。
尽管所有这些优点,但ysd平台关于应用于抗体改造的潜在缺点可能起于与细胞质相比较细胞表面上氧化还原环境中的差异,其中二硫键未稳定形成。mabs包含在vh和vl结构域中高度保守的结构域内二硫键,所述结构域内二硫键使b折叠形成性构架残基保持刚性构象。这些二硫键的破坏扰乱结构域结构,从而减少蛋白质稳定性(ramm等人,j.mol.biol.290:535,1999)。这推测起来负责关于scfv的细胞表面表达和细胞质表达水平之间的差异。此外,融合蛋白(例如,scfv)的表达一般是顺式显性的;即,融合蛋白的表达仅与具有最低稳定性的成员的表达一样好,因此当vh被消除时在观察到的表达中改善的可替代解释是2.4.3的vh结构域在还原条件下明显不如vl稳定(colby等人,同上)。
与任何文库筛选技术(噬菌体和酵母展示技术)有关的重要问题是以高水平表达分离的克隆的能力。现有展示形式涉及与大锚定序列融合,这可以影响展示的蛋白质的表达特征。由于这个原因,在噬菌体、酵母或细菌(特别是在外膜上表达的蛋白质文库)中作为融合物良好展示的scfvs不必顺应作为非融合蛋白可溶形式的高表达(hayhurst等人,j.immunol.meth.276:185,2003)。相比之下,在apex展示中蛋白质n末端栓系到细胞质膜上所需的短(6-aa)序列不太可能影响融合物的表达特征。与这个假设一致,通过apex分离的针对炭疽pa毒素的所有3个亲和力增强的克隆显示出极佳的可溶表达特征,尽管具有众多氨基酸置换,从而暗示可以在细菌中以可溶形式大规模容易地生产的克隆的分离可能是apex选择的固有特征(harvey等人,proc.natl.acad.sci.usa101:9193,2004)。
c:apex细菌展示文库:
基于流式细胞术的方法已使用细菌表达得到开发,用于从组合文库中有效选择高亲和力配体结合蛋白质,和特别地scfvs。apex基于蛋白质与内膜周质侧的锚定,随后为在与荧光标记的抗原温育前破坏外膜和fc分选(harvey等人,proc.natl.acad.sci.usa101:9193,2004)。在apex中,蛋白质通过与大肠杆菌的内膜栓系在周质中表达。细菌外膜化学/酶促透化后,表达锚定的scfv抗体的大肠杆菌细胞可以用荧光抗原特异性标记,大小范围最高达至少240kda,和通过fc进行分析。另一个优点是gfp和抗原之间的融合物可以内源表达且通过周质锚定的scfv进行捕获。因此,在洗涤步骤后,表达荧光抗原和apex锚定的scfv的细胞是高度荧光的,且可以与仅表达单独的scfv或gfp抗原融合物的细胞容易地分选。
使用>400百万细胞/小时的分选率,商业fc机器可以用于筛选大小在微生物转化效率的约束内可接近的文库。此外,多参数fc可以实时提供关于各个和每个文库克隆的功能的有价值信息,因此帮助指导文库构建方法和最优化分选条件(daugherty,p.s.等人,proc.natl.acad.sci.usa97:2029,2000)。特别地,大肠杆菌提供了重组蛋白质的容易表达和高dna转化效率,这允许有效的大型文库生产和蛋白质文库序列空间增加的覆盖。
apex展示提供了超过先前开发的称为pecs(chen等人,naturebiotechnol.19:537,2001)的具有细胞计量筛选的细菌周质表达法,以及表面展示法例如噬菌体和酵母展示技术的几个优点:(i)apex是基于大肠杆菌的系统,且因此提供了通过分离的抗体的转化和制备型蛋白质表达来制备大型文库的容易途径;(ii)通过使用脂肪酰化锚以使蛋白质保留在内膜中,短至6个氨基酸的融合物是展示所需的全部。短融合物不太可能影响分离的蛋白质的亲和力或表达特征;(iii)内膜缺乏可以空间上妨碍与展示的多肽结合的大抗原的分子,例如lps或其他复合糖;(iv)融合物在其展示前必须仅穿过一个膜,且因此可能限制某些序列输出至酵母或细菌表面的生物合成限制可能被回避;(v)展示通过使用n或c末端融合来完成,(vi)apex可以直接用于由广泛使用的噬菌体展示载体表达的蛋白质。最后,(vii)apex提供了用于在相同细胞内同时表达荧光抗原和抗体的手段。这对于肽抗原是特别重要的,且避免了关于制备量探针的合成、纯化和缀合的费时过程,如当荧光抗原与文库一起温育时所需的。apex可以用于检测从小分子(<1kda)到藻红蛋白缀合物(240kda)的抗原,和可能大得多的抗原。
当scfv的结合能主要由2个结构域之一贡献时,apex展示程序可以用于从scfv衍生单结构域抗体(dabs)。
b.hsp70结构域
任何合适的应激蛋白(热激蛋白(hsp))都可以用于本发明的融合多肽中。例如,可以使用hsp60和/或hsp70。转向一般的应激蛋白,细胞通过增加通常称为应激、或热激基因的基因群表达对应激物(一般为热激处理)应答。热激处理涉及使细胞或生物暴露于超过细胞适应的温度1至几摄氏度的温度。与此种基因的诱导一致,相应的应激蛋白水平在受应激细胞中增加。
在细菌中,占优势的应激蛋白是分别具有约70和60kda的分子大小的蛋白质,其通常分别称为hsp70和hsp60。这些和其他特定应激蛋白以及编码其的基因在下文进一步讨论。在细菌中,基于使用十二烷基硫酸钠聚丙烯酰胺凝胶电泳和染料考马斯蓝的染色模式,hsp70和hsp60一般代表约1-3%的细胞蛋白质,但在应激条件下累积至高达25%的水平。应激蛋白看起来参与重要的细胞过程例如蛋白质合成、细胞内运输以及蛋白质复合物的装配和分解。看起来在应激过程中增加的合成的应激蛋白量主要用于使诱导的蛋白质解折叠的后果降到最低。事实上,细胞预暴露于诱导应激蛋白合成的适度应激条件给细胞提供不受后续更极端应激的有害作用的保护。
主要的应激蛋白看起来在迄今为止检查的每种生物和组织类型)中表达。同样,看起来应激蛋白代表迄今为止鉴定的最高度保守的蛋白质群。例如,当比较在广泛多样的生物中的应激蛋白时,hsp90和hsp70在氨基酸水平上显示出50%或更高的同一性,且在非等同位置上共享许多相似性。应当指出相似或更高的同源性水平存在于物种内的特定应激蛋白家族的不同成员之间。
应激蛋白,特别地hsp70、hsp60、hsp20-30和hsp10,在针对经由结核分枝杆菌和麻风分枝杆菌(mycobacteriumleprae)感染的免疫应答中在由宿主免疫系统识别的主要决定簇中。young,r.a.和elliott.t.j.,stressproteins,infection,andimmunesurveillance,cell50:5-8(1989)。此外,一些大鼠致关节炎(arthritogenic)t细胞识别hsp60表位。vaneden,w.等人,nature331:171-173(1988)。然而,个体包括无分枝杆菌感染或自身免疫疾病史的健康个体,也携带识别细菌和人hsp60表位的t细胞;在健康个体中特征在于表达γ-δt细胞受体的相当大级分的t细胞识别自身和外来应激蛋白。o′brien,r.等人,cell57:664-674(1989)。因此,个体即使是健康个体也具有识别外来和自身应激蛋白表位的t细胞群体。
识别应激蛋白表位的这个系统推测构成针对侵入生物的“早期防御系统”。murray,p.j.和young,r.a.,j.bacteriol174:4193-6(1992)。该系统可以通过经由细菌和病毒的频繁刺激得到维持。如前文所讨论的,健康个体具有识别自身应激蛋白的t细胞群体。因此,自身反应性t细胞的存在与正常健康相容且不引起自身免疫疾病;这证实应激蛋白在个体内的安全性。应激蛋白的安全性由bcg(卡介苗,牛分枝杆菌菌株)接种疫苗的成功和相对安全性得到另外证实,所述bcg接种疫苗诱导针对应激蛋白的免疫应答,所述免疫应答还是针对结核分枝杆菌保护性的。
应激基因家族和用于在融合多肽中使用的蛋白质是本领域众所周知的,并且包括例如hsp100-200、hsp100、hsp90、lon、hsp70、hsp60、tf55、hsp40、fkbps、亲环蛋白、hsp20-30、clpp、grpe、hsp10、泛蛋白、钙联接蛋白和蛋白质二硫化物异构酶。macario,a.j.l.,coldspringharborlaboratoryres.25:59-70,1995;parsell,d.a.和lindquist,s.ann.rev.genet.27:437-496(1993);美国专利号5,232,833(sanders等人)。应激蛋白的特别组包括hsp90、hsp70、hsp60、hsp20-30,进一步优选地hsp70和hsp60。
hsp100-200例子包括grp170(用于葡萄糖调节的蛋白)。grp170位于er的腔内,在前高尔基区室中,并且可以在免疫球蛋白折叠和装配中起作用。
hsp100例子包括哺乳动物hsp110、酵母hsp104、clpa、clpb、clpc、clpx和clpy。酵母hsp104和大肠杆菌clpa形成六聚的和大肠杆菌clpb,四聚颗粒,其装配似乎需要腺嘌呤核苷酸结合。clp蛋白酶提供了由clpp(蛋白水解亚单位)和clpa组成的750kda杂寡聚体。clpb-y在结构上与clpa相关,尽管与clpa不同,它们似乎不与clpp复合。
hsp90例子包括在大肠杆菌中的htpg,酵母hsp83和hsc83,以及在人中的hsp90α、hsp90β和grp94。hsp90结合蛋白质群,所述蛋白质一般是细胞调节分子例如类固醇激素受体(例如,糖皮质激素、雌激素、孕酮和睾酮受体),转录因子和在信号转导机制中起作用的蛋白质激酶。hsp90蛋白质还参与包括其他应激蛋白的大的、丰富的蛋白质复合物的形成。
lon是在大肠杆菌中起降解非天然蛋白质的atp依赖性蛋白酶作用的四聚蛋白质。
hsp70例子包括来自哺乳动物细胞的hsp72和hsc73,来自细菌的dnak,所述细菌特别是分枝杆菌例如麻风分枝杆菌、结核分枝杆菌和牛分枝杆菌(例如卡介苗:在本文中称为hsp71),来自大肠杆菌(escherichiacoli)、酵母和其他原核生物的dnak,以及bip和grp78。hsp70能够特异性结合atp以及解折叠的多肽和肽,由此参与蛋白质折叠和解折叠以及蛋白质复合物的装配和分解。
hsp60例子包括来自分枝杆菌的hsp65。细菌hsp60通常也称为groel,例如来自大肠杆菌的groel。hsp60形成大的同寡聚复合物,并且似乎在蛋白质折叠中起关键作用。hsp60同源物存在于真核线粒体和叶绿体中。
tf55例子包括tcpl、tric和热聚体(thermosome)。该蛋白质一般存在于真核生物和一些古细菌的细胞质中,且形成多成员环、从而促进蛋白质折叠。它们还与hsp60弱同源。
hsp40例子包括来自原核生物例如大肠杆菌和分枝杆菌的dnaj以及hsj1、hdj1和hsp40。在其他细胞活性中,hsp40在蛋白质折叠、耐热性和dna复制中作为分子侣伴起作用。
fkbps例子包括fkbp12、fkbp13、fkbp25,以及fkbp59、fprl和nepl。该蛋白质一般具有肽基脯氨酸异构酶活性且与免疫抑制剂例如fk506和雷帕霉素相互作用。该蛋白质一般在细胞质和内质网(endoplasmicreticululum)中发现。
亲环蛋白例子包括亲环蛋白a、b和c。该蛋白质具有肽基脯氨酸异构酶活性且与免疫抑制剂环孢菌素a相互作用。该蛋白质环孢菌素a结合钙依赖磷酸酶(蛋白磷酸酶)。
hsp20-30也称为小hsp。hsp20-30一般在大的同寡聚复合物中,或可能地,也在其中生物或细胞类型表达几种不同类型的小hsps的杂寡聚复合物中发现。hsp20-30与细胞骨架结构相互作用,且可能在肌动蛋白的聚合/解聚中起调节作用。hsp20-30在静息细胞应激或暴露于生长因子后快速磷酸化。hsp20-30同源物包括α晶体蛋白。
clpp是牵涉于异常蛋白质降解的大肠杆菌蛋白酶。clpp的同源物在叶绿体中发现。clpp与clpa形成杂寡聚复合物。
grpe是牵涉于应激损害的蛋白质拯救以及损害蛋白质降解的约20kda的大肠杆菌蛋白质。grpe在大肠杆菌中的应激基因表达调节中起作用。
hsp10例子包括groes和cpn10。hsp10一般在大肠杆菌以及真核细胞的线粒体和叶绿体中发现。hsp10与hsp60寡聚体结合形成7成员环。hsp10也涉及蛋白质折叠。
已发现泛蛋白与通过atp依赖性胞质蛋白酶蛋白水解去除蛋白质一致结合蛋白质。
在具体实施方案中,本发明的应激蛋白得自肠道菌,分枝杆菌(特别地麻风分枝杆菌、结核分枝杆菌、母牛分枝杆菌(m.vaccae)、耻垢分枝杆菌(m.smegmatis)和牛分枝杆菌),大肠杆菌,酵母,果蝇(drosophila),脊椎动物,禽类,鸡,哺乳动物,大鼠,小鼠,灵长类动物或人。
在具体实施方案中,例如在涉及应激蛋白和改造抗体之间的化学缀合物的情况下,使用的应激蛋白是分离的应激蛋白,这意指应激蛋白已进行选择且与它们在其中生产的宿主细胞中分离。此种分离可以如本文所述且使用本领域已知的蛋白质分离的常规方法来进行。
应激蛋白可以是酸性或碱性盐的形式,或中性形式。此外,个别氨基酸残基可以通过氧化或还原进行修饰。此外,可以对氨基酸或核酸序列进行各种置换、缺失或添加,其净效应是保留或进一步增强应激蛋白的增加的生物活性。由于密码简并,例如,在编码相同氨基酸序列的核苷酸序列中可能存在相当大的变异。应激蛋白的部分或得自应激蛋白的肽可以用于融合多肽中,前提是此种部分或肽包括涉及增强免疫应答的表位。应激蛋白的部分可以通过使用蛋白酶断裂,或通过重组方法而获得,例如仅表达应激蛋白编码核苷酸序列(单独或与另一种蛋白质编码核酸序列融合)的部分。肽还可以通过此种方法或通过化学合成进行生产。应激蛋白可以包括在特定基因座上通过多种已知技术引入的突变。参见,例如,sambrook等人,molecularcloning:alaboratorymanual.2ded.,coldspringharborlaboratorypress(1989);drinkwater和klinedinstproc.natl.acad.sci.usa83:3402-3406(1986);liao和wise,gene88:107-111(1990):horwitz等人,genome3:112-117(1989)。
2.制备改造抗体-应激蛋白融合多肽的方法
还提供了用于制备改造抗体-应激蛋白融合多肽的组合物和方法。包括改造抗体和应激蛋白的融合蛋白可以通过重组方法进行生产。例如,编码应激蛋白的核酸可以与编码改造抗体的核酸序列的任一末端进行连接,从而使得2个蛋白质编码序列共享共有的翻译读框,且可以表达为包括改造抗体和应激蛋白的融合蛋白。将组合的序列插入基于所需表达特征和宿主细胞的性质选择的合适载体内。在下文中提供的例子中,核酸序列在适合于在大肠杆菌中蛋白质表达的载体中进行装配。在所选择的宿主细胞中表达后,融合蛋白可以通过常规生物化学分离技术或通过免疫亲和法使用针对融合蛋白的一个或另一部分的抗体进行纯化。可替代地,所选择的载体可以给融合蛋白序列添加标记,例如如下文呈现的实施例中描述的寡组氨酸标记,从而允许表达可以通过亲和力法进行纯化的标记的融合蛋白,使用对于标记具有合适的高亲和力的抗体或其他材料。sambrook等人,molecularcloning:alaboratorymanual,2ded.,coldspringharborlaboratorypress(1989);deutscher,m..guidetoproteinpurificationmethodsenzymology,第182卷.academicpress,inc..sandiego,ca(1990)。如果使用适合于在哺乳动物细胞中表达的载体,例如下文讨论的载体之一,那么融合蛋白可以从哺乳动物细胞中进行表达和纯化。可替代地,哺乳动物表达载体(包括融合蛋白编码序列)可以施用于受试者,以指导改造抗体-应激蛋白融合多肽在受试者的细胞中的表达。编码改造抗体-应激蛋白融合多肽的核酸还可以以化学方法生产,且随后插入合适的载体内用于融合蛋白生产和纯化或施用于受试者。最后,融合蛋白还可以以化学方法制备。
用于制备融合基因的技术是本领域众所周知的。基本上,编码不同多肽序列的各种dna片段的连接依照常规技术来进行,利用平端或交错末端用于连接,限制酶消化以提供合适的末端,适当地补平粘性末端,碱性磷酸酶处理以避免不合需要的连接,和酶促连接。在另一个实施方案中,融合基因可以通过常规技术包括自动化dna合成仪来合成。可替代地,基因片段的pcr扩增可以使用锚定引物来进行,这产生在2个连续基因片段之间的互补突出端,所述互补突出端随后可以进行退火以产生嵌合基因序列(参见,例如currentprotocolsinmolecularbiology,编辑ausubel等人,johnwiley&sons:1992)。因此,提供了包含编码至少一种改造抗体的基因和编码至少一种应激蛋白的基因的融合基因的分离核酸。
核酸可以在包含核苷酸序列的载体中提供,所述核苷酸序列编码改造抗体-应激蛋白融合多肽,且与至少一种调节序列可操作地连接。应当理解表达载体的设计可以依赖于此种因素,如待转化的宿主细胞的选择和/或需要表达的蛋白质类型。应考虑载体的拷贝数,控制拷贝数的能力,和由载体编码的任何其他蛋白质例如抗生素标记的表达。此种载体可以在任何生物学活性的载体中施用,例如能够先体外后体内或体内用编码嵌合多肽的遗传材料有效转染细胞的任何制剂或组合物。方法包括将核酸插入病毒载体中,包括重组逆转录病毒、腺病毒、腺伴随病毒、人免疫缺陷病毒、和单纯疱疹病毒-1,或重组细菌或真核质粒。病毒载体可以用于直接转染细胞;质粒dna可以借助于例如阳离子脂质体(lipofectin)或衍生的(例如,抗体缀合的)、聚赖氨酸缀合物、短杆菌肽s、人工病毒被膜或其他此种细胞内载体单独进行递送。核酸还可以直接进行注射。可替代地,可以进行磷酸钙沉淀以促进核酸进入细胞内。
主题核酸可以用于引起改造抗体-应激蛋白融合多肽在培养中繁殖的细胞中的表达和超表达,例如以生产融合蛋白或多肽。
还提供了用重组基因转染的宿主细胞,以表达改造抗体-应激蛋白融合多肽。宿主细胞可以是任何原核或真核细胞。例如,改造抗体-应激蛋白融合多肽可以在细菌细胞例如大肠杆菌、昆虫细胞(杆状病毒)、酵母、昆虫、植物或哺乳动物细胞中表达。在宿主细胞是人时的那些情况下,它可以在或不在活受试者中。其他合适的宿主细胞是本领域技术人员已知的。此外,宿主细胞可以补加在宿主中一般未发现的trna分子,以便最优化多肽的表达。适合于使融合多肽的表达最大化的其他方法将是本领域技术人员已知的。
细胞培养物包括宿主细胞、培养基和其他副产品。用于细胞培养的合适培养基是本领域众所周知的。融合多肽可以由包含多肽的细胞和培养基的混合物分泌和分离。可替代地,融合多肽可以保留在细胞质中,并且收获细胞、裂解和分离蛋白质。融合多肽可以使用本领域已知的用于纯化蛋白质的技术从细胞培养基、宿主细胞或两者中进行分离,所述技术包括离子交换层析、凝胶过滤层析、超滤、电泳和使用对融合物的特定表位特异的抗体的免疫亲和纯化。
因此,编码所有或部分改造抗体-应激蛋白融合多肽的核苷酸序列可以用于经由微生物或真核细胞过程生产重组形式的蛋白质。将序列连接到多核苷酸构建体例如表达载体内,且转化或转染到真核(酵母、禽类、昆虫或哺乳动物)或原核(细菌细胞)宿主内是标准程序。类似程序或其修改可以用于依照本发明通过微生物方法或组织培养技术制备重组融合多肽。
用于生产重组蛋白质的表达媒介物包括质粒和其他载体。例如,用于表达融合多肽的合适载体包括下述类型的质粒:用于在原核细胞例如大肠杆菌中表达的pbr322-衍生的质粒、pembl-衍生的质粒、pex-衍生的质粒、pbtac-衍生的质粒和puc-衍生的质粒。
在另一个实施方案中,核酸是与细菌启动子可操作地连接的改造抗体-应激蛋白融合多肽,例如在inouye等人(1985)nucl.acidsres.13:3101中描述的厌氧大肠杆菌nirb启动子或大肠杆菌脂蛋白llp启动子;沙门氏菌属(salmonella)pagc启动子(miller等人,同上),志贺氏菌属(shigella)ent启动子(schmitt和payne,j.bacteriol.173:816(1991)),在tn10上的tet启动子(miller等人,同上),或霍乱弧菌(vibriocholera)的ctx启动子。可以使用任何其他启动子。细菌启动子可以是组成型启动子或诱导型启动子。示例性诱导型启动子是可通过铁或铁限制条件诱导的启动子。事实上,一些细菌例如细胞内生物被认为在宿主细胞质中遇到铁限制条件。fepa和tonb的铁调节的启动子的例子是本领域已知的,且在例如下述参考文献中得到描述:headley,v.等人(1997)infection&immunity65:818;ochsner,u.a.等人(1995)journalofbacteriology177:7194;hunt,m.d.等人(1994)journalofbacteriology176:3944;svinarich,d.m.和s.palchaudhuri.(1992)journalofdiarrhoealdiseasesresearch10:139;prince,r.w.等人(1991)molecularmicrobiology5:2823;goldberg,m.b.等人(1990)journalofbacteriology172:6863;delorenzo,v.等人(1987)journalofbacteriology169:2624;和hantke,k.(1981)molecular&generalgenetics182:288。
质粒优选包含核酸在细菌中合适转录所需的序列,例如转录终止信号。载体可以进一步包含编码允许选择包含目的核酸的细菌的因子的序列,例如编码提供针对抗生素抗性的蛋白质的基因,核酸扩增所需的序列,例如细菌复制起点。
在另一个实施方案中,将信号肽序列加入构建体中,从而使得融合多肽从细胞中分泌。此种信号肽是本领域众所周知的。
在一个实施方案中,由大肠杆菌rna聚合酶识别的有力的噬菌体t5启动子与lac操纵基因阻遏模块一起使用,以提供在大肠杆菌中紧密调节的、高水平表达或重组蛋白质。在这个系统中,蛋白质表达在高水平的lac阻遏物的存在下被阻断。
在一个实施方案中,dna与第一种启动子可操作地连接,且细菌进一步包含编码第一种聚合酶的第二种dna,所述第一种聚合酶能够介导从第一种启动子的转录,其中编码第一种聚合酶的dna与第二种启动子可操作地连接。在优选实施方案中,第二种启动子是细菌启动子,例如上文描述的那些。在甚至更加优选的实施方案中,聚合酶是噬菌体聚合酶,例如sp6、t3或t7聚合酶,且第一种启动子是噬菌体启动子,例如分别为sp6、t3或t7启动子。包含噬菌体启动子的质粒和编码噬菌体聚合酶的质粒可以例如从promegacorp.(madison,wis.)和invitrogen(sandiego,calif.)商业上获得,或可以使用标准重组dna技术直接从噬菌体获得(j.sambrook,e.fritsch,t.maniatis,molecularcloning:alaboratorymanual,coldspringlaboratorypress,1989)。噬菌体聚合酶和启动子在例如下述参考文献中得到进一步描述:sagawa,h.等人(1996)gene168:37;cheng,x.等人(1994)pnasusa91:4034;dubendorff,j.w.和f.w.studier(1991)journalofmolecularbiology219:45;bujarski,j.j.和p.kaesberg(1987)nucleicacidsresearch15:1337;和studier,f.w.等人(1990)methodsinenzymology185:60)。此种质粒可以根据待表达的改造抗体-应激蛋白融合多肽的具体实施方案进一步修饰。
在另一个实施方案中,细菌进一步包含编码第二种聚合酶的dna,所述第二种聚合酶能够介导从第二种启动子的转录,其中编码第二种聚合酶的dna与第三种启动子可操作地连接。第三种启动子可以是细菌启动子。然而,超过2种不同的聚合酶和启动子可以引入细菌中,以获得高水平的转录。用于介导细菌中的转录的一种或多种聚合酶的使用可以提供细菌中多肽量相对于其中dna直接在细菌启动子的控制下的细菌的显著增加。采用的系统的选择将依赖于具体用途而变,例如人们希望生产的蛋白质的量。
一般地,编码融合多肽的核酸例如通过转染引入宿主细胞内,且宿主细胞在允许表达融合多肽的条件下进行培养。将核酸引入原核和真核细胞内的方法是本领域众所周知的。用于哺乳动物和原核宿主细胞培养的合适培养基是本领域众所周知的。一般地,编码主题融合多肽的核酸在诱导型启动子的控制下,其在包含核酸的宿主细胞一旦已分裂一定次数就被诱导。例如,当核酸在β半乳糖操纵基因和阻遏物的控制下时,当细菌宿主细胞已达到约od6000.45-0.60的密度时,将异丙基β-d-硫代吡喃型半乳糖苷(iptg)加入培养物中。培养物随后生长一些更多的时间以给予宿主细胞合成多肽的时间。在多肽分离和纯化前,培养物随后一般进行冷冻且可以冷冻贮藏一些时间。
当使用原核宿主细胞时,宿主细胞可以包括表达内部t7溶菌酶的质粒,所述t7溶菌酶例如由质粒plyssl表达(参见实施例)。此种宿主细胞的裂解释放溶菌酶,所述溶菌酶随后降解细菌膜。
可以包括在载体中用于在细菌或其他原核细胞中表达的其他序列包括合成的核糖体结合位点;强转录终止子,例如来自噬菌体λ的t0,和来自大肠杆菌中rrnb操纵子的t4,以阻止连读转录且确保表达的多肽的稳定性;复制起点,例如cole1;和赋予氨苄青霉素抗性的β内酰胺酶基因。
其他宿主细胞包括原核宿主细胞。甚至更加优选的宿主细胞是细菌,例如大肠杆菌。可以使用的其他细菌包括志贺氏菌属物种(shigellaspp.),沙门氏菌属物种(salmonellaspp.),利斯特氏菌属物种(listeriaspp.),立克次氏体属物种(rickettsiaspp.),耶尔森氏菌属物种(yersiniaspp.),埃希氏菌属物种(escherichiaspp.),克雷伯氏菌属物种(klebsiellaspp.),博德特氏菌属物种(bordetellaspp.),奈瑟氏球菌属物种(neisseriaspp.),气单胞菌属物种(aeromonasspp.),弗朗西斯氏菌属物种(franciesellaspp.),棒杆菌属物种(corynebacteriumspp.),柠檬酸杆菌属物种(citrobacterspp.),衣原体属物种(chlamydiaspp.),嗜血菌属物种(hemophilusspp.),布鲁氏菌属物种(brucellaspp.),分枝杆菌属物种,军团菌属物种(legionellaspp.),红球菌属物种(rhodococcusspp.),假单胞菌属物种(pseudomonasspp.),螺杆菌属物种(helicobacterspp.),弧菌属物种(vibriospp.),芽孢杆菌属物种(bacillusspp.)和丹毒丝菌属物种(erysipelothrixspp.)。大多数这些细菌可以得自美国典型培养物保藏中心(atcc;10801universityblvd.,manassas,va20110-2209)。
存在用于在酵母中表达重组蛋白质的许多载体。例如,yep24、yip5、yep51、yep52、pyes2和yrp17是用于将遗传构建体引入啤酒糖酵母(s.cerevisiae)内的克隆和表达媒介物(参见,例如broach等人,(1983)inexperimentalmanipulationofgeneexpression,编辑m.inouyeacademicpress,第83页)。由于pbr322ori的存在这些载体可以在大肠杆菌中复制,且由于酵母2μm质粒的复制决定簇可以在啤酒糖酵母中复制。此外,可以使用药物抗性标记例如氨苄青霉素。
在某些实施方案中,哺乳动物表达载体包含原核序列以促进载体在细菌中的繁殖,和在真核细胞中表达的一种或多种真核转录单位。pcdnai/amp、pcdnai/neo、prc/cmv、psv2gpt、psv2neo、psv2-dhfr、ptk2、prsvneo、pmsg、psvt7、pko-neo和phyg衍生的载体是适合于转染真核细胞的哺乳动物表达载体的例子。这些载体中的一些用来自细菌质粒例如pbr322的序列进行修饰,以促进在原核和真核细胞中的复制和药物抗性选择。可替代地,病毒衍生物例如牛乳头瘤病毒(bpv-1)、或eb病毒(phebo、prep衍生的和p205)可以用于在真核细胞中瞬时表达蛋白质。用于制备质粒和转化宿主生物的各种方法是本领域众所周知的。对于用于原核和真核细胞的其他合适的表达系统,以及一般的重组程序,参见molecularcloningalaboratorymanual,第2版由sambrook,fritsch和maniatis编辑(coldsprinaharborlaboratorypress,1989)第16和17章。在一些情况下,可能需要通过使用杆状病毒表达系统来表达重组蛋白质。此种杆状病毒表达系统的例子包括pvl-衍生的载体(例如pvl1392、pvl1393和pvl941),pacuw-衍生的载体(例如pacuw1),和pbluebac-衍生的载体(例如包含β-gal的pbluebaciii)。
在另一种变化中,蛋白质生产可以使用体外翻译系统来完成。体外翻译系统一般是作为包含将rna分子翻译成蛋白质所必需的至少最低限度元件的无细胞提取物的翻译系统。体外翻译系统一般包含至少核糖体,trnas,起始子甲硫氨酰-trnamet,涉及翻译的蛋白质或复合物,例如eif2、eif3,包含帽结合蛋白(cbp)和真核起始因子4f(eif4f)的帽结合(cb)复合物。多种体外翻译系统是本领域众所周知的,并且包括商购可得试剂盒。体外翻译系统的例子包括真核裂解物,例如兔网织红细胞裂解物、兔卵母细胞裂解物、人细胞裂解物、昆虫细胞裂解物和麦胚提取物。裂解物是从厂商例如promegacorp.,madison,wis.;stratagene,lajolla,calif.;amersham,arlingtonheights,ill.;和gibco/brl,grandisland,n.y.商购可得的。体外翻译系统一般包含大分子,例如酶,翻译、起始和延伸因子,化学试剂和核糖体。此外,可以使用体外转录系统。此种系统一般包含至少rna聚合酶全酶,核糖核苷酸和任何必需转录起始、延伸和终止因子。用于体外翻译的rna核苷酸可以使用本领域已知的方法来生产。体外转录和翻译可以在单罐反应中偶联,以由一种或多种分离的dnas生产蛋白质。
当需要表达多肽的羧基末端片段,即平截突变体时,可能必须给包含待表达的所需序列的寡核苷酸片段添加起始密码子(atg)。本领域众所周知的是在n末端位置上的甲硫氨酸可以通过使用甲硫氨酸氨肽酶(map)进行酶促切割。map已从大肠杆菌(ben-bassat等人,(1987)j.bacteriol.169:751-757)和鼠伤寒沙门氏菌中得到克隆,并且它的体外活性已在重组蛋白质上得到证实(miller等人,(1987)pnasusa84:2718-1722)。因此,若需要,n末端甲硫氨酸的去除可以通过在生产map的宿主(例如大肠杆菌或cm89或啤酒糖酵母)中表达此种重组多肽在体内地,或通过使用纯化的map(例如miller等人的程序)在体外地完成。
在其中使用植物表达载体的情况下,改造抗体-应激蛋白融合多肽的表达可以由许多启动子中的任何一种来驱动。例如,可以使用病毒启动子例如camv的35srna和19srna启动子(brisson等人,1984,nature,310:511-514),或tmv的外壳蛋白启动子(takamatsu等人,1987,emboj.,6:307-311);可替代地,可以使用植物启动子例如rubisco的小亚基(coruzzi等人,1994,emboj.,3:1671-1680;broglie等人,1984,science,224:838-843);或热激启动子,例如大豆hsp17.5-e或hsp17.3-b(gurley等人,1986,mol.cell.biol.,6:559-565)。这些构建体可以使用ti质粒,ri质粒,植物病毒载体;直接dna转化;显微注射,电穿孔等引入植物细胞内。关于此种技术的综述,参见例如weissbach和weissbach,1988,methodsforplantmolecularbiology,academicpress,newyork,sectionviii,pp.421-463;和grierson和corey,1988,plantmolecularbiology,第2版,blackie,london,第7-9章。
可以用于表达多肽标记或包含多肽标记的融合蛋白的可替代表达系统是昆虫系统。在一种此种系统中,苜蓿丫纹夜蛾(autographacalifornica)核型多角体病毒(acnpv)用作载体以表达外来基因。该病毒在草地夜蛾(spodopterafrugiperda)细胞中生长。pghs-2序列可以克隆到病毒的非必需区(例如多角体蛋白基因)中且置于acnpv启动子(例如多角体蛋白启动子)的控制下。编码序列的成功插入将导致多角体蛋白基因的灭活和非包含体型重组病毒(即,缺乏由多角体蛋白基因编码的蛋白质外壳的病毒)的生产。这些重组病毒随后用于感染其中表达插入的基因的草地夜蛾细胞(例如,参见smith等人,1983,j.virol.,46:584,smith,美国专利号4,215,051)。
在昆虫系统的具体实施方案中,将编码改造抗体-应激蛋白融合多肽的dna克隆到pbluebaciii重组转移载体(invitrogen,sandiego,calif.)内多角体蛋白启动子的下游,且转染到sf9昆虫细胞(衍生自草地夜蛾卵巢细胞,可从invitrogen,sandiego,calif.获得)内,以产生重组病毒。重组病毒噬斑纯化后,制备依次将用于感染sf9或highfivetm(衍生自粉纹夜蛾(trichoplusiani)卵细胞匀浆的bti-tn-5b1-4细胞;可从invitrogen,sandiego,calif.获得)昆虫细胞的高效价病毒原液,以产生大量适当地翻译后修饰的主题多肽。
在其他实施方案中,改造抗体和应激蛋白分开生产且随后彼此进行连接,例如共价连接。例如,改造抗体和应激蛋白在体外分开生产、纯化、和在标记将能够与目的多肽连接的条件下混合在一起。例如,应激蛋白和/或改造抗体可以从它已知存在的来源获得(分离),可以由细胞培养进行生产和收获,可以通过克隆和表达编码所需应激蛋白或改造抗体的基因进行生产,或可以酶促合成。此外,编码所需应激蛋白或改造抗体的核酸序列可以化学合成。缀合蛋白质的此种混合物可以具有不同于单个融合蛋白的性质。
接头(也称为“接头分子”或“交联剂”)可以用于使改造抗体和应激蛋白缀合。接头包括能够与几种通常为2种分子的限定的化学基团反应,且因此使其缀合的化学制剂。大多数已知交联剂与胺、羧基和巯基反应。靶化学基团的选择是关键的,如果基团可能涉及待缀合多肽的生物活性的话。例如,与巯基反应的马来酰亚胺可能灭活需要cys以与靶结合的包含cys的肽或蛋白质。接头可以是同功能的(包含相同类型的反应基团)、异功能的(包含不同的反应基团)、或光反应性的(包含在照射后变得反应性的基团)。
接头分子可能负责缀合组合物的不同性质。接头的长度应根据在缀合步骤期间的分子柔性,和缀合分子对于其靶(细胞表面分子等)的可用性加以考虑。较长的接头因此可以改善本发明的组合物的生物活性,及其制备的容易性。接头的几何结构可以用于使分子定向用于与靶的最佳反应。具有柔性几何结构的接头可以允许交联多肽在它们结合其他多肽时构象上适应。接头的性质可以对于其他各种目的进行改变。例如,发现mbus的芳基结构的免疫原性比mbs的芳族间隔基小。此外,接头分子的疏水性和功能性可以受组分分子的物理性质的控制。例如,聚合接头的疏水性可以受沿着聚合物的单体单元顺序的控制,例如其中存在散布亲水单体嵌段的疏水单体嵌段的嵌段聚合物。
制备和利用广泛多样的分子接头的化学是本领域众所周知的,并且用于在缀合分子中使用的许多预制接头可从厂商例如piercechemicalco.,rochemolecularbiochemicals,unitedstatesbiological等商购可得。
3.使用改造抗体-应激蛋白融合多肽和对其适合的组合物的方法
本文描述的改造抗体-应激蛋白融合多肽可以施用于受试者以增强受试者的针对细胞的免疫应答,特别是细胞介导的细胞溶解应答,所述细胞表达融合多肽的改造抗体结构域针对的抗原。融合多肽可以仅增强免疫应答(因此充当免疫原性组合物),或赋予保护性免疫(因此充当疫苗)。
因此,如上所述生产的改造抗体-应激蛋白融合多肽可以纯化至合适的纯度用于用作药物组合物。一般地,纯化的组合物将具有包含组合物中存在的所有种类的超过约85%,存在的所有种类的超过约85%、90%、95%、99%或更多的一个种类。目标种类可以纯化至基本同质性(污染种类通过常规检测法无法在组合物中检测到),其中组合物基本上由单一种类组成。技术人员可以依照本发明的教导使用用于蛋白质纯化的标准技术纯化改造抗体-应激蛋白融合多肽,例如免疫亲和层析、尺寸排阻层析等。多肽的纯度可以通过本领域技术人员已知的许多方法进行测定,包括例如氨基末端氨基酸序列分析、凝胶电泳和质谱分析法分析。
因此,提供了包含上述改造抗体-应激蛋白融合多肽的药物组合物。在一个方面,提供了药学上可接受的组合物,其包含与一种或多种药学上可接受的载体(添加剂)和/或稀释剂一起配制的,治疗有效量的一种或多种上文描述的化合物。在另一个方面,在某些实施方案中,化合物可以照那样或与药学上可接受的载体混合施用,或还可以与其他试剂结合施用。结合(组合)疗法因此包括活性化合物的顺次、同时和分开、或共施用,其方式为当后续的施用时,第一种施用的活性化合物的疗效尚未完全消失。
本文描述的改造抗体-应激蛋白融合多肽可以以多种方式施用于受试者。施用途径包括真皮内、经皮(例如,缓释聚合物)、肌内、腹膜内、静脉内、皮下、经口、硬膜外和鼻内途径。可以使用任何其他常规施用途径,例如输注或弹丸注射,或通过上皮或粘膜皮肤衬料吸收。此外,本文描述的组合物可以包含其他药学上可接受的组分,且与之一起施用,例如生物学活性剂(例如佐剂例如明矾(alum))、表面活性剂(例如甘油酯)、赋形剂(例如,乳糖)、载体、稀释剂和媒介物。此外,组合物可以作为刺激得自受试者的白细胞的手段先体外后体内使用,以在体外引发、扩增和繁殖随后重新引入受试者内的抗原特异性免疫细胞。
此外,改造抗体-应激蛋白融合多肽可以通过体内表达编码此种蛋白质序列的核酸而施用到人受试者内。此种核酸的表达还可以作为刺激得自受试者的白细胞的手段来先体外后体内完成,以在体外引发、扩增和繁殖随后重新引入受试者内的抗原特异性免疫细胞。适合于指导改造抗体-应激蛋白融合多肽表达的表达载体可以选自本领域常用的大量各种载体。优选的将是能够生产高水平的表达以及在目的基因转导中有效的载体。例如,可以使用重组腺病毒载体pjm17(all等人,genetherapy1:367-84(1994);berknerk.l.,biotechniques6:616-241988),第二代腺病毒载体de1/de4(wang和finer,naturemedicine2:714-6(1996)),或腺伴随病毒载体aav/neo(muro-cacho等人,j.immunotherapy11:231-7(1992))。此外,可以使用重组逆转录病毒载体mfg(jaffee等人,cancerres.53:2221-6(1993))或ln、lnsx、lncx、lxsn(miller和rosman,biotechniques7:980-9(1989))。基于单纯疱疹病毒的载体例如phsv1(geller等人,proc.nat′lacad.sci.87:8950-4(1990),或痘苗病毒载体例如mva(sutter和moss.proc.nat′lacad.sci.89:10847-51(1992))可以充当可替代物。
包括启动子和3′序列的常用的特定表达单位是在质粒cdna3(invitrogen)、质粒ah5、prc/cmv(invitrogen)、pcmuii(paabo等人,emboj.5:1921-1927(1986))、pzip-neosv(cepko等人,cell37:1053-1062(1984))和psra(dnax、paloalto,ca)中发现的那些。基因引入表达单位和/或载体内可以使用遗传工程技术来完成,如手册如molecularcloningandcurrentprotocolsinmolecularbiology(sambrook,j.等人,molecularcloning,coldspringharborpress(1989);ausubel,f.m.等人,currentprotocolsinmolecularbiology,greenepublishingassociatesandwiley-interscience(1989))中描述的。所得到的可表达的核酸可以通过能够将核酸以可表达形式置于细胞内的任何方法引入人受试者的细胞内,例如作为如上所述的病毒载体的部分,作为裸质粒或其他dna,或被囊化在靶向的脂质体或红细胞血影中(friedman,t.,science,244:1275-1281(1989);rabinovich,n.r.等人,science.265:1401-1404(1994))。转导方法包括直接注射到组织和肿瘤内,脂质体转染(fraley等人,nature370:111-117(1980)),受体介导的胞吞作用(zatloukal等人,ann.n.y.acad.sci.660:136-153(1992)),和粒子轰击介导的基因转移(eisenbraun等人,dna&cell.biol.12:791-797(1993))。
在本发明的组合物中的改造抗体-应激蛋白融合多肽(如上文所讨论的融合、缀合或非共价连接的)的量是在受试者中产生有效的免疫刺激应答的量。有效量是这样的量,从而使得当施用时,它诱导免疫应答。此外,施用于受试者的改造抗体-应激蛋白融合多肽的量将依赖于多种因素而变,包括使用的改造抗体和应激蛋白,受试者的大小、年龄、体重、一般健康、性别和饮食及其一般的免疫学反应性。确立的剂量范围的调整和操作完全在本领域技术人员的能力内。例如,改造抗体-应激蛋白融合多肽的量可以为约1微克-约1克,优选地约100微克-约1克,和约1毫克-约1克。包含表达载体的有效量的组合物是这样的量,从而使得当施用时,它诱导针对改造抗体所针对的抗原的免疫应答。此外,施用于受试者的表达载体的量将依赖于多种因素而变,包括表达的改造抗体和应激蛋白,受试者的大小、年龄、体重、一般健康、性别和饮食及其一般的免疫学反应性。需要考虑的另外因素是应用途径和使用的载体类型。例如,当预防或治疗性治疗用包含编码改造抗体-应激蛋白融合多肽的核酸的病毒载体来进行时,有效量将是104-1012无辅助病毒、复制缺陷型病毒/kg体重,优选地105-1011病毒/kg体重,和更优选地106-1010病毒/kg体重。
用于在受试者中诱导免疫应答的有效量的融合多肽的测定完全在本领域技术人员能力内,特别是根据本发明提供的详细公开内容。
有效剂量可以最初由体外测定进行评估。例如,剂量可以使用本领域众所周知的技术配制到动物模型中,以达到免疫应答的诱导。基于动物数据本领域技术人员可以容易地最优化对人的施用。剂量的量和间隔可以个别调整。例如,当用作疫苗时,本发明的多肽和/或菌株可以以约1-3剂于1-36周时间段施用。优选地,以约3-4个月的间隔施用3剂,和加强接种疫苗可以在其后定期给予。替代规程对于个别患者可能是合适的。合适的剂量是当如上所述施用时能够在被免疫的患者中产生免疫应答的多肽或菌株的量,所述免疫应答足以保护受试者至少1-2年免于状况或感染。
组合物还可以包括佐剂以增强免疫应答。此外,此种蛋白质可以进一步悬浮在油乳剂中,以引起蛋白质注射后在体内的较缓慢释放。制剂中的每种组分的最适比率可以通过本领域技术人员众所周知的技术进行测定。
多种佐剂中的任何一种都可以用于本发明的疫苗中以增强免疫应答。大多数佐剂包含设计为保护抗原不受快速分解代谢的物质,例如氢氧化铝或矿物油,以及免疫应答的特异性或非特异性刺激物,例如脂质a,或百日咳博德特氏菌(bortadellapertussis)。合适的佐剂是商购可得的,并且包括例如弗氏不完全佐剂和弗氏完全佐剂(difcolaboratories)和merckadjuvant65(merckandcompany,inc.,rahway,n.j.)。其他合适的佐剂包括明矾、生物可降解的小球体,单磷酰脂质a、quila、sbas1c、sbas2(ling等人,1997,vaccine15:1562-1567)、sbas7、al(oh)3和cpg寡核苷酸(wo96/02555)。
在本发明的疫苗中,佐剂可以包括th1型免疫应答。合适的佐剂系统包括例如单磷酰脂质a,优选地3-脱-o-酰单磷酰脂质a(3d-mpl)连同铝盐的组合。增强的系统涉及单磷酰脂质a和皂苷衍生物的组合,特别地如wo94/00153中公开的3d-mlp和皂苷qs21的组合,或如wo96/33739中公开的其中qs21用胆固醇猝灭的反应原性(reactogenic)较小的组合物。先前实验已证实3d-mlp和qs21的组合在诱导体液和th1型细胞免疫应答中明确的协同效应。涉及在水包油乳剂中的qs21、3d-mlp和生育酚的特别有效的佐剂制剂在wo95/17210中得到描述且可以包含制剂。
4.试剂盒
本发明提供了用于表达改造抗体-应激蛋白融合多肽的试剂盒。此种试剂盒可以包含编码改造抗体-应激蛋白融合多肽的核酸。核酸可以包括在质粒或载体内,例如细菌质粒或病毒载体。其他试剂盒包含改造抗体-应激蛋白融合多肽。此外,本发明提供了用于生产和/或纯化改造抗体-应激蛋白融合多肽的试剂盒。
本发明提供了用于预防或治疗患者中的传染性、炎性、自身免疫性或恶性病的试剂盒。例如,试剂盒可以包含如上所述的一种或多种药物组合物,和任选地关于其使用的说明书。在另外其他的实施方案中,本发明提供了包含一种多种药物组合物和用于实现此种组合物的施用的一种或多种设备的试剂盒。
试剂盒组分可以包装用于前述方法的手工或部分或全部自动化实践。在涉及试剂盒的其他实施方案中,可以提供关于其使用的说明书。
实施例
本发明现在进行一般描述,通过参考下述实施例将更容易对其进行理解,所述实施例仅为了举例说明本发明的某些方面和实施方案的目的而包括,并且不意欲以任何方式限制本发明。
除非另有说明,本发明的实践将使用细胞生物学、细胞培养、分子生物学、转基因生物学、微生物学、重组dna、和免疫学的常规技术,其在本领域的技术内。此种技术在文献中得到描述。参见例如,molecularcloningalaboratorymanual,第2版,sambrook,fritsch和maniatis编辑(coldspringharborlaboratorypress:1989);dnacloning,第i和ii卷(d.n.glover编辑1985);oligonucleotidesynthesis(m.j.gait编辑,1984);mullis等人美国专利号:4,683,195;nucleicacidhybridization(b.d.hames和s.j.higgins编辑1984);transcriptionandtranslation(b.d.hames和s.j.higgins编辑1984);cultureofanimalcells(r.i.freshney,alanr.liss,inc.,1987);immobilizedcellsandenzymes(irlpress,1986);b.perbal,apracticalguidetomolecularcloning(1984);thetreatise,methodsinenzymology(academicpress,inc.,n.y.);genetransfervectorsformammaliancells(j.h.miller和m.p.calos编辑,1987,coldspringharborlaboratory);methodsinenzymology,第154和155卷(wu等人编辑),immunochemicalmethodsincellandmolecularbiology(mayer和walker,编辑,academicpress,london,1987);handbookofexperimentalimmunology,volumesi-iv(d.m.weir和c.c.blackwell,编辑,1986);manipulatingthemouseembryo,(coldspringharborlaboratorypress,coldspringharbor,n.y.,1986)。
实施例1:mab-hsp70缀合物的构建和使用缀合物的免疫接种
长14个氨基酸的misr2肽(seqidno3:nanyshlppsgnrg)由于其稳定性、亲水性以及与小鼠misr2的相似性进行选择。肽使用25%戊二醛与hsp70进行缀合。balb/c小鼠以100μgmisr肽-hsp70缀合物以2周间隔2次免疫到爪垫内。使免疫淋巴结细胞与sp2/0骨髓瘤细胞融合。上清液通过间接elisa使用misr肽或misr-hsp70融合蛋白或纯hsp70进行筛选。将阳性物克隆2-4次并在小鼠进行繁殖用于腹水。
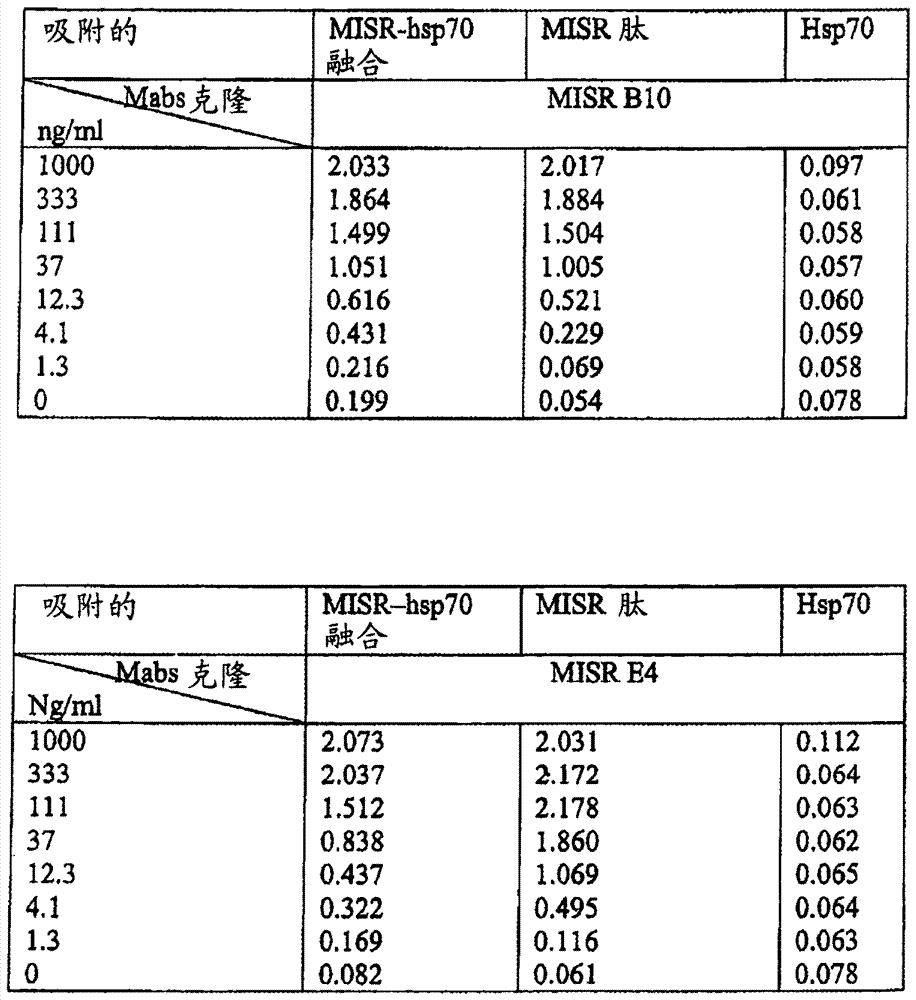
抗体通过复盐沉淀使用硫酸铵从腹水中进行纯化。抗体在paag电泳中在变性条件下进行测试(图3)。抗体在间接elisa中就与misr-hsp70缀合物、misr肽或hsp70结合进行测试。结果显示于图4中。
预示实施例#1:包含scfv和hsp70的tandab
图1描述了包含四价tandab(改造抗体)和hsp70(应激蛋白)的示例性改造抗体-应激蛋白融合多肽。四价tandabs基本上如wo99/57150,us20050089519和kipriyanov等人,1999,j.mol.biol.293:41-56中所述进行制备,所有这些参考文献都特别引入本文作为参考。简言之,编码包含4个抗体可变结构域的单链分子的构建体可以另外掺入应激蛋白基因例如hsp70。可替代地,包含4个抗体可变结构域的单链分子可以分开生产,且随后与应激蛋白例如hsp70进行连接,例如共价连接。
预示实施例#2:scfv在大肠杆菌中的生产
大肠杆菌菌株gx6712(fgalk2rsplci857)和质粒pgx8773可以得自genexcorp(gaithersburg,md)。表达载体pgx8773成功地编码与ompa信号序列融合的单链抗体构建体,且包含结构域间接头。接头是里氏木霉(trichodermareesi)的柔性接头肽。表达载体ply3编码与ompa信号序列融合的scfvvh和vl基因,其中vh和vl结构域由接头栓系。表达载体利用杂交ol/prλ(lamba)启动子,其中蛋白质表达在大肠杆菌gx6712中由从30℃到42℃的温度变动来起始(mallender和voss,j.biol.chem(1994)269:199-206)。
scfv可以分别表达且随后与hsp70栓系,或scfv可以如本说明书自始至终和下文实施例3中描述的掺入融合多肽内。
预示实施例#3:结核分枝杆菌hsp70-scfv融合物在大肠杆菌中的生产
结核分枝杆菌hsp70与scfv的融合物可以如下在大肠杆菌中生产:
i.生产蛋白质scfv和dnak(hsp70)结核分枝杆菌的大肠杆菌菌株的特性
大肠杆菌菌株dlt1270依靠用d1-转导将基因lac1整合到染色体内由dh10a产生。dh10a的基因型如下:dh10b(arad139δ(ara,leu)7697δ(lac)x74galugalkrpsldeorφ801aczdm15endalnupgrecalmcraδ(mrrhsdrmsmcran))。关于dh10b的参考文献,参见grant,s.,g.,等人proc.natl.acad.sci.usa(1990)87:4645-4649。
ii质粒的特性
作为载体,可以使用质粒“qiagen”pqe-30(“qiagen”productguide,www.qiagen.com)。
iii.scfv目的基因的序列在重组载体dnak内的克隆
关于克隆,可以使用先前获得的载体pqe30-dnak-y。重组质粒pqe30-e711-dnak通过允许表达在n末端与序列6his融合的蛋白质dnak来生产杂种蛋白质6his-e7(类型11)-dnak。具有正确方向的重组产物已使用限制酶切分析进行鉴定。scfv目的基因(例如来自如上所述的载体pgx8773和/或使用pcr扩增的)可以通过限制酶切消化与来源切开且用pqe30-dnak-y质粒在bamhi位点上克隆。
iv.用于培养生产蛋白质scfv和dnak(hsp70)结核分枝杆菌的菌株的规程
对于培养,营养培养基luria-bertani(lb)可以在蒸馏水中进行制备,并且它的ph用naoh或柠檬酸调整至7.5。培养基应在高压灭菌器中以1atm灭菌40分钟。当培养基已冷却至40℃时,可以无菌加入氨苄青霉素至50μg/ml的终浓度。具有琼脂的培养基可以无菌转移至培养皿。
生产菌株随后加入新鲜制备的具有琼脂的培养基lb中。培养皿可以置于恒温器中且于37℃温育过夜以允许培养物生长。对于夜间培养物的制备,所需量的lb培养基可以在锥形瓶中进行制备。将培养基转移至耐热的锥形瓶内,从而使得量不超过瓶体积的1/4。大肠杆菌的分离的菌落可以从培养皿中转移且接种到锥形瓶中。将瓶置于热摇动器(thermoshaker)中且于37℃以50rev/分钟温育过夜。
v.dlt1270-pqe30-scfv-dnak的发酵
杂种肽scfv-dnak的合成可以通过将iptg加入培养物中进行诱导。在lb培养基中生长的过夜培养物dlt1270/pqe30-scfv-dnak可以1:100稀释且在lb培养基中生长至od600=0.5。加入0.1mmiptg且培养继续3小时。培养物的密度可以使用分光光度计进行测量。在发酵结束后,生物量可以通过在3000xg下于4℃离心15分钟进行收集。蛋白质的产生随后可以为在聚丙烯酰胺凝胶中电泳。
当量
本发明尤其提供了改造抗体-应激蛋白融合多肽。虽然本发明的具体实施方案已得到讨论,但上述说明书是举例说明性的而不是限制性的。在回顾本说明书后,本发明的许多变化将对本领域技术人员是显而易见的。附加权利要求不意欲要求保护所以此种实施方案和变化,并且本发明的全部范围应通过参考权利要求,连同其等同方案的全部范围,和说明书,连同此种变化进行确定。
参考文献
整体引入作为参考的是任何多核苷酸和多肽序列,其参考关于在环球网ncbi.nlm.nih.gov上的国家生物技术信息中心(nationalcenterforbiotechnologyinformation)(ncbi)的公开数据库中的条目的登记号。所有引用的参考文献的内容,包括如本申请自始至终引用的文献参考、授权的专利、公开或未公开的专利申请,特别在此引入作为参考。
序列表
<110>thegeneralhospitalcorporation
<120>改造抗体-应激蛋白融合物
<130>maa-014.25
<140>pct/us07/061554
<141>2007-02-02
<150>60/764,620
<151>2006-02-02
<160>3
<170>patentinver.3.3
<210>1
<211>625
<212>prt
<213>结核分枝杆菌(mycobacteriumtuberculosis)
<400>1
metalaargalavalglyileaspleuglythrthrasnservalval
151015
servalleugluglyglyaspprovalvalvalalaasnserglugly
202530
serargthrthrproserilevalalaphealaargasnglygluval
354045
leuvalglyglnproalalysasnglnalavalthrasnvalasparg
505560
thrvalargservallysarghismetglyserasptrpserileglu
65707580
ileaspglylyslystyrthralaprogluileseralaargileleu
859095
metlysleulysargaspalaglualatyrleuglygluaspilethr
100105110
aspalavalilethrthrproalatyrpheasnaspalaglnarggln
115120125
alathrlysaspalaglyglnilealaglyleuasnvalleuargile
130135140
valasngluprothralaalaalaleualatyrglyleuasplysgly
145150155160
glulysgluglnargileleuvalpheaspleuglyglyglythrphe
165170175
aspvalserleuleugluileglygluglyvalvalgluvalargala
180185190
thrserglyaspasnhisleuglyglyaspasptrpaspglnargval
195200205
valasptrpleuvalasplysphelysglythrserglyileaspleu
210215220
thrlysasplysmetalametglnargleuargglualaalaglulys
225230235240
alalysilegluleuserserserglnserthrserileasnleupro
245250255
tyrilethrvalaspalaasplysasnproleupheleuaspglugln
260265270
leuthrargalaglupheglnargilethrglnaspleuleuasparg
275280285
thrarglyspropheglnservalilealaaspthrglyileserval
290295300
sergluileasphisvalvalleuvalglyglyserthrargmetpro
305310315320
alavalthraspleuvallysgluleuthrglyglylysgluproasn
325330335
lysglyvalasnproaspgluvalvalalavalglyalaalaleugln
340345350
alaglyvalleulysglygluvallysaspvalleuleuleuaspval
355360365
thrproleuserleuglyilegluthrlysglyglyvalmetthrarg
370375380
leuilegluargasnthrthrileprothrlysargsergluthrphe
385390395400
thrthralaaspaspasnglnproservalglnileglnvaltyrgln
405410415
glygluarggluilealaalahisasnlysleuleuglyserpheglu
420425430
leuthrglyileproproalaproargglyileproglnilegluval
435440445
thrpheaspileaspalaasnglyilevalhisvalthralalysasp
450455460
lysglythrglylysgluasnthrileargileglngluglysergly
465470475480
leuserlysgluaspileaspargmetilelysaspalaglualahis
485490495
alaglugluasparglysargarggluglualaaspvalargasngln
500505510
alagluthrleuvaltyrglnthrglulysphevallysgluglnarg
515520525
glualagluglyglyserlysvalprogluaspthrleuasnlysval
530535540
aspalaalavalalaglualalysalaalaleuglyglyseraspile
545550555560
seralailelysseralametglulysleuglyglngluserglnala
565570575
leuglyglnalailetyrglualaalaglnalaalaserglnalathr
580585590
glyalaalahisproglyglygluproglyglyalahisproglyser
595600605
alaaspaspvalvalaspalagluvalvalaspaspglyarggluala
610615620
lys
625
<210>2
<211>625
<212>prt
<213>牛分枝杆菌(mycobacteriumbovis)
<400>2
metalaargalavalglyileaspleuglythrthrasnservalval
151015
servalleugluglyglyaspprovalvalvalalaasnserglugly
202530
serargthrthrproserilevalalaphealaargasnglygluval
354045
leuvalglyglnproalalysasnglnalavalthrasnvalasparg
505560
thrvalargservallysarghismetglyserasptrpserileglu
65707580
ileaspglylyslystyrthralaprogluileseralaargileleu
859095
metlysleulysargaspalaglualatyrleuglygluaspilethr
100105110
aspalavalilethrthrproalatyrpheasnaspalaglnarggln
115120125
alathrlysaspalaglyglnilealaglyleuasnvalleuargile
130135140
valasngluprothralaalaalaleualatyrglyleuasplysgly
145150155160
glulysgluglnargileleuvalpheaspleuglyglyglythrphe
165170175
aspvalserleuleugluileglygluglyvalvalgluvalargala
180185190
thrserglyaspasnhisleuglyglyaspasptrpaspglnargval
195200205
valasptrpleuvalasplysphelysglythrserglyileaspleu
210215220
thrlysasplysmetalametglnargleuargglualaalaglulys
225230235240
alalysilegluleuserserserglnserthrserileasnleupro
245250255
tyrilethrvalaspalaasplysasnproleupheleuaspglugln
260265270
leuthrargalaglupheglnargilethrglnaspleuleuasparg
275280285
thrarglyspropheglnservalilealaaspthrglyileserval
290295300
sergluileasphisvalvalleuvalglyglyserthrargmetpro
305310315320
alavalthraspleuvallysgluleuthrglyglylysgluproasn
325330335
lysglyvalasnproaspgluvalvalalavalglyalaalaleugln
340345350
alaglyvalleulysglygluvallysaspvalleuleuleuaspval
355360365
thrproleuserleuglyilegluthrlysglyglyvalmetthrarg
370375380
leuilegluargasnthrthrileprothrlysargsergluthrphe
385390395400
thrthralaaspaspasnglnproservalglnileglnvaltyrgln
405410415
glygluarggluilealaalahisasnlysleuleuglyserpheglu
420425430
leuthrglyileproproalaproargglyileproglnilegluval
435440445
thrpheaspileaspalaasnglyilevalhisvalthralalysasp
450455460
lysglythrglylysgluasnthrileargileglngluglysergly
465470475480
leuserlysgluaspileaspargmetilelysaspalaglualahis
485490495
alaglugluasparglysargarggluglualaaspvalargasngln
500505510
alagluthrleuvaltyrglnthrglulysphevallysgluglnarg
515520525
glualagluglyglyserlysvalprogluaspthrleuasnlysval
530535540
aspalaalavalalaglualalysalaalaleuglyglyseraspile
545550555560
seralailelysseralametglulysleuglyglngluserglnala
565570575
leuglyglnalailetyrglualaalaglnalaalaserglnalathr
580585590
glyalaalahisproglyglygluproglyglyalahisproglyser
595600605
alaaspaspvalvalaspalagluvalvalaspaspglyarggluala
610615620
lys
625
<210>3
<211>14
<212>prt
<213>人工序列
<220>
<223>人工序列描述:合成的肽
<400>3
asnalaasntyrserhisleuproproserglyasnarggly
1510
- 还没有人留言评论。精彩留言会获得点赞!