一种新型荧光探针及其制备方法和在检测6‑硫代鸟嘌呤中的应用与流程
本发明属于分析化学领域,尤其涉及新型荧光探针的合成及其对6-硫代鸟嘌呤的检测。
背景技术:
6-硫代鸟嘌呤(6-TG)是鸟嘌呤的类似物,在20世纪50年代初被引入临床和患者的研究。在过去的二十年里,6-硫代鸟嘌呤一直被用来作为白血病治疗的常用药物。近年来,它被应用于治疗乳腺癌。但是6-硫代鸟嘌呤对人体也有一定的危害,它可以抑制鸟嘌呤核苷的合成。6-硫代鸟嘌呤可以整合到CpG位点,并影响DNA甲基化转移酶DNMT1和HpaI介导的胞嘧啶甲基化反应。在从急性淋巴细胞白血病中分离的Jurkat T细胞中,6-硫代鸟嘌呤显著降低整体胞嘧啶甲基化水平。而且,6-硫代鸟嘌呤很容易插入到线粒体DNA(mtDNA)中,并引起细胞中线粒体机能失调。除了插入DNA中,6-硫代鸟嘌呤还可以通过活性氧途径(ROS)杀死细胞。ROS作用于DNA,产生强效的强有力地破坏性的复制逮捕DNA病变包括链间交联。因此对6-硫代鸟嘌呤的检测是至关重要的。荧光技术因其具有灵敏度高,操作简便,成本低,选择性好等众多优点,已被广泛应用于生化分析,环境监测,食品分析和临床检验等方面,渗透到化学,生物,物理,环境和医药等多学科研究领域之中。因此,利用荧光技术开发具有实用价值的化学生物探针已成为当前倍受关注的研究课题。其中,荧光探针,日益成为现代生命科学和疾病诊断等领域不可或缺的分子工具。新型荧光探针的设计合成及其应用为目前跨学科的前沿交叉研究热点。
技术实现要素:
本发明的目的在于设计合成一种可用于有效检测尿液当中的6-硫代鸟嘌呤的新型荧光探针EuIII-dtpa-bis(cytosine)。本发明所涉及化合物属于新型荧光探针,将其应用于检测6-硫代鸟嘌呤操作简单,成本低,无污染,且选择性好。
本发明采用的技术方案是:一种新型荧光探针,所述的新型荧光探针是EuIII-dtpa-bis(cytosine)。
上述的新型荧光探针的制备方法,方法如下:
1)取二乙三胺五乙酸(dtpa)、乙酸酐和吡啶,混合均匀,在60-70℃下,搅拌加热22-25h,冷却至室温,过滤,无水乙醚洗涤,抽滤,干燥,得二乙三胺五乙酸二酐(dtpaa);
2)取二乙三胺五乙酸二酐(dtpaa)、三乙胺、无水二甲基甲酰胺(DMF)和胞嘧啶(cytosine),混合均匀,于95-105℃下,搅拌加热22-25h,静置,冷却到室温,过滤,真空干燥,得二乙三胺五乙酸-双(胞嘧啶)(dtpa-bis(cytosine));
3)将二乙三胺五乙酸-双(胞嘧啶)用pH=7.4的Tris-HCl缓冲溶液溶解,得dtpa-bis(cytosine)溶液,用dtpa-bis(cytosine)溶液洗涤Eu(NO3)3·6H2O,收集洗涤液,洗涤液于70-80℃下加热20-30min或于室温下放置1-2天,得EuIII-dtpa-bis(cytosine)。
优选的,上述的新型荧光探针的制备方法,按摩尔比,二乙三胺五乙酸:乙酸酐:吡啶=1:4:6。
优选的,上述的新型荧光探针的制备方法,按摩尔比,二乙三胺五乙酸二酐:三乙胺:胞嘧啶=1:3:3。
优选的,上述的新型荧光探针的制备方法,按质量比,二乙三胺五乙酸-双(胞嘧啶):Eu(NO3)3·6H2O=40:1。
本发明的新型荧光探针可在检测6-硫代鸟嘌呤中应用。方法如下:将6-硫代鸟嘌呤用pH=7.4的Tris-HCl缓冲溶液溶解。加入由Tris-HCl缓冲溶液配置的pH=7.4的新型荧光探针EuIII-dtpa-bis(cytosine),在288nm的激发波长下观察荧光光谱的变化。
本发明的有益效果是:
1.本发明,对dtpa进行了修饰,在dtpa两端接上胞嘧啶,由于结构的相似性,通过氢键和π-π堆积以及配位键的作用抓取目标物,从而达到检测6-硫代鸟嘌呤的目的。
2.本发明针对6-硫代鸟嘌呤的结构特点,设计了一种新型的荧光探针。通过本发明的方法,该探针可以对6-硫代鸟嘌呤进行特异性检测。与其它检测6-硫代鸟嘌呤的荧光探针相比,具有简单,快速,成本低等特点。
附图说明
图1是荧光探针EuIII-dtpa-bis(cytosine)的合成反应的流程图。
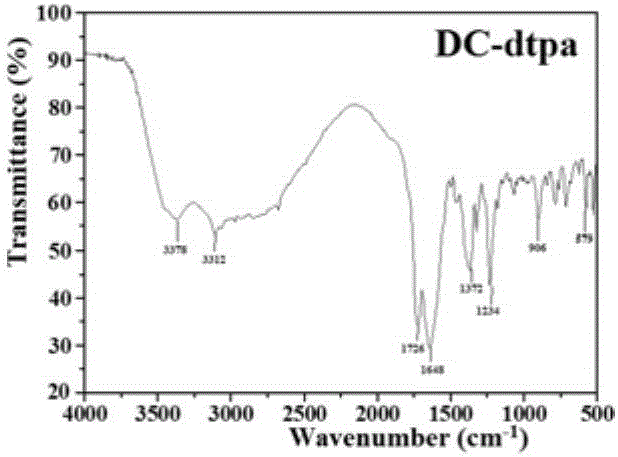
图2a是dtpa-bis(cytosine)(DC-dtpa)的傅里叶变换红外光谱(FT-IR)图。
图2b是胞嘧啶的傅里叶变换红外光谱(FT-IR)图。
图2c是dtpa的傅里叶变换红外光谱(FT-IR)图。
图3是Eu3+,dtpa-bis(cytosine)(dtpa-DC),EuIII-dtpa-bis(cytosine)的紫外吸收光谱图。
图4a是荧光探针加入不同物质荧光光谱对比图。
图4b是荧光探针对不同物质荧光光谱对比图(575nm)。
图4c是荧光探针对不同物质荧光光谱对比图(525nm)。
图5是荧光探针与6-硫代鸟嘌呤相互作用机理图。
图6a是荧光探针对6-硫代鸟嘌呤分别与不同物质混合的干扰荧光光谱对比图。
图6b是荧光探针对6-硫代鸟嘌呤分别与不同物质混合的干扰荧光光谱对比图(575nm)。
图6c是荧光探针对6-硫代鸟嘌呤分别与不同物质混合的干扰荧光光谱对比图(525nm)。
具体实施方式
实施例1新型荧光探针EuIII-dtpa-bis(cytosine)
(一)制备方法
1、二乙三胺五乙酸二酐(dtpaa)的制备
称取dtpa 7.8100g(0.02mmol),乙酸酐16.0mL(0.08mmol),吡啶10.0mL(0.12mmol)置于三颈圆底烧瓶中,在65℃下缓慢搅拌加热24h。冷却至室温,将反应混合物过滤,并用少量无水乙醚洗涤两次,用真空泵抽滤,所得物于真空干燥箱中80℃真空干燥,即得dtpaa。
2、二乙三胺五乙酸双胞嘧啶(dtpa-bis(cytosine))的制备
取1.9610g的dtpaa(55mmol)、8.0mL(165mmol)的三乙胺、50mL的无水DMF和1.83g(165mmol)的胞嘧啶(cytosine),于三颈圆底烧瓶。恒温100℃加热,快速搅拌24h。反应完全后静置,冷却到室温后,得白色固体物质,过滤,50℃真空干燥,即得dtpa-bis(cytosine)。
3、荧光探针EuIII-dtpa-bis(cytosine)的制备
称取0.0724g的dtpa-bis(cytosine)于200.0mL的pH=7.4的Tris-HCl缓冲溶液中溶解,得dtpa-bis(cytosine)溶液。称取0.0018g的Eu(NO3)3·6H2O置于烧杯中。然后用上面配制的dtpa-bis(cytosine)溶液洗涤三次,洗涤液依次移入250mL容量瓶中,定容。把容量瓶中的溶液于70-80℃下加热20-30min,形成EuIII-dtpa-bis(cytosine),此时浓度为5.0×10-4mol/L,作为储备液,备用。合成过程如图1所示。
(二)检测
1.胞嘧啶,dtpa,dtpa-bis(cytosine)的FT-IR图如图2a、图2b和2c所示。通过FT-IR对比发现,在图2a中的dtpa-bis(cytosine),不仅出现了胞嘧啶的特征衍射峰还出现了dtpa的特征衍射峰,即dtpa-bis(cytosine)中不仅存在dtpa还同时存在胞嘧啶。可以发现,图2a中dtpa-bis(cytosine)的v(C-N)出现在906cm-1处,与图2b中胞嘧啶的982cm-1相比有一个76cm-1的红移。图2a中dtpa-bis(cytosine)的vs(COO)出现在1372cm-1,与图2c中dtpa的1399cm-1相比有27cm-1的红移。此外,dtpa-bis(cytosine)的vas(COO)出现在1726cm-1处,而dtpa的vas(COO)出现在1734cm-1,有一个8cm-1的红移。dtpa-bis(cytosine)的vas(CONH)出现在1648cm-1和羟基特征的吸收峰出现在3378cm-1。这些变化证实,合成了dtpa-bis(cytosine)。
2.稀土Eu3+,dtpa-bis(cytosine)(dtpa-DC),EuIII-dtpa-bis(cytosine)(Eu3+-dtpa-DC)紫外吸收光谱图如图3所示。由紫外吸收光谱可以看出,Eu3+的溶液有一个最大吸收峰在220nm波长处,dtpa-bis(cytosine)溶液在205nm处显示很弱的吸收峰。形成EuIII-dtpa-bis(cytosine)后也有最大吸收峰在220nm处,但与Eu3+的溶液相比明显变强。此外,EuIII-dtpa-bis(cytosine)有一个新的吸收峰出现在288nm。这表明dtpa-bis(cytosine)可以形成新的配位场使Eu3+电子结构发生变化。这表明EuIII-dtpa-bis(cytosine)具有作为荧光探针检测6-硫代鸟嘌呤的潜在能力。
实施例2荧光探针EuIII-dtpa-bis(cytosine)在检测6-硫代鸟嘌呤中的应用
1.荧光探针对不同物质的荧光光谱
实验条件:取6-硫代鸟嘌呤,鸟嘌呤,腺嘌呤,尿酸,黄嘌呤,次黄嘌呤,胞嘧啶,尿嘧啶,胸腺嘧啶用pH=7.4的Tris-HCl缓冲液分别配制成浓度为5.0×10-4mol/L的溶液,作为储备液。分别取5.0mL于50mL容量瓶中,再分别加入实施例1制备的5.0mL的荧光探针EuIII-dtpa-bis(cytosine)储备液,定容。此时探针及各检测物质浓度都为5.0×10-5mol/L。在288nm的激发波长下观察荧光光谱的变化。结果如图4a、图4b和图4c所示。如图4b所示,在575nm处,荧光探针对6-硫代鸟嘌呤的荧光强度较为显著。并且在525nm处同时出现荧光峰,而其他的物质在525nm处无明显特征峰。通过图4b和图4c,能够更加直观的观察到荧光强度在575nm和525nm的变化。由此可见,荧光探针EuIII-dtpa-bis(cytosine)可以结合荧光方法对6-硫代鸟嘌呤进行检测。
2.荧光探针EuIII-dtpa-bis(cytosine)对6-硫代鸟嘌呤的检测机理
基于荧光探针对6-硫代鸟嘌呤的检测结果,本发明提出了荧光探针与被检测物6-硫代鸟嘌呤反应的机理,如图5所示。众所周知,Eu离子是九配位的,在EuIII-dtpa-bis(cytosine)中有一分子的水与之配位。经过修饰后的dtpa,在上下两端形成两只“手臂”,两只“手臂”即胞嘧啶与6-硫代鸟嘌呤的结构有一定的相似性,可以通过氢键和π-π堆积以及配位键抓取被检测物,从而形成一个新的配合物。形成新的配合物以后,Eu的配位发生变化,所以在荧光光谱的575nm处出现荧光峰。继续加入6-硫代鸟嘌呤,由于结合位点和结合方式的改变,即6-硫代鸟嘌呤在两只“手臂”的外侧结合,此时在525nm处出现了荧光峰。由于6-硫代鸟嘌呤的结构与鸟嘌呤相似,所以在荧光探针中加入了鸟嘌呤,但是该检测并没有在525nm处出现荧光峰,由此可见,荧光探针EuIII-dtpa-bis(cytosine)可以对6-硫代鸟嘌呤选择性检测。
3.6-硫代鸟嘌呤与不同检测物混合对荧光探针EuIII-dtpa-bis(cytosine)检测的影响
实验条件:分别取鸟嘌呤,腺嘌呤,尿酸,黄嘌呤,次黄嘌呤,胞嘧啶,尿嘧啶,胸腺嘧啶储备液5.0mL于50mL容量瓶中,分别加入5.0mL的6-硫代鸟嘌呤储备液,再分别加入5.0mL的荧光探针储备液,定容,配制成探针,6-硫代鸟嘌呤,各检测物质浓度都为5.0×10-5mol/L的溶液。在288nm的激发波长下观察荧光光谱的变化。结果如图6a、图6b和图6c所示。在575nm处其他检测物对荧光探针的检测有一定影响,但在525nm处影响很小。此现象在图6b和图6c中更加直观。由此可见,荧光探针在有其他物质干扰的情况下,对6-硫代鸟嘌呤依然具有特异性。
- 还没有人留言评论。精彩留言会获得点赞!