高产洛伐他汀枝状枝孢菌Cc‑106菌株及其用途的制作方法
本发明属于微生物生物技术领域,涉及1株液体发酵生产Lovastatin的枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株、用途和发酵生产方法。
背景技术:
Lovastatin是各国公认的降低胆固醇的理想药剂,具有高效、低毒、安全的特点,它能选择性抑制羟甲基戊二酸辅酶A(HMG-CoA)还原酶活性,并阻断胆固醇生物合成,近年来在临床治疗方面应用十分广泛。从1979年,日本学者远滕章(Akira Endo)教授从红色红曲霉(Monascus ruber)的培养液中分离出一种能够强力抑制胆固醇合成的活性物质,命名为Monacolin K(莫纳可林K)开始,时隔1年,美国Albert等从土曲霉(Aspergillus terrers)中发现了相似的物质,并命名为Mevinolin,现称Lovastatin。此后发现Lovastatin存在于包括侧耳属(Pleurotus)、茎点菌属(Phoma)、青霉属(Penicillium)、发光类脐菇 (Omphalotus olearius)在内的多种真菌中。
枝孢菌(Cladosporium)属于半知菌,是一类能够产生分生孢子的霉菌;孢子分布广泛,室内和室外空气中含量丰富;菌落褐绿色,经常与曲霉、青霉混淆;但是枝孢菌的菌丝是有颜色的,菌落整体呈现深色。有文章和专利报道,枝孢菌可用于:① 纤维素酶、木质素酶、超氧化物歧化酶、脂肪酶等酶制剂的生产,② 可产生紫杉醇等抗肿瘤、抗细菌真菌等活性代谢产物,③ 可用作微生物农用杀虫剂等。
技术实现要素:
针对市场上Lovastatin需求日益增长,生产Lovastatin优良工业菌株的缺乏等的问题。本发明的目的是提供1株高产Lovastatin枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株和发酵生产Lovastatin的方法。
本发明所述枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株,保藏编号为:CCTCC M 2016380,保藏地为:中国典型培养物保藏中心,保藏地址:中国武汉武汉大学,保藏日期为:2016年7月7日。
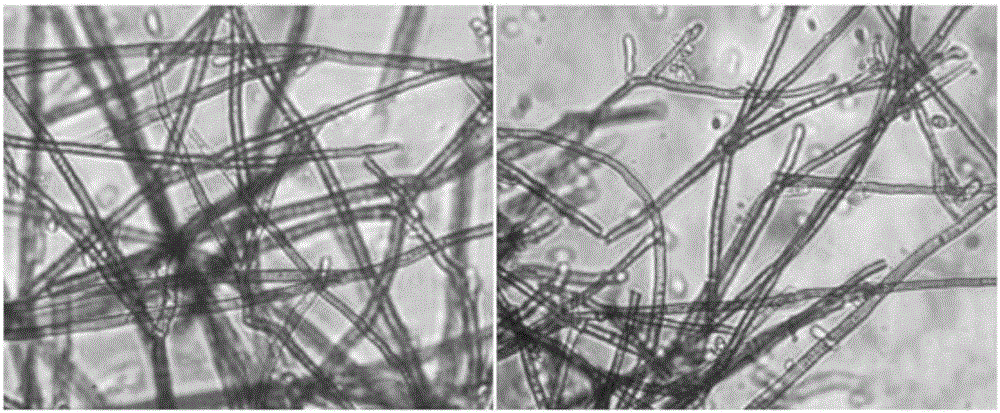
Cc-106菌株的形态特征:在PDA 培养基上28 ℃培养7 d形成较典型的菌落。菌落突点状,褐绿色,菌丝厚绒毛状,较致密,与培养基结合紧密,不易挑起,菌落背面墨绿色(附图1)。显微镜观察菌丝细胞丝状交织,有分隔,壁光滑或粗糙(附图2)。分生孢子梗直立,在中部形成分枝(附图3);分生孢子簇生或单生,无隔或有隔,分生孢子椭圆形至梭形,单细胞大小差异较大,长×宽平均大小为 5.5 µm×3.5 µm(附图4)。
ITS rDNA基因序列分析结果表明,其长度为525 bp(附图5),与枝状枝孢菌(Cladosporium cladosporioides)的进化距离最近(附图6)。根据Cc-106菌株的形态特征,结合枝孢菌属(Cladosporium)分种检索表,将Cc-106菌株鉴定为枝状枝孢菌(Cladosporium cladosporioides)。
Cc-106菌株具有高产Lovastatin、产孢量多、培养简单等优良特性。在发酵培养基初始pH为5.0~5.5,培养温度为28 ℃条件下,Cc-106菌株通过液体发酵培养基和发酵条件优化后,发酵80 h~136 h,Lovastatin产量可达184 mg/L左右(附图7);用液相色谱-质谱联用技术分离检测发酵液中的Lovastatin,结果表明分离物的结构、分子量与Lovastatin准品一致(附图8)。枝状枝孢菌Cc-106菌株丰富了生产Lovastatin的菌种。
枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株可用于发酵生产Lovastatin。用接种针挑取少量菌丝,转接于PDA培养基平皿中,活化培养3 d;取3个菌饼(直径8 mm)接种于一级种子培养液中,摇床培养3 d,制得一级种子液;在二级种子培养液中,按10%加入一级种子液,200 r/min摇床培养2 d成二级种子液;在5 L发酵罐发酵培养液中按20%接入二级种子液,发酵时间为80 h~136 h;发酵培养结束后,取发酵液1 mL,加甲醇4 mL(按1:4的比例),超声处理20 min,50℃水浴2 h,3000 r/min离心3 min,取上清液,经0.45 μm滤膜过滤,HPLC法检测Lovastatin产量,可达184 mg/L左右(附图7)。
本发明利用丰富的霉菌自然资源,筛选到1株高产Lovastatin的枝状枝孢菌Cc-106菌株,该菌株具有高产Lovastatin、产孢量大、培养简单等优良特性。在发酵培养基初始pH为5.5,培养温度为28℃条件下,Cc-106菌株5 L发酵罐液体发酵80 h~136 h,Lovastatin产量可达184 mg/L左右(附图7)。产生Lovastatin的枝状枝孢菌目前还未见有报道,本发明丰富了生产Lovastatin的菌种。
附图说明
图1 Cc-106菌株PDA培养基上培养10 d菌落正面和背面。
图2 Cc-106菌株菌丝和分生孢子梗的显微特征(200 X)。
图3 Cc-106菌株分生孢子梗的显微特征(200 X)。
图4 Cc-106菌株菌株分生孢子显微特征(400 X)。
图5 Cc-106菌株ITS rDNA基因序列(525 bp)。
图6 基于枝孢菌属(Cladosporium)ITS rDNA基因序列建立的Cc-106菌株系统发育树。
图7 Cc-106菌株在5 L发酵罐中的生物量和Lovastatin产量随发酵时间变化曲线。
图8 Cc-106菌株发酵液Lovastatin 液相色谱-质谱联用检测图。
保藏声明
枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株,保藏编号为:CCTCC M 2016380,保藏地为:中国典型培养物保藏中心,保藏地址:中国武汉武汉大学,保藏日期为:2016年7月7日。
具体实施方式
下面对本发明具体实施方式做一个详细的说明。
培养基实施例1 高产Lovastatin枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株的分离、筛选和鉴定
① PDA培养基:马铃薯20%、葡萄糖2%、琼脂粉2.0%,pH 5.5~6.0。用于霉菌菌株的分离纯化和鉴定。
② PD培养液:马铃薯20%、葡萄糖2%、牛肉膏0.5%,pH 5.5~6.0。用于高产Lovastatin霉菌菌株的筛选。
实验方法
2.1 霉菌菌株的分离纯化
从不同生境收集的样品(食品、土壤、水果、有机质等)表面挑取少量菌丝接入PDA培养基平板表面,28℃培养24 h,待白色绒毛状菌丝长出后,取少许菌丝转接于另一PDA培养基平板上继续培养3 d产生孢子后,显微镜观察具有霉菌的典型特征,挑取少许边缘菌丝纯化3次,得性状均一的霉菌纯菌株。将分离纯化获得的霉菌菌株编号保存于25%甘油中,置于4 ℃冰箱备用。
高产Lovastatin霉菌菌株的筛选
用高效液相色谱法(HPLC)检测获得的178株霉菌纯菌株发酵液中Lovastatin产量进行筛选。霉菌各保存菌株28℃ PDA平板培养3 d后,用打孔器取3个菌饼(直径8 mm)转接种于PD培养液中,28℃、200 r/min摇床培养5 d。取发酵液1 mL,加甲醇4 mL(按1: 4的比例),超声处理20 min,50℃水浴2 h,3000 r/min 离心3 min,取上清液,经0.45 μm滤膜过滤,利用HPLC法检测Lovastatin产量,筛选高产Lovastatin的青霉菌株。
目的菌株的鉴定
用镊子挑取少量该菌株菌丝,转接于PDA培养基平板中,活化培养3 d;取平皿中1菌饼(直径8 mm)接种于新的PDA培养基平板上,28℃,培养7 d,显微镜观察目的菌株的菌丝、分生孢子梗、分生孢子等的形态特征,并拍照。提取目的菌株的基因组DNA,扩增rDNA ITS基因序列,送上海生物工程公司测序。
实验结果
3.1高产Lovastatin菌株的筛选
通过分离纯化从浙江省各地不同生境收集的样品(食品、土壤、水果、有机质等)中共获178株霉菌纯菌株。
利用高效液相(HPLC)法对178株霉菌纯菌株发酵液进行Lovastatin产量检测,结果表明不同霉菌菌株Lovastatin产量存在显著差异。经筛选获1株Lovastatin产量较高的编号为Cc-106菌株,Lovastatin产量为115.2 mg/L,Cc-106菌株分离自霉烂的番茄。
菌株的鉴定结果
Cc-106菌株的形态特征:在PDA 培养基上28 ℃培养7 d形成较典型的菌落。菌落突点状,褐绿色,菌丝厚绒毛状,较致密,与培养基结合紧密,不易挑起,菌落背面墨绿色(附图1)。显微镜观察菌丝细胞丝状交织,有分隔,壁光滑或粗糙(附图2)。分生孢子梗直立,在中部形成分枝(附图3);分生孢子簇生或单生,无隔或有隔,分生孢子椭圆形至梭形,单细胞大小差异较大,长×宽平均大小为 5.5 µm×3.5 µm(附图4)。
ITS rDNA基因序列分析结果表明,其长度为525 bp(附图5),与枝状枝孢菌(Cladosporium cladosporioides)的进化距离最近(附图6)。根据Cc-106菌株的形态特征,结合枝孢菌属(Cladosporium)分种检索表,将Cc-106菌株鉴定为枝状枝孢菌(Cladosporium cladosporioides)。
实施例2 枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株在5 L发酵罐中的生长曲线和Lovastatin产生规律
1 菌株:枝状枝孢菌(Cladosporium cladosporioides)Cc-106菌株。
培养基
① PDA培养基:马铃薯20%、葡萄糖2%、琼脂粉2.0%、pH 5.0~5.5。用于Cc-106菌株的活化培养。
② PD培养液:马铃薯20%、葡萄糖2%、pH 5.0~5.5。用于Cc-106菌株的一级种子培养。
③ 二级种子培养液:马铃薯20%、葡萄糖2%、牛肉膏0.5%、pH 5.0~5.5。用于Cc-106菌株的二级种子培养。
④ 发酵培养液:马铃薯20%、葡萄糖2%、酵母膏0.5%、蛋白胨1.5%、NaCl 0. 2%、pH 5.0~5.5。用于Cc-106菌株发酵生产Lovastatin。
实验方法
3.1 Cc-106菌株的培养
用接种针挑少量Cc-106菌株菌丝,转接于PDA培养基平皿中,活化培养3 d;取平皿中3个菌饼(直径8 mm)接种于一级种子培养液中,摇床培养3 d,制得一级种子液;在二级种子培养液中,按10%接入一级种子液,200 r/min摇床培养2 d成二级种子液;在5 L发酵罐发酵培养液中按20%接入二级种子液进行发酵培养。
菌株菌丝干重的测定
1.5 mL空离心管放于在85℃的烘箱中烘干,称取空离心管质量为m;每管吸取1 mL培养液,在4 ℃,10000 r/min离心10 min,弃上清;加无菌蒸馏水洗3次,10000 r/min离心10 min,弃上清,放入85℃烘箱中烘至恒重,称取质量为M;菌丝干重质量为M-m。每隔4 h取3 mL Cc-106菌株发酵液(设3次重复)测定菌丝干重。以发酵时间为横坐标,Cc-106菌株菌丝干重为纵坐标绘制生长曲线。
菌株发酵过程中Lovastatin产量分析
每隔4 h取发酵液1 mL(设3次重复),加甲醇4 mL(按1:4的比例),超声处理20 min,50℃水浴2 h,3000 r/min 离心3 min,取上清液,经0.45 μm滤膜过滤,HPLC法检测Lovastatin产量,以发酵时间为横坐标,Cc-106菌株发酵液中Lovastatin产量为纵坐标,绘制Cc-106菌株Lovastatin产量随发酵时间变化曲线。
Cc-106菌株发酵液中Lovastatin的鉴定
用液相色谱-质谱联用技术分离检测Cc-106发酵液中的Lovastatin结构、分子量等。
实验结果
4.1 Cc-106菌株的生长曲线
每隔4 h取样测定菌丝干重,Cc-106菌株生长曲线见图7。Cc-106菌株0 ~12 h生长速度慢,为迟缓期;16 h~52 h快速生长,菌体量大增,为对数生长期;发酵至56 h后,长势趋于平缓,菌体量达到最高,为稳定生长期,菌丝干重为35.6 g/L;96 h后出现泡沫,进入衰亡期。
Cc-106菌株发酵液中Lovastatin产量随发酵时间变化曲线
每隔4 h取样用HPLC法测定Cc-106菌株发酵液Lovastatin产量,Lovastatin产量随发酵时间的变化曲线见图7,发酵至80 h后,发酵液中Lovastatin产量基本稳定,最大值为184.1 mg/L。
Cc-106菌株发酵液中Lovastatin的鉴定
用液相色谱-质谱联用技术分离检测发酵液中的Lovastatin,结果表明分离物结构、分子量与Lovastatin准品一致,分子式为C24H36O5,分子量为404.45(附图8)。
- 还没有人留言评论。精彩留言会获得点赞!