一种新型核酸荧光定量检测方法与流程
本发明涉及生物医学和分子生物学领域,具体地说,涉及一种新型核酸荧光定量检测方法。
背景技术:
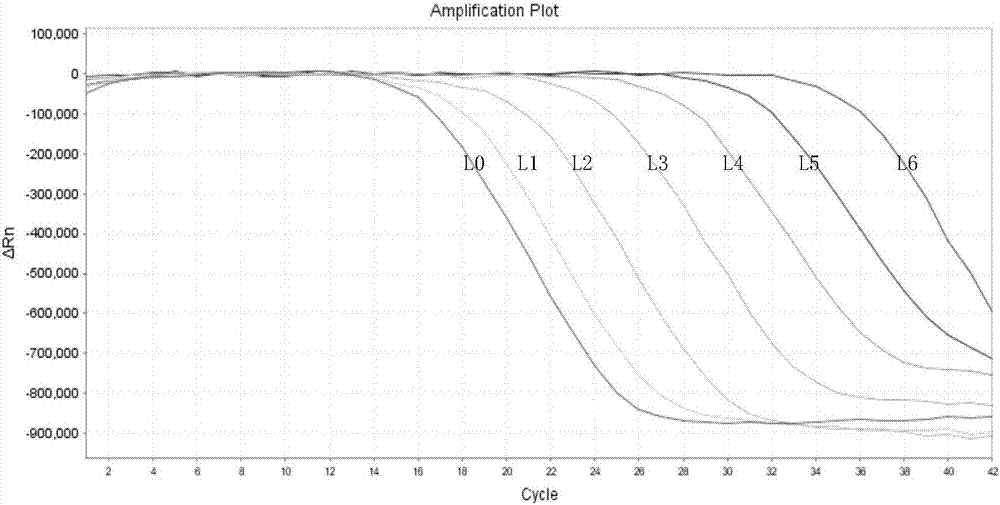
:荧光定量PCR技术自问世以来,就因为其高灵敏性,高特异性和高精确性的特点,已被广泛应用于微生物病原体测定、肿瘤基因检测、免疫分析、基因表达、突变及其多态性等多个研究领域。荧光定量PCR技术的化学原理包括探针类和非探针类两种。探针类技术主要包括Taqman探针法、分子信标法,两者都是利用与靶序列特异杂交的探针所产生的荧光信号,来实现荧光定量检测。非探针类主要包括Sybgreen法,Lux荧光法,两者是利用荧光染料或者发夹结构引物而实现了荧光定量检测。探针类技术由于在扩增过程中增加了探针的识别步骤,特异性更高。因此,探针法已经成为荧光定量PCR检测的主流技术。但是,由于探针的设计非常复杂,同时要求探针必须有一定的长度和较高的退火温度。这无疑增加了探针的设计难度和选择区域,特别是在高突变的靶序列上,很难有效地开展探针设计。而非探针类技术由于只需要设计上下游引物就能开展荧光定量检测,设计简单易行而受到研究人员的喜爱。但是,由于非探针类技术使用的荧光染料或发夹结构引物,会导致非特异性结果或检测结果稳定性差,这也直接导致了非探针类技术在医学检测领域应用受到限制。技术实现要素:本发明的目的是提供一种新型核酸荧光定量检测方法,与常用Taqman探针法、分子信标法、LUX等方法相比,无需设计荧光探针,只需上下游引物就能高效地完成荧光定量扩增检测。本发明的另一目的是提供一种新型核酸荧光定量扩增检测系统。本发明的构思如下:将上游引物5’端标记上荧光基团或淬灭基团,下游引物5’端标记上淬灭基团或荧光基团,然后进行PCR、RT-PCR扩增或进行其他形式的核酸扩增。由于上下游引物每完成一次扩增后,就会在扩增片段的两侧分别带有荧光基团和淬灭基团,就会产生荧光基团的淬灭。通过荧光基团淬灭,来完成对PCR过程进行实时定量检测。由于在PCR扩增的指数时期,模板的Ct值和该模板的起始拷贝数存在线性关系,所以成为定量的依据。该发明与探针法相比,不需额外设计复杂的荧光探针,只需上下游引物就能高效的完成荧光定量扩增检测。(图1)为了实现本发明目的,本发明提供一种新型核酸荧光定量检测方法,在核酸(包括DNA和RNA)荧光定量扩增检测系统中,设置一对或多对上下游引物,每对引物的上游引物序列和下游引物序列的5’端分别标记荧光基团和淬灭基团,或者每对引物的上游引物序列和下游引物序列的5’端分别标记淬灭基团和荧光基团;每完成一次扩增后,就会在扩增产物的两端分别带有荧光基团和淬灭基团,通过荧光基团淬灭,来对PCR反应过程进行实时定量检测。本发明所述荧光基团选自FAM、Alexa546、CY5、ROX、JOE、HEX、TET等,所述淬灭基团选自TAMARA、BHQ-1、BHQ-2、BHQ-3、Eclipse等。优选地,本发明所述上游引物序列和下游引物序列的长度为10-30个碱基,扩增产物的长度为30-90个碱基。本发明所述核酸荧光定量扩增检测系统包括PCR、RT-PCR、等温扩增等常见的核酸扩增体系。本发明所述核酸荧光定量扩增检测系统可以是单色荧光扩增,或者多色荧光同步扩增。本发明还提供一种新型核酸荧光定量扩增检测系统,所述检测系统包含一对或多对上下游引物,每对引物的上游引物序列和下游引物序列的5’端分别标记荧光基团和淬灭基团,或者每对引物的上游引物序列和下游引物序列的5’端分别标记淬灭基团和荧光基团。可将本发明的核酸荧光定量扩增检测系统用于病原微生物、肿瘤检测、遗传疾病检测、检验检疫等多个领域的定性和定量检测。本发明与探针法(Taqman探针法、分子信标法等)相比,无需额外设计复杂的荧光探针,给荧光定量PCR的设计和检测带来巨大便利。同时,由于没有荧光探针对PCR的扩增干扰,将极大的提高荧光定量PCR的检测灵敏度。也降低了多色荧光定量检测的互相干扰。本发明与非探针法相比,避免了由于添加荧光染料而导致的非特异结果。也解决了Lux荧光法的,由于复杂的发夹结构引物设计,而带来的检测结果不稳定等问题。因此,本发明既有探针类技术的高特异性,又具有非探针类技术的设计简便性。本发明从根本上解决了现有荧光探针定量PCR技术存在的设计复杂、成本高等缺陷问题。本发明提供的新型核酸荧光定量扩增检测系统具有设计简单、检测灵敏度高,特异性强,稳定性好等优点。与目前主流的探针法和非探针法荧光定量检测技术相比,本发明成本更加低廉,设计简单易行,扩增效率更高,可广泛应用于医学、遗传、检验检疫等多个领域。附图说明图1为本发明核酸荧光定量扩增检测系统的工作原理。图2为本发明实施例1中检测HBV国家参考品的结果。图3为本发明实施例1中检测HBV国家参考品的检测浓度及其理论浓度的拟合曲线。图4为本发明实施例1中对4种浓度HBV阳性血清样本的重复性测试检测结果。图5为本发明实施例2中对三种病毒血清样本的多重PCR检测结果;其中,A为HBV检测结果,B为HCV检测结果,C为HIV检测结果。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例均按照常规实验条件,如Sambrook等分子克隆实验手册(SambrookJ&RussellDW,MolecularCloning:aLaboratoryManual,2001),或按照制造厂商说明书建议的条件。实施例1乙型肝炎病毒的荧光定量PCR检测1、病毒核酸样本的制备使用东北制药集团辽宁生物医药有限公司生产的“核酸提取试剂盒(磁珠法),备案号:辽本械备20160001”进行乙肝病毒核酸的提取和纯化工作。具体操作参照产品说明书进行。2、PCR反应液的配制按照表1完成PCR反应液组份的配制。然后在每个PCR反应管中分装40μlPCR反应液。表110×Buffer5.0μldNTPs(含有dATP、dCTP、dGTP、dUTP,每种组份各2mM)4.0μl热启动TaqDNA聚合酶(5U/μl)1.0μlUNG酶(1U/μl)0.2μl上游引物HBV-For(20μm,5’端标记FAM)0.5μl下游引物HBV-Rev(20μm,5’端标记BHQ-1)0.5μl去RNase水28.8μl其中,上游引物HBV-For、下游引物HBV-Rev的序列分别为:HBV-For:5’-ACCTCTCTTTACGCGGTCTCC-3’;HBV-Rev:5’-TGCACACGGTCCGGCAGATGAG-3’,扩增产物大小为56bp。3、加样和检测向含有PCR反应液的PCR反应管中,加入提取的病毒核酸样本10μl,盖紧管盖,置于荧光定量PCR仪上进行扩增检测。扩增程序见表2。表2一、国家参考品检测以中国食品药品检定研究院的“乙型肝炎病毒(HBV)核酸定量参考品(L0-L6)”为待测样本,采用上述方法进行检测。最后分析参考品的检测值和理论值之间的双对数线性关系。要求双对数线性关系(R2)≥0.97视为符合。检测结果见图2、图3和表.3,其理论浓度和检测浓度的双对数曲线线性相关系数(R2)为0.999,表明本发明的新定量方法准确可靠,定量结果可以准确溯源到国家参考品。表3参考品质量标准(IU/ml)理论浓度对数值实际检测值检测浓度对数值L0(0.7762~6.165)E+088.3421.73E+088.24L1(0.1479~1.175)E+087.6193.68E+077.566L2(0.1585~1.259)E+076.6494.55E+066.658L3(0.1659~1.318)E+065.6724.34E+055.637L4(0.1820~1.479)E+054.7153.72E+044.571L5(0.1514~1.230)E+043.6364.45E+033.648L6(0.3890~3.090)E+022.0431.37E+022.137二、样本重复性检测以东北制药集团辽宁生物医药有限公司生产的“乙型肝炎病毒(HBV)核酸(DNA)检测试剂盒(荧光探针法)”标定的HBV阳性血清为初始样本,用阴性血清将其稀释成为1.0E+06、1.0E+05、1.0E+04和1.0E+03IU/ml四个梯度样本。每个样本重复三次,最后计算Ct值变异系数。结果如图4所示。Ct值的变异系数分别为0.34%、0.41%、0.38%和0.46%,变异系数均控制在1%以内,表明利用本发明方法检测血清样本的重复性和精密度很好。实施例2多重荧光定量RT-PCR检测1、病毒核酸样本的制备使用东北制药集团辽宁生物医药有限公司生产的“核酸提取试剂盒(磁珠法),备案号:辽本械备20160001”进行病毒核酸的提取和纯化工作。具体操作参照产品说明书进行。2、RT-PCR反应液的配制按照表.4完成RT-PCR反应液组份的配制。然后在每个PCR反应管中分装40μlRT-PCR反应液。表.45×Buffer10.0μldNTPs(含有dATP、dCTP、dGTP、dUTP,每种组份各2mM)4.0μl热启动TaqDNA聚合酶(5U/μl)0.6μlUNG酶(1U/μl)0.1μlM-MLV(200U/μl)0.6μlRNase抑制剂(40U/μl)0.2μl上游引物HBV-For(20μm,5’端标记FAM)0.3μl下游引物HBV-Rev(20μm,5’端标记BHQ-1)0.3μl上游引物HCV-For(20μm,5’端标记HEX)0.3μl下游引物HCV-Rev(20μm,5’端标记BHQ-1)0.3μl上游引物HIV-For(20μm,5’端标记Cy5)0.3μl下游引物HIV-Rev(20μm,5’端标记BHQ-1)0.3μl去RNase水22.7μl其中,上游引物HBV-For、下游引物HBV-Rev的序列分别为:HBV-For:5’-ACCTCTCTTTACGCGGTCTCC-3’;HBV-Rev:5’-TGCACACGGTCCGGCAGATGAG-3’,扩增产物大小为56bp。上游引物HCV-For、下游引物HCV-Rev的序列分别为:HCV-For:5’-AGTAGTGTTGGGTCGCGAAAGG-3’;HCV-Rev:5’-TCTACGAGACCTCCCGGGGCAC-3’,扩增产物大小为76bp。上游引物HIV-For、下游引物HIV-Rev的序列分别为:HIV-For:5’-CTGAGCCTGGGAGCTCTCTGGC-3’;HIV-Rev:5’-CAAGTTTATTGAGGCTTAAG-3’,扩增产物大小为58bp。3、加样和检测向含有RT-PCR反应液的PCR反应管中,加入提取的病毒核酸样本10μl,盖紧管盖,置于荧光定量PCR仪上进行扩增检测。扩增程序见表.5。表.5以东北制药集团辽宁生物医药有限公司生产的“乙型肝炎病毒(HBV)核酸(DNA)检测试剂盒(荧光探针法)”标定的HBV阳性血清(病毒浓度:1.0E+05IU/ml)与HIVWHO国际标准品(病毒浓度:1.85E+05IU/ml)和HCVWHO国际标准品(病毒浓度:1.55E+05IU/ml)进行混合,制备成混合病毒血清样本S1。用阴性血清将混合病毒血清进行三个梯度稀释,分别制备成样本S2,S3和S4。然后采用上述方法进行检测。最后各自分析病毒检测值和理论值之间的双对数线性关系。要求双对数线性关系(R2)≥0.97视为符合。检测结果见图5和表.6,其HBV、HCV和HIV理论浓度和检测浓度的双对数曲线线性相关系数(R2)分别为0.990、0.998和0.997。表明本发明适合进行多重荧光定量检测,检测结果准确可靠。表.6虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之做一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。序列表<110>东北制药集团辽宁生物医药有限公司<120>一种新型核酸荧光定量检测方法<130>KHP171111087.7TQ<160>8<170>PatentInversion3.3<210>1<211>21<212>DNA<213>人工序列<400>1acctctctttacgcggtctcc21<210>2<211>22<212>DNA<213>人工序列<400>2tgcacacggtccggcagatgag22<210>3<211>21<212>DNA<213>人工序列<400>3acctctctttacgcggtctcc21<210>4<211>22<212>DNA<213>人工序列<400>4tgcacacggtccggcagatgag22<210>5<211>22<212>DNA<213>人工序列<400>5agtagtgttgggtcgcgaaagg22<210>6<211>22<212>DNA<213>人工序列<400>6tctacgagacctcccggggcac22<210>7<211>22<212>DNA<213>人工序列<400>7ctgagcctgggagctctctggc22<210>8<211>20<212>DNA<213>人工序列<400>8caagtttattgaggcttaag20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1