近红外发光钌配合物在细胞pH传感中的应用的制作方法
本发明涉及细胞ph传感领域,具体涉及一个双核钌配合物在肿瘤细胞ph测定中的应用。
背景技术:
细胞ph与细胞的功能密切相关[r.a.gottlieb,j.nordberg,e.skowronski,b.m.babior,apoptosisinducedinjurkatcellsbyseveralagentsisprecededbyintracellularacidification,proc.natl.acad.sci.usa,1996,93,654.]。一般情况下细胞内存在两个较宽的ph范围,如细胞质和溶酶体的ph范围分别为6.8~7.4和4.5~6.0[f.galindo,m.i.burguete,l.vigara,s.v.luis,n.kabir,j.gavrilovic,d.a.russell,syntheticmacrocyclicpeptidomimeticsastunablephprobesforthefluorescenceimagingofacidicorganellesinlivecells,angew.chem.int.ed.engl.,2005,44,6504.]。细胞功能紊乱、癌症和老年痴呆症等疾病会导致细胞内ph值偏离正常值[h.izumi,t.torigoe,h.ishiguchi,h.uramoto,y.yoshida,m.tanabe,t.ise,t.murakami,t.yoshida,m.nomoto,k.kohno,cellularphregulators:potentiallypromisingmoleculartargetsforcancerchemotherapy,cancertreat.rev.,2003,29,541.]。因此检测细胞内ph变化对研究细胞的生理和病理过程具有重要意义。近年来发展起来的细胞ph传感器具有快速、无损伤、直观和灵敏度高等特点,已广泛用于监控细胞内ph的变化。但这类传感器主要局限于有机分子,且常常采用高能的紫外光激发,对细胞有损伤[j.y.han,k.burgess,fluorescentindicatorsforintracellularph,chem.rev.,2010,110,2709.]。与有机小分子相比较,基于钌配合物的近红外发光ph传感器具有较长的寿命,较大的斯托克位移,对生物组织穿透能力强、损伤小,并且钌配合物有一定的水溶性,这对检测活体细胞体系的ph非常重要。但这类配合物在细胞ph传感方面的应用报道极为少见。
技术实现要素:
本发明的目的是公开一个含咪唑环的双核钌配合物的细胞ph传感中的应用。
本发明的技术方案如下:
本实验中所用的双核钌配合物细胞ph传感器为[(bpy)2ru(hl1)ru(h2l2)](clo4)4,配阳离子结构式如下所示:
[(bpy)2ru(hl1)ru(h2l2)](clo4)4按照我们公开的专利方法[王克志、孟婷婷、郑泽宝,近红外发光钌配合物ph传感器,专利申请号:201510434319.x]合成。与现有的细胞ph传感器相比,本发明的传感器的有益效果在于:
能通过可见光激发,通过流式细胞术方便地监测细胞内ph对细胞近红外发光强度的影响,传感hela细胞内的ph。另外普通显微镜和激光共聚焦显微镜成像的发光强度也能也能敏感响应细胞内的ph。结果还表明,本专利涉及的钌配合物在成像的浓度下,几乎无细胞毒性。此外,本专利涉及的钌配合物具有可见光激发,近红外区发光的特性,较紫外光激发的细胞探针具有对细胞损伤小的优点。
附图说明
图1不同浓度的钌配合物(10,20,40和80μm)以及5μm的顺铂(ddp)对hela细胞增殖的影响。
图2(a)不同浓度的钌配合物(10,20,40和80μm)以及5μm的顺铂(ddp)对hela细胞周期g1相的影响(纵坐标为g1相所占的百分比);图2(b)不同浓度的钌配合物(10,20,40和80μm)以及5μm的顺铂(ddp)对hela细胞周期s相的影响(纵坐标为s相所占的百分比);图2(c)不同浓度的钌配合物(10,20,40和80μm)以及5μm的顺铂(ddp)对hela细胞周期g2/m相的影响(纵坐标为g2/m相所占的百分比);图2(d)不同浓度的钌配合物(10,20,40和80μm)以及5μm的顺铂(ddp)对hela细胞凋亡的影响(纵坐标为凋亡的hela细胞所占的百分比)。
图3(a)阴性对照(a)以及10μm(b),20μm(c),40μm(d),80μm(e)的钌配合物处理hela细胞2h后流式细胞术检测的细胞发光强度图;图3(b)不同浓度的钌配合物处理hela细胞2h后流式细胞术检测的细胞发光强度随配合物浓度变化图。
图4(a)流式细胞术检测的hela细胞发光强度:(a)阴性对照;40μm的钌配合物孵育hela细胞(b)2h,3.5h(c),5.5h(d),7.5h(e),9.5h(f);图4(b)40μm的钌配合物孵育hela细胞时间对流式细胞术检测到的hela细胞发光强度的影响。
图5(a)流式细胞术检测的细胞内不同ph时对hela细胞发光强度影响:(a)阴性对照;(b)ph7.4,(c)ph7.0,(d)ph6.0,(e)ph5.5,(f)ph5.0,(g)ph4.5,(h)ph4.0;图5(b)hela细胞内ph对流式细胞术检测的细胞发光强度的影响。
图6钌配合物成像不同ph的hela细胞的激光共聚焦显微镜成像图。
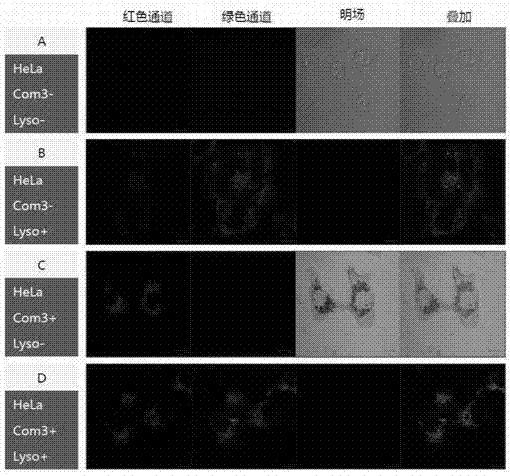
图7钌配合物与溶酶体染料lysogreen在hela细胞中共定位激光共聚焦显微镜成像图。(a)hela;(b)hela+lysogreen;(c)hela+钌配合物;(d)hela+lysogreen+钌配合物。
具体实施方式
实施例1:细胞培养和细胞毒性实验
宫颈癌hela细胞在370℃下用细胞培养液培养在co2培养箱中培养(95%相对湿度,5%co2).配合物的体外细胞毒在moleculardevices公司生产的高内涵分析系统上测定。取处于指数生长期状态较好宫颈癌hela细胞,用培养基制成细胞悬液后,以细胞计数板计数,按照6×103个细胞/孔接种于96孔板,进行传代培养。细胞传代24小时后,加入配合物的二甲基亚砜溶液使其最后浓度10~80μm.100μl的培养基和顺铂分别做阴性和阳性对照。将96孔板放入37℃的相对湿度95%,5%二氧化碳培养箱孵育48小时。然后将10μg/mlhoechst33342and1μg/ml碘化丙啶pi的磷酸盐缓冲液中染色20分钟,用磷酸盐缓冲液冲洗两次后进行高内涵成像分析。对pi呈阳性的细胞标记为凋亡后的死细胞,对pi呈阴性的细胞按照hoechst33342的染色强度分为g1,sandg2/m相细胞.所有数据来自3次独立的实验,表达为平均值±标准偏差。
由图1可知,10μm,20μm,40μm的钌配合物对hela细胞的增殖几乎无影响,而80μm的钌配合物对细胞的增殖有小的影响,与顺铂(ddp)对细胞增殖有显著影响形成鲜明的对照。由图2(a)-2(d)可知,10μm,20μm,40μm的钌配合物几乎不影响细胞周期和引起细胞凋亡,40μm的钌配合物才引起细胞周期g1和s相成分减小,g2/m相和细胞凋亡成分增加,与顺铂(ddp)对细胞周期和引起细胞凋亡有显著影响形成鲜明的对照。上述结果表明,配合物浓度小于等于40μm时对细胞几乎无毒性。
实施例2:流式细胞术分析
宫颈癌hela细胞通过胰蛋白酶消化后,悬浮于5ml磷酸盐缓冲,在1000转/分的速度下离心10分钟。丢弃上清液后加1ml磷酸盐缓冲重新悬浮细胞。通过novocyte型流式细胞仪(acea,usa)分析含有20000个细胞的样品。激发波长488nm,经过780/20nm的滤光片收集发射的光子。
我们通过流式细胞术探讨了配合物最佳浓度和最佳孵化时间。由图3可知,当配合物浓度为80μm时,细胞的发光强度仍未饱和,由于受配合物溶解度的限制,我们实验中选取接近细胞最大发光强度的40μm配合物浓度。由图4可知,当孵化时间达8h后,细胞达最大发光强度,因此我们选取孵化时间8h,研究配合物在hela细胞传感中的应用。由图5可知,当细胞内的ph由4.0增加到7.0时,细胞的发光强度初始时随ph增加显著增加,ph4.0-5.5范围内发光强度随ph增加线性增加,当ph大于等于7时,发光强度达到饱和。上述细胞发光强度随细胞ph变化曲线与配合物溶液发光强度随溶液ph变化曲线[王克志、孟婷婷、郑泽宝,近红外发光钌配合物ph传感器,专利申请号:201510434319.x]完全吻合,表明配合物是非常优异的细胞内ph探针。
实施例3:hela细胞ph成像
为完成激光共聚焦成像,宫颈癌hela在20mm2激光共聚焦显微镜培养皿中培养细胞(每孔1.0×104个细胞)。细胞在在37℃下5%co2气氛下维持24小时直到达到70%汇集。10mm的配合物二甲基亚砜溶液用细胞培养液稀释到最终浓度为40μm。细胞经孵育7.5小时后,过量的配合物用磷酸盐缓冲(ph7.4)洗3次后,进一步处理10分钟。然后,细胞再经磷酸盐缓冲(ph7.4)洗3次,再用不同ph值(4.0,4.5,5.0,5.5,6.0,7.0和7.4)10μm的尼日利亚菌素孵育15分钟.通过配有控温在37℃的zeissaxioobservera1型普通显微镜发光成像(激发波长450–490nm,收集发射波长大于515nm的发射光子)。用zeisslsm700共聚焦显微镜进行成像分析。在配置截止波长为640nm的长波通发射滤光片,氩氪离子激光的zeisslsm700共聚焦显微镜下用488nm激发配合物成像。
通过普通显微镜和激光共聚焦显微镜成像结果(图6)表明,随ph增加,配合物红色发光通道的发光强度随ph增加而减弱,与流式细胞术的检测结果一致。低ph时明显可见配合物在细胞内染色均匀。
实施例4:钌配合物与溶酶体染料lysogreen在hela细胞中的共定位实验
此实验按如下六步完成:(1)将hela细胞接种到8孔培养皿中,37℃细胞培养箱培养24小时;(2)加入40μm钌配合物,继续培养20小时;(3)hbss换液洗1次,每次5min;(4)分别加入染料:0.2μmlysogreen,37℃孵育30min;(5)hbss洗2次,每次5min。(6)用zeisslsm700共聚焦显微镜进行成像分析:红色通道(钌配合物):405nm激发,发射640nm-∞;绿通道(lysogreen):488nm激发,发射500-555nm;明场:观察细胞形态。物镜:zeissplan-apochromat63x/1.40oil。
共聚焦显微镜进行成像结果(图7)表明,且发现钌配合物的红光与溶酶体染料lysogreen所发的绿光重叠,表明配合物能点亮hela细胞中的溶酶体。类似的实验检验钌配合物与线粒体染料mitotracker共定位结果表明,钌配合物并不能点亮线粒体。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荔枝多糖铁配合物的制备方法
- 一种含4,4’-二溴-2,2’-联吡啶的新型钌配合物的制备方法及其抗肿瘤活性的制作方法
- 一种羰基锝-99m标记的美法仑配合物及其制备方法与用图
- 一种锝-99m标记的美法仑配合物及其制备方法与用图
- Ru配合物Ru(bpy)<sub>3</sub>(NH<sub>2</sub>)<sub>2</sub>与石墨烯量子相结合的方法
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑二维铜配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-双三唑均苯四酸钴配合物单晶与应用
- 一种含双氮配体低价金属铑(Ⅰ)的环辛二烯配合物及其制备方法
- 1,4-二甲基-2,5-二-1h-双三唑三维铜配合物单晶与应用
- 一种2-羰基-3-苯基丙酸苯甲酰腙二(2,4-二氯苄基)锡配合物及其制备方法和应用