一种万古霉素核酸二聚体生物传感器、制备方法及其应用与流程
本发明涉及一种万古霉素核酸二聚体的生物传感器及其制备方法及其在革兰氏阳性致病菌检测中的应用,属于致病菌检测与纳米材料制备技术。
背景技术:
目前,用于致病菌检测的生物传感器多以酶、抗体、核酸或者噬菌体作为生物识别元件,采用光学、电化学或压电等信号转换元件将生物信号转变成可检测输出的光、电信号。新型生物传感器的设计工作主要集中在:寻找低成本、亲和力强、靶标广泛的生物识别分子和研发稳定性好、灵敏度高的信号转换元件。
近年来,万古霉素(vancomycin,van)二聚体衍生物因其成本低、亲和力强等优势,常常作为识别分子对革兰氏阳性(g+)致病菌(如金黄色葡萄球菌、肺炎链球菌、肠球菌等)进行生物标记。目前,已报道的万古霉素二聚体大多采用小分子有机化合物作为连接物进行单体的偶联。然而,小分子有机物在溶解性、生物相容性和万古霉素构象的可控性方面都存在缺陷。因此,本发明采用核酸分子替代小分子有机物用以解决以上问题。万古霉素偶联的核酸单链通过碱基互补配对作用形成二聚体。与小分子有机物相比,他们除了具有廉价、易修饰、良好的溶解性和生物相容性等优势外,还可以通过设计核酸分子的序列可以形成不同长短、不同构象的二聚体系列;因此,万古霉素核酸二聚体的创新性设计彻底解决了现有万古霉素二聚体存在的问题,并为革兰氏阳性致病菌提供了一个全面优化的低成本、强亲和力、“广谱”的生物识别元件。
在生物传感器的信号转换元件方面,通过万古霉素核酸二聚体的设计引入核酸末端保护和滚环扩增技术,为后续致病菌信号的转化和放大提供了切入口。核酸末端保护法是一种用于各种分子相互作用的生物传感分析方法。该方法主要通过dna末端修饰的小分子与相应蛋白结合后产生空间位阻,阻止核酸外切酶的酶切作用,从而将小分子是否与蛋白相互作用转化为dna序列存在与否的问题。滚环扩增技术是一种新型的恒温核酸扩增方法,能够在恒温下以环状单链dna为模板进行相对无限单链扩增,产生多个单元拷贝的长单链dna分子,其扩增倍数甚至达到105-109。滚环扩增技术不需要特定的热循环仪,并具有高特异性、高灵敏度和易操作等优点,并逐渐作为一种痕量的分子检测方法,用于极微量甚至单分子水平的生物分子和生物标识物检测。本发明借助万古霉素核酸二聚体与细菌细胞壁的紧密结合产生空间位阻,阻止核酸外切酶iii的酶切作用,将革兰氏阳性细菌的识别信号转化为特定序列的核酸保存信号,通过存留下来的核酸序列,以环形dna为模板,在phi29dna聚合酶作用下,启动滚环扩增反应,实现核酸信号的循环放大,并以扩增放大的核酸分子为基质介导功能化银纳米三角片的有序组装,产生可控的表面等离子共振(surfaceplasmaresonance,spr)和表面增强拉曼散射(surfaceenhancedramanscattering,sers)多种传感信号。核酸末端保护法和滚环扩增技术的引入,将生物识别过程与信号产生过程有效分离,实现信号的循环放大和功能纳米材料的可控组装,提高了spr和sers信号的可控性和稳定性。
综上所述,万古霉素二聚体的生物传感器是以万古霉素核酸二聚体作为识别分子,以功能化银纳米片为信号转换元件,借助核酸末端保护和滚环复制放大技术,将致病菌的识别信号转化为循环放大的核酸信号,并以其为基质介导功能化银纳米片的有序组装,产生超高灵敏度和良好稳定性的spr和sers多种传感信号。目前还未发现类似技术。
技术实现要素:
本发明的目的在于克服上述已有技术的不足,提供一种万古霉素二聚体的生物传感器的制备方法及其应用。本发明提供的新型生物传感器具有靶向性好、灵敏度高、稳定性强等优点,能够满足实际生产生活的需求。
本发明的第一个目的可以通过如下技术方案来实现:一种万古霉素二聚体的生物传感器,其特征在于其包括作为识别分子的万古霉素二聚体、起信号放大作用的核酸末端保护及滚环扩增体系和作为信号转换元件的功能化银纳米三角片三部分;
万古霉素分子的羧基活化位点与核酸单链的氨基共价偶联。两个万古霉素核酸单体通过核酸序列的碱基互补配对形成二聚体,识别革兰氏阳性细菌;核酸末端保护及滚环扩增体系包括核酸外切酶iii、环形模板dna和phi29dna聚合酶。该体系将革兰氏阳性细菌的识别信号转化为特定序列的核酸保存信号,通过存留下来的核酸序列启动滚环扩增反应,实现核酸信号的循环放大;功能化的银纳米三角片表面共价修饰含巯基的核酸单链,该核酸序列可与扩增放大的核酸分子互补配对,实现功能化银纳米三角片的有序组装。
本发明的第二个技术目的可以通过以下技术方案来实现:上述万古霉素二聚体的生物传感器的制备方法,其特征在于其包含以下步骤:
(1)制备两种万古霉素核酸单体,其核酸序列互补配对,形成万古霉素核酸二聚体;
(2)设计合成环形模板dna和含巯基的核酸单链;
(3)合成银纳米三角片;
(4)在银纳米三角片同时修饰拉曼探针分子和含巯基的核酸单链,形成功能化的金银复合纳米颗粒;
(5)生物传感器中,万古霉素核酸二聚体作为识别分子紧密结合到革兰氏阳性致病菌表面形成空间位阻,阻止核酸外切酶iii的酶切作用,将细菌的识别信号转化为特定序列的核酸保存信号,通过存留下来的核酸序列,以环形dna为模板,在phi29dna聚合酶作用下,启动滚环扩增反应,实现信号的循环放大,并以扩增放大的核酸分子为基质介导功能化银纳米三角片的有序组装,产生可控的spr和sers多种传感信号(见图2)。
优选的,所述步骤1中万古霉素核酸单体通过万古霉素的羧基与核酸单链的5’端的氨基进行缩合反应生成。
优选的,所述的步骤1中,核酸单链与万古霉素的摩尔比为1:0.1-1:1;所用缩合剂为n-乙基-n′-(3-二甲基氨丙基)碳二亚胺和三乙胺或o-苯并三氮唑-四甲基脲六氟磷酸酯和n,n-二异丙基乙胺;缩合反应时间控制在12hr-16hr。
优选的,所述的步骤1中,万古霉素核酸单体形成二聚体时所用缓冲液体系为tris-edta缓冲液,反应时间为0.5hr-2hr。
优选的,所述步骤2中,环形模板dna含有万古霉素二聚体中一个单体的核酸序列。含巯基核酸单链含有万古霉素核酸二聚体中另外一个单体的核酸序列。
优选的,所述步骤3中,所述的银纳米三角片采用双氧水氧化法制备,最终合成的银纳米三角片的边长为20-30nm;银片厚度为7-8nm。
优选的,所述步骤3中,所述的银纳米三角片采用双氧水氧化法制备时,其中合成银纳米片时所用双氧水的质量体积百分浓度终为0.105%-0.135%。
优选的,所述步骤4中,拉曼探针分子为小分子的4-巯基苯甲酸或4-巯基苯胺,其和含巯基核酸单链通过银硫键连接到银纳米片表面,且4-巯基苯甲酸与含巯基核酸单链的摩尔比为4:1-6:1。
本发明的第三个技术目的是通过以下技术方案来实现的:上述万古霉素二聚体的生物传感器在革兰氏阳性致病菌检测中的应用。
本发明同已有技术相比可产生如下积极效果:
首先,本发明借助万古霉素偶联的单链核酸分子之间的互补配对,巧妙地设计构建万古霉素核酸二聚体。这一创新性设计彻底解决了现有万古霉素二聚体存在的问题,为所有革兰氏阳性致病菌提供了一个全面优化的“广谱”识别分子,使本项目设计的生物传感器在革兰氏阳性致病菌检测中具有普遍通用性,为其进一步的商品化奠定基础。
其次,本发明还首次将核酸末端保护分析方法推广应用到致病菌检测研究。通过新型生物传感器的巧妙设计,将该方法与滚环扩增技术结合起来。一方面,极大地提高了检测的灵敏度,解决了常规生物传感器在单细菌水平的检测局限;另一方面,也为纳米颗粒的有序组装提供了稳定的核酸基质,解决了以往生物传感器在稳定性和可控性方面的问题。
附图说明:
图1是本发明中万古霉素核酸二聚体的生物传感器示意图;
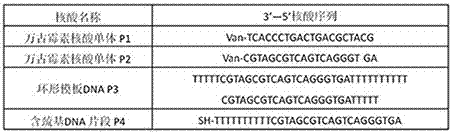
图2是本发明中的核酸序列;
图3是本发明中核酸外切酶exoiii的酶切实验以及致病菌的抑制酶切实验的凝胶电泳结果;条带1:万古霉素核酸二聚体;2:万古霉素核酸二聚体+核酸外切酶iii+e.faecalis(g+致病菌);3:万古霉素核酸二聚体+核酸外切酶iii;4:万古霉素核酸二聚体+核酸外切酶iii+e.coli(革兰氏阴性细菌)
图4是银纳米三角片的投射电镜结果;
图5是本发明中万古霉素核酸二聚体的生物传感器用于革兰氏阳性致病菌enterococcusfaecalis检测的实验结果((a)和(b)为紫外可见光光谱的定性和定量检测结果;(c)和(d)为表面增强拉曼光谱的定性和定量分析结果)。
具体实施方式:下面结合附图的本发明的具体实施方式做详细说明:
实施例1:
一种万古霉素核酸二聚体生物传感器的制备过程如下:
(1)万古霉素核酸单体的合成:
将1mg万古霉素和20ng核酸溶入0.5mltris-edta缓冲液中,加入1mgn-乙基-n′-(3-二甲基氨丙基)碳二亚胺和2μl三乙胺。冰浴反应12hr后,产物经高效液相色谱分离和质谱确认后,收集后冷冻干燥。即得到万古霉素核酸单体。
(2)万古霉素核酸二聚体的合成:
将上述两种不同核酸序列的万古霉素核酸单体各2ng溶于20μltris-edta缓冲液中,4℃放置12hr,即得到0.1ng/μl万古霉素核酸二聚体。
(3)制备功能化的银纳米三角片:
将2ml50mm的硝酸银溶液、20ml75mm的柠檬酸钠溶液依次加入到960ml超纯水中,快速搅拌后依次迅速加入3.5ml30%双氧水和10ml100mm的硼氢化钠溶液,室温搅拌5min后可见溶液从无色迅速变为紫色,继续搅拌60min使其充分反应即可得银纳米三角片,电镜观察其边长约为20-30nm。取1ml上述溶液,加入10nmol含硫核酸,4℃搅拌反应过夜后,12000rpm离心30min,去除上清加入1ml磷酸缓冲液。本实例制备获得的银纳米三角片透射电镜和光动力学散射图见图4。
(4)向步骤1制成的1ml0.2nmol/l的银纳米三角牌中,分别加入3μl5nmol/l的4-巯基苯甲酸和12μl5nmol/l的含硫核酸单链,搅拌反应1hr后,离心去除上清,向沉淀中加入1ml超纯水,制成功能化的银纳米三角片。
(5)将万古霉素核酸二聚体作为识别分子,利用其紧密结合到革兰氏阳性致病菌表面形成的空间位阻阻止核酸外切酶iii的酶切作用,使细菌的识别信号转化为特定序列的核酸保存信号,通过存留下来的核酸序列,以环形dna为模板,在phi29dna聚合酶作用下,启动滚环扩增反应,实现信号的循环放大,并以扩增放大的核酸分子为基质介导功能化银纳米三角片的有序组装,产生可控的spr和sers多种传感信号,并借助相应设备的信号采集,完成生物传感器的构建。
实施例2:万古霉素核酸二聚体的生物传感器检测革兰氏阳性致病菌肠球菌enterococcusfaecalis(atcc51299)。
(1)选用革兰氏阳性致病菌肠球菌enterococcusfaecalis为模型,考察万古霉素核酸二聚体的生物传感器的检测性能,其检测结果如图5所示。在图5(a)和(b)为紫外可见光光谱的定性和定量检测结果;(c)和(d)为表面增强拉曼光谱的定性和定量分析结果。
(2)万古霉素核酸二聚体的生物传感器能够实现对革兰氏阳性致病菌肠球菌enterococcusfaecalis的定性和定量检测。首先,将培养好的细菌用neb反应缓冲液洗涤三次,并稀释成不同浓度的菌液;其次,将10μl0.1ng/μl万古霉素核酸二聚体加入60μl不同浓度的菌液中,37℃孵育30min;继续加入10μl1μg/ml核酸外切酶iii,37℃孵育30min。然后,将反应体系加热至95℃并保持该温度10min后冷却至室温,加入10μl2ng/ul的环形模板dna和10μl1μg/ml的phi29dna聚合酶,室温反应2hr。最后,将上述反应体系加入到900μl功能化的银纳米三角片溶液,室温孵育10min后测试紫外可见光光谱和拉曼光谱。
实施例3:万古霉素核酸二聚体的生物传感器检测革兰氏阳性致病菌肠球菌enterococcusfaecium(atcc51559)。
选用革兰氏阳性致病菌肠球菌enterococcusfaecium为模型,考察万古霉素核酸二聚体的生物传感器的检测性能。万古霉素核酸二聚体的生物传感器能够实现对革兰氏阳性致病菌肠球菌enterococcusfaecium的定性和定量检测。首先,将培养好的细菌用neb反应缓冲液洗涤三次,并稀释成不同浓度的菌液;其次,将10μl0.1ng/μl万古霉素核酸二聚体加入60μl不同浓度的菌液中,37℃孵育30min;继续加入10μl1μg/ml核酸外切酶iii,37℃孵育30min。然后,将反应体系加热至95℃并保持该温度10min后冷却至室温,加入10μl2ng/ul的环形模板dna和10μl1μg/ml的phi29dna聚合酶,室温反应2hr。最后,将上述反应体系加入到900μl功能化的银纳米三角片溶液,室温孵育10min后测试紫外可见光光谱和拉曼光谱。
实施例4:万古霉素核酸二聚体的生物传感器检测革兰氏阳性致病菌金黄色葡萄球菌staphylococcusaureus(atcc29213)。
选用革兰氏阳性致病菌金黄色葡萄球菌为模型,考察万古霉素核酸二聚体的生物传感器的检测性能。万古霉素核酸二聚体的生物传感器能够实现对革兰氏阳性致病菌金黄色葡萄球菌的定性和定量检测。首先,将培养好的细菌用neb反应缓冲液洗涤三次,并稀释成不同浓度的菌液;其次,将10μl0.1ng/μl万古霉素核酸二聚体加入60μl不同浓度的菌液中,37℃孵育30min;继续加入10μl1μg/ml核酸外切酶iii,37℃孵育30min。然后,将反应体系加热至95℃并保持该温度10min后冷却至室温,加入10μl2ng/ul的环形模板dna和10μl1μg/ml的phi29dna聚合酶,室温反应2hr。最后,将上述反应体系加入到900μl功能化的银纳米三角片溶液,室温孵育10min后测试紫外可见光光谱和拉曼光谱。
实施例5:万古霉素核酸二聚体的生物传感器检测革兰氏阳性致病菌单核细胞增生李斯特氏菌listeriamonocytogenes(atcc19115)。
选用革兰氏阳性致病菌单核细胞增生李斯特氏菌为模型,考察万古霉素核酸二聚体的生物传感器的检测性能。万古霉素核酸二聚体的生物传感器能够实现对革兰氏阳性致病菌单核细胞增生李斯特氏菌的定性和定量检测。首先,将培养好的细菌用neb反应缓冲液洗涤三次,并稀释成不同浓度的菌液;其次,将10μl0.1ng/μl万古霉素核酸二聚体加入60μl不同浓度的菌液中,37℃孵育30min;继续加入10μl1μg/ml核酸外切酶iii,37℃孵育30min。然后,将反应体系加热至95℃并保持该温度10min后冷却至室温,加入10μl2ng/ul的环形模板dna和10μl1μg/ml的phi29dna聚合酶,室温反应2hr。最后,将上述反应体系加入到900μl功能化的银纳米三角片溶液,室温孵育10min后测试紫外可见光光谱和拉曼光谱。
实施例6:万古霉素核酸二聚体的生物传感器检测革兰氏阴性致病菌大肠杆菌escherichiacoli(atcc53868)。
选用革兰氏阴性菌大肠杆菌escherichiacoli为模型,考察万古霉素核酸二聚体的生物传感器的检测专一性。首先,将培养好的细菌用neb反应缓冲液洗涤三次,并稀释成不同浓度的菌液;其次,将10μl0.1ng/μl万古霉素核酸二聚体加入60μl不同浓度的菌液中,37℃孵育30min;继续加入10μl1μg/ml核酸外切酶iii,37℃孵育30min。然后,将反应体系加热至95℃并保持该温度10min后冷却至室温,加入10μl2ng/ul的环形模板dna和10μl1μg/ml的phi29dna聚合酶,室温反应2hr。最后,将上述反应体系加入到900μl功能化的银纳米三角片溶液,室温孵育10min后测试紫外可见光光谱和拉曼光谱。结果表明,万古霉素核酸二聚体的生物传感器对革兰氏阴性致病菌肠球菌escherichiacoli无信号响应。
以上的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案作出的各种变形和改进,均应落入本发明的权利要求书确定的保护范围内。
5'-3'
p1:van-tcaccctgactgacgctacg
p2:van-cgtagcgtcagtcagggtga
环形p3:tttttcgtagcgtcagtcagggtgattttttttttcgtagcgtcagtcagggtgattttt
巯基p4:sh-ttttttttttcgtagcgtcagtcagggtga
- 还没有人留言评论。精彩留言会获得点赞!