一种合成取代的1‑磺酰基‑1H‑吡唑的方法与流程
本发明属于有机合成技术领域,一种高效率合成取代的1-磺酰基-1h-吡唑的方法。
背景技术:
含氮杂环是一类重要的化合物,在有机合成化学,药物化学,材料化学中有广泛的应用,比如维生素b12、阿托伐他汀钙、多聚吡唑复合材料等。在众多的含氮杂环中,吡唑这一核心化学骨架,展现了广泛的生物活性,比如镇痛、退热、抗炎、抗菌等。
技术实现要素:
本发明的目的在于克服现有制备技术的缺陷,提供一种起始原料简单易得,收率高,操作方便的1-磺酰基-1h-吡唑合成方法。
为解决上述技术问题,本发明提供的技术方案为:
一种合成取代的1-磺酰基-1h-吡唑的方法,该方法是将磺酰腙、n,n-二取代丙二腈、路易斯酸催化剂,依次加入有机溶剂中,回流条件下合成多取代吡唑化合物,反应式如下:
其中:
(6)r1、r2不在同一个环系上时,r1可为烷基,r2可为烷基,r3可为苯磺酰基、3,4,6-三甲基苯磺酰基。
(7)r1、r2不在同一个环系上时,r1可为苯基或者取代的苯基基团,r2为氢原子、甲基,r3可为苯磺酰基、3,4,6-三甲基苯磺酰基。
(8)r1为单取代苯基时,取代基可为苯环上邻、间、对各个位置独立取代的卤素、甲基、甲氧基、氟、三氟甲基等。
(9)r1为双取代苯基时,r1可为3,5-双三氟甲基苯基、3,4-二甲氧基苯基。
(10)r1、r2在同一环系上时,环系可为环戊基、环己基、环庚基、环辛基、四氢奈基、四氢吡喃基等。
上述的一种合成取代的1-磺酰基-1h-吡唑的方法,所述的催化剂选自:三氟甲烷磺酸锌、三氟甲烷磺酸铜、三氟甲烷磺酸镱的其中之一,优选三氟甲烷磺酸锌。
上述的一种合成取代的1-磺酰基-1h-吡唑的方法,所述的溶剂选自n,n-二取代甲酰胺、正庚烷、1.2-二氯乙烷、四氢呋喃、1.4-二氧六环中的一种或几种,优选1.2-二氯乙烷。
上述的一种合成取代的1-磺酰基-1h-吡唑的方法,所述的加热温度为60-83℃,维持时间为24-36小时,优选83℃,维持36小时。
上述的一种合成取代的1-磺酰基-1h-吡唑的方法,所述的磺酰腙:n,n-二甲基丙二腈:催化剂的摩尔量比为:1﹕1.5﹕0.2-1.0。
与现有技术相比,本发明提供的技术方案将磺酰腙、n,n-二甲基丙二腈、路易斯酸催化剂依次加入到有机溶剂中,回流条件下取代1-对甲苯磺酰基-1h-吡唑。该合成方法起始原料简单,操作方便,能减少资金和劳动力的投入量,具有良好的实用价值和社会经济效率,对同类产品及下游产品的工艺开发具有很好的借鉴意义。
附图说明
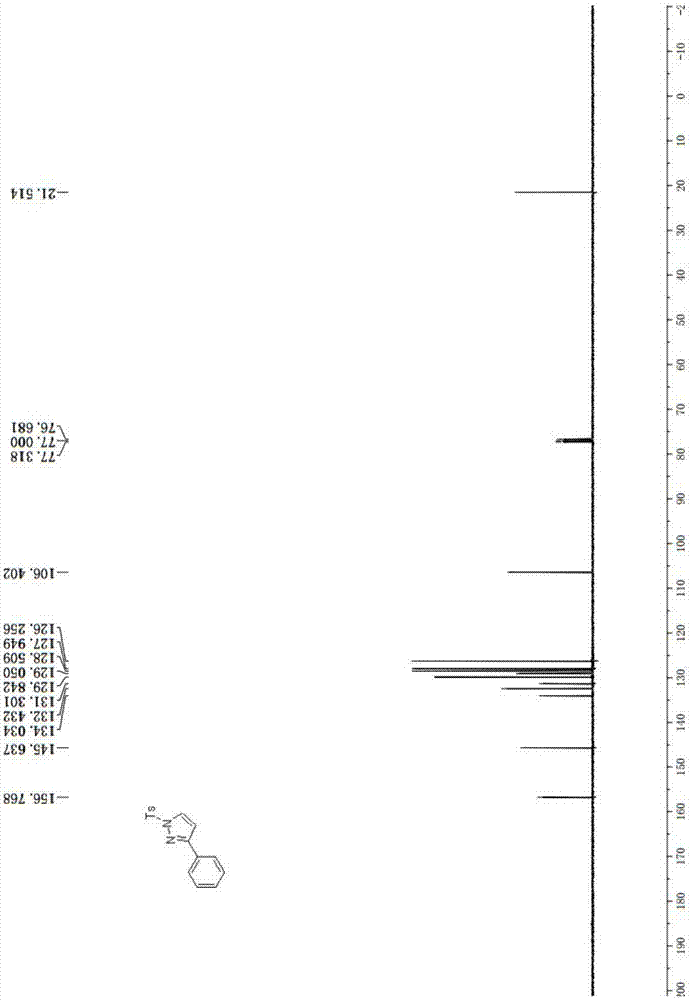
图1是本发明实施例1提供的13cnmr谱图;
图2是本发明实施例1提供的1hnmr谱图;
图3是本发明实施例2提供的13cnmr谱图;
图4是本发明实施例2提供的1hnmr谱图;
图5是本发明实施例3提供的13cnmr谱图;
图6是本发明实施例3提供的1hnmr谱图;
图7是本发明实施例4提供的13cnmr谱图;
图8是本发明实施例4提供的1hnmr谱图;
图9是本发明实施例5提供的13cnmr谱图;
图10是本发明实施例5提供的1hnmr谱图;
图11是本发明实施例6提供的13cnmr谱图;
图12是本发明实施例6提供的1hnmr谱图;
图13是本发明实施例7提供的13cnmr谱图;
图14是本发明实施例7提供的1hnmr谱图;
图15是本发明实施例8提供的13cnmr谱图;
图16是本发明实施例8提供的1hnmr谱图;
图17是本发明实施例9提供的13cnmr谱图;
图18是本发明实施例9提供的1hnmr谱图。
具体实施方式
以下通过具体实施例对本发明做进一步的说明,但不应该将此理解为本发明上述主题的范围仅限于以下的实施例,凡基于本发明上述内容实现的技术均属于本发明的范围。
实施例1以对甲苯磺酰基苯乙酮为底物(反应式1)
将对甲苯磺酰基苯乙酮(50mg,0.174mmol),n,n-二甲基丙二腈(28.4mg,0.260mmol),三氟甲烷磺酸锌(31.6mg,0.087mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(47mg,92%)。
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ8.13(d,j=2.8hz,1h),7.94(d,j=8.0hz,2h),7.83–7.80(m,2h),7.41–7.34(m,3h),7.29(d,j=8.0hz,2h),6.70(d,j=2.8hz,1h),2.36(s,3h);13cnmr(100mhz,cdcl3)δ156.77,145.64,134.03,132.43,131.30,129.84,129.05,128.51,127.95,126.26,106.40,21.51;熔程为139℃-143℃。
实施例2以4-氯-苯乙酮对甲苯磺酰腙为底物(反应式2)
将4-氯-苯乙酮对甲苯磺酰腙(50mg,0.155mmol),n,n-二甲基丙二腈(25.4mg,0.233mmol),三氟甲烷磺酸锌(28.2mg,0.078mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(42.8mg,83%)。
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ8.12(d,j=2.8hz,1h),7.94–7.92(m,2h),7.74–7.72(m,2h),7.36–7.31(m,4h),7.66(d,j=2.8hz,1h),2.40(s,3h);13cnmr(100mhz,cdcl3)δ155.69,145.84,135.00,134.01,132.59,129.98,129.95,128.80,128.12,127.62,106.25,21.66;熔程为115℃-118℃。
实施例3以4-甲氧基-苯乙酮对甲苯磺酰腙为底物(反应式3)
将4-甲氧基-苯乙酮对甲苯磺酰腙(50mg,0.157mmol),n,n-二甲基丙二腈(25.7mg,0.236mmol),三氟甲烷磺酸锌(28.6mg,0.079mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(46.9mg,91%)。
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ8.09–8.08(m,1h),7.92–7.90(m,2h),7.75–7.72(m,2h),7.29–7.27(m,2h),6.91–6.88(m,2h),6.63–6.62(m,1h),3.80(s,3h),2.36(s,3h);13cnmr(100mhz,cdcl3)δ160.30,156.66,145.53,134.13,132.43,129.82,127.91,127.65,123.97,113.88,106.15,55.17,21.54;熔程为95℃-99℃。
实施例4以苯丙酮对甲苯磺酰腙为底物(反应式4)
将苯丙酮对甲苯磺酰腙(50mg,0.166mmol),n,n-二甲基丙二腈(27.1mg,0.248mmol),三氟甲烷磺酸锌(30.1mg,0.083mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(16.5mg,32%)。
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ7.93–7.91(m,3h),7.66–7.63(m,2h),7.42–7.36(m,3h),7.32–7.29(m,2h),2.40(s,3h),2.20(d,j=1.0hz,3h);13cnmr(100mhz,cdcl3)δ156.27,145.41,134.27,131.92;130.64,129.81,128.56,128.31,127.87,127.82,118.03,21.56,10.06;熔程为113℃-115℃。
实施例5以正戊酮对甲苯磺酰腙为底物(反应式5)
将正戊酮对甲苯磺酰腙(50mg,0.197mmol),n,n-二甲基丙二腈(32.2mg,0.295mmol),三氟甲烷磺酸锌(35.8mg,0.098mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(18.2mg,35%)。
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ7.82–7.80(m,2h),7.71(s,1h),7.28–7.25(m,2h),2.53(q,j=7.6hz,2h),2.37(s,3h),1.96(s,3h),1.14(t,j=7.6hz,3h);13cnmr(100mhz,cdcl3)δ160.26,145.04,134.61,129.69,129.64;127.63,118.44,21.54,20.09,12.42,8.25;熔程为108℃-112℃。
实施例6以环己酮对甲苯磺酰腙为底物时(反应式6)
将环己酮对甲苯磺酰腙(50mg,0.188mmol),n,n-二甲基丙二腈(30.7mg,0.282mmol),三氟甲烷磺酸锌(34,2mg,0.094mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(29.1mg,56%)
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ7.76(d,j=8.4hz,2h),7.67(s,1h),7.20(d,j=8.0hz,2h),2.55(t,j=6.4hz,2h),2.43(t,j=6.4hz,2h),2.29(s,3h),1.67–1.54(m,4h).13cnmr(100mhz,cdcl3)δ156.11,145.00,134.23,129.56,127.43,127.25,119.85,23.31,22.38,21.30,20.04;熔程为131℃-135℃。
实施例7以四氢吡喃酮对甲苯磺酰腙为底物(反应式7)
将四氢吡喃酮对甲苯磺酰腙(50mg,0.186mmol),n,n-二甲基丙二腈(30.5mg,0.280mmol),三氟甲烷磺酸锌(33.9mg,0.093mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(29.1mg,56%)。
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ7.86(d,j=8.4hz,2h),7.78(s,1h),7.31(d,j=8.4hz,2h),4.66(s,2h),3.88(t,j=5.6hz,2h),2.78(t,j=5.6hz,2h),2.41(s,3h);13cnmr(100mhz,cdcl3)δ152.68,145.61,134.26,129.96,127.95,125.22,117.90,64.88,62.68,24.39,21.67;熔程为106℃-110℃。
实施例8以茚酮对甲苯磺酰腙为底物时(反应式8)
将茚酮对甲苯磺酰腙(50mg,0.167mmol),n,n-二甲基丙二腈(27.2mg,0.250mmol),三氟甲烷磺酸锌(30.3mg,0.083mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(35.1mg,68%)。
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ7.92–7.88(m,3h),7.84–7.81(m,1h),7.45–7.42(m,1h),7.35–7.30(m,2h),7.28–7.26(m,2h),3.64(s,2h),2.36(s,3h);13cnmr(100mhz,cdcl3)δ165.76,148.84,145.33,134.56,132.42,129.83,128.81,127.74,127.29,126.90,125.90,125.25,121.85,28.24,21.56;熔程为131℃-135℃。
实施例9以苯磺酰基苯乙酮为底物时(反应式9)
将苯磺酰基环己酮(50mg,0.182mmol),n,n-二甲基丙二腈(29.8mg,0.274mmol),三氟甲烷磺酸锌(33,2mg,0.091mmol),依次加入加入到搅拌的dce(2ml)中,在回流条件下反应,反应36小时。萃取、洗涤、干燥、浓缩、纯化即得到白色固体(43.5mg,84%)
产物检测数据如下:
1hnmr(400mhz,cdcl3)δ8.15(d,j=2.8hz,1h),8.08–8.05(m,2h),7.83–7.80(m,2h),7.64–7.59(m,1h),7.54–7.50(m,2h),7.42–7.36(m,3h),6.72(d,j=2.8hz,1h);13cnmr(100mhz,cdcl3)δ157.00,137.11,134.38,132.59,131.26,129.26,129.18,128.59,127.95,126.33,106.62;熔程:99℃-103℃.
以上所述,仅是本发明的较佳实施例而已,并非对本发明做任何形式上的限制,故凡未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同变化与修饰,均仍属于本发明技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种N‑取代吡唑并[3,4‑d]嘧啶酮类化合物及制备方法与应用与流程
- 取代吡唑酰胺类化合物及其应用的制造方法与工艺
- 取代的吡唑并[1,5‑a]嘧啶以及它们在治疗医学障碍中的用途的制造方法与工艺
- 取代的吡唑并[1,5‑a]嘧啶以及它们在治疗医学障碍中的用途的制造方法与工艺
- 取代二氢吡咯并吡唑化合物的制造方法与工艺
- 取代的吡唑并[1,5‑a]吡啶和咪唑并[1,2‑a]吡嗪及其用途的制造方法与工艺
- 经取代的吡唑基吡唑衍生物及其作为除草剂的用途的制造方法与工艺
- 经取代的吡唑基吡唑衍生物及其作为除草剂的应用的制造方法与工艺
- 经取代的吡唑基吡唑衍生物及其作为除草剂的用途的制造方法与工艺
- 经取代的吡唑基吡唑衍生物及其作为除草剂的应用的制造方法与工艺
- 一种4‑氨基安替比林产品的合成工艺及其试液的配备方法与制造工艺
- 一种吡唑酮生产工艺的制造方法与工艺
- 一类含呋喃的苯基联吡唑甲酰胺类衍生物及其制备方法和用图
- N’?5?(取代苯基)?2?呋喃甲酰基?5?丙基?1h?吡唑?3?甲酸乙酯类化合物及其制备方法和应用
- 吡唑啉酮化合物及其用图
- 5-(4-氟苯基)-N–吗啉基-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 5-(4-氟苯基)-N–(4-氯苯基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 含醚性氧原子的全氟烷基取代吡唑环化合物及其制造方法
- 5-(4-氟苯基)-N–(4-氯苯乙基)-7-三氟甲基吡唑并[1,5-a]嘧啶-3-酰胺的合成方法
- 含有色酮结构的吡唑类n‐对硝基苯基马来酰亚胺衍生物及其制备方法与应用