叶酸受体α特异性结合肽1及其应用的制作方法
技术领域:
本发明属于生物技术领域,涉及一种叶酸受体α特异性结合的短肽及其在肿瘤靶向中的应用。
背景技术:
:
噬菌体展示技术是将外源多肽或蛋白与噬菌体的某种衣壳蛋白进行融合表达,使外源蛋白能展示在病毒颗粒表面,同时使编码外源蛋白的dna位于该病毒粒子内。随机十二肽噬菌体展示文库是将随机十二肽融合到m13噬菌体次要衣壳蛋白(piii)上,为一个组合文库。所展示的十二肽表达在piii的n末端。这就在大量的随机多肽与其dna编码序列之间建立起了直接的桥梁,再用各种靶分子(抗体、酶、细胞表面受体等)来进行体外筛选获得靶分子结合肽。体外选择程序简单来说就是噬菌体库与固相靶分子共孵育,洗涤去除未结合噬菌体,然后洗脱得到能与靶分子特异性结合的噬菌体。被洗脱的噬菌体还需进行扩增,进行下一轮的结合/扩增循环,来富集特异性结合噬菌体。经3~4轮“淘选”后,通过dna测序可以得到每个特异性结合的多肽序列。
叶酸受体(folatereceptor,fr)是结合并转运叶酸及其衍生物进入细胞的重要转运体,在体内主要以三种亚型存在:frα、β和γ。叶酸受体α(folatereceptorα,frα)是一种由糖基化磷脂酰肌醇(gpi)锚定于细胞膜表面的糖蛋白。已有文献报道,卵巢癌、肺癌、肝癌、乳腺癌等组织中frα呈高表达,而在正常组织中限制性表达,因此被认为是极具潜力的卵巢癌标志物或肿瘤相关抗原(taa);frα对卵巢癌具有的高度特异性,可作为治疗相关肿瘤的靶点;部分研究也表明,frα对于卵巢癌的早期诊断具有重要价值。基于此,若能得到与frα具有较高亲和力的短肽序列,将为肿癌的靶向性治疗和诊断提供新思路。
技术实现要素:
发明目的
本发明的目的在于利用噬菌体展示技术获得一种能与叶酸受体α特异性结合的多肽。该多肽可用于靶向叶酸受体α表达阳性的肿瘤细胞。
技术方案
为了实现上述目的,本发明所采用的技术方案如下:
1)噬菌体展示肽库的亲和筛选:以叶酸受体α重组蛋白为靶标,运用噬菌体展示十二肽库进行四轮生物筛选。每轮筛选检测回收率和多克隆elisa,以判断筛选是否有效;通过单克隆elisa检测各克隆与叶酸受体α重组蛋白的结合能力;
2)噬菌体阳性单克隆dna的制备及测序鉴定:根据上述elisa结果,选择阳性值高的噬菌体单克隆,对其进行扩增后进行测序模块的快速纯化以产生足够纯的模板进行测序,选用-96giii测序引物送到公司进行测序,分析阳性噬菌体相应展示肽序列;
3)细胞elisa检测噬菌体克隆与天然细胞表面叶酸受体α的结合:选取frα表达阳性细胞株skov3,并以frα表达阴性细胞株hepg2为对照,通过elisa检测噬菌体克隆与细胞株的结合;
4)通过流式细胞术进一步确认噬菌体克隆与frα表达阳性细胞株skov3的结合;
5)运用体内归巢实验检测噬菌体克隆在荷瘤裸鼠体内组织器官的分布情况;
6)合成fitc标记多肽,尾静脉注射balb/c荷瘤裸鼠,运用成像技术检测多肽在主要脏器内的分布。
有益效果
本发明提供的frα结合肽,可特异性结合frα重组蛋白,同时通过细胞elisa及流式细胞术实验分析,发现筛选出的噬菌体展示短肽能与细胞表面天然frα特异性结合。通过体内归巢实验及动物成像分析,该多肽能有效富集于frα高表达的肿瘤部位,而在其他正常组织中分布较少,具有一定的靶向性。具有潜在的医学和药学价值,为肿瘤的靶向性治疗和影像检测提供一种新的方法。
附图说明:
图1.多克隆elisa;
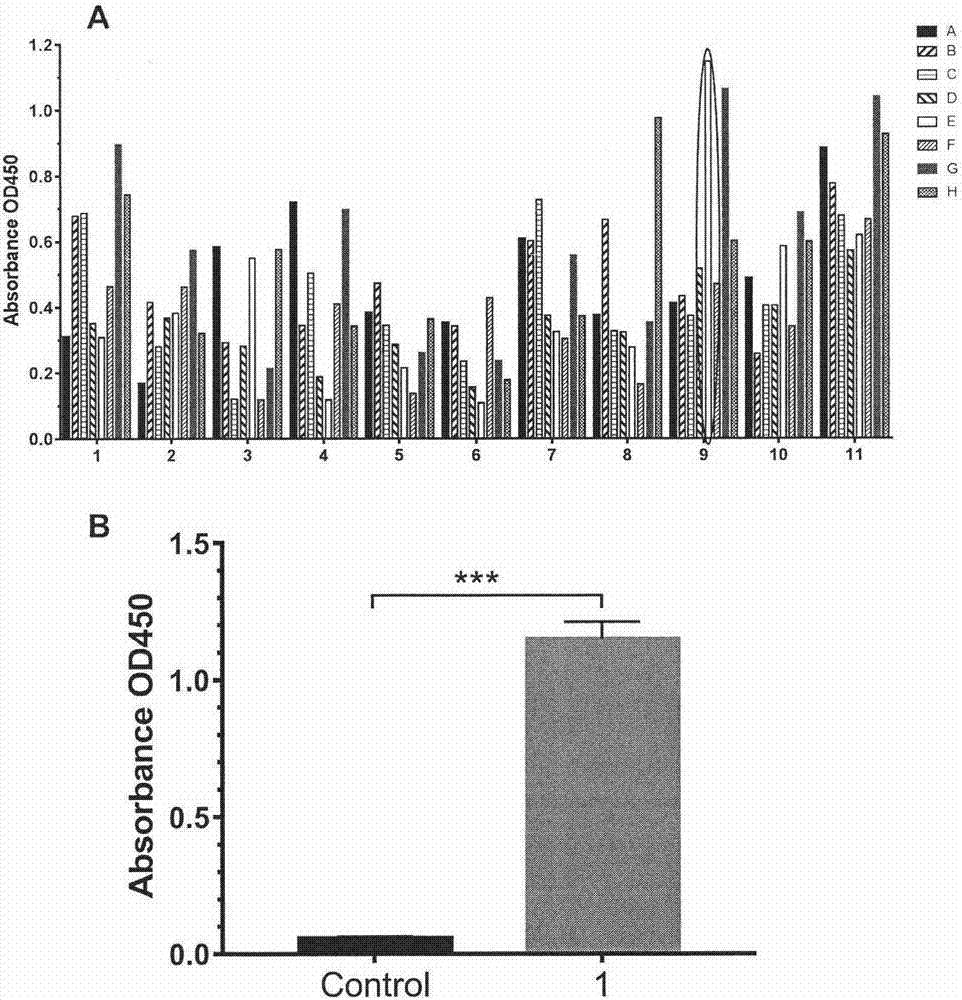
图2.阳性单克隆与叶酸受体α重组蛋白结合能力的研究。图2a.单克隆噬菌体elisa筛选阳性克隆(圈出的克隆为叶酸受体α特异性结合肽1展示克隆);图2b.阳性单克隆与叶酸受体α重组蛋白结合的进一步验证;
图3.细胞elisa检测筛选到的阳性单克隆与frα表达阳性细胞skov3的结合,以m13以及frα表达阴性细胞hepg2为对照;
图4.流式细胞术实验分析阳性单克隆与skov3的特异性结合情况,对照组如图中虚线所示,仅加入抗m13抗体与fitc荧光抗体的skov3细胞;
图5.体内归巢实验检测阳性噬菌体在荷瘤裸鼠体内组织器官的分布情况;
图6.成像技术分析fitc标记多肽在荷瘤裸鼠体内的分布情况。尾静脉注射fitc多肽2小时后解剖,检测各器官组织的荧光强度(mfi)。参数:激发光:470nm;发射光:535nm。
具体实施方式:
为了更清楚地阐述本发明,下述内容提供了较为具体的实施方案,本领域的技术人员应该理解,本发明并不仅仅限定于下述实施例。
实施例1噬菌体展示肽库的亲和筛选
随机十二肽噬菌体展示文库购自neb公司,100μl,滴度为1.5×1013pfu/ml。贮存于含50%甘油的tbs缓冲液(50mmtris-hcl,150mmnacl[ph7.5])中,库容量2.7×109个转化子。escherichiacoiler2738是此肽库的宿主菌。
(1)准备工作
将frα重组蛋白用包被缓冲液(碳酸盐缓冲液[ph9.6])稀释至终浓度50μg/ml,稀释后的溶液以每孔100μl包被酶标板,并反复旋转直至表面完全湿润。在湿盒中4℃孵育过夜。
(2)亲和筛选
第二天倒掉酶标板中的包被液,用tbst缓冲液(tbs+体积比0.1%[v/v]tween-20)洗板,倾去缓冲液,在干净的吸水纸上拍甩以除去残余的液体。之后在每孔中加入200μl封阻液(0.1mnahco3,5mg/mlbsa,0.02%nan3[ph8.6]),置湿盒中4℃孵育过夜或是37℃孵育至少1小时。弃去封阻液,每孔加满tbst缓冲液,洗板6次,每次洗涤5分钟,置于脱色摇床上进行。再倾去缓冲液,在干净的吸水纸上拍甩以除去残余的液体,执行此实验步骤时要快速以避免孔板干燥。用tbst缓冲液稀释原始文库,取稀释后的文库液100μl加入到预先包被frα重组蛋白的酶标板微孔内,加入噬菌体数量约为5×1012。在湿盒中4℃孵育过夜或37℃孵育2小时,弃去孔内液体,将酶标板倒置拍甩除去残余溶液,并用tbst缓冲液洗板10次,操作同前(洗去未结合的噬菌体)。最后一遍洗涤后,将孔内液体拍甩干净,向酶标板微孔中加入100μl非特异性缓冲液如0.2m甘氨酸-盐酸glycine-hcl缓冲液[ph2.2]来洗脱已结合的噬菌体,于室温条件下,脱色摇床上温和摇动10分钟以充分洗脱,再用15μl1mtris-hcl[ph9.1]中和上述洗脱液,转移到一个干净的ep管中。按常规m13方法取5μl洗脱液用来测定洗脱物的滴度,剩余洗脱液均加入到20ml处于对数前期的er2738菌种中进行第一轮噬菌体洗脱物的扩增,于37℃,220rpm摇床培养4.5小时,扩增产物转移到干净离心管中,经4℃,10,000rpm离心10分钟操作后,取约80%的噬菌体上清,转移到另一干净离心管中,加入1/6体积的peg/nacl(20%[w/v]peg-800,2.5mnacl),4℃放置至少1小时或过夜处理,进行噬菌体沉淀。4℃,10,000rpm离心10分钟,用微量移液器弃去残余上清,可再进行短暂离心以彻底吸弃上清。沉淀物重悬于200μltbs缓冲液中,再次离心后取上清,转移到干净的离心管中,此即为扩增后的洗脱物。取5μl洗脱物进行噬菌体滴度的测定。其余部分用于第二轮亲和筛选。重复以上步骤共进行四轮筛选。逐轮筛选增加洗涤步骤中tbst的洗涤次数。
(3)噬菌体滴度的测定
接种er2738菌种于10mllb培养基中,37℃摇床培养至对数中期(od600在0.5左右)。期间将上层琼脂于微波炉中加热溶解,分装到5ml灭菌ep管中,每管3ml,管数根据噬菌体稀释梯度而定,每个稀释梯度一管即可。分装的ep管置于45℃水浴锅中备用;同时准备lb/iptg/xgal培养平板,置于37℃培养箱备用。对收集的噬菌体上清用lb培养基进行10倍梯度稀释(一般扩增的噬菌体稀释范围:108~1011)。稀释完成后将处于对数中期的er2738菌液分装到若干个1.5ml灭菌ep管中,每管200μl。将稀释好的各个梯度的稀释物取10μl立即加到含菌液的ep管中,振荡混匀后于37℃孵育5分钟。随后将45℃放置的上层琼脂取出,管中内容物立即全部转移到上层琼脂中,快速颠倒混匀后倾倒在已预温过的lb/iptg/xgal培养平板上,轻轻晃动平板使上层琼脂均匀分布。待冷却凝固一段时间后,37℃倒置培养过夜。选取噬菌斑总数在100个左右的平板,计数平板上长出来的噬菌斑数目并计算出噬菌体效价(pfu)。根据每轮投入筛选的噬菌体量(输入滴度input)与洗脱得到的噬菌体量(输出滴度output),可计算每轮的产出/投入比,反映特异性噬菌体的富集程度(回收率recovery)。经过四轮筛选发现,与frα重组蛋白特异性结合的高亲和力的噬菌体得到了有效富集(见表1)。
表1每轮输入滴度、输出滴度与回收率的情况
实施例2噬菌体多克隆elisa鉴定
将frα重组蛋白用碳酸盐缓冲液[ph9.6]稀释至终浓度10μg/ml,每孔包被100μl,4℃包被过夜。隔天弃去靶分子溶液,并在干净的吸水纸上拍甩去除残余液体,扣干,用tbs缓冲液洗涤一次后,每孔加入200μl封阻液,37℃放置1~2小时。甩出封阻液,tbs缓冲液洗涤3次,每次5分钟,在干净的吸水纸上用力拍打,甩净洗涤液。洗涤完在每孔中加入100μl稀释的每一轮筛选扩增后的洗脱液(即噬菌体上清),37℃孵育2小时后弃去孔内液体,并用tbst缓冲液和tbs缓冲液依次洗涤3次,每次5分钟,拍甩除去洗涤液后加入hrp标记的小鼠抗m13抗体作为二抗(用封阻液稀释到工作浓度),37℃孵育2小时,弃去孔内液体,洗涤操作同上一操作。每孔加入100μltmb底物液进行显色,室温避光孵育10分钟,孔内液体应由无色变为蓝色;每孔加入50μl1mh2so4终止液,终止显色反应,在酶标仪上检测od450值。
结果表明,随着筛选轮数增加,洗脱物与frα重组蛋白结合的亲和力逐步增加,但在第四轮时亲和力有所下降(见图1)。
实施例3噬菌体单克隆的elisa鉴定及测序鉴定
(1)elisa检测单克隆噬菌体展示短肽对靶分子的结合能力
待测噬菌体的获取:需提前接种er2738菌种,37℃培养至对数前期,将此对数前期培养物转移到2ml深孔板中,每孔600μl。选择四轮筛选中用于检测滴度的平板(总量在100个左右及以下的噬菌斑的平板),用枪头随机挑取多个蓝色噬菌斑至深孔板中,37℃,220rpm摇床培养4.5小时。4℃,10,000rpm离心10分钟,弃去沉淀,每孔取100μl上清用于elisa检测,其余上清收集起来暂4℃保存。
elisa检测:以终浓度10μg/ml将靶分子frα重组蛋白溶于碳酸盐缓冲液[ph9.6]中,每孔包被100μl,在密封的湿盒中4℃包被过夜。甩出多余靶分子溶液,并在干净的纸巾上拍甩除去多余的液体后,每孔加200μl封闭液,37℃封闭1~2小时。甩出封阻液,tbst洗涤6次,拍甩干净酶标板后,将深孔板中获得的100μl上清按顺序依次加入,室温反应1~2小时,再用tbst洗涤6次(操作同上),用封阻液按1∶10000比例稀释hrp标记的抗m13抗体,按每孔100μl加入孔中,室温反应1~2小时,tbst充分洗涤6次(步骤同上),每孔加入100μltmb底物液(现配现用)显色,避光作用10分钟后每孔再加入50μl1mh2so4终止液,终止显色反应,在酶标仪上检测od450值。
结果见图2。图2a为初步检测结果(图2a所圈出的克隆为叶酸受体α特异性结合肽1展示克隆),单独挑取该克隆,经过进一步elisa实验验证其与frα重组蛋白的结合能力(图2b),其中pbs作为空白对照,实验组与pbs对照组比较有显著差异(p<0.05)。
(2)噬菌体阳性单克隆dna的制备及测序鉴定
根据上述elisa结果,选取阳性噬菌体单克隆进行扩增后再进行测序模块的快速纯化以产生足够纯的模板进行测序:将er2738过夜培养物按照1∶100接种于lb培养基中振摇到对数期后,分装1ml到培养管中。取10μl噬菌体阳性克隆到上述1ml培养管中。37℃摇床培养4.5~5小时。培养物转入微量离心管中,离心30秒。上清转入一个干净离心管,此即为扩增噬菌体贮液,若不立即进行接下去的实验,可暂4℃贮存。
测序模板的快速纯化:取上述收集的含噬菌体上清(体积约1ml),加入400μlpeg/nacl,颠倒混匀,室温放置10分钟后12,000rpm离心10分钟,弃上清,可再进行离心操作,彻底吸弃残余上清。沉淀物中加入200μl碘化物缓冲液(10mmtris-hcl,1mmedta,4mnai[ph8.0])并彻底重悬沉淀物,再加入500μl乙醇,室温孵育10分钟(使dna沉淀);12,000rpm离心10分钟,弃上清。用1ml预冷的70%乙醇清洗沉淀一次后12,000rpm离心10分钟,弃上清后开盖过夜风干,使乙醇充分挥发。最后将沉淀重悬于30μl双蒸水中,此即为测序模板,取5μl用1%琼脂糖凝胶电泳检测,检测合格后的dna选用-96giii测序引物送到公司进行测序,分析噬菌体相应的12肽序列。
通过比对,申请人获得了一条短肽seqidno.1:mhtapgwgyrls。
实施例4细胞elisa检测噬菌体展示短肽与细胞的结合
为验证筛选出来的多肽与细胞表面表达的天然状态下frα的结合情况,选取高表达frα的卵巢癌细胞skov3,并设置无关的肝癌细胞hepg2为对照,进行细胞elisa。skov3细胞和hepg2细胞培养至细胞密度达80%以上,在显微镜下观察细胞形态良好,经0.25%胰酶消化后加入相应的新鲜培养基重悬并进行活细胞计数,调整细胞密度至2×105个/ml,按每孔100μl铺96孔细胞培养板,37℃培养过夜。隔天吸弃上清,用无菌pbs缓冲液(137mmnacl,2.7mmkcl,10mmna2hpo4,2mmkh2po4[ph7.4])轻柔洗涤两次,每次5分钟,室温下用10%多聚甲醛固定15分钟,吸弃固定液,并用pbs缓冲液轻柔洗板3次,每次5分钟,以5%脱脂牛奶(pbs稀释)作为封闭液37℃封闭2小时。弃封闭液,pbs可做简单漂洗后,将对应的噬菌体适当稀释后加入细胞培养板中,设置一组阴性对照(野生型m13),每孔100μl,4℃孵育过夜。隔天吸弃上清,并用pbst(pbs+体积比0.1%[v/v]tween-20)、pbs缓冲液依次洗涤3次,每次5分钟。再加入用封闭液稀释到工作浓度(1∶10000)的hrp标记的抗m13抗体,每孔100μl,37℃孵育2小时,同上进行洗涤操作后,显色反应与终止反应同噬菌体elisa步骤。
结果如图3。与野生型m13相比,实验组多肽与skov3有较好的结合,且相比于与hepg2的结合,具有明显的特异性(p<0.05),说明筛选得到的frα结合肽与肿瘤细胞表面表达的天然frα可发生特异性结合。
实施例5流式检测噬菌体展示短肽与细胞表面frα的结合情况
实验目的同细胞elisa实验。利用流式细胞术检测筛选出来的阳性噬菌体单克隆对skov3肿瘤细胞的结合情况。
细胞处理:skov3细胞培养至细胞密度达80%以上,显微镜下观察细胞形态良好,经0.25%胰酶消化,加入新鲜培养基终止消化作用,1,500rpm离心5分钟,pbs重悬制备单细胞悬液,进行活细胞计数,调整细胞浓度至1~2×106个/ml,分装到1.5mlep管中,每管250μl~350μl。3,000rpm离心5分钟后,每管加入100μl稀释好的噬菌体上清作为一抗(稀释液为2%fbs-pbs),选择与合成的多肽相对应的噬菌体上清,4℃孵育1小时后,取出3,000rpm离心5分钟,弃上清,每管加1mlpbs洗涤2~3次,吸弃上清。加入100μl稀释好的鼠源抗m13二抗,4℃放置1小时,取出同上操作进行洗涤,最后加入带fitc标签的羊抗鼠荧光二抗,按1∶500稀释比用2%fbs-pbs稀释,每孔100μl,注意此步骤需避光操作。4℃避光孵育1小时,洗涤步骤同上,最后一遍洗涤完后根据细胞沉淀加入适量体积的pbs重悬,上流式细胞仪进行检测。
结果显示,见图4,合成的多肽能较好地与frα高表达的细胞株发生特异性结合,结合率可达51.2%。
实施例6体内归巢实验检测噬菌体展示短肽在荷瘤裸鼠体内组织的分布
本实验需在超净台下操作,动物实验手术器械均需消毒灭菌后使用。选择6~7周龄,体重20~25g之间的spf级balb/c雌性裸鼠,通过皮下注射方式对其进行植瘤操作,选择鼠左侧腋下(近心端)进行操作,每只裸鼠注射2×106个skov3细胞。待瘤体积长到一定大小,进行体内归巢实验。
将扩增后的噬菌体200μl,2×1011pfu,以尾静脉注射的方式注入荷瘤裸鼠体内,经过15~30分钟充分循环,用10%水合氯醛以100mg/kg剂量腹腔注射麻醉,75%酒精棉擦拭裸鼠消毒。横膈水平切开皮肤,使胸腔完全暴露,切断胸骨,操作时避免损伤心脏及周边大血管,充分暴露心脏后采用心脏灌注技术,在右心耳部位用手术剪剪开一个小口,将静脉针穿刺入左心室,可观察到针头处有回流的血液后,缓慢推入无菌pbs,血液将从右心耳剪口处流出,待裸鼠实质性脏器发白即可停止灌注。剥取裸鼠部分肿瘤及组织器官并称重,在组织匀浆器中研磨,加入1mlrmpi1640-pi溶液(1mlrmpi1640培养基中加入1mm蛋白酶抑制剂、20μg/ml抑肽酶及1μg/ml亮肽酶,pmsf现用现加,终浓度0.1mm)。将匀浆组织转移到2mlep管中,加入rmpi1640-pi+1%bsa溶液进行非特异性洗涤,在涡旋振荡器上涡旋10秒以充分洗涤,4000rpm离心5分钟,共洗涤4~5次,随后进行噬菌体的洗脱。加入1ml0.2m甘氨酸-盐酸glycine-hcl缓冲液[ph2.2],于室温在脱色摇床上温和摇动10分钟以充分洗脱,再加100μl1mtris-hcl[ph9.1]中和上述洗脱液,4000rpm离心5分钟,上清转移至新的ep管中。取10μl洗脱液进行滴度的检测,具体操作同前。设置m13噬菌体对照组。计算各器官单位重量的噬菌体数量。
结果如图5所示,可以看出,该噬菌体在肿瘤部位富集,与其他正常组织相比有显著性差异,且与m13对照组相比也有显著差异。
实施例7通过活体成像仪观察fitc标记多肽在荷瘤裸鼠器官组织中的分布
将这条多肽序列送至吉尔生化(上海)有限公司合成fitc标签多肽,纯度在95%以上。
选择6~7周龄,体重20~25g之间的spf级balb/c雌性裸鼠,通过皮下注射方式对其进行植瘤操作,选择鼠左侧腋下(近心端)进行操作,每只裸鼠注射5×106个skov3细胞。待瘤体积长到一定大小,通过尾静脉注射将100μl2mg/mlfitc标记的合成多肽(无菌pbs稀释)注入裸鼠体内,注意避光操作。待2小时后拉颈处死,剖离各个器官,利用成像仪观察多肽在裸鼠各器官组织的荧光强度。
根据得到的mfi(平均荧光强度)发现,肿瘤部位荧光强度最强,肝部位次之,其次依次是肾,在心、肺及卵巢组织中几乎无荧光强度。(见图6)。
- 还没有人留言评论。精彩留言会获得点赞!