一种基于纯微生物处理的高效利用木聚糖转化生物丁醇的方法与流程
本发明属于微生物生物技术及生物能源发酵技术领域,涉及一种基于纯微生物处理的高效利用木聚糖转化生物丁醇的方法。
背景技术:
随着石油等不可再生资源的日益消耗,开发新能源已经逐渐成为人类生存与发展的迫切需求。作为可再生能源之一,生物燃料通常指由生物质组成或转化的各种固体、液体或气体燃料的总称。其除了具有良好的可贮藏性和可运输性,还具有可循环性和环保性两大优点,是替代化石燃料的最佳选择,也是生物质能开发利用的重要方向之一。在众多生物燃料中,生物丁醇以其腐蚀性小、不易吸水、便于管道运输、挥发性低、燃烧值高等优点成为了理想的生物燃料燃油替代品。但就目前来说,传统的丁醇发酵过程存在的主要问题之一是依赖于可食用的粮食原料,如玉米淀粉等,这就部分造成了工业生产与人类生存共同竞争粮食作物的窘状,同时也很大程度增加了丁醇发酵的生产成本。因此寻找廉价的非粮食依赖型原料便成了解决这一问题的重点。
木质纤维素生物质是自然界中来源最为广泛的生物质,但是大部分的木质纤维素未被有效利用,或者直接作为堆肥原料,造成了严重的资源浪费和环境污染,而针对木质纤维素生物质的有效利用也一直是当今世界性尚待解决的难题之一。为了进一步减轻对化石燃料的依赖,利用木质纤维素生物质转化生物能源也引起了人们更为广泛的关注。作为构成木质纤维素生物质的主要成分之一,半纤维素是除纤维素外含量最为丰富的杂多糖,占木质纤维素生物质总量的25%–35%,是第二丰富的可再生生物质。而木聚糖是构成半纤维素的主要成分,因此有效利用木聚糖将成为有效利用木质纤维素生物质中重要的一步。传统方法是将木聚糖进行化学法水解,再将水解产物进一步发酵转化为生物能源物质。化学水解方法因其简单、快速而被普遍使用,但其水解过程中会伴随某些抑制物的产生,如4-羟基苯甲醛,羟甲基糠醛等,进而影响后续发酵或转化反应,抑制木聚糖向生物能源的转化过程。因此如何采用温和且无污染的处理方法,高效利用木聚糖转化生物能源便成为了目前亟待解决的问题。
但是由于木质纤维素生物质自身的高聚合复杂结构加大其水解难度,其水解利用效率不高一直是目前众多尚待解决难题之一;而且木质纤维素生物质成分复杂,仅依赖单一酶制剂无法实现其高效利用,且酶制剂成本过高,不利于工业大规模应用;另外利用单一微生物菌株直接处理木质纤维素生物质的能力有限,几乎无法实现较高的底物利用率及生物丁醇转化率。而造成现有报道技术主要存在以下缺点:1、木质纤维素生物质中的半纤维素(主要成分为木聚糖)富含各类杂多糖,其结构较为复杂,酶水解成本过高,增加发酵工艺条件和成本;2、酸碱等化学处理方式过于剧烈,容易导致底物中可利用的成分结构遭到破坏并产生抑制菌株发酵的物质(如糠醛),因而影响后期的发酵效果;3、菌株直接利用木聚糖的底物利用率较低,生物丁醇转化率不高。
技术实现要素:
本发明的目的在于针对木质纤维素生物质转化生物能源研究的基础上,提供一种纯微生物处理技术,该技术能提高木质纤维素生物质的主要成分之一木聚糖的生物利用率,结合联合发酵的手段,高效转化为生物丁醇,实现底物到产物的高转化率,解决现有技术存在的问题。
为了实现上述的目的,采用如下的技术方案:
一种基于纯微生物处理的高效利用木聚糖转化生物丁醇的方法,主要包括以下步骤:
(1)从红树林环境获取红树林底泥样品;
(2)在厌氧条件中将红树林底泥样品加入到木聚糖为唯一碳源的发酵培养基中,并置于37℃、150rpm的培养条件下进行驯化富集培养稳定的微生物菌群;
(3)将步骤(2)驯化富集培养的稳定的微生物菌群以5%的接种量接种到新的木聚糖发酵培养基中;置于37℃、150rpm的培养条件下进行发酵培养6-8天,再置于115℃条件下高压蒸汽灭菌15min;
(4)纯培养梭菌菌株wst活化,并以2%的接种量接种到步骤(3)所得发酵液中,再放置于30℃、150rpm的培养条件下继续联合发酵培养7-8天。菌群只是起到提高木聚糖的水解效果,对菌株wst有一定的抑制作用。
进一步的,步骤(1)所述驯化富集培养稳定的微生物菌群的方法为:通过检测所产生的生物气体和发酵产物来分析微生物菌群的生长情况并进行传代,待微生物菌群产气量及产物成分比例稳定后,则停止传代并最终获取稳定的能利用木聚糖为底物的微生物菌群。
进一步的,木聚糖为唯一碳源的发酵培养基中,主要的组成成分为:木聚糖,20g/l;nahco3,2.52g/l;酵母提取物,10g/l;100×盐溶液(nacl1.0g/l;mgcl2·6h2o,0.5g/l;kh2po4,0.2g/l;nh4cl,0.3g/l;kcl,0.3g/l;cacl2·2h2o,0.015g/l),10ml;1000×微量元素溶液(fecl2·4h2o,1.5g/l;cocl2·6h2o,0.19g/l;mncl2·4h2o,0.1g/l;zncl2,0.07g/l;h3bo3,0.006g/l;na2moo4·2h2o,0.036g/l;nicl2·6h2o,0.024g/l;cucl2·2h2o,0.002g/l)1ml;2-(n-吗啉基)乙磺酸(mes),1.952g/l。所述木聚糖为唯一碳源的发酵培养基的制备方法为:先将其主要的组成成分加入蒸馏水使其完全溶解并定容至1000ml,在此过程中保持n2的持续通入,然后最后依次加入用于最终除氧的还原剂na2s·9h2o,0.048g/l;l-半胱氨酸(cys),0.0242g/l和dl-二硫苏糖醇(dtt)0.077g/l,并用4mol/l的hcl调节ph值至6.0,分别封装到厌氧培养用的血清瓶中,于121℃灭菌20min后冷却备用。
进一步的,传到第10代菌群基本稳定则停止传代,最终获取的稳定菌群中微生物菌株种类的85%-90%属于ruminococcus属,5-6%属于clostridium属。
进一步的,所述红树林底泥为表层10cm以下,用厌氧收集袋4℃存储运回实验室,并在24小时内于厌氧条件下进行处理。
本发明是一种基于纯微生物处理的高效利用木聚糖转化生物丁醇的方法,主要涉及一个从红树林底泥环境中驯化获得稳定的微生物菌群,以及经灭活处理后同纯化梭菌菌株wst进行联合发酵,能以木聚糖为唯一碳源进行生长,并显著提高了木聚糖的生物可利用率,结合联合发酵的方式,大幅度提高木聚糖到生物丁醇的转化率,为木质纤维素类生物质的可持续利用提供了新的思路。本发明操作过程简单方便,且不产生二次污染,在利用木质纤维素生物质转化生产生物丁醇的工业应用上具有广阔前景和潜力。
而现有的技术主要是采用化学试剂或酶制剂对木聚糖进行水解,然后再对水解产物加以利用和转化为生物丁醇等目的产物。本发明于现有的技术相比,具体如下:
(1)与化学水解法相比:化学法水解速度较快,但是同时会产生抑制产物,且控制不得当,会造成利用该水解产物转化生物丁醇的效率严重下降;而本发明方法简单,易于操作,且条件温和无污染,对后续反应基本无不利影响;
(2)与酶解法相比:直接使用酶解法,条件温和,但单一酶解效率较低,且成本较高,导致木聚糖转化率较低,无法实现生物能源的有效利用和高效转化;而本发明直接利用微生物菌群和单一菌株的联合发酵即可实现高效转化木聚糖为生物丁醇,除底物外,无需添加酶及其他附加成本。
综上所述,本发明与现有技术相比,具有以下优势:一、成本较低,反应条件温和。本发明借助微生物菌群和单一微生物菌株的联合发酵,实现木聚糖向生物丁醇的转化,整个转化过程除底物外,无其他附加成本且基本无不利的抑制产物产生。二、处理方法简单,且易于操作。在本发明中通过采用高压蒸汽灭菌处理的方法,消除了菌群对后续菌株的影响,有效且明显提高生物丁醇转化率,整个过程条件易于控制。三、与其他已报道的相关技术相比,本发明利用木聚糖发酵的生物丁醇产量及底物转化率相对较高,且副产物量较低,有利于简化后续丁醇的纯化手段,降低生产成本。
附图说明
图1为本发明具体流程图。
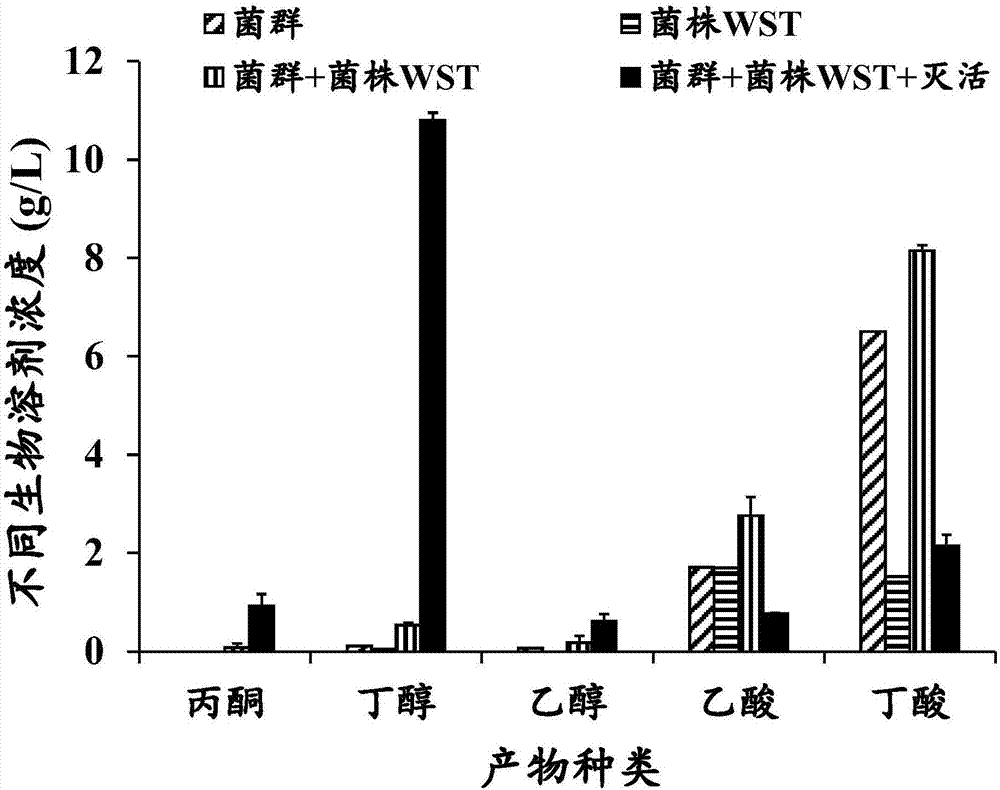
图2为以木聚糖为底物在不同处理方式下进行发酵获得的各发酵产物的含量,其中包括纯菌株wst发酵、纯微生物菌群发酵及微生物菌群与菌株wst在灭活与未灭活处理下的联合发酵。
图3为本发明微生物菌群在灭活处理后与菌株wst联合发酵过程中各发酵产物的变化情况。
图4为本发明微生物菌群在属水平上的结构分布情况。其中x0表示原始土样微生物菌群;而x1、x3、x6、x8以及x10分别属于驯化富集过程中第一、第三、第六、第八以及第十代的微生物菌群。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
实施例1
1、微生物菌群的富集培养过程
土壤样品来自于位于表层10cm以下的红树林底泥,用厌氧收集袋4℃存储,在24小时内运回实验室进行处理。在厌氧条件中准确称取5.0g底泥样品,加入到45ml以20g/l的木聚糖为碳源的发酵培养基中,并置于37℃以及150rpm的培养条件下进行富集培养。在培养过程中,对其生物产气量及培养基中的发酵产物含量进行检测,待无气体产生且发酵产物含量比例没有明显变化时(约6-8天培养时间),准确吸取培养基中菌液,以2%的接种比例接种到新的厌氧培养基中,同时重新记录总生物气体量及发酵产物的成分比例。之后则以同样的条件继续对菌群进行富集传代培养,至生物气体总产气量和发酵产物成分比例趋于稳定时停止传代,实验结果证明,传至第10代后生物气体产量及发酵产物成分比例已基本稳定,最后通过气相色谱确定培养基中各种发酵产物的最终产量。
2、梭菌菌株wst的筛选和分离纯化
土壤样品来自于红树林底泥表层10cm以下,称取5.0g进行高温(70℃)处理0.5小时后,在厌氧条件下加入到45ml以30g/l的葡萄糖为碳源的发酵培养基中。在30℃、150rpm的条件下进行厌氧富集培养。培养24小时后,将富集的菌体进行梯度稀释并涂布到强化型梭菌培养基(rcm)的固体培养平板中,于30℃进行恒温培养24-48小时后,经多次划线分离后挑取单一菌落,转接于发酵培养集中进行发酵培养96小时后检测生物丁醇的产量,最终获取一株高生物丁醇产率的微生物菌株,经鉴定并命名为clostridiumsp.wst。更详细的制备及性能检测等均已经在专利一株高产丁醇梭菌及其筛选与应用(申请号为201710755578.1)中公布。
3、生物菌群与菌株wst的联合发酵过程
准确吸取富集培养所得微生物菌群菌液,以5%的接种量接种到新的木聚糖发酵培养基中,同样置于37℃、150rpm的培养条件下进行发酵培养。待培养6天后,将发酵液取置于115℃条件下高压蒸汽灭菌15min。之后在进一步以2%的接种量接种已活化好的菌株wst到发酵液中,并将发酵液重新放置于30℃、150rpm的培养条件下继续发酵培养。在接入菌株wst后的24、48、72、120和168小时,分别收集发酵液并采用气相色谱检测不同发酵产物的含量。
本实施例中,以木聚糖为唯一碳源的厌氧培养基的主要的组成成分为:木聚糖,20g/l;nahco3,2.52g/l;酵母提取物,10g/l;100×盐溶液(nacl1.0g/l;mgcl2·6h2o,0.5g/l;kh2po4,0.2g/l;nh4cl,0.3g/l;kcl,0.3g/l;cacl2·2h2o,0.015g/l),10ml;1000×微量元素溶液(fecl2·4h2o,1.5g/l;cocl2·6h2o,0.19g/l;mncl2·4h2o,0.1g/l;zncl2,0.07g/l;h3bo3,0.006g/l;na2moo4·2h2o,0.036g/l;nicl2·6h2o,0.024g/l;cucl2·2h2o,0.002g/l)1ml;2-(n-吗啉基)乙磺酸(mes),1.952g/l。制备方法为,先将主要主要的组成成分加入蒸馏水使其完全溶解并定容至1000ml,在此过程中保持n2的持续通入,最后依次加入用于最终除氧的还原剂na2s·9h2o,0.048g/l;l-半胱氨酸(cys),0.0242g/l和dl-二硫苏糖醇(dtt)0.077g/l,并用4mol/l的hcl调节ph值至6.0,分别封装到厌氧培养用的血清瓶中,于121℃灭菌20min后冷却备用。
以葡萄糖为碳源的发酵培养基的组成除将木聚糖(20g/l)调整为葡萄糖(30g/l),其他成分维持不变;另外制备方式及除氧方法同上,培养基同样封装到厌氧培养用的血清瓶中,于121℃灭菌20min后冷却备用。
实施例2
本实施例涉及的微生物菌群从红树林底泥中由本实验室经以木聚糖为唯一碳源的发酵培养基(培养基组分同实施例1)进行驯化富集培养而获得的。在驯化过程中,主要通过检测所产生的生物气体来分析微生物菌群的生长情况并进行传代,待微生物菌群产气量及发酵产物稳定后,则停止传代并最终获取稳定的能利用木聚糖为底物的微生物菌群。
通过气相色谱(gc-fid)测定上述稳定微生物菌群直接以木聚糖为底物,厌氧发酵6天之后获得的产物如图2所示,结果显示本发明所涉及的微生物菌群利用木聚糖可产生丁酸(6.51g/l)、乙酸(1.71g/l)、少量丁醇(0.11g/l)以及微量乙醇(0.07g/l),因此可以看出该微生物菌群具有转化木聚糖生产各种生物溶剂的潜力,特别是产生的丁酸能够在结合梭菌菌株wst的联合发酵中进一步转化为生物丁醇。
因此,将上述微生物菌群处理过的木聚糖作为底物,添加已活化的梭菌菌株clostridiumsp.wst(帅选培养方法同实施例1)进行的联合发酵培养,并按照图1方案所示,进一步分析对微生物菌群进行灭活处理(115℃,15min)与否对生物丁醇产量的影响。通过将所有样品进行厌氧发酵培养,并分别在24、48、72、120及168小时进行取样,采用气相色谱(gc)测定发酵产物的含量。
实验结果显示,木聚糖在通过微生物菌群处理过后,与梭菌菌株wst进行联合发酵168h后,均能提高生物丁醇的产量,如图3所示。特别是在对处理后的木聚糖底物进行菌群灭活,消除菌群对wst的抑制作用后,进一步比较发现,其生物丁醇、生物乙醇产量分别可达到10.80、1.52g/l,极其明显地高于联合发酵前和未进行灭活处理的实验组,如图3所示。由此也可以说明,本发明纯微生物处理木聚糖转化生物丁醇的方法可明显提高木聚糖的可利用效率,特别是生物丁醇的转化率(50.4%),对不同处理方式的实验结果进行比较,如表1所示。
表1不同处理方式转化木聚糖生产生物丁醇的比较
本实施例所涉及的厌氧微生物菌群的富集培养方法如下:土壤样品主要取自于位于表层10cm以下的红树林底泥,用厌氧收集袋4℃存储,在24小时内运回实验室进行处理。在厌氧培养中准确称取5.0g底泥样品,加入到45ml上述的发酵培养基中,并置于37℃以及150rpm的培养条件下进行富集培养。在培养过程中,对其生物产气量及培养基中的发酵产物含量进行检测,待无气体产生且发酵产物含量比例无明显变化时(约6-8天培养时间),准确吸取培养基中菌液,以2%的接种比例接种到新的发酵培养基中,同时重新记录总生物气体量及发酵产物的成分比例。之后则以同样的条件继续对菌群进行富集传代培养,至生物气体总产气量和发酵产物成分比例趋于稳定时停止传代,实验结果证明,传至第10代后生物气体产量及发酵产物成分比例已基本稳定,最后通过气相色谱确定培养基中各种发酵产物的最终产量。
本实施例所涉及的微生物菌群和菌株wst的联合发酵步骤如下:准确吸取富集培养所得微生物菌群菌液,以5%的接种量接种到新的木聚糖发酵培养基中(培养基组成如前所述),同样置于37℃、150rpm的培养条件下进行发酵培养。待培养6天后,将发酵液取置于115℃条件下高压蒸汽灭菌15min。之后再进一步以2%的接种量接种已活化的菌株clostridiumsp.wst到发酵液中,并将发酵液重新放置于30℃、150rpm的培养条件下继续发酵培养。在接入菌株wst后的24、48、72、120和168小时,分别收集发酵液并经气相色谱检测发酵产物中各个产物的含量。同时在相同条件下,分析比较在不接入菌株wst、不接入微生物菌群及对微生物菌群不进行灭菌处理等三个对照组的区别。
将本实施例处理方式与其他方法对利用木质纤维素生物质发酵转化生物溶剂的效率进行比较,如表2所示。
表2木质纤维素的不同处理方式及其转化生物溶剂效率的比较
实施例3
为进一步探究本发明所涉及的微生物菌群在以木聚糖为唯一碳源的发酵培养基进行驯化富集培养过程中不同微生物种类的变化情况,根据培养过程中微生物菌群的生物产气量和发酵产物,分别选取第1、第3、第6、第8和第10代微生物菌群,对比原始红树林底泥样品,采用
以上所揭露的仅为本发明的较佳实施例而已,当然不能以此来限定本发明之权利范围,因此依本发明权利要求所作的等同变化,仍属本发明所涵盖的范围。
- 还没有人留言评论。精彩留言会获得点赞!