一种肿瘤干细胞培养基、分选方法和抑制其分化为肿瘤源性免疫细胞的方法与流程
本发明涉及肿瘤干细胞分选和分化技术领域,尤其涉及一种肿瘤干细胞培养基、分选方法和抑制其分化为肿瘤源性免疫细胞的方法。
背景技术:
肿瘤组织由实质和间质两部分构成,肿瘤实质是肿瘤细胞,是肿瘤的主要成分,具有组织来源特异性。间质部分包括间质细胞和非细胞成分,其中间质细胞中主要包括免疫细胞、内皮细胞、平滑肌细胞、成纤维细胞等。非细胞成分包括细胞外间质和分泌到细胞外的细胞因子等。所有的这些成分构成了复杂的肿瘤微环境。
构成肿瘤组织的肿瘤细胞,尤其是恶性肿瘤,通过其特殊机制,经常逃避机体的免疫系统监视,而且在肿瘤进行性生长时,肿瘤患者的免疫功能受到抑制,免疫系统中的免疫细胞对于肿瘤细胞的识别及清除发生障碍,不能发挥正常的清除异己功能,从而发生肿瘤转移复发等现象。现有的肿瘤新药研发和临床治疗方法均基于此理论认知,包括放疗、化疗、手术、传统中医药和免疫疗法等,却收效甚微,仍无法避免肿瘤转移复发,人类肿瘤的死亡率及五年生存率并未得到明显改善。
近年来有关肿瘤干细胞的理论认为,在肿瘤细胞中有一小部分细胞具有自我更新、无限增殖、多向分化潜能,具有干细胞特性,它们是肿瘤发生,转移和复发的根源。已经有文献证实,肿瘤组织中的血管并非机体正常血管迁移浸润形成,而是由肿瘤干细胞分化而来,并因此影响部分抗肿瘤药物的效果。还有研究表明,在某些情况下,肿瘤特异性抗体非但不能杀伤肿瘤细胞,反而会干扰特异性细胞免疫应答对肿瘤细胞的杀伤作用,具有促进肿瘤生长的作用,机理不详。由此,我们推测,具有多向分化潜能的肿瘤干细胞可以通过分化为诱导肿瘤免疫逃逸的“肿瘤源性免疫细胞”,进而抑制免疫系统对肿瘤的有效识别和杀伤,甚至促进肿瘤的发生和发展。
对肿瘤元凶肿瘤干细胞研究的前提条件是获取肿瘤干细胞,目前获得干细胞的方法有单细胞克隆培养法、磁珠分选法、流式分选法等。其中,单细胞克隆培养采用极限稀释的方法,主观人为差异误差较大,费时费力,其余方法则需要特殊仪器、特殊药物抗体或特殊药物等,例如流式分选法需要流式机器分选,众多实验室并不具备购买如此大型机器的能力,其他方法所需要的特殊抗体、磁珠或药物以及操作过程都将对细胞产生不同程度的损伤。获得肿瘤干细胞后,现有的肿瘤干细胞培养基难以在保持肿瘤干细胞生理特征的同时避免其诱导分化,而肿瘤干细胞的多向分化潜能使其分化为不同类型的肿瘤细胞后,会对后续关于肿瘤细胞的研究产生干扰。
技术实现要素:
针对现有的肿瘤干细胞培养基难以在保持肿瘤干细胞生理特征的同时避免其诱导分化,获得肿瘤干细胞的方法需要特殊仪器、误差较大、费时费力、对细胞有损伤的技术问题,本发明提供一种肿瘤干细胞培养基。
以及,本发明还提供一种肿瘤干细胞的分选方法。
以及,本发明还提供一种抑制肿瘤干细胞分化为肿瘤源性免疫细胞的方法。
为达到上述发明目的,本发明实施例采用了如下技术方案:
一种肿瘤干细胞培养基,所述肿瘤干细胞培养基中包括细胞因子b27、碱性成纤维细胞生长因子、转化生长因子和表皮细胞生长因子。
本发明所提供的肿瘤干细胞培养基能够使肿瘤干细胞保持干细胞的活性,且不贴壁生长,从而能够培养成肿瘤球。该培养基还能避免对肿瘤干细胞分化的诱导,避免肿瘤干细胞分化为不同类型的肿瘤细胞后对肿瘤细胞的研究产生干扰。当实验者需要得到特定细胞时,通过特定的诱导方法进行定向诱导,即可得到预期的细胞群。
优选地,所述肿瘤干细胞培养基中细胞因子b27的浓度为1.8~2.2%wt;所述碱性成纤维细胞生长因子的浓度为18~22ng/ml;所述转化生长因子的浓度为18~22ng/ml;所述表皮细胞生长因子的浓度为18~22ng/ml。各细胞因子在上述浓度下,能更好地使肿瘤干细胞保持活性,并避免其分化。
优选地,所述肿瘤干细胞培养基中还包括双抗,所述双抗在所述无血清培养基中的浓度为0.1~1.0%v/v。
以及,本发明实施例还提供一种肿瘤干细胞的分选方法,具体包括以下步骤:
步骤a、取对数生长期的肿瘤细胞,胰酶消化后加入培养基制成单细胞悬液;
步骤b、将所示单细胞悬液均匀添加至微筏芯片中,培养至所述肿瘤细胞贴壁;
步骤c、取仅含有单个细胞的微筏,将其置于预先加入培养基的细胞培养板中,使所述细胞培养板的每个培养孔中含有一个所述微筏,继续培养至所述微筏中的所述肿瘤细胞形成全克隆形态;
步骤d、取步骤c中形成全克隆形态特征的肿瘤细胞,转移至上述肿瘤干细胞培养基中,培养得肿瘤干细胞悬液。
本发明中的微筏芯片(microraftarrays)是一系列能够提供进行细胞分类、细胞隔离、长时间细胞分析和繁殖克隆种群的微孔,每个微筏(microraft)中均可容纳较少数量的单个细胞。该芯片能够同时进行大量的肿瘤干细胞分选工作,使肿瘤干细胞的分选操作更加简便,并能够显著缩短成球时间,成本更低,微筏中能够仅含有一个细胞,可排除其他细胞的干扰,使分选更为准确。
具体地,上述步骤a和步骤c中所述培养基为rmpi1640培养基。该培养基可以适应多种细胞的生长,包括肿瘤细胞。
优选地,所述rmpi1640培养基中还包括5~10%v/v胎牛血清。
优选地,所述rmpi1640培养基中还包括0.1~1%v/v双抗。
上述步骤c中所述取仅含有单个细胞的微筏的具体操作为:用释放针刺穿并释放含有单个细胞的微筏后用磁棒吸取。
以及,本发明实施例还提供一种抑制肿瘤干细胞分化为肿瘤源性免疫细胞的方法,其特征在于,向按权利要求4所述分选方法得到的肿瘤干细胞悬液加入细胞因子il-2、il-3、tgfβ或il-6中的至少一种。该肿瘤源性免疫细胞为肿瘤干细胞分化而来的具有免疫细胞特性、能够使肿瘤细胞产生免疫逃逸机制的细胞。本发明通过使用优选的细胞因子,能够抑制肿瘤干细胞分化成具有免疫逃逸机制的肿瘤源性免疫细胞,从而为研究肿瘤治疗方法提供一种新的思路。
附图说明
图1本发明实施例常规培养的a549细胞形态;
图2本发明实施例a549细胞dna的str分型检验;
图3本发明实施例免疫荧光显示的a549细胞中cd133+cscs;
图4本发明实施例流式检测a549中cd133+cscs含量;
图5本发明实施例microraftarrays分选法所得的肿瘤干细胞;
图6本发明实施例免疫磁珠法所得的肿瘤干细胞;
图7本发明实施例96孔板极限稀释法所得的肿瘤干细胞;
图8本发明实施例免疫磁珠法、96孔板极限稀释法以及microraftarrays分选法所得肿瘤干细胞培养至成球干细胞数目达到100时所需天数;
图9本发明实施例microraftarrays分选法、免疫磁珠法以及96孔板极限稀释法所得肿瘤干细胞的成球实验结果;
图10免疫荧光法测得本发明实施例microraftarrays分选法、免疫磁珠法以及96孔板极限稀释法所得肿瘤干细胞的cd133分子表达量;
图11流式细胞术测得本发明实施例microraftarrays分选法、免疫磁珠法以及96孔板极限稀释法所得肿瘤干细胞的cd133分子表达量;
图12本发明实施例microraftarrays分选法、免疫磁珠法以及96孔板极限稀释法所得肿瘤干细胞的cd133分子表达量对比;
图13本发明实施例westernblot检测a549细胞及microraftarrays分选法所得肿瘤干细胞的相关转录因子表达;
图14本发明实施例microraftarrays分选法所得单个细胞可形成的全克隆形态与旁克隆形态;
图15本发明实施例pcrarray探测两种克隆形态细胞的84个表面标记分子基因表达情况;
图16本发明实施例microraftarrays分选法所得全克隆形态细胞在基因芯片中表达量最高的前20个基因;
图17本发明实施例microraftarrays分选法所得两种克隆形态细胞的qrt-pcr验证cd2结果;
图18本发明实施例microraftarrays分选法所得两种克隆形态细胞琼脂糖凝胶电泳的pcr产物特异性;
图19本发明实施例microraftarrays分选法所得两种克隆形态细胞pcr产物cd2的测序结果;
图20本发明实施例流式细胞术检测microraftarrays分选法所得两种克隆形态细胞中cd2分子表达情况;
图21本发明实施例不同细胞因子刺激对microraftarrays分选法所得细胞cd2分子基因表达的影响;
图22本发明实施例免疫荧光技术观察microraftarrays分选法所得细胞cd2与cd133分子表达位置;
图23本发明实施例microraftarrays分选法所得两种克隆形态细胞中cd4与cd8a、cd8b的基因表达情况;
图24本发明实施例microraftarrays分选法所得两种克隆形态细胞中特异转录因子rorγt及ifr4的基因表达情况;
图25本发明实施例microraftarrays分选法所得两种克隆形态细胞中细胞因子il-17a及il-23的基因表达情况;
图26本发明实施例microraftarrays分选法所得两种克隆形态细胞cd3四条链的表达情况;
图27正常免疫细胞和本发明实施例microraftarrays分选法所得肿瘤干细胞经tfgβ和il-6诱导后产生的细胞中rorγt、il-17a和il-23的基因表达情况;
图28本发明实施例microraftarrays分选法所得两种克隆形态细胞在培养12h、24h、36h、48h时上清中il-17a的含量;
图29本发明实施例microraftarrays分选法所得两种克隆形态细胞在培养12h、24h、36h、48h时上清中il-23的含量。
图30培养基对比例的培养基1中的肿瘤干细胞中sox2、nanog、oct-4表达情况;
图31培养基对比例的培养基2中的肿瘤干细胞中sox2、nanog、oct-4表达情况;
图32培养基对比例的培养基3中的肿瘤干细胞中sox2、nanog、oct-4表达情况;
图33实施例2所提供的培养基中的肿瘤干细胞中sox2、nanog、oct-4表达情况。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合具体实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用于解释本发明,并不用于限定本发明。
实施例1
本实施例提供了一种肿瘤干细胞培养基,该培养基中包括1.8%v/v细胞因子b27、18ng/ml碱性成纤维细胞生长因子、18ng/ml转化生长因子和18ng/ml表皮细胞生长因子。
实施例2
本实施例提供了一种肿瘤干细胞培养基,该培养基中包括2.0%v/v细胞因子b27、20ng/ml碱性成纤维细胞生长因子、20ng/ml转化生长因子和20ng/ml表皮细胞生长因子。
实施例3
本实施例提供了一种肿瘤干细胞培养基,该培养基中包括2.2%v/v细胞因子b27、22ng/ml碱性成纤维细胞生长因子、22ng/ml转化生长因子和22ng/ml表皮细胞生长因子。
实施例4
本实施例提供了一种肿瘤干细胞培养基,该培养基中包括2.0%v/v细胞因子b27、20ng/ml碱性成纤维细胞生长因子、20ng/ml转化生长因子、20ng/ml表皮细胞生长因子和0.1%v/v双抗。
实施例5
本实施例提供了一种肿瘤干细胞培养基,该培养基中包括2.0%v/v细胞因子b27、20ng/ml碱性成纤维细胞生长因子、20ng/ml转化生长因子、20ng/ml表皮细胞生长因子和1.0%v/v双抗。
实施例6
本实施例提供了一种肿瘤干细胞的分选方法,并对所得肿瘤干细胞进行分析检验。其中肿瘤细胞来自于非小细胞肺癌细胞系a549细胞。具体操作步骤为:
1、常规培养a549细胞,待细胞生长至80%融合,即处于对数生长期时,收集该对数生长期细胞用于以下实验。
正常生长的a549细胞形态如图1所示,细胞呈上皮样多角形,单层贴壁生长,状态良好。
1.1str基因分型进行细胞鉴定
取上述对数生长期的a549细胞,胰酶消化后收集1×106个细胞,提取细胞dna,采用21身份鉴定系统pcr扩增试剂盒(microreader21id系统)进行复合pcr扩增,在abi3730xl型遗传分析仪上对str位点和性别基因amelogenin进行检测。分型结果如图2所示,对数生长期a549细胞的dna经pcr扩增后图谱清晰,分型结果良好,未出现三等位基因,即未出现细胞交叉污染,没有混杂免疫细胞或其他细胞。且经atcc和dsmz数据库比对,分型可完全匹配。
1.2免疫荧光法检测肿瘤干细胞标记分子cd133的表达
取上述对数生长期的a549细胞,胰酶消化后制成单细胞悬液,调整细胞浓度,以5×104/1ml/孔的浓度接种于24孔板,待细胞生长至80%融合后,按常规方法染色封片后,激光共聚焦显微镜下观察,观察cd133分子的表达,结果如图3所示,可见少量的细胞表达cd133分子,即对数生长期的a549细胞中有少量肿瘤干细胞存在。
1.3流式细胞术定量检测肿瘤干细胞含量
取上述对数生长期的a549细胞,胰酶消化后制成单细胞悬液,离心,用rmpi1640培养基重悬,调整细胞浓度,取1×106个细胞,加1×pbs2ml,离心重悬,重复此步骤2次。弃上清,加10μlcd133抗体及同型抗体,混匀后于4℃孵育10分钟,重复pbs清洗步骤后,用bd流式检测仪检测,结果如图4所示,a549细胞中,有1.24%的细胞为cd133+肿瘤干细胞。
结论:上述对数生长期的a549细胞无细胞间交叉污染,并含有极少量肿瘤干细胞。
2、分选肿瘤干细胞
2.1用microraftarrays分选法分选肿瘤干细胞
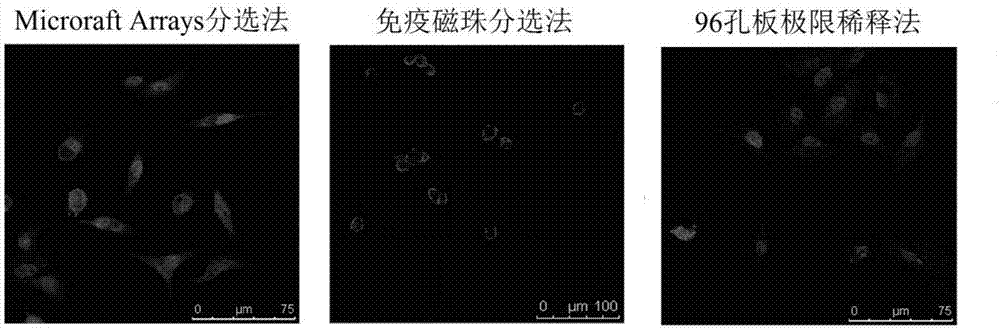
取5000个上述对数生长期的a549细胞重悬于2ml培养基(rmpi1640培养基中加入10%v/v血清和1%v/v双抗)中,制成单细胞悬液,将该单细胞悬液均匀地添加到microraftarrays的整个阵列中,然后置于培养箱中培养至细胞沉降贴壁。贴壁后,在显微镜观察下,用释放针刺穿并释放含单个细胞的microraft,用磁棒吸取。将每孔均含200μl培养基(rmpi1640培养基中加入10%v/v血清和1%v/v双抗)的96孔板放置于磁性收集板,并将某一孔对准收集板中心。将吸取有microraft的磁棒插入此孔以转移释放的microraft。重复此步骤至96孔板每孔中均含有一个含单个细胞的microraft。结果如图5所示,在96孔板培养孔内,存在单个microraft,且每个microraft上有一个单个细胞。
2.2用免疫磁珠分选法(macs)分选肿瘤干细胞
取上述对数生长期的a549细胞,胰酶消化成单细胞悬液离心,用1×pbs重悬离心重复3次,细胞计数后每107个细胞重悬于60μlbuffer,并加20μlfcrblockingreagent以及20μlcd133微珠,于4℃孵育15分钟后,加2mlbuffer离心,最后用500μlbufffer重悬。用预处理的ls柱分选,收集被标记的细胞。于与2.1相同的无血清培养基中培养。结果如图6所示,刚分选得到的肿瘤干细胞呈单个悬浮生长。
2.3用96孔板极限稀释法分选肿瘤干细胞
取上述对数生长期的a549细胞,胰酶消化成单细胞悬液离心,用培养基(rmpi1640培养基中加入10%v/v血清和1%v/v双抗)重悬,细胞计数后取1×106个细胞重悬于10ml该培养基中,用倍比稀释法稀释至102/10ml,按100μl/孔接种于96孔板,并记录单细胞孔,剔除多细胞以及无细胞小孔,常规培养于培养箱。结果如图7所示,96孔板小孔中,仅存在单个细胞。
3、肿瘤干细胞分析
3.1比较三种方法所得肿瘤干细胞成球实验时间
将用2.1~2.3三种方法得到的肿瘤干细胞于无血清培养基(含有2%v/v细胞因子b27,1%v/v双抗,20ng/ml碱性成纤维细胞生长因子、20ng/ml转化生长因子和20ng/ml表皮细胞生长因子)中扩大培养,待其由单个细胞成长成细胞数目达到100的肿瘤球细胞时,记录天数,如图8所示,用microraftarrays分选法所得肿瘤干细胞的成球时间明显低于另两种方法。
肿瘤球形态如图9所示,细胞球为圆或椭圆形,球内细胞结合紧密,球体饱满,折光性强,形状较规则。
3.2免疫荧光法比较三种方法所得肿瘤干细胞cd133的表达情况
实验操作步骤同1.2。结果如图10所示,三种方法所得肿瘤干细胞cd133的表达无明显差异。
3.3流式细胞术检测三种方法所得肿瘤干细胞表面分子标记cd133的表达情况
实验操作步骤同1.3。结果如图11、图12所示,microraftarrays分选法所得肿瘤干细胞cd133的表达量高于另两种方法所得肿瘤干细胞cd133的表达量。
3.4蛋白质印迹法(westernblot)检测microraftarrays分选法所得肿瘤干细胞中干细胞转录因子的表达情况
以a549细胞为对照,检测microraftarrays分选法所得肿瘤干细胞中nanog、oct-4和sox2三种蛋白的表达。结果如图13所示,三种干细胞转录因子的表达水平明显高于a549贴壁细胞。
3.5干细胞与非干细胞的克隆形态差异
如图14所示,microraftarrays法所得的单个细胞可形成全克隆与旁克隆两种克隆形态。全克隆形态是干细胞的克隆形态特征,而旁克隆形态是分化后的非干细胞克隆形态特征。
由图14可见,全克隆形态的细胞群落体积大,边界平滑,细胞呈巢状隆起生长,结构致密,细胞体积小,生长快。旁克隆形态细胞群落体积小,边界极不规则,细胞增殖活性低。二者差异明显。
实施例7
本实施例提供了一种抑制肿瘤干细胞分化为肿瘤源性免疫细胞的方法,其中所使用的肿瘤干细胞为microraftarrays分选法所得两种克隆形态细胞(即干细胞群落与非干细胞群落)。
1、肿瘤干细胞的免疫特性分析
1.1基因分析
分别取microraftarrays分选法所得的两种克隆形态细胞(即干细胞群落与非干细胞群落)各1×106个,经提取rna、反转录及pcr芯片(pcrarray)探测等步骤,以循环阈值(ct值)为指标,探查了84个细胞表面标记的基因表达水平。结果如图15。
pcr芯片包括t细胞、b细胞、nk细胞、单核巨噬细胞、内皮细胞、平滑肌细胞、树突状细胞、成纤维细胞、肥大细胞、上皮细胞及脂肪细胞共计11种细胞的84个基因。统计分析后发现,有7个基因仅表达于旁克隆细胞,5个仅表达于全克隆细胞,6个基因在两种细胞中均不表达,共同表达的有66个基因。
对上述84个基因中全克隆形态细胞在基因芯片中表达量前20个基因进行分析,结果如图16所示,发现75%的基因属于免疫系统基因,且以t、b细胞为主。
1.2基因水平验证免疫细胞特异标记分子cd2的表达
cd2又称淋巴细胞功能相关抗原2或绵羊红细胞受体,表达于全部t细胞表面,与apc表面cd58结合,能增强细胞间粘附,并直接介导t细胞激活。
取上述microraftarrays分选法所得的两种克隆形态细胞,经提取rna、反转录后,用实时荧光定量的方法,以gapdh为内参,△△ct法比较两组细胞cd2基因表达差异,结果如图17所示,全克隆cd2基因表达明显高于旁克隆,且溶解曲线峰型单一,为特异性扩增产物,无引物二聚体形成。
1.3琼脂糖凝胶电泳验证pcr产物特异性并测序
取2g琼脂糖粉末,溶于100ml0.5×tbe溶液,加入7μlgelredtmnucleicacidgelstain配置2%凝胶,160v恒压,电泳30分钟。azurespotc500采集图像。结果如图18所示,左侧为50bpdnaladder,右侧两列为pcr产物cd2,目的片段大小位置处于161bp位置,为特异性的cd2目的片段。
此外,又采用了毛细管电泳,双脱氧链终止法,用abi3730xl测序仪对pcr产物进行测序。结果如图19所示,可见信号峰型清晰,无明显双峰出现,且与cd2基因序列完全匹配。
1.4流式细胞术检测cd2分子表达情况
分别取上述microraftarrays分选法所得的两种克隆形态细胞各1×106个,按上述常规方法进行流式细胞术检测。结果如图20所示,可见全克隆细胞中cd2+细胞数目明显高于旁克隆组。
1.5免疫荧光技术观察cd2与cd133分子表达位置
取上述microraftarrays分选法所得的全克隆形态细胞,按实施例6中1.2所述的方法进行免疫荧光染色。激光共聚焦显微镜观察结果如图22所示,四张显微照片从左至右依次为细胞核、cd2分子表达位置、cd133分子表达位置以及cd2与cd133分子共同表达的情况。由图22可见,microraftarrays分选法所得肿瘤干细胞同时表达干细胞标记物cd133(红色荧光表示)和t细胞标记物cd2(绿色荧光表示)。从更加直观的形态学视角证实肿瘤干细胞可以向免疫细胞分化。
2、抑制肿瘤干细胞分化为肿瘤源性免疫细胞
2.1用il-2、il-3抑制肿瘤干细胞分化
取上述microraftarrays分选法所得的全克隆形态细胞,调整细胞密度,以1.5×106/10ml/皿常规传代培养于10cm培养皿,分成对照组、il-2组及il-3组,每组设3重复。融合度达70%时,将培养基换成无血清的rmpi1640基础培养基,饥饿处理6h。对照组加10μl0.1%bsa作为对照,il-2组及il-3组分别按10ng/ml添加il-2或il-3,再继续培养24小时,弃培养基,收细胞后,经trizol提取rna、反转录后,用实时荧光定量的方法,以gapdh为内参,△△ct法比较两组细胞cd2基因表达差异,结果如图21所示,il-2组及il-3组经il-2、il-3诱导培养后cd2基因与对照组相比有明显降低。
2.2分别选取microraftarrays分选法所得的两种克隆形态细胞,经提取rna、反转录后,用实时荧光定量的方法,以gapdh为内参,△△ct或△ct法比较两组细胞免疫细胞相关基因表达差异,结果如图22、23、24、27、28所示。
如图23所示,全克隆细胞组中cd4+t细胞表达量高于旁克隆细胞组,且cd8a差异明显。用内参基因标准化后的△ct法进行比较,cd8a在两组均有表达,但无明显差异,而cd8b均表现为无穷大,即不表达。
如图24所示,特异转录因子rorγt及ifr4的基因在两组细胞中均有表达,且全克隆细胞组明显高于旁克隆细胞组。
如图25所示,细胞因子il-17a及il-23的基因在两组细胞中均有表达,且全克隆细胞组明显高于旁克隆细胞组。
如图26所示,通过检测t细胞受体复合物组成分子cd3四条链在两组细胞中的表达情况,发现作为tcr复合体功能不可缺少的cd3在旁克隆三种基因的△ct均表现为无穷大,即不表达。而全克隆组,也仅表达了cd3g一条肽链的基因。
将microraftarrays法所得的肿瘤干细胞经tfgβ和il-6(促进th17细胞产生的细胞因子)诱导后,与常规培养的结果进行对比,细胞中的rorγt、il-17a和il-23的基因表达情况如图27所示。rorγt、il-17a和il-23是th17细胞相关的基因,经tfgβ和il-6诱导后,这三个基因的表达与常规培养相比有明显降低,说明经tfgβ和il-6诱导后能够抑制肿瘤干细胞向肿瘤源性免疫细胞分化。
收集两种克隆形态细胞不同时间培养上清,用酶联免疫吸附试验(ellisa),按试剂盒规定操作进行,检测细胞分泌il-17及il-23含量,结果如图26、27所示。
如图28所示,在培养36h后,il-17a表达量最高,且24h时与36h时,全克隆细胞组明显高于旁克隆细胞组。
如图29所示,通过ellisa法检测,两组细胞在培养12h、24h、36h、48h时均有il-23的分泌,而不同时间点分泌量无明显差异。
由图23~29的分析可见,microraftarrays分离得到的肿瘤干细胞可以分化为肿瘤源性免疫细胞,而此肿瘤源性免疫细胞确并不能完全表达机体正常免疫细胞所表达的相关基因。
培养基对比例
本对比例提供了三种肿瘤干细胞培养基,各培养基组成如下:
培养基1:20ng/ml碱性成纤维细胞生长因子、20ng/ml转化生长因子和20ng/ml表皮细胞生长因子;
培养基2:2.0%v/v细胞因子b27、20ng/ml碱性成纤维细胞生长因子和20ng/ml表皮细胞生长因子;
培养基3:2.0%v/v细胞因子b27、20ng/ml碱性成纤维细胞生长因子、20ng/ml转化生长因子、20ng/ml表皮细胞生长因子和500ng/ml胰岛素。
用上述培养基1、2、3以及实施例2所提供的培养基对microraftarrays分选法所得肿瘤干细胞进行培养,结果如图30~33所示,各培养基中维持干细胞干性的三种蛋白(sox2、nanog、oct-4)表达量不同,由图33可见,只有实施例2所提供的培养基中的表达量几乎可达100%(红色荧光),明显高于其他培养基。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换或改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!