靶向IL-1RAP的CAR-T细胞及它们的用途的制作方法
本发明涉及:编码嵌合抗原受体(car)的分离的核酸分子,其中,所述car包含抗体或抗体片段,所述car包括人源化的抗il-1rap结合结构域、跨膜结构域以及至少包含刺激结构域的细胞内信号转导结构域;由该核酸分子编码的多肽;以及包含此类抗体或抗体片段的分离的嵌合抗原受体(car)分子。
本发明还涉及包含编码car的核酸分子的载体,以及包含该载体的t细胞。
本发明还涉及该表达car分子的t细胞治疗哺乳动物的增殖性疾病的用途。
背景技术:
慢性粒细胞白血病(chronicmyelogenousleukemia,cml),也称为慢性髓系白血病,是一种骨髓增殖性紊乱,其特征在于粒细胞细胞系增殖增加,而且未丧失其分化能力。
cml是造血干细胞疾病,由t(9;22)(q34;q11)易位引起,其具有缩短的22号染色体,称为费城染色体22q-。易位导致9号染色体上的abl1基因与22号染色体上的bcr基因并列,产生bcr-abl1融合基因,该基因编码bcr-abl1转录本和具有高酪氨酸激酶活性的融合蛋白。即使充分了解了cml的分子发病机理,导致基因易位的机制尚不清楚。
cml的发病率在10-15例/106/年,没有任何明显的地理或种族差异。在欧洲,诊断时的中位年龄在60-65岁,但在人口较年轻的国家中要低得多。儿童中的cml很少见。
cml的诊断通常很简单。在多数情况下,可基于特征性血液计数进行诊断。通过鉴别外周血或骨髓细胞中的费城染色体22q-或bcr-abl1转录本或两者,可得到诊断确认。
在2000年代初之前,干扰素α(ifnα)和造血干细胞移植是cml唯一有效的治疗方法。当可获得相容的hla供体时,造血干细胞同种异体移植被认为是对符合条件的患者来说唯一可能的治愈性治疗。该同种异体移植为过继免疫治疗疗法,用于多数侵袭性血液病的治疗。原理是依赖于通过特定t受体的细胞毒性t效应物的活性的免疫转移。然而,对于这些淋巴细胞而言特异的细胞毒活性受到肿瘤抗原呈递与人白细胞抗原(hla)系统的分子的限制。此类移植过程的死亡率以及同种异体移植后复发的风险仍然是这种免疫疗法的主要风险。
众所周知,尽管存在移植相关的死亡毒性,移植物抗白血病(graft-versus-leukemia)、同种异体干细胞移植的免疫学影响以及供体淋巴细胞输注(dli)的功效仍然是唯一的允许实现持久性疾病缓解(如果未治愈的话)的疗法。
自2000年代初以来,慢性期cml的治疗中酪氨酸激酶抑制剂(tki)的发现和广泛使用已大大改变了该血液病的预后,实现了超过90%的生存率。现在,将cml中造血干细胞的同种异体移植的适应症保留给tki不耐受/耐药的患者以及晚期cml(加速期或急变期)。
在2017年,关于一线疗法,选择的治疗仍然为使用酪氨酸激酶抑制剂(tki),尽管可使用其它治疗性替代方案。在tki疗法中,多数患者恢复了正常的造血。然而,尽管诸如伊马替尼、达沙替尼、尼洛替尼、博舒替尼或普纳替尼的tki在cml患者的总生存率和生活质量方面提供了很多,这些药物治愈cml的能力有限。
此外,考虑到不耐受和毒性,怀孕的潜在风险或卫生资助机构的医学经济目的导致考虑停用tki。
在一项多中心伊马替尼研究中,伊马替尼治疗(持续时间超过2年)在分子层面上检测不到白血病的cml患者中中断。在登记的69名患者中,这69名患者中的42名(61%)复发。在12个月时,69名患者的持续的分子层面检测不到的白血病的概率为41%。失败的原因是tki无法根除静息cml干细胞。
法国研究stim1(n=100名患者)于2017年进行了更新,该研究试图在具有完全分子反应的患者中停止伊马替尼。在2.5个月的中位时间内,停止tki后的分子复发率为61%,说明了在这些复发的患者中疾病的骨髓贮库的持久性。
实际上,当前的tki更多的是抑制性疗法而非治愈性疗法,需要连续长期给予tki,并可能发生意料之外和未知的不良事件。此外,向年轻cml患者长期给予tki可能对未来构成挑战。
因此,需要消除持久的tki抗性cml静息前体。遗传方法提供了增强免疫识别和消除癌细胞的潜在手段。一种有前途的策略是对免疫效应细胞进行遗传工程化,以表达将细胞毒性重定向至肿瘤细胞的嵌合抗原受体。
最近,由于细胞工程的进步,使得能够绕过肿瘤逃逸机制,最新一代的car(嵌合抗原受体)-t细胞正在涌现。car-t细胞是表达嵌合tcr的t淋巴细胞,所述嵌合tcr由与免疫球蛋白可变片段融合的tcr的恒定部分组成。靶标的识别不受hla的限制,因此允许靶向各种肿瘤标志物。
在新的免疫疗法中,这些针对细胞表面肿瘤相关抗原的car-t细胞不仅在难治性/复发性all(急性淋巴性白血病)(cd19)或cll(慢性淋巴细胞白血病)(cd19)患者中显示出出乎预料的成功,也在实体瘤和血液学领域的临床前研究(主要在mm(多发性骨髓瘤)(cd38、bcma(b细胞成熟抗原)、cd44v6或cs1)、aml(急性粒细胞白血病)(cd33或cd123)、t细胞恶性肿瘤(cd5)或淋巴瘤(cd30)方面)中显示出出乎预料的成功。
在cml中,基因表达谱研究已揭示了由白血病造血干细胞而非正常cd34+/cd38-造血干细胞表达的细胞表面生物标志物(il-1rap或il-1r3)。此外,il-1rap表达与cml疾病的临床阶段以及肿瘤负荷有关。
il-1rap(白介素1受体辅助蛋白,genbank登录号aab4059)是il-1和il33受体的共受体,参与il-1信号转导,其激活不同的信号转导途径,包括map激酶、p38、nf-·b和炎症和增殖中包含的其它基因。该蛋白在肿瘤细胞表面表达。因此,il-1rap是一种有前途的肿瘤相关抗原。
技术实现要素:
本申请人发现,通过使用该il-1rap抗原,可生成待给予至患有癌症或肿瘤(特别是cml)的患者的遗传修饰的cart细胞。
靶向造血干细胞phi+(其为cml的病因,具有靶标il-1rap)的细胞car-t的开发是作为tki的补充或代替tki来根除血液病的来源的手段,其实质上靶向血液病的前体。
该新的治疗武器可应用于:
-tki停用后复发的患者;
-同种异体移植(移植物抗白血病,同种异体干细胞移植,供体淋巴细胞输注(dli))后复发的患者;
-在tki下反应次优的非合格患者;或
-表现出加速的cml/急变且复发风险大的患者;
-青年或儿童cml患者。
在一个实施方式中,提供了编码car的多核苷酸,所述car包含结合靶抗原的细胞外结构域、跨膜结构域以及一个或多个细胞内信号转导结构域。在一个实施方式中,本文考虑了用包含car的载体遗传修饰的t细胞。表达car的t细胞在本文中称为cart细胞或car修饰的t细胞。
在具体实施方式中,本发明考虑了经遗传修饰以表达本文所考虑的car的细胞,用于癌症治疗。本文使用的术语“遗传工程化”或“遗传修饰”指将处于dna或rna形式的额外的遗传物质添加至细胞的总遗传物质中。
术语“#e3c3”和“#a3c3”应理解为相同:#e3c3能够被自由地用以指代#a3c3,反之亦然。
通过阅读下面的描述、附图和实施例,本发明的其它目的、特征、方面和优势将更加清楚。
附图说明
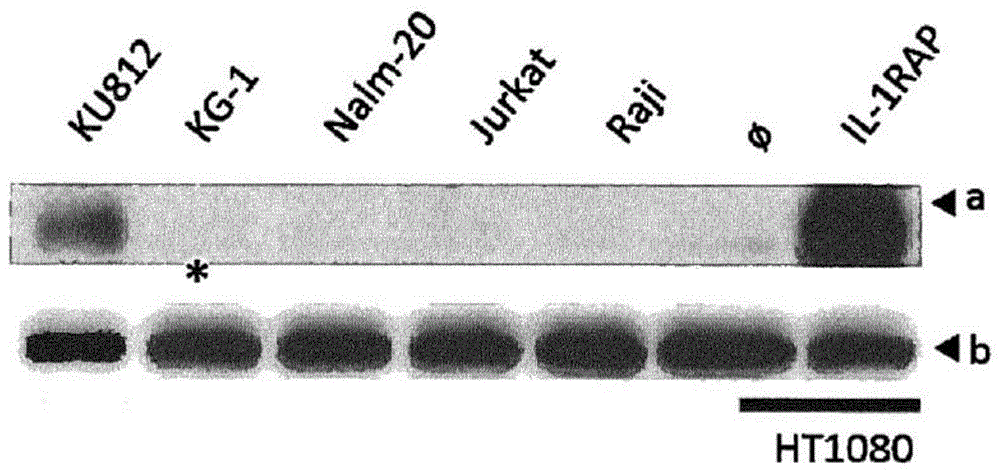
图1:使用#e3c3mab的蛋白质印迹。使用白血病细胞系ku812、kg-1、nalm-20、jurkat和raji。使用经il-1rapcdna变体转染的ht1080细胞系作为对照。肌动蛋白显示为蛋白上样对照。a排:il-1rap(72kda)的检测;b排:对照肌动蛋白(43kda)的检测,*:弱信号。
图2:通过elisa技术用#e3c3mab识别il-1rap重组蛋白(b)。bsa为阴性对照(a)。
图3:在诊断时(diag)或伊马替尼(im)治疗后2名cml阳性患者的外周血(pm)或骨髓(bm)的免疫分型。il-1rap(#e3c3)与cd34+和cd38-荧光染色结合使用。系统地使用了不同mab的荧光染料缀合的同种型对照mab。
图4:用荧光mab染色的ku812(a)和raji细胞系(b)[(左图:抗鼠fc-igg;中图:il-1rap(#e3c3)]。用核染色剂dapi进行复染并叠加至荧光染色(右图,合并)。
图5:使用冷冻组织阵列的特异性组织结合。分别使用高il-1rap表达细胞系(ku812)(a)或il-1rap阴性表达细胞系(raji)(b)作为阳性对照或阴性对照。测试了以下组织:a:淋巴结;b:结肠;c:小肠;d:胎盘;e:胃;f:肺;g:脾;以及h:前列腺。
图6:携带安全icasp9盒、#e3c3mab的单链可变片段(thesinglechainfragmentvariable,scfv)以及细胞表面表达的标志物·cd19的sin慢病毒构建体的设计。3个转基因被2a肽剪切序列分隔开,并处于ef1启动子加sp163增强子序列的控制下。
图7:il-1rap转导的t细胞的亚细胞级分的蛋白质印迹。a:总裂解物;b:膜;c:胞浆;d:核;(1)car相关cd3ζ(55kda);(2)内源性cd3ζ(16kda);(3)cd45(147kda);(4)核纤层蛋白(68kda);(5)gapdh(35kda)。
图8:il-1rapcar转导的cemt细胞系或原代t细胞的facs分析检测。将生物素+/cd19+cemt细胞或t细胞的百分比(a)针对生物素标记重组蛋白(b)的量作图。
图9:二聚体化学诱导剂(chemicalinducerdimerizer,10nmcid)暴露后,icasp9/ap1903自杀系统盒的安全开关。(a)293t细胞;(b)il-1rapcar293t细胞。
图10:与未转导的t细胞(c0)相比,24h或48hcid暴露后il-1rapcart细胞的消除(***p<0.001,n=3)。
图11:亚型1(v1)和亚型3(v5)的流式细胞术(11a)和蛋白质印迹(11b)。(a)肌动蛋白;(b)il-1rap-v1或il-1rap-v5(72kda);(1)总细胞k562蛋白;(2)来自k562培养物的培养基上清液。
图12:通过cfse染色的c0、mock或il-1rapcart细胞在k562(a)、k562-v1(b)、k562-v5(c)或ku812(d)细胞系存在的情况下的共培养,由表达il-1rap靶标的细胞触发的il-1rapcart细胞的增殖能力。(p<0.001,n=4)
图13:与c0(a)、mockt细胞(b)或cart细胞(c)共培养后上清液中th1/th2/th17细胞因子的测量。
图14:针对il-1rap+表达靶细胞(k532-v1,ku812),在共培养的il-1rapcart细胞上进行的cd107a&b脱粒测定。用莫能菌素处理效应物,并在37℃下用cd107amab和cd107bmab染色1小时。5小时后,通过流式细胞术分析cd3+/cd19+/cd8+细胞的cd107a和cd107b染色。pma/iono激活用作对照。(p<0.001,n=4)。
图15:通过荧光(efluor)和7-aad染色进行的表达il-1rapcar的t细胞的体外il-1rap依赖性细胞溶解能力。使用未转导的t细胞或mock转导的t细胞作为对照。(p<0.001,n=4)。
图16:鼠实验。a/nsg小鼠k562异种移植模型。从第2天至第28天,不同组的小鼠的b/bli分析。
图17:针对来自cml患者的原代il-1rap+循环细胞的体外毒性。左:根据欧洲抗癌(europeagainstcancer,eac)方法和建议的bcr-abl1转录本比(在国际水平上的%)的动力学定量。rm3.0、rm4.0、rm4.5和rm5.0分别代表对应于降低3log、4log、4.5log和5log的分子反应水平。im400:伊马替尼400mg/天;das100:达沙替尼100mg/天;bos400:博舒替尼400mg/天;nil600:尼洛替尼600mg/天。右:来自cml患者的pbmc的转导效率的cd3+/cd19+染色和流式细胞术分析。
图18:在效应物c0、mock-t细胞或cart细胞以不同的e:t比与ku812细胞共培养后,在fsc+/7-aad-门控内持久存活的ku812细胞的图示,以efluor标记。fsc+/7-aad-门控内持久存活的ku812细胞的图示。
图19:针对来自cml患者的原代il-1rap+循环细胞的体外毒性。由重复实验计算得出的所杀伤的总靶标的百分比。结果表示为平均值±sd。
图20:在各种效应物:靶标(e:t)比下,il-1rapcart细胞或mockt细胞针对其各自的cml自体移植物的细胞毒性。来自3名不同cml患者的3项独立实验的结果汇总。提供了从对照细胞(c0)计算出的剩余的存活的cd34+/il-1rap+细胞的百分比。**p<0.01。
图21:将由cml患者(n=3,这些患者仍然活着并且实际上处于不同的tki治疗20年以上(最少16年,最多21年)或未治疗的情况中)的pbmc产生的自体il-1rapcart细胞与他们各自冷冻保存的自体外周血干细胞移植物(pbsc,20多年前在他们诊断时采集)进行了体外共培养。cml患者、外周血干细胞自体移植的特征。
图22:(a)组织微阵列。美国食品药品监督管理局标准冷冻组织阵列的代表性#a3c3染色,包括每种器官3个不同供体的90个组织核心(30种器官)(usbiomax,rockville,md,美国)。使用ultraviewuniversaldab检测试剂盒(ventana,美国)检测免疫染色。获取图像并使用ndp.view2.0软件进行分析。显示了分析的3个个体的至少一个个体的组织显示出一定程度的#a3c3mab染色(比例尺100μm)。分别使用高il-1rap表达细胞系(ku812)或il-1rap阴性表达细胞系(raji)作为阳性对照或阴性对照。(b)hmec-1真皮内皮细胞系的il-1rapr&d(红)染色或#a3c3(蓝)染色。同种型igg1(灰色)以叠加形式描绘。提供了两种染色的rfi。
图23:il-1rapcart细胞对健康造血细胞的影响以及安全自杀基因icasp9盒的效率。(a)来自健康供体(n=5)的外周血(左)或骨髓(右)细胞上的il-1rap细胞表面表达。ssc-a/cd45+将其区分为如淋巴细胞(ssc-a低)、单核细胞(cd33+)、粒细胞(ssc-a高)或hsc(cd33-/cd34+)的亚群。计算亚型染色的rfi并提供在每个窗口中。(b)全人脐带血细胞的代表性il-1rap染色(3个中的1个)。提供了整体的cd34+、cd34+/cd38-和cd34+/cd38+hsc脐带血亚群的il-1rap染色。(c)相比来自cml患者的bm(n=10)或外周血(pb,n=10)的cd34+细胞,来自健康供体(n=5)的脐带血(cb,n=5)或骨髓(bm)的cd34+细胞中的il-1rap阳性细胞。(d)左:在自体非转导t细胞或mockt细胞或il-1rapcart细胞的不同效应物:靶标(e:t)比的存在下培养的ssc-a/cd45+粒细胞(g)、单核细胞(m)和淋巴细胞(l)亚群的点图。右:与自体mockt细胞(虚线)或il-1rapcart细胞(实线)共培养24h的淋巴细胞(正方形)、单核细胞(圆圈)和粒细胞(三角形)中的活细胞的相对百分比,归一化至非转导的自体t细胞(c0)。(e)在mockt细胞(黑色,虚线)或il-1rapcart细胞(白色,实线)以不同e:t比存在下,单核细胞(正方形)、ku812(圆圈)或k562(三角形)亚群中活细胞的相对百分比。基于5000荧光珠细胞计数采集,使用trucount管测定的绝对细胞数来计算百分比。(f)左:关于cidap1903诱导的细胞死亡的绝对计数的门控策略和分析。将非转导的t细胞(c0)或il-1rapcart细胞暴露于仅培养基或培养基+cid(20nm,24h)。在采集5000个荧光珠后进行定量。将杀伤效率归一化至对照细胞(未处理的细胞)。细胞杀伤计算如下:%死细胞=[1-(ap1903处理的细胞中活细胞的绝对数目/未经处理的细胞中活细胞的绝对数目)]×100。(d)死亡率的绝对百分比。c0或il-1rapcart细胞(在cd3+/cd19+上进行门控)cid暴露24h或48h。右:结果为来自3个独立实验的平均值。**p<0.001。(g)在i.p.ap1903处理(白色条)后24小时注射入肿瘤(cmlku812,i.v.)异种移植nsg模型中的il-1rapcart细胞的绝对定量(n=3只小鼠/组)。使用输注有对照t细胞(c0)的小鼠作为对照(n=2只小鼠/组)。**p<0.01。提供了每ml外周血的细胞数。
图24:实验性免疫安全性人cd34+移植nog鼠模型,用以研究自体il-1rapcart细胞对于人cd34+脐带血细胞移植/nog鼠模型(hu-nog)的hsc和/或免疫细胞的特异性毒性。简而言之,输注10×10e6个自体cart细胞或对照t细胞(c0)(由人cd45+细胞产生,分选自鼠pbmc、脾或骨髓)。在输注后的不同时间(第5天、第8天和第15天)通过细胞计数术评估对成熟免疫细胞(hcd3+、hcd19+、hcd56+、hcd14+、hcd11b+)的监测。由cart细胞输注前第-7天获得的免疫分型参比计算倍数变化。与外周血采集时间(第-9天)相比。与外周血采集时间(第-9天)相比,未转导的细胞(c0,白色条)或il-1rapcart细胞(黑色条)输注后第3天、第8天和15天时不同免疫活性细胞亚群的倍数变化。从眼球后样本收获的外周血中进行细胞计数,并针对第-7天参比计算倍数变化。n.s:不显著。
图25:集落形成单位(cfu-gm)实验{giavridis,2018#1861}:从3个不同脐带血中获得cd34+hsc,单独培养(白色条)或与它们各自的自体未转导t细胞(c0,灰色条)或il-1rapcart细胞共培养(黑色条)。
图26:上图:通过光学显微术评价cid对转导的293t细胞的作用。下图:cidap1930暴露后il-1rapcart细胞的流式细胞术分析。在未转导的t细胞(c0)以及表达或不表达il-1rapcar的gmtc混合物上进行cid暴露(20nm,24小时,深灰色)或不进行暴露(浅灰色)后的流式细胞术分析。cd3+/cd19+染色允许区分表达car的gmtc。
具体实施方式
下表总结了序列标识符。
表1:序列表
igg1、igg4、cd8α、4-1bb、cd3ζ、cd28和icasp9基因的铰链区的序列可在genbank上找到。
除非特别指出相反的情况,否则本发明的实施将采用本领域技术范围内的化学、生物化学、有机化学、分子生物学、微生物学、重组dna技术、遗传学、免疫学和细胞生物学的常规方法,出于说明的目的在下面对其中的许多方法进行了描述。此类技术在文献中有充分解释。参见,例如,sambrook等,molecularcloning:alaboratorymanual(第3版,2001);sambrook等,molecularcloning:alaboratorymanual(第2版,1989);maniatis等,molecularcloning:alaboratorymanual(1982);ausubel等,currentprotocolsinmolecularbiology(johnwileyandsons,2008年7月更新);shortprotocolsinmolecularbiology:acompendiumofmethodsfromcurrentprotocolsinmolecularbiology,greenepub.associatesandwiley-interscience;glover,dnacloning:apracticalapproach,vol.i&ii(irl出版社,牛津,1985);anand,techniquesfortheanalysisofcomplexgenomes,(学术出版社,纽约,1992);transcriptionandtranslation(b.hames&s.higginsz,1984);perbal,apracticalguidetomolecularcloning(1984);harlowandlane,antibodies,(冷泉港实验室出版社,冷泉港,n.y.,1998);currentprotocolsinimmunology,q.e.coligan,a.m.kruisbeek,d.h.margulies,e.m.shevach和w.strober编,1991;annualreviewofimmunology;以及advancesinimmunology等期刊的专著。
除非另有定义,本文中使用的全部技术术语和科学术语具有与本发明所属领域的普通技术人员通常理解的含义相同的含义。尽管类似或等同于本文描述的方法和材料的任何方法和材料都可用于本发明的实践或测试,本文描述了组合物、方法和材料的优选实施方式。
如本领域技术人员将理解的并且如本文中其它地方所述,完整的抗体包含两条重链和两条轻链。每条重链由可变区以及第一恒定区、第二恒定区和第三恒定区组成,而每条轻链由可变区和恒定区组成。哺乳动物重链分为α、δ、ε、γ和μ,哺乳动物轻链分为λ或κ。包含α、δ、ε、γ和μ重链的免疫球蛋白被分类为免疫球蛋白(ig)a、igd、ige、igg和igm。完整的抗体形成“y”形。y的茎由结合在一起的两个重链的第二恒定区和第三恒定区(对于ige和igm为第四恒定区)组成,并在铰链中形成二硫键(链间)。重链γ、·和δ具有由3个串联(在一条线上)的ig结构域组成的恒定区以及用于增加柔性的铰链区;重链μ和ε具有由4个免疫球蛋白结构域组成的恒定区。第二恒定区和第三恒定区分别称为“ch2结构域”和“ch3结构域”。y的每个臂包含与一条轻链的可变区和恒定区结合的一条重链的可变区和第一恒定区。轻链和重链的可变区负责抗原结合。
轻链和重链可变区包含被3个高变区(也称为“互补决定区”或“cdr”)中断的“框架”区。可通过常规方法界定或鉴别cdr,例如通过根据kabat等所述的序列(wu,tt和kabat,e.a.,jexpmed.132(2):211-50,(1970);borden,p.和kabate.a.,pnas,84:2440-2443(1987)(参见kabat等,sequencesofproteinsofimmunologicalinterest,美国卫生与公共服务部,1991);或者通过根据chothia等所述的结构(choithia,c.和lesk,a.m.,jmol.biol.,196(4):901-917(1987);choithia,c.等,nature,342:877-883(1989))。
不同轻链或重链的框架区的序列在物种(例如人)内相对保守。抗体的框架区(其为组成的轻链和重链的组合框架区)用于在三维空间中定位和排列cdr。cdr主要负责结合抗原表位。每条链的cdr通常称为cdr1、cdr2和cdr3,从n端开始按顺序编号,并且通常还由特定cdr所在的链来标识。因此,位于抗体重链的可变结构域中的cdr被称为cdrh1、cdrh2和cdrh3,而位于抗体轻链的可变结构域中的cdr被称为cdrl1、cdrl2和cdrl3。具有不同特异性(即针对不同抗原的不同结合位点)的抗体具有不同的cdr。
提及“vh”或“vh”是指免疫球蛋白重链的可变区,包括抗体、fv、scfv、fab或如本文所公开的其它抗体片段的可变区。
提及“vl”或“vl”是指免疫球蛋白轻链的可变区,包括抗体、fv、scfv、dsfv、fab或如本文所公开的其它抗体片段的可变区。
“单克隆抗体”是由b淋巴细胞的单一克隆或由其中转染了单一抗体的轻链和重链基因的细胞所产生的抗体。单克隆抗体通过本领域技术人员已知的方法来产生,例如通过由骨髓瘤细胞与免疫脾细胞的融合制造杂交的形成抗体的细胞。单克隆抗体包括人源化单克隆抗体。
冠词“一个/一种(a/an)”和“所述/该(the)”在本文中用于指代一个或一种或者知道多于一个或一种(即指代至少一个/一种)该冠词的语法对象。
本文使用的术语“约/大约(about/approximately)”是指数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度与参比数量、水平、值、数目、频率、百分比、尺寸、大小、量、重量或长度相差多达30%、25%、20%、25%、10%、9%、8%、7%、6%、5%、4%、3%、2%或1%。在具体实施方式中,当在数值之前时术语“约/大约”表示该值±15%、±10%、±5%或±1%。
在整个本说明书中,除非上下文另有要求,词语“包括/包含/含有(comprise/comprises/comprising)”将被理解为暗示包括所提到的步骤或要素或者步骤或要素的组,但不排除任何其它步骤或要素或者步骤或要素的组。
在整个说明书中提及“一个实施方式”、“实施方式”、“具体实施方式”、“某一实施方式”、“另外的实施方式”或“进一步的实施方式”或其组合意为结合该实施方式描述的具体特征、结构或特性包括在本发明的至少一个实施方式中。
为本发明的目的,通过在比较窗口中比较两个比对的序列来计算“同一性”或“同源性”。序列的比对使得能够确定比较窗口中两个序列共有的位置(核苷酸或氨基酸)的数目。然后,将共有位置的数目除以比较窗口中的总位置数并乘以100,以获得同源性百分比。序列同一性百分比的确定可手动完成或者使用公知的计算机程序完成。
本发明提供了免疫效应细胞,所述免疫效应细胞经被设计为表达将细胞毒性重定向至肿瘤细胞的嵌合抗原受体的载体遗传工程化。这些遗传工程化的受体在本文中称为嵌合抗原受体(car)。car是如下分子:结合针对靶抗原(例如肿瘤抗原)的基于抗体的特异性与t细胞受体激活细胞内结构域,而生成表现出特异性抗肿瘤细胞免疫活性的嵌合蛋白。本文使用的术语“嵌合”描述由来自不同来源的不同蛋白或dna的部分组成。
本发明涉及编码嵌合抗原受体(car)的分离的核酸分子,其中,所述car包含抗体或抗体片段,所述car包含抗il-1rap结合结构域、跨膜结构域以及细胞内信号转导结构域,所述细胞内信号转导结构域至少包含刺激结构域,其中,所述抗il-1rap结合结构域包含:
(i)轻链,所述轻链包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:6具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:7具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区3(cdr3)与氨基酸序列seqidno:8具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性;以及
(ii)重链,所述重链包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:12具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:13具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区3(cdr3)与氨基酸序列seqidno:14具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性。
car的主要特征是它们重定向免疫效应细胞特异性的能力,从而引起增殖、细胞因子产生、吞噬、或者可以以主要组织相容性(mhc)非依赖性的方式介导表达靶抗原的细胞的细胞死亡的分子的产生,利用单克隆抗体、可溶性配体或细胞特异性共受体的细胞特异性靶向能力。
本文使用的术语“结合结构域”、“细胞外结合结构域”、“抗原特异性结合结构域”和“细胞外抗原特异性结合结构域”可互换使用,并提供了car特异性结合至感兴趣的靶抗原的能力。结合结构域可包含拥有特异性识别并结合至生物分子(例如细胞表面受体或肿瘤蛋白、脂质、多糖或其它细胞表面靶分子,或它们的组成部分)的能力的任意蛋白、多肽、寡肽或肽。结合结构域包括感兴趣的生物分子的任何天然存在的结合伴侣、合成的结合伴侣、半合成的结合伴侣或重组产生的结合伴侣。本文使用的术语“特异性结合亲和力”或“特异性结合(的)(specificallybinds/specificallybound/specificbinding)”或“特异性靶向”描述了一个分子与另一分子以比背景结合更大的结合亲和力结合。如果结合结构域(或包含结合结构域的car或包含结合结构域的融合蛋白)以例如大于或等于约105m-1的亲和力或ka(即特定结合相互作用的平衡缔合常数,以1/m为单位)与靶分子结合或缔合,则该结合结构域(或包含结合结构域的car或包含结合结构域的融合蛋白)“特异性结合”该靶分子。可使用常规技术例如竞争性elisa(酶联免疫吸附测定)容易地确定根据本公开的结合结构域多肽和car蛋白的亲和力。
抗体为人抗体、鼠抗体或人源化抗体。
在某些优选的实施方式中,抗体是特异性结合至肿瘤细胞的表面蛋白的人源化抗体(例如人源化单克隆抗体)。“人源化”抗体是包含人框架区以及来自非人(例如小鼠、大鼠或合成的)免疫球蛋白的一个或多个cdr的免疫球蛋白。因此,可能除了cdr外,人源化免疫球蛋白的所有部分与天然人免疫球蛋白序列的相应部分基本上相同。人源化单克隆抗体或其它单克隆抗体可具有额外的保守氨基酸置换,所述置换对抗原结合或其它免疫球蛋白功能大体上没有影响。可借助遗传工程来构建人源化抗体(参见例如美国专利no.5,585,089)。
抗体包括其抗原结合片段,例如fab片段、fab'片段、f(ab)'2片段、f(ab)'3片段、fv、单链fv蛋白(“scfv”)以及全长抗体负责抗原结合的部分。该术语还包括遗传工程化形式,例如嵌合抗体(如人源化鼠抗体)、异源结合抗体(heteroconjugateantibodies)(如双特异性抗体)以及它们的抗原结合片段。
“单链fv”或“scfv”抗体片段包含抗体的vh结构域和vl结构域,其中,这些结构域以单一多肽链和任一方向存在(例如vl-vh或vh-vl)。
可从对期望的靶标而言特异的杂交瘤的v区域基因克隆单链抗体。此类杂交瘤的生产已成为常规。可用于克隆重链可变区(vh)和轻链可变区(vl)的技术已有所描述,例如在orlandi等,pnas,1989;86:3833-3837中。
通常,scfv多肽进一步包含处于vh和vl结构域之间的多肽接头,其使得scfv能够形成期望的抗原结合结构。
本文考虑的car可包含1个、2个、3个、4个或5个或更多个接头。在具体实施方式中,接头的长度为约1个至约25个氨基酸、约5个至约20个氨基酸、或约10个至约20个氨基酸或者任何介于中间的氨基酸长度。在一些实施方式中,接头长度为1个、2个、3个、4个、5个、6个、7个、8个、9个、10个、11个、12个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个、24个、25个或更多个氨基酸。
接头的示例性实例包括甘氨酸聚合物(g)n;甘氨酸丝氨酸聚合物(gi_ssi_5)n,其中n为至少1、2、3、4或5的整数;甘氨酸丙氨酸聚合物;丙氨酸丝氨酸聚合物;以及本领域已知的其它柔性接头。甘氨酸聚合物和甘氨酸丝氨酸聚合物是相对非结构化的,并且因此可能能够充当融合蛋白(例如本文所述的car)的结构域之间的中性系链(tether)。甘氨酸甚至比丙氨酸明显更容易接近phi-psi空间,并且比具有更长侧链的残基受到更少限制(参见scheraga,rev.computationalchem.11173-142(1992))。普通技术人员将认识到,具体实施方式中car的设计可包括完全或部分柔性的接头,使得接头可包含柔性接头以及一个或多个赋予较低柔性结构的部分,以提供期望的car结构。
在具体实施方式中,接头在vh结构域和vl结构域之间。
在具体实施方式中,接头包含氨基酸序列seqidno:5或者由氨基酸序列seqidno:5组成。
在一个实施方式中,il-1rap结合结构域为包含轻链可变区和重链可变区的scfv,所述轻链可变区包含具有至少1个、2个或3个修饰但不多于30个、20个或10个修饰的轻链可变区氨基酸序列seqidno:4的的氨基酸序列,所述重链可变区包含具有至少1个、2个或3个修饰但不多于30个、20个或10个修饰的重链可变区氨基酸序列seqidno:2的氨基酸序列。
优选地,il-1rap结合结构域为scfv,所述scfv包含(i)轻链可变区,所述轻链可变区包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:6具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:7具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区3(cdr3)与氨基酸序列seqidno:8具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性;以及(ii)重链可变区,所述重链可变区包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:12具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:13具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区3(cdr3)与氨基酸序列seqidno:14具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性。
car的结合结构域通常后面是一个或多个“铰链区”,其在将抗原结合结构域定位于远离效应细胞表面以使得能得到适当的细胞/细胞接触、抗原结合和活化中起作用。car通常在结合结构域和跨膜结构域之间包含一个或多个铰链区。铰链区可来源于天然来源、合成来源、半合成来源或重组来源。
优选地,抗il-1rap结合结构域通过铰链区连接至跨膜结构域。
在实施方式中,铰链区包含igg1的铰链序列或与igg1的铰链序列具有95%-99%同一性的序列。
在进一步的实施方式中,铰链区包含igg4的铰链序列或与igg4的铰链序列具有95%-99%同一性的序列。在进一步的实施方式中,铰链区还可包含igg1或igg4的ch2-ch3区域或者与igg1或igg4的ch2-ch3区域具有95%-99%同一性的序列。
在进一步的实施方式中,铰链区包含cd8α或与cd8α具有95%-99%同一性的序列。
“跨膜结构域”是car的一部分,其融合细胞外结合部分和细胞内信号转导结构域,并将car锚定至免疫效应细胞的质膜。跨膜结构域可来源于天然来源、合成来源、半合成来源或重组来源。
优选地,编码的car包含选自于由以下蛋白所组成的组中的蛋白的跨膜结构域:t细胞受体的α链、β链或ζ链,cd28,cd3ε,cd45,cd4,cd5,cd8,cd9,cd16,cd22,cd33,cd37,cd64,cd80,cd86,cd134,cd137和cd154,更优选cd28。
在具体实施方式中,本文考虑的car包含细胞内信号转导结构域。“细胞内信号转导结构域”是指car的以下部分:其参与将有效的car与靶抗原结合的信息转导至免疫效应细胞内部以引发效应细胞功能,例如活化、细胞因子产生、增殖和细胞毒性活性,包括向car结合的靶细胞释放细胞毒性因子,或由抗原结合至细胞外car结构域所引起的其它细胞反应。
术语“效应物功能”是指细胞的专门功能。t细胞的效应物功能例如可为细胞溶解活性或包括细胞因子分泌在内的活性或协助。因此,术语“细胞内信号转导结构域”是指蛋白的如下部分:其转导效应物功能信号并指导细胞执行专门的功能。虽然通常可使用整个细胞内信号转导结构域,但在许多情况中,没有必要使用整个结构域。就使用细胞内信号转导结构域的截短部分而言,只要其转导效应物功能信号,就可使用此类截短部分代替整个结构域。术语“细胞内信号转导结构域”旨在包括足以转导效应物功能信号的任意细胞内信号转导结构域截短部分。
已知仅通过tcr生成的信号不足以完全激活t细胞,并且还需要次级信号或共刺激信号。因此,可以说t细胞活化是由两类不同的细胞内信号转导结构域介导的:通过tcr(例如tcr/cd3复合体)起始抗原依赖性主要激活的主要信号转导结构域,以及以抗原非依赖性方式起作用以提供次级或共刺激信号的共刺激信号转导结构域。在优选的实施方式中,本文考虑的car包含细胞内信号转导结构域,所述细胞内信号转导结构域包含一个或多个“共刺激信号转导结构域”。
在实施方式中,分离的核酸分子可编码包含至少一个共刺激结构域的细胞内信号转导结构域。因此,在这种实施方式中,细胞内信号转导结构域包含至少一个共刺激结构域。
本文使用的术语“共刺激信号转导结构域”或“共刺激结构域”是指共刺激分子的细胞内信号转导结构域。共刺激分子是除抗原受体或fc受体外的细胞表面分子,其在结合至抗原后提供t淋巴细胞的有效活化和功能所需的第二信号。
优选地,功能性细胞内信号转导结构域的至少一个共刺激结构域由选自于由以下蛋白所组成的组中的一种或多种蛋白获得:ox40、cd2、cd27、cd28、cds、cd3ζ、icam-1、lfa-1(cd11a/cd18)、icos(cd278)和4-1вb(cd137)。
更优选地,由4-1вb(cd137)获得的共刺激结构域具有与4-1bb的共刺激结构域的氨基酸序列具有95%-99%同一性的序列。
更优选地,从cd3ζ获得的共刺激结构域具有与cd3ζ的共刺激结构域的氨基酸序列具有95%-99%同一性的序列。
在另一实施方式中,细胞内信号转导结构域包含由4-1bb获得的共刺激结构域和/或由cd3ζ获得的共刺激结构域。
在特别优选的实施方式中,car包含cd3ζ主要信号转导结构域和一个或多个共刺激信号转导结构域。细胞内主要信号转导结构域和共刺激信号转导结构域可以以任何顺序串联连接至跨膜结构域的羧基末端。
还考虑了由本发明的核酸分子编码的分离的多肽分子以及包含抗体或抗体片段的分离的car分子,所述car包含抗il-1rap结合结构域、跨膜结构域和细胞内信号转导结构域,其中,所述抗il-1rap结合域包含:
(i)轻链,所述轻链包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:6具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:7具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区3(cdr3)与氨基酸序列seqidno:8具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性;以及
(ii)重链,所述重链包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:12具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:13具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区域3(cdr3)与氨基酸序列seqidno:14具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性。
除非有相反的说明,否则“多肽”、“多肽片段”、“肽”和“蛋白”可互换并根据常规含义(即为氨基酸的序列)使用。多肽不限于特定长度,例如它们可包含全长蛋白序列或全长蛋白的片段,并且可包含多肽的翻译后修饰物(例如糖基化、乙酰化、磷酸化等)以及天然存在的和非天然存在的本领域中已知的其它修饰物。
可使用各种众所周知的重组和/或合成技术中的任一种来制备多肽。本文考虑的多肽具体涵盖本公开的car,或具有对如本文所公开的car的一个或多个氨基酸的删除、添加和/或置换的序列。
本文使用的“分离的肽”或“分离的多肽”等指从细胞环境体外分离和/或纯化的肽或多肽分子,不与细胞的其它成分缔合。类似地,“分离的细胞”是指由体内组织或器官获得并且基本上不含细胞外基质的细胞。
术语“载体”在本文中用于指能够转移或运输另一核酸分子的核酸分子。所转移的核酸通常连接至(例如插入)载体核酸分子。载体可包含指导在细胞中自主复制的序列,或者可包含足以允许整合至宿主细胞dna的序列。
本发明还提供了包含编码本发明的car的核酸分子的载体,所述载体选自dna、rna、质粒、慢病毒载体、腺病毒载体或逆转录病毒载体,优选慢病毒载体。
在一些实施方式中,本发明的载体包含启动子,优选ef-1α启动子。
逆转录病毒是基因递送的常用工具。在具体实施方式中,逆转录病毒用于将编码嵌合抗原受体(car)的多核苷酸递送进细胞。本文使用的术语“逆转录病毒”是指如下rna病毒:所述rna病毒将其基因组rna逆转录为线性双链dna拷贝,并随后将其基因组dna共价整合进宿主基因组中。一旦病毒整合进宿主基因组中,其被称为“前病毒(provirus)”。前病毒充当rna聚合酶ii的模板,并指导编码产生新病毒颗粒所需的结构蛋白和酶的rna分子表达。
因此,用本发明的载体转导的t细胞能够引起稳定、长期且持久的car介导的t细胞应答。
在具体实施方式中,用编码根据本发明的car的逆转录病毒载体(例如慢病毒载体)对t细胞进行转导。
本文使用的术语“慢病毒”是指一组(或属)复杂的逆转录病毒。示例性慢病毒包括但不限于:hiv(人免疫缺陷病毒;包括1型hiv和2型hiv);维斯那-梅迪病病毒(visna-maedivirus,vmv);山羊关节炎-脑炎病毒(caev);马传染性贫血病毒(eiav);猫免疫缺陷病毒(fiv);牛免疫缺陷病毒(biv);以及猴免疫缺陷病毒(siv)。
术语“慢病毒载体”是指含有主要源自慢病毒的结构遗传元件和功能遗传元件或者它们的部分(包括ltr)的病毒载体或质粒。
“自灭活”(sin)载体是指复制缺陷型载体,例如逆转录病毒或慢病毒载体,其中已对右端(3')ltr增强子-启动子区域(称为u3区域)进行了修饰(例如,通过删除或置换),以防止第一轮病毒复制之外的病毒转录。
在一个实施方案中,优选sin载体骨架。
优选地,使用的载体进一步包含启动子,例如ef-1α启动子。
本文使用的术语“启动子”是指rna聚合酶所结合至的多核苷酸(dna或rna)的识别位点。rna聚合酶起始并转录与启动子可操作地连接的多核苷酸。在具体实施方式中,可期望由在t细胞中提供稳定且长期的car表达的启动子表达包含car的多核苷酸,并且以足以将t细胞重定向至表达靶抗原的细胞的水平表达。
本发明还提供了包含编码本发明的car的核酸分子或本发明的载体的细胞,所述细胞优选为t细胞,例如人t细胞;更优选cd8+t细胞,例如人cd8+t细胞。在优选的实施方式中,本发明的细胞(例如t细胞)在其膜上表达本发明的car。
在具体实施方式中,在本文所述的免疫效应细胞的体外操纵或者遗传修饰之前,从对象获得细胞来源。在具体实施方式中,在其膜上表达本发明的car的免疫效应细胞包括t细胞。t细胞可获得自多种来源,包括但不限于:外周血单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染部位的组织、腹水、胸腔积液、脾组织以及肿瘤。在某些实施方式中,可使用技术人员已知的任何技术(例如沉淀,如ficolltm分离)从收集自对象的单位血液获得t细胞。在一个实施方式中,通过析离术(apheresis)获得来自个体循环血液的细胞。析离术的产物通常包含淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其它有核白细胞、红细胞和血小板。在一个实施方式中,可对通过析离术收集的细胞进行洗涤,以移除血浆级分,并将细胞置于合适的缓冲液或介质中以用于后续处理。
在某些实施方式中,通过裂解红细胞并耗尽单核细胞(例如通过经percolltm梯度离心),从外周血单核细胞中分离t细胞。可通过阳性或阴性选择技术进一步分离表达一种或数种标志物(例如cd4或cd8)的特定t细胞亚群。例如,可用针对阴性选择的细胞特有的表面标志物的抗体组合来完成通过阴性选择的t细胞群体的富集。
在本发明的一些实施方式中,多核苷酸或带有本发明的多核苷酸的细胞利用自杀基因(包括诱导型自杀基因)来降低直接的毒性(即同种异体给予环境中的移植物抗宿主病)和/或基因修饰的细胞不受控制的增殖的风险。在具体方面,自杀基因对带有所述多核苷酸或细胞的宿主不具有免疫原性。可使用的自杀基因的某些实例为诱导型半胱天冬酶-9(icasp9)、单纯疱疹病毒胸苷激酶(hsv-tk)、cd20、截短的egfr、半胱天冬酶8或胞嘧啶脱氨酶。可使用特定的二聚化化学诱导剂(cid)激活半胱天冬酶9。其它系统可通过对前药(更昔洛韦)进行代谢或者通过结合抗体(利妥昔单抗,西妥昔单抗(cituximab))来激活。
本文公开了一类细胞疗法,其中,对t细胞离体进行遗传修饰以表达car,并将cart细胞输注至需要其的接受者。输注的细胞能够杀伤接受者(优选人)中的肿瘤细胞。与抗体疗法不同,cart细胞能够在体内复制,从而导致可引起持续的肿瘤控制的长期持久性。
此外,car使得通过抗体来源的受体结合后允许效应t细胞向任何细胞表面分子重定向和活化,并且独立于mhc限制。
从患者自身的t细胞(自体)开始构建本发明的遗传修饰的t细胞,但它们也可起源于其它同种异体供体,以在骨髓或外周造血干细胞同种异体移植物环境中提供同种异体遗传修饰的t细胞(供体淋巴细胞输注)。这些表达根据本发明的car分子的t细胞可用于治疗哺乳动物(优选人)的增殖性疾病,该疾病与细胞表面il-1rap表达有关。
优选地,这些t细胞表达包含抗原结合结构域(其为抗il-1rapscfv)的car分子,所述car分子包含抗il-1rap结合结构域、cd28蛋白的跨膜结构域、共刺激4-1bb信号转导结构域以及cd3ζ信号转导结构域,其中,所述抗il-1rap结合域包含:
(i)轻链,所述轻链包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:6具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:7具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区3(cdr3)与氨基酸序列seqidno:8具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性;以及
(ii)重链,所述重链包含互补决定区1(cdr1)、互补决定区2(cdr2)以及互补决定区3(cdr3),所述互补决定区1(cdr1)与氨基酸序列seqidno:12具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区2(cdr2)与氨基酸序列seqidno:13具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性,所述互补决定区3(cdr3)与氨基酸序列seqidno:14具有至少80%、85%、90%、95%、96%、97%、98%、99%同一性或具有100%同一性。
本发明还提供了用作药物的根据本发明的细胞(例如t细胞)。
本发明还提供了用于治疗哺乳动物(优选人)的增殖性疾病的根据本发明的细胞(例如t细胞)。
在一些实施方式中,增殖性疾病为与il-1rap表达有关的疾病。
与il-1rap表达有关的疾病优选选自癌症或恶性肿瘤或癌前病症,例如骨髓增生异常(myelodysplasia)、骨髓增生异常综合征或白血病前期。
成人肿瘤/癌症和儿童肿瘤/癌症也包括在内。
更优选地,所述疾病为血液癌症,所述血液癌症选自于由以下疾病所组成的组中的:一种或多种急性白血病,包括b细胞急性淋巴性白血病(“ball”)、t细胞急性淋巴性白血病(“tall”)、急性淋巴性白血病(all);一种或多种慢性白血病,包括慢性粒细胞白血病(cml)和慢性淋巴细胞白血病(cll)。
在更优选的实施方式中,所述疾病为慢性粒细胞白血病。
在第一线中,cml的治疗包括使用tki。然而,一旦治疗停止,超过一半的患者复发,表明使用tki不能治愈该病。
因此,表达il-1rap特异性car分子的t细胞在治疗人cml的方法中有用,其中,所述人已经过至少一种酪氨酸激酶抑制剂(tki)治疗。
优选地,表达il-1rap特异性car分子的t细胞因此在与至少一种酪氨酸激酶抑制剂(tki)联合治疗哺乳动物的增殖性疾病的方法中有用。
所使用的tki可为伊马替尼、达沙替尼、尼洛替尼、博舒替尼和普纳替尼。
因此,表达il-1rap特异性car分子的t细胞在治疗人cml的方法中有用,其中,所述人已接受了移植物抗白血病、同种异体干细胞移植或供体淋巴细胞输注(dli)。
本文使用的“治疗(treatment/treating)”包括对疾病或病理病症的症状或病理的任何有益或期望的效果,并且甚至可以包括所治疗的疾病或病症(例如癌症)的一种或多种可测量的标志物的最低降低。治疗可任选地包括疾病或病症的症状的减轻或缓解,或者疾病或病症的进展的延迟。“治疗”不一定指疾病或病症或者其相关症状的完全根除或治愈。
因此,本公开提供了cml的治疗或预防,包括向有需要的受试者给予治疗有效量的本发明的t细胞。
本文所述的t细胞可单独给予,或作为药物组合物与稀释剂和/或与与其它成分(如il-2或其它细胞因子或细胞群体)组合给予。简而言之,药物组合物可包含如本文所述的靶细胞群与一种或多种药学上或生理学上可接受的载体、稀释剂或赋形剂组合。此类组合物可包含缓冲剂,如中性缓冲盐、磷酸盐缓冲盐等;碳水化合物,如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白;多肽或氨基酸,如甘氨酸;抗氧化剂;螯合剂,如edta或谷胱甘肽;助剂(例如氢氧化铝);以及防腐剂。短语“药学上可接受的”在本文中用于指这样的化合物、材料、组合物和/或剂型:在合理的医学判断的范围内,其适于与人和动物的组织接触使用而无过度的毒性、刺激性、过敏反应或其它问题或并发症,具有合理的效益/风险比。
本发明还提供了包含根据本发明的细胞(例如t细胞)的组合物(例如药物组合物)。
优选将本发明的组合物配制用于肠胃外给药,例如血管内(静脉内或动脉内)给药、腹膜内给药或肌内给药。
本文使用的“肠胃外给药”是指不同于肠内和局部给药的给药方式,通常通过注射进行,并且包括但不限于血管内注射、静脉内注射、肌内注射、动脉内注射、鞘内注射、囊内注射、眶内注射、瘤内注射、心内注射、皮内注射、腹膜内注射、经气管注射、皮下注射、表皮下注射、关节内注射、囊下注射、蛛网膜下注射、脊柱内注射和胸骨内注射以及输注。
在一个实施方式中,通过直接注射入肿瘤、淋巴结、全身循环或感染部位,将本文考虑的car修饰的t细胞或组合物给予受试者。
在一个实施方式中,可通过以下方式将本发明用于对诊断为癌症的受试者进行治疗:从所述受试者中移出免疫效应细胞,用包含编码本文考虑的car的核酸的载体对所述免疫效应细胞进行遗传修饰,从而产生修饰的免疫效应细胞的群,以及将所述修饰的免疫效应细胞的群给予同一受试者。在优选的实施方式中,免疫效应细胞包括t细胞。
尽管通过动物模型以及最终通过临床试验可确定适当的剂量,但给药的量、频率以及与常规cml治疗(包括tki)的可能的联用顺序将取决于患者的状况以及患者的疾病类型和严重程度等因素。
遗传修饰的治疗性细胞的“治疗有效量”可根据诸如个体的疾病状态、年龄、性别和体重以及干细胞和祖细胞在个体中引发期望的应答的能力等因素而变化。治疗有效量也是其中治疗有益效果超过病毒或转导的治疗性细胞的任何毒性或有害效果的量。通常可指出,包含本文所述的t细胞的药物组合物可以以104-109个细胞/kg体重、优选105-106个细胞/kg体重(包括这些范围内的所有整数值)的剂量给予。
实施例
参考以下实验实施例进一步对本发明进行详细描述。仅出于说明目的提供这些实施例,并且除非另有指明,它们不旨在限制。
实施例1:患者的样本、健康供体的血液样本、细胞系
在tki治疗后的诊断和随访期间,从患者建立cml样本集。使用ficoll-paque(velizy-villacoublay,法国)通过ficoll梯度密度离心从法国血液中心(
实施例2:单克隆抗体生产
通过标准杂交瘤技术生成了小鼠抗hil-1rap单克隆抗体。
简而言之,将balb/c小鼠(5周,charlesriver)用由il-1rap的细胞外部分(nm_002182.2,ncbi)和人igg1的fc部分(r&dsystems,lille,法国)组成的重组融合蛋白通过足垫(n=3)免疫或腹膜内(n=5)免疫。收获淋巴结或脾细胞以及血液样本,并将细胞与小鼠骨髓瘤细胞系融合,然后通过facs分析(bectondickinson)针对il-1rap阳性细胞系(ku812)和il-1rap阴性细胞系(raji,kg1)进行筛选。
杂交瘤的筛选允许选择5种区分il-1rap阳性细胞系(ku812或kg-1,分别为aml或phi+p210cml)与阴性细胞系(tom-1、nalm-20、jurkat或raji,分别为phi+p190b-all、phi-b-all、t-all或burkitt淋巴瘤)的单克隆抗体亚克隆。
-抗体的分子表征
根据wang.z.等的方案(j.immunol.methods,2000;233,pp167-77),通过用对fr1以及重链和轻链的恒定区特异的简并引物获得的pcr克隆产物扩增的sanger测序,来进行分子表征。根据brochetx.等(nucleicacidsres.,2008,36,pp503-8),使用v-quest在线工具针对
通过针对重组il-1rap蛋白的elisa、蛋白质印迹、免疫组织化学、共聚焦显微术、正常组织(fda正常人器官组织阵列,99个核心/33个部位/75例)和cml患者的主要样本的组织微阵列(tma),对所选定的抗体(克隆#e3c3)进行表征。
-亚细胞级分的蛋白质印迹
超声处理后获得实施例1中列出的细胞的全细胞、亚细胞或分泌蛋白级分,并悬浮在补充有蛋白酶抑制剂混合物(完全不含miniedta;roche,瑞士)的ripa裂解液和提取缓冲液(thermofisherscientific)中。将il-1rapcdna变体1(nm_002182.2,ncbi)转染的ht1080细胞系用作对照。肌动蛋白显示为蛋白上样对照。关于il-1rap、car或β-肌动蛋白的表达,分别用il-1rap#e3c3(以1:103稀释)、cd3ζ(bdpharmigen,克隆#8d3)或β-肌动蛋白(1:103,克隆ac15,#a5441,sigma-aldrich)一抗过夜探测pdvf膜上转移的蛋白。用绵羊抗小鼠igg多克隆二抗(#515-035-062,jackson,usa)进行免疫检测染色。用照相机和bio-1d软件(vilber-lourmat,collegien,法国)进行检测。在蛋白质印迹中使用#e3c3单克隆抗体揭示ku812(图1)。
-通过elisa的重组il-1rap蛋白体外检测。
将抗人fc抗体包被在塑料elisa板的底部。用鼠和人il-1rap(#e3c3)抗体探测人抗体上加载的il-1rap蛋白,然后通过涂有辣根过氧化物酶(hrp)的抗小鼠fc抗体进行揭示。
elisa确认了#e3c3单克隆抗体识别il-1rap重组蛋白(图2)。
-来自cml患者的原代细胞的流式细胞术分析。
使用包括鼠alexafluor488标记的il-1rap抗体克隆#e3c3的一组cd45、cd34、cd38、cd33、cd133、cd117跟踪来自cml患者的造血干细胞。使用包括cd3、cd4、cd8和cd19的一组抗体对转导的细胞进行染色,以区分辅助gmtc或细胞毒性gmtc。使用一组cd45ra、cd62l、cd95、ccr7单克隆抗体分析初始t细胞、中央t细胞或记忆t细胞亚集。使用cantoii细胞计数仪(bdbiosciences,lepontdeclaix,法国)收集细胞,并使用diva6.1软件(bdbiosciences,lepontdeclaix,法国)进行分析。
进行了伊马替尼(tki)治疗后或未治疗的2例cml阳性患者的外周血或骨髓的免疫分型。将il-1rap(#e3c3)与cd34+和cd38-荧光染色结合使用。系统地使用了来自不同单克隆抗体的荧光染料缀合的同种型对照单克隆抗体。
#e3c3单克隆抗体与一组抗体整合允许区分诊断时或12个月伊马替尼后患者的骨髓或外周血中il-1rap+白血病表达干细胞cd34+cd38+或cd34+cd38-亚群(图3)。
-共聚焦显微术
通过cytospin对载玻片(superfrosttmplus,4951plus4,thermofisherscientific)上集中的ku812和raji细胞系进行共聚焦显微术评估。简而言之,将细胞用荧光单克隆抗体抗鼠fc-igg、il-1rap(#e3c3)染色,并用配备有qimagingretiga2000r照相机的olympusbх51显微镜进行分析。使用40×物镜获取数字图像,并用image-proplus(6.0版,mediacybernetics)进行数字化。通过核染色剂dapi(2-(4-脒基苯基)-6-吲哚甲脒二盐酸盐,sigma-aldrich-france)进行复染,并叠加至荧光染色。
共聚焦显微术清楚地示出了对应于il-1rap表达的细胞膜染色(图4)。
-原位检测
为了研究特异性或非靶组织结合,如前所述,对fda标准冷冻组织阵列(包括每种器官3个不同供体的90个组织核心(30种器官),usbiomax,rockville,美国)进行孵育。使用ultraviewuniversaldab检测试剂盒(ventana,usa)检测免疫染色。获取图像并用ndp.view2软件进行分析。高il-1rap表达细胞系(ku812)或il-1rap阴性表达细胞系(raji)分别用作阳性或阴性对照。染色强度分级如下:阴性(0)、弱染色(1+)、中度染色(2+)或强染色(3+)。高il-1rap表达细胞系(ku812)或il-1rap阴性表达细胞系(raji)分别用作阳性或阴性对照。
使用#e3c3单克隆抗体研究了il-1rap表达。在仅6种组织(淋巴结、结肠、小肠、胎盘、胃和前列腺,主要是上皮细胞或内皮细胞)中检测到不同强度的染色(图5)。
实施例3:慢病毒构建体
基于vdj或vj重排的分子测序和cdr3核苷酸序列确定,通过将来源于实施例1的#e3c3il-1rap杂交瘤的合成产生的单链可变片段(scfv)克隆至sin-psdy骨架中来制备car慢病毒构建体(psdy-ic9-il-1rapcar-dcd19)(rossolillop,winterf,simon-lorieree,gallois-montbruns,negronim.retrovolution:hiv-drivenevolutionofcellulargenesandimprovementofanticancerdrugactivation.plosgenet.2012;8(8):e1002904)。
简而言之,构建了携带icasp9安全盒、#e3c3单克隆抗体的单链可变片段以及细胞表面表达的标志物dcd19(用于监测和潜在细胞选择)的sin慢病毒构建体。所有这3个转基因被2a肽剪切序列分隔开,并处于ef1启动子和sp163增强子序列(小鼠vegf基因5'utr的部分,genbank登录号#u41383)的控制下。
如图6所示,构建体携带如下3个不同部分:icasp9(化学诱导型半胱天冬酶9)自杀安全盒、il-1rapcar以及细胞表面选择标志物δcd19(截短了细胞内部分的cd19,以避免信号转导),其被2个不同的2a核糖体跳跃序列(p2a和t2a)分开,并处于ef1α(延伸因子1启动子α)启动子和sp163增强子的控制下。将scfv与cd28-4.1bb-cd3z信号链读码框内克隆在一起,并处于ef1α启动子和sp163增强子的控制下,所述scfv由#e3c3免疫球蛋白的重链(vh)和轻链(vl)序列的可变区组成。il-1rapcar含有单链可变片段(scfv),其与前导序列(l)结合,标记有人流感血细胞凝集素(ha),并通过铰链区连接至由2个共同刺激结构域(修饰的跨膜和细胞内信号转导cd28和4-1bb)和cd3z细胞内信号转导结构域组成的t细胞激活结构域。mockt细胞由不具有il-1rapscfv的相同构建体构成。
实施例4:il-1rapcart细胞的生成
根据制造商的说明,将从健康供体外周血单核细胞中获得的cd3+t淋巴细胞用抗cd3/cd28珠(lifetechnologies,法国)活化,然后在磁柱(macs,miltenyibiotec,巴黎,法国)上分离。在第2天,在与上清液(sn)接触的情况下,通过在10℃下以2000g离心接种(spinoculation)90min,来对活化的t细胞进行转导。通过进行流式细胞术分析以鉴别δcd19细胞表面标志物表达,来确定转导效率。转导后4天,使用macs柱对标记有cd19微珠(miltenyibiotec,巴黎,法国)的cd19阳性细胞进行磁分离。在补充有8%人血清的含500ui/mlrhil-2(proleukin;novartis)的完全x-vivo培养基(lonza,bale,瑞士)中使分离的cd19表达细胞扩增,并冷冻保存。在实验上,我们使用了transactt细胞试剂和补充有人il-2、il-7、il-15或il-7+il-15的texmacs培养基(miltenyibiotec,巴黎,法国)。
实施例5:供体t细胞的慢病毒转导
慢病毒载体上清液原液通过以下方式产生:使用cacl2方法,用编码水疱性口炎病毒(vsv)包膜(pmdg)的辅助质粒以及gag/pol(pspax2)包装质粒(addgene,分别为#12259和#12260,trono等,lausanne,瑞士)对近汇合(subconfluent)的293t细胞进行瞬时共转染。48小时和72小时后收获病毒上清液,使用peg和低速离心(3000g,过夜)浓缩,然后在-80℃下保存直至使用。将不具有il-1rapscfv的相同慢病毒构建体(mock)用作对照。使用sn的连续稀释液通过293t容许性细胞转导来确定慢病毒上清液的滴度。
通过流式细胞术测量转导效率。根据起始细胞的数目从上清液滴度中扣除感染复数(moi)。
对于mock或caril-1rap上清液,使用慢病毒上清液的体外生产过程允许分别以2的moi转导原代t细胞。
-il-1rapcar表达的蛋白质印迹分析。
用小鼠抗人cd3z抗体探测从il-1rap转导的t细胞的膜或胞浆细胞亚级分(超速离心后获得)提取的全蛋白裂解物或蛋白。亚细胞级分的蛋白质印迹显示,il-1rapcar与cd3z信号转导相关(55kda处的信号,与预期的16kda处的内源性cd3z信号相比)(图7)。
-流式细胞术分析
使用重组il-1rap生物素化蛋白分析t细胞表面的car表达,并使用抗生物素二抗(miltenyibiotecclone#bio3-18e7)通过流式细胞术进行揭示。用mock或caril-1rap转导cem细胞系或原代t细胞。然后,在量逐渐增加的生物素标记的重组il-1rap存在的情况下对细胞进行孵育。用抗生物素荧光抗体进行染色,并通过流式细胞术进行分析。将生物素+/cd19+cem或t细胞的百分比相对于生物素标记重组蛋白的量进行作图。提供了代表性染色(包括最大染色)的细胞计数分析的点图。使用未转导的细胞(c0)或mockt细胞作为对照。
使用生物素化的il-1rap蛋白的系列稀释液(20ng-2.4pg/ml)进行的额外分析以及facs分析允许检测il-1rapcar转导的cemt细胞系或原代t细胞。单个实验允许展示,募集最多的cem(85.8%)或原代(68.5%)gmtc分别需要不同量的重组蛋白(如1.25ng和0.15ng)(图8)。
相比原代t细胞,在cem的细胞表面表达更多的car。此外,在e:t共培养中添加大量(1000倍>血浆浓度)的冷重组il-1rap蛋白导致效应细胞毒性的显著抑制。
这些实验证实了car被定位于细胞表面上,并且存在car特异性识别和结合il-1rap蛋白。
实施例6:安全自杀基因icasp9盒的效率
将转导的(il-1rapcar293t)或未转导的(293t)细胞在仅培养基(-二聚体化学诱导剂(cid))或含有20nmcidap1903的培养基中培养24h。光学显微术允许对培养物中活细胞或死细胞的存在和结构进行成像(×40)。
通过光学显微术,可显示由il-1rapcar转导的293t细胞培养物对cid敏感(图9)。
对未转导的t细胞(c0)以及表达或不表达il-1rapcar的gmtc细胞混合物进行cid暴露(20nm,24h)或不暴露(浅灰色)后的流式细胞术分析。cd3+/cd19+染色允许将表达car的gmtc与其它相区分。
使未转导的细胞(c0)或il-1rapcart细胞均暴露于仅培养基或培养基+cid(20nm,24h)。
根据制造商的说明(beckmancoulter,im3614),在膜联蛋白-v/7-aad门控后,通过流式细胞术首先评估精确的细胞死亡。荧光分析门控在cd3+/cd19+阳性细胞上。在获取5000个荧光珠后确定定量。针对对照细胞(未处理的细胞)对杀伤效率进行归一化。细胞杀伤如下进行计算:%死细胞=[1-(ap1903处理的细胞中活细胞的绝对数目/未经处理的细胞中活细胞的绝对数目)]×100。对c0或il-1rapcart(在cd3+/cd19+上进行门控)细胞进行cid暴露24h或48h。结果显示为3个独立实验的平均值±sd。***:p<0.001(图10)。
细胞计数分析显示,表达(cd19+)或不表达(cd19-)il-1rapcar的t细胞的混合群cid暴露24小时后,仅cd19-cd3+细胞持续存在。更具体而言,使用凋亡定量annv/7aad测定,我们发现与未转导的t细胞(c0,在24h或48h时分别为1.28%和6.13%)相比,在24h或48hcid暴露后分别消除了84.11%和88.93%的il-1rapcart细胞(p<0.001,n=3)。
实施例7:表达il-1rapcar的t细胞的il-1rap依赖性增殖和细胞因子分泌
为了分析il-1rapcart细胞的增殖特性和更广泛的功能特性,除天然表达il-1rap的细胞系ku812外,生成了表达膜il-1rap(亚型1)或可溶性il-1rap(亚型3)的mhci类缺陷细胞系k562(分别由变体1(v1)或变体5(v5)转录本翻译)。为了生产表达膜(mb)il-1rap或可溶性(s)il-1rap的细胞系,分别用变体1(亚型1,nm_002182.2)或变体5(亚型2,nm_001167930)orf克隆(pcmv6-ac-gfp载体,origen或pez-m61,genecopoeia)转染k562细胞。然后用plenticmvv5-lucblast(addgene,质粒#21474)转导稳定表达mb-il-1rap或s-il-1rap的k562细胞。
对这些细胞进行了蛋白质印迹分析。简而言之,在补充有蛋白酶抑制剂混合物(完全不含miniedta;roche,
通过流式细胞术和蛋白质印迹,这些实验确认了亚型1(v1)在细胞表面良好表达,并在k562-v5的培养物上清液中检测到亚型3(v5),而在k562-v1中未检测到(图11a和图11b)。
将k562-v1(深色)和ku812(浅色)用il-1rap抗体染色(红色柱状图),并与未标记的细胞(蓝色柱状图)进行比较。报告了软件提供的相对荧光强度。
有趣的是,转染的k562-v1的il-1rap表达高于天然表达il-1rap的ku812细胞系[荧光强度比(rfi)=10.57以及33.46](图11a和图11b)。
实施例8:il-1rapcart细胞的增殖能力
为了确定由表达il-1rap靶标的细胞触发的il-1rapcart细胞的增殖能力,我们在k562、k562-v1、k562-v5或ku812细胞系存在的情况下进行了经cfse染色的c0、mock细胞或il-1rapcart细胞的共培养(效应物-靶比,e:t=1:1)。
与c0或mock细胞相比,效应il-1rapcart细胞仅响应于细胞表面表达il-1rap的k562-v1(76.1%±10.9)和ku812细胞(81.6%±6.16)的存在而显著分裂,但对于k562-v5(27.3%±9.03)或仅培养基(18.8%±7.02)水平最低(p<0.001,n=4)。
以相同方式但e:t比为1:5,我们通过细胞内ifn·产生的染色评估了在il-1rap+靶细胞存在的情况下cart细胞如何能够产生ifn·。
il-1rapcartcd8+或cd8-细胞产生ifn·,并且仅针对表达il-1rap的靶细胞k562-v1(cd8+:23.7±0.71%,cd8-:14.8±3.58%)和ku812(cd8+:22.3±2.39%,cd8-:13.1±2.79%),而c0或mock细胞不生产ifn·(p<0.001,n=4)(图12)。
实施例9:细胞因子谱
为了确定cart细胞所产生的细胞因子谱,按照制造商的说明使用了允许定量人il-2、il-4、il-6、il-10、tnf-α、ifn-γ和il-17a分泌的人th1/th2/th17细胞因子珠阵列(cytokinesbeadarray,cba)试剂盒(bdbiosciences)。简而言之,将1×105个cart细胞过夜培养物的上清液(有靶细胞存在(比例为1:1)或无靶细胞(对照)存在)与珠和pe缀合的抗细胞因子抗体孵育3h。对珠进行洗涤并通过标准化的流式细胞术测定进行获取。使用fcap
最后,除了确认il-1rapcart细胞的刺激展现出th1样细胞因子谱分泌外,在与c0、mock细胞或cart细胞共培养(e:t=1:1)后,测量了上清液中的th1/th2/th17细胞因子。
仅细胞表面表达il-1rap的k562-v1和ku812细胞能够触发细胞因子分泌,其中具有稳健的ifng和il-2分泌、中度的tnfα分泌以及低il-4、il-6和il-10分泌但无il-17分泌,相当程度地指向特异性th1谱(图13)。
实施例10:il-1rap依赖的car细胞毒性和表达il-1rap的肿瘤靶细胞系的裂解
用cd107脱粒测定对t细胞介导的细胞毒性活性进行分析。通过在不同的e:t细胞比下孵育20-24h,评估car-t细胞针对活肿瘤细胞的细胞毒性。关于il-1rapcart细胞(以e:t比=1:5共培养)针对il-1rap+表达靶细胞(k532-v1、ku812)进行的cd107a&b脱粒测定显示cd107a&b在il-1rap特异性t细胞的cd8-(主要为cd4+)和cd8+隔室中均有显著的细胞表面动员,但对于细胞表面il-1rap-表达细胞(k562、k562-v5)未有细胞表面动员,而来自细胞供体的未转导细胞(c0)或mock细胞未显示可评估的脱粒(p<0.001,n=4)(图14)。
为了确定表达il-1rapcar的t细胞的体外il-1rap依赖性细胞溶解能力,我们使用了荧光(efluor)和7-aad染色,以分别区分cart细胞和活细胞。
il-1rap+靶细胞(k562-v1和ku812)与il-1rap-靶细胞(k562、k562-v5)之间可显示统计学上显著的裂解活性,其由7-aad-/efluor-门中细胞的消失进行表征(p<0.001,n=4)。使用未转导的t细胞或mock转导的t细胞作为对照(图15)。
实施例11:异种移植鼠模型-体内研究(图16)
向nsg(nod.cg-prkdcscidil2rgtm1wji/szj)小鼠(charlesriver,法国)移植luc+、il-1rap+肿瘤细胞系,并注射或不注射效应cart细胞。除了小鼠存活外,通过细胞计数术或生物发光分析每周分析循环的cart细胞和肿瘤负荷。
简而言之,在移植前24小时以3.5gy的剂量(n=5/组)对小鼠进行亚致死性辐射。然后使用尾静脉内(i.v)注射将2×106个k562-v1、il-1rap+、荧光素酶+、gfp+表达细胞系(k562-v1il-1rap+/gfp+/luc+)移植进6-8周龄的nod.cg-prkdcscidil2rgtm1wjl/szj(nsg)小鼠中(thejacksonlaboratory,barharbor,me)。肿瘤注射后4天,i.v一次注射1×10e6至5×10e6个mockt细胞或il-1rapcart细胞。还将一组注射k562-v1il-1rap+/gfp+/luc+但未经t细胞处理的小鼠用作对照。为了追踪k562-v1il-1rap+/gfp+/luc+肿瘤负荷,在异氟烷麻醉下,每周在nightowl(bertholdtechnologies,thoiry,法国)上成像前10min,向小鼠腹膜内注射50mg/gd-荧光素(promega,lyon,法国)。评价了il-1rapcart细胞体内消除表达il-1rap的细胞的能力。
结果显示,在肿瘤植入后(d4),允许il-1rapcart细胞(e:t=1:1)靶向k562-v1il-1rap+/luc+肿瘤,直到注意到大小减小(d4至d9)至完全消除(在>d9时)。
相反,在未处理的小鼠和mockt细胞处理的小鼠中注意到肿瘤进展,导致小鼠死亡(d28时两组分别为2/3),而在cart细胞处理组中无小鼠死亡。有趣的是,在未处理的组或mockt细胞处理的组的存活小鼠中,在cart细胞不存在的情况下,肿瘤继续生长。
实施例12:针对来自cml患者的表达il-1rap的原代细胞的体外细胞毒性
从tki原发性耐药cml患者(bcr-abl(is)比始终>10%)到历时4年用4种tki进行的5线治疗(图17上部),我们能够生产具有95.5%的转导效率的cart细胞(图17底部)。il-1rapcart细胞针对il-1rap+ku812细胞表现出剂量依赖性的细胞毒性活性,在e:t比为3:1时效率为95%,与从健康供体产生的il-1rapcart细胞相当;相比之下c0或mockt细胞的同种异体反应性(alloreactive)细胞毒性分别为18%和21%(图18)。此外,自体il-1rapcart细胞针对cml患者pbmc的共培养在24小时后表现出il-1rap+/cd34+细胞的特异性裂解(il-1rapcart细胞为76.65±9.2%,相比之下c0或mockt细胞分别为4.16±4.3%和2.78±1.72%)(图19)。
此外,自体il-1rapcart细胞由在长期治疗(包括tki)或无治疗情况下的cml患者(n=3)产生(转导效率:85.33±8.8%)的(图21),并针对他们各自的长期冷冻保存(>20年)的初始外周血干细胞自体移植物,以79.78±10.7%的效率杀伤cd34+/il-1rap+细胞(图20)。
实施例13:由icasp9安全开关保障的il-1rap-cart细胞对健康造血细胞无重大的有害作用
为了预测脱靶毒性,我们使用了#a3c3mab,并使用30种正常人组织的组织宏阵列(tma)研究il-1rap表达。在仅6种组织(淋巴结、前列腺、骨骼肌、胃、结肠和小肠以及胰腺)中检测到不同强度水平的染色(排除炎性因子或坏死因子,图22a和表2)。有趣的是,微脉管hmec-1内皮细胞系未被我们的#a3c3il-1rapmab识别出(图22b),而r&dil-1rapmab(r&dsystems-ref#89412)清楚地检测到细胞表面表达,表明识别不同表位。
关于健康造血系统的靶向,即使mab#a3c3未检测到来自健康供体(图23a、图23c)的骨髓(rfi<1.2,n=5)或正常脐带血(图23b、图23c)中的hsc,我们注意到2/5的健康供体外周血和3/5的健康供体骨髓中单核细胞亚群的弱染色(rfi<2)(图23a)。接下来,我们通过以不同e:t比共同培养pbmc和自体cart细胞研究了单核细胞的体外敏感性。在e:t比为1:1时,仅一些单核细胞被靶向,使41.45%的单核细胞存活(图23d,右,表3),而淋巴细胞、粒细胞和k562il-1rap阴性细胞系即使在较高的e:t比下也不受影响(图22d)。有趣的是,在该e:t比下杀伤了94.77%的白血病细胞(图23e)。
表2:正常组织的il-1rap(mab#a3c3)免疫染色
表3:根据不同e(mockt细胞或il-1rapcart细胞):t比的共培养的不同亚群中活细胞的百分比。
在hcd34移植鼠模型(hu-nog)中体内证实了这些结果,其中我们证明了,尽管单核细胞在第15天下降(41±25%,n=3,p=n.s),来源于hcd34+细胞的其它人免疫活性细胞未受到cart细胞影响(图24)。健康cd34+脐带血hsc与自体cart细胞(n=3)体外共培养后的造血干细胞培养测定证实,hsc不受影响(图25)。这些结果与il-1rapcart细胞免疫疗法对造血系统几乎无不良影响一致。
为限制潜在的毒性,我们评价了暴露于二聚体化学诱导剂(cid;10nm)后icasp9/ap1903自杀系统盒的安全开关的功能性。首先,我们使用光学显微术注意到il-1rapcar转导的293t细胞培养物对cid敏感(图26,上部)。细胞计数分析显示24小时cid暴露后,在cd19+和cd19-il-1rapcart细胞的混合群中仅cd19-cd3+细胞持续存在(图26,底部)。更具体而言,在凋亡的定量测定中,与非转导的t细胞(c0)相比(在24或48小时时分别为1.28%和6.13%),在24小时或48小时cid暴露后分别消除了84.11%和88.93%的il-1rapcart细胞(p<0.001,n=3;图23f)。最后,nsg鼠模型中的安全开关体内评价显示,ap1903i.p.给药后可消除87±7.32%(p<0.01,n=3)的il-1rapcart细胞,但在pbs给药后未受影响,而对照t细胞(c0)不受任何处理的影响(图23g)。
序列表
<110>etablissementfrancisdusang
institutnationaldelasanteetdelarecherchemedicale
(inserm)
centrehospitalieruniversitairedebesancon
universitedefranchecomte
<120>靶向il-1rap的car-t细胞及它们的用途
<130>1h318460-0004
<160>18
<170>patentinversion3.5
<210>1
<211>423
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>编码鼠抗il-1rapscfv的h链(vh)的核苷酸序列
<400>1
atgggatggagctgtatcatcctcttcttggtagcaacagctacaggtgtcaactcccag60
gtccaactgcagcagcctggggctgagcttatgatgcctggggcttcagtgaaagtgtcc120
tgcgaggcttctggctacacattcactgactcctggatgcactgggtgaagcagaggcct180
ggacaaggccttgagtggatcggagcgattgatccttctgatagttatactacctataat240
caaaaattcacgggcaaggccacattgagtgtagacgaatcctccaacacagcctacatg300
cagctcagcagcctgacatctgaggactctgcggtctattactgtgcaaggtattactcc360
ggtagtaactacatatcgccctttccttactggggccaagggactctggtcactgtctct420
gca423
<210>2
<211>141
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>鼠抗il-1rapscfv的h链(vh)的氨基酸序列
<400>2
metglytrpsercysileileleupheleuvalalathralathrgly
151015
valasnserglnvalglnleuglnglnproglyalagluleumetmet
202530
proglyalaservallysvalsercysglualaserglytyrthrphe
354045
thraspsertrpmethistrpvallysglnargproglyglnglyleu
505560
glutrpileglyalaileaspproseraspsertyrthrthrtyrasn
65707580
glnlysphethrglylysalathrleuservalaspgluserserasn
859095
thralatyrmetglnleuserserleuthrsergluaspseralaval
100105110
tyrtyrcysalaargtyrtyrserglyserasntyrileserprophe
115120125
protyrtrpglyglnglythrleuvalthrvalserala
130135140
<210>3
<211>382
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>编码鼠抗il-1rapscfv的k链(vl)的核苷酸序列
<400>3
atggagtcacagattcaggtctttgtattcgtgtttctctggttgtctggtgttgacgga60
gacattgtgatgacccagtctcacaaattcatgtccacatcagtaggagacagggtcacc120
atcacctgcaaggccagtctggatgtgagtactgctgtggcctggtatcaacagaaacca180
ggacaatctcctaaactactgatttactcggcatcctaccggtacactggagtccctgat240
cgcttcactggcagtggatctgggacggatttcactttcaccatcagcagtgtgcaggct300
gaagacctggcagtttattactgtcagcaacattatagtcctccattcacgttcggctcg360
gggacaaacttggagataaaac382
<210>4
<211>127
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>鼠抗il-1rapscfv的k链(vl)的氨基酸序列
<400>4
metgluserglnileglnvalphevalphevalpheleutrpleuser
151015
glyvalaspglyaspilevalmetthrglnserhislysphemetser
202530
thrservalglyaspargvalthrilethrcyslysalaserleuasp
354045
valserthralavalalatrptyrglnglnlysproglyglnserpro
505560
lysleuleuiletyrseralasertyrargtyrthrglyvalproasp
65707580
argphethrglyserglyserglythraspphethrphethrileser
859095
servalglnalagluaspleualavaltyrtyrcysglnglnhistyr
100105110
serproprophethrpheglyserglythrasnleugluilelys
115120125
<210>5
<211>15
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>vh和vl结构域之间的接头
<400>5
glyglyserglyglyglyglyserglyglyglyglyservalasp
151015
<210>6
<211>6
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>轻链的cdr1
<400>6
leuaspvalserthrala
15
<210>7
<211>3
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>轻链的cdr2
<400>7
seralaser
1
<210>8
<211>9
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>轻链的cdr3
<400>8
glnglnhistyrserproprophethr
15
<210>9
<211>18
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>轻链的cdr1(nt)
<400>9
ctggatgtgagtactgct18
<210>10
<211>9
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>轻链的cdr2(nt)
<400>10
tcggcatcc9
<210>11
<211>27
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>轻链的cdr3(nt)
<400>11
cagcaacattatagtcctccattcacg27
<210>12
<211>8
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>重链的cdr1
<400>12
glytyrthrphethraspsertrp
15
<210>13
<211>8
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>重链的cdr2
<400>13
ileaspproseraspsertyrthr
15
<210>14
<211>15
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>cdr3oftheheavychain
<400>14
alaargtyrtyrserglyserasntyrileserpropheprotyr
151015
<210>15
<211>24
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>重链的cdr1(nt)
<400>15
ggctacacattcactgactcctgg24
<210>16
<211>24
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>重链的cdr2(nt)
<400>16
attgatccttctgatagttatact24
<210>17
<211>45
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>重链的cdr3(nt)
<400>17
gcaaggtattactccggtagtaactacatatcgccctttccttac45
<210>18
<211>283
<212>prt
<213>人工序列(artificialsequence)
<220>
<223>鼠抗il-1rapscfv的氨基酸序列(即#a3c3car)
<400>18
metglytrpsercysileileleupheleuvalalathralathrgly
151015
valasnserglnvalglnleuglnglnproglyalagluleumetmet
202530
proglyalaservallysvalsercysglualaserglytyrthrphe
354045
thraspsertrpmethistrpvallysglnargproglyglnglyleu
505560
glutrpileglyalaileaspproseraspsertyrthrthrtyrasn
65707580
glnlysphethrglylysalathrleuservalaspgluserserasn
859095
thralatyrmetglnleuserserleuthrsergluaspseralaval
100105110
tyrtyrcysalaargtyrtyrserglyserasntyrileserprophe
115120125
protyrtrpglyglnglythrleuvalthrvalseralaglyglyser
130135140
glyglyglyglyserglyglyglyglyservalaspmetglusergln
145150155160
ileglnvalphevalphevalpheleutrpleuserglyvalaspgly
165170175
aspilevalmetthrglnserhislysphemetserthrservalgly
180185190
aspargvalthrilethrcyslysalaserleuaspvalserthrala
195200205
valalatrptyrglnglnlysproglyglnserprolysleuleuile
210215220
tyrseralasertyrargtyrthrglyvalproaspargphethrgly
225230235240
serglyserglythraspphethrphethrileserservalglnala
245250255
gluaspleualavaltyrtyrcysglnglnhistyrserproprophe
260265270
thrpheglyserglythrasnleugluilelys
275280
- 还没有人留言评论。精彩留言会获得点赞!
- 基于lmp-1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于bcg1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于pap抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hm1.24抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hcv1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于afp抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hpve6抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hbv2抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于hbv1抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图
- 基于ck19抗原的dc细胞、靶向性免疫细胞群及其制备方法和用图