氨基喹唑啉芳基哌嗪类化合物及其药物组合物和应用的制作方法
本发明属于抗肿瘤药物技术领域,具体涉及氨基喹唑啉芳基哌嗪类化合物及其药物组合物和应用。
背景技术:
恶性肿瘤是发病率、死亡率最高的疾病之一,严重影响患者的生活品质。
恶性肿瘤是由于机体细胞失去正常调控,过度增殖而引起的疾病。过度增殖的细胞也称为癌细胞,癌细胞常可以侵犯周围组织,甚至可经体内循环系统和淋巴系统转移到身体其他部位。恶性肿瘤有许多类型,而病症的严重程度取决于癌细胞所在部位、恶性程度及是否发生转移。一旦确诊,常以结合手术、化疗和放疗的方式进行治疗。如果癌症未经治疗,最终结果将导致死亡。各个年龄层的人都有可能患癌症,由于去氧核糖核酸的损伤会随着年龄而累积增加,年纪越大得癌症的机会也随之增加。
传统的抗肿瘤药物非特异性地抑制细胞分裂,从而达到诱导细胞凋亡,在杀死肿瘤细胞的同时,也大量破坏人体的正常细胞。细胞毒性药物的许多不良反应限制了药物的治疗范围。
传统药物在进入人体后,仅极少一部分能够真正作用于病变部位,很大程度制约了药物的疗效,并且导致药物具有毒副作用。而被赋予了靶向能力的药物或其制剂,能瞄准特定的病变部位,并在目标部位蓄积或释放有效成分,在目标局部形成相对较高的浓度,从而在提高药效的同时抑制毒副作用,减少对正常组织细胞的伤害。
研究表明,多巴胺受体广泛的表达于多种肿瘤细胞表面,同时研究发现多巴胺受体与肿瘤干细胞有明显相关作用。
技术实现要素:
本发明旨在至少解决现有技术中存在的技术问题之一。为此,本发明提出氨基喹唑啉芳基哌嗪类化合物及其药物组合物和应用。
根据本发明第一方面实施例的氨基喹唑啉芳基哌嗪类化合物,具有如式(i)所示的化合物或其药学上可接受的盐:
其中,r1~r10各自独立表示氢、卤素、氨基、硝基、羟氨基、胍基、脲基、三氟甲基、芳磺酰基、取代芳基、c1~c10烷氧基、c1~c10氨烷基、c1~c10烷基或c1~c10酰胺基;
n为0~5的整数;
x=c、n、o或s;
y=c或n;
z=h、oh、卤素或酯基。
根据本发明的一些实施方式,所述r1~r10各自独立表示氢、卤素、c1~c10烷氧基或c1~c10烷基。
根据本发明的一些实施方式,所述卤素选自氟、氯、溴或碘。
根据本发明的一些实施方式,所述卤素优选为氟。
根据本发明的一些实施方式,所述氨基是指-nh2。
根据本发明的一些实施方式,所述c1~c10烷氧基选自取代苄氧基、吡咯烷-1-基-(c2-c4)烷氧基、吗啡啉-1-基-(c2-c4)烷氧基、哌嗪-1-基-(c2-c4)烷氧基、n-甲基哌嗪-1-基-(c2-c4)烷氧基或哌啶-1-基-(c2-c4)烷氧基。
根据本发明的一些实施方式,所述c1~c10烷基选自甲基、乙基、丙基、异丙基、丁基、异丁基、仲-丁基、叔-丁基、环丁基、环己基或环庚二烯基。
根据本发明的一些实施方式,所述c1~c10氨烷基选自氨基乙基、1-氨基丙基或2-氨基丙基。
根据本发明的一些实施方式,所述烷氨基选自n-甲氨基、n-乙基氨基、n-异丙氨基、n-吡咯烷基氨基或n-哌嗪基氨基。
根据本发明的一些实施方式,所述烷氨基优选自n-甲氨基、n-乙基氨基或n-异丙氨基。
根据本发明的一些实施方式,所述酰胺基是指-conh-。
根据本发明的一些实施方式,所述酰胺基选自乙酰胺基、丙酰胺基、丁酰胺基、苯甲酰胺基或异丁酰胺基。
根据本发明的一些实施方式,所述磺酰基是指-so2-。
根据本发明的一些实施方式,所述c1~c10磺酰胺基是指“1-10个碳原子的烷基”与“磺酰基”相连。
根据本发明的一些实施方式,所述磺酰基优选为甲磺酰基、乙磺酰基、丙磺酰基、异丙磺酰基、正丁磺酰基、异丁磺酰基或仲丁磺酰基。
根据本发明的一些实施方式,所述取代芳基在苯环或萘环上被1至4个选自由下项组成的组中的取代基取代:卤素、羟基、硝基、氰基、烷氧基、1至4个碳原子的烷基或氨基。
根据本发明的一些实施方式,所述的盐为盐酸盐、氢溴酸盐、硫酸盐、乙酸盐、乳酸盐、酒石酸盐、鞣酸盐、枸橼酸盐、三氟醋酸盐、苹果酸盐、马来酸盐、琥珀酸盐、对甲苯磺酸盐或甲磺酸盐。
为方便理解本发明,从式(i)中结构的化合物中优选了下述具体的化合物,编号分别为c-1至c-24,但本发明不限于下述化合物:
所述的式(i)结构的化合物可以与无机酸、有机酸成盐,得到式(i)结构的化合物的盐形式物质,所述的盐为盐酸盐、氢溴酸盐、硫酸盐、乙酸盐、乳酸盐、酒石酸盐、鞣酸盐、枸橼酸盐、三氟醋酸盐、苹果酸盐、马来酸盐、琥珀酸盐、对甲苯磺酸盐或甲磺酸盐。
根据本发明第二方面实施例的氨基喹唑啉芳基哌嗪类化合物的制备方法,式(i)结构的化合物的常规制备工艺流程如下:
式(i)结构的化合物通过常规合成法合成,任何本专业技术人员均可通过如下方法合成:
第一步:取代氯喹唑啉a(2.5mmol)、b(2.5mmol)、选择三乙胺或碳酸钾作碱,溶剂可以选用甲醇、乙醇、异丙醇、正丁醇、异丁醇、正戊醇等,温度控制在50~150℃之间,搅拌回流8~24小时。通过薄层层析监测反应完成。
第二步:减压蒸除溶剂,二氯甲烷/水萃取处理固体,收集有机层。分别经过2n的盐酸溶液洗涤两次,碳酸氢钠饱和溶液洗涤两次、水洗涤两次。脱去溶剂,经柱层析(乙酸乙酯/石油醚=1:1-5:1)得到淡黄色固体产物。
上述制备方法还可以进一步包括式(i)结构的化合物与无机酸(或无机碱)、有机酸(或有机碱)反应,冷却析出式(i)结构的化合物的盐。
上述制备方法中,所涉及的原料,化和物a、b等可以通过商业渠道购买。
根据本发明第三方面实施例的一种药物组合物,包括上述的化合物或其药学上可接受的盐。
上述化合物或其药学上可接受的盐或药物组合物在制备抗肿瘤药物中的应用。
上述化合物或其药学上可接受的盐或药物组合物在制备抗肿瘤药物中的应用,所述抗肿瘤药物用于治疗实体癌,优选为乳腺癌、肺癌、胰腺癌、膀胱癌、宫颈癌、结肠癌、食管癌、头颈部癌、肝癌、非鳞状非小细胞肺癌、黑素瘤、骨髓瘤、成神经细胞瘤、卵巢癌、前列腺癌、肾癌、晚期肾细胞癌、肉瘤、皮肤癌、胃癌、睾丸癌、甲状腺癌、子宫癌、间皮瘤、胆管细胞癌、平滑肌肉瘤、脂肪肉瘤、鼻咽癌、神经内分泌癌、卵巢癌、肾癌、唾液腺癌、小细胞肺癌或梭形细胞癌。
根据本发明实施例的氨基喹唑啉芳基哌嗪类化合物,至少具有如下技术效果:
本发明的化合物在体外具有一定的细胞毒作用,能明显抑制乳腺癌干细胞成球、抑制肿瘤细胞的克隆形成、抑制肿瘤细胞的迁移和侵袭;体内能显著抑制乳腺癌的肺转移、抑制乳腺肿瘤以及非小细胞肺癌肿瘤的生长,并且具有良好的安全性,没有引起动物体重、血象以及各种主要器官的异常。
此系列化合物结构具有较好抗肿瘤活性且毒性较低。
本发明实施方式中化合物的设计思路为:
靶向药物具有一定特殊性,不能因化和物中某结构的简单修饰而直接得到具有相应活性或活性更好的另一系列化和物,需要考虑化和物结构与靶点蛋白空间构象的差异及关键结合位点,设计、合成及生物筛选才能得到系列活性新衍生物。
n-苯基哌嗪类化合物具有良好的多巴胺受体亲核能力;同时,喹唑啉类结构存在于多种抗肿瘤药物结构中,如高效靶向药物,埃克替尼、盐酸厄洛替尼等。在本发明中,研发人员尝试将n-苯基哌嗪以及喹唑啉类结构引入到同一化合物当中,通过分子结构修饰,探讨化合物结构的构效关系。通过大量的化合物的合成以及生物活性测试,筛选出一批具有稳定表达抗肿瘤活性特别是抗肿瘤转移的化合物结构。
附图说明
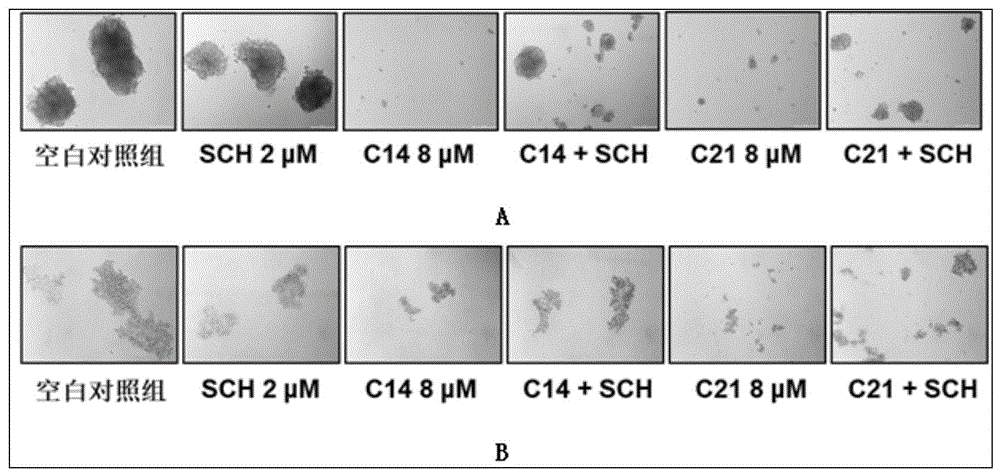
图1为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌干细胞球形成抑制作用的效果图。
图2为c-14及c-21对4t1细胞干细胞球中aldh+细胞比例抑制作用。
图3为c-14及c-21对mda-mb-231细胞干细胞球中aldh+细胞比例抑制作用。
图4为c-14及c-21对4t1细胞干细胞球中凋亡细胞比例抑制作用。
图5为c-14及c-21对mda-mb-231细胞干细胞球中凋亡细胞比例抑制作用。
图6为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞增殖抑制作用的效果图。
图7为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞集落形成能力抑制作用及sch逆转该抑制作用的效果图。
图8为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞迁移能力抑制作用及sch逆转该抑制作用的效果图。
图9为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞侵袭能力抑制作用及sch逆转该抑制作用的效果图。
图10为c-14单药对4t1乳腺癌移植瘤模型中肺转移抑制作用及sch逆转该抑制作用的效果图。
图11为c-14对4t1乳腺癌移植瘤模型中肿瘤生长抑制作用及sch逆转该抑制作用的效果图。
图12为c-14和阳性对照药物厄洛替尼(er)对体内a549非小细胞肺癌移植瘤模型中肿瘤生长的抑制作用。
具体实施方式
以下是本发明的具体实施例,并结合实施例对本发明的技术方案作进一步的描述,但本发明并不限于这些实施例。
除非有相反陈述,下列用在说明书和权利要求中的术语具有下述含义。
术语“烷基”指饱和的脂族烃基团,包括1至10个碳原子的直链或支链基团。优选含有1至5个碳原子的烷基。更优选含有1至3个碳原子的烷基,例如甲基,乙基,正丙基,异丙基。
各种含碳氢结构部分的碳原子含量由该部分的标有最小和最大碳原子数目的前缀表示,即前缀ci~j表示该部分的碳原子数为整数“i”至整数“j”(包括i和j)。因此,例如,c1~3烷基是指1至3个碳原子的烷基(包括1和3)。
术语“羟基”指-oh基团。
术语“卤素”指氟、氯、溴或碘。
除非特别说明,本发明中,所有出现的化合物均意在包括所有可能的异构体,例如互变异构体、对映异构体、非对映异构体、及其混合物形式。
术语“本发明化合物”指通式(i)所示的化合物。该术语还包括通式(i)化合物的各种晶型形式、药学上可接受的盐、水合物或溶剂合物。
术语“药学上可接受的盐”指本发明化合物与酸或碱所形成的适合用作药物的盐。药学上可接受的盐包括无机盐和有机盐。一类优选的盐是本发明化合物与酸形成的盐包括但不限于:盐酸盐、氢溴酸盐、硫酸盐、乙酸盐、乳酸盐、酒石酸盐、鞣酸盐、枸橼酸盐、三氟醋酸盐、苹果酸盐、马来酸盐、琥珀酸盐、对甲苯磺酸盐或甲磺酸盐。
术语“药学上可接受的载体”表示能用于制备药物组合物的载体,它们一般是安全的、无毒性的,不是生物上或其他方面不期待的,且包括能被动物和人类药学上接受的载体。在说明书和权利要求书中使用的“药学上可接受的载体”包括一种或一种以上的这类载体。
术语“含有”、“包含”或“包括”表示各种成分可一起应用于本发明的混合物或组合物中。因此,术语“主要由...组成”和“由...组成”包含在术语“含有”中。
术语“治疗”可指抑制疾病,例如阻止或降低疾病或其临床症状的发展,或者缓解疾病,例如使疾病或其临床症状退化。
实施例1
c-1的合成:
2-氯-6,7-二甲基喹唑啉(0.19g,1.0mmol)、3-(4-苯基-1-哌嗪)丙胺(0.22g,1.0mmol)、碳酸钾(0.691g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-1,收率68.5%。
esi-ms[m+h]+:m/z376.2453。
1hnmr(500mhz,dmso)δ8.45(s,1h),7.67(s,1h),7.38(dd,j=11.8,7.0hz,2h),7.08(d,j=3.0hz,1h),6.89(t,j=9.3hz,2h),6.75(t,j=7.0hz,1h),3.88(s,3h),3.87(s,3h),3.57(dd,j=12.7,6.5hz,2h),3.45-3.41(m,4h),3.15-3.10(m,4h),2.47–2.40(m,2h),2.35(s,3h),2.31(s,3h),1.78–1.70(m,2h)。
实施例2
c-2的合成:
2-氯-6,7-二乙基喹唑啉(0.22g,1.0mmol)、3-(4-苯基-1-哌嗪)丙胺(0.22g,1.0mmol)、碳酸钾(0.691g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-1,收率71.8%。
esi-ms[m+h]+:m/z404.2772。
1hnmr(500mhz,dmso)δ8.45(s,1h),7.67(s,1h),7.38(dd,j=11.8,7.0hz,2h),7.08(d,j=3.0hz,1h),6.89(t,j=9.3hz,2h),6.75(t,j=7.0hz,1h),3.88(s,3h),3.87(s,3h),3.57(dd,j=12.7,6.5hz,2h),3.45-3.41(m,4h),3.15-3.10(m,4h),2.47–2.40(m,2h),2.35(s,3h),2.31(s,3h),1.78–1.70(m,2h)。
实施例3
c-3的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、3-(4-苯基-1-哌嗪基)丙胺(0.22g,1mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-3,收率70.6%。
esi-ms[m+h]+:m/z408.2358。
1hnmr(500mhz,dmso)δ8.35(d,j=8.5hz,1h),7.57(s,1h),7.18(dd,j=11.8,7.0hz,2h),7.08(d,j=3.0hz,1h),6.89(t,j=9.3hz,2h),6.75(t,j=7.0hz,1h),3.88(s,3h),3.87(s,3h),3.55(dd,j=12.7,6.5hz,2h),3.43(d,j=19.5hz,4h),3.10(s,4h),2.45–2.39(m,2h),1.88–1.80(m,2h)。
实施例4
c-4的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、3-[4-(2-甲氧基苯基)-1-哌嗪基]丙胺(0.24g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-4,收率74.5%。
esi-ms[m+h]+:m/z438.2460。
1hnmr(500mhz,dmso)δ8.35(s,1h),7.58(s,1h),7.09(s,1h),6.98–6.89(m,2h),6.87(t,j=6.2hz,2h),3.88(s,6h),3.77(s,3h),3.56(dd,j=13.0,6.5hz,2h),2.96(s,4h),2.62–2.51(m,4h),2.44(t,j=7.0hz,2h),1.84(p,j=7.0hz,2h)。
实施例5
c-5的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(3-甲氧基苯基)-1-哌嗪基]丙胺(0.24g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-3,收率64.7%。
esi-ms[m+h]+:m/z438.2460。
1hnmr(500mhz,dmso)δ8.34(s,1h),7.62(s,1h),7.11(s,1h),6.98(dd,j=12.1,6.6hz,1h),6.55(d,j=6.4hz,1h),6.47(d,j=6.6hz,1h),6.40(s,1h),3.89(s,6h),3.78(s,3h),3.56(dd,j=13.0,6.5hz,2h),2.98(s,4h),2.62–2.54(m,4h),2.45(t,j=7.0hz,2h),1.85(p,j=7.0hz,2h)。
实施例6
c-6的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(4-甲氧基苯基)-1-哌嗪基]丙胺(0.24g,1.0mmol)、碳酸钾(0.691g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-6,收率84.3%。
esi-ms[m+h]+:m/z438.2460。
1hnmr(500mhz,dmso)δ8.35(s,1h),7.61(s,1h),7.11(s,1h),6.82(d,j=12.0hz,2h),6.59(d,j=12.0hz,2h),3.89(s,6h),3.79(s,3h),3.57(dd,j=13.0,6.5hz,2h),3.00(s,4h),2.62–2.54(m,4h),2.44(t,j=7.0hz,2h),1.86(p,j=7.0hz,2h)。
实施例7
c-7的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(2,3-二氯苯基)-1-哌嗪基]丙胺(0.29g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-7,收率32%。
esi-ms[m+h]+:m/z442.2000。
1hnmr(500mhz,dmso)δ8.43–8.21(m,0h),7.65–7.55(m,0h),7.34–7.21(m,1h),7.15–7.01(m,1h),3.87(d,j=13.0hz,3h),3.54(dd,j=12.9,6.8hz,1h),3.40(s,2h),2.94(s,2h),2.37(s,1h),1.72–1.63(m,1h),1.58–1.50(m,1h)。
实施例8
c-8的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(2-氟苯基)-1-哌嗪基]丙胺(0.24g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-8,收率77.5%。
esi-ms[m+h]+:m/z426.2261。
1hnmr(500mhz,dmso)δ8.37(s,1h),7.55(s,1h),7.09(s,1h),7.03-6.99(m,2h),6.81(d,j=6.2hz,1h),6.67(d,j=6.2hz,1h),3.90(s,6h),3.60(dd,j=13.0,6.5hz,2h),2.92(s,
4h),2.60–2.50(m,4h),2.46(t,j=7.0hz,2h),1.86(p,j=7.0hz,2h)。
实施例9
c-9的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(2-吡啶基)-1-哌嗪基]丙胺(0.22g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-9,收率77.5%。
esi-ms[m+h]+:m/z409.2306。
1hnmr(500mhz,dmso)δ8.37(s,1h),7.55(s,1h),7.09(s,1h),7.03-6.99(m,2h),6.81(d,j=6.2hz,1h),6.67(d,j=6.2hz,1h),3.90(s,6h),3.60(dd,j=13.0,6.5hz,2h),2.92(s,4h),2.60–2.50(m,4h),2.46(t,j=7.0hz,2h),1.86(p,j=7.0hz,2h)。
实施例10
c-10的合成:
3-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(2-嘧啶基)-1-哌嗪基]丙胺(0.33g,1.5mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-10,收率47.5%。
esi-ms[m+h]+:m/z410.2264。
1hnmr(500mhz,dmso)δ8.34(d,j=4.5hz,3h),7.58(s,1h),7.08(s,1h),6.60(t,j=4.7hz,1h),3.89(s,3h),3.88(s,3h),3.75–3.68(m,4h),3.56(dd,j=13.0,6.6hz,2h),2.46–2.41(m,4h),2.40(d,j=7.2hz,2h),1.88–1.80(m,2h)。
实施例11
c-11的合成:
2-氯-6,7-二(2-甲氧基乙氧基)喹唑啉(0.32g,1mmol)、3-(4-苯基-1-哌嗪基)丙胺(0.22g,1mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-11,收率67.8%。
esi-ms[m+h]+:m/z496.2751。
1hnmr(500mhz,dmso)δ8.39(s,1h),7.65(s,1h),7.29–7.21(m,2h),7.15(s,1h),6.96(d,j=8.1hz,2h),6.81(t,j=7.2hz,1h),4.31–4.26(m,2h),4.26–4.22(m,2h),3.77(d,j=3.6hz,2h),3.77–3.73(m,2h),3.60(dd,j=12.9,6.6hz,2h),3.39(s,3h),3.38(s,3h),3.21–3.13(m,4h),2.56(dd,j=5.9,3.8hz,4h),2.48(t,j=7.0hz,2h),1.94–1.84(m,2h)。
实施例12
c-12的合成:
2-氯-6,7-二(2-甲氧基乙氧基)喹唑啉(0.32g,1mmol)、4-[4-(2-甲氧基苯基)-1-哌嗪基]丙胺(0.24g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-12,收率71.8%。
esi-ms[m+h]+:m/z526.2982。
1hnmr(500mhz,dmso)δ8.34(s,1h),7.62(s,1h),7.11(s,1h),6.96–6.90(m,2h),6.85(t,j=6.4hz,2h),4.25–4.18(m,4h),3.76(s,3h),3.73(dd,j=9.3,5.9hz,4h),3.55(dd,j=12.9,6.6hz,2h),3.35(s,3h),3.34(s,3h),2.86(d,j=97.1hz,4h),2.54(dd,j=35.4,33.7hz,4h),2.43(t,j=7.0hz,2h),1.83(p,j=7.1hz,2h)。
实施例13
c-13的合成:
2-氯-6,7-二(2-甲氧基乙氧基)喹唑啉(0.32g,1mmol)、4-[4-(2,3-二氯苯基)-1-哌嗪基]丙胺(0.29g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-13,收率57.1%。
esi-ms[m+h]+:m/z565.2037。
1hnmr(500mhz,dmso)δ8.35(s,1h),7.62(s,1h),7.28(dd,j=7.1,4.0hz,2h),7.15–7.07(m,2h),4.21(dd,j=9.9,5.1hz,4h),3.77–3.71(m,4h),3.55(dd,j=12.8,6.5hz,2h),3.35(s,3h),3.34(s,3h),2.99(s,4h),2.54(s,4h),2.46(t,j=6.6hz,2h),1.84(dd,j=13.6,6.8hz,2h)。
实施例14
c-14的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1mmol)、4-(4-苯基-1-哌嗪基)丁胺(0.24g,1mmol),碳酸钾(0.69g,5mmol)为原料,按照(i)类化合物合成通法合成c-14,收率70.6%。
esi-ms[m+h]+:m/z422.2510。
1hnmr(500mhz,dmso)δ8.34(s,1h),7.60(s,1h),7.19(t,j=8.0hz,2h),7.08(s,1h),6.90(d,j=8.0hz,2h),6.76(t,j=7.2hz,1h),3.89(s,6h),3.54(dd,j=12.9,6.7hz,2h),3.08(m,4h),2.47(s,4h),2.35(t,j=7.1hz,2h),1.72–1.63(m,2h),1.59–1.50(m,2h)。
实施例15
c-15的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(2-嘧啶基)-1-哌嗪基]丁胺(0.24g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-15,收率59.5%。
esi-ms[m+h]+:m/z424.2418。
1hnmr(500mhz,dmso)δ8.48–8.26(m,3h),7.58(d,j=20.5hz,1h),7.08(s,1h),6.60(q,j=4.8hz,1h),3.91–3.86(s,6h),3.69(s,4h),3.53(dd,j=13.0,6.7hz,2h),2.38(d,j=4.2hz,4h),2.36–2.30(m,2h),1.67(dd,j=14.0,6.7hz,2h),1.55(d,j=5.1hz,2h)。
实施例16
c-16的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(2-甲氧基苯基)-1-哌嗪基]丁胺(0.26g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-16,收率65.8%。
esi-ms[m+h]+:m/z452.2619。
1hnmr(500mhz,dmso)δ8.38(s,1h),7.60(s,1h),7.09(s,1h),6.92(dd,j=12.1,6.0hz,2h),6.86(d,j=3.3hz,2h),3.88(s,6h),3.76(s,3h),3.54(dd,j=12.8,6.6hz,2h),3.08–2.82(m,4h),2.49(s,4h),2.36(t,j=7.1hz,2h),1.72–1.64(m,2h),1.59–1.51(m,2h)。
实施例17
c-17的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(3-甲氧基苯基)-1-哌嗪基]丁胺(0.26g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-17,收率55.7%。
esi-ms[m+h]+:m/z452.2618。
1hnmr(500mhz,dmso)δ8.35(s,1h),7.61(s,1h),7.09(s,1h),7.02(dd,j=12.1,6.6hz,1h),6.57(d,j=6.4hz,1h),6.46(d,j=6.6hz,1h),6.40(s,1h),3.87(s,6h),3.66(s,3h),3.59-3.52(m,2h),3.06–2.78(m,4h),2.50(s,4h),2.35(t,j=7.1hz,2h),1.75–1.68(m,2h),1.55–1.49(m,2h)。
实施例18
c-18的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(4-甲氧基苯基)-1-哌嗪基]丁胺(0.26g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-18,收率55.7%。
esi-ms[m+h]+:m/z452.2618。
1hnmr(500mhz,dmso)δ8.34(s,1h),7.60(s,1h),7.09(s,1h),6.82(d,j=12.1hz,2h),6.59(d,j=12.1hz,2h),3.87(s,6h),3.81(s,3h),3.57(dd,j=12.8,6.6hz,2h),3.09–2.80(m,4h),2.60-2.56(m,4h),2.35(t,j=7.1hz,2h),1.74–1.69(m,2h),1.57–1.50(m,2h)。
实施例19
c-19的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、4-[4-(2,3-二氯苯基)-1-哌嗪基]丁胺(0.30g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-19,收率55.0%。
esi-ms[m+h]+:m/z490.1735。
1hnmr(500mhz,dmso)δ8.43–8.21(m,0h),7.65–7.55(m,0h),7.34–7.21(m,1h),7.15–7.01(m,1h),3.87(d,j=13.0hz,3h),3.54(dd,j=12.9,6.8hz,1h),3.40(s,2h),2.94(s,2h),2.37(s,1h),1.72–1.63(m,1h),1.58–1.50(m,1h)。
实施例20
c-20的合成:
2-氯-6,7-二(2-甲氧基乙氧基)喹唑啉(0.31g,1.0mmol)、4-[4-(2-甲氧基苯基)-1-哌嗪基]丁胺(0.26g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-20,收率65.8%。
esi-ms[m+h]+:m/z540.3138。
1hnmr(500mhz,dmso)δ8.33(s,1h),7.63(s,1h),7.10(s,1h),6.95–6.88(m,2h),6.86(t,j=6.6hz,2h),4.24–4.19(m,4h),3.76(s,3h),3.75–3.70(m,4h),3.53(dd,j=12.8,6.7hz,2h),3.35(s,3h),3.34(s,3h),2.93(s,4h),2.51–2.39(m,4h),2.35(t,j=7.1hz,2h),1.73–1.61(m,2h),1.59–1.49(m,2h)。
实施例21
c-21的合成:
2-氯-7-甲氧基-6-(3-吗啡啉基)丙氧基喹唑啉(0.34g,1.0mmol)、4-[4-(2-甲氧基苯基)-1-哌嗪基]丙胺(0.29g,1.2mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-21,收率44.5%。
esi-ms[m+h]+:m/z551.3304。
1hnmr(500mhz,dmso)δ8.33(s,1h),7.56(s,1h),7.19(t,j=7.8hz,2h),7.07(s,1h),6.90(d,j=8.2hz,2h),6.76(t,j=7.2hz,1h),4.08(t,j=6.2hz,2h),3.88(s,3h),3.57(d,j=2.0hz,2h),3.55(d,j=14.3hz,4h),3.11(s,4h),2.50(s,4h),2.42(t,j=7.0hz,4h),2.35(s,4h),1.96–1.89(m,2h),1.88–1.79(m,2h)。
实施例22
c-22的合成:
2-氯-3-甲基-6,7-二甲氧基喹唑啉(0.24g,1.0mmol)、3-(4-苯基-1-哌嗪基)丙胺(0.22g,1mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-22,收率70.6%。
esi-ms[m+h]+:m/z422.2510。
1hnmr(500mhz,dmso)δ7.50(s,1h),7.18(dd,j=11.8,7.0hz,2h),7.08(s,1h),6.89(t,j=7.2hz,2h),6.75(t,j=7.0hz,1h),3.90(s,3h),3.86(s,3h),3.53(dd,j=12.7,6.5hz,2h),3.40(d,j=19.5hz,4h),3.10(m,4h),2.44–2.38(m,2h),1.88–1.78(m,2h)。
实施例23
c-23的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、2-[4-(2-甲氧基苯基)-1-哌嗪基]乙胺(0.23g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-23,收率44.5%。
esi-ms[m+h]+:m/z424.2300。
1hnmr(500mhz,dmso)δ8.37(s,1h),7.54(s,1h),7.11(s,1h),6.96–6.87(m,2h),6.85(t,j=6.2hz,2h),3.90(s,6h),3.78(s,3h),3.55(dd,j=13.0,6.5hz,2h),2.98(s,4h),2.62–2.51(m,4h),2.45(t,j=7.0hz,2h),1.87(p,j=7.0hz,2h)。
实施例24
c-24的合成:
2-氯-6,7-二甲氧基喹唑啉(0.22g,1.0mmol)、2-羟基-3-[4-(2-甲氧基苯基)-1-哌嗪基]丙胺(0.24g,1.0mmol)、碳酸钾(0.69g,5.0mmol)为原料,按照(i)类化合物合成通法合成c-24,收率74.5%。
esi-ms[m+h]+:m/z438.2460。
1hnmr(500mhz,dmso)δ8.35(s,1h),7.55(s,1h),7.08(s,1h),6.97–6.90(m,2h),6.86(t,j=6.2hz,2h),3.89(s,6h),3.66(m,,1h),3.56(t,j=7.0hz,2h),3.50(s,,1h),2.96(s,4h),2.62–2.51(m,4h),2.47(t,j=7.0hz,2h)。
药理实验证明
以c14和c21为代表的两种化合物为模型药物,测试了该类化合物的抗肿瘤作用。
药理学研究包括体外、体内两部分。体外研究主要采用乳腺癌细胞(4t1和mda-mb-231细胞),进行了包括srb实验、肿瘤干细胞球形成实验、克隆形成实验、transwell迁移实验和transwell侵袭实验等多种研究,用以证明化合物对肿瘤细胞或肿瘤干细胞的生长、迁移、克隆形成的影响。体内研究主要考察c14对4t1同种移植瘤模型中乳腺癌的肺转移及其肿瘤生长的影响,以及初步考察c14对a549细胞接种的非小细胞肺癌移植瘤模型中肿瘤生长的影响,同时初步评价了化合物的体内安全性。
结果显示c14和c21在体外具有一定的细胞毒作用,能明显抑制乳腺癌干细胞成球、抑制肿瘤细胞的克隆形成、抑制肿瘤细胞的迁移和侵袭;体内能显著抑制乳腺癌的肺转移、抑制乳腺肿瘤以及非小细胞肺癌肿瘤的生长,并且具有良好的安全性,没有引起动物体重、血象以及各种主要器官的异常。上述结果说明这类化合物具有较好的开发前景。
在这些研究中,sch23390(即(5r)-8-chloro-3-methyl-5-phenyl-1,2,4,5-tetrahydro-3-benzazepin-7-ol)简称sch,是用于机理研究的靶点(d1dr)的特异性拮抗剂,sch可以逆转这两个化合物的相关作用,用以说明机制。
图1为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌干细胞球形成抑制作用的效果图。a为c-14及c-21对4t1细胞干细胞球形成抑制作用;b为c-14及c-21对mda-mb-231细胞干细胞球形成抑制作用。sch为多巴胺d1受体拮抗剂,在药理实验中用于验证新化合物通过激动多巴胺d1受体起效。
图2为c-14及c-21对4t1细胞干细胞球中aldh+细胞比例抑制作用。图3为c-14及c-21对mda-mb-231细胞干细胞球中aldh+细胞比例抑制作用。aldh+细胞比例为每个样品测试管(-deab)与对照管(+deab)的细胞比例之差。aldh+是一种广泛使用的肿瘤干细胞标志物,本专利中使用该标志物区分肿瘤干细胞。
图4为c-14及c-21对4t1细胞干细胞球中凋亡细胞比例抑制作用。图5为c-14及c-21对mda-mb-231细胞干细胞球中凋亡细胞比例抑制作用。凋亡细胞比例为早凋(右下)和晚凋(右上)细胞比例之和。
图6为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞增殖抑制作用的效果图。a和b分别为c-14对4t1和mda-mb-231细胞增殖抑制作用;c和d分别为c-21对4t1和mda-mb-231细胞增殖抑制作用。
图7为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞集落形成能力抑制作用及sch逆转该抑制作用的效果图。a和b分别为不同浓度c-14对4t1和mda-mb-231细胞集落形成能力的抑制作用;c和d分别为不同浓度c-21对4t1和mda-mb-231细胞集落形成能力的抑制作用。
图8为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞迁移能力抑制作用及sch逆转该抑制作用的效果图(transwell迁移实验)。a和b分别为不同浓度c-14对4t1和mda-mb-231细胞迁移能力的抑制作用;c和d分别为不同浓度c-21对4t1和mda-mb-231细胞迁移能力的抑制作用。
图9为c-14、c-21单药分别对4t1和mda-mb-231两种乳腺癌细胞侵袭能力抑制作用及sch逆转该抑制作用的效果图。a和b分别为不同浓度c-14对4t1和mda-mb-231细胞侵袭能力的抑制作用;c和d分别为不同浓度c-21对4t1和mda-mb-231细胞侵袭能力的抑制作用。
图10为c-14单药对4t1乳腺癌移植瘤模型中肺转移抑制作用及sch逆转该抑制作用的效果图。a,雌性babl/c小白鼠分别给与空白对照,c-1420mg/kg,c-1440mg/kg,sch0.05mg/kg,c-1440mg/kg+sch0.05mg/kg时各组肺脏拍照结果;b,各组肺脏转移结节计数结果。
图11为c-14对4t1乳腺癌移植瘤模型中肿瘤生长抑制作用及sch逆转该抑制作用的效果图。a,雌性babl/c小白鼠分别给与空白对照,c-1420mg/kg,c-1440mg/kg,sch0.05mg/kg,c-1440mg/kg+sch0.05mg/kg时肿瘤拍照结果;b,各组肿瘤体积的生长曲线;c,各组肿瘤质量;d,各组小鼠体重变化;e,给药第16天,处死动物,将小鼠解剖,取心脏、肝脏、肾脏称重并计算各脏器重量相对于小鼠净重的百分比,即脏器指数;f,给药第16天,小鼠眼眶采全血测定血常规结果。
图12为c-14和阳性对照药物厄洛替尼(er)对体内a549非小细胞肺癌移植瘤模型中肿瘤生长的抑制作用。
本发明所述化和物可以以组合物的形式通过口服、注射等途径施用于需要肿瘤治疗的哺乳动物(包括人)。
所述组合物包括治疗有效量的式i结构的化合物或其药学上可接受的盐和药学上可接受的载体。
所述的载体是指药学领域常规的载体,例如:稀释剂、赋形剂如水等;粘合剂如纤维素衍生物、明胶、聚乙烯吡咯烷酮等;填充剂如淀粉等;崩裂剂如碳酸钙、碳酸氢钠;另外,还可以在组合物中加入其它辅助剂如香味剂和甜味剂。
本发明的组合物可以制备成常规的固体制剂,如片剂、胶囊等,用于口服;也可以将其制备成注射剂等剂型用于注射。
本发明的组合物的各种剂型可以采用要学领域常规的方法进行制备,其中活性成分式i结构的化合物的含量为组合物重量的0.1%~99.5%(重量比)。
本发明所述的式i结构的化合物在临床上可以通过口服或注射方式对哺乳动物(包括人)进行给药,其中尤以口服方式最佳。用药剂量为每日0.0001mg/kg~200mg/kg体重。最佳剂量视个体而定,通常开始时剂量较小,然后逐渐增加用量。
综上所述,本发明所述的化合物作为抗肿瘤药物应用时具有更小的毒副作用,更易于作为抗肿瘤药物使用,相当于现有技术,本发明具有新颖性、创造性和科学的进步。
- 还没有人留言评论。精彩留言会获得点赞!