分离装置和分离方法与流程
本申请涉及生物技术领域,具体地,涉及一种用于分离液体样本中目标颗粒的分离装置和分离方法。
背景技术:
外泌体(exosome)是由活细胞持续大量分泌的一种直径为30-150nm的双磷脂膜结构小囊泡,其作为细胞间通信交流的载体携带来源于母细胞的蛋白、核酸、代谢小分子等特异性组分。大量的研究表明,外泌体参与了肿瘤发展的多种事件,包括免疫逃逸、血管生成、肿瘤转移、肿瘤耐药等。外泌体能更早、持续地被癌细胞释放并进入患者血液循环系统,其脂质双层膜结构能够有效保护所携带的蛋白质和包裹的核酸类物质。外泌体广泛且稳定地存在于多种临床样本中,包括血液、尿液、腹水、组织液、眼泪、唾液和脑脊液等。其中血液和尿液中的外泌体数量多、临床取样容易。因此,外泌体被认为是体外诊断研究和肿瘤临床检测领域中的重点研究对象,有望在肿瘤早期诊断、肿瘤转移复发评估、肿瘤异质性评估、动态检测肿瘤发生发展和疗效、耐药突变检测、个性化用药等方面发挥巨大的临床价值。
目前,实现外泌体临床应用的主要障碍是分离过程中发生过滤膜堵孔现象,通量低、纯度低。
技术实现要素:
有鉴于此,有必要提供一种能够解决上述问题的分离装置和分离方法。
本申请提供一种分离装置,用于从液体样本中分离提纯出目标颗粒。所述分离装置包括:
分离芯片组件,包括分离芯片、第一振动件和第二振动件,所述分离芯片包括样本池和位于所述样本池相对的两侧的第一过滤膜和第二过滤膜,所述第一过滤膜和所述第二过滤膜的孔径均小于所述目标颗粒的粒径,所述分离芯片还包括第一腔室和第二腔室,所述第一腔室通过所述第一过滤膜与所述样本池连通,所述第二腔室通过所述第二过滤膜与所述样本池连通,所述第一振动件固定于第一过滤膜和第二过滤膜,所述第二振动件固定于所述第一腔室的外表面以及所述第二腔室的外表面;
真空系统;
变频模块,通过所述真空系统分别与所述第一腔室和所述第二腔室连接,所述变频模块用于控制所述真空系统交替地在所述第一腔室和所述第二腔室中产生负压;以及
控制器,用于在所述真空系统停止在所述第一腔室中产生负压时,控制所述第一振动件和所述第二振动件振动;还用于在所述真空系统停止在所述第二腔室中产生负压时,控制所述第一振动件和所述第二振动件振动,其中,所述第一振动件和所述第二振动件在振动时分别产生第一振动波和第二振动波,所述第一振动波的频率大于所述第二振动波的频率,所述第一振动波的振幅小于所述第二振动波的振幅。
在一些可能的实现方式中,所述第一振动波的振动频率为5000hz-8000hz,所述第二振动波的振动频率为100-500hz。
在一些可能的实现方式中,所述第一振动波的振动频率等于所述第一过滤膜或所述第二过滤膜的共振频率。
在一些可能的实现方式中,所述第一振动件和所述第二振动件位于同一水平面上。
在一些可能的实现方式中,所述第一振动件为谐波振荡器,所述第二振动件为振动马达。
本申请还提供一种分离方法,用于从液体样本中分离提纯出目标颗粒。所述方法包括:
提供上述分离装置,并向所述样本池提供液体样本;
在所述第一腔室产生负压,从而使所述样本池内的液体样本中粒径小于所述第一过滤膜的孔径的组分在负压作用下进入所述第一腔室;
停止在所述第一腔室中产生负压,并控制所述第一振动件和所述第二振动件振动;
在所述第二腔室中产生负压,从而使所述样本池内的液体样本中粒径小于所述第二过滤膜的孔径的组分在负压作用下进入所述第二腔室;以及
停止在所述第二腔室中产生负压,并控制所述第一振动件和所述第二振动件振动,其中,所述第一振动件和所述第二振动件在振动时分别产生第一振动波和第二振动波,所述第一振动波的频率大于所述第二振动波的频率,所述第一振动波的振幅小于所述第二振动波的振幅。
在一些可能的实现方式中,所述第一振动波的振动频率为5000hz-8000hz,所述第二振动波的振动频率为100-500hz。
在一些可能的实现方式中,所述第一振动波的振动频率等于所述第一过滤膜或所述第二过滤膜的共振频率。
在一些可能的实现方式中,所述第一振动件和所述第二振动件位于同一水平面上。
在一些可能的实现方式中,所述第一振动件为谐波振荡器,所述第二振动件为振动马达。
相较于现有技术,本申请在真空系统停止在第一腔室/第二腔室中产生负压时,控制第一振动件和第二振动件振动,第一振动件向第一过滤膜和第二过滤膜传递第一振动波,使吸附于滤膜的膜孔中的目标颗粒能够快速与过滤膜的膜孔分离并重新悬浮于回流的液体样本中;第二振动件产生的第二振动波和第一振动波共同扰动液体样本和过滤膜并产生声学效应,防止目标颗粒堵塞滤孔或者聚集在一起,实现高效分离。
附图说明
图1为本申请实施例所提供的分离芯片组件的结构示意图。
图2为向图1所示的分离芯片组件上所施加负压的示意图。
图3为向图1所示的分离芯片组件上施加的第一振动波和第二振动波的示意图。
图4为本申请实施例所提供的分离装置的功能模块示意图。
图5为对本申请实施例与对比例1-4得到的外泌体的含量随时间的变化趋势图。
图6为本申请实施例得到的外泌体的扫描电镜图。
图7为本申请对不同体积和外泌体浓度的尿液样本进行分离提纯后得到的外泌体的含量测试图。
图8为本申请对不同类型的液体样本进行分离提纯后得到的外泌体的含量测试图。
图9为对本申请实施例和对比例5得到的外泌体进行蛋白质印迹分析得到的图谱。
图10为本申请实施例和对比例5在提纯时间、外泌体产量和外泌体浓度三个维度的比较示意图。
主要元件符号说明
如下具体实施方式将结合上述附图进一步说明本申请。
具体实施方式
下面将结合本申请的优选实施方式及实施例对本申请的技术方案进行描述。需要说明的是,当一个单元被描述为“连接”于另一个单元,它可以是直接连接到另一个单元或者可能同时存在居中单元。当一个单元被描述为“设置于”另一个单元,它可以是直接设置在另一个单元上或者可能同时存在居中单元。除非另有定义,本文所使用的所有的技术和科学术语与属于本申请的技术领域的技术人员通常理解的含义相同。在本申请的说明书中所使用的元件或设备的名称只是为了描述具体的实施例的目的,不是旨在于限制本申请。
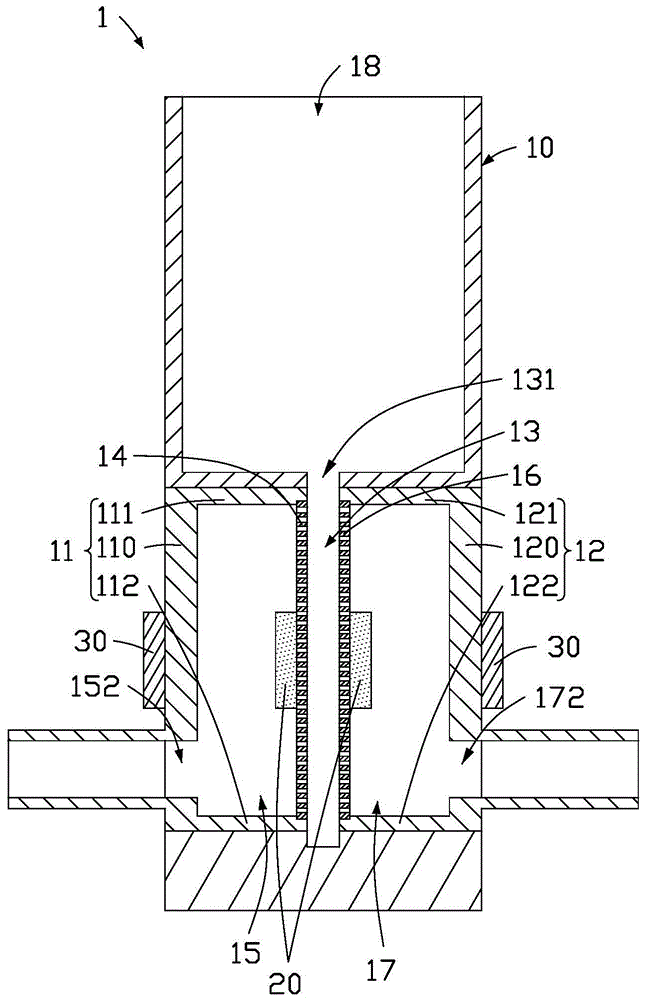
请参阅图1,本申请实施例提供一种分离芯片组件1,用于对液体样本中不同尺寸的颗粒进行分离提纯,以得到特定尺寸的目标颗粒。该液体样本可为人体血浆、血清、脑髓液、唾液、尿液以及胃液等。目标颗粒可为外泌体或循环肿瘤细胞等。分离芯片组件1包括分离芯片10、第一振动件20和第二振动件30。
分离芯片10包括样本池13以及位于样本池13相对的两侧的第一过滤膜14和第二过滤膜16。样本池13用于容置液体样本。第一过滤膜14和第二过滤膜16的孔径均小于目标颗粒的粒径。
进一步地,分离芯片10还可包括第一腔室15和第二腔室17,第一腔室15与样本池13通过第一过滤膜14相连通,第一腔室15设置有第一开口152,第一开口152连通第一腔室15与外界。第二腔室17与样本池13通过第二过滤膜16相连通,第二腔室17设置有第二开口172,第二开口172连通第二腔室17与外界。其中,第一腔室15与第二腔室17分别位于该样本池13相对的两侧。
使用分离芯片组件1时,将液体样本加入样本池13,将第一开口152和第二开口172分别与真空系统50(参图4)相连接。当真空系统50通过第一开口152使第一腔室15受到抽吸时,第一腔室15中产生负压。在第一腔室15的负压作用下,样本池13中的液体样本中尺寸小于第一过滤膜14的过滤孔径的组分(包括小颗粒和液体组分)朝向第一过滤膜14移动,经由第一过滤膜14流入第一腔室15。当真空系统50通过第二开口172使第二腔室17受到抽吸时,第二腔室17中产生负压。在第二腔室17的负压作用下,样本池13中的液体样本中尺寸小于第二过滤膜16的过滤孔径的组分朝向第二过滤膜16移动,经由第二过滤膜16流入第二腔室17,与此同时,样本池13中的液体样本在第一过滤膜14处会产生回流现象,从而减少或移除粘附于第一过滤膜14的组分,避免过滤分离过程中过滤膜被堵塞的情况发生。反复交替使第一腔室15和第二腔室17内产生负压,可以有效地使液体样本反复交替地流过第一过滤膜14和第二过滤膜16,使液体样本中尺寸大于第一过滤膜14和第二过滤膜16孔径的组分(即目标颗粒)留在样本池13中。分离芯片10的结构设计使吸附于第一过滤膜14和第二过滤膜16表面的组分在反复交替的负压变化中易于从滤膜表面脱落,可以有效地防止滤膜的膜孔被堵塞。
请一并参照图2,在一实施例中,该真空系统50交替地在该第一腔室15以及该第二腔室17内产生的负压(negativepressure,np)形成周期的梯形脉冲信号。矩形脉冲信号的幅度为10vpp,频率为5000hz至7000hz。其中,梯形脉冲信号可防止负压方向突然改变对第一过滤膜14以及第二过滤膜16的损坏。在一实施例中,鉴于血浆样本中蛋白含量较多,为了进一步避免过滤膜堵塞现象,可以在其中一腔室内产生负压的同时在另一腔室内产生正压(airpressure,ap),加强过滤膜处的回流现象。
如图1所示,第一振动件20的数量为两个。其中一第一振动件20固定于第一过滤膜14远离第二过滤膜16的表面。另一第一振动件20固定于第二过滤膜16远离第一过滤膜14的表面。第一振动件20用于在振动时产生横向的第一振动波,然后向第一过滤膜14和第二过滤膜16传递第一振动波,从而带动第一过滤膜14和第二过滤膜16高频振动。因此,吸附于滤膜的膜孔中的目标颗粒能够快速与过滤膜的膜孔分离并重新悬浮于回流的液体样本中,从而进一步防止滤膜的膜孔被堵塞,实现高效分离。
第二振动件30的数量为两个。其中一第二振动件30固定于第一腔室15的外表面。另一第二振动件30固定于第二腔室17的外表面。第二振动件30用于在在振动时产生横向的第二振动波。请一并参阅图3,其中,第一振动波的频率大于第二振动波的频率,第一振动波的振幅小于第二振动波的振幅。第二振动波通过第一腔室15和第二腔室17向整个分离芯片10传递,使分离芯片10低频振动。第二振动波能够与第一振动波共同扰动液体样本和过滤膜并产生声流效应(acousticstreaming),防止目标颗粒堵塞滤孔或者聚集在一起,提高分离提纯效率。在一实施方式中,第一振动件20可为谐波振荡器,第二振动件30可为振动马达。
在一实施方式中,第一振动波的振动频率为5000hz-8000hz,第二振动波的振动频率为100-500hz。该振动频率下的第一振动波和第二振动波均不会对目标颗粒造成损坏。优选的,第一振动波的振动频率可与第一过滤膜14或第二过滤膜16的共振频率大致相同,此时,第一过滤膜14或第二过滤膜16可以更大的振幅振动,便于吸附于过滤膜上的目标颗粒更快速地分离下来。
在一实施方式中,第一振动件20和第二振动件30位于同一水平面上。即,第一振动波与第二振动波朝向同一方向,使得第一振动波和第二振动波可以相互叠加,形成协同振动。
在一实施方式中,分离芯片10包括第一侧盖片11和第二侧盖片12。第一侧盖片11包括第一盖片本体110以及位于第一盖片本体110相对两侧的第一挡片111和第二挡片112,第一过滤膜14固定于第一挡片111和第二挡片112之间且与第一盖片本体110相对。第一盖片本体110、第一挡片111、第二挡片112和第一过滤膜14共同围设出第一腔室15。第二侧盖片12包括第二盖片本体120以及位于第二盖片本体120相对两侧的第三挡片121和第四挡片122,第三挡片121与第一挡片111相对,第四挡片122与第二挡片112相对,第二过滤膜16固定于第三挡片121和第四挡片122之间且与第二盖片本体120相对,第二盖片本体120、第三挡片121、第四挡片122和第二过滤膜16共同围设出第二腔室17。样本池13位于第一过滤膜14和第二过滤膜16之间。其中,第二振动件30固定于第一盖片本体110或第二盖片本体120的外表面。
进一步地,第一挡片111和第三挡片121相距设置以限定出与样本池13连通的加样口131。分离芯片10还包括加样室18,加样室18与样本池13通过加样口131连通。操作时,将液体样本加入加样室18中,加样口131用于使得加样室18内的液体样本能够流出加样室18并进入样本池13。
请参阅图4,本申请实施方式进一步提供了一种分离装置100,包括如上的分离芯片组件1、真空系统50和变频模块40和控制器60。
真空系统50用于分别使分离芯片组件1的第一腔室15和第二腔室17产生负压。真空系统50可以是两个独立的真空系统,也可以是经过设计的一个真空系统。真空系统50也可以包括微型真空泵或微型抽气泵等设备。可以理解的是,真空系统50与分离芯片10之间可以通过气密性较佳的管道连接。在一实施方式中,真空系统50包括第一真空泵510和第二真空泵520,第一真空泵510与分离芯片10的第一开口152相连接,第二真空泵520与分离芯片10的第二开口172相连接。
变频模块40与真空系统50电连接,变频模块40可以控制提供给真空系统50的电源电压,从而使第一腔室15和第二腔室17内交替产生负压。在一实施方式中,变频模块40包括变频器410以及与变频器410连接的控制阀420。控制阀420可以是液路转换器,包括但不仅限于电磁阀、旋转阀。控制阀420分别与第一真空泵510以及第二真空泵520中的其中一个连通,从而使第一真空泵510和第二真空泵520反复交替工作。例如,将控制阀420连通第一真空泵510,使得变频器410控制第一真空泵510运行,通过第一开口152抽气使第一腔室15内产生负压,样本池13中的液体样本中的液体和尺寸小于第一过滤膜14孔径的组分在负压作用下通过第一过滤膜14,进入第一腔室15;然后,变频器410控制第一真空泵510停止运行;之后,将控制阀420切换至与第二真空泵520连通,使得变频器410控制第二真空泵520运行,通过第二开口172抽气使第二腔室17内产生负压,使得样本池13中的液体样本中的液体和尺寸小于第二过滤膜16孔径的组分在负压作用下通过第二过滤膜16,进入第二腔室17;再之后,变频器410控制第二真空泵520停止运行;反复上述步骤多次。
控制器60用于在第一腔室15停止抽吸时,控制第一振动件20和第二振动件30振动,从而分别产生第一振动波和第二振动波。控制器60还用于在第二腔室17停止抽吸时,控制第一振动件20和第二振动件30振动,从而分别产生第一振动波和第二振动波。其中,控制器60可与第一真空泵510和第二真空泵520电性连接,当第一真空泵510或第二真空泵520停止运行时,控制器60即判断第一真空泵510在第一腔室15停止抽吸,或判断第二真空泵520在第二腔室17停止抽吸,此时便可通知对应的第一振动件20和第二振动件30开始振动。
本申请实施例进一步提供一种应用于上述分离芯片组件1的分离液体样本中目标颗粒的方法,其包括如下步骤:
步骤s1,提供本申请的分离芯片组件1,向该分离芯片组件1的样本池13中提供液体样本。
步骤s2,通过第一开口152抽吸第一腔室15,使第一腔室15内产生负压。
其中,在进行抽吸之前,将第一开口152、第二开口172分别与分离装置100的真空系统50相连。如此,真空系统50通过第一开口152抽吸第一腔室15,使第一腔室15内产生负压。样本池13中的液体样本中的液体和尺寸小于第一过滤膜14孔径的组分在负压作用下朝向第一过滤膜14移动,经由第一过滤膜14进入第一腔室15。
步骤s3,停止抽吸第一腔室15,控制第一振动件20和第二振动件30振动,从而分别产生第一振动波和第二振动波。同时,通过的第二开口172抽吸第二腔室17使第二腔室17内产生负压。
其中,第一振动波带动第一过滤膜14高频振动,使吸附于滤膜的膜孔中的目标颗粒能够快速与过滤膜的膜孔分离并重新悬浮于回流的液体样本中。第二振动波可以防止目标颗粒聚集在一起。同时,真空系统50通过第二开口172抽吸第二腔室17,使第二腔室17内产生负压。粘附在第一过滤膜14表面的组分可以随着气流和/或液流样本池13中,样本池13中的液体样本中的液体和尺寸小于第二过滤膜16孔径的组分在负压作用下朝向第二过滤膜16移动,经由第二过滤膜16进入第二腔室17。
步骤s4,停止抽吸第二腔室17,控制第一振动件20和第二振动件30振动。
然后,步骤s2至步骤s4可循环多次,使液体样本中小于过滤膜孔径的组分被去除,大于过滤膜孔径的组分被截留在样本池13中,以实现更好的分离提纯效果。
以下将结合实施例和对比例对本申请进行具体描述。
实施例
使用本申请提供的分离芯片组件对2ml的尿液样本进行外泌体分离提纯,第一振动件的频率为6250hz(与过滤膜的共振频率大致相同),第二振动件的频率为200hz。
对比例1
使用分离芯片组件对2ml的尿液样本进行外泌体分离提纯,与实施例的分离芯片组件不同之处在于,对比例1的分离芯片未含有第一振动件和第二振动件。
对比例2
使用分离芯片对2ml的尿液样本进行外泌体分离提纯,与实施例的分离芯片组件不同之处在于,对比例2的分离芯片仅含有第二振动件(频率为200hz),未含有第一振动件。
对比例3
使用分离芯片对2ml的尿液样本进行外泌体分离提纯,与实施例的分离芯片组件不同之处在于,对比例3的分离芯片仅含有第一振动件(频率为6250hz),未含有第二振动件。
对比例4
使用死端过滤法(dead-endfiltration)对2ml的尿液样本进行外泌体分离提纯,死端过滤采用与实施例的分离芯片相同的过滤膜,不同之处在于,将液体样本置于过滤膜的上游,在压力差的推动下,使液体组分和粒径小于膜孔的颗粒透过过滤膜。
对实施例和对比例1-4随时间推进得到的外泌体的含量进行测定,结果记录于图5中。如图5所示,实施例在10min内便可分离出将近30μm的外泌体,分离效率远大于对比例1-4。进一步对实施例得到的外泌体进行透射电镜测试(标尺刻度为250nm),测试结果如图6所示。其中,分离得到的外泌体粒径在50nm至200nm,与外泌体的理论粒径相符,且形状为圆形或杯形,具有较高的完整性。
进一步地,使用同一个分离芯片组件并以相同的方法重复对四种具有不同外泌体浓度的尿液样本进行分离提纯,每一尿液样本的体积从1ml至20ml不等。然后,采用微量紫外-可见光分光光度计对每次分离得到的外泌体进行蛋白含量测试,结果记录于图7中。如图7所示,每一外泌体浓度下,提纯得到的外泌体含量均随尿液样本体积的增加而呈现线性增加的趋势,这表明在测试各种不同体积的尿液样本或尿液样本具有各种不同含量的外泌体的情况下,使用本申请实施例的分离芯片组件进行分离提纯均具有较高的结构稳定性。此外,重复使用同一个分离芯片组件对体积为10ml的尿液样本进行分离提纯,重复二十遍之后发现得到的外泌体含量之间变异系数(cv)小于9.9%,表明使用该分离芯片组件进行分离提纯具有较高的可重复性。
进一步地,还采用本申请提供的分离芯片组件对其它液体样本进行外泌体分离提纯,包括血浆(plasma)、细胞培养液(culturemedium)、泪液(tear)、唾液(saliva)和脑脊液(csf)等。如图8所示,从这几种液体样本中均分离出较高浓度的外泌体,表明本申请提供的分离芯片组件适用于多种液体样本的分离提纯。而且,分离得到的外泌体粒径同样在50nm至200nm。
对比例5
使用传统的超速离心(uc)、聚乙二醇(peg)沉淀、磷脂酰丝氨酸(ps)亲和、排阻色谱(sec)、膜亲和(ma)等方法分别从同样的尿液样本中分离外泌体。
具体地,使用蛋白质印迹法对实施例和对比例5中各分离提纯方法得到的外泌体中的alix、cd63、tsg101、cd81蛋白标志物进行测试。其中,尿调节素(umod)是尿液样本中含量较高的蛋白,可用于表征外泌体提纯后的纯度。如图9所示,相对于传统的分离提纯方法,本申请使用分离芯片组件(在图9中记为exodus)对尿液样本分离提纯后得到的外泌体中能够同时检测到较高浓度的四种蛋白标志物,表明提纯产量较高;而且外泌体未吸附有大量的尿调节素,表明提纯精度较高。
其中,提纯所需时间、外泌体产量和外泌体纯度是用于表征不同分离提纯方法的三个维度的参数。如图10所示,相较于对比例5中各种传统的分离提纯方法,实施例的分离芯片组件(在图10中记为exodus)进行分离提纯所需时间较短(减少95%)、外泌体产量较高(提高526%)、外泌体纯度较高(提高259%),表明该分离芯片组件相较于市售的各种外泌体分离手段具有较强的竞争力。
上述实施例为本申请较佳的实施方式,但本申请的实施方式并不受上述实施例的限制,以上实施方式仅是用于解释权利要求书。然本申请的保护范围并不局限于说明书。任何熟悉本技术领域的技术人员在本申请披露的技术范围内,可轻易想到的变化或者替换,都包含在本申请的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!