钌配合物在DNA和酸性pH双功能磷光传感中的应用的制作方法
本发明涉及水溶液中的DNA和pH传感领域,具体涉及一个钌配合物在水溶液中的DNA和pH磷光传感中的应用。
背景技术:
1990年,Barton等人通过研究发现配合物[Ru(bpy)2(dppz)]2+的水溶液几乎不能发出荧光,向其中逐渐加入DNA之后,溶液的荧光大幅增强,当配合物与DNA达到键合饱和时,荧光增强的倍数可达104[Friedman,A.E.;Chambron,J.C.;Sauvage,J.P.;Turro,N.J.;Barton,J.K.J.Am.Chem.Soc.1990,112,4960.]。在DNA加入前后,配合物都经历了荧光从无到有的大幅变化,于是人们形象地把它们叫作“DNA的光开关”。后来,Barton和Barbara等人对上述配合物的DNA光开关性质的机理进行了探究,他们发现配合物的激发态3MLCT直接指向配体dppz的吩嗪环,在没有DNA存在时,杂环吩嗪上的N原子易与周围溶剂水分子形成氢键导致配合物产生非辐射跃迁,因而没有荧光被观察到;配合物与DNA分子发生键合作用后,位于嵌入配体上的吩嗪环的N原子得到疏水的DNA碱基区的保护,溶剂水分子难以对其产生影响,从而出现荧光增强的现象[Turro,C.;Bossmann,S.H.;Jenkins,Y.;Barton,J.K.;Turro,N.J.J.Am.Chem.Soc.1995,117,9026.]。Ru(II)配合物作为DNA光开关的发现是一个令科研工作者兴奋的结果,配合物分子的DNA光开关性质为DNA分子的定性或定量检测开辟了新的途径,也为不同类型、不同碱基含量的DNA的识别和DNA的特定序列识别开拓了新思路,这类配合物也因此成为公认的“明星分子”。自此以后,出现了不少致力于在这两种配合物的基础上通过改变或修饰配体来开发新的DNA分子光开关的研究,形成了DPPZ系列的光开关化合物。对原型分子[Ru(bpy)2(dppz)]2+的修饰工作主要通过以下几种途径实现:延长dppz配体的共轭体系、在dppz上引入新的取代基、引入电负性强的杂原子如N原子和改变辅助配体。但是该方面的工作却没有得到人们期待的更好的DNA分子光开关,由于dppz系列的Ru(II)配合物的DNA光开关性能均不及原型配合物,研究人员逐渐开始从其他体系的Ru(II)配合物着手探索DNA光开关。我们课题组曾报道了一个含有羧基的钌配合物[Ru(phen)2(Hcdpq)]2+[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.],表现出较好的DNA光开关性能,且能从含有小牛胸腺DNA和酵母RNA的溶液中选择性性磷光传感DNA。但该配合物与DNA的键合能力较弱,检测DNA的灵敏度较差,限制了其实际应用。本专利通过改变其辅助配体,成功实现了高选择性、高灵敏度检测DNA。
技术实现要素:
本发明的目的是公开一个钌配合物的DNA磷光传感中应用。
本发明的技术方案如下:
本实验中所用的双核钌配合物细胞pH传感器为[(bath)2Ru(Hcdpq)](ClO4)2,配阳离子结构式如下图所示:
与现有DNA磷光传感器相比,本发明的传感器的有益效果在于:在小牛胸腺DNA和酵母RNA共存的溶液中磷光传感DNA的选择性性优于明星配合物[Ru(bpy)2(dppz)]2+,其键合的选择性和灵敏度明显优于[Ru(phen)2(Hcdpq)]2+。
附图说明
图1在Tris-HCl缓冲溶液(5mM Tris,pH=7.1,50mM NaCl)中[Ru(DIP)2(Hcdpq)]+(4μM)的紫外-可见光谱随DNA浓度增加(0-8.5μM)的变化(插图为随着DNA浓度增加[DNA]/(εa-εf)的变化及线性拟合)。
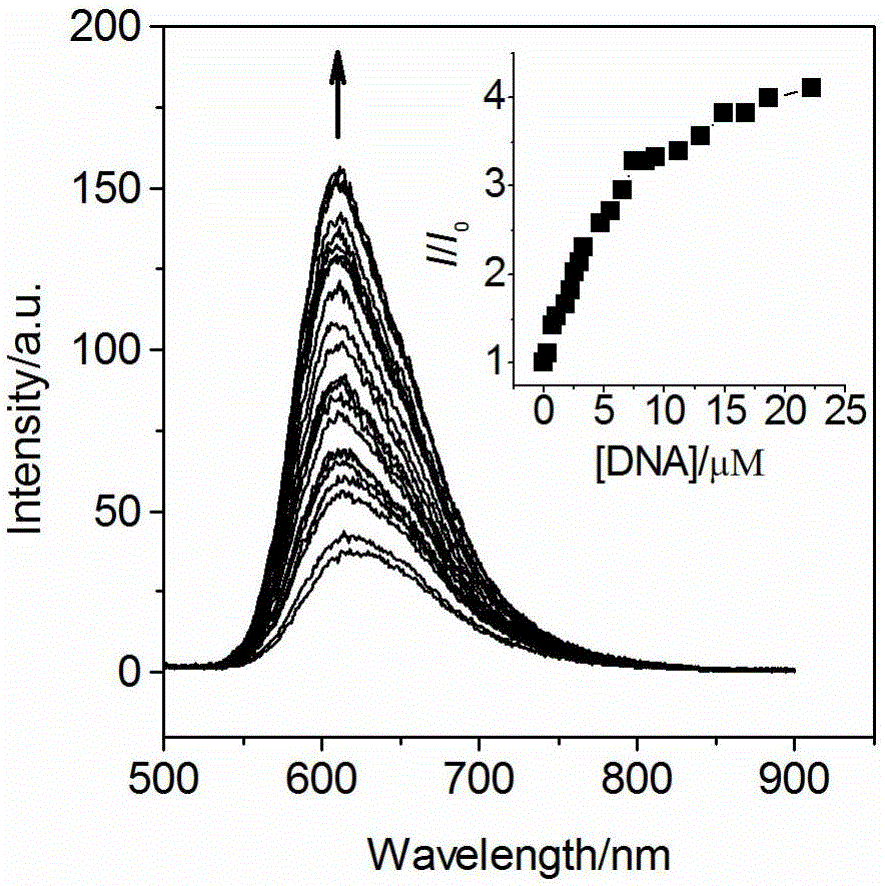
图2在Tris-HCl缓冲溶液(5mM Tris,pH=7.1,50mM NaCl)中[Ru(DIP)2(Hcdpq)]+(4μM)的发射光谱随DNA浓度增加(0-22.3μM)的变化(λex=471nm)(插图为随着DNA浓度增加I/I0的变化图)。
图3(a)[Ru(DIP)2(Hcdpq)]+(4μM)对DNA(0-7.5μM)的荧光响应的工作曲线;图3(b)[Ru(phen)2(Hcdpq)]+(2.69μM)对DNA(0-86μM)的荧光响应的工作曲线。
图4随RNA浓度增加(0-23μM)[Ru(DIP)2(Hcdpq)]+(4μM)在5mM Tris-HCl缓冲溶液(50mM NaCl,pH=7.1)中的荧光光谱变化图,插图为I/I0值随RNA或DNA浓度增大的变化。
图5[Ru(DIP)2(Hcdpq)](ClO4)2(4μM)在Britton-Robinson缓冲溶液中随pH变化(0.2-11.6)的荧光光谱图(λex=457nm)的变化;插图为615nm处荧光强度随pH变化的Sigmoidal拟合)。
具体实施方式
实施例1:配合物[Ru(DIP)2(Hcdpq)](ClO4)2的合成
将Ru(DIP)2Cl2(0.0836g,0.1mmol),吡嗪并[2,3-f][1,10]邻菲咯啉-2-羧酸(0.0295g,0.107mmol)和乙二醇4mL加入25mL圆底烧瓶中,N2保护下在110℃反应10h。反应结束后,冷却至室温,得到橙红色澄清溶液,然后向溶液中加入含0.05M HClO4的饱和NaClO4溶液,得到红色沉淀,常压过滤并用0.05M HClO4水溶液洗涤,真空干燥,得粗产品。用乙腈/水/KNO3(体积比0:5:1)的展开剂对粗产品进行硅胶柱色谱分离,接收色谱柱上的红色荧光带。然后将接收到的液体旋蒸浓缩,向浓缩液中加入含有0.05M HClO4的饱和NaClO4溶液,有部分白色的盐析出,过滤将其除去,继续向滤液中加入含有0.05M HClO4的饱和NaClO4溶液,有红色沉淀析出,同时也有白色的盐析出,过滤沉淀,真空干燥,再用尽量少的乙腈溶解产品中的红色配合物,大部分盐由于不溶于乙腈被除去,将乙腈溶液旋蒸浓缩,若仍有盐析出则过滤除去,向除盐后的溶液中加入含有0.05M HClO4的饱和NaClO4溶液,析出红色沉淀,于70℃真空干燥后得到产品0.076g(0.061mmol),产率为61%。氢核磁共振谱(400MHz,Me2SO-d6)δ/ppm:9.82(s,1H),9.61(d,J=8.3Hz,2H),8.40(dd,J=7.1,2.7Hz,2H),8.33(t,J=6.3Hz,4H),8.28(s,4H),8.04(m,2H),7.84(d,J=5.5Hz,2H),7.79(dd,J=5.5,1.3Hz,2H),7.66(m,20H)。元素分析[C63H40Cl2N8O2Ru·H2O(F.W.=1259.01)]:计算值:C 60.10;N 8.90;H 3.36%;测量值:C 60.96;N 8.83;H 3.37%。基体辅助激光解吸电离飞行质谱:计算值:m/z521.0563([M-2ClO4]2+);测量值:521.1280([M-2ClO4]2+)。
本发明采用硅胶柱色谱分离技术,提纯目标配合物,较文献[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.]报道的[Ru(phen)2(Hcdpq)](ClO4)2的重结晶纯化方法,产率(65%)和纯度稳定,耗时少。而文献纯化时使用乙腈和二氧六环进行重结晶,产物析出很慢,需要数周的时间,且产物的产率纯度难以控制。
实施例2:DNA或RNA键合实验紫外-可见光谱和荧光光谱的测定
将1.3mg[Ru(DIP)2(Hcdpq)](ClO4)2溶于1mL乙腈中配成浓溶液(约1mM),配制500mL5mM Tris-HCl缓冲溶液(pH=7.1,50mM NaCl),再将8.5mg小牛胸腺DNA(ct-DNA)加入10mLTris-HCl缓冲液中,在冰水中超声半个小时将缠结在一起的DNA打碎,测试前将DNA溶液于4℃冰箱中静置一夜。配置RNA溶液是取8mg干粉状的酵母RNA,将其溶于10mLTris-HCl缓冲溶液中,测试前放于4℃冰箱中静置一夜。测试时取两个小烧杯,分别记为a和b(a装待测液,b装参比液),向两个烧杯中分别加入10mLTris-HCl缓冲溶液,然后从两个烧杯中各取3mL溶液分别加入两个比色皿中,将加入a中溶液的比色皿置于外槽,加入b中的溶液的比色皿置于内槽(整个测试过程中两个比色皿与烧杯a、b及内、外槽的对应关系始终保持不变),在波长200-700nm范围内作紫外-可见光谱的基线,然后将比色皿中的溶液分别倒回相应的烧杯中。向烧杯a中加入一定量的配合物的乙腈溶液,为了消除溶剂乙腈的影响,向烧杯b中加入相同体积的乙腈溶液,搅匀后取溶液测定未加DNA时配合物溶液的吸收光谱,为了保证配合物溶液浓度适宜,其光谱中可见光区460nm处的吸收值应在0.1左右。然后测定未加DNA的配合物溶液的荧光发射光谱,先以460nm为激发波长测定发射光谱,再固定发射波长测定激发光谱,如此反复,直至激发波长和发射波长对应不再变化,此时的激发波长即为最佳激发波长。随后将比色皿中的溶液倒回对应烧杯中,向烧杯a,b中分别逐渐加入等量的DNA溶液,每次加入后搅拌5min,然后测定配合物溶液的紫外-可见光谱和荧光发射光谱,直至光谱不再变化为止。紫外-可见光谱和荧光光谱RNA滴定实验也是按照与上述同样的过程进行的。
如图1所示,DNA的加入引起配合物紫外可见光谱明显的变化,表明二者具有较强的相互作用。配合物在276nm处的尖锐的吸收峰主要是由配体内和配体间的π→π*跃迁的共同作用引起的,350nm-500nm之间的宽带吸收则属于1MLCT跃迁峰,是由电子从中心金属原子Ru的d轨道向主配体Hcdpq的π*轨道跃迁引起的。当向配合物溶液中逐渐加入DNA后,这两个吸收峰处的吸光度均明显减小,但吸收峰位基本不变。当达到键合饱和时([DNA]/[Ru]=2.125),276nm和460nm处的减色率H%(H%=(Abound-Afree)/Abound)×100%)分别为57.6%和52%。值得一提的是,[Ru(DIP)2(cdpq)]+与DNA发生相互作用后紫外-可见光谱的减色效应明显,而同系列的配合物[Ru(bpy)2(cdpq)]+和[Ru(phen)2(cdpq)]+的紫外-可见光谱随DNA浓度增加均不发生明显的变化[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.]。对比配合物的研究结果表明,表明配合物均可能以沟面键合模式与DNA相互作用的。[Ru(DIP)2(cdpq)]+所表现出的明显的减色效应甚至大于一些以嵌入模式键合DNA的配合物。以嵌入方式与DNA作用的配合物,嵌入配体与DNA碱基对之间产生π─π堆积作用,配体的π*轨道和碱基对的π轨道存在偶合作用,偶合后π*轨道还会部分填充电子,使以配体为中心的π→π*跃迁和金属中心向配体的电荷转移跃迁(MLCT)的能级差和跃迁几率都有所减小,容易表现出紫外-可见光谱吸收峰的红移和减色。但是也有一些以沟面模式或部分嵌入模式与DNA键合的配合物表现出明显的吸收光谱的减色现象,所以[Ru(DIP)2(cdpq)]+的减色效应仅能说明其不是以静电模式与DNA键合,可能以沟面或嵌入模式键合DNA。为进一步求得配合物与DNA的键合强度,可下式计算配合物与DNA作用的键合常数。
上式中,[DNA]表示溶液中加入的DNA的溶度,εa,εf,εb,分别表示滴定过程中每次加入DNA后测定紫外-可见光谱得到的同一波长下的摩尔消光系数(ε=A/(bc)),未与DNA键合的Ru(II)配合物的摩尔消光系数,Ru(II)配合物完全与DNA键合后的摩尔消光系数,Kb为键合常数。如图1的内插图所示以[DNA]为横坐标、[DNA]/(εa-εf)为纵坐标作图,拟合一条直线,直线的斜率和截距的比值即为键合常数Kb。用直线方法拟合得到[Ru(DIP)2(cdpq)]+与DNA的表观键合常数Kb=(2.39±0.20)×105M-1,比[Ru(phen)2(cdpq)]+的DNA键合常数都大。
图2所示为[Ru(DIP)2(cdpq)]+在水溶液中与DNA作用前后的荧光光谱变化。[Ru(DIP)2(cdpq)]+的水溶液在618nm处出现荧光发射峰,该峰是由处于激发态3MLCT的配合物向基态的辐射跃迁产生的。随着DNA溶液的加入,配合物的荧光发射强度逐渐增加,当[Ru]/[DNA]=5.6时,配合物的荧光增长基本趋于稳定,因此,[Ru(DIP)2(cdpq)]+对DNA有荧光开关响应。图2中的插图是荧光强度随[Ru(DIP)2(cdpq)]+浓度增加的变化,当配合物与DNA达到键合饱和时,配合物的荧光强度约是未加DNA时的4倍,发射峰位蓝移了7nm。Ru(II)配合物对DNA的荧光增强响应可应用于DNA的定量荧光检测,由图3(a)得到[Ru(DIP)2(cdpq)]+对DNA的荧光响应的工作曲线方程为I=43.7996+1.1096×107[DNA],斜率为1.1096×107M-1,根据3σ/K法计算得到[Ru(DIP)2(cdpq)]+对DNA的荧光检出限为0.6μM。由图3(b)得到[Ru(phen)2(cdpq)]+对DNA的荧光响应的工作曲线方程为I=5.7624+6.1055×105[DNA],斜率为6.1055×105M-1,根据3σ/K法计算得到[Ru(phen)2(cdpq)]+对DNA的荧光检出限为1.3μM。可见尽管[Ru(DIP)2(cdpq)]+键合DNA后的荧光增强幅度比[Ru(phen)2(cdpq)]+小很多,但其在DNA的定量荧光检测方面比[Ru(phen)2(cdpq)]+更有优势,灵敏度更高,这得益于[Ru(DIP)2(cdpq)]+与DNA的键合强度大。
图4所示为[Ru(DIP)2(cdpq)]+的荧光光谱随RNA浓度增加的变化。荧光光谱RNA滴定的结果与DNA有着很大的不同,配合物溶液的荧光随着DNA的加入有明显的增强,但随着RNA的加入却无明显变化,图5中的插图将配合物的荧光强度随DNA或RNA浓度增加的变化进行了对比。可见配合物仅对DNA有荧光开关的响应,表明配合物对DNA和RNA的不同荧光响应可用于DNA和RNA的选择性识别。而而经典的DNA光开关[Ru(phen)2(dppz)]2+与RNA键合后的荧光增强因子可高达16.8。
实施例3:pH滴定实验
配制Britton-Robinson缓冲溶液(0.04M H3BO3,0.04M H3PO3,0.04M CH3COOH),为保持一定的离子强度,向缓冲溶液中加入NaCl使其浓度为0.1M。向20mLBritton-Robinson缓冲溶液中加入一定量的1mM的[Ru(DIP)2(Hcdpq)](ClO4)2的乙腈溶液,使溶液的吸光度处于测量紫外-可见光谱的合适范围内。参比溶液根据待测配合物溶液中乙腈和Britton-Robinson溶液的体积比配置。将待测配合物溶液平均分为两份,一份用封口毛细管点蘸浓硫酸调节pH从2到0.2,另一份用饱和氢氧化钠溶液调节pH从2-12,调节过程中每隔0.2个pH测定一次溶液的紫外-可见吸收光谱和荧光光谱。
图5为随着pH的改变配合物[Ru(DIP)2(Hcdpq)](ClO4)2的荧光光谱图的变化。当配合物处于pH<2的强酸性溶液环境时,溶液几乎没有明显的发光现象,当溶液的pH>2时,溶液的荧光开始随着pH的增大出现大幅度的增长,约到pH=6.8时,荧光增长趋于稳定,此后pH的增大不再引起荧光的明显变化,溶液在荧光增长的过程中没有出现明显的发射峰位变化。这种荧光从无到有的变化是配体Hcdpq上的羧基的去质子化过程引起的,同时说明dpq杂环上的氮原子在实验pH范围内并没有发生质子化或去质子化作用。当溶液的荧光增长到几乎不再变化时,荧光强度约为最初的27倍,可见配合物表现出较好的off-on型pH光开关性能。通过对610nm处荧光强度随pH变化(见图5的插图)进行Sigmoidal曲线拟合,得到[Ru(DIP)2(Hcdpq)](ClO4)2的表观电离常数pKa=3.12±0.05。由图5的插图可知,在pH2.0-5.0间,配合物的发光强度随pH的增大而线性增大,根据此工作曲线,可测定水溶液的pH,较配合物[Ru(phen)2(Hcdpq)](ClO4)2测定的pH范围(pH 2.0-4.0)宽和敏感[Zhang,A.G.;Zhang,Y.Z.;Duan,Z.M.;Wang,K.Z.;Wei,H.B.;Bian,Z.Q.;Huang,C.H.Inorg.Chem.2011,50,6425.]。根据上述工作曲线,测定的调制的小月河水样中的pH4.55,与pHS3型酸度计测量值4.61吻合很好。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种荔枝多糖铁配合物的制备方法
- 一种含4,4’-二溴-2,2’-联吡啶的新型钌配合物的制备方法及其抗肿瘤活性的制作方法
- 一种羰基锝-99m标记的美法仑配合物及其制备方法与用图
- 一种锝-99m标记的美法仑配合物及其制备方法与用图
- Ru配合物Ru(bpy)<sub>3</sub>(NH<sub>2</sub>)<sub>2</sub>与石墨烯量子相结合的方法
- 1,4-二甲基-2,5-二-1h-1,2,4-双三唑二维铜配合物单晶与应用
- 1,4-二甲基-2,5-二-1h-双三唑均苯四酸钴配合物单晶与应用
- 一种含双氮配体低价金属铑(Ⅰ)的环辛二烯配合物及其制备方法
- 1,4-二甲基-2,5-二-1h-双三唑三维铜配合物单晶与应用
- 一种2-羰基-3-苯基丙酸苯甲酰腙二(2,4-二氯苄基)锡配合物及其制备方法和应用