锂离子电池的制作方法
本公开大体上涉及锂离子电池。
背景技术:
二次或可充电锂离子电池用于许多固定和便携式装置中,例如在消费性电子产品、汽车和航空工业中遇到的那些装置。锂离子类电池由于以下种种原因而受到欢迎,包括:相对较高的能量密度,当与其他种类的可充电电池相比时普遍缺乏任何记忆效应,相对低的内阻,以及在未使用时相对低的自放电速率。锂电池在其有用的寿命期间经历重复的充电放电循环的能力使得其成为有吸引力且可靠的电能来源。
技术实现要素:
锂离子电池包括正极、负极以及浸泡在电解质溶液中的纳米多孔或微孔聚合物隔膜,正极包括粘合剂材料,负极包括粘合剂材料,纳米多孔或微孔聚合物隔膜操作性地设置在正极与负极之间。一种或多种螯合剂被包含在电池中,以足以不影响在锂离子电池工作期间锂离子在纳米多孔或微孔聚合物隔膜上的移动的方式来与过渡金属离子络合。螯合剂为以下至少一种:溶解在电解质溶液中;接枝到纳米多孔或微孔聚合物隔膜的聚合物上作为取代侧基;操作性地设置在隔膜的孔内;附接到负极的粘合剂材料;附接到正极的粘合剂材料;涂覆在隔膜表面上;涂覆在负极的表面上;以及涂覆在正极的表面上。螯合剂选自:分子形式的离子阱,其选自由聚胺、硫醇以及有机酸的碱金属盐组成的组;有机酸的碱金属盐官能化的聚合物;含氮化学基团官能化的聚合物;以及两种或两种以上官能团官能化的聚合物。
附图说明
本公开的实例的特征将通过参考以下详细描述和附图而变得显而易见,其中相同的附图标记对应于类似(尽管可能不相同)的部件。为了简洁性,可能结合或不结合先前所述功能出现的其他附图来描述具有先前所述功能的附图标记或特征。
图1是多孔隔膜的一个实例的示意性横截面图,该多孔隔膜由本文所公开的高分子螯合剂的一个实例形成;
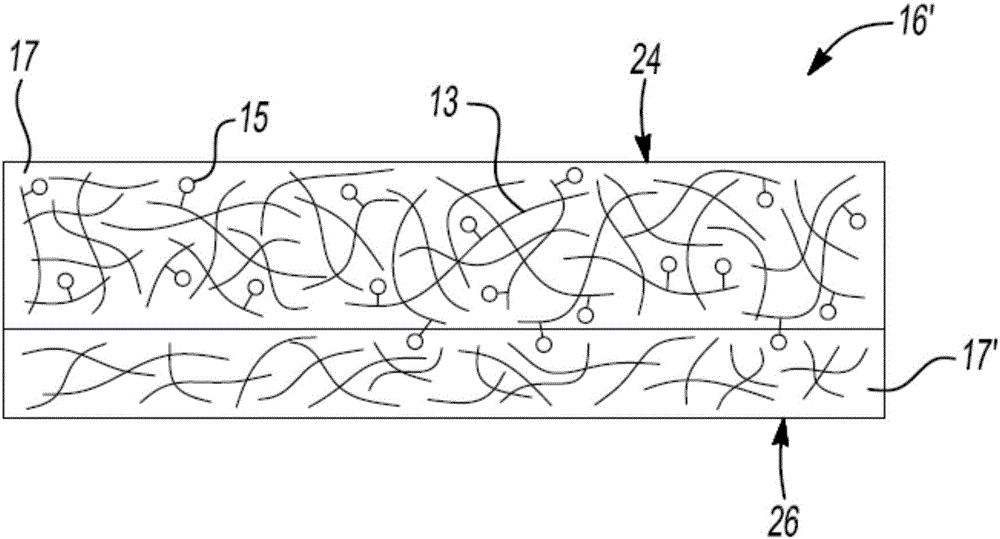
图2是多孔隔膜的一个实例的示意性横截面图,该多孔隔膜包括涂覆有本文所公开的高分子螯合剂的一个实例的多孔薄膜的多孔膜;
图3是正极的一个实例的示意性横截面图,该正极包括涂覆有本文所公开的高分子螯合剂的一个实例的多孔薄膜的结构;
图4是在放电状态时的锂离子电池的一个实例的示意性立体图,其中该电池的多孔隔膜包括本文所公开的螯合剂的一个实例;
图5是放电状态时的锂离子电池的另一实例的示意性立体图,其中电池的隔膜包括涂覆有本文所公开的高分子螯合剂的一个实例的多孔薄膜的多孔膜;
图6是在放电状态时的锂离子电池的又一实例的示意性立体图,其中电池的电极包括涂覆有本文所公开的高分子螯合剂的一个实例的多孔薄膜的结构;
图7a至7d是示出比放电容量(以mah/g计,左侧y轴)和法拉第效率(库伦效率或“电流效率”)(右侧y轴)作为在c/5速率、30℃(图7a和7c)和55℃(图7b和7d)温度下的循环期间lmo-li(图7a和7b)和lmo-石墨(图7c和7d)纽扣电池的循环数(x轴)的函数的曲线图,该纽扣电池含有功能性和基准隔膜,插图中的直方图示出了100个循环之后在负极上发现的以ppm计的锰量(归一化成lmo的质量,即每毫克lmo的微克mn);
图8是示出针对处于初始状态和来自循环电池的功能性隔膜的对照性ftir光谱(以任意单位计的透射率与以cm-1计的波数)的曲线图;
图9a和9b是示出比放电容量(以mah/g计,左侧y轴)和法拉第电流效率(库仑效率)(右侧y轴)作为在c/5速率下、在30℃(图9a)和55℃(图9b)温度下的循环期间lmo-li钮扣电池的循环数(x轴)的函数的曲线图,该钮扣电池含有在碳酸亚乙酯(ec)和碳酸二甲酯(dmc)中的1.0m(1:1v/v)六氟磷酸锂(lipf6)电解质溶液(1.0mlipf6ec/dmc),并含有普通聚烯烃隔膜和包含本文所公开的螯合剂的实例的隔膜,插图中的直方图示出了30天后在负极上发现的以ppm计的锰量(归一化为lmo质量,即,每毫克lmo的微克mn);
图10a和10b是示出比放电容量(以mah/g计,左侧y轴)和法拉第电流效率(库仑效率)(右侧y轴)作为在c/5速率下、在30℃(图10a)和55℃温度下(图10b)的循环期间lmo-石墨钮扣电池的循环数(x轴)的函数的曲线图,该lmo-石墨钮扣电池含有1m(1:1v/v)的lipf6ec/dmc电解质溶液,以及含有普通聚烯烃隔膜和包含本文所公开的螯合剂的实例的隔膜,插图中的直方图示出了30天后在负极上发现的以ppm计的锰量(归一化为lmo质量);
图11a和11b是其中纳入p(e-alt-mali2)的官能分隔部的扫描电子显微镜(sem)图像——表面形态,插图中为代表性的能量分散型x射线光谱(edx)曲线(图11a),以及横截面形态(图11b);以及
图12是示出在al-li电池中记录的线性扫描伏安图的曲线图,该al-li电池具有实例制造的功能性隔膜和商购的聚丙烯(celgard2500)基准隔膜。
图4至图6中所示的隔膜用于示出离子在相应锂离子电池的负极与正极之间的流动,因此不一定是按比例绘制的。
具体实施方式
锂离子电池通常通过在负极(有时称作阳极)与正极(有时称作阴极)之间可逆地传递锂离子而工作。负极和正极位于多孔聚合物隔膜的相对侧上,该多孔聚合物隔膜用适合传导锂离子的电解质溶液浸泡。负极和正极中的每一个还操作性地与其各自的集流器相关联或由其各自的集流器支撑。与两个电极相关联的集流器例如通过接头而连接到可中断的外部电路,该电路允许电流在电极之间通过电平衡锂离子的相关迁移。此外,负极可包括锂插层基质材料,正极可包括能在比负极的插层基质材料更高的电位来储存锂离子的锂基活性材料。电解质溶液可含有溶解在非质子非水溶剂中的锂盐。
已经发现,锂离子电池受到来自正极的过渡金属阳离子溶解的不利影响,这导致加速容量衰减,并因此导致电池耐久性的损失。过渡金属阳离子从电池的正极迁移到负极,从而导致其“中毒”。在一个实例中,石墨电极由于从正极的尖晶石lixmn2o4活性材料溶解出的mn+2、mn+3或mn+4阳离子而中毒。例如,mn+2阳离子可迁移通过电池电解质,并沉积到石墨电极上。当沉积到石墨上时,mn+2阳离子可变成mn金属。已经表明,相对少量(例如,90ppm)的mn金属可使石墨电极中毒并阻止可逆电极工作,从而不利地影响电池的有用寿命。沉积在负极的mn的不利效应在电池暴露于高于室温的温度(例如,40℃以上)时显著增强,而不管该暴露是仅在存储过程中(即,简单地处于某一充电状态中的开路电压),还是在电池工作期间(即,充电期间、放电期间或充电-放电循环期间)发生。
通过将本文公开的螯合剂的实例掺入到电池中,可以减少或防止锂离子电池由于从正极溶解出的过渡金属的中毒。单独或被束缚到聚合或陶瓷材料的螯合剂与从锂离子电池的正极浸出的过渡金属阳离子络合并捕集该过渡金属阳离子(例如mn阳离子),从而防止它们迁移到负极以及相关联的电池性能退化。任何可被螯合剂的实例捕集的过渡金属阳离子包括例如以下金属的阳离子:锰(例如,mn+2、mn+3、mn+4)、铁(例如,fe2+、fe3+)、铬(例如,cr2+、cr3+)、钴(例如,co2+、co3+)、镍(例如,ni2+、ni3+、ni4+)和/或钒(例如,v3+、v4+、v5+)。
在有些情况下,有些先前确定的过渡金属阳离子螯合/捕集材料可能相当昂贵。本公开的实例提出了较为便宜的新材料,同时表现良好以防止过渡金属阳离子迁移到负极。
本文所公开的螯合剂的实例可以是以下各项中的任一者或组合:溶解或分散在电解质溶液中;接枝到/被束缚到纳米多孔或微孔隔膜的材料(例如,作为接枝到隔膜中或隔膜的聚合材料或陶瓷材料上的取代侧基);附接到负极的粘合剂材料;附接到正极的粘合剂材料;设置在隔膜的开放孔内;涂覆在隔膜的表面上;涂覆在负极的表面上;和/或涂覆在正极的表面上。
合适的螯合剂包括金属离子载体,如本文所使用的,该金属离子载体为结合到特定离子(例如,mn+2或其他过渡金属阳离子)而同时允许锂离子通过的化合物。在电池内部,螯合剂有效地捕集不需要的金属阳离子,同时在电池的工作期间,锂离子跨越纳米多孔或微孔隔膜的移动不受影响。在实例中,螯合剂选择性地与不需要的金属阳离子络合,例如通过固定可能从正极溶解进入电解质溶液中的金属阳离子(例如,co+2、fe+2、mn+2等)。螯合剂因此用作捕集并固定不需要的金属阳离子的金属阳离子清除剂,从而阻止金属阳离子通过电解质溶液并到达负极的迁移。应理解,螯合剂与锂离子络合不太强(例如,与锰阳离子相比,每一百个位点中有单个捕集位点被li+阳离子占据),因此不会不利地影响锂离子在负极与正极之间的移动。
图1至3示出了本文公开的高分子螯合剂的不同实例。
在图1中,高分子螯合剂形成锂离子电池隔膜16。在此实例中,隔膜16本身是高分子螯合剂的多孔薄膜。在图1中,聚合物主链由附图标记13表示,键合到该聚合物主链的螯合剂由附图标记15表示,薄膜中的孔由附图标记17表示。
如图1所示,隔膜16的此实例具有形成于整个聚合物主链13的孔17。螯合剂15附接到聚合物主链13。在此实例中,键合的螯合剂15是隔膜基质的一部分,且可存在于开放的孔17内部。在本公开的实例中,还可以使用游离的(分子)螯合剂15(即,未键合到聚合物)或高分子螯合剂,例如作为隔膜基质内的填充剂材料和/或操作性地设置在隔膜16的孔17内(例如,作为隔膜16的孔17内部的微珠(与隔膜基质分开))。
在另一实例中,游离的(分子)螯合剂15还可溶解或分散在电解质溶液中。
现参看图2,高分子螯合剂呈纳米多孔或微孔膜26上的涂层24的形式。涂层24与纳米多孔或微孔膜26共同形成锂离子电池隔膜16’的另一实例。由于涂层24在纳米多孔或微孔膜26的表面上形成,所以在有些情况下,高分子螯合剂中有些可迁移到纳米多孔或微孔膜26的孔17′中。
高分子螯合剂可如图1所示而形成,包括附接到聚合物主链13的螯合剂15。所得涂层24还包括孔17。在用高分子螯合剂涂覆膜26的实例中,高分子螯合剂可悬浮在四氢呋喃中,此悬浮液可沉积在膜26上或在以其他方式暴露于膜26。例如,可将悬浮液的湿润薄膜涂施到膜26。
合适的纳米多孔或微孔膜26的实例包括聚烯烃。作为实例,聚烯烃可以是聚乙烯(pe)、聚丙烯(pp)、pe和pp的共混物、或者多层结构的pe和/或pp多孔薄膜。市场上可购得的聚烯烃多孔膜26包括可从celgardllc公司购得的
在另一实例中,纳米多孔或微孔膜26可由选自以下的另一聚合物形成:聚对苯二甲酸乙二酯(pet)、聚偏二氟乙烯(pvdf)、聚酰胺(尼龙)、聚氨基甲酸酯、聚碳酸酯、聚酯、聚醚醚酮(peek)、聚醚砜(pes)、聚酰亚胺(pi)、聚酰胺-酰亚胺、聚醚、聚甲醛(例如,乙缩醛)、聚对苯二甲酸丁二酯、聚环烷酸乙二酯、聚丁烯、聚甲基戊烯、聚烯烃共聚物、丙烯腈-丁二烯苯乙烯共聚物(abs)、聚苯乙烯共聚物、聚甲基丙烯酸甲酯(pmma)、聚硅氧烷聚合物(例如聚二甲基硅氧烷(pdms))、聚苯并咪唑(pbi)、聚苯并恶唑(pbo)、聚亚苯基类(例如,parmaxtm(密西西比州聚合物技术有限公司,贝圣路易斯,密西西比州))、聚亚芳基醚酮、聚全氟环丁烷、聚偏二氟乙烯共聚物(例如,pvdf-六氟丙烯(pvdf-hfp))以及聚偏二氟乙烯三聚物、聚氟乙烯、液晶聚合物(例如,vectrantm(赫斯特公司,德国)和
纳米多孔或微孔膜26可以含有由干式或湿式工艺制造的单层或多层层合物,该层合物通过溶剂浇铸、通过非织物纤维铺设工艺,或通过用于使纳米多孔或微孔膜26具有适于应用于锂离子电池的性能的任何其他工艺来制造。例如,在一个实例中,单层聚烯烃可构成膜26的整体。在另一实例中,可以形成膜26的聚合物之一或聚合物中任意的组合的单层(例如,上文针对膜26列举的聚烯烃和/或其他聚合物中的一种或多种)可以构成膜26的整体。然而,作为另一实例,可将用于膜26的类似或不同的聚烯烃和/或聚合物的多个离散层组装成膜26。在一个实例中,可将聚合物中的一种或多种的离散层涂覆在用于膜26的聚烯烃的离散层上。此外,膜26中可以进一步包含聚烯烃(和/或其他聚合物)层和任何其他任选聚合物层作为纤维层,以帮助为膜26提供适当的结构和多孔特性。可在p.arora和z.zhang的《电池隔膜》(化学综述,104,44244427(2004))中发现单层和多层锂离子电池隔膜以及可用于制造隔膜的干式和湿式工艺的较全面论述。
还有其他合适的纳米多孔或微孔膜26包括具有陶瓷层附接的膜、在聚合物基质(即,有机-无机复合基质)中具有陶瓷填充剂的膜以及由陶瓷材料形成的膜。合适的陶瓷材料的一些实例包括氧化铝(al2o3)和二氧化硅(sio2)。
现参看图3,高分子螯合剂呈结构25上的涂层24的形式。涂层24和结构25共同形成正极14′的实例。涂层24也可位于或者替代地位于负极12上,例如,如图6中的虚线所示。虽然在图6中未示出,当应当理解,整个负极12可封装在涂层24中。
如上文所提及的,高分子螯合剂包括附接到聚合物主链13的螯合剂15。所得涂层24还包括孔17。在用高分子螯合剂涂覆结构25的实例中,高分子螯合剂可悬浮在四氢呋喃中,且此悬浮液可以沉积在或以其他方式暴露于至少结构25的表面上,该结构25将要定位成邻近锂离子电池中的纳米多孔或微孔膜26(图3中未示出)。虽然在图3中未示出,但应当理解,整个结构25可封装在涂层24中。
结构25包括锂过渡金属基活性材料19、导电碳21和粘合剂23。应当理解,可以使用任何能充分经受锂插层和脱插层同时用作锂离子电池的正极端子的基于锂过渡金属的活性材料19。活性材料19的实例包括以下中的至少一种:尖晶石氧化锰锂(limn2o4,又名lmo)、锂钴氧化物(licoo2,又名lco)、锰-镍-氧化物尖晶石[li(mn1.5ni0.5)o2](又名lnmo)、层状锂镍锰钴氧化物[li(ni1-xmn1-ycox+y)o2](又名nmc)、linio2、li2msio4(m=co、fe、mn)、锂铁聚阴离子氧化物(例如磷酸铁锂(lifepo4)或氟磷酸铁锂(li2fepo4f)),或者富锂层结构阴极(例如,xli2mno3-(1-x)limo2,m由任意比例的ni、mn和co构成)。还可利用其他的锂基活性材料,例如lini1-xco1-ymx+yo2、limn1.5-xni0.5-ymx+yo4(m由任意比例的al、cr、ti和/或mg构成)、稳定的锂锰氧化物尖晶石(lixmn2-ymyo4,其中m由任意比例的al、cr、ti和/或mg构成)、锂钒氧化物(liv2o5)、li2msio4(m由任意比例的co、fe和/或mn构成)、xli2mno3-(1-x)limo2(m由任意比例的ni、mn和/或co构成),以及任何其他镍-锰-钴材料。“任何比例”意指任何元素可以以任意的量存在。因此,在一些实例中,m可以是ni,有或没有co和/或mn,或所列元素的任意其他组合。在另一实例中,可在锂过渡金属基活性材料的任何实例的晶格中产生阴离子取代基以使晶体结构稳定。例如,任何o原子可用f原子来取代。
结构25的导电碳21可以是任何与锂过渡金属基活性材料19混合的高表面积碳,例如乙炔黑。本文使用的“高表面积碳”意指包括具有50到2,000m2/g范围内的bet(bet=brunauer-emmett-teller)表面积的任何碳。可以添加导电碳21以便确保锂离子电池的集流器与正极14′的活性材料粒子19之间的电子传导。导电碳21还可以是单壁(sw)和多壁(mw)的碳纳米管,以约0.02重量%到约1重量%范围内的量存在。
在实例中,如图3中虚线所示,螯合剂15可附接到正极14’的粘合剂23。应当理解,螯合剂15还可以或替代地附接到负极12的粘合剂23(如图4中虚线所示)。
结构25(或负极12)的粘合剂23可以是能够在结构上将锂基活性材料19保持在一起的任何高分子粘合剂。粘合剂23的一些实例包括聚偏二氟乙烯(pvdf)、乙烯丙烯二烯单体(epdm)橡胶、羧甲基纤维素(cmc)、聚丙烯酸锂(lipaa)、聚丙烯酸钠(napaa)、藻酸钠和/或藻酸锂。在实例中,lipaa和na/li藻酸盐可理想地用于高压(5v)正极材料中。
图4至6示出掺入本文公开的高分子螯合剂的不同实例的锂离子电池10、10′、10″的不同实例。电池10、10′、10″大体上包括负极12、负极侧集流器12a、正极14、正极侧集流器14a以及定位在负极12与正极14之间的隔膜16、16’或26。应当理解,隔膜16、16’、26和/或正极14和/或负极12可以包括螯合剂15和涂覆在其上的聚合物主链13。锂离子电池10、10’、10″的每一实例还包括连接负极12与正极14的可中断外部电路18。
现参看图4,锂离子电池10包括图1所示设置在负极12与正极14之间的隔膜16。如上所述,隔膜16由高分子螯合剂的实例形成。用作含电解质溶液的海绵和电绝缘体的隔膜16夹在负极12与正极14之间,以防止两个电极12、14之间的物理接触以及短路的出现。隔膜16除了提供两电极12、14之间的物理屏障之外,还确保锂离子(在图4中用黑点和具有(+)电荷的开口圆标示)和相关阴离子(在图4中用具有(-)电荷的开口圆标示)通过填充其孔的电解质溶液。存在于隔膜16的基质中的螯合剂15还有效地捕集和固定不需要的金属阳离子(例如,mn2+),以便阻止这些金属阳离子迁移通过电解质溶液并到达负极12。在另一实例中,螯合剂15(未被束缚到聚合物)可以溶解或分散在电解质溶液中。下文进一步列出呈分子形式的螯合剂的一些实例(其中一个实例为乙二胺四乙酸的四钠盐(edtana4))。
负极12可以包括任何能够充分地经受锂插层和脱插层同时用作锂离子电池10的负极端子的锂主体活性材料。锂主体活性材料的实例包括石墨或低表面积的无定形碳。石墨被广泛用于形成负极12,因为它表现出了良好的锂插层和脱插层特性,同时具有相对不活泼,而且还可以以产生相对高的能量密度的量来存储锂。例如,可以用于制造负极12的商用形式的石墨可以从timcalgraphite&carbon(瑞士博迪奥市)、lonzagroup(瑞士巴塞尔市)或superiorgraphite(伊利诺伊州芝加哥市)获得。也可以使用其他的材料来形成负极,包括例如钛酸锂(lto)、硅或硅碳复合物以及氧化锡。
负极12还可以包括与锂主体活性材料混合的聚合物粘合剂材料23,以便在结构上将锂主体活性材料保持在一起。粘合剂的一些实例包括聚偏二氟乙烯(pvdf)、乙烯丙烯二烯单体(epdm)橡胶、羧甲基纤维素(cmc)、藻酸钠或藻酸锂。这些材料(即锂主体活性材料和粘合剂)可以与高表面积碳(例如乙炔黑)混合,以便确保在负极12的集流器(图4中示出为12a)和活性材料粒子之间的电子传导。负极侧集流器12a可以由铜或本领域技术人员熟知的任意其他合适的电导性材料形成。
本实例的锂离子电池10中的正极14与前面结合图3描述的结构25类似。简言之,正极14可以包括前述的锂过渡金属基活性材料19、导电碳21以及粘合剂23中的任意一种。
与正极14相邻的是正极侧集流器14a,其可以由铝或本领域技术人员熟知的任意其他合适的电导性材料形成。
负极侧集流器12a和正极侧集流器14a可以定位成分别与负极12和正极14接触,以便收集和移动流向和来自可中断外部电路18的自由电子,该电路连接负极12和正极14。
在一个实例中,负极12、正极14和多孔隔膜16中的每一个都浸泡在电解质溶液中。应当理解,任何能够在负极12和正极14之间传导锂离子的适当的电解质溶液都可以在锂离子电池10中使用。在一个实例中,电解质溶液可以是非水性液体电解质溶液,其包括溶解于有机溶剂或有机溶剂混合物中的锂盐。本领域技术人员熟知可以用在锂离子电池10中的多种非水性液体电解质溶液,也熟知如何制造它们或者通过商业途径得到它们。可以溶解于有机溶剂以形成非水性液体电解质溶液的锂盐的实例包括liclo4、lialcl4、lii、libr、liscn、libf4、lib(c6h5)4、licf3so3、lin(cf3so2)2(litfsi)、lin(fso2)2(lifsi)、liasf6、lipf6、lib(c2o4)2(libob)、libf2(c2o4)(liodfb)、lipf4(c2o4)(lifop)、lino3,以及它们的混合物。这些以及其他类似的锂盐可以溶解于多种有机溶剂,例如环状碳酸酯(碳酸亚乙酯、碳酸异丙烯酯、碳酸亚丁酯、碳酸氟亚乙酯)、线性碳酸酯(碳酸二甲酯、碳酸二乙酯、碳酸甲乙酯)、脂族羧酸酯(甲酸甲酯、乙酸甲酯、丙酸甲酯)、γ-内酯(γ-丁内酯、γ-戊内酯)、链状醚(1,2-二甲氧基乙烷、1,2-二乙氧基乙烷、乙氧基甲氧基乙烷)、环状醚(四氢呋喃、2-甲基四氢呋喃),以及它们的混合物。
电解质溶液还可以包括多种添加剂,例如溶剂和/或作为溶液次要组分的盐类。示例性的添加剂包括二(草酸根合)硼酸锂(libob)、二氟草酸硼酸锂(lidfob)、碳酸亚乙烯酯、碳酸单氟亚乙酯、丙磺酸内酯、2-丙炔-醇-甲磺酸酯、二氟乙酸甲酯、丁二酸酐、马来酸酐、己二腈、联苯、邻三联苯、联苄、二苯醚、n-甲基吡咯、呋喃、噻吩、3,4-亚乙基二氧基噻吩、2,5-二氢呋喃、三六氟异丙基磷酸酯、三羟基苯、四甲氧基钛等。尽管本发明已经给出了一些实例,但是应当理解,也可以使用其他添加剂。当包含有添加剂时,这些添加剂可以构成电解质溶液的组合物的约0.05%至约5%。
可以使用其他电解质替代电解质溶液。作为实例,可以使用聚合物电解质、离子液体、熔融电解质等。一些离子液体的特定实例包括1-乙基-3-甲基咪唑双(氟代磺酰基)酰亚胺、1-乙基-3-甲基咪唑双(三氟甲烷磺酰基)酰亚胺、双(三氟甲烷磺酰基)酰亚胺鏻、双(氟代磺酰基)酰亚胺鏻、三乙基(甲氧基甲基)鏻双(三氟甲基磺酰基)酰亚胺、三乙基(2-甲氧基乙基)鏻以及双(三氟甲基磺酰基)酰亚胺。熔融电解质的一些实例包括二甲基甲烷磺酰胺中的双(氟代磺酰基)酰亚胺锂以及二甲基甲烷磺酰胺中的双(三氟甲烷磺酰基)酰亚胺锂。尽管本文已经给出一些实例,但是应当理解,可以使用其他的聚合物电解质、离子液体以及低共熔熔融电解质。
锂离子电池10可以支持能够可操作地连接到外部电路18的负载设备22。当锂离子电池10放电时,负载设备22从通过外部电路18的电流接收电能供应。尽管负载设备22可以是任意数量的已知电动设备,但是,耗电负载设备的一些具体实例包括混合动力车或纯电动车的电机、笔记本电脑、手机以及无线电动工具。然而,负载设备22还可以是为了贮存能量而给锂离子电池10充电的发电装置。例如,风车和太阳电池板可变地和/或间歇地发电的趋势经常导致需要贮存多余的能量备用。
锂离子电池10还可以包括多种其他元件,尽管在此处没有描述,然而对于本领域技术人员来说却是已知的。例如,锂离子电池10可以包括外壳、垫圈、端子、极耳以及由于性能相关的目的或其他实际目的而可以置于负极12和正极14之间或周围的任何其他期望的元件或材料。此外,锂离子电池10的尺寸和形状,以及其主要部件的设计和化学组成可以根据其设计针对的特定应用而变化。例如,电池供电的汽车和手持消费电子设备是锂离子电池10最有可能被设计成具有不同尺寸、容量和电力输出规格的两种情形。锂离子电池10或多个锂离子电池还可以与其他类似的锂离子电池串联和/或并联连接,以产生更大的电压输出和电流(如果并联布置)或电压(如果串联布置),如果负载设备22如此需要的话。
锂离子电池10通常通过在负极12和正极14之间可逆地传递锂离子而工作。在完全充电状态下,电池10的电压处于最大值(通常在2.0v-5.0v范围内);而在完全放电状态下,电池10的电压处于最小值(通常在0v-2.0v范围内)。实质上,正极14和负极12中的活性材料的费米能级在电池工作期间发生变化,二者之间的差值(也称为电池电压)同样在变化。电池电压在放电期间随着费米能级彼此接近而减少。在充电期间,发生相反的过程,随着费米能级被分开,电池电压增加。在电池放电期间,外部负载设备22使得电流能以致使费米能级之间的差值(以及相应地,电池电压)减少的方向流入外部电路18。在电池充电期间发生相反的情形:电池充电器迫使电流以致使费米能级之间的差值(以及相应地,电池电压)增加的方向流入外部电路18。
在放电开始时,锂离子电池10的负极12含有高浓度的插层锂,而正极14相对耗尽。当负极12含有足够更高的相对含量的插层锂时,锂离子电池10可以通过当外部电路18闭合以连接负极12和正极14时发生的可逆电化学反应而产生有利的电流。在这种情形下,闭合外部电路的建立导致从负极12上提取出插层锂。当提取出的锂原子在负极-电解质界面处离开插层主体时,它们分裂成锂离子(以黑点和具有(+)电荷的开口圆标示)和电子(e-)。
正极14和负极12之间的化学势差(范围从约2.0v至5.0v,取决于电极14、12的精确化学组成)驱使在负极12处插层锂的氧化所产生的电子(e-)穿过外部电路18流向正极14。同样在负极12上产生的锂离子同时地被电解质溶液携带穿过多孔隔膜16移向正极14。流过外部电路18的电子(e-)以及迁移穿过电解质溶液中的隔膜16的锂离子最终在正极14处结合并形成插层锂。通过外部电路18的电流可以被控制并且引导穿过负载设备22,直到负极12中的插层锂的水平降至低于可工作水平或者电能需求消失。
通过向锂离子电池10施加外部电池充电器以使电池放电期间发生的电化学反应逆转,锂离子电池10可以在其可用容量部分或完全放电后随时进行充电或再充电。外部电源连接到锂离子电池10迫使在正极14上的锂过渡金属氧化物或磷酸盐发生其他方式的非自发氧化,从而产生电子并释放锂离子。通过外部电路18流回负极12的电子以及被电解质携带穿过多微孔聚合物隔膜16移向负极12的锂离子在负极12上重新结合,并且使用在下一个电池放电循环期间消耗的插层锂进行补充。
可以用来对锂离子电池10充电的外部电池充电器可以根据锂离子电池10的尺寸、结构以及特定最终用途而变化。一些合适的外部电池充电器包括插入到交流电源插座和机动车交流发电机中的电池充电器。
现参考图5,描绘了锂离子电池10'的另一实例。本实例包括图2中示出的设置在负极12和正极14之间的隔膜16'。如上所述,隔膜16'的膜26上的涂层24由高分子螯合剂的实例形成。
在本实例中,隔膜16'用作电绝缘体和机械支撑,被夹在负极12和正极14之间,以防止在两个电极12、14之间的物理接触以及短路的出现。隔膜16确保锂离子(在图5中用黑点和具有a(+)电荷的开口圆标示)和相关阴离子(在图5中用具有a(-)电荷的开口圆标示)通过填充其孔的电解质溶液。存在于隔膜16'的涂层24中的螯合剂15还有效地捕集和固定不需要的金属阳离子(例如mn2+),以便阻止这些金属阳离子迁移穿过电解质溶液和移向负极12。
其他部件(例如,电极12、14,集流器12a、14a,外部电路18、负载22等)以及电池10'的工作与本文前述有关电池10的部件和电池10的工作类似。
现参考图6,描绘了锂离子电池10”的又一实例。本实例包括图3中示出的正极14',布置成使得涂层24邻近于多孔膜26(在本实例中,其用作隔膜)的一侧。如上所述,正极14'的结构25上的涂层24由高分子螯合剂的实例形成。同样如上所述,涂层24也可以位于或者替代地位于负极12上,例如,如图6中的虚线所示。
在本实例中,膜26用作电绝缘体和机械支撑,被夹在负极12和正极14'之间,以防止在两个电极12、14'之间的物理接触以及短路的出现。膜26确保锂离子(在图6中用黑点和具有(+)电荷的开口圆标示)和相关阴离子(在图6中用具有(-)电荷的开口圆标示)通过填充其孔的电解质溶液。之前描述的膜26的任何实例都可以用在电池10”的本实例中。
如上所述,正极14'的涂层24位于膜26附近。在本实例中,存在于正极14'的涂层24中的螯合剂15有效地捕集和固定不需要的金属阳离子(例如mn2+),以便阻止这些金属阳离子迁移穿过膜26(电解质溶液)和移向负极12。
其他部件(例如,电极12,集流器12a、14a,外部电路18,负载22等)以及电池10”的工作与本文前述有关电池10的部件和电池10的工作类似。
本公开的实例提出了新材料,从而有效地捕集并固定不需要的金属阳离子,以防止/减少这些金属阳离子向负极12的迁移。根据本公开的螯合剂的实例选自:
1)分子形式的离子阱,其选自由以下组成的组:多胺、硫醇、有机酸的碱金属盐(有机酸的实例包括例如酚、醇、硫醇、羧酸和磺酸)及其组合;
2)用有机酸的碱金属盐官能化的聚合物;
3)用含氮官能团官能化的聚合物;以及
4)具有多个官能团的聚合物(所述聚合物的一些实例包括细菌素、壳聚糖、木质素等)。官能团的一些实例包括羧酸盐、胺、羟基等。类别2)~4)是本文所述的高分子螯合剂的实例。
下面描述每个类别的一些非限制性实例。应当理解,类别(1-4)的任何实例的锂、钠、钾和/或铯盐中的任何一者都可以用于本公开的螯合剂的实例中。此外,针对以下实例示出了许多(但不是全部)的化学结构。
1.分子形式的离子阱
1.1有机酸的碱金属(例如,li、na、k和cs中的任何一者或混合物)盐
1.1.1二齿(如本文所用,“-齿”是指可用于与不需要的过渡金属离子络合的酸性基团的数目;例如,“二齿”包括两个这样的酸性基团,“三齿”包括三个,等等。多齿是指包括二齿、三齿等)
亚氨基二乙酸二锂(li2ida)
亚氨基二乙酸二钠(na2ida)
1.1.2三齿
na3nta是另一实例
1.1.3四齿
li4bapta盐的iupac名称是1,2-双(邻氨基苯氧基)乙烷-n,n,n',n'-四乙酸的四锂盐
li4dota盐的iupac名称是1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸的四锂盐
乙二胺四乙酸的四锂盐(edtali4)
另一个四齿实例是乙二胺四乙酸的四钠盐(edtana4)。
li4egta(乙二醇-双-(2-氨基乙醚)-n,n,n',n'-四乙酸四锂盐)
1.1.4.五齿
三胺五乙酸五锂盐(li5dtpa)盐
1.1.5.六齿
li6tmpa
li6tmpa的iupac名称是三(亚甲基膦酸)六锂盐
葡萄糖酸六锂或六钠
1.1.6.八齿
乙二胺四甲基磷酸八锂(li8edtmp)
1.2聚胺
2,2'-双(亚水杨基氨基)偶氮苯
1.3硫醇
n,n'-双(2-巯基乙基)异酞酰胺(bdth2)
2.用有机酸的碱金属(li、na、k和/或cs)盐官能化的聚合物
p(e-alt-mali2)
聚(乙烯-交替-马来酸二锂盐)
聚(甲基乙烯基醚-交替-马来酸酯,锂盐)
聚乙烯-接枝-马来酸酯,锂盐
聚(1-十四碳烯-交替-马来酸酯,锂盐)
聚(1-十八碳烯-交替-马来酸酯,锂盐)
聚(苯乙烯-马来酸酯二钠盐)共聚物
聚(丙烯酸酯,锂盐-共-马来酸酯,锂盐)
聚苯乙烯-嵌段-聚(乙烯-无规-丁烯)-嵌段-聚苯乙烯-接枝-马来酸酯,锂盐
fura-2li盐
(idali2)用亚氨基二乙酸的二锂盐官能化的苯乙烯-二乙烯基苯共聚物
(idana2)用亚氨基二乙酸的二钠盐官能化的苯乙烯-二乙烯基苯共聚物
3.用氮官能团官能化的聚合物(胺和吡啶)
线性和支化聚乙烯亚胺(pea)(已示出),以及羧甲基化和羧乙基化聚乙烯亚胺
bpap(双-吡啶甲酰胺官能化聚合物)
聚酰胺胺(pamam)树枝状聚合物
4.具有多个官能团的聚合物
2-十二烷基-2-甲基-1,3-丙二基双[n-[5'-硝基(苯并-15-冠-5)-4'-基]氨基甲酸酯](胺加冠醚的实例)
壳聚糖(胺和羟基)
羧甲基化壳聚糖和羧乙基化壳聚糖也是具有多个官能团的聚合物的合适实例。
聚(马来酸酯,锂盐-交替-1-癸烯),3-(二甲基氨基)-1-丙胺衍生物
木质素
羧甲基化木质素和羧乙基化木质素也是合适的具有多个官能团的聚合物的实例。
细菌素:
2,3-二羟基苯甲酸
为了进一步说明本公开,本文给出了实施例。应当理解的是,这些实施例仅为说明性目的而提供,而不是解释为对本公开范围的限制。
实施例
引言
通过相转化过程将p(e-alt-mali2)阳离子螯合聚合物嵌入到聚(偏二氟乙烯-六氟丙烯)(或称为pvdf-hfp)基质中来制备新型多功能隔膜的实例。下面示出了它们的锰阳离子螯合能力、氧化极限以及表面和横截面形态的数据。还示出了在30℃以及55℃下具有1mlipf6/ec:dmc(1:1v/v)电解质溶液的lmo-li和lmo-石墨纽扣电池的循环数据,表明相比起具有普通隔膜的电池而言,具有本文所公开的功能性隔膜的实例的电池的容量维持率得到改善。
本发明的发明人表示,在循环测试期间,从lmo溶解到电解质溶液中的大多数锰离子被p(e-alt-mali2)的马来酸官能团所捕集,并且锂和石墨负极都经历了大大减少的锰污染。还表明,p(e-alt-mali2)材料具有多功能性,即其提供给lmo-石墨电池的改善的容量维持率不仅归因于锰阳离子捕集,还归因于质子清除(其通过酸侵蚀降低锰的总体溶解度)。除了通过功能性隔膜对锰离子和质子的螯合之外,隔膜还起着过量li+离子来源的作用。这有助于减少循环期间不可逆的li损失,从而增加电池的可逆容量。
实验
除非另有说明,否则所有商业材料在整个工作中均是在没有进行进一步纯化或改性的情况下使用,并且除非指定了另一个温度,否则所有工作均在室温(约25℃)下进行。
p(e-alt-mali2)材料的合成和表征
p(e-alt-mali2)的合成方案和螯合机制直接如下示出。
p(e-alt-mali2)的合成和螯合机制
p(e-alt-mali2)通过用lioh(sigmaaldrich,货号442410)对聚(乙烯-交替-马来酸酐)(sigmaaldrich,货号188050)进行水解而合成。将10克量的聚(乙烯-交替-马来酸酐)溶于100ml的双重蒸馏去离子(dd-di)水中,并在40℃下搅拌将近14小时,直至得到ph值为约7的澄清溶液。然后将该溶液在30℃持续搅拌下滴加到100ml的2mlioh水溶液中,同时监测其ph值。继续加入聚(乙烯-交替-马来酸)溶液,直至ph值达到7.5~8。然后,将得到的p(e-alt-mali2)溶液在-18℃下冷冻,之后在-80℃的温度下于<10mtorr的真空下进行冷冻干燥。通过研磨由冷冻干燥过程产生的固体块来制备精细的p(e-alt-mali2)粉末。使用配备有分辨率为2cm-1的geatr晶体的is50型号nicolet仪器,通过ftir光谱分析表征所得到的粉末以及聚(乙烯-交替-马来酸酐)前体。在1775cm-1处的峰(酸酐中的c=o基团)的消失以及在1550cm-1和1405cm-1处的两个峰(两者都与-cooli+基团有关)的存在证实了聚(乙烯-交替-马来酸酐)的完全水解。
功能性隔膜的制造
分别选择丙酮(99.5%,sigmaaldrich,货号320110)和干乙醇(99.8%,sigmaaldrich,货号32221)作为基质(“真”)溶剂和反溶剂,用于通过相转化制备功能性隔膜。将三克pvdf-hfp共聚物(苏威集团,货号21216)于35℃、持续搅拌3小时下溶解在81克的丙酮中。然后将干乙醇(10克)逐滴加入到搅拌的丙酮-共聚物溶液中,直至该溶液变得透明。将六克精细研磨的高分子螯合锂盐掺入到共聚物共混物中,并在室温下继续搅拌12小时。所得悬浮液中pvdf-hfp共聚物、螯合p(e-alt-mali2)聚合物填料、溶剂和反溶剂的优化质量组成分别为3%、6%、81%和10%。接下来,使用间隙为200μm的刮刀将共聚物-填料悬浮液浇铸到玻璃板上。溶剂混合物在空气中蒸发之后,将复合膜于80℃下真空干燥14小时。隔膜的干基质中共聚物与填料之间的质量比为1:2,对应于隔膜中约2mg·cm-2的p(e-alt-mali2)负载量。
测定锰离子的螯合能力
通过在1mlipf6/ec:dmc(1:1v/v)(ubeinc.)中分别溶解六水合高氯酸锰(ii)(99%纯度,阿法埃莎,货号359386)和二水合醋酸锰(iii)(纯度97%,sigmaaldrich,货号215880)来制备具有约15mmmn2+和约7.5mmmn3+浓度的储液。将50mg量的干螯合材料(原始pe-alt-li2粉末或功能性隔膜的碎片)引入到容纳在聚丙烯管中的5ml储备溶液中,将这些聚丙烯管密封并随后在装有氩气的手套箱内搅拌5天。然后借助在12000rpm下运转的超速离心机对固体和溶液加以分离。来自于每种上清液的0.1ml等分试样在双重蒸馏去离子(dd-di)水中稀释100倍,使用jobin-yvonhoriba公司的ultima2仪器通过电感耦合等离子体发射光谱法(icp-oes)测定它们的mn浓度。类似地,将0.1ml体积的储液在dd-di水中稀释100倍,以便用作icp-oes测量的参考溶液。然后,根据测试中总锰含量与参考溶液中总锰含量之间的差异,确定针对mn3+离子的螯合能力。
电极制造、电池组装和电化学测试
在这些实验中使用购自云南玉溪汇龙科技有限公司的锰酸锂(lmo)。通过用刮刀以100μm的间隙将混合物浆料涂布于铝集流体上,然后在120℃下真空干燥14小时,从而制备出复合正极,所述混合物由85wt%的锰酸锂、10wt%的作为导电填料的superpli导电碳黑(购自imersltd.)、5wt%的pvdf粘合剂(购自苏威公司)以及作为分散溶剂的n-甲基吡咯烷酮(nmp,购自sigmaaldrich)组成。按照类似的方式,即通过将浆料用刮刀涂布于铜集流体上来制备复合石墨负极,所述浆料由90wt%的石墨(购自smghitachiinc)、3wt%的superpli导电碳黑(购自imersltd.)、7wt%的pvdf粘合剂(购自苏威)以及作为分散溶剂的n-甲基吡咯烷酮(nmp,购自sigmaaldrich)组成。(复合电极与nmp的质量比为1:1)。电极的干燥按前文所述的进行。铝和铜集流体上的活性材料负载量分别约为10.8mgcm-2和4.5mgcm-2。在含1m的lipf6/ec:dmc(1:1w/w)电解质以及直径为1.4cm的电极的lmo/li和lmo/石墨这两种纽扣电池(加拿大国家研究委员会,型号为2325)中测试该实例功能性隔膜。将它们的性能与含基准隔膜的电池的性能进行比较。纽扣电池具有单层官能化隔膜或两层基准隔膜,以及几何面积为2.83cm2的电极(直径为1.93cm)。在湿度和氧水平<1ppm的条件下,于充满氩气的手套箱内组装电池。
在每次循环测试之前都使用arbin的bt2000型多通道电池测试系统在30℃下对各电池进行4次按c/10速率的化成循环。在化成(4次按c/10速率的循环)以及100次按c/5速率的循环之后、各电池拆解之前,用英国输力强仪器公司的1225型高频频率响应分析仪以及该公司的1287型电化学接口对电池进行电化学交流阻抗测量。以5mv的激励幅值、于100khz至10mhz的频率范围内,在放电状态中的开路电压(约3v)下采集阻抗谱。
在完成100次恒电流循环以及相应的后循环电化学交流阻抗测量之后,立即将所有电池都拆解以回收电极和充满电解质的隔膜用于进一步的分析。通过电感耦合等离子体发射光谱法(icp-oes)测定来自半电池和全电池的功能性隔膜以及负极中的mn量。用3m的盐酸从用过的隔膜洗脱出锰离子,然后在用dd水稀释100倍之后测量它们的浓度。用dmc清洗来自另一组锰lmo/石墨电池在电池拆解之后的隔膜并通过傅里叶变换红外线(ftir)对其表征。用dd-di水溶解来自lmo-li电池的锰污染锂电极,然后在事先不进行任何稀释的情况下通过icp-oes法测定溶液中的锰含量。将来自锰lmo-石墨电池的铜负载石墨负极溶解于王水(hcl:hno3=3:1)中。接着,用dd-di水将含锰等分试样稀释100倍,然后通过icp-oes法测定锰浓度。为了评定lmo材料在循环期间发生的任何结构变化,使用布鲁克公司(德国)的axsd8advance衍射计(其是具有θ–θ型反射几何结构、可进行铜靶kα辐射、接收狭缝为0.2mm的高分辨率能量-色散检测器)对自使用功能性以及基准隔膜两者的电池回收的正极进行x射线衍射(xrd),其中数据采集时间为0.5秒每步,步长为0.049°。最后,还使用尼高力is50型红外光谱仪采集原始状态的以及在高温循环测试之后自lmo-石墨电池回收以后的官能化隔膜的ftir光谱。
p(e-alt-mali2)型功能性隔膜的表征
粉末状的以及在掺入功能性隔膜中时p(e-alt-mali2)材料的mn3+阳离子螯合量分别为0.37mm·g-1和0.33mm·g-1;而对于mn2+阳离子,其相应数值分别为0.56mm·g-1和0.51mm·g-1。在嵌入隔膜中时,p(e-alt-mali2)材料的螯合量下降了约10%,这很可能是由于螯合基团被共聚物基质所阻断而造成的。
图11a和11b为功能性隔膜的扫描电子显微镜(sem)图像:(a)表面形态,在插图中示出了其典型的edx曲线,以及(b)断面形态。
图12中的曲线图示出了功能性以及基准隔膜的线性扫描伏安曲线。两隔膜都在相对于li/li+电压为5v处出现了氧化电流急剧增加的情况,这是由于铝集流体钝化以及电解质分解而造成的。因此,这些电压电流数据表示该功能性隔膜材料的电化学稳定性不比聚丙烯celgard2500(基准)隔膜的氧化稳定性极限或1m的lipf6/ec:dmc(1:1)电解质溶液的差。
电化学电池的性能以及拆解后分析数据
图7a至7d示出了在c/5速率和30℃或55℃下采集的具有功能性和基准隔膜的lmo-li以及lmo-石墨电池的循环数据。所有含功能性隔膜的电池的比容量初期相对于相应的使用基准隔膜的电池的比容量的最小初始增加,很可能是由于电解质吸收率较高以及功能化隔膜的耐电解质性能降低而造成的。图7a和7b表示在分别于30℃或55℃下进行了100次按c/5速率的循环之后,具有功能性隔膜的lmo-li电池的容量相对于基准电池仅仅4%和8%的最小提高。另一方面,图7c和7d示出了在分别于30℃和55℃下进行了100次循环之后,具有功能性隔膜的lmo-石墨电池保留了比基准电池多31%和100%的容量。此外,图7a至7d中的插图示出了经过相同的测试后,具有普通隔膜的电池的负极中的mn量与具有官能化隔膜的电池的负极中的mn量之比在4.4至约5之间的范围内,不论测试温度是多少以及何种负极类型。这些结果显示了工作电池中功能性隔膜的阳离子螯合能力。虽然具有金属锂电极的电池在循环时的容量维持率仅有最小的提高,具有石墨电极的电池在循环时的容量维持率的提高明显更大,与因性能退化反应而沉积于石墨电极上的锰的催化效应一致。
从图7a和7b可以看出,包括p(e-alt-mali2)功能性隔膜的lmo-li电池表现出:
在c/5速率和30℃下循环100次之后多4%的容量;
在c/5速率和55℃下循环100次之后多8%的容量;
在30℃下具有官能化隔膜的锂电极上的锰少5x;以及
在55℃下具有官能化隔膜的锂电极上的锰少4.5x。
从图7c和7c可以看出,包括p(e-alt-mali2)功能性隔膜的lmo-石墨电池表现出:
在c/5速率和30℃下循环100次之后多31%的容量;
在c/5速率和55℃下循环100次之后多100%的容量;
在30℃下具有官能化隔膜的石墨电极上的锰少9x;以及
在55℃下具有官能化隔膜的石墨电极上的锰少5x。
由于反应性下降,具有功能性隔膜的电池的法拉第电流效率高于具有基准隔膜的电池,尤其是在升高的温度。初始法拉第电流效率(fe)相当低(在两种类型的电池的第一次30℃、c/10速率下的循环期间约为85%),但在化成循环期间稳定增加,反映了石墨负极上的稳定固体电解质界面(sei)层的化成。在100次c/5速率下的循环结束时,具有功能性隔膜的lmo-石墨电池的fe在30℃约为0.999,在55℃下约为0.994,相对地,具有基准隔膜的电池的fe在30℃约为0.996,在55℃下约为0.990。fe较高表示与后一种电池相比,前一种电池中形成的sei层更稳定。此外,具有基准隔膜的lmo-石墨电池的fe在55℃从第60次循环起开始降低,表示随着循环的进行,sei逐渐被破坏,导致石墨电极处更大的反应性。在30℃和55℃下进行的100次c/5速率下的循环之后所测得的具有功能性隔膜的电池的石墨电极上的mn量为1.6μg·cm-2和3.0μg·cm-2(即分别为每毫克lmo中含0.15μg和0.28μgmn),与其相比,基准电池的则为8.0μg·cm-2和13.3μg·cm-2(即分别为每毫克锰酸锂中含0.74μg和1.23μgmn)。这些实验中的一个重要发现是,具有功能性隔膜的电池的隔膜和负极中的总mn量比基准电池的负极和隔膜中的锰含量要低1.5倍。这表明功能性隔膜不仅阻止了锰阳离子向石墨负极迁移,还降低了锰从锰酸锂活性材料的溶出度。
图8示出了原始状态的以及在高温循环测试之后的功能性隔膜的傅里叶变换红外线(ftir)光谱。应注意的是,循环后的电池的隔膜的数据在1,750cm-1处呈现出强羧酸高峰,而原始的隔膜则没有。对这个观察结果的解释是,由于lipf6盐被电解质溶液中的痕量水杂质分解而得到的hf的存在而使羧酸二锂盐基团再质子化。由于hf腐蚀是导致过渡金属离子从正极活性材料溶出的主要原因,而功能性隔膜通过将羧酸基团质子化降低了电池中的hf含量,因此也将减少锰的溶出。所提出的质子化机理以及随之发生的电解质溶液中hf含量的降低在实验中得到了证实,是依据如前文所描述的,与使用基准隔膜的电池相比,在使用功能性隔膜的电池的正极之外所发现的锰总量减少了33%(即1.5x)。因此,除了螯合锰阳离子之外,官能化隔膜中的锂化马来酸基团还充当质子清除剂,因此在一定程度上减少过渡金属离子从正极活性材料上溶出。
关于聚(乙烯-交替-马来酸)二锂盐螯合剂的结论
用于锂离子电池的实例多功能隔膜是用相转化技术来制造的,以聚(乙烯-交替-马来酸)二锂盐作为功能性填料材料,pvdf-hfp共聚物作为惰性基质材料。与含基准隔膜的电池相比,含功能性隔膜的lmo-li和lmo-石墨这两种电池都仅仅只有较少的阻抗增加。在100次c/5速率下的循环之后在具有功能性隔膜的电池的负极中所发现的mn量比使用商品化聚烯烃隔膜的基准电池中的至少小4.4x至5x,不论何种负极材料(不论是锂还是石墨),也不论循环温度是多少。此外,在循环测试期间从具有功能性隔膜的电池中的lmo正极溶解出的总锰量比基准电池中的要低1.5x。在lmo-石墨电池循环数据中最为突出的是由多功能隔膜实例所带来的性能提高,在100次分别于30℃和55℃下进行的循环之后,相对于使用普通商品化隔膜的基准电池,保留的容量要多约31%和约100%。由这种功能性隔膜所带来的有益之处可追溯至由p(e-alt-mali2)材料所执行的三个重要功能:螯合溶解的锰离子,容纳额外的li+离子以及清除质子。
另外的实例隔膜的制备
a类=bpap=具有如下化学结构的高分子氨基-双-甲基吡啶:
b类=pea=聚乙烯亚胺官能化的聚合物,具有如下化学结构:
c类=edtana4=乙二胺四乙酸的四钠盐
另外的螯合隔膜是用相转化技术制造的,用丙酮(购自sigmaaldrich)作为真溶剂。基于两种反溶剂制造了两类相转化隔膜:对于a类和b类材料使用水,对于c类材料则使用无水乙醇(购自sigmaaldrich)。由于c类材料溶于水,所以不能在相转化方法中用水作为反溶剂。将3g聚(偏二氟乙烯-六氟丙烯)(pvdf-hfp)共聚物(购自苏威)在35℃、持续搅拌3小时下溶于81g丙酮中。然后,将水或无水乙醇(10g)滴加到搅拌后的丙酮共聚物溶液之中,直到其变透明。将6g精碾的螯合材料掺入共聚物共混物之中,并在室温下持续搅拌12小时。接着,使用刮刀使共聚物-填料悬浊液以200μm的间隙浇铸至玻璃板上。接下来,在空气中蒸发溶剂混合物以后,于真空中在80℃下将复合膜干燥14小时。共聚物和填料在干的隔膜膜中的最终质量组成分别是1:2,因此隔膜中螯合填料(螯合剂作为填料)的负载量约为2mgcm-2。
具有另外的实例隔膜的电池电化学性能
图9a和9b是比放电容量以及法拉第电流效率作为在c/5速率、30℃(图9a)和55℃(图9b)的温度下的循环期间lmo-li纽扣电池的循环数的函数的曲线图,该lmo-li纽扣电池含有在碳酸亚乙酯(ec)和碳酸二甲酯(dmc)中的1.0m(1:1v/v)六氟磷酸锂(lipf6)电解质溶液(1.0mlipf6ec/dmc),并含有普通聚烯烃隔膜和包含a类、b类和c类螯合剂的隔膜。插图中的直方图示出了30天之后在负极上所发现的以ppm计的锰量(归一化为lmo质量,即,每毫克锰酸锂中锰的微克数)。
从图9a和9b可以看出,包含bpap、pea或edtana4的功能性隔膜的电池表现出:
在有bpap或pea的情况下,在100次c/5速率和30℃下的循环之后多6%的容量;
在有bpap或pea和edtana4官能化隔膜的情况下,在c/5速率和55℃下循环30天后,分别多15%和10%的容量;
在30℃下,在有bpap、pea和edtana4官能化隔膜的情况下,锂电极上的锰分别少11x、14x和16x;以及
在55℃下,在有bpap、pea和edtana4官能化隔膜的情况下,锂电极上的锰分别少13x、15x和21x。
图10a和10b是比比放电容量以及法拉第电流效率作为在c/5速率、30℃(图10a)和55℃(图10b)的温度下的循环期间lmo-石墨纽扣电池循环数的函数的曲线图,该lmo-石墨纽扣电池含有1.0m(1:1v/v)的lipf6ec/dmc电解质溶液,并含有普通聚烯烃隔膜以及包括a、b和c类螯合剂的隔膜。插图中的直方图示出了30天之后在负极上所发现的以ppm计的锰量(归一化成lmo质量)。
在30℃下,在测试结束时(eot),具有a、b和c类材料的电池维持了比基准电池多22%、26%和27%的容量,而在55℃下、在eot时,具有a、b和c类材料的电池维持了比基准电池多75%、89%和125%的容量。
应当理解,这里所提供的范围包括所述的范围以及任何在所述的范围内的值或子范围。例如,从约0.05%至约5%的范围应理解为不仅包括明确列举的约0.05%至约5%的限制范围,而且还包括如0.07%、3.5%等单独的值以及如从约0.25%至约4%等子范围。此外,当“约”用于描述一个值时,这是意在涵盖所述值发生的较小的变化(可达+/-10%)。
在整个说明书中所提及的“一个实施例”、“另一个实施例”、”实施例”等是指结合该实施例描述的某要素(例如特征、结构和/或特性)包括在至少一个本说明书中所描述的实施例当中,也可以出现或不出现在其他实施例之中。此外,还应当理解,所描述的任何实施例的要素可以以任何合适的方式结合在各种实施例之中,除非上下文另有明确规定。
在描述和请求保护本所明书公开的实施例时所使用的单数形式的“一种”、“所述”和“该”也包括多数形式,除非上下文另有明确规定。
虽然已对若干实施例进行了详细描述,但是应当理解所公开的实施例还可以修改。因此,在前文进行的描述应视为非限制性的。
- 还没有人留言评论。精彩留言会获得点赞!