一种靶向纳米基因给药系统、制备方法和应用与流程
本发明属于生物纳米技术及其应用领域,特别涉及胃癌靶向纳米基因给药系统、制备方法及其应用。
背景技术:
胃癌是消化系统最常见的恶性肿瘤之一,世界范围内胃癌位居肿瘤死亡的第二位,且每年有70万例病人因患胃癌死亡。由于饮食结构等多方面的原因,亚洲是胃癌的高发地区,我国每年新发胃癌病例约40万,其中男性每10万人中就有32.9例,女性为每10万人中有15.9例。加之我国目前医疗资源的配给不平衡及人民保健意识不强等原因,造成国内胃癌的早期诊断率较低,临床就诊患者多为中晚期,故胃癌位居全国各类癌症死亡原因之首。
目前,胃癌主要的治疗的手段包括手术、化疗、辅助化疗及放疗等。虽然这些治疗方法不断发展,但进展期胃癌患者的预后及生活质量仍然欠佳,因此迫切需要研究胃癌综合治疗的新策略。随着纳米技术的发展,纳米靶向治疗已成为胃癌治疗的重要组成部分。
磷酸钙作为基因载体除了生物相容性好,可生物降解,靶向细胞外,最突出的优点是无定形磷酸钙在弱酸性pH值可以快速溶解,导致大量的钙离子和磷酸根离子释放到内涵体里的内体混合物中。内涵体中的渗透压迅速增加,使内涵体涨破,磷酸钙载的基因释放到细胞质中,避免载体进入溶酶体中使得基因被降解。Pittella等人制备了mPEG-NH2(Mw:12000)与天冬氨酸苄酯聚合制备了PEG-PAsp,然后将其与磷酸钙和siRNA的复合的纳米颗粒,可以提高siRNA的内涵体逃逸。【Frederico Pittella,Mingzhen Zhang,Yan Lee,Hyun J.Kim,Theofilus Tockary,Kensuke Osada,Takehiko Ishii,Kanjiro Miyata,Nobuhiro Nishiyama,Kazunori Kataoka.Biomaterials,2011,32(11):3106-3114.】。Sun等人制备了羧甲基壳聚糖接枝PEG(Mw:5000)的PEG-CMCS与磷酸钙和siRNA复合的纳米粒,具有高效的抗癌效果【Ying Xie,Hongzhi Qiao,Zhigui Su,Minglei Chen,Qineng Ping, Minjie Sun.Biomaterials,2014,35:7978-7991.】。
技术实现要素:
本发明的目的是针对现有技术中的不足,提供了一种治疗胃癌靶向纳米基因给药系统。
本发明的再一目的是提供一种上述靶向纳米基因给药系统在制备治疗胃癌药物中的应用。
本发明的另一目的是提供一种上述治疗胃癌靶向纳米基因给药系统的制备方法。
为实现上述目的,本发明采取的技术方案是:提供一种治疗胃癌的靶向纳米基因给药系统是由磷酸钙、带负电荷的聚乙二醇-磷脂、基因和包载药物自组装成纳米系统,所述的磷酸钙、聚乙二醇-磷脂、基因及其包载药物的重量百分比为8%~50%、40%~90%、0.5%~10%和2%~8%,优选为15%~30%、50%~80%、0.5%~5%、2%~8%;
所述的聚乙二醇分子量为0.75-12kDa;磷脂为1,2-二硬脂酰基磷脂酰乙醇胺、1,2-二棕榈酰-sn-甘油-3-磷酰乙醇胺、1,2-二油酰-sn-甘油-3-磷酸乙醇胺、1,2-十四酰基磷脂酰乙醇胺或者二硬脂酰基磷脂酰基丝氨酸(均购于Avanti Polar Lipids.Inc.)中的任一种。
所述的基因为有功能性的小干扰siRNA或微小核糖核酸miRNA;
所述的包载药物为紫杉醇、阿霉素、5-氟尿嘧啶或顺铂。
本发明的治疗胃癌的靶向纳米基因给药系统由下述方法获得:
聚乙二醇-磷脂胶束分散液和含有磷酸钙的siRNA或miRNA的溶液混合,产品经过超滤纯化。所述的磷酸钙、聚乙二醇-磷脂、基因及其包载药物的重量百分比为8%~50%、40%~90%、0.5%~10%和2%~8%,优选为15%~30%、50%~80%、0.5%~5%、2%~8%;;
本发明的方法可以进一步描述如下:
(1)聚乙二醇-磷脂胶束分散液的制备
将40mg聚乙二醇-磷脂溶于三甲氯甲烷组成油相,加入pH7.4的10mM Tris·HCl缓冲液为水相、氯甲烷组成油相、油/水=1:10,加入pH7.4的10mM Tris·HCl缓冲液为水相,油/水体积比为1:10,超声分散(200W,2s,2s,2min)。 将乳液转移到圆底烧瓶中旋转蒸发30℃、10-30min除去三氯甲烷,得到聚乙二醇-磷脂胶束分散液。
所述的聚乙二醇优选的分子量为0.75-12kDa;磷脂为1,2-二硬脂酰基磷脂酰乙醇胺、1,2-二棕榈酰-sn-甘油-3-磷酰乙醇胺、1,2-二油酰-sn-甘油-3-磷酸乙醇胺、1,2-十四酰基磷脂酰乙醇胺或者二硬脂酰基磷脂酰基丝氨酸(均购于Avanti Polar Lipids.Inc.)中的任一种。
所述的聚乙二醇-磷脂胶束的粒径为5-200nm,Zeta电位小于-15mV。
(2)靶向纳米基因治疗系统的制备
在0~35℃下,将4-羟乙基哌嗪乙磺酸Hepes、磷酸三钠和氯化钠(均购于Sigma-Aldrich Co.LLc.)加入到水中,配制浓度分别为50mM、1~2mM、140mM和pH7~8的溶液A;
将聚乙二醇-磷脂的胶束分散液稀释到500~1000μg/mL产物分散液B;
将无水氯化钙(购于Sigma-Aldrich Co.LLc.)溶于超纯水中浓度为2.5M的溶液,加入1mM~50mM的siRNA(购于广州锐博生物科技有限公司)或miRNA,将其转移到分散液B中混合均匀为C;
将A和C等体积混合,静置10-30min,然后用截留分子量为10kDa的超滤管超滤离心力1000g,超滤时间10-30min,得到磷酸钙与聚乙二醇-磷脂复合的靶向纳米基因给药系统。
所述的纳米基因给药系统粒径在5~200nm之间,优选为10~100nm。Zeta电位小于零。
本发明的上述磷酸钙与聚乙二醇-磷脂共聚物复合的纳米基因载体可以进行修饰,所述的修饰制剂为肿瘤相关抗原标志物的抗体配体、作为酶类标志物的肽类、基因或小分子制剂。
本发明的靶向纳米基因给药系统由纳米载体和药物组成。纳米载体是由磷酸钙和聚乙二醇-磷脂通过静电作用力自组装组成的复合体系,其可以延长在血液中循环时间,保护基因在体内循环过程中避免被降解,提高基因的转染效率。本发明的胃癌纳米靶向给药系统具有制备方法简单、稳定性好、生物可降解、生物相容性好、无免疫原性且可以靶向到胃部等优点,具有较好的基因治疗效果,可用于制备安全有效的治疗胃癌的药物。
纳米基因载体、能将基因和化疗药物递送到胃癌和胃组织中、用于制备对治疗胃癌的药物。
本发明的优点在于:
(1)本发明所用原料为磷酸钙和聚乙二醇-磷脂,都是天然的生物材料,且被FDA批准用于人体,低毒性,是一种生物相容性好的纳米基因治疗系统。
(2)本发明制备的磷酸钙和聚乙二醇-磷脂复合纳米基因给药系统,制备方法简单,反应时间很短,无须洗涤,能得到颗粒大小为10~60nm,分散性很好的纳米颗粒。
(3)与阳离子聚合物和脂质体比较,磷酸钙和聚乙二醇-磷脂复合纳米基因给药系统的基因装载量大,转染效率高,无免疫原性,无细胞毒性,且具有生物可降解性等优点。
(4)本发明的胃癌靶向纳米基因给药系统具有优异的治疗效果,纳米基因给药系统不需要修饰靶向基团,通过静脉注射就可以将目的基因递送到胃癌组织和胃部。
附图说明
附图1是胃癌纳米靶向基因给药系统的表征,纳米载体可以保护siRNA避免被降解,且纳米载体的粒径在5-200nm之间,多分散指数PDI=0.127,透射电镜图可以看出颗粒为球形,大小在20-50nm之间。
其中,a:纳米载体系统负载siRNA的凝胶阻滞实验,图中“siRNA”为游离的siRNA,“NP/siRNA”为纳米载体负载的siRNA;b:纳米载体系统的粒径大小和分布;c:纳米载体系统的透射电镜。
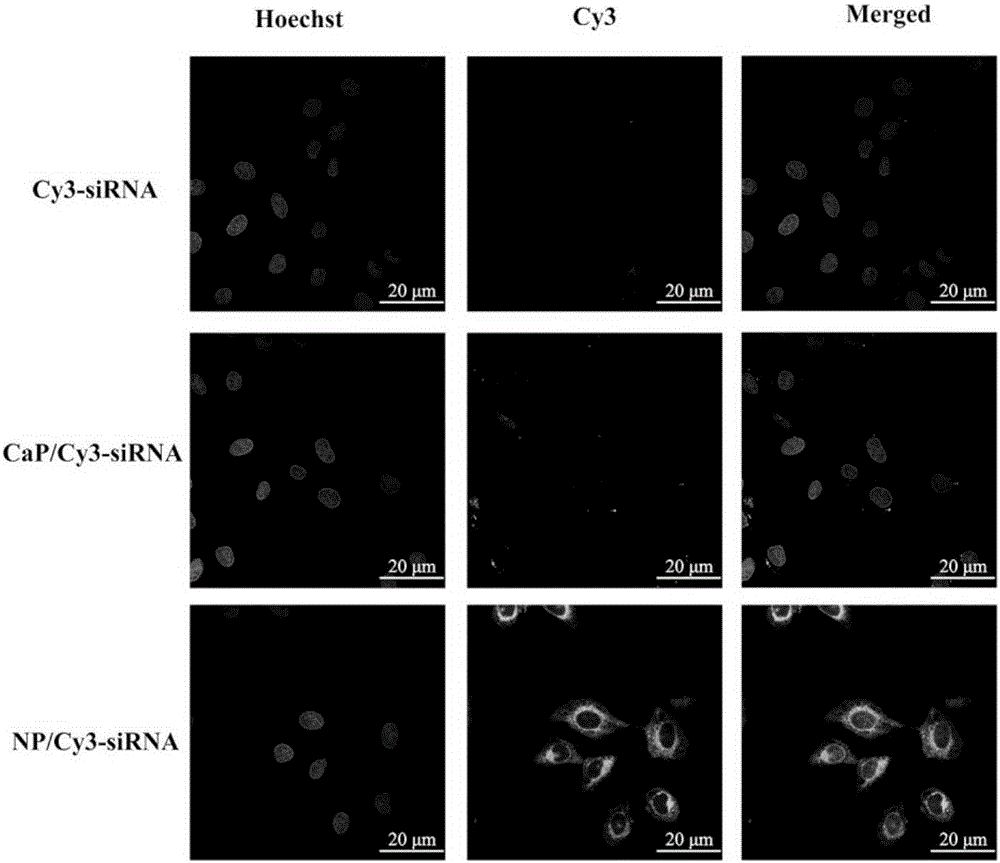
附图2是纳米载体系统负载Cy3标记的siRNA、游离的Cy3标记的siRNA以及磷酸钙负载Cy3标记的siRNA的细胞摄取和分布,可以看出纳米载体高效递送siRNA到细胞中,明显优于游离组合磷酸钙组;
图中“Cy3-siRNA”表示为游离的Cy3标记的siRNA,“CaP/siRNA”表示为磷酸钙负载的Cy3标记的siRNA,“NP/Cy3-siRNA”表示为纳米载体负载的Cy3标记的siRNA,“Hoechst”表示为细胞核染色后发出荧光,“Cy3”表示为Cy3发出的荧光,“Merged”表示为前两者合并起来的图片。
附图3是纳米载体系统负载Cy5标记的siRNA的体内分布;纳米载体可以 将siRNA导入到肿瘤组织中,明显提高siRNA的递送效率。
其中a:静脉注射4h和24h后的体内分布图,图中“Cy5-siRNA”表示为Cy5标记的siRNA,“NP/Cy5-siRNA”表示为纳米载体负载Cy5标记的siRNA;b:肿瘤和主要组织的荧光图像,图中“Heart”、“Liver”、“Spleen”、“Lung”、“Kidney”、“Stomach”、“Tumor”分别表示为心、肝、脾、肺、肾、胃、肿瘤。
附图4是静脉注射Cy5标记的siRNA的纳米载体系统后胃组织的冰冻切片的荧光图像,图中“Bright Field”、“Cy5-siRNA”、“Merged”分别表示为明亮场、Cy5标记的siRNA和前两者的合并图片,可以确认纳米载体负载siRNA进入胃组织之后被胃组织细胞摄取。
附图5是静脉注射负载了miRNA-39或β-actin-siRNA的纳米载体系统后miRNA-39表达量及siRNA对β-actin沉默;纳米载体可以提高RNA的转染效率,明显提高了miRNA-39的表达量,降低β-actin-siRNA的表达量。
其中,a:裸鼠胃miRNA-39表达量,图中“NP-miR39”、“F-miR39”和“PBS”分别表示纳米载体负载miRNA39、游离的miRNA和磷酸盐缓冲液;
b:裸鼠胃β-actin表达量,图中“NP-siRNA”、“F-siRNA”和“PBS”分别表示纳米载体负载siRNA、游离的siRNA和磷酸盐缓冲液
c:SGC7901细胞miRNA-39表达量,图中“NP-miR39”、“F-miR39”、“Blank-NP”和“PBS”分别表示纳米载体负载miRNA39、游离的miRNA、空白纳米载体和磷酸盐缓冲液;
d:SGC7901细胞β-actin表达量,图中“NP-siRNA”、“F-siRNA”、“Blank-NP”和“PBS”分别表示纳米载体负载siRNA、游离的siRNA、空白纳米载体和磷酸盐缓冲液。
附图6是静脉注射负载Cy5标记的siRNA纳米载体到裸鼠原位胃癌SGC-7901细胞株动物模型,4h和24h后的体内分布和肿瘤及主要组织中的分布、图中“Heart”、“Liver”、“Spleen”、“Lung”、“Kidney”、“Stomach”、“Tumor”分别表示为心、肝、脾、肺、肾、胃、肿瘤,可以看出肿瘤和胃组织中明显有荧光分布,可以提高siRNA进入肿瘤和胃组织中。
附图7是静脉注射负载β-actin-siRNA的纳米载体到裸鼠胃癌SGC-7901细胞株移植瘤动物模型,每两天注射一次,图中可以看出纳米载体组可以提高siRNA的转染效率,抑制肿瘤的生长,且几乎没有毒性。
其中,a:经过治疗的肿瘤生长曲线(n=6,mean±SD),图中“PBS”“NP”“siRNA”和“NP/siRNA”分别表示为磷酸盐缓冲液、空白载体、游离的siRNA和纳米载体负载siRNA。
b:经过治疗的小鼠体重变化曲线(n=6,mean±SD),图中“PBS”“NP”“siRNA”和“NP/siRNA”分别表示为磷酸盐缓冲液、空白载体、游离的siRNA和纳米载体负载siRNA。
具体实施方式
通过下述实施例将有助于进一步理解本发明,但是不能够限制本发明的内容。
实施例1
将40mg聚乙二醇-磷脂溶于4ml三氯甲烷组成油相(10mg/mL),加入pH7.4的10mM Tris·HCl缓冲液的水相,油/水体积比为1:10,超声分散200W,2s,2s,2min。将乳液转移到圆底烧瓶中旋转蒸发30℃、10-30min除去三氯甲烷,得到聚乙二醇-磷脂胶束分散液。
实施例2
在0~35℃下,将Hepes、磷酸三钠和氯化钠加入到水中,配制相应浓度分别为50mM、1~2mM、140mM和pH7~8的溶液A;将聚乙二醇-磷脂的胶束分散液稀释到500~1000μg/mL的分散液B;将无水氯化钙溶于超纯水中浓度为2.5M的溶液,加入1mM~50mM的siRNA,混合均匀,将其转移到分散液B中混合均匀为C;将A和C等体积混合,静置10-30min,然后用截留分子量为10kDa的超滤管超滤1000g,30min,得到磷酸钙与聚乙二醇-磷脂复合的纳米基因治疗系统。
实施例3
将实施例2中的制备纳米基因给药系统与含有基因水解酶的血清中培养不同的时间,测定游离基因和纳米基因治疗系统中的基因水解程度,1%的琼脂糖凝胶包含0.5μg/mL的溴化乙锭。电泳在100mV电压下进行15min,然后用伯乐公司的GelDoc XR成像系统进行观察,凝胶阻滞实验结果显示纳米基因治疗系统可以保护基因避免被酶催化水解见附图1a。需要具体试验的的条件描述
实施例4
将实施例2中制备的纳米基因给药系统用动态光散射法(Malvern Zetasizer nano ZS,Malvern)测定其粒径大小和分布见附图1b以及用透射电镜(H-800,Hitachi,Japan)观察期形态粒径在20-50nm之间见附图1c。
实施例5
将纳米基因给药系统负载Cy3标记的siRNA与SGC-7901细胞一起培养,在含有10%的胎牛血清、1%的青霉素-链霉素的培养基,37℃、5%的CO2条件下培养4h,用共聚焦显微镜(FV-1200 Olympus confocal microscope)拍摄细胞摄取和分布,结果显示纳米基因治疗系统要明显强于游离组见附图2。
实施例6
用纳米基因给药疗系统负载荧光标记的基因注射到裸鼠,移植瘤动物模型用荧光成像仪观察(LB 983,Berthold Technologies Gmbh&Co.KG),结果显示肿瘤组织和胃部具有明显的荧光见附图3。
实施例7
将实施例7中的注射纳米基因给药系统的裸鼠的胃组织做冰冻切片,结果显有大量的荧光分布在胃组织切片中见附图4。
实施例8
将纳米基因给药系统分别负载siRNA注射到Bab/c小鼠体内,在不同时间取其胃组织用PCR(CFX384 TouchTM,Bio-Rad Laboratories,Inc.)测定胃组织中miRNA-39和β-actin-siRNA的表达量,结果显示纳米载体可以提高miRNA-39表达量,降低β-actin-siRNA的表达量见附图5。
实施例9
将纳米基因给药系统负载Cy5标记的siRNA注射到裸鼠原位胃癌SGC-7901细胞株的动物模型,用荧光成像仪(LB 983,Berthold Technologies Gmbh&Co.KG)观察不同时间体内分布,结果显示在瘤内和胃部有明显的荧光分布见附图6。
实施例10
将纳米基因给药系统负载β-actin-siRNA静脉注射的裸鼠胃癌SGC-7901细胞株移植瘤动物模型,评价纳米载体负载β-actin-siRNA的体内治疗效果,结果显示纳米载体负载β-actin-siRNA明显可以抑制肿瘤生长而且没有体内毒性见附图7。
- 还没有人留言评论。精彩留言会获得点赞!
- 采用寡核苷酸介导的基因修复提高靶向基因修饰的效率的方法和组合物与流程
- CRISPR/Cas9靶向敲除人ezrin基因增强子关键区的方法及其特异性gRNA与流程
- CRISPR/Cas9 靶向敲除人PD‑1基因及其特异性gRNA的制作方法与工艺
- 靶向人TSPAN8基因的siRNA及其应用的制作方法与工艺
- 靶向人TSPAN8基因的siRNA及其应用的制作方法与工艺
- CRISPR/Cas9靶向敲除人乙肝病毒P基因及其特异性gRNA的制作方法与工艺
- 一种特异靶向人ABCG2基因的sgRNA导向序列及其应用的制作方法与工艺
- 一种利用CRISPR‑Cas9靶向敲除MSTN基因的方法与流程
- CRISPR/Cas9靶向敲除人CNE10基因及其特异性gRNA的制作方法与工艺
- 用于猪APN基因编辑的靶向sgRNA、修饰载体及其制备方法和应用与流程