茶黄素‑3,3’‑双没食子酸酯的用途的制作方法
本发明属于药物新用途领域,涉及一种假体周围骨溶解的药物,尤其涉及茶黄素-3,3’-双没食子酸酯在制备假体周围骨溶解药物中的用途。
背景技术:
人工关节置换术(total joint arthroplasty,TJA)是二十世纪最成功的骨科手术之一,能达到有效解决患者关节疼痛、重建关节功能、提高患者生活质量的目的。2007年《Lancet》上曾发表述评文章,将TJA称为“世纪性的手术”(The Operation of the Century)。目前,TJA已成为治疗严重骨关节炎、类风湿性关节炎及股骨头坏死终末期病变等的首选方法。据统计,在美国,每年大约有70万患者接受TJA,预计到2030年每年接受TJA的患者可超过400万。然而随着该技术的广泛应用以及假体使用年限的延长,假体后期松动问题日益突出。Ranawat等研究发现,TJA术后15-20年,10-15%的人工假体将失效,需要更换新的人工假体。Dobzyniak等统计发现,在需行翻修手术的患者中,无菌性松动(aseptic loosening,AL)引起的占到了75%。目前,AL已成为制约人工假体使用寿命的关键因素,也是导致假体翻修的主要原因。
无菌性松动的发生机制复杂,至今尚不完全清楚。人工假体周围的微环境是一个动态变化的过程,多种致病因素都可以参与到AL的发生。目前多数学者认为AL的致病因素基本可归纳为两大类:一类为机械性因素,如假体设计、循环负荷、液体压力、假体微动、应力遮挡等;另一类为生物学因素,即由磨损颗粒引起的生物学反应。虽然机械因素可以通过不同的方式对人工假体的稳定产生影响,但磨损颗粒引起的假体周围骨溶解被认为是引起假体AL的主要原因。
破骨细胞活性改变是引起各种骨代谢疾病的主要原因,也是研究的热点。目前,多数学者认为磨损颗粒引起的破骨细胞活化是导致假体周围骨溶解的首要因素。研究发现松动假体周围组织中成熟的破骨细胞数量明显增多;体外研究也证实聚乙烯、钛、PMMA等颗粒能促进破骨细胞前期细胞分化为成熟的破骨细胞。因此,抑制破骨细胞活化已成为药物预防和治疗假体周围骨溶解和假体无菌性松动的首要研究方向。
茶黄素-3,3’-双没食子酸酯(theaflavin-3,3’-digallate,TF3)是一类具有苯骈卓酚酮结构的物质,通过儿茶素苯并环化作用而形成;其分子式为C43H32O20,分子量为868.70,CAS NO.33377-72-9,结构式如下所示:
TF3是红茶的主要活性成分,大量的研究证实TF3具有抗肿瘤、抗炎、抗氧化、抗病毒以及降血脂等作用。目前TF3与磨损颗粒诱导假体周围骨溶解和假体无菌性松动的关系尚不明确。
技术实现要素:
解决的技术问题:为了克服现有技术的缺陷,开发茶黄素-3,3’-双没食子酸酯的新用途,且寻找预防和治疗假体周围骨溶解和假体无菌性松动的有效药物,本发明提供了茶黄素-3,3’-双没食子酸酯在制备假体周围骨溶解药物中的用途。
技术方案:茶黄素-3,3’-双没食子酸酯在制备假体周围骨溶解药物中的用途。
所述假体周围骨溶解为人工关节置换术后发生的假体周围骨溶解。
一种假体周围骨溶解药物,包含茶黄素-3,3’-双没食子酸酯。
优选的,所述茶黄素-3,3’-双没食子酸酯在药物中的质量分数为1%~99%,优选10%~90%。其中,药物中选用的辅料为茶黄素-3,3’-双没食子酸酯在药学上可接受的载体。
优选的,所述药物为适用于胃肠道的药物制剂,剂型为片剂、胶囊剂或控释、缓释制剂。
本发明所述的药学上可接受的载体为组合物中制剂使用的辅料,可采用本领域常规的辅料,以不和本发明活性成分发生反应或不影响本发明药物的疗效为前提,所述制剂的制备方法可采用本领域常规的制备方法进行制备。
本发明中,组合物的制备方法没有限制,TF3直接做成制剂,或者分别或/和辅料混合后做成制剂,然后按照本领域常规的方式进行包装,与其它辅料混合制成制剂。本发明中的药物组合物的给药剂量根据给药对象、给药途径或药物的制剂形式不同可以进行适当的变化,但以保证该药物组合物在哺乳动物体内能够达到有效的血药浓度为前提。
有益效果:(1)采用本发明所述药物治疗假体周围骨溶解时,骨表面陷窝数、陷窝面积明显减少,骨密度、骨体积分数明显增加,骨溶解程度明显减轻,骨膜增厚程度减轻,成熟破骨细胞数量减少;(2)本发明所述药物能够抑制RANKL诱导的破骨细胞活化,且抑制作用呈浓度依赖性;(3)本发明所述药物能明显抑制ERK信号通路的活化;抑制ERK下游靶因子c-fos和NFATc1的表达,而对ERK上游调节激酶MEK1/2的活性无影响。
附图说明
图1为micro-CT扫描各实验组小鼠颅骨的二维图像及小鼠颅骨陷窝数、陷窝面积、骨密度(BMD)及骨体积分数(BV/TV)检测值分析图;其中A为四组实验中小鼠颅骨micro-CT扫描图,B为四组实验中小鼠骨密度检测值分析图,C为四组实验中小鼠骨体积分数检测值分析图,D为四组实验中小鼠颅骨陷窝数检测值分析图,E为四组实验中小鼠颅骨陷窝面积检测值分析图。
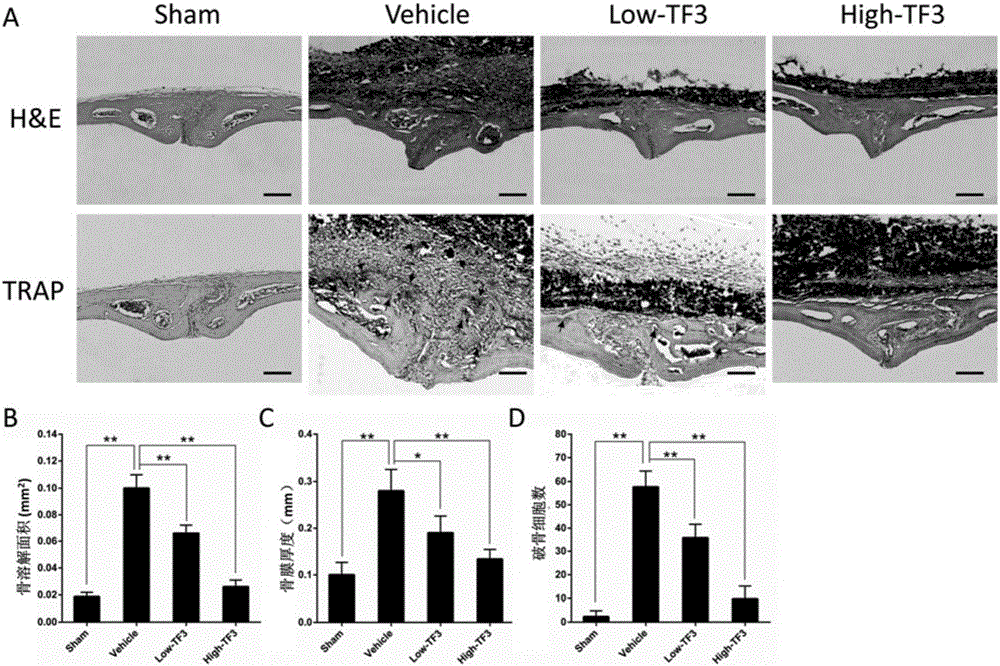
图2为各实验组小鼠颅骨H&E、TRAP染色结果及颅骨骨溶解面积、骨膜厚度及破骨细胞数量检测值分析图;其中A为各实验组小鼠颅骨H&E、TRAP染色结果图,B为各实验组小鼠颅骨骨溶解面积检测值分析图,C为各实验组小鼠颅骨骨膜厚度检测值分析图,D为各实验组小鼠颅骨破骨细胞数量检测值分析图。
图3为BMM细胞活性检测结果图。
图4为TF3对BMMs分化的作用结果图;其中A为不同浓度的TF3与BMMs细胞共培养后TRAP染色结果,B为不同浓度的TF3与BMMs细胞共培养后显微镜下计数TRAP-阳性细胞数检测值,C为不同处理时间的TF3与BMMs细胞共培养后TRAP染色结果,D为不同处理时间的TF3与BMMs细胞共培养后显微镜下计数TRAP-阳性细胞数检测值。
图5为骨吸收培养板及F-actin染色结果图;其中A为不同浓度的TF3对破骨细胞F-actin环形成的影响,B为不同浓度的TF3对破骨细胞吸收面积的影响,C为TF3对破骨细胞F-actin环形成的剂量效应。
图6为破骨细胞活化相关基因RT-PCR检测结果图;其中A为不同浓度的TF3对相关基因表达的影响结果,B为不同加入时间,TF3对相关基因表达的影响结果
图7为NF-κB、PI3K/AKT和MAPK通路关键蛋白Western blot检测结果图。
图8为ERK及其上下游调节蛋白Western blot检测结果图。
具体实施方式
以下实施例进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改和替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1 建立本发明所述药物的应用模型
1、主要药品及试剂
茶黄素-3,3’-双没食子酸酯(TFDG)、抗酒石酸酸性磷酸酶(TRAP)染色试剂盒、乙二胺四乙酸二钠盐二水合物(EDTA)、封片剂购自美国Sigma公司;RANKL、m-CSF购自美国R&D公司,切片石蜡购自德国Lecia公司,RT-PCR试剂盒购自美国Invitrogen公司。
2、主要仪器设备
Micro-CT(SkyScan 1176,比利时)、石蜡切片机(Leica 2135,德国)、烤片机(Leica 1120,德国)、石蜡包埋机(BMJ-Ⅱ,中国,常州)、正置显微镜Axio Imager.M1(Zeiss,德国)、酶标仪(Biotec,美国)、高压蒸汽消毒锅(日本Sanyo公司)、酶联免疫检测仪(美国Bio-Rad公司)、PCR仪(TAKARATP800,日本TAKARA公司)。
3、实验动物
健康C57BL/J6小鼠28只,雄性,体重20~25g,8~10周龄,清洁级,由苏州大学动物实验中心提供[动物许可证号:SYXK(苏)2012-0045]。喂养条件如下:7只一笼,室温18~20℃,湿度50~60%,通风良好,自由摄食进水。
4、细胞
RAW264.7(ATCC:TIB-71)是小鼠单核/巨噬细胞系,在RANKL的诱导下可分化为成熟的破骨细胞;小鼠骨髓来源的巨噬细胞(BMMs)来源于小鼠骨髓,其在RANKL和M-CSF诱导下可分化为成熟的破骨细胞。
5、实验方法
(1)Ti颗粒的处理
Ti颗粒直径为3.32±2.39μm,其中90%的颗粒直径小于3.6μm,50%的颗粒直径小于1.6μm,10%的颗粒直径小于1.0μm。在使用前,Ti颗粒应消毒和去除内毒素。我们将Ti颗粒置于烘箱内,180℃烘烤6h后,硝酸(1M)浸泡4h,等渗盐水反复冲洗,2000rpm离心5min;后将其浸泡于75%乙醇,室温下振荡1h,重复四次,无水乙醇浸泡过夜,等渗盐水洗涤3次,2000rpm离心5min沉淀Ti颗粒;将Ti颗粒置于超净工作台中,紫外线照射条件下自然干燥后4℃保存备用。
(2)实验动物分组
C57BL/J6小鼠28只,随机分为以下4组:
Sham组:7只,操作与Vehilce组相同,仅将置入的钛颗粒改为等量的生理盐水,术后每天腹腔注射0.2mL生理盐水,2周后处死;
Vehicle组:7只,在小鼠颅骨表面置入30mg钛颗粒,术后每天腹腔注射0.2mL生理盐水,2周后处死;
Low-TF3组:7只,为TF3低剂量治疗组,在小鼠颅骨表面置入30mg钛颗粒后,每2天腹腔注射TF(0.2mL,1mg/kg),2周后处死;
High-TF3组:7只,为TF3高剂量治疗组,:在小鼠颅骨表面置入30mg钛颗粒后,每2天腹腔注射TF3(0.2mL,10mg/kg),2周后处死。
(3)小鼠颅骨骨溶解模型的制备
采用小鼠颅骨骨溶解模型(Kaar SG,et al.Rapid repair of titanium particle-induced osteolysis is dramatically reduced in aged mice.J Orthop Res.2001;19:171-8.)模拟磨损颗粒诱导骨溶解的病理过程。小鼠称重后,以40g/L水合氯醛按40mg/kg腹腔注射麻醉。麻醉成功后,采用小鼠固定板固定小鼠四肢和头部,颅顶局部皮肤去毛后安尔碘消毒。在颅骨表面沿颅骨正中矢状缝的体表投影位置作一长约1cm切口,暴露1cm×1cm的视野,不破坏骨膜。以小鼠颅骨矢状缝和冠状缝交汇处为中心,将消毒后的Ti颗粒均匀涂在颅骨表面(30mg/只)。以4-0手术线间断缝合伤口。术后日光灯照射加温复苏小鼠,待小鼠完全苏醒后再放回饲养笼内。术前每只小鼠经皮下注射6-氯-α-甲基咔唑-2-乙酸4mg/kg;术后在饮用水中加入100mg/mL恩诺沙星,持续3天。
(4)标本收集
给药2周后,使用CO2箱处死小鼠,整体分离小鼠颅骨及颅下脑组织,剔除颅底附着软组织,10%多聚甲醛固定48h后行micro-CT扫描,再以10%多聚甲醛固定48h后,加入10%EDTA脱钙,进行组织病理学检测。
实施例2 TF3对小鼠颅骨陷窝数、陷窝面积、骨密度及骨体积分数的影响
使用比利时SkyScan公司生产的高分辨显微CT SkyScan 1076对小鼠颅骨进行扫描分析。扫描前将标本从固定液中取出,晾干。将每个颅骨放置在micro-CT测试试管杯中,每次5只,每个颅骨间用泡沫塑料片隔开;颅骨要摆放整齐,避免碰到试管壁。扫描参数设置为:扫描分辨率18μm,旋转角度180°,旋转角度量增0.9°,电压80kV,电流100μA,曝光时间100ms。扫描结束后,采用SkyScan 1076自带软件进行颅骨三维重建。按照Wedemeyer建立的方法(Wedemeyer C,et al.Particle-induced osteolysis in three-dimensional micro-computed tomography.Calcif Tissue Int.2007;81(5):394-402.),使用CT Analyzer分析软件(CT An,SkyScan)在小鼠颅骨表面以冠状缝和矢状缝交汇处为中心选定一圆柱形感兴趣区域(Region of interest,ROI;3×3×1mm),分析以下参数:骨密度(Bone mineral density,BMD),以mg/cc表示;骨体积分数(Bone volume to tissue volume ratio,BV/TV;%);ROI区域内骨陷窝数(Number of pores within the ROI)及陷窝面积(area of porosity)。
结果如图1所示,三维重建结果显示Ti颗粒植入后小鼠颅骨变薄,虫蚀样破坏明显;经腹腔注射TF3治疗后,颅骨表面的虫蚀样破坏明显减轻,因此TF3能够减轻Ti颗粒引起的骨破坏。统计结果表明,Vehicle组颅骨表面陷窝数及陷窝面积较对照组分别增加了3.3倍和2.5倍,差异有统计学意义(**p<0.01);TF3(1mg/kg和10mg/kg)治疗后,小鼠颅骨表面陷窝数及陷窝面积明显减少,与Vehicle组比较,差异有统计学意义。Vehicle组骨密度(BMD)和骨体积分数(BV/TV)显著低于对照组,采用TF3(1mg/kg和10mg/kg)治疗后,上述参数较Vehicle组分别增加了:BMD:63.7%,124.9%;BV/TV:83.1%,165.2%,差异有统计学意义(*p<0.05,**p<0.01)。
实施例3 TF3对小鼠颅骨骨溶解面积、骨膜厚度及破骨细胞数量的影响
颅骨经10%EDTA脱钙后,常规石蜡包埋。取颅骨水平位,于颅骨矢状缝处连续切片,片厚5μm。分别行HE和TRAP染色。
1、HE染色步骤
H&E染色是最常用的染色方法,本研究采用H&E染色观察颅骨表面大体变化,分析炎性细胞浸润及骨质破坏程度。具体操作步骤如下:
(1)每个样品选择5张连续切片,放入烤箱(60℃)内烘烤30min;
(2)石蜡切片经二甲苯(15min×2次)脱蜡后,依次经过无水乙醇,无水乙醇,95%乙醇,95%乙醇,90%乙醇、80%乙醇、75%乙醇各5min,去离子水冲洗;
(3)苏木素染色3-5min,去离子水冲洗;
(4)1%盐酸酒精分化20s,1%氨水返蓝30秒,去离子水冲洗;
(5)l%伊红溶液复染5min,自来水冲洗5min,去离子水冲洗1min;
(6)常规脱水、透明(75%乙醇5min,90%乙醇5min,95%乙醇5min,无水乙醇5min,二甲苯透明10min×2次);
(7)用吸水纸擦去样品周围多余的二甲苯,在保持样品湿润的情况下滴加中性树胶,加盖玻片封片;
Axio imager.M1正置显微镜(Zeiss,德国)观察颅骨的形态学变化,于10×条件下摄片,颅骨的ROI区域位于拍摄的中央。用显微镜计算机图像分析系统(Image-Proplus 6.0),参照von Knoch M法(von Knoch M,et al.Decrease in particle-induced osteolysis in obese(ob/ob)mice.Biomaterials.2004;25:4675-81),计算骨膜厚度(Periosteum thickness,PT;mm)以及骨溶解面积(Eroded surface;mm2)。
2、抗酒石酸酸性磷酸酶染色(Tartrate-Resistant Acid Phosphatase Staining,TRAP)
抗酒石酸酸性磷酸酶是破骨细胞特有的一种酶,常被用来鉴定成熟的破骨细胞。采用Sigma公司的TRAP染色试剂盒(387A)染色后,成熟的破骨细胞呈紫红色。具体染色方法如下:
(1)每个样品选择5张连续切片,放入烤箱(60℃)内烘烤30min;
(2)石蜡切片经二甲苯(15min×2次)脱蜡后,依次经过无水乙醇,无水乙醇,95%乙醇,95%乙醇,90%乙醇、80%乙醇、75%乙醇各5min,双蒸水冲洗;
(3)用吸水纸擦干样品周围的水渍,将切片放入丙酮溶液中固定30s;
(4)双蒸水冲洗2min;
(5)将玻片放入暗盒内,加入新鲜配制的TRAP染液,染液需完全覆盖切片,37℃水浴锅避光孵育1h;
(6)双蒸水冲洗2min×3次;
(7)苏木素复染2min;
(8)自来水冲洗,晾干,中性树胶封片。
Axio imager.M1正置显微镜(Zeiss,德国)观察,于20×条件下摄片,颅骨的ROI区域位于拍摄的中央。由于在骨组织中鉴定成熟破骨细胞比较困难,我们采用Sawyer建立的方法(Sawyer A,et al.Quantification of tartrate resistant acid phosphatase distribution in mouse tibiae using image analysis.Biotech Histochem.2003;78:271-8.),运用显微镜计算机图像分析系统(Image-Proplus 6.0)计算ROI区域内成熟破骨细胞数量。
结果如图2所示,H&E染色结果显示Ti颗粒植入部分可见炎症反应明显,有大量的巨噬样细胞浸润,骨连续性中断,TF3治疗组骨膜内细胞数量减少,炎症反应减轻,骨破坏程度得到改善,且抑制作用呈剂量依赖性。骨组织计量学结果显示矢状缝骨吸收面积在Vehicle组为(0.11±0.01)mm2,在Control组、L-TF3和H-TF3组分别为(0.02±0.002)mm2、(0.07±0.005)mm2和(0.03±0.004)mm2,与Vehicle组比较,差异有统计学意义(**p<0.01)。Ti颗粒植入2周后,小鼠骨膜厚度变薄,Image Pro-Plus 6.0软件测量结果显示Vehicle组骨膜厚度(PT)为(0.10±0.03)mm,与Control组(0.28±0.04)mm比较,差异有统计学意义(**p<0.01);TF3治疗后,PT分别降低为L-TF3组(0.19±0.03)mm,H-TF3组(0.13±0.02)mm,与Ti颗粒组比较,差异有统计学意义(*p<0.05,**p<0.01)。
破骨细胞是介导磨损颗粒诱导骨溶解的直接效应细胞。TRAP染色结果发现Control组仅少量、散在点状阳性改变,Vehicle组颅骨溶解侧可见大片连续的紫红色深染区域;L-TF3和H-TF3组仅在颅骨溶解边缘有少量阳性区域(图2)。骨组织计量学分析结果显示Vehicle组TRAP阳性细胞为(57.67±5.56)个,与Control组(2.33±2.05)个比较,差异有统计学意义(**p<0.01);而L-TF3和H-TF3组TRAP阳性细胞数分别为(35.67±4.92)个、(9.67±4.50)个,与Vehicle组比较,差异有统计学意义(**p<0.01)。上述结果证实LiCl通过抑制破骨细胞形成减轻Ti颗粒引起的骨溶解。
实施例4 TF3对BMM细胞活性的影响
1、小鼠BMMs细胞的分离培养
选取4-6周龄的雌性C57BL/6小鼠(10只,2%戊巴比妥钠腹腔注射麻醉后,无菌条件下取出双侧股骨和胫骨,剪断一侧骨端,用注射器吸取含10%胎牛血清、1%青/链霉素,和2mM L-谷氨酰胺的DMEM培养液,从另一端插入注射器冲洗3次,然后反复吹打骨髓细胞,经200目的滤网过滤后,1000rpm离心6min,将收集的细胞置于含有10%胎牛血清、1%青/链霉素和10ng/mL M-CSF的DMEM培养。24h后取非贴壁细胞悬液,与单核细胞分离液按1:2体积比置于离心管中,2400rpm,离心15min;弃去上层培养液,取单个核细胞层,20mL PBS轻轻吹打洗涤2次。将细胞接种在含有10%胎牛血清、1%青/链霉素和10ng/mL M-CSF的DMEM中培养4h,弃掉未贴壁细胞。用含10%胎牛血清、1%青/链霉素、50ng/mL RANKL和30ng/mL M-CSF的DMEM培养基重悬细胞,诱导培养。
2、CCK-8法细胞增殖率
CCK-8试剂常用来进行细胞增殖和毒性分析。其基本原理为:该试剂中含有的2-(2-甲氧基-4-硝基苯基)-3-(4-硝基苯基)-5-(2,4-二磺酸苯)-2H-四唑单钠盐在1-甲氧基-5-甲基吩嗪硫酸二甲酯的作用下被细胞中的脱氢酶还原为具有高度水溶性的黄色甲染料。细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。对于同样的细胞,颜色的深浅和细胞数目呈线性关系。
取生长状态良好的BMMs细胞,显微镜下计数,调整细胞密度1.5×104/孔接种于96孔细胞培养板(DMEM培养基,30ng/mL M-CSF,50ng/mL RANKL),每组设3个复孔,24h后更换含有TF3(0.01-40μM),30ng/mL M-CSF和50ng/mL RANKL的DMEM培养基,培养48h。每100μl培养基中加入10μl CCK-8,37℃,5%CO2细胞培养箱中放置4h,在酶标仪上测定450nm处的OD。以上实验重复3次,取其平均值。
结果如图3所示,体外结果显示TF3浓度<5μM时对BMM细胞的活性无影响。
实施例5 TF3对破骨细胞分化的影响
BMMs以1.0×104/孔接种于96孔细胞培养板,加入含有不同浓度的TF3培养4h,在加入含有RANKL(50ng/mL),M-CSF(30ng/mL)和TF3的培养基诱导培养,培养5d后,倒置显微镜观察细胞大体状态;TRAP染色参考Sigma公司的TRAP染色试剂盒(387A)说明书,封片后,显微镜下观察、拍照,并计数细胞核≥3的TRAP染色阳性细胞。
结果如图4所示,将TF3(0,0.01,0.1,1μM)加入到含有50ng/mL RNAKL和30ng/mL M-CSF的BMM培养基中,诱导培养5d,TRAP染色结果显示成熟破骨细胞数量从267.7±32.2/孔(0μM)减少到66.6±5.4/孔(1μM)。为了进一步明确TF3在破骨细胞分化的哪个阶段起作用,我们采用1μM的TF3,分别在诱导培养的0,2,4d加入培养基,TRAP染色结果显示TF3在0,2d时加入能明显抑制破骨细胞分化,而在4d时加入对破骨细胞分化无影响。
实施例6 破骨细胞骨吸收能力
1、OAP板检测破骨细胞骨吸收能力
BMMs细胞以1.5×105个/孔接种于24孔骨吸收培养板(OAP,美国Corning公司),加入含有不同浓度TF3和30ng/mL M-CSF的基础培养基培养4h,再更换诱导含有RANKL(50ng/mL),M-CSF(30ng/mL)和TF3的培养基诱导培养,培养5d后,弃培养基。以PBS清洗3次,每次2min;再加入PBS,采用超声波清洗2次,每次5min;自然晾干后,倒置显微镜下观察并记录每组骨吸收陷窝图像。运用显微镜计算机图像分析系统(Image-Proplus 6.0)进行分析,计算每组骨吸收陷窝面积比[骨吸收陷窝面积比(resorption area of well,%)=骨吸收陷窝面积/培养孔面积]。
2、F-actin染色
细胞弃培养基后,以4%多聚甲醛固定10min,在加入含有0.1%Triton X-100的PBS渗透5min;再加入Acti-stainTM488Fluorescent Phalloidin(Cytoskeleton Inc,USA)室温避光反应30min;PBS清洗3次,再加入DAPI复染10min;荧光显微镜观察。
结果如图5所示,采用OAP板以及F-actin染色的方法检测TF3对破骨细胞功能的影响,结果显示,破骨细胞骨吸收面积从81.9%(0μM)降低到25.6%(1μM),差异有统计学意义(*p<0.05,**p<0.01)。F-actin染色结果显示TF3能明显抑制破骨细胞F-actin环的形成,且抑制效应呈剂量依赖性。
实施例7 TF3对相关基因表达的影响
采用定量RT-PCR的方法,检测不同干预条件下BMMs细胞中TRAP,NFATc1,c-Fos,CTSK和Oscar的表达变化。采用Trizol试剂(美国Gibco公司)提取细胞内总RNA。采用美国Promega公司逆转录试剂盒进行逆转录反应,RT-PCR在TP800荧光定量PCR仪(日本TaKaRa公司)上进行,引物由上海生工公司设计合成,以GAPDH为内参,引物序列如下:
TRAP forward 5’-CTGGAGTGCACGATGCCAGCGACA-3’,
TRAP reverse 5’-TCCGTGCTCGGCGATGGACCAGA-3’;
NFATc1forward 5’-CCGTTGCTTCCAGAAAATAACA-3’,
NFATc1reverse 5’-TGTGGGATGTGAACTCGGAA-3’;
c-Fos forward 5’-CCAGTCAAGAGCATCAGCAA-3’,
c-Fos reverse 5’-AAGTAGTGCAGCCCGGAGTA-3’;
CTSK forward 5’-CTTCCAATACGTGCAGCAGA-3’,
CTSK reverse 5’-TCTTCAGGGCTTTCTCGTTC-3’;
Oscar forward 5’-CTGCTGGTAACGGATCAGCTCCCCAGA-3’,
Oscar reverse 5’-CCAAGGAGCCAGAACCTTCGAAACT-3’;
GAPDH forward 5’-ACCCAGAAGACTGTGGATGG-3’,
GAPDH reverse 5’-CACATTGGGGGTAGGAACAC-3’。
扩增条件:95℃,5s;60℃,24s;40个循环。
结果如图6所示,采用定量RT-PCR的方法检测破骨细胞活化相关基因NFATc1、c-Fos、TRAP、CTSK和Oscar的表达,结果显示RANKL加入后,上述基因mRNA的表达明显增加,而TF3能抑制NFATc1、c-Fos、TRAP、CTSK和Oscar的表达,且抑制效应与TF3的浓度和加入的时间有关。
实施例8 TF3对相关蛋白的影响
采用Western blot检测不同干预条件下AKT1、P-AKT1,p65、P-p65,IκBa、P-IκBa,ERK、P-ERK,JNK、P-ERK,p38、P-p38,MEK1/2、P-MEK1/2,c-fos和NFATc1的表达变化。
1、试剂配置
30%丙烯酰胺溶液:丙烯酰胺29g,N,N’-亚甲丙烯酰胺1g,溶于50mL ddH2O中,加热至37℃充分搅拌溶解,补足总体积至100mL,微孔滤膜过滤除菌,严格控制pH值不大于7.0,置于棕色瓶,4℃避光保存;
2×SDS上样缓冲液:含有100mM Tris-HCl(pH 6.8),200mM DTT,4%SDS,0.2%溴酚蓝,20%甘油,4℃保存;
1×电泳缓冲液:含25mM Tris-HCI(pH 8.8),192mM甘氨酸,0.1%SDS,加ddH2O稀释至1000mL,4℃保存;
抗体稀释液(PBST):20×PBS 50mL加ddH2O稀释至1000mL,再加入1mL Tween-20;
转膜缓冲液:取3.03g Tris碱,14.2g甘氨酸,加入150mL甲醇溶解,加ddH2O水稀释至1000mL,4℃保存;
封闭液:1.25g脱脂奶粉,1.25gBSA加PBST稀释至50mL,现配现用;
抗体洗脱缓冲液:Tris-HCl 62.5mol/L(pH 6.8),SDS 2%,β-巯基乙醇100mol/L,4℃保存;
考马斯亮蓝染液:考马斯亮蓝-R250 1.0g,10%冰醋酸100mL,异丙醇250mL,加ddH2O稀释至1000mL,搅拌均匀,滤纸过滤,室温保存;
考马斯亮蓝R-250脱色液:10%冰醋酸100mL,甲醇450mL,加ddH2O稀释至1000mL,搅拌均匀,室温保存。
2、细胞总蛋白提取
(1)对照组与各干预组细胞吸去培养基,细胞用预冷的PBS清洗3次,尽量将液体去除干净;
(2)加入细胞裂解液(20mM Tris-HCL pH 7.5,150mM NaCl,1mM EGTA,1%Triton,2.5mM sodium pyrophosphate,1mMβ-glycerophosphate,1mM Na3VO4,1μg/mL leupeptin),1mM PMSF,蛋白酶抑制剂,冰上孵育30分钟;
(3)用刮棒刮下细胞,移入预冷的离心管中,14000rpm离心10min;
(4)吸取上清,BCA蛋白定量后-20℃保存备用。
3、配制12%的SDS-PAGE胶
(1)将玻璃板及样品梳清洗干净,无水乙醇擦拭,晾干,固定于制胶板上;
(2)在两块玻璃板之间加入分离胶溶液,留出灌注积层胶所需空间。然后在分离胶溶液上覆盖一层1cm的无水乙醇层,注意不要引入气泡;
(3)等分离胶聚合后,用吸水滤纸吸净残留液体;
(4)在分离胶上层灌注浓缩胶,立即插入样品梳,注意保持样品梳水平,避免引入气泡;
(5)待聚合完全后,小心移出样品梳,用去离子水清洗加样槽以除去未聚合的丙烯酰胺,把凝胶固定于电泳装置上,各加入电泳缓冲液;
分离胶配比(5mL):1.6mL ddH2O,2.0mL 30%丙烯酰胺溶液,1.3mL Tris-HCL(1.5mol/L,pH 8.8),0.05mL 10%SDS,0.05mL 10%过硫酸胺,0.002mL TEMED;
浓缩胶配比(1mL):0.68mL ddH2O,0.17mL 30%丙烯酰胺溶液,0.13mL Tris-HCL(1.0mol/L,pH 6.8),0.01mL 10%SDS,0.01mL 10%过硫酸胺,0.001mL TEMED;
(6)上样:取相同质量的各组样本(体积×蛋白质浓度),并加等体积的2×电泳加样缓冲液,100℃煮沸5min,冰上5min,2000rpm离心30s。按照实验设计的顺序用微量加样器依次将样品小心加入上样孔内,注意不要溢出;
(7)电泳:加入1×电泳缓冲液进行SDS-PAGE电泳,起始电压为80V,约30min后待样品完全进入分离胶时,将电压调为160V,电泳约1.5h至溴酚蓝染料前沿抵达分离胶末端时,即停止电泳;
(8)转膜:准备4张与胶同样大小的滤纸和2张PVDF膜,PVDF膜置于无水乙醇中浸泡5min后,与转膜用的夹子、两块海绵垫一起浸泡在转膜缓冲液中。撬开玻璃板剥胶,去除浓缩胶,注意不要损伤分离胶,做好标记,区分正、反面;将胶浸泡于预冷的转膜缓冲液中15min。在转膜仪的阳极和阴极之间,依次放置海绵、滤纸、膜、胶、滤纸、海绵,注意赶走各层气泡。4℃条件下,恒流30mA转移30min;
(9)封闭:将转移好的PVDF膜置于新鲜配置的封闭液中,正面朝上,37℃摇床孵育2h;
(10)加一抗:吸去封闭液,加入用封闭液稀释的一抗,4℃摇床孵育过夜;
(11)清洗PVDF膜:取出与一抗共同孵育的PVDF膜,用PBST清洗5次,每次5min;
(12)加二抗:用封闭液将LI-COR IRDyeTM800-标记的二抗稀释到推荐浓度,加入装有PVDF膜(正面朝上)的密封袋中,室温避光孵育30min;
(13)清洗:取出PVDF膜,用PBST洗5次,每次5min,摇床振荡;
扫描图像:采用Li-Cor Odyssey红外激光成像系统检测,扫描的图像保存。膜置于ddH2O中,4℃保存。
结果如图7、8所示,TF3(1μM)预处理4h再加入含有RANKL的诱导培养基培养0、5、15、30或60min,Western blot检测结果显示NF-κB和PI3K/AKT信号通路活性无显著变化,进一步的结果发现TF3对MAPK通路中JNK和p38信号通路的影响也不显著,但TF3能明显抑制ERK信号通路的活化。RANKL加入15min后,P-ERK的表达明显增加,而TF3处理组P-ERK的表达明显减少(图7)。
为了进一步明确TF3对ERK信号通路的影响,我们采用不同浓度的TF3(0、0.01、0.1、1.0μM)干预RAW264.7细胞,结果显示RANKL单独处理组,P-ERK的表达明显增加,而TF3能抑制P-ERK的表达,且抑制作用呈浓度依赖性。进一步研究发现TF3能够抑制ERK下游靶因子c-fos和NFATc1的表达,而对ERK上游调节激酶MEK1/2的活性无影响(图8)。
本发明统计分析步骤应用SPSS17.0统计软件(SPSS,Chicago,IL,USA),数据以均数±标准差表示,采用单因素方差分析及配对t检验进行统计分析。统计运算前所有数据先用Bartlett检验方法进行方差齐性检验;若资料不符合方差分析的条件,采用Kruskal-Wallis秩和检验进行统计分析。p<0.05为差异有统计学意义。
经上述实施例,得出以下结论:本实验通过TF3干预小鼠颅骨骨溶解模型,结果表明TF3能减少磨损颗粒引起的小鼠颅骨表面陷窝数及陷窝面积,增加颅骨骨密度及骨体积分数,减少骨质破坏区域成熟破骨细胞数量;且高剂量的TF3作用更为明显,可以明显减少成熟破骨细胞数量,抑制磨损颗粒引起的骨溶解。本研究结果证明TF3对磨损颗粒引起的骨溶解有一定的治疗作用,且高剂量的作用较为明显。
破骨细胞过度活化是导致骨溶解的主要原因,因此可推测TF3对磨损颗粒诱导骨溶解的治疗作用可能与其抑制破骨细胞活化有关。在小鼠颅骨骨溶解模型中发现,TF3能明显减少骨质破坏区域成熟破骨细胞数量;体外研究结果显示,TF3能抑制RANKL诱导的破骨细胞活化,且抑制作用与TF3的剂量及作用时间有关。MAPK、NF-κB或PI3K/AKT是调控破骨细胞活化的主要通路,且发现TF3对NF-κB、PI3K/AKT信号通路以及MAPK的JNK和p38信号通路的活性无影响,但能显著抑制ERK信号通路的活化。进一步研究发现TF3能够抑制ERK下游靶因子c-fos和NFATc1的表达,而对ERK上游调节激酶MEK1/2的活性无影响。研究结果表明TF3通过干预ERK/c-fos/NFATc1信号通路抑制RANKL诱导的破骨细胞活化。
- 还没有人留言评论。精彩留言会获得点赞!