酪胺酸激酶抑制剂的眼用调配物、其使用方法、及其制备方法与流程
优先权声明本申请根据美国法典第卅五卷第119条(e)款,主张2015年6月22日提出申请的第62/183,180号美国临时申请的优先权,其全文并于此以供参考。本发明关于一种眼用调配物,其包含如尼达尼布(nintedanib)、阿西替尼(axitinib)及索拉非尼(sorafenib)的酪胺酸激酶抑制剂,及使用此眼用调配物以治疗眼表疾病。
背景技术:
:眼用药物通常是用于眼睛以治疗眼睛的外部,以及通过角膜以提供眼内的治疗。通常来说,大部分的眼部疾病是以溶液、悬浮液及凝胶形式的局部药物应用进行治疗。眼用的局部药物传递系统应具备某些所需性质,例如活性医药能有良好的角膜及结膜的穿透能力、持久的角膜前停留时间、易于滴入、无刺激性,及高舒适度以减少流泪及反射性眨眼。其也应该具有适当的流变性质(rheologicalproperties)。然而,由于眼睛内存在各种解剖及病理生理上的屏障,传统的眼用剂型常面临眼部生物可利用性不佳的问题。许多在治疗眼部血管新生及与血管渗透性相关的疾病上被认为潜在有效的化合物经常难溶于水。传统方法经常尝试使用高浓度的共溶剂来溶解难溶解的药物,但这却造成毒性及眼部耐受性的问题。此外,对于某些眼部病症,有效的局部治疗仍待发展。例如,目前治疗翼状胬肉唯一核准的方法为手术。翼状胬肉为源自眼睛结膜的肉质病变或肉质生长。由于手术对于病患属于侵入性且在该病变蔓延至角膜并使视力模糊之前病患通常并无任何征兆,因此病患经常得承受其眼睛的病变直到视力受损且需要手术。此外,在手术后有很高的病变复发机会,且需要额外的手术来移除复发的病变。最近,酪胺酸激酶抑制剂,如阿西替尼、帕唑帕尼(pazopanib)及索拉非尼,已被用作眼科应用。适合眼睛的局部应用的组合物,其包含这些化合物作为具有疗效的活性成分已公开于美国专利公开号2015/0164790、美国专利公开号2014/0235678、美国专利公开号2011/0142923、及美国专利公开号2015/0141448。pct专利公开号2014/074823也公开施用至眼睛的脉络膜上腔(suprachoroidalspace(scs))的可注射组合物,其用于治疗眼后部疾病及脉络膜疾病;且seo等人所著“inhibitionofcornealneovascularizationinratsbysystemicadministrationofsorafenib”cornea(2012)31(8),907,其评估在大鼠模式中口服索拉非尼对于角膜新生血管的效果。尽管上述在眼用调配物领域中的进展,此领域仍然需要改良的调配物及治疗眼睛疾病的方法,特别地是针对缺乏非侵入式现有替代方案的疾病(如翼状胬肉)。用于眼科应用的调配物须能够易于施用而不造成眼睛刺激,因而增加病患顺服性(compliance)。该调配物也须将足以有效治疗的活性药剂浓度递送至眼睛。技术实现要素:本发明通过提供能有效治疗眼部疾病(特别是眼表疾病,如翼状胬肉)的创新眼用调配物来满足此需求。本发明的眼用调配物能被局部施用、具良好耐受性且几乎没有毒性。在一总体方面,本发明关于一种眼用调配物,其包含治疗有效量的尼达尼布、其前药或其医药上可接受的盐,以及至少一医药上可接受的赋形剂。在本发明的一个实施例中,该眼用调配物包含尼达尼布。在本发明的一个实施例中,该眼用调配物包含尼达尼布乙磺酸盐(nintedanibethanesulfonate)。在本发明的一个实施例中,该眼用调配物还包含作为表面活性剂的泰洛沙泊(tyloxapol)。在本发明的一个实施例中,该眼用调配物为一种液态悬浮液。在本发明的一个实施例中,该眼用调配物为一种局部眼用组合物。在本发明的特定的实施例中,眼用调配物包含一治疗有效量的酪胺酸激酶抑制剂的纳米化或微米化粒子及至少一医药上可接受的赋形剂,该酪胺酸激酶抑制剂选自由以下所组成的群组:阿西替尼、尼达尼布、索拉非尼、帕唑帕尼、其前药及其医药上可接受的盐。在本发明的一个较佳的实施例中,该眼用调配物包含尼达尼布或其医药上可接受的盐的纳米化粒子。在另一总体方面,本发明关于一种治疗有需求个体的眼表疾病的方法,该方法包含将本发明的眼用调配物施用至该个体的眼睛。在本发明的一个实施例中,该眼表疾病为与翼状胬肉相关联的充血、结膜翼状胬肉或复发性翼状胬肉。在本发明的一个较佳的实施例中,该眼用调配物的施用为局部眼部施用。且在又一总体方面,本发明关于一种本发明的眼用调配物的制备方法,该方法包括将酪胺酸激酶抑制剂与至少一医药上可接受的赋形剂混合,其中该酪胺酸激酶抑制剂选自由以下所组成的群组:阿西替尼、尼达尼布、索拉非尼、帕唑帕尼、其医药上可接受的前药、及其医药上可接受的盐;且该方法较佳为还包括形成酪胺酸激酶抑制剂的微米粒子或纳米粒子,内含在本发明的眼用调配物。本发明也关于一种使用本发明眼用调配物制备治疗眼表疾病的药剂的用途。附图简单说明本发明上述
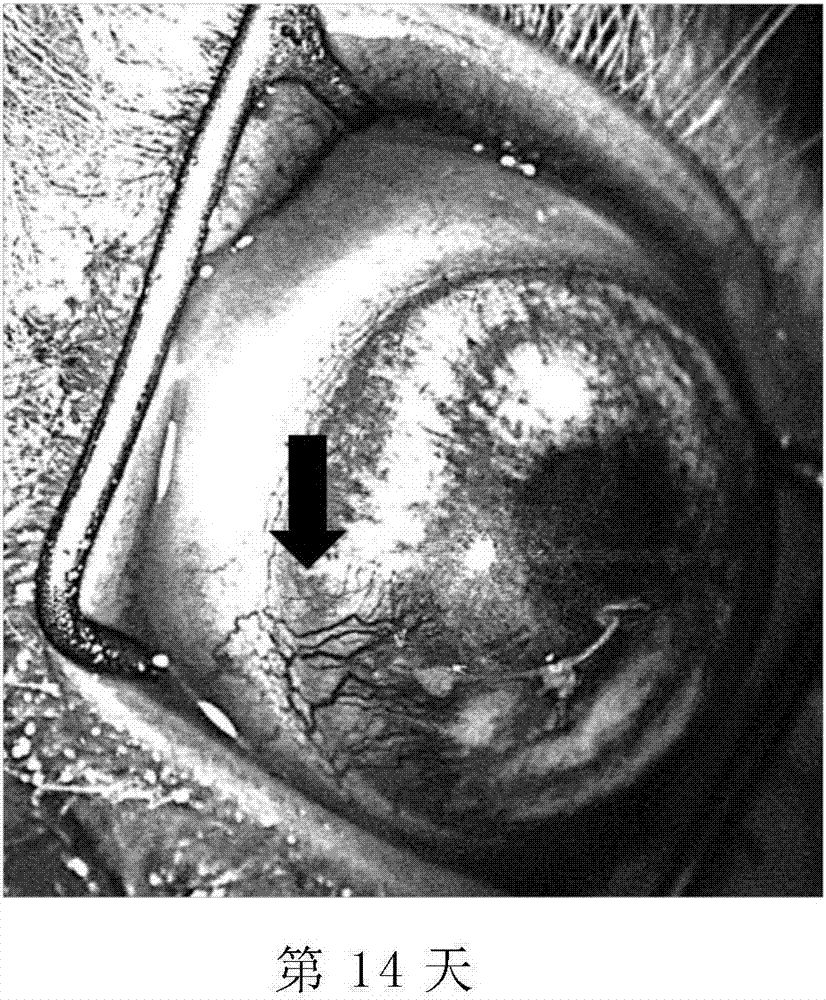
发明内容及接下来的实施方式应结合所附的附图使阅读时更清楚易懂。但是本发明应被理解为不限于这些附图所描述的特定实施例。在附图中:图1a及1b为在纽西兰白兔模式中,对角膜缝线所诱导(corneasuture-induced)的血管新生施用悬浮液载体,以每日三次(threetimesdaily,tid)持续十四天的方式治疗下,显示角膜血管新生的代表性摄影图像。图1a显示在第7天时有些微的血管新生。图1b显示在第14天时角膜的血管新生,其中箭头指向血管新生的区域。图2a及2b为在纽西兰白兔模式中,角膜缝线所诱导的血管新生以癌思停(avastin)治疗下(在缝线置入后的第1天及第7天通过结膜下注射将癌思停施用至该缝线置入的眼),显示角膜血管新生的代表性摄影图像。图2a及2b分别显示在第7天及第14天几乎没有血管新生,图2b中的箭头指向在眼睛上预期观察到任何血管新生的区域。图3a及3b为在纽西兰白兔模式中,对角膜缝线所诱导的血管新生施用0.3%阿西替尼,以每日三次持续十四天的方式治疗下,显示角膜血管新生的代表性摄影图像。图3a及3b分别显示在第7天及第14天都没有角膜血管新生。图4a及4b为在纽西兰白兔模式中,对角膜缝线所诱导的血管新生施用0.3%尼达尼布乙磺酸盐,以每日三次持续十四天的方式治疗下,显示角膜血管新生的代表性摄影图像。图4a及4b分别显示在第7天及第14天都没有角膜血管新生。图5a及5b为在纽西兰白兔模式中,对角膜缝线所诱导的血管新生施用0.3%索拉非尼,以每日三次持续十四天的方式治疗下,显示角膜血管新生的代表性摄影图像。图5a及5b分别显示在第7天及第14天仅些微角膜血管新生,其中,图5b中的箭头指向血管新生的区域;及图6显示不同表面活性剂对于尼达尼布粒径分布产生影响的分布图。具体实施方式在
背景技术:
及整篇说明书中引用或阐述许多出版品、文章、及专利,这些文献的全文各自并于此处以供参考。包括在本发明说明书中的文件、技术、材料、装置、文章或诸如此类的讨论是为了提供本发明的内容。这些讨论并非承认这些资料的任一部分将成为任何公开或请求的发明的
背景技术:
部分。除非另外定义,此处所用的所有技术及科学术语与本发明所属
技术领域:
中技术人员通常所了解的意义相同。否则,本说明书有加以定义的术语则具有根据本发明书所述的意义。本文所引用的所有专利、已公开专利申请、及出版品全文并于此处以供参考。须注意除非内文另外明确指出,否则本文及权利要求书所用的单数形式的“一”、“该”包括复数形式。本文中,术语“医药上可接受的盐”为所述化合物的盐,这些盐施用于哺乳动物时是安全及有效的,并且能具备所需的生物活性。医药上可接受的盐包括,但不限于,盐酸盐、氢溴酸盐、氢碘酸盐、硝酸盐、硫酸盐、硫酸氢盐、磷酸盐、酸式磷酸盐、异烟酸盐(isonicotinate)、碳酸盐、碳酸氢盐、乙酸盐、乳酸盐、水杨酸盐、柠檬酸盐、酒石酸盐、丙酸盐、丁酸盐、丙酮酸盐、草酸盐、丙二酸盐、泛酸盐(pantothenate)、酒石酸氢盐(bitartrate)、抗坏血酸盐、琥珀酸盐、顺丁烯二酸盐、龙胆酸盐、反丁烯二酸盐、葡萄糖酸盐、葡萄糖醛酸盐(glucuronate)、蔗糖酸盐、甲酸盐、苯甲酸盐、麸胺酸盐、甲磺酸盐、乙磺酸盐、苯磺酸盐、对甲苯磺酸盐和双羟萘酸盐(即,1,1'-伸甲基-双-(2-羟基-3-萘甲酸盐))。合适的碱盐包括,但不限于,铝盐、钙盐、锂盐、镁盐、钾盐、钠盐、锌盐、铋盐及二乙醇胺盐。医药上可接受的盐的综述可参照berge等人,j.pharm.sci.(1977)66,1-19,其并于此处以供参考。本发明关于一种眼用调配物及使用该眼用调配物以治疗眼表疾病的方法。本文中的“眼用调配物”是指适合用于眼部施用(即,施用于眼睛)的任何医药组合物。虽然该眼用调配物可被调配成以其他施用途径(如玻璃体内注射或结膜下注射)的组合物,该眼用调配物较佳地适合于局部施用于眼睛。作为说明性及非限制性的例子,适合于局部施用的眼用调配物可以为各种形式,如液体(诸如悬浮液或溶液)、乳剂、软膏、凝胶、凝胶形成的液体、含有微脂粒或微胞的悬浮液、喷雾调配物;乳化液;可进入到眼睛的下睑沟(cul-de-sac)的易溶蚀或不易溶蚀的载剂。在本发明较佳的实施例中,该眼用调配物为一种液态悬浮液。在本发明的一个实施例中,眼用调配物包含一治疗有效量的酪胺酸激酶抑制剂。术语“治疗有效量”是指引发所需生物或临床效果所需具疗效的活性化合物的量。根据本发明的实施例,“治疗有效量”为治疗眼部失调症或病症(如,眼表疾病)所需要的酪胺酸激酶抑制剂的量。本文中的术语“酪胺酸激酶抑制剂(tyrosinekinaseinhibitor,tki)”是指一具有疗效的活性化合物,其具有能够抑制一或多种酪胺酸激酶的活性,该一或多种酪胺酸激酶为例如:血小板衍生生长因子受体(platelet-derivedgrowthfactorreceptor,pdgfr)、纤维母细胞生长因子受体(fibroblastgrowthfactorreceptor,fgfr)、血管内皮生长因子受体(vascularendothelialgrowthfactorreceptor,vegfr)、类fms酪胺酸激酶-3(fms-liketyrosinekinase-3,flt3)。适合本发明使用的酪胺酸激酶抑制剂的例子包括,但不限于,尼达尼布、索拉非尼、阿西替尼、帕唑帕尼、其医药上可接受的前药及其医药上可接受的盐。该酪胺酸激酶抑制剂较佳为尼达尼布或阿西替尼,且更佳为尼达尼布。尼达尼布的较佳医药上可接受的盐包括尼达尼布乙磺酸盐。尼达尼布、索拉非尼、阿西替尼及帕唑帕尼分别具有以下化学式(i)、(ii)、(iii)及(iv)。在此也考虑了上述酪胺酸激酶抑制剂的前药,本文中的术语“前药”是指一化合物,其在体内中被转换以产生化学式(i)、(ii)、(iii)及(iv)的化合物,或其医药上可接受的盐。前药通常为在体内被转换成生物活性化合物或药物的药物前驱物。体内的转换可通过各种机制发生,包括代谢及/或化学过程,该过程又包含,例如通过在血液中或目标组织(如,眼睛)中的水解(见,例如,rautio等人,naturereviews7,255-270(2008))。以下的文献也提供了使用前药的讨论:t.higuchi及w.stella,“pro-drugsasnoveldeliverysystems,”vol.41,a.c.s.symposiumseries;bioreversiblecarriersindrugdesign,ed.edwardb.roche,americanpharmaceuticalassociationandpergamonpress,1987;及mbarot等人,“prodrugstrategiesinoculardrugdelivery”medchem,8(4):753-768,2012。根据本发明实施例的前药的说明性例子,如果化学式(i)、(ii)、(iii)及(iv)的化合物并入胺官能基,则前药可以如以下方式形成:通过以一官能基(例如,-c(o)r或-c(o)or)来取代胺基、脲基(urea)或酰胺基上的一个氢原子;或者前药可以如以下方式形成:通过以一至二个官能基(如,–c(o)r或-rr’,其中r及r’各自独立为(c1-c10)烷基、(c3-c7)环烷基、或苯甲基)来取代磺酰胺基上的一或二个氢原子。另一替代方案为,-c(o)r可为天然的α-胺酰基或–c(oh)c(o)oy1,其中y1为氢、(c1-c6)烷基、苯甲基、或-c(oy2)y3;y2为(c1-c4)烷基;y3为(c1-c6)烷基、羧基(c1-c6)烷基、胺基(c1-c4)烷基、单-n-或二-n,n-(c1-c6)烷胺基烷基、或–c(y4)y5;y4为氢或甲基;及y5为单-n-或二-n,n-(c1-c6)烷胺基吗啉基、哌啶-1-基、或吡咯烷-1-基、及诸如此类。酪胺酸激酶fgfr、pdgfr及vegfr已被认为与原发性肺部纤维化有关。尼达尼布乙磺酸盐在先前已被核准用于治疗原发性肺部纤维化,并结合多烯紫杉醇(docetaxel)以治疗局部晚期、转移性或局部复发性非小细胞肺癌(non-smallcelllungcancer,nsclc)。因此尼达尼布已在先前被用于肿瘤治疗,且就本发明人所知,市场上或临床试验上并无含有尼达尼布的眼部用药。在本发明的一个实施例中,该酪胺酸激酶抑制剂为尼达尼布、其前药或其医药上可接受的盐,如尼达尼布乙磺酸盐。在本发明的另一个实施例中,该酪胺酸激酶抑制剂为阿西替尼、其前药或其医药上可接受的盐。在本发明的另一个实施例中,该酪胺酸激酶抑制剂为索拉非尼、其前药或其医药上可接受的盐。在本发明的另一个实施例中,该酪胺酸激酶抑制剂为帕唑帕尼、其前药或其医药上可接受的盐。根据本发明的实施例,眼用调配物包含至少一种医药上可接受的赋形剂。可用的医药上可接受的赋形剂的例子包括,但不限于,表面活性剂、防腐剂、粘度调节剂、ph活性成分(如,ph调节剂、缓冲剂等)、稳定剂及渗透压调节剂(张力调节剂(tonicityadjuster))。根据本发明,可用于眼用调配物的合适的表面活性剂包括,但不限于,泊洛沙姆(poloxamer)、聚氧乙烯脂肪酸甘油酯及油、聚氧乙烯烷基醚、聚氧乙烯脂肪酸酯、脱水山梨醇酯、聚氧乙烯脱水山梨醇酯、丙二醇脂肪酸酯、脂肪酸、甘油基脂肪酸酯、α-生育酚聚乙烯乙二醇琥珀酸酯(α-tocopherylpolyethyleneglycolsuccinate,tpgs)、聚乙氧烷基芳基醚聚合物、烷基芳基聚醚醇的聚合物及诸如此类。该表面活性剂较佳为聚山梨醇酯80(tween80)、聚山梨醇酯20(tween20)、泊洛沙姆188、泊洛沙姆407或泰洛沙泊。在本发明的一个较佳实施例中,眼用调配物还包含作为表面活性剂的泰洛沙泊。根据本发明,可用于眼用调配物的合适的粘度调节剂包括,但不限于,羟丙基甲基纤维素(hydroxypropylmethylcellulose,hpmc)、羟丙基纤维素(hydroxypropylcellulose,hpc)、羧甲基纤维素(carboxymethylcellulose,cmc)、甲基纤维素(methylcellulose,mc)、羟乙基纤维素(hydroxyethylcellulose,hec)、纤维素及其衍生物、聚卡波非(polycarbophil)、聚氧乙二醇(polyoxyethyleneglycol,peg)、玻尿酸(hyaluronicacid,ha)、淀粉酶及其衍生物、支链淀粉及其衍生物、葡聚糖和其衍生物、聚乙烯吡咯烷酮(polyvinylpyrrolidone,pvp)、聚乙烯醇(polyvinylalcohol,pva)及丙烯酸系聚合物(例如,聚丙烯酸或聚甲基丙烯酸的衍生物(包括羟甲基甲基丙烯酸酯(hydroxylmethylmethacrylate,hema))、卡波姆(carbomer)或其混合物。在一个较佳的实施例中,该粘度调节剂选自由以下所组成的群组:羟丙基甲基纤维素、羧甲基纤维素钠、卡波姆、聚卡波非、聚氧乙二醇及玻尿酸。在一个更佳的实施例中,该粘度调节剂为羟丙基甲基纤维素。根据本发明,可用于眼用调配物的合适的ph活性成分(如,缓冲剂或ph调节剂)包括,但不限于,酸(如硼酸,柠檬酸,盐酸,及其盐);碱金属盐(如磷酸氢二钠、磷酸二氢钠、硼酸钠、柠檬酸钠、氢氧化钠及磷酸钾)。根据本发明的实施例,眼用调配物的ph值可在约5.0至8.0,例如5.0、5.5、6.0、6.5、7.0、7.5或8.0。该ph值较佳地在6.0及7.5之间。调整ph值可以控制眼用调配物中酪胺酸激酶抑制剂的粒径分布。调整ph值也可以提供活性成分的最佳化学稳定性。根据本发明较佳的实施例,为了抵抗由于蒸发及/或疾病所导致眼泪所形成的高渗透压,眼用调配物的渗透压相较于眼泪的渗透压为相等或稍低。举例而言,本发明的等渗透压或稍微低渗透压的眼用调配物的渗透压可在约250至300毫渗透摩尔/公斤(mosm/kg)。可使用渗透压调节剂以将调配物的渗透压调整至或接近250至350毫渗透摩尔/公斤。可使用的合适的渗透压调节剂包括,但不限于,离子型及非离子的渗透压调节剂(如氯化钠、氯化钾、葡聚糖、环糊精、甘露醇、葡萄糖、甘油、山梨糖醇、硼酸、硼砂及丙二醇及其组合)。可用于本发明眼用调配物的防腐剂包括,但不限于,氯化芐二甲烃铵、溴化十六烷基三甲铵、氯化十六烷基吡啶、十二烷基二甲基芐基溴化铵、氯化本索宁(benzethoniumchloride)、硫柳汞(thiomersal)、氯丁醇、苯甲醇、苯氧乙醇、苯乙醇、山梨酸、对羟基苯甲酸甲酯及丙酯、氯己定二葡糖酸(chlorhexidinedigluconate)、乙二胺四乙酸(edta)、聚季铵盐(polyquad)、亚氯酸钠(purite)、过硼酸盐系防腐剂、其它汞化合物、锌多元醇复合物或其混合物。在本发明一个特定的实施例,该眼用调配物包含氯化芐二甲烃铵作为一防腐剂。氯化芐二甲烃铵较佳地以约0.001至0.02%重量/体积的数量存在,例如0.001%、0.005%、0.01%或0.02%,以及最佳为约0.005%重量/体积。根据本发明的实施例,眼用调配物中的酪胺酸激酶抑制剂的浓度范围约为0.01%至约10%重量/体积,例如0.01%、0.03%、0.05%、0.1%、0.3%、0.5%、1%、2%、3%、4%、5%、6%、7%、8%、9%或10%。如本文所使用,“酪胺酸激酶抑制剂的粒子”是指包含酪胺酸激酶抑制剂的粒子。本文中的“粒子”可为微滴(droplet)、囊泡(vesicle)、微脂粒(lipsome)、微胞(micelle)等。根据本发明的实施例,酪胺酸激酶抑制剂的粒子可选择性地包含其他成分,例如磷酸胆碱,脂肪酸甘油酯,乳酸-乙醇酸共聚物(plga)及聚乳酸(pla)。在本发明特定的实施例,眼用调配物包含“微米化”、较佳为“纳米化”粒子,其包含酪胺酸激酶抑制剂,如尼达尼布、索拉非尼、阿西替尼或帕唑帕尼的纳米化或微米化粒子。如本文所使用,术语“纳米化粒子(nanonizedparticle)”、“纳米尺寸的粒子(nano-sizedparticle)”、“纳米粒子(nanoparticle)”及“次微米粒子(sub-micronparticle)”都是指包含具有次微米范围的平均粒径的具有疗效的活性化合物的粒子,且其尺寸范围为约1纳米至约低于1000纳米,较佳为100纳米至900纳米,且更佳为约200纳米至约800纳米。术语“纳米化(nanonize)”是指将粒径(particlesize)(即,粒子的平均直径)减小至纳米范围的过程。如本文所使用,术语“微米化粒子(micronizedparticle)”、“微米尺寸的粒子(micro-sizedparticle)”及“微米粒子(microparticle)”都是指包含具有平均粒径为约0.5微米至约1000微米、较佳为约0.5微米至约100微米,且更佳为约0.5微米至约10微米的具有疗效的活性化合物的粒子。术语“微米化(micronize)”是指将粒径(即,粒子的平均直径)减小至数个微米的范围的过程,例如,1微米至约10微米的范围。在本发明的一个实施例中,眼用调配物为液态悬浮液。该液态悬浮液较佳为适合局部施用,且该液态悬浮液可为“纳米悬浮液(nanosuspension)”或“微米悬浮液(microsuspension)”。如本文所使用,“纳米悬浮液”是指一种包含酪胺酸激酶抑制剂的粒子的悬浮液,其中,在悬浮液中至少多数作为纳米粒子的粒子具有小于1微米的平均粒径。纳米悬浮液也可具有一些平均粒径大于1微米的粒子于悬浮液中。对于局部眼部使用的纳米悬浮液,d90粒径为约1微米或小于1.5微米,且d50粒径为小于1微米。液态悬浮液的d90粒径是指在该悬浮液中90体积%的粒子均小于其最长尺寸,其测量是通过熟习此项技术者所知的任何现有的粒径测量技术所完成。液态悬浮液的d50粒径是指在该悬浮液中50体积%的粒子均小于其最长尺寸,其测量是通过熟习此项技术者所知的任何现有的粒径测量技术所完成。因此,d50粒径为测量粒径的体积中数(volumemedian),但其经常是指“平均(average)”或“平均(mean)”粒径。用于测定粒径的技术包括(但不限于):沉降场流分离法(sedimentationfieldflowfractionation)、光子双关频谱法(photoncorrelationspectroscopy)、雷射光散射法(laserlightscattering)及盘式离心法(diskcentrifugation)。如本文所使用,“微米悬浮液”是指一种包含酪胺酸激酶抑制剂的粒子的悬浮液,其中,在悬浮液中至少多数作为微米粒子的粒子具有为约1微米至1000微米的平均粒径。微米悬浮液也可具有一些平均粒径小于1微米的粒子于悬浮液中。对于局部眼部使用的微米悬浮液,d90粒径为约小于20微米,且d50粒径为约小于10微米。在本发明的一个实施例中,眼用调配物包含纳米粒子或微米粒子,这些粒子包含尼达尼布、或其前药、或其医药上可接受的盐,如尼达尼布乙磺酸盐。在本发明的另一个实施例中,眼用调配物包含纳米粒子或微米粒子,这些粒子包含阿西替尼、或其前药、或其医药上可接受的盐。在本发明的另一个实施例中,眼用调配物包含纳米粒子或微米粒子,这些粒子包含索拉非尼、或其前药、或其医药上可接受的盐。在本发明的另一个实施例中,眼用调配物包含纳米粒子或微米粒子,这些粒子包含帕唑帕尼、或其前药、或其医药上可接受的盐。在一个较佳的实施例中,眼用调配物包含纳米粒子,该纳米粒子包含具有d90粒径小于1微米的酪胺酸激酶抑制剂。液态介质可用于制备作为本发明眼用调配物的溶液、悬浮液及乳化液。例如,本文描述的酪胺酸激酶抑制剂或其纳米粒子可在医药上可接受的液态介质(如水、有机溶剂、水与一或多种有机溶剂的混合物)或医药上可接受的油或脂肪中悬浮。液态介质可含有其他合适的医药添加物,包括,但不限于,熟习此项技术者所知的表面活性剂、防腐剂、粘度调节剂、ph调节剂、稳定剂及渗透压调节剂。包含用于本发明眼用调配物的酪胺酸激酶抑制剂的微米化或纳米化粒子可由熟习此项技术者所知的技术所制成。用于制备微米化或纳米化粒子的技术的例子包括,但不限于,研磨、均质化、沉淀、冷冻、模板乳化技术(templateemulsiontechnique)、微脂粒形成法(liposomeformation)、乳化、微乳化法、溶剂萃取/蒸发法,超临界流体技术(supercriticalfluidtechnology)、喷雾干燥法、超声波法或它们的任何组合。举例而言,均质化及研磨法可与沉淀步骤并用,从而获得较小粒径分布的更小粒子。在一个实施例中,包含酪胺酸激酶抑制剂的微米粒子或纳米粒子通过干式或湿式研磨所制成。常用的研磨机例子包含干式研磨机,如喷射研磨机(jetmill)、传统及行星式球研磨机、震动式棍研磨机、及槌子与刀研磨机。这些干式研磨机是用于单独研磨药物以提供数微米直径的粒子。然而,使用传统干式研磨法很难获得较细微的粒子,特别是小于1微米直径的次微米粒子。湿式研磨机已被进一步指出可用于进一步减小粒径(可参考,例如,(lachman等人,"thetheoryandpracticeofindustrialpharmacy,"milling,45(1986))。对于湿式研磨机,经常使用介质研磨机(mediamill)(例如分别以多个球或珠作为研磨介质的行星式珠球研磨机)及无介质研磨机(medialessmill)(例如高压均质机)。典型的湿式研磨法包含以下步骤:将难溶解的化合物散布在液态分散介质中,接着在研磨介质存在的情况下通过机械手段来获得其中化合物的粒径已减低至理想平均粒径的分散液。该分散液介质可为,例如水、红花油、乙醇、第三丁醇、甘油、聚乙二醇、己烷或乙二醇。化合物的粒径可在至少一种介面稳定剂存在的情况下通过研磨来减小。另一替代方案为化合物在研磨后可与一或多种介面稳定剂接触。其他成分,如稀释剂,可在粒径减小的过程中被添加至含有该化合物及介面稳定剂的组合物中。分散液可连续地或以批次模式(batchmode)被制造。在研磨过程中,可以采取分散研磨机的机械手段来减小粒径。合适的分散研磨机包括球研磨机、磨碎机(attritionmill)、震动式研磨机,及如砂研磨机或珠研磨机的介质研磨机。使用介质研磨机较佳是因为提供所要的粒径减低所需要的研磨时间相对较短。对于介质研磨机,混合物研磨前的明显黏度(如,含有溶于水的活性医药成分及润湿剂的混合物)较佳为在100至约1000厘泊之间。对于球研磨机,混合物研磨前的明显黏度(如,含有溶于水的活性医药成分及润湿剂的混合物)较佳地在1至约100厘泊之间。这样的范围似乎是能帮助于在有效粒径的减小与介质侵蚀之间得到最佳平衡,但绝非对其具有限制性。任何其他由熟习此项技术者所知的机械手段可被用于减低粒径。在研磨过程中,可使用熟习此项技术者所知的任何材料以作为研磨介质来减低粒径。例如,研磨介质选自于硬质介质,较佳为球型或粒状形式,且尺寸在0.01至3毫米,更佳为在0.01至小于1毫米的范围内。对于精细的研磨,研磨介质的尺寸较佳为0.02至2毫米,且更佳为0.03至1毫米。这样的研磨介质可以较短的处理时间提供用于本发明的粒子,且对于研磨设备所造成的磨损较少。研磨材料的非限制性例子包括:氧化锆(zirconiumoxide)(如,经镁稳定的95%氧化锆)、硅酸锆、陶瓷、不锈钢、钛、铝、钇(yttrium)及玻璃。研磨介质可含有由聚合物树脂、玻璃、硅酸锆或其他合适的材料制成的粒子,其形状较佳为球形。另一替代方案为研磨介质可包含具有聚合物树脂涂层粘附于其上的芯。在研磨过程中,通过研磨将粒径减小的步骤后,可使用二次处理的传统分离技术(如,简单过滤、通过网状过滤器或筛网的筛分,及诸如此类)将研磨介质从已研磨的纳米粒子中分离。也可采用其他分离技术,如离心。另一替代方案为在研磨过程中将粒径减小后,可利用筛网移除研磨介质。根据本发明的实施例,可使用沉淀法来形成适合用于本发明眼用调配物的酪胺酸激酶抑制剂的纳米粒子。沉淀法包括纳米沉淀法。一般而言,纳米沉淀法是指先对大分子凝集成的小粒团进行成核作用,接着对所形成的核进行凝聚作用。一种可使用的纳米沉淀工艺为纳米形变法(nanomorph),其工艺是通过将酪胺酸激酶抑制剂溶解于溶剂中,以工业级规模使低水溶解度的分子从结晶状态转换成不定形的纳米粒子,并供给至混合室中以迅速地与活性医药成分(activepharmaceuticalingredient,api)的非溶剂混合,该非溶剂即为:api于其中溶解度不佳,或者api无法良好地溶解于其中的溶剂。另一种纳米沉淀的途径为使用微射流反应器技术(microjetreactortechnology),通过该技术,酪胺酸激酶抑制剂与一或多种聚合物的有机溶液在一个充满气体的腔室中间与活性医药成分的非溶剂碰撞,该一或多种聚合物例如,羟丙基甲基纤维素、羧甲基纤维素钠、卡波姆、聚卡波非、聚氧乙二醇及玻尿酸。结合了喷嘴的小直径及高速率,能造成不溶反应产物非常快速且剧烈的混合及沉淀。注入气体能将该分散液带离反应腔室。虽然粒径及粒径分布是视聚合物与化合物的去溶速度及沉淀动力学而定,但通过此方法可获得小粒径分布的小粒子。根据本发明,另一种形成纳米粒子的方法为模板乳化法(templateemulsion)。模板乳化法产生具有控制粒径分布及快速溶解表现的纳米结构粒子。模板乳化法包括:制备水包油乳化液,接着在包含所选酪胺酸激酶抑制剂及稳定剂的非水溶液中膨胀。然后去除溶剂及水。最后所得的胺酪酸激酶抑制剂的粒径分布通常是根据乳化液微滴装载胺酪酸激酶抑制剂前的尺寸,且可对乳化微滴尺寸进行最佳化以控制胺酪酸激酶抑制剂的粒径分布。此外,通过所选用的溶剂及稳定剂,可以不产生奥氏熟化(oswaldripening)或抑制奥氏熟化来实现乳化液稳定性。通过控制处理的条件,如乳化液微滴、溶剂及稳定剂的尺寸,可实现不同的粒子型态。一种例示性均质化法,即,形成一种包含纳米粒子或微米粒子的悬浮液,较佳为形成一种包含纳米粒子的悬浮液,该均质化法包括将胺酪酸激酶抑制剂、其前药或其医药上可接受的盐的粒子分散于液态分散液介质中,接着进行均质化以减小粒径至所需有效平均粒径。特定地,在高压均质化过程中,具有微米范围粒径的胺酪酸激酶抑制剂粒子的预悬浮液通过一个非常小的均质机隙缝。如此当悬浮液离开隙缝且再次达到一般空气压力时,所产生的高紊流及高剪切的空蚀力(cavitationforce)结合压缩、加速、压降及冲击力,高到足以将胺酪酸激酶抑制剂的微米粒子崩解成纳米粒子(processor,microfluidics,美国)。均质化压力及均质化循环的次数在最佳化的过程中为重要的参数,且熟悉此项技艺人士将能够决定这些参数的最佳值,从而实现所需的结果。在本发明其他的实施例中,一种眼用调配物包含分散于含有生物粘附剂材料的组合物中的胺酪酸激酶抑制剂、或其前药或其医药上可接受的盐的粒子。生物黏附剂材料可为阳离子生物粘附剂或阴离子生物粘附剂。胺酪酸激酶抑制剂的粒子(如微米粒子或纳米粒子,且较佳为胺酪酸激酶抑制剂的纳米粒子)可与包含会与该粒子结合及/或涂覆该粒子的生物粘附剂的溶液接触。在一些实施例中,具有一或多层生物粘附剂涂层的粒子可通过层接层法(layer-by-layermethod)来形成。在其他实施例,可在胺酪酸激酶抑制剂被包覆以形成粒子之前先由溶液中的生物粘附剂组装中空基质。再通过加入相反电荷聚合物而进一步稳定生物粘附剂涂层,其中该相反电荷聚合物会与生物粘附剂涂层形成坚固的静电复合体。此使得在每一个纳米粒子的周边出现非常薄但稳定的层或壳。此壳能防止粒子的附聚(agglomeration),且可在纳米粒子的表面上轻易且重复地形成。如本文所述,以生物粘附剂涂覆的粒子可具有任何合适的形状及/或尺寸。在一些实施例中,被涂覆的粒子具有实质上与核相似的形状。根据本发明的实施例,本文所述的被涂覆的粒子可为纳米粒子或微米粒子。在特定实施例中,本文所述的胺酪酸激酶抑制剂的粒子,如纳米粒子或微米粒子,可进一步包含影响粒子界面电位的表面改质官能基(surface-alteringmoieties)及/或表面改质剂。可用于本发明的表面改质官能基及/或表面改质剂可包括,但不限于,玻尿酸、卡波姆、聚卡波非、羧甲基纤维素钠(cmc-na)、氯化芐二甲烃铵、氯化苯甲十六烷胺、氯化本索宁、几丁聚糖、油胺、及溴化十六烷基三甲铵。举例而言,被涂覆的粒子的界面电位可至少为约-100毫伏、至少约-75毫伏、至少约-50毫伏、至少约-30毫伏、至少约-20毫伏、至少约-10毫伏、至少约-5毫伏、至少约5毫伏、至少约10毫伏、至少约20毫伏、至少约30毫伏、至少约50毫伏、至少约为75毫伏或至少约100毫伏。被涂覆的粒子较佳为具有在约-30至30毫伏范围内的界面电位,该范围对于保持悬浮液稳定度而言为最佳范围的界面电位。然而,也可能是其他的范围。根据本发明的实施例,生物粘附剂提供多项优点,例如,在特定区域内定位剂型、增加药物的生物可利用性、促进其与表面的较长时间的接触、及减少剂型使用频率(dosagefrequency)。在特定情况下,生物粘附剂可为可生物降解及/或可生物相容的聚合物,该聚合物包括,但不限于,玻尿酸、玻尿酸的衍生物及玻尿酸的盐(如,交联玻尿酸、玻尿酸钠、及玻尿酸的阳离子衍生物)、明胶、硫酸软骨素、胶原、交联胶原、胶原衍生物(如,琥珀胶原或甲基化胶原)、几丁聚糖、几丁聚糖衍生物(如,甲基吡咯烷酮-几丁聚糖)、几丁质及其他糖胺聚糖、硬脂胺、油胺、聚乙烯亚胺(pei)、聚-l-离胺酸(pll)、阳离子脂质(如,n-(1-(2,3-二油酰氧基)丙基)-n,n,n-三甲基铵(dotap)氯化物及二油酰磷脂酰乙醇胺(dope),及四级铵化合物及其衍生物,或其任何合适的组合。本发明也关于一种本文所述眼用调配物的用途,该用途为用于治疗或预防眼部疾病,特别是眼表疾病。根据本发明的实施例,一种治疗有需求个体的眼表疾病的方法包含将本发明眼用调配物施用至该个体的眼睛。在本发明的方法中可使用任何于本文所述的眼用调配物。本发明的眼用调配物较佳为局部地施用至个体的眼睛。一般都认为本发明的眼用调配物在哺乳类动物内的药物释放、生物可利用性及/或顺服性的性质是有利的,这使得该调配物适合用于治疗眼部失调症,例如,眼表疾病。本文所述的“个体”是指将被或已被根据本发明实施例的方法治疗的任何动物,较佳为哺乳类,最佳为人类。本文中,术语“哺乳类”包括任意哺乳类。哺乳类的例子包括,但不限于,牛、马、羊、猪、猫、狗、小鼠、大鼠、兔子、天竺鼠、非人类灵长类(nhp)(例如猴子或人猿)、人类等,且更佳为人类。本文所述的“眼表疾病”是指眼睛表面的任何疾病,该表面形成眼睛前部的外露层。本发明的方法可治疗的眼表疾病的例子包括,但不限于,眼睛前部(frontoftheeye)的血管新生(如,角膜炎、角膜移植(cornealtransplantation)或角膜成形术(keratoplasty)后续的角膜血管新生);伴随缓慢增生的结膜变性(睑裂斑);结膜乳头状瘤(conjunctivalpapilloma);由于缺氧所引起的角膜血管新生;充血;与翼状胬肉(pterygium)相关联的充血;甲状腺亢进所诱导的眼睛充血(hyperthyroidism-inducedeyecongestion);免疫或手术有关的干眼症;新生血管性青光眼(neovascularglaucoma,nvg);眼癌(ocularcancer);结膜翼状胬肉(pterygiumconjunctivae);复发性翼状胬肉;史蒂芬强森症候群(stevenjohnsonsyndrome);及麦粒肿(stye)。在本发明较佳的实施例中,待治疗的眼表疾病为与翼状胬肉相关联的充血、结膜翼状胬肉、复发性翼状胬肉或角膜血管新生。翼状胬肉为眼睛的一种病症,其始发于结膜,在眼白上的血管呈粉红色、且肉质的生长,其生长可蔓延至角膜缘。该病变可能为任何形状,但典型地为三角形或翅形。翼状胬肉病变通常具有三个部分:帽部、头部及本体/尾部。帽部为主要含有纤维母细胞且位于角膜上的平坦区;头部为牢固地附着在角膜且位于帽部后方的血管区;及本体/尾部为在球结膜上方的移动区。病患通常在该病变在蔓延至角膜(可使视力模糊)之前是无症状的。然而,在该疾病进展的早期,一些病患会感受到特定症状,如,灼热、眼睛内的粗糙感、或异物感。翼状胬肉可为原发病变,或复发病变。复发病变为最初原发病变移除后(如,通过手术移除)再发生的病变。复发翼状胬肉是指已移除或是已治疗最初或原发病变后,再度发生的翼状胬肉病变。翼状胬肉也可能与其他病症及副作用有关,如,充血。充血(发红)通常是指增加的血液流向眼睛,而导致眼睛的发红增加。充血可自行发生(原发)或其与一或多个其他眼部疾病相关的症状(次发)共同发生,如,翼状胬肉。本发明的其他实施例中,包含一治疗有效量的尼达尼布的眼用调配物可通过,例如,玻璃体内注射至眼睛的背/后部,以用于治疗特征在于血管新生、血管渗透性、水肿或发炎的其他眼睛疾病。这些眼科疾病包括,但不限于,眼部发炎及/或眼部血管新生,诸如,老年性黄斑部病变(aged-relatedmaculardegeneration,amd)、增生性及非增生性糖尿病视网膜病变、脉络膜血管新生、葡萄膜炎、虹膜红变、及新生血管性青光眼。本文中,术语“治疗”是指将组合物施用至个体,以在个体中达到需要的治疗或临床效果。在一个实施例中,“治疗”是指施用本发明眼用调配物以减低、缓和或减缓眼表疾病的进展或发展。在又一个实施例中,“治疗”是指施用本发明眼用调配物以抑制或减低眼睛的角膜血管新生及/或细胞增生。在又另一个实施例中,“治疗”是指施用本发明眼用调配物以减缓在角膜的血管新生的进展或发展(如,角膜血管新生)。在本发明的特定的实施例中,如参照翼状胬肉所用,术语“治疗”是指防止复发病变的生长或减低这种病变的复发速度;减缓、延迟或防止病变从结膜蔓延至角膜区域;减低或缓和一或多个与翼状胬肉相关的症状(如,眼睛内的灼热感或粗糙感);角膜区域的病变消退;及/或减少、减缓或缓解与翼状胬肉相关的次发病症(如,充血)。根据本发明的实施例,眼用调配物可以熟习此项技术者所熟知的任何方法施用(如,局部施用、结膜下注射、或通过如隐形眼镜的装置进行眼部给药)。在一个较佳的实施例,眼用调配物是通过例如,眼药水或通过擦涂(swab)、或是戴上载有药物的隐形眼镜、或置于眼睛之下睑沟的易溶蚀或不易溶蚀的插入物(insert)的方式局部施用。举例来说,液态的纳米悬浮液可作为眼药水施用。以眼药水形式存在的纳米粒子可快速地进入角膜及结膜并与之结合,驻留在角膜及结膜的纳米粒子可贡献在眼睛前段的眼组织以达到主要的药物浓度。眼用调配物可施用至眼睛的任何部分,较佳为施用至眼睛的表面以治疗眼表疾病。根据本发明实施例施用眼用调配物至个体的参数,例如给药量、施用频率、及施用时间长度,并不受任意特定方式所限定。这些参数的最佳值视多种因子而定,例如待治疗的个体、待治疗的特定眼表疾病、疾病的严重性等,且本领域技术人员可决定这些参数的最佳值,以达到所需治疗或临床结果。举例而言,眼用调配物可一天施用一次、或一天施用多次(例如,两次、三次、四次等)。一例示性及非限制性给药方案包含将眼用调配物作为眼药水,以一天三次的频率,持续一至二周施用。本发明也关于一种制备眼用调配物的方法,其包括一种制备本文所述的任何一种眼用调配物的方法。根据本发明的实施例,制备眼用调配物的方法包含选择性地形成酪胺酸激酶抑制剂的纳米粒子或微米粒子,及将该酪胺酸激酶抑制剂或其微米粒子或其纳米粒子与至少一医药上可接受的赋形剂组合,其中该酪胺酸激酶抑制剂选自由以下所组成的群组:阿西替尼、尼达尼布、索拉非尼、帕唑帕尼、其前药及其医药上可接受的盐。根据本发明的实施例,可在表面活性剂存在的情况下形成微米粒子或纳米粒子。可使用如本文所述的任何表面活性剂,包括,但不限于,聚山梨醇酯80、聚山梨醇酯20、泊洛沙姆188、泊洛沙姆407或泰洛沙泊,且较佳为泰洛沙泊。可使用如本文所述的任何方法来形成纳米粒子或微米粒子。较佳为使用研磨法,如,球研磨法。以下本发明的实施例为进一步说明本发明的本质。应了解以下实施例并非用以限制本发明,且本发明的保护范围由权利要求书来界定。实施例实施例1为一种眼用调配物,其包含一治疗有效量的尼达尼布、其前药或其医药上可接受的盐,以及至少一医药上可接受的赋形剂。实施例2为根据实施例1的眼用调配物,其中该至少一医药上可接受的赋形剂选自由以下所组成的群组:表面活性剂、防腐剂、粘度调节剂、ph调节剂、稳定剂及渗透压调节剂。实施例3为根据实施例2的眼用调配物,其中该表面活性剂选自由以下所组成的群组:聚山梨醇酯80、聚山梨醇酯20、泊洛沙姆188、泊洛沙姆407或泰洛沙泊。实施例4为根据实施例3的眼用调配物,其中该表面活性剂为泰洛沙泊。实施例5为根据实施例2的眼用调配物,其中该粘度调节剂选自由以下所组成的群组:hpmc、羧甲基纤维素钠、卡波姆、聚卡波非、聚氧乙二醇(peg)及玻尿酸或其盐及衍生物。实施例6为根据实施例1至5中任一者的眼用调配物,其中该眼用调配物包含微米化粒子或纳米化粒子,这些粒子包含尼达尼布、其前药或其医药上可接受的盐。实施例7为根据实施例1至6中任一者的眼用调配物,其中该调配物为供局部眼部施用的液态悬浮液,较佳为纳米悬浮液。实施例8为根据实施例1至7中任一者的眼用调配物,其中尼达尼布、其前药或其医药上可接受的盐的浓度为0.01%至10%(重量/体积)。实施例9为一种眼用调配物,其包含一治疗有效量的微米化或纳米化粒子及至少一医药上可接受的赋形剂,这些粒子包含选自由以下所组成群组的一酪胺酸激酶抑制剂:阿西替尼、尼达尼布、索拉非尼、帕唑帕尼、其前药及其医药上可接受的盐。实施例10为根据实施例9的眼用调配物,其中该酪胺酸激酶抑制剂的浓度为0.01%至10%(重量/体积)。实施例11为根据实施例9或10的眼用调配物,其中该调配物为供局部眼部施用的液态悬浮液,较佳为纳米悬浮液。实施例12为一种治疗一需求个体的眼表疾病的方法,该方法包含将实施例1至11中任一者所述的眼用调配物施用至该个体的眼睛。实施例13为根据实施例12的方法,其中该眼表疾病选自由以下所组成的群组:眼睛前部的血管新生;角膜炎、角膜移植或角膜成形术后续的角膜血管新生;伴随缓慢增生的结膜变性(睑裂斑);结膜乳头状瘤;由于缺氧所引起的角膜血管新生;充血;与翼状胬肉相关联的充血;甲状腺亢进所诱导的眼睛充血;干眼症(包括,但不限于,免疫、发炎或手术有关的干眼症);新生血管性青光眼(nvg);眼癌;结膜翼状胬肉;复发性翼状胬肉;史蒂芬强森症候群;及麦粒肿。实施例14为根据实施例13的方法,其中该眼表疾病为与翼状胬肉相关联的充血、结膜翼状胬肉、或复发性翼状胬肉。实施例15为一种制备实施例1至11中任一者的眼用调配物的方法,其包含选择性地形成酪胺酸激酶抑制剂的微米粒子或纳米粒子,及将该酪胺酸激酶抑制剂或其微米粒子或其纳米粒子与至少一医药上可接受的赋形剂混合,其中该酪胺酸激酶抑制剂选自由以下所组成的群组:阿西替尼、尼达尼布、索拉非尼、帕唑帕尼、其前药及其医药上可接受的盐。实施例16为根据实施例15的方法,其中该微米粒子或纳米粒子是通过研磨法所形成。实施例17为根据实施例15或16的方法,其中该微米粒子或纳米粒子是在泰洛沙泊的存在下形成。实施例18为根据实施例9至11的任一眼用调配物,其中该纳米粒子具有小于1微米的d90粒径。实施例19为根据实施例1至11的任一眼用调配物用于制备治疗眼表疾病的药剂的用途。实施例20为根据实施例1至11的任一眼用调配物,其是用于治疗眼表疾病。实施例21为将尼达尼布、其前药或其医药上可接受的盐用于治疗眼表疾病。实施例22为一种使用尼达尼布、其前药或其医药上可接受的盐用于制备治疗眼表疾病的药剂的用途。实施例23为一种眼用调配物,其包含:(a)一治疗有效量的纳米粒子,这些粒子包含浓度约0.1%至约10%(重量/体积)的尼达尼布或其医药上可接受的盐;(b)约0.01%至约0.3%的泰洛沙泊;及(c)约0.1%至1%的hpmc。其中该调配物为用于局部施用的液态悬浮液。实施例24为根据实施例23的眼用调配物,其具有d10粒径范围约为0.1至0.5微米。实施例25为根据实施例23或实施例24的眼用调配物,其具有d50粒径范围约为0.4至1.5微米。实施例26为根据实施例23至25的任一眼用调配物,其具有d90粒径范围约为0.5至3.0微米。实施例27为一种治疗一需求个体的眼表疾病的方法,该方法包含将根据实施例23至26的任一眼用调配物施用至该个体的眼睛。实施例28为根据实施例27的方法,其中该眼表疾病选自由以下所组成的群组:眼睛前部的血管新生;角膜炎、角膜移植或角膜成形术后续的角膜血管新生;伴随缓慢增生的结膜变性(睑裂斑);结膜乳头状瘤;由于缺氧所引起的角膜血管新生;充血;与翼状胬肉相关联的充血;甲状腺亢进所诱导的眼睛充血;干眼症(包括,但不限于,免疫、发炎或手术有关的干眼症);新生血管性青光眼(nvg);眼癌;结膜翼状胬肉;复发性翼状胬肉;史蒂芬强森症候群;及麦粒肿。实施例29为根据实施例28的方法,其中该眼表疾病为与翼状胬肉相关联的充血、结膜翼状胬肉、复发性翼状胬肉或角膜血管新生。实施例实施例1:含有尼达尼布乙磺酸盐的眼用悬浮液的制备制备0.3%尼达尼布乙磺酸盐的眼用悬浮液,其具有下表1所示的成分。表1成分重量/体积(%)尼达尼布乙磺酸盐0.3hpmc(methocelf4m)1.0聚山梨醇酯800.1磷酸氢二钠七水合物0.27磷酸二氢钠单水合物0.03氯化钠0.85氯化芐二甲烃铵(bak)0.005乙二胺四乙酸二钠0.11n氢氧化钠ph7.4纯水适量(qs)载体的制备首先,将2%的羟丙基甲基纤维素(hpmc)储备液与5x缓冲液混合,接着加入适量(qs)的纯水以获得具有最终浓度为1%hpmc储备液及20%缓冲液的载体,用于配制眼用悬浮液。该hpmc储备液及缓冲液是通过以下方式制备。hpmc储备液(2%)200毫升hpmc的制备是按照以下步骤:(1)将水(150毫升)加热至约80℃(持续搅拌下)。(2)将hpmc(4克)逐渐地加至水中(持续搅拌下)以形成hpmc溶液;(3)混合hpmc溶液,直到hpmc充分地分散及悬浮;(4)将hpmc溶液定量地转移至200毫升的容量瓶中并加入纯水至接近最终体积;(5)将该容量瓶放置在水浴中并持续地搅拌以冷却至室温;及(6)加入纯水至200毫升的最终体积,并充分混合。缓冲液(5x)的制备200毫升的5x缓冲液的制备是按照以下步骤:(1)将磷酸氢二钠七水合物(2.7毫克)、磷酸二氢钠单水合物(0.3克)、氯化钠(8.5克)、乙二胺四乙酸二钠(1.0克)、聚山梨醇酯80(1.0克)、氯化芐二甲烃铵(0.050克)溶于180毫升的纯水中;(2)利用1n氢氧化钠将ph值调整至7.4;(3)将该缓冲液转移至200毫升的容量瓶;并(4)加入纯水至200毫升的最终体积,及将缓冲液充分混合。液态悬浮液的制备接着,尼达尼布乙磺酸盐的液态悬浮液(0.3%重量/重量)是按照以下步骤来制备:(1)将尼达尼布乙磺酸盐(45.37毫克)及载体(14.97515克)秤入20毫升的闪烁小瓶中,加入搅拌子,并将该小瓶盖紧;(2)将该小瓶用超音波涡旋约1分钟;(3)将该小瓶震动约30秒以分散大的活性医药成分聚集物;(4)将该小瓶用超音波涡旋约1分钟;(5)将该小瓶在磁力搅拌板上以高速混合5分钟;(6)依照需要,重复步骤(3)至(5),直到尼达尼布乙磺酸盐已均匀地分散/悬浮且无可见的聚集物残留(总混合及超音波时间估计约为1.25小时);(7)将该小瓶在磁力搅拌器上额外混合10分钟,以获得含有0.3%尼达尼布乙磺酸盐的眼用液态悬浮液。悬浮液均匀性测试0.3%尼达尼布乙磺酸盐的液态悬浮液的悬浮液均匀性是利用高效能液相层析(hplc)方法,按照下列设置及制剂所测定。仪器设置:hplc方法是利用一仪器以表2所显示的参数来施行。表2稀释液的制备:将水与甲醇以1:1的体积比例混合制备稀释液。对于1升稀释液的制备,将500毫升的水与500毫升的甲醇混合。载体的制备:将载体(0.5克)稀释在25毫升稀释液中并混合均匀。尼达尼布乙磺酸盐的标准制备:将尼达尼布乙磺酸盐(50.33毫克)秤入50毫升的容量瓶中,将稀释液(40毫升)加入,并将该混合物利用超音波处理至溶解。该混合物通过稀释液稀释以获得1.0066毫克/毫升的尼达尼布乙磺酸盐标准储备液。该标准储备液进一步通过稀释液稀释并充分混合以获得0.0604毫克/毫升的尼达尼布乙磺酸盐标准制备品。样品制备:将0.3%尼达尼布乙磺酸盐的液态悬浮液(0.5克)秤入25毫升的容量瓶中,以稀释液(20毫升)稀释,并混合及超音波处理至溶解。该混合物进一步通过稀释液稀释并混合均匀以获得含有0.060毫克/毫升的尼达尼布乙磺酸盐的样品。在该悬浮液制备后,置于室温8小时(于工作台上持续混合),接着在室温下放置1小时(不混合),之后立刻取出闪烁小瓶的顶部、中部及底部位置的样品。通过hplc分析该样品。总共测试9组样品。0.3%尼达尼布乙磺酸盐悬浮液的悬浮液均匀性测试的结果显示:在所有的时间点及在小瓶中的所有位置均具良好的悬浮液均匀性,且9组样品的总体%相对标准偏差(%rsd)低于2%。粒径分布分析0.3%尼达尼布乙磺酸盐的眼用液态悬浮液的粒径分析是利用雷射散射粒径分布分析仪(laserscatteringparticlesizedistributionanalyzer)la-950进行三重复的测试。结果示于下表3。表3粒径分布分析测试的结果显示:上述制备的0.3%尼达尼布乙磺酸盐悬浮液的平均粒径是在微米的范围。渗透压及ph值0.3%尼达尼布乙磺酸盐悬浮液的渗透压进行三重复的测试且结果为325毫渗透摩尔/公斤(n=3)。ph值经测量为7.18。实施例2:含有阿西替尼的眼用悬浮液的制备制备为液态悬浮液形式的1%(重量/重量)阿西替尼眼用调配物。该阿西替尼液态悬浮液的成分与表1所显示的成分相同,除了该悬浮液含有1%阿西替尼而非含有0.3%的尼达尼布乙磺酸盐。其载体也是如上述实施例1的方式来制备。根据以下步骤配制该阿西替尼眼用悬浮液:(1)将阿西替尼(150.24毫克)及载体(14.8225克)秤入20毫升的闪烁小瓶中,加入搅拌子,并将该小瓶盖紧;(2)将该小瓶用超音波涡旋约2分钟;(3)将该小瓶摇动约30秒以分散阿西替尼的大聚集物;(4)将该小瓶间歇地以超音波处理及涡旋1分钟;(5)将该小瓶在磁力搅拌板上以高速混合5分钟:(6)依照需要,重复步骤(3)至(5),直到阿西替尼均匀地分散/悬浮且无可见的聚集物残留(总混合及超音波时间估计约为0.5小时);(7)将该小瓶在磁力搅拌器上额外混合10分钟,以获得含有1%阿西替尼的眼用液态悬浮液。悬浮液均匀性测试1%阿西替尼液态悬浮液的悬浮液均匀性是利用高效能液相层析(hplc)方法按照下列设置及制剂来测定。仪器设置:hplc方法是利用表4所显示的参数的仪器来进行。表4稀释液的制备:对于1升稀释液的制备,是将650毫升的0.1%磷酸(~85%)与350毫升的水混合。载体的制备:将载体(0.5克,如实施例1所述的方式制备)稀释在25毫升的稀释液中并混合均匀。阿西替尼的标准制备:将阿西替尼(51.12毫克)与稀释液(40毫升)混合并利用超音波处理至溶解。该混合物进一步用稀释液稀释以获得具有最终浓度0.2045毫克/毫升的阿西替尼的标准制备品。样品制备:秤出1%的阿西替尼悬浮液制备品(0.5克),以稀释液(20毫升)稀释,并以超音波处理至溶解。该混合物进一步通过稀释液稀释并混合均匀以获得约0.2毫克/毫升的阿西替尼样品。在该悬浮液制备后置于室温8小时(于工作台上持续混合),接着在室温下放置1小时(不混合),之后立刻取出闪烁小瓶的顶部、中部及底部位置的样品。通过hplc分析该样品。总共测试9组样品。1%阿西替尼悬浮液的悬浮液均匀性测试的结果显示:其在所有的时间点及在小瓶中的所有位置均具良好的悬浮液均匀性,且9组样品的总体%相对标准偏差(%rsd)低于2%。粒径分布分析1%阿西替尼眼用液态悬浮液的粒径分析是使用雷射散射粒径分布分析仪la-950进行三重复的测试。结果示于表5。表5粒径分布分析测试的结果显示,上述制备的1%阿西替尼悬浮液的平均粒子直径在微米的范围。特别地,该眼用悬浮液具有约1.6微米的d10粒径、约4.0微米的d50粒径及具有约8.0微米的d90粒径。渗透压及ph值1%阿西替尼悬浮液的渗透压经过三重复的测试,结果为307毫渗透摩尔/公斤(n=3)。ph值经测量为7.83。实施例3:眼用悬浮液的眼部耐受性研究将没有可见的眼部缺陷的雄性荷兰黑带兔(3至4个月大)的单双侧(双眼)局部施用悬浮液后,进行眼部耐受性的评估以及眼部暴露的特征分析。所有动物均在两眼局部施用0.3%尼达尼布乙磺酸盐微米悬浮液、0.3%索拉非尼甲苯磺酸盐微米悬浮液或0.3%阿西替尼微米悬浮液。含有索拉非尼甲苯磺酸盐的眼用悬浮液的制备分别与实施例1及2所述的尼达尼布乙磺酸盐微米悬浮液及阿西替尼微米悬浮液的制备方式相同。所有组别均在第一天、第二天及第三天以每日三次的频率施用,而在第四天以每日一次的频率施用。使用已校准过的正位移滴管将35微升/眼睛的剂量体积施用至每只眼睛的眼球上。给药期间、给药前及安乐死前进行临床观察。耐受性评估在每次给药后进行。眼部刺激测量是利用德莱兹计分系统(draizescoringsystem)在下列时间点进行:第零天(给药前)、第一天第一次给药及第三天第一次给药,及紧接第四天的最终时间点之前。在研究过程中的所有观察中,德莱兹计分系统均为0分,这与每日的观察是一致的。测试的调配物均不造成任何衍生的眼部刺激。在第四天最终给药约两小时后,将兔子通过过量巴比妥安乐死,接着取样及解剖双眼以收集眼房水、结膜及角膜。收集后,将组织秤重并在干冰上进行急冻,并放置在-80℃的冰箱中,直到进行分析。在最终时间点收集的结膜、角膜及眼房水的尼达尼布乙磺酸盐、索拉非尼甲苯磺酸盐及阿西替尼的浓度是利用合格的lc-ms/ms法进行定量。结果显示于表6。表6:于结膜、角膜及眼房水测量的尼达尼布乙磺酸盐、索拉非尼甲苯磺酸盐及阿西替尼的浓度。1纳克/克=每克结膜组织中的阿西替尼、尼达尼布乙磺酸盐、或索拉非尼甲苯磺酸盐的纳克量。2纳克/克=每克角膜组织中的阿西替尼、尼达尼布乙磺酸盐、或索拉非尼甲苯磺酸盐的纳克量。施用含有0.3%(重量/重量)的尼达尼布乙磺酸盐眼用悬浮液后,在结膜及角膜中,观察到最高浓度分别为5260纳克/克及3910纳克/克。施用0.3%(重量/重量)的阿西替尼后,在眼房水的最高浓度为15.4纳克/毫升。整体而言,所有测试的化合物在局部眼部给药三天(每日三次)后,均显示良好的耐受性。至于组织浓度,局部眼部给予0.3%(重量/重量)的尼达尼布乙磺酸盐后,在结膜、角膜有最高的浓度,而给予0.3%(重量/重量)的阿西替尼后,在眼房水有最高的浓度。实施例4:动物模式中眼用悬浮液在角膜缝线所诱导血管新生的局部功效此研究的目的为测定兔子模式中本发明眼用悬浮液的局部施用(眼药水)是否会减少角膜缝线所诱导血管新生的血管新生(campos-mollo等人,“newcornealneovascularizationmodelinrabbitsforangiogenesisresearch”ophthalmicres.(2010)45,135-141)。在这项研究中,选用约五个月大且没有可见的眼部缺陷迹象的纽西兰白兔。缝线的置入是在第一天进行。手术前,利用散瞳剂(1%的托平卡胺)扩张每只动物的右眼,并利用约10毫升的氯化芐二甲烃铵(zephirantm)(其在无菌水,u.s.p.,中稀释至1:10000(体积/体积))冲洗结膜。生理食盐水(0.9%)也与氯化芐二甲烃铵一起用来冲洗眼睛。动物在手术期间用异氟醚/氧气麻醉。依照需要,眼睛的保湿通过生理食盐水的冲洗来维持。手术在解剖或手术显微镜下进行。利用开睑器将右眼的角膜露出。在外科医生认为有需要时,适当地标记角膜中央区域。将9.0的丝缝线于距离角膜缘约1毫米以二次基质穿刺(stromalincursion)的方式置入每只动物的右眼中。缝线置入的外部点选在靠近角膜缘(1至2毫米)之处,且内部缝线点选在与角膜缘距离相等的靠近角膜中央处,以获得标准化的血管生成反应。左眼则并没有置入缝线。此实验的设计显示于下列表7:表71调配物为液态微米悬浮液对于癌思停对照组(5毫克),在第1天及第7天时通过结膜下注射将制剂调配物施用至每只动物的缝线置入的右眼,以制剂体积200微升在缝线置入后随即施用。对于悬浮液载体、0.3%阿西替尼、0.3%尼达尼布乙磺酸盐、或0.3%索拉非尼甲苯磺酸盐的组别,则以每日三次的频率给予制剂调配物,持续14天。制剂调配物是使用校准过的正位移微量滴管(以确保与结膜的接触),通过局部眼部滴入(至上角膜表面),以间隔六小时±30分钟施用。剂量体积为每剂一滴(35微升)。给药后,将上眼睑及下眼睑轻轻地接触在一起来避免制剂滴出的损失并使制剂分布至整个眼睛。眼部影像及血管新生的评估在治疗前、第7天及第14天各执行一次。将氯胺酮(ketamine)(15毫克/公斤)及右美托咪啶(dexmedetomidine)(0.25毫克/公斤)的前麻醉剂混合物通过皮下施用,且该动物在手术过程前及期间维持在异氟醚/氧气的混合的气体中。角膜影像仍从双眼(自每眼的中央、或鼻或侧头骨)拍摄。将影像进行定性及定量的评估,以评定角膜血管新生(cornealneovascularization,cnv)的程度,并测定受cnv影响的区域。对于每张选出的影像,利用数位测微器(以毫米为单位)测量血管侵入的长度(从角膜缘测量至cnv所侵入的远端)。定性评估包括角膜周围的百分比估计值(依需要使用多张影像)、及血管分支。在第7天及第14天在给予悬浮液载体的动物的右眼发现cnv的情形,其血管新生长度平均为1至2.7毫米,且最多影响50%的角膜周围,且血管有轻度至中度的分支(见图1a及1b)。相反地,给予5毫克的癌思停/眼的组别中,在一些动物观察到极少或无角膜血管新生(见图2a及2b)。值得注意地,以癌思停治疗的动物,在第14天时观察到极少的角膜血管新生(~0.5至1.1毫米),其环绕约20%至30%之间的角膜周围(图2b)。第7天时,给予阿西替尼或尼达尼布乙磺酸盐的动物中无发现角膜血管新生(见图3a及图4a)。在这些组别中,血管长度大约为0.5毫米,且大约覆盖了20%的角膜周围并具有非常些微至中度的血管分支。在第7天时,以尼达尼布乙磺酸盐治疗的组别与给予癌思停的组别是不相上下的。到了第14天时,观察到施用尼达尼布乙磺酸盐的组别的血管具有稀少及无分支的特征(图4b)。在第15天时,若比较血管长度、表面区域及血管分支,给予尼达尼布乙磺酸盐的组别相较于给予癌思停的组别为稍微更有效的。在第7天及第14天时,发现以索拉非尼甲苯磺酸盐治疗的动物具有些微的角膜血管新生(图5a及图5b),且该组别相较于癌思停控制组,在第14天时具有增加的角膜血管新生长度及区域。结果也显示于下列表8。表8:角膜血管新生(cnv)评估的概要a0=无,1=非常些微的;2=些微的;3=中度的;4=严重的在研究过程中,没有发现到与所进行处理相关的临床表征。但发现到一些眼部相关的临床表征,如,眼睛分泌物、部分闭合的眼睛、发红,但发现到的这些情况似乎是偶发且与该处理没有特别关联。上述研究的结果显示,含有尼达尼布乙磺酸盐及阿西替尼的眼用悬浮液调配物具良好的耐受性且能有效预防或减缓cnv的进展。该结果也显示尼达尼布乙磺酸盐是更有效的,或是可说与癌思停在预防或减缓cnv进展的效果是不相上下的。实施例5:含有尼达尼布的眼用纳米悬浮液的制备制备含有尼达尼布纳米粒子的液态悬浮液形式的眼用调配物。在室温下,尼达尼布(4.0克)在200毫升的0.2%泰洛沙泊溶液中通过搅拌而被分散及混合。接着,尼达尼布及泰洛沙泊的混合物在minicer的160毫升的腔室中与200微米氧化锆研磨珠一起研磨。调整研磨速度及时间以改变调配物组合物的特定特性,如,粒径分布。使用的示例性速度及时间为3000rpm进行20分钟。研磨后,评估尼达尼布粒子的粒径分布。根据上述球研磨法制造的一示例性尼达尼布纳米悬浮液的粒径及组合物示于表9。表9:1%尼达尼布眼用纳米悬浮液化学稳定性测试纳米悬浮液的化学稳定性及调配物稳定性对于维持调配物特性及所需药理作用是重要的。纳米悬浮液在不同储存条件下(包括不同储存时间及储存温度下)监测。特别地,纳米悬浮液在室温、40℃及60℃储存历时20天后及30天后被测试。储存在室温、40℃及60℃历时20天及30天后,在所有被测试的样品中都侦测到一些杂质,此数值相似于最初测试数值。表面活性剂对粒径的影响包括聚山梨醇酯80、聚山梨醇酯20、泊洛沙姆188(f-68)及泰洛沙泊等不同的表面活性剂在球研磨法中的润湿能力也被测试。根据表10显示的结果,于纳米悬浮液中加入泰洛沙泊会减低d90粒径至纳米范围,如,1微米以下,反观其他测试的表面活性剂,其d90粒径大于1微米。表面活性剂对于纳米悬浮液的粒径的稳定性的效果也在储存于室温、40℃及60℃历时20天及30天后进行评估。该结果显示于表10。表10如上方表10显示,特别地,含有泰洛沙泊的调配物4在所有测试的温度下储存20天及30天后的粒径仅增加一些或没有增加。悬浮剂对于纳米悬浮液内的粒径稳定性的效果评估作为悬浮剂的聚合物(包括羧甲纤维素钠(cmc-na7l2p,mw49000)及羟丙基甲基纤维素(hpmce4m,mw86000))在纳米悬浮液中对于粒径稳定性的效果。纳米悬浮液的粒径在储存于4℃、室温、40℃及60℃历时7天、14天及28天后进行测量。如下方表11所显示,含有hpmc(调配物1)的纳米悬浮液中的粒径仅增加一些或没有增加。表11ph值对于纳米悬浮液内的粒径稳定性的效果尼达尼布的水溶解度会随着调配物的ph值而有所变化,进而造成粒径的后续变化。因此,将不同ph值的纳米悬浮液的粒径稳定性进行评估。调配物的ph值在测量最初悬浮液的粒径前先调整至指示值。对于ph值5.8、6.5、7.0及7.4的调配物的结果显示在表12。表12a=异常数据结果显示,当在ph值高于5.8,例如在ph值6.5、7.0及7.4时,粒径在28天后仍保持稳定。纳米悬浮液的同质性为了测定纳米悬浮液的同质性,将含有各种表面活性剂或是在不同ph值下(如以下列表13所显示)的尼达尼布纳米悬浮液放置1小时,接着通过手摇动10次(幅度:10公分)。摇动后,样品从纳米悬浮液的顶部、中部及底部取出并进行尼达尼布含量的分析。该结果在表13列在“第1小时的同质性”中,可看出其在重新悬浮后显示良好的悬浮同质性。表13虽然已详述本发明细节,且参照其特定实施例,然而对本领域技术人员而言,在不背离其精神与范围下可在其中作多种变化及修饰。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种快速检测BCR/ABL基因融合的探针组、试剂盒及方法与流程
- 酪氨酸激酶抑制剂的制造方法与工艺
- 芳香族酰胺类衍生物、其制备方法及其在医药上的应用与制造工艺
- 包含5α‑还原酶抑制剂的药物组合物的制造方法与工艺
- 作为脾酪氨酸激酶抑制剂的二氮杂螺烷酮取代的噁唑衍生物的制造方法与工艺
- 包含热弹性感觉剂和TRPA1受体抑制剂的皮肤接合剃刮助剂的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 5‑溴‑7‑氮杂吲哚啉‑2‑酮类化合物及其制备方法与制造工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种抗癌药物的晶体化合物及其制备方法与制造工艺