具有药物释放功能的3D打印生物支架及其制备方法与流程
本发明涉及一种生物支架制备技术领域,尤其涉及一种具有药物释放功能的3D打印生物支架及其制备方法。
背景技术:
植入性的医用生物支架具有结构仿生、组织塑性等优点,基于3D打印技术的生物支架在医学领域得到广泛应用。目前植入性的生物支架主要起结构仿生作用。植入性的支架不仅仅需要具有结构重建的作用,还需要优良的生物相容性,从而提高支架和组织的界面结合力。
目前,这些生物支架的材料主要是金属、高分子等。而3D打印主要集中在结构的设计,从而满足3D结构具有的特殊功能,然而对于体内植入修复组织类的3D支架,除了结构要满足需求,还需要促进组织重建和再生功能。而现有的3D打印支架只是结构的满足,很难满足促进再生的生物功能需求。药物具有治疗疾病和促进再生功能,但是基于3D打印技术的生物支架,由于其制备过程的影响,很难实现支架内的药物控释,特别是活性大分子、活性因子等药物的释放。现有技术主要通过支架表面涂覆药物实现支架的药物释放功能,但很难实现在支架内部装载药物,且难于实现药物缓释,难于实现蛋白类、水溶性类等药物的装载,特别是蛋白类药物的活性维持,难于实现多种药物联合作用。
脂质体是一种装载药物的载药双分子层,人们可以将水溶性、脂溶性大分子,蛋白,活性因子等装载到脂质体内。此外,通过在脂质体双分子层进行基团修复,可以实现脂质体表面带上特殊的基团。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种具有药物释放功能的3D打印生物支架及其制备方法,通过对3D技术打印的生物支架表面进行化学修饰,并在脂质体双分子层表面接枝上特殊的基团,然后将二者表面的基团交联,从而可以将负载药物的纳米脂质体结合到3D打印支架表面,制备出具有药物释放功能的3D打印生物支架。
本发明的一种具有药物释放功能的3D打印生物支架的制备方法,包括以下步骤:
(1)提供表面修饰有活性基团的3D打印生物支架;
(2)提供表面修饰有活性基团的载药脂质体溶液;
(3)在4-40℃下,将步骤(1)的3D打印生物支架浸入步骤(2)得到的载药脂质体溶液中,使二者表面修饰的活性基团发生反应,得到具有药物释放功能的3D打印生物支架。
进一步地,在步骤(1)中,活性基团为巯基、羧基、氨基、邻苯二酚基团和邻苯二醌基团中的一种或几种。
进一步地,在步骤(1)中,采用3D打印技术得到生物支架。
进一步地,在步骤(1)中,生物支架的材质为左旋聚乳酸(PLLA)、聚谷氨酸(PGA)、聚乳酸-羟基乙酸共聚物(PLGA)或聚己内酯(PCL)。
进一步地,在步骤(2)中,活性基团为巯基、羧基、氨基、马来酰亚胺基团中的一种或几种。
进一步地,在步骤(2)中,载药脂质体中负载的药物为脂溶性药物或水溶性药物。
进一步地,水溶性药物为水溶性小分子、水溶性大分子、蛋白类、细胞因子类和抗体中的一种或几种。
进一步地,在步骤(2)中,负载的药物为紫杉醇、阿霉素、布洛芬、吉西他滨、青霉素钠、顺铂、凝血酶、胰岛素、辅酶Q10、BMP-2和抗体中的一种或几种。
进一步地,在步骤(2)中,载药脂质体溶液的制备方法包括以下步骤:
将磷脂类、胆固醇类和磷脂酰乙醇胺-聚乙二醇衍生物与药物在有机溶剂中混匀,然后除掉有机溶剂,再用磷酸盐缓冲溶液(PBS)进行水化,处理后得到载药脂质体溶液。
进一步地,当所载药物为脂溶性药物时,将磷脂类、胆固醇类和磷脂酰乙醇胺-聚乙二醇衍生物与脂溶性药物溶于有机溶剂,旋转蒸发除尽有机溶剂,真空干燥过夜,后用磷酸盐缓冲溶液进行水化,处理后得到载药脂质体溶液。
进一步地,当所载药物为水溶性小分子药物时,将磷脂类、胆固醇类和磷脂酰乙醇胺-聚乙二醇衍生物溶于有机溶剂,再向其中加入药物水溶液,超声1-10min得到均匀乳液,旋转蒸发形成胶状物,后用磷酸盐缓冲溶液进行再水化,处理后得到载药脂质体溶液。
进一步地,当所载药物为水溶性大分子、蛋白类、细胞因子或抗体时,将磷脂类、胆固醇类和磷脂酰乙醇胺-聚乙二醇衍生物溶于有机溶剂,得到混合溶液,然后将药物溶于磷酸盐缓冲溶液中,边搅拌边将混合溶液缓慢加入其中,除掉有机溶剂后得到载药脂质体溶液。
进一步地,磷脂类为二棕榈酰磷脂酰胆碱(DPPC)、二硬脂酰基卵磷脂(DSPC)、二油酰基卵磷脂(DOPC)、二硬脂酰基磷脂酰乙醇胺(DSPE)、大豆磷脂或蛋黄卵磷脂;胆固醇类为胆固醇或硫酸胆固醇。
进一步地,有机溶剂为氯仿、乙醇或乙醚。
进一步地,磷脂酰乙醇胺-聚乙二醇衍生物的分子式如下:
其中,R1为羧基、氨基、马来酰亚胺基或巯基。当R1为羧基时,以下简称为DSPE-PEG-COOH(磷脂酰乙醇胺-聚乙二醇-羧基)。当R1为氨基时,以下简称为DSPE-PEG-NH2(磷脂酰乙醇胺-聚乙二醇-氨基)。当R1为马来酰亚胺基时,以下简称为DSPE-PEG-MAL(磷脂酰乙醇胺-聚乙二醇-马来酰亚胺)。当R1为巯基时,以下简称为DSPE-PEG-SH(磷脂酰乙醇胺-聚乙二醇-硫醇)。
进一步地,磷脂类、胆固醇类和磷脂酰乙醇胺-聚乙二醇衍生物的摩尔比为55-96:10-50:2-10。
进一步地,对水化后的溶液进行过膜整形处理,通过0.22-0.8μm的微孔滤膜后得到载药脂质体溶液。
本发明还提供了一种采用上述方法所制备的具有药物释放功能的3D打印生物支架。
借由上述方案,本发明至少具有以下优点:
本发明通过等离子体、多巴胺、碱处理等方法的处理,使3D打印生物支架表面修饰特定的活性基团,例如氨基、羧基、羟基、巯基等,从而将3D打印生物支架表面功能化;制备载药的脂质体,在制备过程中,将脂质体带上特定基团,例如羧基、氨基、巯基等基团,从而有利于脂质体和支架上的基团发生化学结合作用;采用本发明的方法制备出支架表面接枝载药脂质体的给药体系,通过脂质体实现不同药物的装载,例如脂溶性药物或水溶性药物;本发明制备的生物支架同时具有结构仿生性、组织相容性和疾病治疗功能,从而使支架由常规功能走向治疗功能。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如后。
附图说明
图1是本发明实施例1中生物支架的制备过程示意图;
图2是本发明实施例3中生物支架的制备过程示意图;
图3是本发明实施例4中生物支架的制备过程示意图;
图4是本发明实施例5中生物支架的制备过程示意图;
图5是本发明实施例6中生物支架的制备过程示意图;
图6是本发明实施例6中未负载药物的3D打印生物支架侧面的SEM图;
图7是本发明实施例6中负载药物后的3D打印生物支架正面的SEM图。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
实施例1
将1g PLLA和0.13g的KH550(氨基丙基三乙氧基硅烷)混合后,进行3D打印,得到表面氨基化的3D打印支架。
按照摩尔比96:19:4:20,称取二棕榈酰磷脂酰胆碱、胆固醇、DSPE-PEG-COOH(磷脂酰乙醇胺-聚乙二醇-羧基)和紫杉醇,用30mL氯仿将其溶解后转移至茄形瓶中。旋蒸掉溶剂后得到脂质薄膜,真空干燥过夜。向茄形瓶中加入20mL的PBS水化得到脂质体粗乳。用超声探头对脂质体粗乳进行处理,超声时间为3min,超声功率为40%,工作2s停1s。将超声后的脂质体溶液依次通过0.8μm、0.45μm、0.22μm的微孔滤膜,得到表面修饰有羧基的脂质体溶液。
将上述制备的表面氨基化的3D打印支架浸入表面修饰有羧基的脂质体溶液中,于4℃下浸泡2h,氨基与羧基发生反应形成酰胺键,从而将脂质体成功嫁接于3D打印支架的表面。
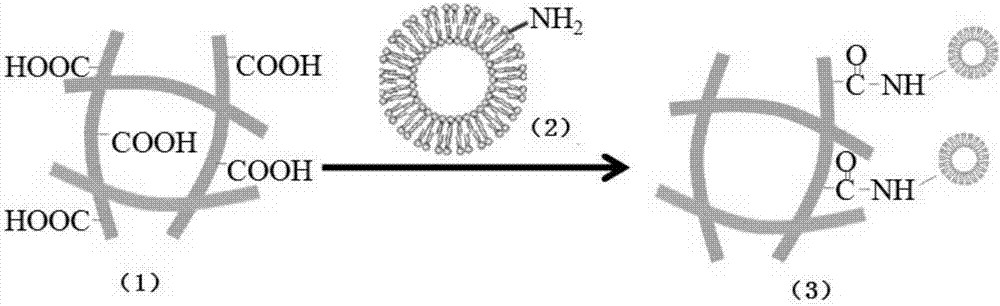
图1为本实施例具有药物释放功能的3D打印生物支架的制备过程示意图,其中图1中的(1)代表表面氨基化的3D打印支架,图1中的(2)代表表面修饰有羧基的脂质体溶液;图1中的(3)代表具有药物释放功能的3D打印生物支架。
实施例2
将洗净干燥的3D打印支架(材质为PLLA)浸泡在6wt%己二胺/正丙醇溶液中于60℃振荡一定时间后,用乙醇和去离子水反复清洗并真空干燥可得到氨基官能团化的3D打印支架。
按照摩尔比80:40:4:20,称取大豆磷脂、胆固醇硫酸盐、DSPE-PEG-COOH(磷脂酰乙醇胺-聚乙二醇-羧基)和布洛芬,然后用30mL氯仿将其溶解后转移至茄形瓶中。旋转蒸发除掉溶剂后得到脂质薄膜,真空干燥过夜除尽有机残留。向茄形瓶中加入20mL的PBS水化得到脂质体粗乳。用超声探头对脂质体粗乳进行处理,超声时间为3min,超声功率为20%,工作1s停1s。将超声后的脂质体溶液依次通过0.45μm、0.22μm的微孔滤膜,得到表面修饰有羧基的脂质体溶液。
将上述制备的表面氨基化的3D打印支架浸入表面修饰有羧基的脂质体溶液中,于37℃下浸泡2h,氨基于羧基发生反应形成酰胺键,从而将脂质体成功嫁接于3D打印支架的表面。
实施例3
利用3D打印技术打印出PCL生物支架。对该支架进行等离子处理,具体如下:将3D打印支架置于等离子装置内固定于电极之间,当内室压达到10-3Torr时,以0.2Torr注入氧气以及气态丙烯酸,并且施加射频功率50W以及负极脉冲电压维持30s,即得表面修饰有羧基的3D打印支架。
按照摩尔比90:30:3:15,称取蛋黄卵磷脂、胆固醇、DSPE-PEG-NH2(磷脂酰乙醇胺-聚乙二醇-氨基)和阿霉素,并将其溶解于2mL乙醇溶液中,得到脂质乙醇溶液。量取20mL的PBS溶液置于烧杯中,在转速为300rpm,温度为40℃的条件下向烧杯中逐滴加入脂质乙醇溶液。滴加完成后,继续搅拌,当烧杯中乙醇完全挥发掉后,即得表面修饰有氨基的脂质体溶液。
将上述制备的表面羧基化的3D打印支架浸入表面修饰有氨基的脂质体溶液中,于25℃下浸泡2h,氨基与羧基发生反应形成酰胺键,从而将脂质体成功嫁接于3D打印支架的表面。
图2为本实施例具有药物释放功能的3D打印生物支架的制备过程示意图,其中图2中的(1)代表表面羧基化的3D打印支架,图2中的(2)代表表面修饰有氨基的脂质体溶液;图2中的(3)代表具有药物释放功能的3D打印生物支架。
实施例4
将实施例1制备的表面氨基化的支架浸入500μL含800μg N-琥珀酰亚胺S-乙酰三乙酸(SATA)的二甲亚砜溶液中,45min后取出,然后用PBS反复清洗,再将其浸入500μL浓度为25mM pH为7.4的含羟胺17.4mg EDTA溶液中,浸泡2h即得表面巯基化的3D打印支架。
按照摩尔比80:40:4:20,称取DPPC(二棕榈酰磷脂酰胆碱)、Chol(胆固醇)、DSPE-PEG-MAL(磷脂酰乙醇胺-聚乙二醇-马来酰亚胺)和吉西他滨,用5mL乙醚将除吉西他滨外的物质溶解。在300rpm/min的搅拌条件下缓缓加入1mL上述吉西他滨溶液,超声3min得到均匀乳液。旋转蒸发后得到胶状体,再加入20mL的PBS进行再水化,水浴1h后得到脂质体溶液。
将上述制备的表面巯基化的3D打印支架浸入表面修饰有马来酰亚胺基的脂质体溶液中,于4℃下浸泡2h,巯基与马来酰亚胺基发生反应形成硫醚键,从而将脂质体成功嫁接于3D打印支架的表面。
图3为本实施例具有药物释放功能的3D打印生物支架的制备过程示意图,其中图3中的(1)代表表面巯基化的3D打印支架,图3中的(2)代表表面修饰有马来酰亚胺基的脂质体溶液;图3中的(3)代表具有药物释放功能的3D打印生物支架。
实施例5
将3D打印支架(材质为PGA)浸入在2mg/mL的多巴胺溶液中(以Tris-HCL为溶剂),在氧气的氧化的作用下,多巴胺发生自聚合反应,在3D打印支架表面生成聚多巴胺薄层,室温反应16小时后可得到表面修饰有PDA涂层的3D打印支架,在该3D打印支架表面的多巴胺的聚合产物中,含有大量的邻苯二酚基团、氨基、亚氨基及巯基等官能团。
按照摩尔比90:30:4.8:10,称取DPPC(二棕榈酰磷脂酰胆碱)、Chol(胆固醇)、DSPE-PEG-SH(磷脂酰乙醇胺-聚乙二醇-硫醇)和凝血酶,用乙醚将除了凝血酶之外的物质其溶解。在搅拌条件下缓缓加入1mL凝血酶溶液,超声5min得到均匀乳液。旋转蒸发得到胶状体,再加入30mL的PBS进行再水化,水浴30min后得到脂质体溶液。
将上述表面PDA修饰的3D打印支架浸入脂质体溶液中,在碱性环境下,多巴胺聚合产物中的邻苯二酚基团被氧化成邻苯二醌基团,在4℃下浸泡2h,邻苯二醌基团与巯基反应,即可形成硫醚键将脂质体成功嫁接于3D打印支架的表面。
图4为本实施例具有药物释放功能的3D打印生物支架的制备过程示意图,其中图4中的(1)代表经过碱处理的表面附有聚多巴胺3D打印支架,图4中的(2)代表表面修饰有巯基的脂质体溶液;图4中的(3)代表具有药物释放功能的3D打印生物支架。
实施例6
按照摩尔比80:40:4:15,称取DPPC(二棕榈酰磷脂酰胆碱)、Chol(胆固醇)、DSPE-PEG-NH2(磷脂酰乙醇胺-聚乙二醇-氨基)和胰岛素,用2mL的乙醇将其溶解。在搅拌条件下(300rpm/min,37℃)缓缓加入到20mL的PBS中,持续搅拌,待乙醇被挥尽后得到脂质体溶液。
将实施例5制备的表面PDA修饰的3D打印支架浸入上述脂质体溶液中,在碱性环境下,多巴胺聚合产物中的邻苯二酚基团被氧化成邻苯二醌基团,在4℃下浸泡持续2h,邻苯二醌基团与氨基发生反应,即可将脂质体成功嫁接于3D打印支架的表面。
图5为本实施例具有药物释放功能的3D打印生物支架的制备过程示意图,其中图5中的(1)代表经过碱处理的表面附有聚多巴胺3D打印支架,图5中的(2)代表表面修饰有氨基的脂质体溶液;图5中的(3)代表具有药物释放功能的3D打印生物支架。
图6为本实施例中未负载药物的3D打印生物支架侧面的SEM图;图7为本实施例中负载药物的3D打印生物支架正面的SEM图。从图中可以看出脂质体的表面嫁接对于生物支架的外部形貌没有明显影响。
实施例7
采用PCL和PGA混合溶液,利用3D打印技术打印出生物支架。对该支架进行等离子处理,具体如下:将3D打印支架置于等离子装置内固定于电极之间,当内室压达到10-3Torr时,以0.2Torr注入氧气以及气态丙烯酸,并且施加射频功率50W以及负极脉冲电压维持30s,即得表面修饰有羧基的3D打印支架。
按照摩尔比55:10:2:15,称取DSPC、硫酸胆固醇、DSPE-PEG-NH2(磷脂酰乙醇胺-聚乙二醇-氨基)和青霉素钠,先将DSPC、硫酸胆固醇、DSPE-PEG-NH2溶解于2mL乙醇溶液中,得到脂质乙醇溶液。再加入青霉素钠的水溶液,然后超声1-10min得到均匀乳液,旋转蒸发形成胶状物。再加入磷酸盐缓冲溶液进行再水化,离心表面修饰有氨基的脂质体溶液。
将上述制备的表面羧基化的3D打印支架浸入表面修饰有氨基的脂质体溶液中,于25℃下浸泡2h,氨基与羧基发生反应形成酰胺键,从而将脂质体成功嫁接于3D打印支架的表面。
实施例8
按照摩尔比96:50:10:30,称取DPPC(二棕榈酰磷脂酰胆碱)、Chol(胆固醇)、DSPE-PEG-NH2(磷脂酰乙醇胺-聚乙二醇-氨基)和辅酶Q10,用2mL的乙醇将其溶解。在搅拌条件下(300rpm/min,37℃)缓缓加入到20mL的PBS中,持续搅拌,待乙醇被挥尽后得到脂质体溶液。
将实施例5制备的表面PDA修饰的3D打印支架浸入上述脂质体溶液中,在碱性环境下,多巴胺聚合产物中的邻苯二酚基团被氧化成邻苯二醌基团,在4℃下浸泡持续2h,邻苯二醌基团与氨基发生反应,即可将脂质体成功嫁接于3D打印支架的表面。
实施例9
将洗净干燥的3D打印支架(材质为PLLA和PLGA)浸泡在6wt%己二胺/正丙醇溶液中于60℃振荡一定时间后,用乙醇和去离子水反复清洗并真空干燥可得到氨基官能团化的3D打印支架。
按照摩尔比70:30:10:20,称取DOPC、胆固醇、DSPE-PEG-COOH(磷脂酰乙醇胺-聚乙二醇-羧基)和顺铂,然后用30mL氯仿将其溶解后转移至茄形瓶中。旋转蒸发除掉溶剂后得到脂质薄膜,真空干燥过夜除尽有机残留。向茄形瓶中加入20mL的PBS水化得到脂质体粗乳。用超声探头对脂质体粗乳进行处理,超声时间为3min,超声功率为20%,工作1s停1s。将超声后的脂质体溶液依次通过0.45μm、0.22μm的微孔滤膜,得到表面修饰有羧基的脂质体溶液。
将上述制备的表面氨基化的3D打印支架浸入表面修饰有羧基的脂质体溶液中,于37℃下浸泡2h,氨基于羧基发生反应形成酰胺键,从而将脂质体成功嫁接于3D打印支架的表面。
实施例10
将1g PLLA和0.13g的KH550(氨基丙基三乙氧基硅烷)混合后,进行3D打印,得到表面氨基化的3D打印支架。
按照摩尔比96:19:4:20,称取二棕榈酰磷脂酰胆碱、胆固醇、DSPE-PEG-COOH(磷脂酰乙醇胺-聚乙二醇-羧基)和BMP-2,用2mL的乙醇将其溶解。在搅拌条件下(300rpm/min,37℃)缓缓加入到20mL的PBS中,持续搅拌,待乙醇被挥尽后得到脂质体溶液。
将上述制备的表面氨基化的3D打印支架浸入表面修饰有羧基的脂质体溶液中,于25℃下浸泡2h,氨基与羧基发生反应形成酰胺键,从而将脂质体成功嫁接于3D打印支架的表面。
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!