一种利用干细胞构建的人源化乙型肝炎鼠模型及应用的制作方法
本发明属于临床医学、实验医学、再生医学和病毒学领域,具体地说,是一种基于干细胞技术构建的人源化慢性乙型肝炎模型。
背景技术:
乙型肝炎病毒(hbv)流行范围广,据统计,我国有1亿左右的乙肝病毒感染者。由于慢性乙型肝炎无法彻底治愈,给社会、家庭和患者带来了沉重负担。同时,因为乙型肝炎病毒只能在高级灵长类动物中致病,动物实验模型常需使用猿猴类动物,猿猴类实验成本高,操作复杂,实验周期长。而目前较为常用的鸭乙型肝炎模型是基于禽类载体,与人类的种属差异大,具有较大的局限性。由于慢性乙型肝炎难以治愈,根据2015年世界卫生组织报告,约有30%的乙肝患者会进入肝硬化和肝癌,对患者生命健康造成重大威胁。而目前常用的肝硬化动物模型,均为手术(如胆总管结扎)和化学药物(四氯化碳、二甲基亚硝胺等),这一类肝硬化模型为非乙肝病毒所致,故在疾病的机制与转归上与乙肝所致的肝硬化有很大的差异,不适合用于研究乙肝肝纤维化、肝硬化发生发展的机制与治疗。在我国肝癌患者中,由乙肝引起的原发性肝癌占肝癌的绝大多数,原发性肝癌是我国常见的恶性肿瘤之一,病死率高,早期诊断困难。其它利用小动物构建的肝癌模型多基于化学药物,这类模型与基于hbv感染引起的肝癌模型有很大区别,尤其是在发病机制上,存在明显的差异。
因此,建立能感染乙型肝炎病毒并致病的小型哺乳动物模型有很大的科学意义和应用价值。但由于乙肝病毒无法感染小型哺乳动物,因此小型哺乳动物研究模型建立困难,严重阻碍了肝脏疾病发生进展机制、治疗和转归的研究,并很大程度上限制了治疗方案的优化。建立人源化慢性乙型肝炎鼠模型将为研究病毒性肝炎机制及其治疗与疾病转归提供良好的研究载体。骨髓间充质干细胞具有潜在分化能力,可以分化成成熟肝细胞,我们之前的研究发现人骨髓间充质肝细胞(hbmsc)能嵌合在肝损伤的鼠肝内,嵌合率高达50-95%,为建立新型人源化鼠模型奠定了基础,此鼠模型对阐明慢性乙型肝炎病毒生物学特性、发病机制、研发和筛选治疗新药物等提供保障,为研究肝炎及其治疗与疾病转归提供良好的研究载体。
技术实现要素:
本发明正是针对现有原发性肝癌模型的缺陷,提供了一种人源化乙型肝炎鼠模型,本发明是通过以下技术方案来实现的:
本发明公开了一种利用干细胞构建的人源化慢性乙型肝炎鼠模型,所述的鼠模型由以下步骤获得:
1)、获取人干细胞;
2)、将人干细胞植入肝损伤的鼠,致使鼠体内存在移植的人干细胞1*104^8;
3)、人肝细胞嵌合:鼠肝脏内,移植的人干细胞分化形成人肝细胞;人源化的免疫系统:鼠体内,移植的人干细胞分化形成人免疫系统;
4)、hbv感染人源化鼠;
5)、hbv感染的确认、肝脏疾病的确认。
作为进一步地改进,本发明所述的人干细胞的来源是健康人分离培养的干细胞或商品化的细胞系。
作为进一步地改进,本发明所述的肝损伤的鼠包括化学药物所致的肝脏化学损伤和外科手术所致的肝脏物理损伤,鼠是正常小鼠或免疫缺陷小鼠或正常大鼠或免疫缺陷大鼠。
作为进一步地改进,本发明所述的步骤3)中,移植的人干细胞分化形成人肝细胞,干细胞可表达人肝细胞标志物是hsa,hla,alb或ntcp等。
作为进一步地改进,本发明所述的步骤3)中,由移植的干细胞分化而来的人免疫系统,可检测到表达人淋巴细胞标志物的cd45+/cd4+/cd8+t细胞。
作为进一步地改进,本发明所述的步骤5)中,hbv感染的确认是通过检测鼠体内持续稳定存在hbv完整颗粒实现,肝脏疾病可以是肝炎、及在该肝炎模型上进展形成肝脏纤维化、肝硬化或肝癌。
作为进一步地改进,本发明当明确该模型鼠肝脏存在点状坏死等症状的为肝炎;当明确该模型鼠肝脏存在炎症和纤维化,为肝脏纤维化;当出现肝硬化的特征性改变假小叶,为肝硬化;当鼠模型体内存在组织学和影像学可观察到的原发性肝癌病灶,为肝癌。
本发明还公开了一种利用干细胞构建的人源化慢性乙型肝炎模型在进行新型抗病毒药物或新型抗纤维化药物或新型抗癌药物的开发研究的应用。
本发明还公开了一种利用干细胞构建的人源化慢性乙型肝炎鼠模型在进行抗病毒药物耐药性研究的应用。
本发明还公开了一种利用干细胞构建的人源化慢性乙型肝炎鼠模型在进行慢性乙型肝炎发病机制研究的应用。
与现有模型相比,本发明的有益效果如下:
为阐明乙型肝炎病毒生物学特性、慢性乙型肝炎发病的具体机制,本发明从生化指标、免疫组织化学,基因表达水平,蛋白组学等多个方面进行研究。发现通过诱导肝损害并移植人骨髓间充质干细胞并注射乙型肝炎病毒,形成人源化慢性乙型肝炎鼠模型。该模型的独特优势为该模型鼠具有由干细胞分化而来的人类免疫系统和嵌合在鼠肝内的人的肝细胞。在鼠模型体内存在有表达早期标志的人淋巴细胞,表达肝细胞表面标志物的人肝细胞。在注射乙型肝炎病毒后,在小鼠肝内嵌合的人肝细胞基因组中,可发现乙肝病毒dna的整合。在小鼠的血清中,可发现持续稳定的乙肝病毒。分离该病毒可继续感染健康小鼠。说明这种病毒颗粒是完整具有感染性的。在完成乙肝病毒的感染后,在生化水平上,可观察到持续的转氨酶升高,说明存在持续的慢性肝脏炎症。该模型能研究慢性乙型肝炎的整个自然病史,及乙型肝炎病毒慢性感染过程中的人源化免疫应答反应。与现有的动物模型相比,该人源化慢性乙型肝炎病毒模型有明显的优势。相比灵长类动物模型,鼠模型缩短了实验周期,简化了实验操作,同时,极大的降低了实验费用。而相比鸭慢性乙型肝炎模型,小鼠为哺乳动物,与人类更为接近,该鼠模型可直接研究人类乙型肝炎病毒。与其他乙肝病毒感染的转基因鼠类模型相比,该模型小鼠在体内构建了基于干细胞转分化而来的人肝细胞和人类的免疫系统,人类的免疫系统会识别并攻击感染了乙肝病毒的人类肝细胞,进而产生肝脏的炎症损伤。该模型最大程度上模拟了人体内乙肝病毒和人体免疫系统之间的相互作用。
人源化慢性乙型肝炎鼠模型除了用于研究乙肝病毒感染机制外,还可用于治疗的研究。针对目前乙肝药物的开发,大多基于肝细胞水平,缺乏有效的动物模型进行药物的全面评估。该模型简单易得,很好的模拟了人体感染乙肝病毒的应答反应,对于慢性乙型肝炎药物的研发具有重大意义。
该慢性乙型肝炎鼠模型在常见的饲养观察中,可发生乙肝肝纤维化、乙肝肝硬化以及乙肝原发性肝癌。
附图说明
图1为运用人源化慢性乙型肝炎小鼠模型进行新型抗病毒药物开发研究示意图;
图2为运用人源化慢性乙型肝炎大鼠模型进行抗病毒药物耐药性的研究示意图;
图3运用人源化慢性乙型肝炎大鼠模型慢性乙型肝炎的发病机制研究示意图;
图4运用人源化肝纤维化、肝硬化大鼠模型进行新型抗纤维化药物开发研究示意图;
图5运用人源化乙型肝炎原发性肝癌小鼠模型进行乙型肝炎原发性肝癌的发病机制研究示意图;
具体实施方式
本发明公开了一种基于干细胞技术构建的人源化慢性乙型肝炎鼠模型,下面对本发明的技术方案作进一步地说明:
一种利用干细胞构建的人源化慢性乙型肝炎鼠模型,鼠模型通过以下步骤获得:
1)、获取人干细胞,人工细胞的来源是健康人分离培养的干细胞或商品化的细胞系。
2)、将人干细胞植入肝损伤的鼠,致使鼠体内存在移植的人干细胞1*104^8;肝损伤的鼠包括化学药物所致的肝脏化学损伤和外科手术所致的肝脏物理损伤,鼠是正常小鼠或免疫缺陷小鼠或正常大鼠或免疫缺陷大鼠。
3)人肝细胞嵌合:鼠肝脏内,移植的人干细胞分化形成人肝细胞,移植的人干细胞分化形成人肝细胞,干细胞可表达人肝细胞标志物是hsa,hla,alb或ntcp等;
4)人源化的免疫系统:鼠体(肝脏、血液、脾脏、骨髓等)内,移植的人干细胞分化形成人免疫系统。由移植的干细胞分化而来的人免疫系统,可检测到表达人淋巴细胞标志物的cd45+/cd4+/cd8+等t细胞。
5)、hbv感染人源性鼠。
6)、hbv感染的确认、通过检测鼠体内持续稳定存在hbv完整颗粒。
7)、肝脏疾病的确认:当明确该模型鼠肝脏存在点状坏死等症状的为肝炎;当明确该模型鼠肝脏存在炎症和纤维化,为肝脏纤维化;当出现肝硬化的特征性改变假小叶,为肝硬化;当鼠模型体内存在组织学和影像学可观察到的原发性肝癌病灶,为肝癌。
本发明的利用干细胞构建的人源化慢性乙型肝炎鼠模型可以用于进行新型抗病毒药物开发研究,抗病毒药物耐药性研究和慢性乙型肝炎发病机制研究。
下面根据说明书附图,通过具体实施例对本发明的技术方案作进一步地说明:
鼠模型的具体制备步骤为:
一、获取人干细胞
1、分离培养人干细胞
1)获得纯化人干细胞。
2)干细胞培养,传代。
3)培养于20℃-40℃,2%-10%co2的培养箱中。
2、获取商品化的分离或冻存的人干细胞或细胞系。
二、干细胞移植入肝损伤的鼠
1、获得不同品系的实验鼠,实验鼠包括正常小鼠、免疫缺陷小鼠、正常大鼠和免疫缺陷大鼠。
2、通过腹腔、肌肉、外周静脉注射、口服或灌胃的方式予以肝损药物,或予以外科部分肝切除术,建立肝损伤鼠模型。
3、通过外周静脉、门静脉、脾脏或肝脏注射的方式移植1×104-8干细胞。
三、hbv感染人源性鼠
通过外周静脉、皮下、肌肉或腹腔每只鼠注射乙型肝炎病毒。
实施例1运用人源化慢性乙型肝炎小鼠模型进行新型抗病毒药物开发研究。
1、将150只人源化慢性乙型肝炎小鼠随机分为3组,每组50只,3组治疗前的乙肝病毒为1*10^7左右,无显著性差异。
2、实验组予以治疗剂量的新型抗病毒药物,对照组1予以一线核苷类似物抗病毒药物替诺福韦(100mg/kg)口服,对照组2予以干扰素注射抗病毒治疗。
3、在治疗1周,2周,4周,8周,12周,24周分别检测各组小鼠乙肝病毒载量,并检测其他主要脏器的不良反应(如肾功能、心肌酶谱等)
4、将治疗组的小鼠病毒载量变化与替诺福韦对照组和干扰素对照组的病毒曲线进行比较,从而得出新型抗病毒药物的抗病毒作用与目前一线抗病毒药物替诺福韦、干扰素的差异。
5、通过副反应的观察,得出新型抗病毒药物的不良反应,为进行一期临床试验奠定基础。
图1运用人源化慢性乙型肝炎小鼠模型进行新型抗病毒药物开发的示意图。说明了运用该人源化慢性乙型肝炎小鼠模型,可有效的进行新药的筛选实验,途中新药组的病毒滴度下降曲线与一线药物替诺福韦接近,优于干扰素组。
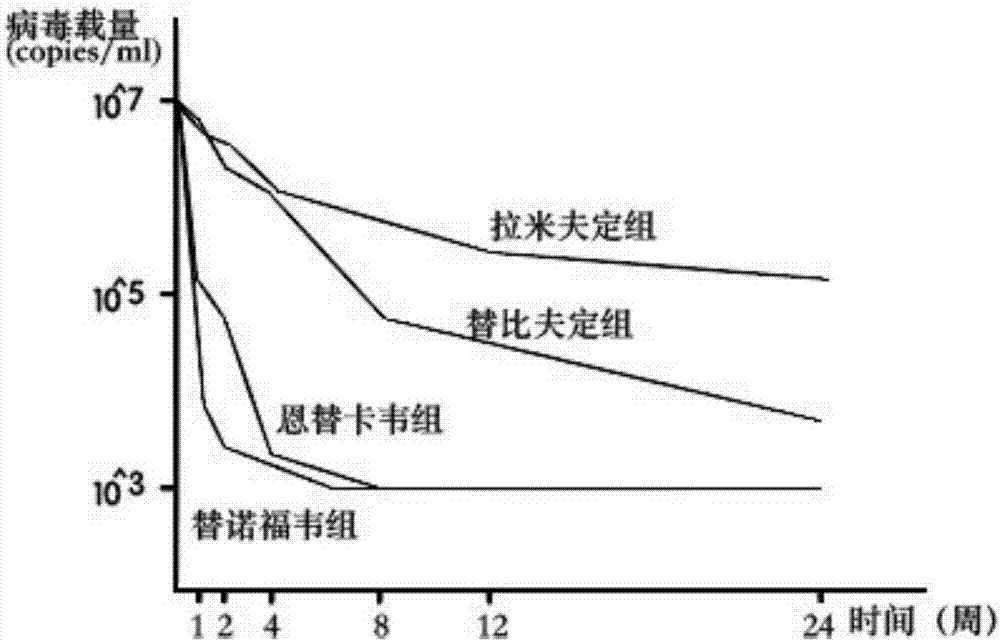
实施例2:运用人源化慢性乙型肝炎大鼠模型进行抗病毒药物疗效和耐药性的研究。
1、200只人源化慢性乙型肝炎大鼠随机分为四组,各组间年龄、性别、体重和基线乙肝病毒载量无显著差异。
2、四组分别予以治疗剂量的常用的抗病毒药物拉米夫定、替比夫定、恩替卡韦及替诺福韦。
3、在治疗1周,2周,4周,8周,12周,24周分别检测大鼠乙肝病毒载量。
4、将各组各时间点的病毒载量绘制曲线,比较各组间差异,评估目前常用的抗病毒药物疗效和耐药性。
图2运用人源化慢性乙型肝炎大鼠模型进行抗病毒药物耐药性研究中各组的病毒曲线图。说明了运用该人源化慢性乙型肝炎大鼠模型,可有效的进行抗病毒药物的耐药性研究。图中替诺福韦、恩替卡韦组24周的病毒滴度下降曲线优于替比夫定、拉米夫定组。
实施例3:运用人源化慢性乙型肝炎大鼠模型慢性乙型肝炎的发病机制研究。
1、50只人源化慢性乙型肝炎大鼠,从注射病毒开始作为起始点。
2、在起始点后1天,3天,5天,7天,14天,30天,60天,90天,180天,360天各处死5只大鼠,收取血清、肝组织等样本。
3、通过蛋白组、基因组等多组学关联分析,寻找在乙肝病毒感染和慢性乙型肝炎发生发展中的基因组、蛋白组变化谱。
4、找出其中有显著差异的基因和蛋白,并进行相关通路的分析,揭示慢乙肝发病机制。
图3运用人源化慢性乙型肝炎大鼠模型慢性乙型肝炎的发病机制研究的示意图。该模型可从蛋白质组学,基因组学水平研究,通过多组学联合的方式进行慢性乙型肝炎的机制研究。
实施例4:运用人源化肝纤维化、肝硬化大鼠模型进行新型抗纤维化药物开发研究
1、将75只人源化肝纤维化、肝硬化大鼠随机分为3组,每组25只,3组治疗前的肝纤维化程度无显著性差异。
2、实验组予以治疗剂量的新型抗纤维化药物,对照组予以安络化纤丸口服和一线抗病毒药替诺福韦口服。
3、在治疗1周,2周,4周,8周,12周,24周分别检测大鼠肝纤维化程度,并检测其他主要脏器的不良反应(如肾功能、心肌酶谱等)
4、将治疗组的大鼠肝纤维化程度与安络化纤丸、替诺福韦对照组的肝纤维化程度进行比较,从而得出新型抗纤维化药物的抗纤维化作用与目前一线抗纤维化药物安络化纤丸的差异。
5、通过副反应的观察,得出新型抗纤维化药物的不良反应,为进行一期临床试验奠定基础。
图4说明了运用该人源化乙型肝炎肝硬化大鼠模型,可有效的进行新药的筛选实验。图中新药组的肝硬化程度下降曲线与抗纤维化药物安络化纤丸组接近,略好于安络化纤丸组,明显优于一线药物替诺福韦组。
实施例5:运用人源化乙肝原发性肝癌小鼠模型进行肝癌的机制研究。
1、100只人源化乙肝原发性肝癌小鼠,予以常规饲养,无治疗干预。
2、在7天,14天,30天,60天,90天各处死10只小鼠,收取血清、肝组织等样本。
3、通过蛋白组、基因组等多组学关联分析,寻找在肝癌转移过程中的基因组、蛋白组变化谱。
4、找出其中有显著差异的基因和蛋白,并进行相关通路的分析,揭示肝癌的转移机制。
图5所示该小鼠肝癌模型可从蛋白质组学,基因组学水平研究,通过多组学联合的方式进行乙型肝炎原发性肝癌的机制研究。
以上例举的仅是本发明的优选实施方式,本发明并不限于以上实施例,本领域技术人员在不脱离本发明的精神和构思的前提下直接导出或联想到的其他改进和变化,均应认为包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!