一种尺寸和形貌可调的贵金属纳米粒子的制备方法及应用与流程
本发明涉及一种贵金属纳米粒子的制备方法,属于晶体生长及检测技术领域。
背景技术:
金属纳米粒子存在量子尺寸效应,特殊的电子结构决定了其具有异于宏观粒子独特的物理化学性质。迄今为止,已经有大量关于金属纳米粒子在催化、生物、光学、医学等领域的应用报道。在众多金属中,涉及金、银纳米粒子的研究内容较多,成果丰富,包括合成、修饰、组装、光电性质及在各方面的应用。值得指出的是,在表面增强拉曼光谱(SERS)领域,大量不同形貌、尺寸及组装方式的金、银纳米粒子被相继报道,加速了SERS在理论及应用方面的发展。同时,SERS科学家对进一步增强散射信号强度的渴求,也激励了纳米专家在制备方法上日益寻求突破。
通常,纳米结构的制备方法主要分为自上往下(top-down)和自下往上(Bottom-up)两种。自上往下的方法,即通过一些仪器将大块的金属,不断地分割磨细变小,直到粒子尺寸达到纳米尺度。然而,该制备方法不仅需要较为昂贵的仪器设备,同时在粒子的尺寸和形貌的控制方面也存在诸多限制。自下而上,即通过化学还原方法从原子或分子开始逐渐堆积,形成簇(cluster),再进一步堆积,直到尺寸在纳米范围之内,并停止堆积。以金纳米粒子为例,此自下而上的合成方法早在1857年已被法拉第发明。比较著名的是Turkevich-Frens法,分别由Turkevich于1951年首创,并在1973年被Frens改进。该方法是在沸腾的水溶液中以柠檬酸钠作为保护剂和还原剂,还原氯金酸,形成金纳米粒子(参见文献:Frens G. Nat. Phys. Sci., 1973, 241, 20.)。相似的方法也可以用于银纳米粒子的合成,Lee等最先将柠檬酸钠用作还原合成银纳米粒子,被称为Lee-Meisel法(参见文献:Lee P. C., Meisel D., J. Phys. Chem. 1982, 86, 3391.)。
除了Turkevich-Frens方法,一种基于硫醇控制合成金纳米粒子的方法,命名为Brust-Schiffrin法,也被广泛采用并进行了深入的研究(参见文献:Perala, S. R. K., Kumar, S., Langmuir, 2013, 29, 9863)。然而,此法合成的纳米粒子较小,一般为几个纳米,难以在SERS领域获得应用。此外,还有研究人员将高聚物、生物分子等引入反应体系,作为添加剂、稳定剂或还原剂合成纳米粒子。而以上提及的研究大都集中在水作为溶剂的体系中进行。Xia等发展了以多元醇法在高温时还原贵金属盐合成大量形貌各异的金、银纳米粒子,且方法的系统性及通用性非常好(参见文献:Wiley, B., Sun, Y. G. Langmuir, 2005, 21, 8077)。Xia所用的合成方法,实验均在有机溶剂(乙二醇)中进行。当然,除了以上一步合成法,即纳米粒子的成核和生长同时发生,另外一种方法称为种子生长法,即以一步法合成的粒子(通常是小粒径的)作为种子,在生长液中再次生长,可将成核与生长分开,以便能更加精确的控制反应过程,获得粒子不同的尺寸和形貌。
纳米粒子的尺寸对其光学性质有显著的影响。常见的55 nm Au在520 nm处有一明显的吸收峰,若纳米粒子的尺寸大于或小于55 nm,吸收峰位置会发生红移或蓝移。当纳米粒子尺寸小于10 nm, 该吸收峰一般会消失。此外,纳米粒子的形貌对其光学性质也有重要影响。如球状的纳米粒子在消光光谱上只能检测到一个峰,棒状的纳米粒子有两个峰,片状的能检测到三个甚至四个峰。在SERS领域,纳米粒子的尺寸对探针分子的散射强度存在显著的影响,一般10 nm以下的粒子基本没有增强效应。此外,粒子的形貌及粒子之间的聚集方式及聚集程度等均对最终的SERS信号强度产生重要的影响。
因此,为了调控粒子的不同性质,以期在各个领域获得合适的应用,合成不同尺寸及形貌的纳米粒子是其首要任务。最为常见的方法,即调控尺寸的Turkevich-Fens法以及调控形貌的多元醇法。Turkevich-Fens法通过调节柠檬酸钠与氯金酸的加入比例调节粒子的尺寸,而多元醇法通过添加不同的助剂及控制反应的各项参数获得不同形貌的纳米结构。然而,这些经典的方法存在一些局限性。如:两种方法均需要在高温下进行反应,必须搭建回流冷凝装置,因此操作过程复杂;整个反应从加热、反应到冷却,过程耗时长;多元醇法中额外的助剂,尤其是强吸附的试剂,可能影响粒子后续的修饰或应用。因此,发展一种常温反应、操作简单、反应迅速、不含额外助剂的“绿色”合成方法显得尤为重要。
技术实现要素:
本发明针对现有技术存在的不足,提供一种合成工艺简单、反应迅速、绿色环保且尺寸和形貌可调的贵金属纳米粒子的制备方法。
实现本发明目的的技术方案是提供一种尺寸和形貌可调的贵金属纳米粒子的制备方法。按体积计,在每10份反应体系中,包括氯金酸或硝酸银水溶液 1份、有机溶剂 1~7 份、纯水7~1 份、抗坏血酸水溶液 1份;其中,控制有机溶剂:水相为1~7∶9~3;在常温、剧烈搅拌条件下,将反应物混合,反应后静置10~50分钟,再经离心清洗,在水溶液中保存,得到一种尺寸和形貌可调的金或银纳米粒子;
所述的有机溶剂为丙酮、四氢呋喃或乙醇中的一种,选择不同的有机溶剂和有机溶剂与水相的体积比,调控贵金属纳米粒子的尺寸和形貌,调控方法如下:
(1)以丙酮为有机溶剂,加入氯金酸水溶液,调控丙酮与水的体积比从1:9~7:3逐渐上升,得到平均尺寸从65 nm~400 nm逐渐增大、形貌为球形的金纳米粒子;
(2)以四氢呋喃为有机溶剂,加入氯金酸水溶液,调控四氢呋喃与水的体积比从1:9~7:3逐渐上升,得到平均尺寸从25 nm~330 nm逐渐增大、形貌为球形的金纳米粒子;
(3)以乙醇为有机溶剂,加入氯金酸水溶液,调控乙醇与水的体积比从1:9~7:3逐渐上升,得到平均尺寸从66 nm~930 nm逐渐增大、形貌为球形或花状的金纳米粒子;
(4)以丙酮为有机溶剂,加入硝酸银水溶液,调控丙酮与水的体积比从1:9~7:3逐渐上升,依次分别得到的银纳米粒子形貌为球形、花状和不规则团聚结构;
(5)以四氢呋喃为有机溶剂,加入硝酸银水溶液,调控四氢呋喃与水的体积比从1:9~7:3逐渐上升,得到平均尺寸从1.3 µm~0.4 µm逐渐减小、形貌为花状的银纳米粒子;当四氢呋喃与水的体积比为7:3时及以上,为不规则结构;
(6)以乙醇为有机溶剂,加入硝酸银水溶液,调控乙醇与水的体积比从1:9~7:3逐渐上升,得到平均尺寸从1.3 µm~0.7 µm逐渐减小、形貌为花状的银纳米粒子,当乙醇与水的体积比为7:3及以上时,为不规则结构。
调控方法(4)中,当丙酮与水的体积比为1:9时,得到平均直径为360 nm的球形银纳米粒子;当丙酮与水的体积比为3:7~5:5时,得到平均尺寸从380 nm下降为220 nm的花状银纳米粒子;当丙酮与水的体积比为7:3时及以上,为不规则团聚结构。
本发明技术方案还包括按上述制备方法得到的尺寸和形貌可调的贵金属纳米粒子的应用,其一是将得到的金纳米粒子用于对孔雀石绿浓度为10-9~10-7 mol·dm-3的水溶液进行表面增强拉曼光谱检测;其二是将得到的银纳米粒子用于对孔雀石绿浓度为10-11~10-9 mol·dm-3的水溶液进行表面增强拉曼光谱检测。
本发明通过选择常见与水互溶的有机溶剂,与水溶液形成混合反应体系,提供了一种在常温下操作简单、反应迅速并可以调控金、银纳米粒子尺寸及形貌的制备方法。鉴于纳米粒子的尺寸和形貌对SERS性质的影响,采用4-硝基苯硫酚遴选出不同溶剂体系中的最优化SERS基底,对危害添加剂孔雀石绿分子的最低检测浓度分别可达10-9 mol·dm-3及10-11 mol·dm-3。
本发明提供了一种合成工艺简单、反应迅速且不需加热的绿色制备方法,用于合成粒径及形貌可调的金、银纳米粒子。该法是通过遴选常见的有机溶剂,确定以丙酮、四氢呋喃、乙醇与水组成混合体系,选择一定的混合比例,以常见的氯金酸和硝酸银作为氧化剂提供高价态的金和银,以抗坏血酸为还原剂,在有机溶剂/水混合体系中,通过氧化还原反应获得不同尺寸及形貌的金、银纳米粒子。经测试,通过该法获得的一系列金、银纳米粒子均具有良好的SERS增强效应。以4-硝基苯硫酚为探针分子,遴选出同一混合溶剂中SERS信号最强的基底。以该最优化的SERS基底,分别对危害添加剂孔雀石绿进行检测,金、银纳米粒子均能获得较低的检测浓度,为快速、方便的制备高灵敏的SERS基底提供坚实的实验基。
本发明与现有技术相比,具有如下优点:
1、反应在常温常压下进行,条件温和,因此无需加热、加压等复杂、昂贵的装置,降低了生产成本。
2、反应采用的试剂均为常见的有机溶剂,价格低廉,可显著提高批量化制备SERS基底的可行性。
3、反应迅速,耗时短。部分有机无机溶剂混合比例下,反应完成的时间在“秒级”,最慢的时间也不超过“分钟级”。
4、合成的纳米粒子无额外添加强吸附的表面活性剂,可为较弱吸附的分子提供优良的SERS基底。
附图说明
图1是本发明实施例一在丙酮和水的混合体系中,按不同丙酮:水的比例合成Au纳米粒子的SEM图;
图2是本发明实施例一中以4-硝基苯硫酚(PNTP)为探针分子,在图1中的四种基底上获得的SERS谱图;
图3是本发明实施例一中以图2的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图;
图4是本发明实施例一在四氢呋喃和水的混合体系中,按不同四氢呋喃:水的比例合成Au纳米粒子的SEM图;
图5是本发明实施例一中以4-硝基苯硫酚(PNTP)为探针分子,在图4中的四种基底上获得的SERS谱图;
图6是本发明实施例一中以图5的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图;
图7是本发明实施例一在乙醇和水的混合体系中,按不同乙醇:水的比例合成Au纳米粒子的SEM图;
图8是本发明实施例一中以4-硝基苯硫酚(PNTP)为探针分子,在图7中的四种基底上获得的SERS谱图;
图9是本发明实施例一中以图8的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图;
图10是本发明实施例二在丙酮和水的混合体系中,按不同丙酮:水的比例合成Ag纳米粒子的SEM图;
图11是本发明实施例二中以4-硝基苯硫酚(PNTP)为探针分子,在图10中的四种基底上获得的SERS谱图;
图12是本发明实施例二中以图11的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图;
图13是本发明实施例二在四氢呋喃和水的混合体系中,按不同四氢呋喃:水的比例合成Ag纳米粒子的SEM图;
图14是本发明实施例二中以4-硝基苯硫酚(PNTP)为探针分子,在图13中的四种基底上获得的SERS谱图;
图15是本发明实施例二中以图14的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图;
图16是本发明实施例二在乙醇和水的混合体系中,按不同乙醇:水的比例合成Ag纳米粒子的SEM图;
图17是本发明实施例二中以4-硝基苯硫酚(PNTP)为探针分子,在图16中的四种基底上获得的SERS谱图;
图18是本发明实施例二中以图17的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图。
具体实施方式
实施例一:
一、系列Au纳米粒子的制备
1、前驱溶液的配制:
(1)0.33%氯金酸水溶液:将6 mL 1% (w/w)的氯金酸溶液(1g HAuCl4·4H2O溶解在100 mL水中)加入到12 mL水中,混合均匀。
(2)10 mmol·dm-3抗坏血酸水溶液:称取0.176 g 抗坏血酸粉末加入到10 mL水中,溶解并混合均匀。
2、金纳米粒子的制备:
(1)丙酮/水体系:
控制溶剂丙酮 :水相体积比分别为 1 : 9、3 : 7、5 : 5、7: 3,在剧烈搅拌的条件下依次在反应瓶中加入0.33%氯金酸水溶液 1 mL、丙酮 1、3、5、7 mL、纯水体积分别为7、5、3、1 mL、10 mmol·dm-3抗坏血酸水溶液 1 mL,使反应瓶中的总体积为10 mL,保持搅拌3分钟后停止,静置30分钟,离心清洗后在水溶液中保存,可获得丙酮/水体系中的Au纳米粒子。
参见附图1,它是本实施例按不同丙酮:水的比例合成Au纳米粒子的SEM图,标尺为600 nm;其中,丙酮:水的比例,(A) 图为 1:9; (B) 图为3:7; (C) 图为5:5; (D) 图为7:3;由图(A)~(D)可以看出,Au纳米粒子为球形,粒子的直径从65 ~ 400 nm逐渐增大,单分散性较好。
(2)四氢呋喃/水体系:
控制四氢呋喃:水相体积比分别为 1 : 9、3 : 7、5 : 5、7: 3,在剧烈搅拌的条件下依次在反应瓶中加入0.33%氯金酸溶液 1 mL、四氢呋喃1、3、5、7 mL、纯水体积分别为7、5、3、1 mL、10 mmol·dm-3抗坏血酸溶液 1 mL,使反应瓶中的总体积为10 mL,保持搅拌3分钟后停止,静置30分钟,离心清洗后在水溶液中保存,可获得四氢呋喃/水体系中的Au纳米粒子。其粒子直径从25 ~ 330 nm逐渐增大,参见附图4,它是本实施例在四氢呋喃和水的混合体系中,按不同四氢呋喃:水的比例(A) 1:9; (B) 3:7; (C) 5:5; (D) 7:3合成Au纳米粒子的SEM图,标尺为300 nm;图4(A)~(D)中可见,形貌为球形。
(3)乙醇/水体系:
控制乙醇:水相体积比分别为 1 : 9、3 : 7、5 : 5、7: 3,在剧烈搅拌的条件下依次在反应瓶中加入0.33%氯金酸溶液 1 mL、乙醇1、3、5、7 mL、纯水体积分别为7、5、3、1 mL、10 mmol·dm-3抗坏血酸溶液 1 mL,使反应瓶中的总体积为10 mL,保持搅拌3分钟后停止,静置30分钟,离心清洗后在水溶液中保存,可获得乙醇/水体系中的Au纳米粒子。其粒子直径从66 ~ 930 nm逐渐增大,参见附图7,它是本实施例在乙醇和水的混合体系中,按不同乙醇:水的比例(A) 1:9; (B) 3:7; (C) 5:5; (D) 7:3合成Au纳米粒子的SEM图,标尺为400 nm;由图(A)~(D)可见,所获得的粒子的形貌由球形发展为花状。
二、应用4-硝基苯硫酚确定最优Au的SERS基底:
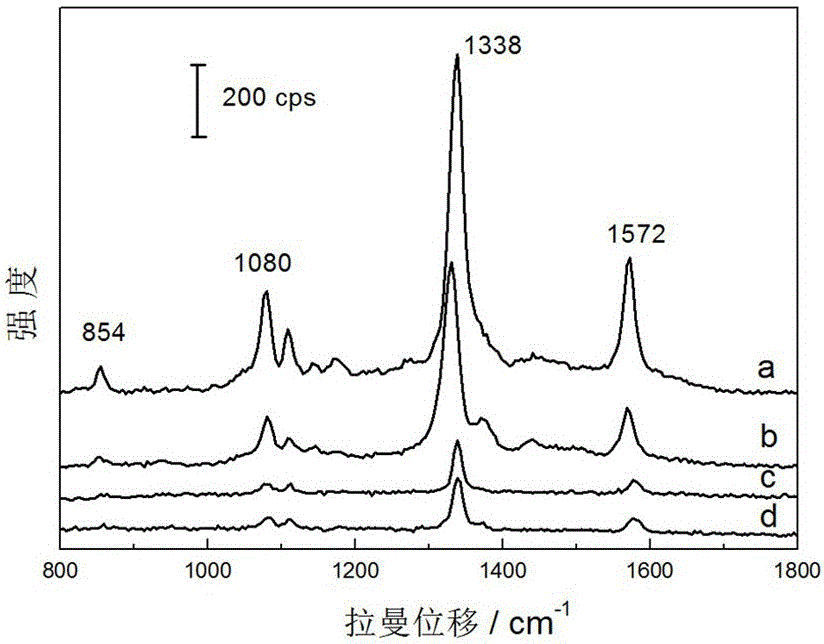
配制1 mmol·dm-3的4-硝基苯硫酚的乙醇溶液,以该分子为探针分子。将所有体系中合成的Au纳米粒子离心清洗后,分别滴加至洁净的硅片上,真空抽干,制成SERS基底。将此基底分别浸泡在1 mmol·dm-3的4-硝基苯硫酚的乙醇溶液中,8小时后取出,乙醇冲洗,氮气吹干后,进行SERS检测。SERS测试时,每片基底随机取10处采集SERS信号,将获得的信号强度平均。参见附图2、5和8,图2是本实施例中以4-硝基苯硫酚(PNTP)为探针分子,在图1中的四种基底上获得的SERS谱图,其中, (a) 以A为基底; (b) 以B为基底; (c) 以C为基底; (d) 以D为基底;图5是本实施例中以4-硝基苯硫酚(PNTP)为探针分子,在图4中的四种基底上获得的SERS谱图,其中, (a) 以A为基底; (b) 以B为基底; (c) 以C为基底; (d) 以D为基底;图8是本实施例中以4-硝基苯硫酚(PNTP)为探针分子,在图7中的四种基底上获得的SERS谱图,其中, (a) 以A为基底; (b) 以B为基底; (c) 以C为基底; (d) 以D为基底。经对比发现,SERS信号最优化的基底分别为丙酮:水相体积比为1:9,四氢呋喃:水相体积比为3:7,以及乙醇:水相体积比为3:7的所制备的Au纳米粒子。由图2可知,谱线a具有最强的SERS信号,约为1100 cps。因此,在丙酮/水体系中,65 nm的球形Au纳米粒子为该体系中的最优SERS基底。同样地,在四氢呋喃/水体系、乙醇/水体系中的最优SERS基底分别是58 nm的Au球形粒子和240 nm的Au纳米花状结构。
最优Au基SERS基底对危害添加剂分子孔雀石绿的检测:
以孔雀石绿为待检测的危害添加剂分子,配制一系列浓度的孔雀石绿水溶液,分别将SERS信号最优化的金纳米粒子滴加到洁净的硅片上,真空抽干,制成SERS基底。将基底分别浸泡在各种不同浓度的孔雀石绿水溶液中,8小时后取出,水冲洗,氮气吹干后,进行SERS检测。其结果参见附图3、6和9,图3是本实施例中以图2的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图,其中,(a)10-5 mol·dm-3; (b) 10-6 mol·dm-3; (c) 10-7 mol·dm-3; (d) 10-8 mol·dm-3; (e) 10-9 mol·dm-3 ;图6是本实施例中以图5的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图,其中,(a)10-5 mol·dm-3; (b) 10-6 mol·dm-3; (c) 10-7 mol·dm-3; (d) 10-8 mol·dm-3 ;图9是本实施例中以图8的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图,其中,(a)10-5 mol·dm-3; (b) 10-6 mol·dm-3; (c) 10-7mol·dm-3; (d) 10-8 mol·dm-3; (e) 10-9 mol·dm-3; (f) 10-10 mol·dm-3;由图可知,以上三种Au纳米粒子能检测到孔雀石绿的最低浓度分别为10-8、10-7 和10-9 mol·dm-3。
实施例二:
一、系列Ag纳米粒子的制备
1、前驱溶液的配制:
(1)10 mmol·dm-3硝酸银水溶液: 称取85 mg AgNO3粉末加入到50 mL水中,溶解并混合均匀。
(2)10 mmol·dm-3抗坏血酸水溶液:称取0.176 g 抗坏血酸粉末加入到10 mL水中,溶解并混合均匀。
2、银纳米粒子的制备:
(1)丙酮/水体系:
控制溶剂丙酮:水相的体积比分别为 1 : 9、3 : 7、5 : 5、7: 3,在剧烈搅拌的条件下依次在反应瓶中加入10 mmol·dm-3硝酸银水溶液1 mL、丙酮 1、3、5、7 mL、纯水体积分别为7、5、3、1 mL、10 mmol·dm-3抗坏血酸水溶液 1 mL,使反应瓶中的总体积为10 mL,保持搅拌3分钟后停止,静置30分钟,离心清洗后在水溶液中保存,可获得丙酮/水体系中的Ag纳米粒子。参见附图10,它是本实施例在丙酮和水的混合体系中,按不同丙酮:水的比例(A) 1:9; (B) 3:7; (C) 5:5; (D) 7:3合成Ag纳米粒子的SEM图,标尺为500 nm; A图中银纳米粒子为单分散性较好的球形,平均直径为360 nm,B图则为花状结构。随着丙酮加入量的增多,平均尺寸开始下降,如图10(C)所示,直径降为220 nm,而D图则为不规则团聚结构。
(2)四氢呋喃/水体系:
控制溶剂四氢呋喃 :水相的体积比分别为 1 : 9、3 : 7、5 : 5、7: 3,在剧烈搅拌的条件下依次在反应瓶中加入10 mmol·dm-3硝酸银水溶液1 mL、四氢呋喃 1、3、5、7 mL、纯水体积分别为7、5、3、1 mL、10 mmol·dm-3抗坏血酸水溶液 1 mL,使反应瓶中的总体积为10 mL,保持搅拌3分钟后停止,静置30分钟,离心清洗后在水溶液中保存,可获得四氢呋喃/水体系中的Ag纳米粒子。参见附图13,它是本实施例在四氢呋喃和水的混合体系中,按不同四氢呋喃:水的比例(A) 1:9; (B) 3:7; (C) 5:5; (D) 7:3合成Ag纳米粒子的SEM图,标尺为1 µm;(A)~(D)图中显示,银纳米粒子为花状结构,平均直径由1.3 µm降低至0.4 µm,D图则为不规则结构。
(3)乙醇/水体系:
控制溶剂乙醇 :水相体积比分别为 1 : 9、3 : 7、5 : 5、7: 3,在剧烈搅拌的条件下依次在反应瓶中加入10 mmol·dm-3硝酸银水溶液1 mL、乙醇 1、3、5、7 mL、纯水体积分别为7、5、3、1 mL、10 mmol·dm-3抗坏血酸水溶液 1 mL,使反应瓶中的总体积为10 mL,保持搅拌3分钟后停止,静置30分钟,离心清洗后在水溶液中保存,可获得乙醇/水体系中的Ag纳米粒子。参见附图16,是本实施例在乙醇和水的混合体系中,按不同乙醇:水的比例(A) 1:9; (B) 3:7; (C) 5:5; (D) 7:3合成Ag纳米粒子的SEM图,标尺为1 µm;其中,A、B、C图中的银纳米粒子为花状结构,平均直径分别为1.3 µm,0.8 µm ,0.7 µm,D图则为不规则结构。
二、应用4-硝基苯硫酚确定最优Ag基SERS基底:
配制1 mmol·dm-3的4-硝基苯硫酚的乙醇溶液,以该分子为探针分子。将Ag纳米粒子离心清洗后,分别滴加到洁净的硅片上,真空抽干,制成SERS基底。将此基底分别浸泡在1 mmol·dm-3的4-硝基苯硫酚的乙醇溶液中,8小时后取出,乙醇冲洗,氮气吹干后,进行SERS检测。SERS测试时,每片基底随机取10处采集SERS信号,将获得的信号强度平均。通过对比,发现SERS信号最优化的基底分别为丙酮:水相体积比为1:9,四氢呋喃:水相体积比为7:3,以及乙醇:水相体积比为1:9的Ag纳米粒子。参见附图11、14和17;图11是本实施例中以4-硝基苯硫酚(PNTP)为探针分子,在图10中的四种基底上获得的SERS谱图,其中,(a) 以A为基底; (b) 以B为基底; (c) 以C为基底; (d) 以D为基底;图14是本实施例中以4-硝基苯硫酚(PNTP)为探针分子,在图13中的四种基底上获得的SERS谱图,其中, (a) 以A为基底; (b) 以B为基底; (c) 以C为基底; (d) 以D为基底;图17是本实施例中以4-硝基苯硫酚(PNTP)为探针分子,在图16中的四种基底上获得的SERS谱图,其中,(a) 以A为基底; (b) 以B为基底; (c) 以C为基底; (d) 以D为基底。由图可知,每组光谱数据中可观察到信号最强的一条谱线。如图11中,谱线a具有最强的SERS信号,约为1600 cps,因此,在丙酮/水体系中,360 nm的球形Ag纳米粒子为该体系中的最优SERS基底。同样地,在四氢呋喃/水体系、乙醇/水体系中的最优SERS基底分别是Ag不规则粒子和直径为1.3 µm的Ag纳米花状结构。
最优Ag基SERS基底对危害添加剂分子孔雀石绿的检测:
以孔雀石绿为待检测的危害添加剂分子,配制一系列浓度的孔雀石绿水溶液,分别将SERS信号最优化的Ag纳米粒子滴加到洁净的硅片上,真空抽干,制成SERS基底。将此基底分别浸泡在各种不同浓度的孔雀石绿水溶液中,8小时后取出,水冲洗,氮气吹干后,进行SERS检测。其结果参见附图12、15和18;图12是本实施例中以图11的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图,其中,(a)10-5 mol·dm-3; (b) 10-6 mol·dm-3; (c) 10-7mol·dm-3; (d) 10-8 mol·dm-3; (e) 10-9 mol·dm-3; (f) 10-10 mol·dm-3; (g) 10-11mol·dm-3; (h) 10-12 mol·dm-3;图15是本实施例中以图14的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图,其中,(a)10-5 mol·dm-3; (b) 10-6 mol·dm-3; (c) 10-7mol·dm-3; (d) 10-8 mol·dm-3; (e) 10-9 mol·dm-3; (f) 10-10 mol·dm-3;图18是本实施例中以图17的最强谱线的基底检测不同浓度的孔雀石绿的SERS谱图,其中,(a) 10-7mol·dm-3; (b) 10-8 mol·dm-3; (c) 10-9 mol·dm-3; (d) 10-10 mol·dm-3。由图可知,以上三种Ag纳米粒子能检测到孔雀石绿的最低浓度分别为10-11、10-9 以及10-9 mol·dm-3。
- 还没有人留言评论。精彩留言会获得点赞!
- 具吡啶二硫功能基的磁性纳米粒子Fe3O4@SiO2@S-S-Py的制备及生物医药中的应用的制造方法与工艺
- 聚乙二醇化包裹聚多巴胺载药磁性纳米颗粒的制备方法与流程
- 一种PQQ‑DA印迹磁性纳米粒子的制备方法及其应用与制造工艺
- 一种可降解聚合物磁性纳米粒子及其制备方法与制造工艺
- 一种山梨酸-茶多酚复合纳米粒子及其应用的制造方法与工艺
- 一种实现纳米线生物传感器表面修饰的方法与制造工艺
- 磁性纳米粒子和产生自由基的酶的介孔催化剂及其使用方法与制造工艺
- 一种靶向性超顺磁性纳米探针的制备方法和应用方法与制造工艺
- 油酸包裹的超顺磁性纳米Fe3O4及其制备方法与制造工艺
- 一种贵金属纳米粒子间距可控的SERS衬底制备方法与制造工艺