一种制备手性2-氯-3,4-二氟苯乙醇的方法与流程
本发明涉及生物制药和生物化工技术领域,具体涉及一种制备手性2-氯-3,4-二氟苯乙醇的方法。
背景技术:
替卡格雷(Ticagrelor)是由美国阿斯利康(AstraZeneca)公司研发的一种新型小分子抗凝血药物。该药对ADP引起的血小板聚集有明显的抑制作用,且口服使用后起效迅速,因此能有效改善急性冠心病患者的症状。在多条替卡格雷的合成路线中(WO2008018822,WO2013150495),手性2-氯-3,4-二氟苯乙醇(3)都是关键中间体。例如,其中一条的合成路线如下(中国医药工业杂志,2014,45.4:315-321):
现有技术中,手性2-氯-3,4-二氟苯乙醇[(S)-3]由2-氯-3,4-二氟苯乙酮进行化学不对称还原合成,该方法常受到产物光学纯度不够高、得率低、催化剂制备复杂、成本高和易燃等因素的限制,从而不利于实际的生产利用。
利用生物催化实现还原反应生产手性仲醇是一种高效的绿色催化技术。通过文献检索,没有生物酶催化该还原反应的实例。因此,通过广泛筛选,获得能高效催化目标反应的酮还原酶,并据此建立产率高且操作简单的手性2-氯-3,4-二氟苯乙醇的绿色生产工艺,将具有重要意义。
技术实现要素:
本发明提供了一种制备手性2-氯-3,4-二氟苯乙醇的方法,与现有化学合成工艺相比,该方法的产物得率高、光学选择性好且环境友好。
一种制备手性2-氯-3,4-二氟苯乙醇的方法,以2-氯-3,4-二氟苯乙酮为底物,利用酮还原酶(KRED)催化还原底物,生成手性2-氯-3,4-二氟苯乙醇,所述酮还原酶的氨基酸序列如SEQ ID NO.1~21所示。
反应的合成路线为:
上述酮还原酶的氨基酸序列均可通过商业化的全基因合成制得。
所获得的产物2-氯-3,4-二氟苯乙醇均具有手性。所述酮还原酶的氨基酸序列如SEQ ID NO.14、17、18、19、20所示时,酮还原酶催化还原底物生成的2-氯-3,4-二氟苯乙醇主要为R型。
所述酮还原酶的氨基酸序列如SEQ ID NO.1~13、15、16、21所示时,酮还原酶催化还原底物生成的2-氯-3,4-二氟苯乙醇主要为S型。
所述酮还原酶可采用本领域常规的技术手段进行制备,具体为:将含酮还原酶基因的基因片段与pET28a质粒的酶切产物连接,转入感受态的大肠杆菌E.coliBL21(DE3)中,获得转化的重组子;将重组子进行诱导表达,细胞破碎,离心获得酮还原酶,经冻干后,获得酮还原酶酶粉。
现有技术中,手性2-氯-3,4-二氟苯乙醇采用化学合成法制备获得,未有生物催化制备的相关报道,而本发明发现上述序列的酮还原酶可以催化2-氯-3,4-二氟苯乙酮还原成手性2-氯-3,4-二氟苯乙醇。优选地,所述酮还原酶的氨基酸序列如SEQ ID NO.9、10、11、12、13、15、16、21所示;含上述氨基酸序列的酮还原酶催化制备S-2-氯-3,4-二氟苯乙醇的得率和手性纯度更高。
优选地,反应起始时的反应体系中,底物的质量百分浓度为1%~25%(w/v),更优选,1~20%;所述酮还原酶的用量为底物质量的1%~30%,更优选,5~20%。
作为优选,所述反应的温度为10~45℃,更优选,20~30℃;所述反应的时间为20~25h。
作为优选,反应液的pH值为6.0~10.0;更优选,pH值为7.0~8.0。
上述反应体系还包括辅因子及其再生体系;所述的辅因子为NAD+/NADH或NADP+/NADPH;而辅因子的再生体系则是指能够将氧化型辅因子NAD+/NADP+转换成还原型辅因子NADH/NADPH的过程。
优选地,所述辅因子用量为底物质量的0.02%~2%。
上述反应结束后,反应液需经后处理才能获得成品,所述后处理为:向反应液中加入硅藻土,过滤,采用正己烷萃取滤液,获得的有机相经洗涤、浓缩后,获得成品手性2-氯-3,4-二氟苯乙醇。
与现有技术相比,本发明具有以下有益效果:
本发明以2-氯-3,4-二氟苯乙酮为底物,采用特定的酮还原酶进行不对称还原反应,获得得率高、手性纯度高的2-氯-3,4-二氟苯乙醇,反应条件温和,操作简便,避免了目前纯粹的化学合成方法存在的反应条件苛刻、催化剂制备复杂、成本高、易燃和产物手性纯度不够高等问题,具有良好的实际工业应用价值。
附图说明
图1为本发明实施例3中反应0h后取样所得的样品的HPLC图谱。
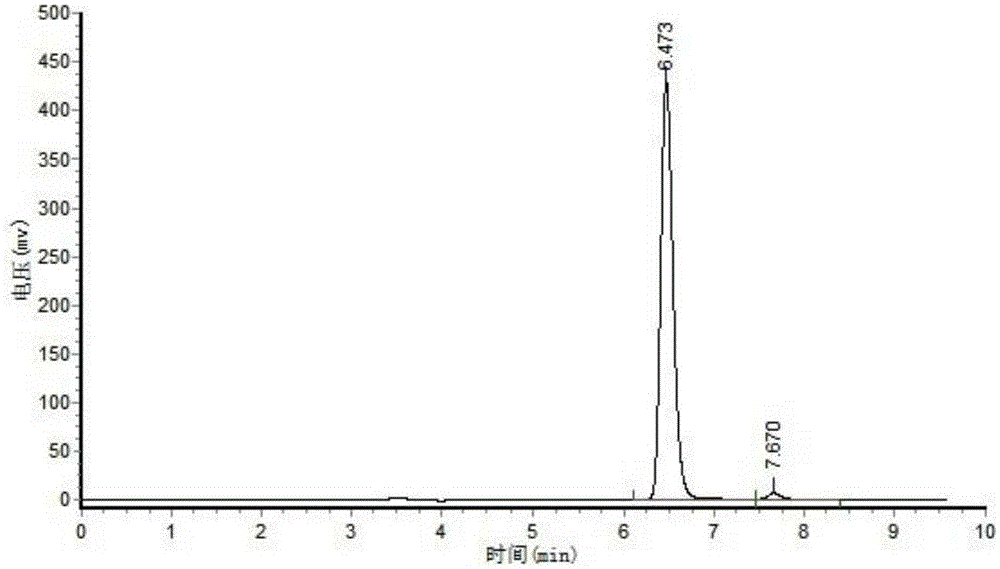
图2为本发明实施例3中反应20h后取样所得的样品的HPLC图谱。
具体实施方式
下面结合具体实施例对本发明做进一步详细地说明,但本发明并不限于以下实施例。
实施例1酮还原酶(KRED)酶粉的摇瓶生产工艺
将含有酮还原酶基因(SEQ ID NO.1至23)的基因片段(由上海捷瑞生物工程有限公司合成),与pET28a质粒的酶切产物连接,转入感受态E.coli BL21(DE3)菌株,筛选得到阳性克隆子,接种到4mL含氨苄青霉素抗性的液体LB培养基活化过夜(37℃,200rpm)。
取过夜的培养物,以1/100的接种量转接到100mL含氨苄青霉素抗体的液体LB培养基中,37℃、200rpm振荡培养至OD600值达到0.6,加入IPTG,于30℃下继续培养过夜。离心收集细胞,用10mL磷酸缓冲液(2mM,pH7.0)悬浮细胞。细胞悬浮液置于冰浴中超声波破碎10分钟,离心,上清液预冻过夜,冻干36h,即得冻干粉状的酮还原酶(KRED)酶粉。
实施例2酮还原酶(SEQ ID NO.1~21)毫克级反应
在5mL反应瓶中,加入10mg的底物2-氯-3,4-二氟苯乙酮和0.1mL异丙醇,待底物完全溶解后,加入1.2ml TEA-HCl缓冲液(0.1M,pH7.0)、0.1mgNAD+、0.1mgNADP+(溶于0.1ml缓冲液),再加入20mg葡萄糖以及2mg葡萄糖脱氢酶,最后,分别加入2mg实施例1中获得的酮还原酶KRED酶粉(0.5U/mg,溶于0.1ml缓冲液),在30℃下摇床反应20h。
取反应后的产物进行HPLC分析,检测产物的产率和产物ee值,结果如表1所示:
表1 不同酮还原酶反应的产率和产物ee值
产率标记说明:+代表产率1%-20%,++代表产率20%-50%,+++代表产率50%-80%,++++代表产率80%-95%,+++++代表产率>95%;
ee值标记说明:ee值指产物2-氯-3,4-二氟苯乙醇的对映体过量(enantiomeric excess),计算公式如下:eeS=(CS-3-CR-3)/(CS-3+CR-3)*100%或者eeR=(CS-3-CR-3)/(CS-3+CR-3)*100%;
CS-3指样品中S-2-氯-3,4-二氟苯乙醇的浓度,CR-3指样品中R-2-氯-3,4-二氟苯乙醇的浓度。
+代表ee值<50%,++代表ee值50%-80%,+++代表ee值80%-90%,++++代表ee值90%-99%,+++++代表ee值>99%。
实施例3百毫克级制备工艺
在5ml反应瓶中,加入150mg的底物2-氯-3,4-二氟苯乙酮和0.3ml异丙醇,待底物完全溶解后,加入1.2ml TEA-HCl缓冲液(0.1M,pH7.0)、7.5mg酮还原酶粉(SEQ ID NO.9)(溶于0.1ml缓冲液)、0.75mgNAD+(溶于0.1ml缓冲液),在30℃下,进行磁力搅拌反应,设置两个反应时间:0h和20h。
反应后取样对产物进行HPLC分析,结果如图1和图2所示;
图1为反应0小时后获得的产物的分析结果,图中7.67分钟的物质为底物;
图2为反应20小时后获得的产物的分析结果,图中,保留时间为6.47分钟的物质为产物,最终转化率>99.5%。
实施例4不同温度和pH下反应
在5ml反应瓶中,加入150mg的底物2-氯-3,4-二氟苯乙酮和0.3ml异丙醇,待底物完全溶解后,分别加入1.2ml 0.1M不同pH(6.0~10.0)的TEA-HCl缓冲液、7.5mg酮还原酶粉(SEQ ID NO.9)(溶于0.1ml缓冲液)、0.75mgNAD+(溶于0.1ml缓冲液),在不同温度(10~45℃),磁力搅拌下,进行反应20h。反应后取样对产物进行HPLC分析。各组产率结果如下表:
表2 不同温度和pH下反应的产率
从上表可以看出:反应体系的温度为10~45℃,优选20~30℃。反应液的pH值为6.0~10.0,优选pH值为7.0~8.0。
实施例5不同酶量和辅酶量下反应
在5ml反应瓶中,加入150mg的底物2-氯-3,4-二氟苯乙酮和0.3ml异丙醇,待底物完全溶解后,加入1.2ml 0.1M pH7.0的TEA-HCl缓冲液、分别加入不同量的(底物量的1~30%)酮还原酶粉(SEQ ID NO.9)(溶于0.1ml缓冲液)、分别加入不同量的(底物量的0.02%~2%)NAD+(溶于0.1ml缓冲液),在30℃,磁力搅拌下,进行反应20h。反应后取样对产物进行HPLC分析。各组产率结果如下表:
表3 不同酶量和辅酶量下反应产率
从上表可以看出:反应体系中,酮还原酶的用量为底物质量的1%~30%,优选5~20%。辅因子用量为底物质量的0.02%~2%。
实施例6不同底物浓度反应
在5ml反应瓶中,分别加入(15~375mg)的底物2-氯-3,4-二氟苯乙酮和0.3ml异丙醇,待底物完全溶解后,加入1.2ml 0.1M pH7.0的TEA-HCl缓冲液、按底物量的5%加入不同量的酮还原酶粉(SEQ ID NO.9)(溶于0.1ml缓冲液)、0.75mgNAD+(溶于0.1ml缓冲液),在30℃,磁力搅拌下,进行反应20h。反应后取样对产物进行HPLC分析。各组产率结果如下表:
表4 不底物浓度下反应产率
从上表可以看出:反应体系中,底物的质量百分浓度为1%~25%(w/v),优选1~20%。
实施例7百克级制备工艺
将450g的底物2-氯-3,4-二氟苯乙酮加至20L反应釜中,加入1.5L异丙醇,搅拌至完全溶解;加入8.5L Tris-HCl缓冲液(0.1M,pH7.0),于30℃下搅拌(450rpm)均匀;然后依次加入22.5g酮还原酶粉(SEQ ID NO.9)、2.25g NAD+后,进行反应。HPLC监控,反应24h后,产物转化率为99.3%,终止反应。
向反应液中加入50g硅藻土搅拌0.5h,过滤,滤液用正己烷萃取(3.0L×2),滤饼返回反应釜,加入正己烷搅拌过滤,合并有机相;有机相用饱和食盐水洗涤两次,浓缩后得到0.37kg的2-氯-3,4-二氟苯乙醇,收率81.4%,GC纯度98.7%,eeS值99.5%。
实施例8公斤级制备工艺
将1.35kg的底物2-氯-3,4-二氟苯乙酮加至20L反应釜中,加入3L异丙醇,搅拌至完全溶解;加入7.0L Tris-HC缓冲液(0.1M,pH7.0),于30℃下搅拌(450rpm)均匀;然后依次加入67.5g酮还原酶粉(SEQ ID NO.9)与6.75g NAD+后,进行反应。HPLC监控,反应24h后,产物转化率为99.2%,终止反应。
向反应液中加入150g硅藻土搅拌0.5h,过滤,滤液用正己烷萃取(9.0L×2),滤饼返回反应釜,加入正己烷搅拌过滤,合并有机相;有机相用饱和食盐水洗涤两次,浓缩后得到1.09kg2-氯-3,4-二氟苯乙醇,收率80.1%,GC纯度99.2%,eeS值99.5%。
对比例1
在5mL反应瓶中,加入10mg的底物2-氯-3,4-二氟苯乙酮和0.1mL异丙醇,待底物完全溶解后,加入1.2ml TEA-HCl缓冲液(0.1M,pH7.0)、0.1mgNAD+、0.1mgNADP+(溶于0.1ml缓冲液),最后,分别加入2mg酮还原酶KRED酶粉(SEQ ID NO.22,溶于0.1ml缓冲液),在30℃下摇床反应20h。
取反应后的产物进行HPLC分析,检测产物的产率和产物ee值,结果没有2-氯-3,4-二氟苯乙醇产生。
对比例2
在5mL反应瓶中,加入10mg的底物2-氯-3,4-二氟苯乙酮和0.1mL异丙醇,待底物完全溶解后,加入1.2ml TEA-HCl缓冲液(0.1M,pH7.0)、0.1mgNAD+、0.1mgNADP+(溶于0.1ml缓冲液),最后,分别加入2mg酮还原酶KRED酶粉(SEQ ID NO.23,溶于0.1ml缓冲液),在30℃下摇床反应20h。
取反应后的产物进行HPLC分析,检测产物的产率和产物ee值,结果没有2-氯-3,4-二氟苯乙醇产生。
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!