包含尿苷和N‑乙酰基‑D‑甘露糖胺的培养基的制作方法
本发明涉及包含尿苷和N-乙酰基-D-甘露糖胺的细胞培养基和糖蛋白的生产方法,所述方法包括使用所述细胞培养基培养用编码糖蛋白的外源DNA转化的细胞。
背景技术:
作为在糖蛋白的蛋白质和聚糖之间的主要连接模式,存在N-乙酰基-D-葡糖胺与构成蛋白质的天冬酰胺残基共价连接的N-糖苷键(N-连接的聚糖,N-糖苷连接的糖链),和N-乙酰基-D-半乳糖胺与构成蛋白质的丝氨酸或苏氨酸残基共价连接的O-糖苷键(O-连接的聚糖,O-糖苷连接的糖链)。
在哺乳动物细胞中,糖蛋白的N-糖苷键连接的糖链为通过涉及各种酶的复杂途径与蛋白质的天冬酰胺残基连接的那些糖链,同时在从RNA翻译蛋白质后,通过内质网内腔转移至高尔基体。N-糖苷键连接的糖链的主要类型是复合型糖链和高甘露糖型糖链。复合型糖链,尽管它们存在各种类型,但特征在于它们的非还原端由唾液酸残基组成。它们的实例显示于下文结构式2。
[化学式1]
如果哺乳动物细胞,例如中国仓鼠卵巢细胞(CHO细胞),用于生产重组糖蛋白,则由此获得的蛋白质的大部分糖链在其结构上将是复合型的,因此唾液酸残基将出现在这样的重组糖蛋白的糖链的非还原端。已知,如果在其非还原端上具有唾液酸残基的复合型糖链与蛋白质连接,则给予机体的重组蛋白质在血液中的稳定性增加(参见专利文献1)。因此,当欲产生在血液中循环时显示效果的重组糖蛋白时,利用使用CHO细胞的生产方法,其中产生在其非还原端上具有唾液酸残基的糖链,预期它们在血液中的半寿期延长和由此增强它们的药理学效果。促红细胞生成素和促卵泡激素(FSH)是这样的重组糖蛋白的典型实例(参见专利文献2和3)。
并且,因为当更多唾液酸残基添加至糖蛋白的糖链时,预期糖蛋白在血液中的半寿期延长,所以报道了数种方法,其目标是添加更多的唾液酸残基至糖蛋白。例如,报道了使用用具有添加唾液酸至糖链末端的能力的唾液酸转移酶转化的宿主细胞来生产重组糖蛋白的方法(参见专利文献4)。还报道了通过以逐步方式用降低的温度培养用编码糖蛋白的基因转化的哺乳动物细胞,将获得添加有更多唾液酸残基的重组糖蛋白(参见专利文献5)。
报道了另外几种细胞培养基,其用于添加更多唾液酸至糖蛋白的糖链。例如,报道了唾液酸与细胞表达的重组糖蛋白的摩尔比可通过在培养细胞时加入预定浓度的链烷酸(例如丁酸)或其盐来调整(参见专利文献6)。并且,已经报道了具有特定唾液酸化程度的重组糖蛋白可通过加入唾液酸的前体例如ManNAc、乙酰基-ManNAc、过乙酰基-ManNAc或肽球蛋白至培养基来产生(参见专利文献7)。并且,已报道重组糖蛋白的唾液酸化水平可通过加入单糖例如葡萄糖、甘露糖和半乳糖的组合至培养基来增加(参见专利文献8)。
现有技术文件
[专利文献]
[专利文献1] JP H08-027181
[专利文献2] JP 2001-525342
[专利文献3] WO2009/127826
[专利文献4] JP H05-071934
[专利文献5] JP 2006-520186
[专利文献6] JP H11-507523
[专利文献7] JP 2007-522179
[专利文献8] JP 2001-525342。
技术实现要素:
[技术问题]
针对上述背景,本发明的目标之一是提供用于培养细胞的培养基,其包含预定浓度的尿苷和N-乙酰基-D-甘露糖胺,用于提高使用用编码糖蛋白的基因转化的细胞表达的糖蛋白的唾液酸含量。
[技术方案]
在涉及上述目标的研究中,本发明人发现,通过在包含尿苷和N-乙酰基-D-甘露糖胺的培养基中培养用编码促红细胞生成素的基因转化的哺乳动物细胞(CHO细胞),获得高度唾液酸化的促红细胞生成素。
因此,本发明提供以下内容。
(1) 用于通过培养细胞来表达糖蛋白的培养基,所述培养基包含浓度为0.5-10mM的尿苷和浓度为1-15mM的N-乙酰基-D-甘露糖胺。
(2) 根据上述(1)的培养基,其中尿苷的浓度是1-8mM和N-乙酰基-D-甘露糖胺的浓度是4-12mM。
(3) 根据上述(1)的培养基,其中尿苷的浓度是2-5mM和N-乙酰基-D-甘露糖胺的浓度是5-10mM。
(4) 根据上述(1)的培养基,其中尿苷的浓度是约3mM和N-乙酰基-D-甘露糖胺的浓度是约8mM。
(5) 根据上述(1)-(4)中任一项的培养基,进一步包含L-丙氨酰基-L-谷氨酰胺。
(6) 根据上述(5)的培养基,其中L-丙氨酰基-L-谷氨酰胺的浓度是0.5-5mM。
(7) 根据上述(5)的培养基,其中L-丙氨酰基-L-谷氨酰胺的浓度是1-3mM。
(8) 根据上述(5)的培养基,其中L-丙氨酰基-L-谷氨酰胺的浓度是约2mM。
(9) 根据上述(1)-(8)中任一项的培养基,其中所述培养基不包含血清。
(10) 根据上述(1)-(9)中任一项的培养基,其中所述细胞选自哺乳动物细胞、植物细胞和昆虫细胞。
(11) 根据上述(10)的培养基,其中所述细胞是哺乳动物细胞。
(12) 根据上述(11)的培养基,其中所述哺乳动物细胞是CHO细胞。
(13) 糖蛋白的生产方法,所述方法包括在根据上述(1)-(10)中任一项的培养基中培养用编码糖蛋白的外源DNA转化的细胞。
(14) 根据上述(13)的生产方法,其中将所述编码糖蛋白的外源DNA掺入至表达载体中以使糖蛋白在转化的细胞中表达。
(15) 根据上述(13)或(14)的生产方法,其中所述编码糖蛋白的外源DNA是人来源的DNA。
(16) 糖蛋白的生产方法,所述方法包括在根据上述(11)或(12)的培养基中培养用编码糖蛋白的外源DNA转化的哺乳动物细胞。
(17) 根据上述(16)的生产方法,其中将所述编码糖蛋白的外源DNA掺入至表达载体中以使糖蛋白在转化的哺乳动物细胞中表达。
(18) 根据上述(16)或(17)的生产方法,其中所述编码糖蛋白的外源DNA是人来源的DNA。
(19) 根据上述(16)-(18)中任一项的生产方法,其中将所述哺乳动物细胞在36-37℃的温度下温育,和然后在30-35℃的温度下温育。
(20) 根据上述(16)-(18)中任一项的生产方法,其中将所述哺乳动物细胞在36-37℃的温度下温育,和然后在31-33℃的温度下温育。
(21) 根据上述(16)-(18)中任一项的生产方法,其中将所述哺乳动物细胞在36-37℃的温度下温育,和然后在约32℃的温度下温育。
(22) 根据上述(13)-(21)中任一项的生产方法,其中所述糖蛋白选自:溶酶体酶,例如α-半乳糖苷酶A、酸性鞘磷脂酶、溶酶体酸性脂酶、N-乙酰半乳糖胺-4-硫酸酯酶、己糖胺酶、α-N-乙酰基半乳糖胺酶、α-甘露糖苷酶、艾杜糖醛酸-2-硫酸酯酶、葡糖脑苷脂酶、加硫酶(galsulfase)、α-L-艾杜糖苷酸酶、唾液酸酶和酸性α-葡糖苷酶;组织纤溶酶原激活物(t-PA);凝血因子,例如凝血因子VII、凝血因子VIII、凝血因子IX;淋巴因子,例如白介素-6;生长因子,例如粒细胞集落刺激因子(G-CSF)、粒细胞巨噬细胞集落刺激因子(GM-CSF)和巨噬细胞集落刺激因子(M-CSF);促红细胞生成素;干扰素;血栓调节素;促卵泡激素;DNA酶I;促甲状腺激素(TSH);小鼠抗体;人源化小鼠抗体;人/小鼠嵌合抗体;人抗体;PD-1;PD-1配体;和促卵泡激素。
(23) 根据上述(13)-(21)中任一项的生产方法,其中所述糖蛋白是促红细胞生成素。
(24) 根据上述(13)-(23)中任一项的生产方法,其中所述糖蛋白是在其聚糖中包含唾液酸的糖蛋白。
(25) 根据上述(13)-(24)中任一项的生产方法,进一步包括下述步骤:在培养后收集培养物,随后从收集的培养物除去哺乳动物细胞以制备包含糖蛋白的培养物上清液。
[发明效果]
本发明能够生产高度唾液酸化的糖蛋白。一般而言,高度唾液酸化的糖蛋白当作为药物给予至人血液时显示在血液中延长的半寿期,因此由此产生的糖蛋白可作为长期稳定的药物来提供。
附图说明
图1显示编码人促红细胞生成素的DNA所掺入的pCI-neo载体。
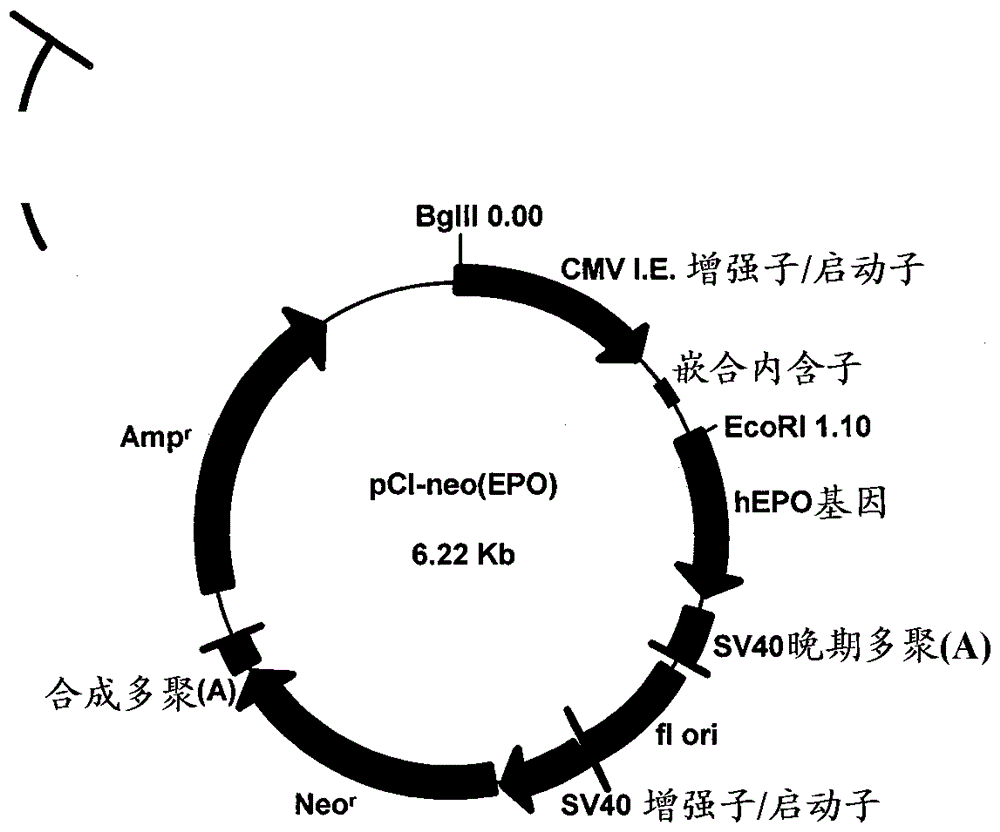
图2显示掺有编码人促红细胞生成素的DNA的pCl-neo(hEPO)载体。
图3显示通过在各种培养基中培养用于表达重组人促红细胞生成素的细胞获得的重组人促红细胞生成素中各同种型(1型至3型)的比率。纵坐标表示同种型比率(%)。误差棒表示标准偏差(n=4)。分别地,图(1)显示通过在基础培养基中培养获得的各同种型,图(2)显示通过在添加有8mM的N-乙酰基-D-甘露糖胺的基础培养基中培养获得的各同种型,图(3)显示通过在添加有3mM的尿苷的基础培养基中培养获得的各同种型,图(4)显示通过在添加有8mM的N-乙酰基-D-甘露糖胺和3mM的尿苷的基础培养基中培养获得的各同种型。
图4显示通过在各种培养基中培养用于表达重组人促红细胞生成素的细胞获得的重组人促红细胞生成素中同种型1型至3型的比率总和。纵坐标表示比率(%)。分别地,图(1)显示通过在基础培养基中培养获得的比率,图(2)显示通过在添加有8mM的N-乙酰基-D-甘露糖胺的基础培养基中培养获得的比率,图(3)显示通过在添加有3mM的尿苷的基础培养基中培养获得的比率,图(4)显示通过在添加有8mM的N-乙酰基-D-甘露糖胺和3mM的尿苷的基础培养基中培养获得的比率。
图5显示用于构建pE-neo载体的方法的流程图。
图6显示用于构建pE-hygr载体的方法的流程图。
图7显示掺有编码人FSH α-链的α链的DNA的pE-Neo(FSHα)载体。
图8显示掺有编码人FSH β-链的β链的DNA的pE-hygr(FSHβ)载体。
图9显示通过在各种培养基中培养用于表达重组人FSH的细胞获得的重组人FSH中唾液酸含量的相对值(%),其中将通过在基础培养基中培养获得的重组人FSH中唾液酸含量计为100%。分别地,图(1)显示通过在基础培养基中培养获得的唾液酸含量,图(2)显示通过在添加有8mM的N-乙酰基-D-甘露糖胺的基础培养基中培养获得的唾液酸含量,图(3)显示通过在添加有3mM的尿苷的基础培养基中培养获得的唾液酸含量,图(4)显示通过在添加有8mM的N-乙酰基-D-甘露糖胺和3mM的尿苷的基础培养基中培养获得的唾液酸含量。
具体实施方式
在本发明中,术语“糖蛋白”意指由蛋白质和糖之间的共价键构成的一类分子的统称。糖和蛋白质之间的共价键包括:N-乙酰基-D-葡糖胺与构成蛋白质的天冬酰胺残基共价连接的N-糖苷键(N-连接的聚糖),和N-乙酰基-D-半乳糖胺与构成蛋白质的丝氨酸或苏氨酸残基共价连接的O-糖苷键(O-连接的聚糖),但在本发明中糖和蛋白质之间的连接方式不特别受到限制。包含N-连接的聚糖或O-连接的聚糖的糖蛋白以及包含这两者的糖蛋白也被分类为本发明的糖蛋白。
这样的糖蛋白包括:溶酶体酶,例如α-半乳糖苷酶A、酸性鞘磷脂酶、溶酶体酸性脂酶、N-乙酰半乳糖胺-4-硫酸酯酶、己糖胺酶、α-N-乙酰基半乳糖胺酶、α-甘露糖苷酶、艾杜糖醛酸-2-硫酸酯酶、葡糖脑苷脂酶、加硫酶、α-L-艾杜糖苷酸酶、唾液酸酶和酸性α-葡糖苷酶;组织纤溶酶原激活物(t-PA);凝血因子,例如凝血因子VII、凝血因子VIII和凝血因子IX;淋巴因子,例如白介素-6;生长因子,例如粒细胞集落刺激因子(G-CSF)、粒细胞巨噬细胞集落刺激因子(GM-CSF)和巨噬细胞集落刺激因子(M-CSF);促红细胞生成素;干扰素;血栓调节素;促卵泡激素;DNA酶I;促甲状腺激素(TSH);包括各种抗体药物的小鼠抗体、人源化小鼠抗体、人/小鼠嵌合抗体、人抗体等;PD-1;PD-1配体;和促卵泡激素,但不限于它们。
本发明的糖蛋白优选在其聚糖中包含唾液酸。每个糖蛋白分子中唾液酸分子的平均数优选为1个或多个。
并且在本发明中,当提及术语“编码糖蛋白的基因”或“编码糖蛋白的外源DNA”时,关于基因或外源DNA的来源不特别受到限制,但优选来源是哺乳动物,包括人、牛、马、其它家畜、狗、猫和其它宠物动物。最实用地,来源是人。术语“编码糖蛋白的基因”或“编码糖蛋白的外源DNA”还包括为例如优化表达的由基因或外源DNA编码的糖蛋白量的目的而在其中引入突变的基因或外源DNA。
在本发明中,术语“糖蛋白”不仅包括天然存在的糖蛋白,而且包括天然存在的糖蛋白的类似物,其中一个或多个氨基酸残基被置换、缺失、插入或/和添加。在本发明中术语“糖蛋白”还包括例如:组合源自两个或更多个天然存在的糖蛋白或其类似物的结构域的嵌合蛋白质,和并非天然存在蛋白质,只要聚糖和蛋白质在其中共价结合。
在本发明中,术语“重组糖蛋白蛋白质”意指使用细胞产生的糖蛋白,所述细胞经人工构建以使编码糖蛋白的基因或外源DNA强表达和使表达状态得以保持。一般而言,强表达的基因或外源DNA可通过用掺入有所述基因或外源DNA的表达载体转化宿主细胞(例如哺乳动物细胞)而引入。但不限于此,强表达的基因也可以是经人工修饰以实现有力表达的内源基因。人工修饰内源基因的方法的实例可以是但不限于修饰内源基因本身的方法。例如,诱导基因强表达可通过用诱导强基因表达的启动子置换位于内源基因上游的内源启动子来实现。这样的实例公开于数个现有技术(例如 WO94/12650和WO95/31560)。
在本发明中,作为用于表达编码糖蛋白的基因或外源DNA的表达载体,一般实践是使用其中编码目的糖蛋白的基因掺入到诱导基因的有力表达的基因调节位点的下游的表达载体,所述基因调节位点例如巨细胞病毒(CMV)-衍生的启动子、SV40早期启动子(SV40增强子/启动子)、延伸因子1α (EF-1α)启动子和人泛素C启动子。用于诱导强基因表达的启动子的实例,所述启动子可置换内源启动子以实现内源基因的有力表达,包括巨细胞病毒(CMV)-衍生的启动子、SV40早期启动子(SV40增强子/启动子)、延伸因子1α (EF-1α)启动子和人泛素C启动子。
一般实践是使用哺乳动物细胞作为用掺有编码糖蛋白的基因或外源DNA的表达载体转化的细胞,或作为通过引入修饰至其内源基因而经修饰以有力表达内源基因的细胞。但也可使用植物细胞、昆虫细胞、酵母等。即是说,在本发明中,当简称为“细胞”时,该术语广泛包括植物细胞、昆虫细胞、哺乳动物细胞、酵母和其它真核细胞,但其意指优选植物细胞、昆虫细胞、哺乳动物细胞或酵母,更优选植物细胞、昆虫细胞或哺乳动物细胞,和还更优选哺乳动物细胞。
关于使用的哺乳动物细胞不特别受到限制,只要它们可表达预期的重组糖蛋白。它们可以是从自机体切除的器官、肌肉组织、皮肤组织、结缔组织、神经组织、血液、骨髓等收集的那些的原代培养细胞,它们的次代培养的细胞,或通过重复传代培养保持其特征而建立的细胞系。所述细胞可以是正常细胞或已变为癌性的细胞。可使用的细胞特别优选为来自中国仓鼠卵巢的CHO细胞;来自小鼠骨髓瘤的NS/0细胞;人成纤维细胞;和来自非洲绿猴的肾成纤维细胞的COS细胞。当使用CHO细胞表达重组糖蛋白时,通常可获得具有N-糖苷连接的糖链的重组糖蛋白。
在本发明中,用于培养细胞以表达糖蛋白的培养基可以是补充有尿苷和N-乙酰基-D-甘露糖胺的培养基。然而,按需要,补充有N-乙酰基-D-甘露糖胺而没有尿苷的基础培养基也可用作用于在本发明中培养细胞以表达糖蛋白的培养基。尽管关于用作基础培养基的培养基不特别受到限制,只要它可用于培养细胞以表达糖蛋白,但可优选使用无血清培养基。
上述无血清培养基的实例是包含以下的培养基:3-700mg/mL的氨基酸、0.001-50mg/L的维生素、0.3-10g/L的单糖、0.1-10000mg/L的无机盐、0.001-0.1 mg/L的微量元素、0.1-50mg/L的核苷、0.001-10 mg/L的脂肪酸、0.01-1 mg/L的生物素、0.1-20微克/L的氢化可的松、0.1-20 mg/L的胰岛素、0.1-10 mg/L的维生素B12、0.01-1 mg/L的腐胺、10-500 mg/L的丙酮酸钠和水溶性铁化合物。按需要,还可包括胸苷、次黄嘌呤、常规pH指示剂和抗生素。
此外,DMEM/F12培养基,一种由DMEM和F12组成的混合培养基,也可用作基础无血清培养基。这两种培养基是本领域技术人员众所周知的。作为无血清培养基,也可使用DMEM(HG)HAM改良的(R5)培养基,其包含碳酸氢钠、L-谷氨酰胺、D-葡萄糖、胰岛素、亚硒酸钠、二氨基丁烷、氢化可的松、硫酸铁(II)、天冬酰胺、天冬氨酸、丝氨酸和聚乙烯醇。此外,市售可得的无血清培养基也可用作基础培养基,例如CD OptiCHOTM培养基、CHO-S-SFM II培养基、CD CHO培养基(Life Technologies Inc.)、EX-CELLTM302培养基、EX-CELLTM325-PF培养基(SAFC Biosciences Inc.)等。
当包含血清(胎牛血清)的培养基用作基础培养基时,培养基中的血清浓度优选为5-20%(v/v),和更优选8-12%(v/v)。
在本发明中,添加至基础培养基的尿苷可以是其盐。添加至基础培养基的尿苷的量应根据使用的细胞类型、使用的表达载体和表达的糖蛋白而合适调整,但尿苷以优选0.5-10mM、更优选1-8mM、还更优选2-5mM和进一步更优选3mM的浓度加入基础培养基。添加至基础培养基的N-乙酰基-D-甘露糖胺可以是其盐。添加至基础培养基的N-乙酰基-D-甘露糖胺的量应根据使用的细胞类型、使用的表达载体和表达的糖蛋白而合适调整,但N-乙酰基-D-甘露糖胺以优选1-15mM、更优选4-12mM、还更优选5-10mM、进一步更优选5-8mM和特别优选8mM的浓度加入基础培养基。
除了尿苷和N-乙酰基-D-甘露糖胺之外,L-丙氨酰基-L-谷氨酰胺或其盐也可添加至基础培养基。添加至基础培养基的L-丙氨酰基-L-谷氨酰胺的量应根据使用的细胞类型、使用的表达载体和表达的糖蛋白而适当调整,但L-丙氨酰基-L-谷氨酰胺以优选0.5-5mM、更优选1-3mM、还更优选1.5-2.5mM和特别优选2mM的浓度加入基础培养基。
在本发明中,当通过培养用编码糖蛋白的基因或外源DNA转化的哺乳动物细胞或内源启动子被置换以使内源基因强表达的哺乳动物细胞,并使糖蛋白表达而产生重组糖蛋白时,培养温度应根据使用的细胞类型、使用的表达载体和表达的糖蛋白而适当调整。然而,优选调整温度至30-37℃,和更优选36-37℃。培养温度可以保持恒定,或在培养期间以逐步的方式降低。当培养温度以逐步的方式降低时,培养温度例如在培养开始时可调整至36-37℃,和然后在培养期间可降低至优选30-35℃,和更优选31-33℃,例如32℃。因为大部分重组糖蛋白从细胞分泌至培养基,因此包含重组糖蛋白的上清液可通过在温育后收集培养物和从收集的培养物除去哺乳动物细胞而获得。重组糖蛋白可通过例如色谱等方法从培养物上清液纯化。
实施例
尽管本发明在下文将参照实施例进行更详细的描述,但不旨在将本发明局限于所述实施例。
[用于人促红细胞生成素的表达载体的构建]
使用以下引物对,经PCR从人胎儿肝脏cDNA文库(Clontech Inc.)扩增编码人促红细胞生成素的cDNA:
引物EPO-5',合成序列(SEQ ID NO:1)和引物EPO-3',合成序列(SEQ ID NO:2)。
在SEQ ID NO: 1所示的序列中,核苷酸3-8对应于EcoRI位点,和核苷酸9-28对应于编码区的前20个核苷酸。
在SEQ ID NO: 2所示的序列中,核苷酸12-17对应于BglII位点,和核苷酸18-30对应于cDNA的核苷酸774-762。
PCR反应循环30次,其中变性步骤在95℃持续1分钟,退火步骤在60℃持续1分钟和延伸步骤在72℃持续2分钟。将扩增的cDNA用EcoRI和HindIII消化,然后在pBluescript载体(pBS: Stratagene Inc.)的多克隆位点的EcoRI和HindIII位点之间亚克隆。得到的载体用BglII消化,然后通过T4 DNA聚合酶平端化,随后通过EcoRI消化切下人促红细胞生成素基因的片段。获得的hEPO基因的片段的核苷酸序列和编码的氨基酸序列分别显示于SEQ ID NO:3和SEQ ID NO:4。在SEQ ID NO:3中,核苷酸9-587对应于编码氨基酸的区域,核苷酸3-8对应于EcoRI位点,和核苷酸775-780对应于BglII位点。使用DNA连接试剂盒版本2 (TAKARA Inc.)将获得的hEPO基因片段在pCI-neo载体(Promega Inc.,图1)的EcoRI和SmaI位点之间连接,图2中所示的得到的重组载体用作人促红细胞生成素表达载体pCI-neo(hEPO)。
[用于表达重组人促红细胞生成素的细胞的建立]
CHO细胞(CH0-K1)购自RIKEN,日本。使用Lipofectamine-2000 (Invitrogen Inc.)以常规方式用20μg的上述人促红细胞生成素表达载体转化1X107个CHO细胞,然后在补充有10%胎牛血清(FBS)和0.8mg/mL的G418 (SIGMA Inc.)的Ham-F12培养基(Invitrogen Inc.)中选择性培养细胞,以获得对新霉素有抗性的稳定转化体。然后,为使细胞习惯于无血清培养基,将细胞转移至补充有4mM的L-谷氨酰胺、10mg/L的次黄嘌呤、4mg/L的胸苷和0.12mg/mL的G418的市售可得的无血清EX-CELL302培养基(JRH Inc.),并继续培养直至细胞的生长变得稳定。将得到的细胞悬浮于补充有10% FBS和10% DMSO的Ham-F12培养基,并作为母细胞贮存在液氮中。
[用于表达重组人促红细胞生成素的细胞的培养]
将贮存在液氮中的上述母细胞在37℃恒温浴中迅速解冻,并悬浮于补充有2mM的GlutaMAX (Life Technologies Inc.)和1 × HT补充物(Life Technologies Inc.)的基础培养基CD Opti CHOTM培养基(Life Technologies Inc.)中。然后,离心沉淀细胞并收集。将收集的细胞悬浮于基础培养基以获得细胞悬液,并计算活细胞数。将细胞悬液用基础培养基稀释至2 × 105个细胞/mL的活细胞密度。将细胞悬液按各自120mL分配至培养容器以产生4个组,并在37℃在5% CO2下温育5天。使用Bio Jr.8进行该温育(100mL × 8个容器培养装置,AbleBiott Inc.),并在温育期间将培养基的pH保持在6.9和溶解氧水平(DO)保持在40%。此时,加入表1所示浓度的尿苷和N-乙酰基-D-甘露糖胺至各组(组1至组4)。各组的温育重复一次。
[人促红细胞生成素的纯化]
在上述温育的第5天,收集10mL的各培养物至离心管,在3,000rpm离心10分钟。然后,收集培养物上清液,用双蒸水稀释1.5倍。然后,将这些稀释的培养物上清液各自7.5 mL加载至用20mM Tris缓冲液(pH 7.5)预平衡的CaptoTM粘附柱,一种多模式阴离子交换树脂(柱体积:1mL, GE Healthcare Bioscience Inc.)。在用5个柱体积的20mM Tris缓冲液(pH 7.5)洗涤柱后,用包含200mM的NaCl的20mM Tris缓冲液(pH 7.5)洗脱树脂吸附的重组人促红细胞生成素,以获得洗脱的流分。通过Amicon Ultra-4 Centrifugal Filter Units (分子量截止值:3kDa, Millipore Inc.)将洗脱的流分浓缩至100μL体积。
[重组人促红细胞生成素的分析]
使用与毛细管电泳系统(P/ACETM系统MDQ, Beckmann Coulter Inc.)连接的Bare Fused-Silica Capillary (50μm ID,375μm OD, 50cm长度, Beckmann Coulter Inc.),对各组的浓缩溶液进行毛细管电泳。在如此进行时,包含10mM的氯化钠、500mM的乙酸钠、7M尿素和2.5mM腐胺的10mM Tris缓冲液(pH4.5)用作电泳缓冲液,和在恒定电流24μA下进行电泳50分钟。此外,通过UV检测器监测214nm波长以检测经过电泳的重组人促红细胞生成素。
[重组人促红细胞生成素的分析结果]
在通过上述毛细管电泳检测时在显示不同等电点的同种型中显示最低等电点的同种型被称为I型,和按等电点的递增顺序,其它同种型被称为II型和III型。分别计算I型、II型和III型与所有检测的同种型的总数的比率。在各组之间比较各比率。各组中I型、II型和III型的比率显示于图3。在通过在基础培养基中培养细胞获得的组1的重组人促红细胞生成素中I型、II型和III型的比率分别为约0.7%、约5%和约15% (图3)。
相比之下,在通过在添加有仅8mM的N-乙酰基-D-甘露糖胺的基础培养基中培养细胞获得的组2中,I型、II型和III型的比率分别为约1.2%、约7%和约20.7% (图3)。重组人促红细胞生成素的同种型的等电点根据每个重组人促红细胞生成素分子加入的唾液酸分子数的增加而降低。因此,上述结果表明,通过加入8mM的N-乙酰基-D-甘露糖胺至基础培养基获得的组2的每个重组人促红细胞生成素分子加入的唾液酸分子数多于使用基础培养基获得的唾液酸分子数。
与此相反,在通过在添加有仅3mM的尿苷的基础培养基中培养细胞获得的组3中,与通过在基础培养基中培养细胞获得的组3的那些相比,I型、II型和III型的比率显著降低,分别变成约0.3%、约3.5%和约13% (图3)。这些结果表明,与使用基础培养基获得的唾液酸分子数相比,通过加入3mM的尿苷至基础培养基获得的组3的每个重组人促红细胞生成素分子加入的唾液酸分子数降低。
此外,在通过在添加有8mM N-乙酰基-D-甘露糖胺和3mM尿苷的基础培养基中培养细胞获得的组4中,I型、II型和III型的比率分别为约1.1%、约7%和约21.5% (图3)。当在组4和组2之间比较I型、II型和III型的比率总和时,组4超过组2,这表明每个重组人促红细胞生成素分子加入的唾液酸分子数可通过与3mM的尿苷同时加入8mM的N-乙酰基-D-甘露糖胺而进一步增加(图4)。当考虑到通过仅加入3mM的尿苷至培养基获得的组3的每个重组人促红细胞生成素分子加入的唾液酸分子数低于使用基础培养基获得的唾液酸分子数时,N-乙酰基-D-甘露糖胺和尿苷的这种协同作用是出人意料的。
[其它讨论]
根据上文所示的分析结果,已经阐明了每个重组人促红细胞生成素分子加入的唾液酸分子数可通过在添加有8mM的N-乙酰基-D-甘露糖胺或8mM的N-乙酰基-D-甘露糖胺和3mM的尿苷的培养基中培养用重组人促红细胞生成素的基因转化的细胞而增加。认为每个重组人促红细胞生成素分子加入的唾液酸分子数可通过在这些培养基中培养细胞的方法和另一种方法(例如在细胞培养期间用以逐步方式降低的温度培养细胞的方法)的组合而增加。
[用于人FSH的表达载体的构建]
用KpnI和NcoI消化pEF/myc/nuc载体(Invitrogen Inc.)以切下包括EF-1α启动子和其第一个内含子的区域,然后用T4 DNA聚合酶平端化。用BgIII和EcoRI消化载体pCl-neo (Invitrogen Inc.)以切下包括CMV增强子/启动子和内含子的区域,然后用T4 DNA聚合酶平端化。向其中插入上述包括EF-1α启动子和其第一个内含子的区域以得到pE-neo载体(图5)。
用SfiI和BstXI消化载体pE-neo以除去包括新霉素抗性基因的约1 kbp的区域(图6)。使用pcDNA3.1/Hygro(+) (Invitrogen Inc.)作为模板,通过PCR用引物Hyg-Sfi (SEQ ID NO: 5)和引物Hyg-BstX (SEQ ID NO:6)扩增潮霉素基因(图6)。用SfiI和BstXI消化由此扩增的潮霉素基因,然后插入至前述pE-neo载体以形成pE-hygr载体(图6)。
使用人胎盘cDNA文库(Takara Bio Inc.)作为模板,用引物HCG-A-F (SEQ ID NO:7)和引物HCG-A-R (SEQ ID NO:8)进行一次PCR。然后,使用由此获得的PCR产物,用引物HCGA-ORF-F (SEQ ID NO:9) (其具有位于一次PCR中使用的引物HCG-A-F的3’-端的稍微下游的序列)和引物HCGA-ORF-R (SEQ ID NO:10) (其具有位于一次PCR中使用的引物HCG-A-R的5’-端的稍微上游的序列),进行二次PCR以扩增人FSHα链cDNA。以相同的方式,使用人脑垂体cDNA文库(Takara Bio Inc.)作为模板,用一次引物FSH-F (SEQ ID NO:11)和FSH-R (SEQ ID NO:12)和然后二次引物FSH-F2 (SEQ ID NO:13)和FSH-R2 (SEQ ID NO: 14)进行PCR,以扩增人FSHβ链cDNA。
用于人FSHα链的一次PCR是使用100ng的人胎盘cDNA文库作为模板和运行40个反应循环进行,所述循环各自由"95℃/10秒、55℃/10秒和72℃/10秒"组成。二次PCR是使用1μL的一次PCR反应混合物作为模板和运行30个反应循环进行,所述循环各自由"95℃/10秒、60℃/10秒和72℃/10秒"组成。并且,用于人FSHβ链的一次PCR是使用10 ng的人脑垂体cDNA文库作为模板和运行40个反应循环进行,所述循环各自由"98℃/2秒、60℃/10秒和72℃/10秒"组成。二次PCR是使用1μL的一次PCR反应混合物作为模板和运行30个反应循环进行,所述循环各自由"98℃/2秒、60℃/10秒和72℃/10秒"组成。
用EcoRI消化由此扩增的人FSHα链cDNA,并插入至已用EcoRI消化的pBluescriptIISK(-) (pBS: Stratagene Inc.)的EcoRI位点。用XbaI和EcoRV消化由此获得的质粒DNA,以切下人FSHα-链cDNA,然后将其插入至已用XbaI和SmaI消化的pE-neo载体,以形成人FSHα-链表达载体pE-neo (hCGα) (图7)。
用EcoRI和NotI消化上述扩增的人FSHβ-链cDNA,然后引入至已用EcoRI和NotI消化的pBluescriptIISK(-)。用EcoRI消化由此获得的质粒DNA,并且在用T4 DNA聚合酶平端化后,进一步用NotI消化以切下人FSHβ-链cDNA。用XbaI消化pE-hygr载体,并且在用T4 DNA聚合酶平端化后,进一步用NotI消化。向该pE-hygr载体中引入人FSHβ-链cDNA,以形成人FSHβ表达载体pE-hygr(FSHβ) (图8)。
[产生用于表达重组人FSH的细胞]
按照以下方法,使用Lipofectamine-2000 (Invitrogen Inc.),用上述表达载体pE-neo(hCGα)和pE-hygr(FSHβ)转染CHO细胞(CHO-K1:购自美国典型培养物保藏中心(American Type Culture Collection))。在转染前一天,将CHO-K1细胞接种至3.5-cm培养皿,使得细胞密度可接近汇合状态的密度,并在37℃在包含5%二氧化碳气体的空气流下培养细胞过夜。在第二天,用PBS(-)洗涤细胞两次,并将培养基置换为1 mL的无血清D-MEM/F12培养基(Invitrogen Inc.)。加入200μL的由下述组成的1:1混合物溶液:用Opti-MEM I培养基(Invitrogen Inc.)稀释20倍的Lipofectamine-2000溶液和包含13.2μg/mL的pE-neo(hCGα)和6.6μg/mL的pE-hygr(FSHβ)的质粒DNA溶液,并在37℃进行转染5小时。
在上述转染后,将培养基置换为包含5% FCS的D-MEM/F12培养基(D-MEM/F12/5% FCS),并在37℃在包含5%二氧化碳的空气流下进行培养2天。然后,将培养基置换为包含0.6 mg/mL G418和0.4 mg/mL潮霉素B的D-MEM/F12/5% FCS培养基,并在37℃在包含5%二氧化碳的空气流下进行选择性培养。将在用于选择性培养的培养基中生长的细胞在培养基中进行连续数轮的传代培养以得到重组体细胞。
然后,根据有限稀释技术,以每孔可接种不超过1个细胞的方式将重组体细胞接种至96-孔板,并将细胞培养约10天,以使得它们各自形成纯系集落。对形成纯系集落的各孔中的培养物上清液取样,通过ELIZA检查表达的人FSH的量,并选择被发现表达高量的人FSH的细胞系。
为习惯于无血清的悬浮细胞培养,将选择的细胞系在补充有4mM的L-谷氨酰胺、10mg/L的次黄嘌呤、4mg/L的胸苷、120mg/L的G148和80mg/L的潮霉素B的市售可得的无血清培养基EX-细胞302培养基(JRH Inc.)中连续培养,直到细胞的生长速率稳定。然后,将培养基置换为IS CHO-V-GS培养基,并连续进行培养直至细胞的生长速率稳定,将细胞悬浮于补充有10% DMSO的IS CHO-V-GS培养基中并作为母细胞贮存在液氮中。
[用于表达重组人FSH的细胞的培养]
将上述在液氮中贮存的母细胞在37℃恒温浴中快速解冻,并悬浮于补充有2mM的GlutaMAX (Life Technologies Inc.)和1 × HT补充物(Life Technologies Inc.)的基础培养基CD Opti CHOTM 培养基(Life Technologies Inc.)中。然后,离心沉淀细胞,并收集。将收集的细胞悬浮于基础培养基,以获得细胞悬液,并计算活细胞数。用基础培养基将细胞悬液稀释至2 × 105个细胞/mL的活细胞密度。
按各自120mL将细胞悬液分配至培养容器,以产生4组,并在37℃在5% CO2下温育5天。使用Bio Jr.8 (100mL × 8个容器培养装置,AbleBiott Inc.)进行该温育,在温育期间将培养基的pH保持在6.9和溶解氧水平(DO)保持在40%。此时,加入表1所示浓度的尿苷和N-乙酰基-D-甘露糖胺至各组(组1至组4)。各组的温育重复一次。
[重组人FSH的纯化]
在上述温育的第5天,收集10mL的培养物至离心管,并在3,000rpm离心10分钟以收集培养物上清液。然后,将20mL的各培养物上清液加载至用PBS(pH 7.4)预平衡的CaptureSelectTM FSH,一种FSH亲和树脂(柱体积:1mL, Life Technologies Inc.)。在用5个柱体积的PBS(pH 7.4)洗涤柱后,用包含2M的MgCl2的20mM Tris缓冲液(pH 7.4)洗脱树脂吸附的重组人FSH,以获得洗脱的流分。用水稀释洗脱的流分,并使用Amicon Ultra-4 Centrifugal Filter Units (分子量截止值:3kDa, Millipore Inc.)重复浓缩。最后,将洗脱的流分浓缩至100μL的体积,以获得对于各组(组1至组4)的纯化的重组人FSH的浓缩溶液。将在纯化的重组人FSH中的重组人FSH的浓度调整至1mg/mL。
[唾液酸含量的测量]
在37℃用0.3M氢氧化钠对各组的50μL的纯化重组人FSH的浓缩溶液进行碱处理30分钟,随后在80℃用0.05M盐酸进行酸处理60分钟,以使构成重组人FSH的聚糖水解成单糖。然后,向溶液中加入荧光试剂(包含9.6mM的1,2-二氨基-4,5-亚甲基-二羟基苯二盐酸盐、24mM的亚硫酸氢钠和1M的2-巯基乙醇的溶液),并在50℃加热150分钟以对水解得到的单糖进行荧光标记。将由此得到的反应溶液用作样品溶液。作为标准品,同时以相同的方式处理唾液酸,得到荧光标记的唾液酸的标准品。通过使用COSMOSIL 5C18-PAQ作为反相柱的HPLC分析由此得到的标准品,并测量唾液酸的洗脱时间,即对应于唾液酸的峰出现的时间。通过HPLC分析各样品溶液,并计算对应于唾液酸的峰面积。
相对于通过在基础培养基中培养细胞获得的组1的峰面积(峰面积视为100%),计算组2和组3的峰面积的相对值(%) (图9)。作为结果,在添加有8mM的N-乙酰基-D-甘露糖胺的基础培养基中培养细胞的组2的峰面积几乎约100%。相比之下,在添加有3mM的尿苷的基础培养基中培养细胞的组3的峰面积为约112%,表明当在添加有3mM的尿苷的培养基中培养细胞时,每个重组人FSH分子的唾液酸分子的平均数增加约10%。此外,在添加8mM N-乙酰基-D-甘露糖胺和3mM尿苷至基础培养基而得的培养基中培养细胞的组3的峰面积为约121%,表明当与通过在基础培养基中培养细胞获得的重组人FSH相比,通过在添加有8mM的N-乙酰基-D-甘露糖胺和3mM的尿苷的培养基中培养细胞获得的每个重组人FSH分子的唾液酸分子的平均数增加约20%。
在重组人促红细胞生成素的情况下,当与通过在基础培养基中培养得到的相比时,加入仅3mM的尿苷至培养基的组3的每个重组人促红细胞生成素分子加入的唾液酸分子数降低。相比之下,在重组人FSH的情况下,当与通过在基础培养基中培养得到的相比时,加入仅3mM的尿苷至培养基的组3的每个重组人FSH分子加入的唾液酸分子数增加。另一方面,加入仅8mM的N-乙酰基-D-甘露糖胺至培养基的组2的每个重组人FSH分子加入的唾液酸分子数几乎等于通过在基础培养基中培养所得到的值。
然而,与通过使用基础培养基所得到的那些相比,通过在包含8mM的N-乙酰基-D-甘露糖胺和3mM的尿苷的培养基中培养细胞得到的重组人促红细胞生成素和重组人FSH两者均显示更高的唾液酸含量,表明通过在补充有这两种要素的培养基中培养细胞以生产重组糖蛋白,可增加每个分子加入的唾液酸分子数,而不管糖蛋白的类型如何。
[其它讨论]
根据上述分析结果,已经阐明了,通过在添加有8mM的N-乙酰基-D-甘露糖胺和3mM的尿苷的培养基中培养用编码目的糖蛋白的基因或外源DNA转化的细胞,可增加每个重组糖蛋白分子加入的唾液酸分子数。认为:每个糖蛋白分子加入的唾液酸分子数可通过在所述培养基中培养细胞的方法和另一种方法(例如在培养期间用以逐步方式降低的温度培养细胞的方法)的组合而增加。
[工业适用性]
根据本发明,提供了包含糖蛋白作为活性成分且显示在给予机体时在血液中延长的半寿期的长期稳定的药物。
[序列表自由文本]
SEQ ID NO:1 = 引物EPO-5',合成序列
SEQ ID NO:2 = 引物EPO-3',合成序列
SEQ ID NO:3 = 通过引物EPO-5'和引物EPO-3'扩增的PCR产物
SEQ ID NO:5 = 引物Hyg-Sfi,合成序列
SEQ ID NO:6 = 引物Hyg-BstX,合成序列
SEQ ID NO:7 = 引物HCG-A-F,合成序列
SEQ ID NO:8 = 引物HCG-A-R,合成序列
SEQ ID NO:9 = 引物HCGA-ORF-F,合成序列
SEQ ID NO:10 = 引物HCGA-ORF-R,合成序列
SEQ ID NO:11 = 引物FSH-F,合成序列
SEQ ID NO:12 = 引物FSH-R,合成序列
SEQ ID NO:13 = 引物FSH-F2,合成序列
SEQ ID NO:14 = 引物FSH-R2,合成序列
[序列表]
1195P_ST25
- 还没有人留言评论。精彩留言会获得点赞!