用于检测和分析结核分枝杆菌的组合物和方法与流程
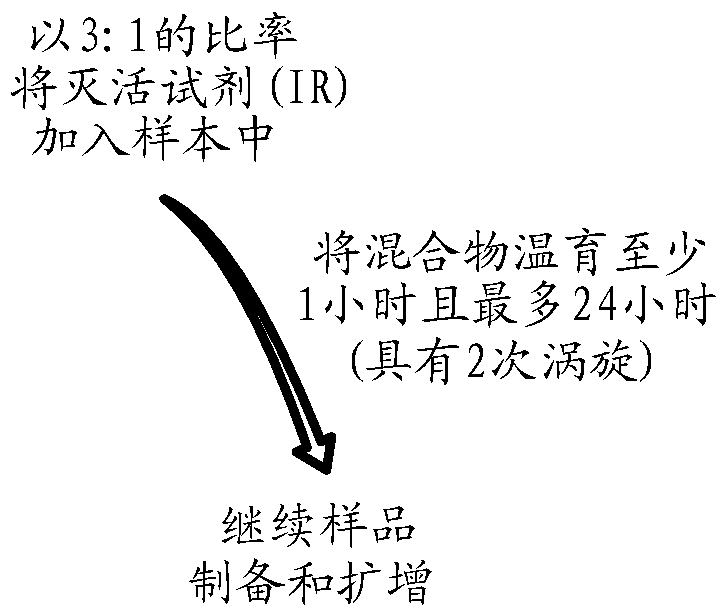
本发明涉及结核分枝杆菌(mycobacteriumtuberculosis)。具体地,本发明涉及用于检测结核分枝杆菌的组合物和方法。
背景技术:
:结核分枝杆菌(MTB)构成世界上对公共卫生的严重威胁,并且作为由单一传染性病原体引起的全世界最大杀手仅次于HIV/AIDS(Warren等人,DifferentiationofMycobacteriumtuberculosiscomplexbyPCRamplificationofgenomicregionsofdifference,2006年7月,IntJTubercLungDis.10(7):818-822)。所述CDC报告称,在2011年,估计有870万新MTB病例(13%被HIV共感染);140万人死于MTB,包括大概100万例属于HIV-阴性个体的死亡和430,000属于HIV-阳性的人。世界卫生组织(WHO)报告称,MTB是女性的顶尖杀手之一,在2011年300,000例死亡属于HIV-阴性女性,且200,000例死亡属于HIV-阳性女性。它是15-44岁的女性的前三大死亡原因。MTB也是具有HIV的存活人的主要杀手,造成所有死亡的四分之一。在2011年估计有50万病例和64,000例死亡属于儿童。多药抗性的MTB(MDR-TB)正在增加中,并且存在于几乎所有调查的国家中。在地理学上,MTB的负担在亚洲和非洲是最高的。WHO报告称,全面MTB病例检测在低收入国家(LIC)中仍然小于60%,且在全球仅占66%。也就是说,在2011年在估计的870万因MTB患病的人中,290万具有活动性疾病的人没有被诊断和报告给国家MTB控制程序。另外,仅19%的MDR-MTB病例被适当地诊断和报告。少于1/20的新MTB患者进行过药物易感性测试。由于MTB的传播风险、药物抗性株的出现潜力和被HIV-1感染的患者中疾病的严重程度,低价的、快速的且准确的MTB分子测试是非常重要的。常规培养是费时的,且可以需要多达6周。抗酸涂片的显微镜检查是检测分枝杆菌的最快方法,但是它是不灵敏的和非特异性的。发明概述本文提供了可用于检测MTB的组合物和方法。具体地,本文提供了特异性地且灵敏地检测样品中的MTB的试剂盒、试剂、反应混合物和方法,包括它们用于核酸扩增和检测程序。这样的组合物和方法包括用于检测不同人样品(诸如痰、支气管肺泡灌洗液(BAL)以及痰和BAL样品的N-乙酰基-L-半胱氨酸(NALC)-NaOH沉淀物)中的MTB复合物的引物、探针、引物集合、引物和探针集合和方法。在某些实施方案中,将本文中作为SEQIDNO:1-9提供的多核苷酸试剂中的两种或更多种组合在组合物(例如,试剂集合、试剂盒、反应混合物等)中。在某些实施方案中,所述核酸试剂中的一种或多种或全部包含可检测的部分(例如,合成的标记)。在某些实施方案中,所述组合物包含一种或多种引物SEQIDNO:1-4或7-8。在某些实施方案中,所述组合物包含一个或多个引物对SEQIDNO:1和2、3和4、或7和8。在某些实施方案中,所述组合物包含一种或多种SEQIDNO:5、6或9的探针(例如,标记的探针)。在某些实施方案中,所述组合物包含引物和探针集合:SEQIDNO1-2和5、3-4和6、或7-9。在某些实施方案中,所述组合物包含内部对照试剂,诸如SEQIDNO:7-9。在某些实施方案中,所述组合物包含含有SEQIDNO:5和6的双探针系统。在某些实施方案中,所述组合物和方法采用包含多核苷酸组分的试剂集合,所述多核苷酸组分具有引物、探针、引物集合和/或探针集合。在某些实施方案中,所述组合物的多核苷酸组分由上述的引物、探针、引物集合或探针集合组合组成。作为反应混合物,所述组合物可以由这样的多核苷酸以及在样品中包括的任何多核苷酸(即,唯一非样品核酸分子是由SEQIDNO:1-9个别地或组合地(例如,上述组合)代表的多核苷酸)组成。本文提供的引物集合包含两种引物,且可用于扩增靶序列,例如,在PCR中。在某些实施方案中,所述组合物包含至少两种引物以及一种或多种(例如,两种或更多种)检测由所述引物产生的扩增子的探针。本文还提供了用于检测样品中的MTB的方法。在某些实施方案中,所述方法包括:(a)形成反应混合物,其包含核酸扩增试剂、至少本文描述的多核苷酸引物或探针、和可能含有至少一个靶序列的测试样品;和(b)使所述混合物处于扩增条件以产生靶序列的互补核酸序列的至少一个拷贝。在某些实施方案中,所述方法还包括检测产生的扩增子。在某些实施方案中,所述检测包括(c)使探针与靶序列的互补核酸序列杂交从而形成杂合物,所述杂合物包含探针和靶序列的互补核酸序列;和(d)直接地或间接地检测所述杂合物作为MTB在测试样品中的存在的指示。进一步,当扩增是PCR或类似的热循环扩增过程时,可以将步骤(b)重复多次以增加靶序列拷贝的数目。根据另一个实施方案,检测MTB和一种或多种另外的传染性病原体(例如,HIV)或其它核酸分子(例如,人序列)。因此,在某些实施方案中,组合物包含用于检测这样的其它试剂或核酸分子的试剂。在某些实施方案中,所述组合物和方法还采用对照试剂或试剂盒组分(例如,阳性对照、阴性对照)。在某些实施方案中,所述对照试剂包括合成的靶核酸。在某些实施方案中,所述对照试剂包括用于检测预期存在于样品中的MTB、人或其它序列的试剂。在某些实施方案中,选择对照靶核酸(无论是合成的还是在样品中内源性的),使得扩增MTB靶核酸的扩增引物也扩增对照靶核酸。在某些这样的实施方案中,检测MTB靶核酸或从其产生的扩增子的探针不会检测对照靶标或从其产生的扩增子。在某些实施方案中,提供了这样的对照探针,其检测对照靶核酸或从其产生的扩增子,但是不检测MTB靶核酸或从其产生的扩增子。在某些实施方案中,提供了用于定量的内部标准品。在某些实施方案中,除了上面讨论的试剂以外,试剂盒还包括一个或多个合适的容器、使用说明书、软件(例如,数据分析软件)等。在某些实施方案中,试剂盒包括用于标记多核苷酸的试剂。在某些实施方案中,试剂盒中的一种或多种组分呈冻干形式。本发明的实施方案提供了用于鉴别复杂生物样品(诸如痰或支气管肺泡灌洗液及其沉淀物)中的MTB的组合物、试剂盒、系统和方法。在某些实施方案中,所述组合物和方法提供了能够特异性地和准确地分离和鉴别MTB的灭活试剂和单个探针或多个探针实时检测方法。例如,在某些实施方案中,本发明提供了一种组合物,其包含:至少一个(例如,1、2或3个)选自SEQIDNO:1和2、SEQIDNO:3和4、或SEQIDNO:7和8的引物对。在某些实施方案中,所述组合物包含SEQIDNO:1-4和7-8。在某些实施方案中,所述组合物还包含至少一种选自SEQIDNO:5、6或9的探针。其它实施方案提供了一种组合物,其包含:SEQIDNO:1和2和SEQIDNO:3和4的引物对集合。在某些实施方案中,所述组合物还包含至少一种选自SEQIDNO:5、6或9的探针。在某些实施方案中,所述组合物还包含SEQIDNO:7和8的引物对。另外的实施方案提供了一种组合物,其包含SEQIDNO:1-9的每种核酸。在某些实施方案中,上述组合物包括一个或多个选自SEQIDNO:10-36的核酸序列或被其取代。本发明的实施方案提供了一种试剂盒,其包括:a)前述组合物中的任一种,和b)至少一种用于执行核酸扩增反应的试剂(例如,核酸聚合酶;多种dNTP、缓冲液或灭活试剂)。在某些实施方案中,所述灭活试剂包含水、去污剂、醇和NaOH(例如,异丙醇、氢氧化钠、吐温-20和水)。在其它实施方案中,本发明提供了一种反应混合物,其包含:与结核分枝杆菌(MTB)核酸杂交的前述组合物或核酸中的任一种。在某些实施方案中,所述MTB靶核酸是插入序列(IS)6110和蛋白抗原B(PAB)中的一种或多种(例如,两种)。在其它实施方案中,本发明提供了一种鉴别生物样品中的MTB核酸的方法,所述方法包括:a)使来自受试者的生物样品与前述核酸引物或探针中的任一种接触,和b)直接地或间接地检测核酸引物或探针与MTB核酸的结合。在某些实施方案中,所述方法还包括以下步骤:c)当检测到所述结合时,确定MTB在样品中的存在。在某些实施方案中,所述检测是通过实时PCR检测。在某些实施方案中,所述方法还包括使用灭活缓冲液灭活样品中的MTB的步骤。在某些实施方案中,所述样品是痰、支气管肺泡灌洗液[BAL]或痰和BAL的N-乙酰基-L-半胱氨酸[NALC]沉淀物。在某些实施方案中,所述方法还包括在灭活以后从样品提取DNA的步骤。再其它的实施方案提供了一种检测生物样品中的MTB核酸的方法,所述方法包括:a)用灭活试剂灭活生物样品以产生灭活的样品;b)从所述灭活的样品提取DNA;c)使所述DNA与一个或多个引物对和一种或多种核酸探针接触;d)执行扩增测定以扩增一个或多个MTB核酸靶标;和e)鉴别所述靶标在样品中的存在。其它实施方案提供了一种检测生物样品中的MTB核酸的方法,所述方法包括:a)用包含异丙醇、氢氧化钠、吐温-20和水的灭活试剂灭活所述生物样品以产生灭活的样品;b)从所述灭活的样品提取DNA;c)使所述DNA与以下物质接触:一个或多个选自SEQIDNO:1和2和SEQIDNO:3和4的引物对;和一种或多种选自SEQIDNO:5和6的核酸探针;d)执行扩增测定以扩增一个或多个MTB核酸靶标;和e)鉴别所述靶标在所述样品中的存在。另外的实施方案提供了一种检测生物样品中的MTB核酸的方法,所述方法包括:a)用灭活试剂灭活所述生物样品以产生灭活的样品;b)从所述灭活的样品提取DNA;c)使所述DNA与以下物质接触:一个或多个选自SEQIDNO:1和2和SEQIDNO:3和4的引物对;和一种或多种选自SEQIDNO:5和6的核酸探针;d)执行扩增测定以扩增一个或多个MTB核酸靶标;和e)鉴别所述靶标在样品中的存在。其它实施方案提供了一种检测生物样品中的MTB核酸的方法,所述方法包括:a)用灭活试剂灭活所述生物样品以产生灭活的样品;b)从所述灭活的样品提取DNA;c)使所述DNA与以下物质接触:一个或多个选自SEQIDNO:1和2和SEQIDNO:3和4的引物对;和一种或多种选自SEQIDNO:5和6的核酸探针;d)执行实时PCR测定以扩增一个或多个MTB核酸靶标;和e)鉴别所述靶标在样品中的存在。再其它的实施方案提供了一种检测生物样品中的MTB核酸的方法,所述方法包括:a)用灭活试剂灭活所述生物样品以产生灭活的样品;b)从所述灭活的样品提取DNA;c)使所述DNA与以下物质接触:一个或多个选自SEQIDNO:1和2和SEQIDNO:3和4的引物对;和一种或多种选自SEQIDNO:5和6的核酸探针;d)执行扩增测定以扩增一个或多个选自IS6110和PAB的MTB核酸靶标;和e)鉴别所述靶标在样品中的存在。在某些实施方案中,本发明提供了一种检测生物样品中的MTB核酸的方法,所述方法包括:a)用灭活试剂灭活所述生物样品以产生灭活的样品;b)从所述灭活的样品提取DNA;c)使所述DNA与以下物质接触:SEQIDNO:1和2和SEQIDNO:3和4的引物对;和SEQIDNO:5和6的核酸探针;d)执行扩增测定以扩增一个或多个MTB核酸靶标;和e)鉴别所述靶标在样品中的存在。在某些实施方案中,本发明提供了一种检测生物样品中的MTB核酸的方法,所述方法包括:a)用包含异丙醇、氢氧化钠、吐温-20和水的灭活试剂灭活所述生物样品以产生灭活的样品;b)从所述灭活的样品提取DNA;c)使所述DNA与以下物质接触:SEQIDNO:1和2和SEQIDNO:3和4的引物对;和SEQIDNO:5和6的核酸探针;d)执行扩增测定以扩增一个或多个MTB核酸靶标;和e)鉴别所述靶标在样品中的存在。本文描述了另外的实施方案。附图说明图1显示了本文提供的技术的某些实施方案中的MTB测定工作流简图。图2显示了来自46个MTB系统发生上和地理学上不同的MTB分离物的检测的数据。图3显示了样品制备的MTB测定工作流简图。图4显示了当测试MTB复杂基因组DNA以确定测定包容性时所确定的平均循环数目值。具体实施方式本文提供了可用于检测MTB的组合物和方法。具体地,本文提供了特异性地和灵敏地检测样品中的MTB的试剂盒、试剂、反应混合物和方法,包括它们用于核酸扩增和检测程序。在某些实施方案中,本文提供了与MTB的核酸序列或其补体特异性地杂交的多核苷酸。这些多核苷酸用于扩增MTB(如果存在于样品中),和特异性地检测MTB的存在。示例性的多核苷酸由例如SEQIDNO:1-9或10-36描述。在某些实施方案中,本文描述的测定利用多个(例如,两个)不同的MTB-特异性的引物/探针集合。例如,在某些实施方案中,第一集合被设计成检测多拷贝插入元件IS6110(ThierryD,等人,NucleicAcidsRes1990;18:188),和第二集合,单拷贝基因,PAB(AndersonAB,HansenEB,InfectImmun1989;57:2481-2488)。因为已经存在缺少IS6110(MathemaB,等人,ClinicalMicrobiologyReviews2006;19:658-685)或具有PAB基因中的缺失(GilpinCM,等人,JClinMicrobiol2002;40:2305-2307)的MTB株的报告,两种靶标的应用会使假阴性结果的风险最小化。本文描述的实验证实,双靶标策略导致以高可靠性对MTB基因组DNA的检测。由于亲脂分子和多糖的复杂结构,分枝杆菌细胞壁对常规细胞裂解技术具有抗性。因而,在某些实施方案中,MTB检测测定利用硫氰酸胍-磁性微粒纯化方法,其具有对于TB细胞裂解和基因组DNA释放而言经优化的温育温度和混合条件。在本文描述的测定的实施方案的开发过程中进行的实验表明,样品DNA提取方法在效率上与用于TB细胞裂解的机械珠拍打相当。其它实验证实,通过测定检测到所有66种MTB复合物DNA(包括8种不同的MTB复合种)。以四种方式评估测定的可靠性。首先,通过测试80种潜在不同的交叉反应器来评估测定的特异性。没有检测到潜在交叉反应器。其次,执行遗留(carryover)评估,其中在阴性样品旁边处理高阳性的MTB样品以确定在阴性样品中是否检测到假阳性或遗留。没有观察到假阳性。第三,针对它们对测定性能的影响测试了各种潜在干扰物质。没有观察到干扰,除了在其中观察到干扰的8.3%和5.0%牛粘液以外。当粘液浓度降低至<2.5%时,该干扰被除去。当测试临床样本时,具有无效IC结果的样本的比率是0.3%,从而证实了本文描述的样品制备方法以有效的方式除去了PCR抑制剂。这会提供所述方案的稳健性的证据,并指示,由牛粘液造成的干扰的影响可能对于测定不是显著的。最后,执行再现性研究,其中多个用户使用多个m2000仪器系统或手工样品制备,以测试低阳性的(3倍LOD)和阴性的组。观察到100%再现性。这些数据支持当用在分析研究和临床样品测试中时测定的稳健性质。使用存档的样品和将来收集的样品,通过测试在五个国家中从疑似具有TB的患者收集的痰和NALC样本,评估MTB检测测定的临床实用性。总测定灵敏度是93%,而它在涂片阳性的、培养阳性的样品中是99%,且在涂片阴性的、培养阳性的样品中是81%。特异性是97%。来自美国内的非-TB疑似群体的分析特异性测试和痰样品测试的结果都表现出100%特异性。基于测定结果与培养结果的对比来确定临床特异性。本文描述的技术的实施方案提供了具有高灵敏度和特异性的高通量自动化MTB检测。与常规培养测定相比,所述技术通过允许临床样本中的分枝杆菌的直接检测而显著地改善了TB的快速诊断。与常规抗酸涂片显微镜检查相比,所述测定提供了优良的灵敏度和特异性。与当前的MTB诊断测定的间隙是,在培养阳性的和涂片阴性的群体(在样品中具有低TB浓度)中缺乏灵敏度。本文提供的技术的实施方案填充了该间隙。本文提供的测定是稳健的,具有非常低的抑制率,尽管难以对痰样品起作用。这会减少无效样品的重复测试所需的时间。在某些实施方案中,查询多拷贝MTB靶标,从而提供更大的靶标灵敏度和更少的由靶区域中的突变/缺失造成的假阴性测定结果的机会。实施方案进一步提供了独特的且有效的MTB灭活方法。本文中使用的术语“特异性地杂交”表示核酸可检测地和特异性地结合第二核酸的能力。在使与非特异性的核酸的可检测结合的可察觉量最小化的杂交和洗涤条件下,多核苷酸与靶核酸链特异性地杂交。可以用于实现特异性杂交的严谨条件是本领域已知的。本文中使用的“靶序列”或“靶核酸序列”是指使用一种或多种本文提供的多核苷酸扩增、检测、或扩增并检测的MTB的核酸序列或要检测的其它序列(例如,HIV)或其补体。另外,尽管术语靶序列有时表示双链核酸序列,本领域技术人员会认识到,所述靶序列还可以是单链的。在所述靶标是双链的情况下,多核苷酸引物序列优选地扩增靶序列的两条链。可以选择对特定生物体或多或少具有特异性的靶序列。例如,所述靶序列可以对整个属、对超过一个属、对一个种或亚种、血清群、营养型、血清型、菌株、分离物或其它生物体子集具有特异性。本文中使用的术语“测试样品”是指从疑似含有或可能含有MTB靶序列的生物体、生物流体、环境样品或其它样品采取的样品。所述测试样品可以取自任何生物学来源,例如,组织,血液,唾液,痰,痰、粘液、支气管肺泡灌洗液(BAL)的N-乙酰基-L-半胱氨酸(NALC)-NaOH沉淀物,汗液,尿,尿道拭子,宫颈拭子,泌尿生殖器或肛门拭子,结膜拭子,眼用透镜流体,脑脊液,乳,腹水液,滑液,腹膜液,羊水,发酵液,细胞培养物,化学反应混合物等。所述测试样品可以(i)以从来源得到的状态直接使用,或(ii)在预处理以改变样品的特性以后使用。因而,在使用之前可以如下预处理测试样品:例如,从血液制备血浆或血清,破碎细胞或病毒颗粒,从固体材料制备液体,稀释粘稠的流体,过滤液体,蒸馏液体,浓缩液体,灭活干扰组分,添加试剂,纯化核酸,等。本文中使用的术语“标记”是指这样的分子或部分:其具有能够检测和任选地定量的性质或特性。标记可以是可直接检测的,与例如(并且不限于)放射性同位素、荧光团、化学发光体、酶、胶体颗粒、荧光微粒等一样;或标记可以是可间接检测的,与例如特异性结合成员一样。应该理解,可直接检测的标记可能需要另外的组分,例如,底物、触发试剂、淬灭部分、光等,以实现所述标记的检测和/或定量。当使用可间接检测的标记时,它们通常与“缀合物”联合使用。缀合物通常是已经与可直接检测的标记连接或偶联的特异性结合成员。用于合成缀合物的偶联化学是本领域众所周知的,且可以包括,例如,不会破坏特异性结合成员的特异性结合性质或标记的可检测性质的任何化学方式和/或物理方式。本文中使用的“特异性结合成员”是指结合对的一个成员,例如,两个不同的分子,其中所述分子之一通过例如化学或物理方式特异性地结合其它分子。除了抗原和抗体特异性结合对以外,其它特异性结合对包括,但不意图限于,抗生物素蛋白和生物素;半抗原和对半抗原特异性的抗体;互补的核苷酸序列;酶辅因子或底物和酶;等。多核苷酸是核糖核酸(RNA)、脱氧核糖核酸(DNA)、修饰的RNA或DNA、或RNA或DNA模拟物(例如,但不限于PNA)、及其衍生物、及其同系物的核酸聚合物。因而,多核苷酸包括由天然存在的核苷碱基、糖和共价核苷间(主链)键组成的聚合物,以及具有起类似作用的非天然存在部分的聚合物。这样的修饰的或取代的核酸聚合物是本领域众所周知的,且为了本发明的目的,被称作“类似物”。为了容易制备和技术人员熟悉,多核苷酸优选地是脱氧核糖核酸或核糖核酸的修饰的或未修饰的聚合物。有用的多核苷酸类似物包括具有修饰的主链或非天然的核苷间键的聚合物。修饰的主链包括在主链中保留磷原子的那些,诸如硫代磷酸酯、手性硫代磷酸酯、二硫代磷酸酯、磷酸三酯、氨基烷基磷酸三酯、甲基和其它烷基膦酸酯,以及不再具有磷原子的那些,诸如由短链烷基或环烷基核苷间键、混合的杂原子和烷基或环烷基核苷间键、或一个或多个短链杂原子或杂环核苷间键形成的主链。这样的不含磷的主链的一个例子是吗啉代键(参见,例如,美国专利号5,185,444、5,034,506和5,142,047,它们都通过引用并入本文)。修饰的核酸聚合物(类似物)可以含有一个或多个修饰的糖部分。例如,通过2-甲氧基乙氧基(2-MOE)基团在2'位处的取代可以修饰糖部分(参见,例如,Martin等人,(1995)Helv.Chim.Acta,78:486-504)。实施方案也预见到作为RNA或DNA模拟物的类似物,其中核苷酸单元的糖和核苷间键被新基团替代。在这些模拟物中,碱基单元维持用于与靶序列杂交。这样的模拟物的一个例子(其已经被证实具有优良的杂交性能)是肽核酸(PNA)(Nielsen等人,(1991)Science,254:1497-1500;国际专利申请WO92/20702,通过引用并入本文)。在PNA化合物中,寡核苷酸的糖-主链被含有酰胺的主链(例如氨基乙基甘氨酸主链)替代。核苷碱基被保留并直接地或间接地结合至主链的酰胺部分的氮杂-氮原子。预见到的多核苷酸可以还包括这样的衍生物,其中核酸分子已经通过置换、化学方式、酶方式或其它适当方式被除了天然存在的核苷酸以外的部分(例如作为标记起作用的部分,如本文中所述)共价地修饰。本发明还包括具有SEQIDNO:1-9或10-36中所示的核酸序列的多核苷酸的同系物。同系物是在SEQIDNO:1-9或10-36中的任一个所示的基本序列中具有至少一个改变的核酸,所述改变不会破坏如上所述的多核苷酸与靶序列特异性地杂交的能力。因此,可以改变基本序列,例如,通过例如SEQIDNO:1-9或10-36中的一个或多个核苷酸的插入、添加、缺失或置换。因而,作为在SEQIDNO:1-9或10-36中公开的序列的片段的同系物可以具有SEQIDNO:1-9或10-36的核酸序列的至少约7个、10个、13个、14个、15个、16个、17个、18个、19个、20个、21个、22个、23个或更多个核苷酸的连续序列,且保留如上所述与靶序列特异性地杂交的能力。通常,同系物的核酸序列与SEQIDNO:1-9或10-36所示的核酸序列具有至少约50%、60%、70%、80%、85%、90%或95%核酸序列同一性。就这样的序列而言的同一性在本文中被定义为,比对所述序列并在必要时引入间隙以实现最大同一性百分比以后,候选序列中与已知多核苷酸相同的核苷酸的百分比。末端(5'或3')或内部缺失、延伸或在核苷酸序列中的插入不应解释为影响同一性。在某些实施方案中,所述多核苷酸包含与MTB靶序列特异性地杂交的引物和探针,例如具有SEQIDNO:1-9或10-36中所示的核酸序列中的任一个的核酸分子,包括可以与MTB靶序列特异性地杂交的所述核酸序列的类似物和/或衍生物,及其同系物。如下所述,多核苷酸用作引物和/或探针以扩增或检测MTB。可以通过多种技术来制备多核苷酸。例如,使用固相合成,使用商购可得的设备,诸如可得自AppliedBiosystemsUSAInc.(FosterCity,Calif.)、DuPont(Wilmington,Del.)或Milligen(Bedford,Mass.)的设备,可以制备多核苷酸。还可以容易地制备经修饰的多核苷酸,诸如硫代磷酸酯和烷基化的衍生物(参见,例如,美国专利号5,464,746、5,424,414和4,948,882)。所述多核苷酸可以直接用作探针用于测试样品中的MTB核酸的检测或定量、或两者。在合适的杂交条件下使测试样品与至少一种多核苷酸接触,并且然后检测靶序列和至少一种多核苷酸之间的杂交。检测可以是直接的或间接的。在某些实施方案中,直接地检测探针和靶标之间的杂合物。在某些实施方案中,间接地定向所述杂合物,例如,通过检测由酶反应产生的反应副产物,所述酶反应在探针和MTB靶标之间的双链体存在下发生。所述多核苷酸可以包含一种或多种可检测标记。可检测标记是这样的分子或部分:其具有可以直接地或间接地检测的性质或特征,并且经过选择使得多核苷酸与它的靶序列杂交的能力不会受到不利影响。检测标记具有与前面定义的“标记”相同的定义,且“捕获标记”通常用于从其它扩增反应物分离延伸产物、和与任何这样的产物结合的探针。特异性结合成员(如前面定义)非常适合用于此目的。并且,根据该方法使用的探针可以在它们的3'末端处被封闭,使得它们不会在杂交条件下延伸。用于阻止探针延伸的方法是众所周知的,且是本领域技术人员的选择内容。在采用标记检测引物-扩增产物的情况下,引物序列任选地可以用捕获标记或检测标记进行标记。在某些实施方案中,引物包含与MTB靶核酸杂交的3’部分和将非-MTB序列引入由其产生的延伸产物的5’部分。这样的5’部分可以包括用于例如下一代测序技术中的合成标签序列。在某些实施方案中,使用探针与延伸产物或由引物序列产生的扩增子杂交,且通常与不包括引物序列的序列杂交。类似于引物序列,所述探针序列还可以用捕获标记或检测标记进行标记,条件是,在某些实施方案中,当用捕获标记来标记引物时,用检测标记来标记探针,反之亦然。在形成拷贝序列/探针杂合物后,在拷贝序列和探针序列上的差别标记(即,捕获和检测标记)可以用于分离和检测这样的杂合物。所述多核苷酸也适合在夹心-型测定中用作捕获探针。简而言之,将多核苷酸捕获探针连接至固体支持物并在合适的杂交条件下与测试样品接触,使得在捕获探针和存在于测试样品中的任何靶核酸之间形成探针:靶标杂合物。一个或多个适当的洗涤步骤以后,检测探针:靶标杂合物,经常借助于第二“公开”探针或通过识别杂合分子的特异性抗体。实施方案也预见到多核苷酸在改进的核酸杂交测定中的应用。例如,美国专利号5,627,030公开了一种在核酸杂交测定中放大检测信号的方法。在公开的测定中,使第一多核苷酸探针序列在合适的条件下与靶序列杂交,随后将探针:靶标杂合物免疫捕获和固定化。然后将含有许多重复序列单元的第二多核苷酸探针与探针:靶标杂合物的探针组分杂交。通过许多标记的核酸序列探针的杂交实现检测,每种探针针对存在于第二探针中的重复序列单元中的每一种。多个标记的探针与第二探针的连接因而会放大检测信号和增加测定的灵敏度。MTB核苷酸序列的扩增和检测所述多核苷酸可以用作引物或探针以扩增和/或检测测试样品中的MTB。本文中提供的引物/探针集合包含至少两种引物和至少一种探针。根据核酸扩增技术可以采用这些引物/探针集合。因此,可以采用在任何特定引物/探针集合中的引物来扩增靶序列。在大多数情况下,探针与由一种或多种引物产生的靶序列的拷贝杂交,且通常促进检测在扩增反应过程中产生的靶序列的任何拷贝。当将适当的引物和探针组合时,根据核酸扩增程序可以采用所有引物/探针集合以特异性地和灵敏地检测MTB。预见到,本文提供的引物/探针集合的各个引物和探针可以可替换地与在本文提供的引物/探针集合中所述的那些以外的引物和/或探针联合使用。在某些实施方案中,采用两个引物和探针集合来检测两种不同的MTB靶序列。扩增程序包括、但不限于:聚合酶链式反应(PCR)、TMA、滚环扩增、基于核酸序列的扩增(NASBA)和链置换扩增(SDA)。本领域技术人员会理解,为了用在某些扩增技术中,可能需要修饰引物,例如,对于SDA,所述引物包含在它的5'末端附近的另外核苷酸,其构成限制性内切核酸酶的识别位点。类似地,对于NASBA,所述引物包含在5'末端附近的另外核苷酸,其构成RNA聚合酶启动子。在某些实施方案中,当为扩增反应选择引物时,考虑某些标准。例如,当扩增反应需要引物对时,应当选择引物,使得形成3'双链体的可能性最小化,并使得解链温度(TM)足够类似以优化与靶序列的退火并使非特异性退火的量最小化。在某些实施方案中,所述扩增方法包括:(a)形成反应混合物,其包含核酸扩增试剂、至少一个引物/探针集合、和疑似含有至少一个靶序列的测试样品,和(b)使所述混合物处于扩增条件以产生靶序列的互补核酸序列的至少一个拷贝。可以将以上方法的步骤(b)重复任意合适的次数(在检测方法中在步骤(c)之前),例如,通过使反应混合物热循环10-100次,通常约20至约60次,更通常约25至约45次。核酸扩增试剂包括、但不限于:至少具有聚合酶活性的酶,酶辅因子诸如镁或锰;盐;烟酰胺腺嘌呤二核苷酸(NAD);和脱氧核苷酸三磷酸(dNTP)例如脱氧腺嘌呤三磷酸、脱氧鸟嘌呤三磷酸、脱氧胞嘧啶三磷酸和脱氧胸腺嘧啶三磷酸。扩增条件是通常促进一个或多个核酸序列的退火和延伸的条件。通过多种方法可以检测使用如上所述的多核苷酸扩增靶核酸序列所产生的具体扩增子。例如,可以标记在扩增反应中使用的一种或多种引物,使得可以在扩增反应以后通过常规技术直接检测扩增子。可选地,在扩增反应结束以后,可以加入探针(其由在扩增反应中使用的引物之一的标记形式组成)或第三多核苷酸,所述第三多核苷酸不同于已经标记的引物序列且与扩增的序列的一个区域互补。然后将混合物处于适当的杂交和洗涤条件并通过常规方法检测所述标记。在靶序列的扩增过程中或随后,可以检测如上生产的扩增产物。用于在扩增(例如,实时PCR)过程中检测靶序列的扩增的方法如上所述,且描述在,例如,美国专利号5,210,015中。可选地,使扩增产物与探针杂交,然后与其它反应组分分离,并使用微粒和标记的探针检测。容易理解,允许靶核酸序列的扩增和检测在单个未启封的反应容器中同时进行的程序将是有利的。这样的程序会避免扩增后加工步骤中的“遗留”污染风险,并且也会促进高通量筛选或测定和所述程序对自动化的适应。此外,这类程序允许“实时”监测扩增反应以及“端点”监测。特别适合这类程序的探针分子的例子包括分子信标探针和TAQMAN探针。TAQMAN探针通常是由靶序列的互补多核苷酸组成的双标记的发荧光的核酸探针,其在5'末端处用荧光团标记且在3'末端处用猝灭剂标记。在游离的探针中,荧光团和猝灭剂的紧密靠近会确保所述荧光团在内部被淬灭。在扩增反应的延伸阶段中,通过聚合酶的5'核酸酶活性切割探针并释放荧光团。释放的荧光团然后可以发荧光并从而产生可检测信号。在某些实施方案中,采用“分子信标”探针。分子信标探针描述在,例如,美国专利号6,150,097、5,925,517和6,103,476(通过引用整体并入本文)中。基本上,分子信标是能够形成茎-环(发夹)结构的多核苷酸探针。所述环是含有靶序列的互补序列的单链结构,而所述茎通常与靶序列无关并自杂交以形成双链区域。既与靶序列互补又可以自杂交的核苷酸也可以形成茎区域的组成部分。荧光团部分连接至所述茎的一个臂,且猝灭剂部分连接至另一个臂。当多核苷酸呈现发夹形状时,荧光团和猝灭剂紧密靠近且由荧光团发射的能量因而被猝灭剂吸收和作为热而发出,从而导致荧光团的内部淬灭。在多核苷酸与它的靶序列结合后,荧光团和猝灭剂变得在空间上分离,且荧光团可以发荧光从而产生可检测信号。使用的荧光团的例子包括、但不限于:荧光素和荧光素衍生物诸如二卤代-(C1至C8)二烷氧基羧基荧光素、5-(2'-氨基乙基)氨基萘-1-磺酸(EDANS)、香豆素和香豆素衍生物、萤光黄、德克萨斯红、四甲基罗丹明、四氯-6-羧基荧光素、5-羧基罗丹明、酞菁染料等。猝灭剂包括、但不限于:DABCYL、4'-(4-二甲基氨基苯基偶氮基)苯甲酸(DABSYL)、4-二甲基氨基苯基偶氮基苯基-4'-马来酰亚胺(DABMI)、四甲基罗丹明、羧基四甲基罗丹明(TAMRA)、BlackHoleQuestion(BHQ)染料等。在某些实施方案中,采用定量测定。在某些这样的实施方案中,在反应中采用内部标准品。这样的内部标准品通常包含对照靶核酸序列和对照多核苷酸探针。所述内部标准品可以任选地还包括另一对引物。这些对照引物的基本序列可能与MTB多核苷酸无关且对于对照靶核酸序列是特异性的。可选地,如果设计对照靶序列使得它结合MTB引物,不需要使用另外的引物。使用“端点”方法或“实时”方法可以定量测试样品中的靶核酸的量。在某些实施方案中,将MTB检测测定提供为高通量测定。对于高通量测定,经常将反应组分容纳在多容器载体或平台(诸如多孔微孔滴定板)中,其允许在相同测定中监测多个含有不同测试样品的测定反应。在某些实施方案中,采用高度自动化的高通量测定来增加筛选或测定过程的效率。许多高通量筛选或测定系统现在可商业得到,用于许多程序(诸如样品和试剂吸量、液体分配、定时温育、使样品形成微阵列、微量培养板热循环和在适当检测器中的微量培养板读出)的自动化能力也可商业得到,从而产生快得多的测出时间(throughputtimes)。在某些实施方案中,在微流控装置(例如,卡片)中执行反应。所述多核苷酸、方法和试剂盒可用在临床或研究场合中用于检测和/或定量MTB核酸。因而,在这些场合中,多核苷酸可以在测定中用于诊断受试者中的MTB感染,或监测被MTB感染的受试者中的MTB靶核酸序列的量。监测受试者中的细菌的量在鉴别或监测对抗细菌疗法的应答中是特别重要的。在某些实施方案中,使用与样品灭活组合的实时PCR执行双靶标测定。尽管可以使用多种样品,高度临床上有关的样品包括涂片阳性的或涂片阴性的痰样本(诱导的或咳出的)、支气管肺泡灌洗液(BAL)样品、或痰和BAL样品的N-乙酰基-L半胱氨酸(NALC)-处理的沉淀物。这些样品呈现的挑战包括痰的分子复杂性,其含有可以干扰分子测定、细胞裂解和细胞灭活的众多组分。在某些实施方案中,执行样品灭活步骤以降低与可能含有MTB的临床样本有关的感染风险。例如,通过与灭活试剂一起温育临床样品(参见下面的实施例3)实现感染风险的降低。在某些实施方案中,所述测定适合于与自动化的实时PCR检测系统(诸如Abbottm2000sp系统)一起使用。因而,在某些实施方案中,在进行测定之前,制备样品用于与这样的系统一起使用。例如,在某些实施方案中,使用基于磁性微粒的技术(AbbottmSamplePreparationSystemDNA)执行靶DNA的制备。这可以使用用于自动化的样品制备的Abbottm2000sp或使用手工样品制备方案来执行。在某些实施方案中,从样品制备的开始处理内部对照(IC)、阳性对照和阴性对照以证实所述过程已经正确地进行。对于扩增,在某些实施方案中,使用Abbottm2000sp仪器或手工地将纯化的样品DNA和主混合物加入96-孔PCR平板中。加入以后,将每个平板密封并转移至Abbottm2000rt,在其中使用DNA聚合酶执行PCR扩增。在某些实施方案中,通过测量MTB探针的实时荧光信号,在退火/延伸步骤中检测MTB扩增产物的存在。通过测量IC探针的实时荧光信号来检测IC扩增产物的存在。在某些实施方案中,所述MTB和IC探针是由以下部分组成的单链DNA寡核苷酸:靶标特异性结合序列,与探针的5′末端共价地连接的荧光部分,和与探针的3′末端共价地连接的淬灭部分。在没有MTB或IC靶序列存在下,探针荧光被淬灭。在有MTB或IC靶序列存在下,MTB或IC探针在退火/延伸步骤过程中特异性地结合靶标中的它们的互补序列,从而允许荧光发射和检测。在某些实施方案中,所述MTB探针用不同的荧光染料(FAM™用于MTB靶标探针,Quasar®用于IC)标记,从而允许MTB和IC的扩增产物在相同反应中同时检测。在某些实施方案中,采取步骤来避免核酸污染。例如,在某些实施方案中,污染被最小化,因为:PCR扩增和寡核苷酸杂交发生在密封的多孔平板中;检测自动地进行,不需要打开反应容器(例如,平板孔);使用气溶胶屏障移液器尖部用于所有吸液;在使用以后抛弃移液器尖部;和将单独的专用区域用于执行MTB测定。在某些实施方案中,以试剂盒和/或系统(例如,包含本文描述的自动化的样品程序和测定仪器的系统)的形式提供上述试剂。例如,在某些实施方案中,所述试剂盒包含以下组件、基本上由其组成或由其组成:1.MTB内部对照(4个小瓶,0.4mL/小瓶),在含有载体DNA的缓冲溶液中的<0.01%的非传染性的线性化的DNA质粒。防腐剂:叠氮化钠和0.15%ProClin®950。2.扩增试剂包(4包,24个测试/包)。每个试剂包含有:1瓶(0.078mL)在含有稳定剂的缓冲溶液中的DNA聚合酶(5.4-5.9单位/μL)。1瓶(0.5314mL)MTB扩增试剂。<0.1%合成寡核苷酸(一个或多个靶标引物集合和探针;用于内部对照的引物集合和探针),和在含有参比染料的缓冲溶液中的<0.6%dNTP。防腐剂:叠氮化钠和0.15%ProClin®950。1瓶(0.778mL)活化试剂。在缓冲溶液中的38mM氯化镁。防腐剂:叠氮化钠和0.15%ProClin®950。3.MTB阴性对照(8个小瓶,1.6mL/小瓶);缓冲溶液;防腐剂:叠氮化钠和0.15%ProClin®950。4.MTB阳性对照(8个小瓶,1.6mL/小瓶);在含有载体DNA的缓冲溶液中的<0.01%非传染性的线性化的DNA质粒。防腐剂:叠氮化钠和0.15%ProClin®950。在某些实施方案中,检测到MTB的所有形式(例如,选择引物和探针以鉴别可能存在于样品中的所有MTB核酸靶序列)。在某些实施方案中,检测特异性的MTB序列,诸如抗生素-抗性株(例如,利福平、异烟肼)。实施例下述实施例仅用于例证目的,且不应解释为以任何方式限制本发明的范围。实施例1示例性的测定工作流本实施例描述了进行实时PCR以检测样品中的MTB的特异性的、有效的方案。在某些实施方案中,实时PCR方法包括下述步骤或由下述步骤组成:1.使用灭活试剂(IR)灭活样品(例如,痰、支气管肺泡灌洗液[BAL]、以及痰和BAL的N-乙酰基-L-半胱氨酸[NALC]沉淀物)中的MTB。在某些实施方案中,所述灭活试剂包含异丙醇、氢氧化钠、吐温-20和水或由其组成;2.样品制备,其中使用试剂从灭活的样品提取DNA;使用自动化的m2000sp仪器(AbbottMolecular)或手工地执行样品制备;3.PCR组装,其中将纯化的样品和测定PCR组分一起加入96-孔光学反应平板或其它多室反应支持物中;这使用m2000sp或手工地执行;4.96-孔光学反应平板的手工密封和平板向m2000rt仪器的转移。5.使用自动化的m2000rt仪器对PCR产物的扩增和检测;在m2000rt工作站上自动地报告患者结果。该工作流的图形概述显示在图1中。实施例2靶标选择和引物/探针设计在某些实施方案中,采用双靶标策略来检测MTB复合物。两种靶标包括:插入序列(IS)6110和蛋白抗原B(PAB)。参见下面的表1:表1.AbbottRealTimeMTB靶标选择:双靶标策略的应用会阻止由靶序列突变或缺失造成的假阴性结果。用于检测IS6110和PAB靶序列的探针和引物包括在表2中的那些。表2.实时MTB引物/探针序列(FP=正向引物;RP=反向引物;#pdU=5’丙炔基dU;*pdC=5’丙炔基dC;Fam=荧光素染料;BHQ=黑洞猝灭剂;IC=内部对照):材料SEQIDNO序列IS6110(121)FPSEQIDNO:15'CCTGCGAGCGTAGGCGTCGGTGA3’IS6110(121)RPSEQIDNO:25'CGTCCAGCGCCGCTTCGGACCA3’PABabt2FPbSEQIDNO:35'GCACCTCAAGCTGAACGGAAAAGTCCT3’PABabt2RPxSEQIDNO:45'CCGGGGTTGAGCGCAGCGATCT3’IS6110探针6SEQIDNO:55'6-Fam-pdU#AGGpdUGAGGpdUpdC*pdUGpdCpdUApdCpdCpdC-BHQ1dT3’PAB探针1SEQIDNO:65'6-Fam-pdUApdCpdCAGGGpdCApdCpdCApdUpdCAAA-BHQ1dT3’ICFP196SEQIDNO:75’CTACAGCAGAGTTGGCAGCTTCACTTTC3’ICRP310SEQIDNO:85’GTCTGGCCTTTCAGCAAGTTTC3’内部对照探针:SEQIDNO:95’Quasar-GApdCGAGpdUpdUpdCApdUGAGGGpdCA-BHQ2dT3’表3提供了用于检测MTB靶序列的替代引物和探针。除了IS6110和PAB以外,另外的靶标包括rPOB(编码RNA聚合酶的β亚基的单拷贝基因,约95%的利福平抗性突变的位点)、SenX3-RegXe(编码调节蛋白的单拷贝基因)、hsp65(编码热激蛋白的单拷贝基因)和MPB64(编码23KDa蛋白的单拷贝基因)。表3.其它引物/探针序列:名称SEQIDNO序列IS6110(104)FP1SEQIDNO:105'GCCGCTTCGGACCACCAGCACCTAACIS6110(104)RP1SEQIDNO:115'GTAGGCGTCGGTGACAAAGGCCACGTAGIS6110(104)探针SEQIDNO:125'TGCCCAGGTCGACACATAIS6110(80)FP1SEQIDNO:135'TACGACCACATCAACCGGGAGCCCAIS6110(80)RP1SEQIDNO:145'GCGTGGACGCGGCTGATGTGCTCCTIS6110(80)pr1SEQIDNO:155'CCGCGAGCTGCGCGATGPABabt1FPSEQIDNO:165'-GCACGCTGCTCTACCCGCTGTTCAACCTPABabt1RPSEQIDNO:175'-GTGCCCTGAGCGGTGATCGTGACGTTPABabt1探针:SEQIDNO:185'TCCGGCCTTTCACGAGAnhsp65FP1SEQIDNO:195’TCGGGGCTCGGGTAGAAGTTnhsp65RP1SEQIDNO:205’TCGTCAACTCGGGCAGCAACnhsp65探针1SEQIDNO:215’TACTCGGCTCACGCACGvhsp65FP1SEQIDNO:225'GGCTCGGGTAGAAGTTCGACTTGGvhsp65RP1SEQIDNO:235'GTCAACTCGGGCAGCAACGACvhsp65探针1SEQIDNO:245'CTCACGCACGGCGGTATTCsenX3FPSEQIDNO:255’GGCAGCGGACTCGGGTTsenX3RPSEQIDNO:265’ACCGCAGTTCGGGCTCTCsenX3PrSEQIDNO:275’TCACGACGACGAGCGACregX3FPSEQIDNO:285’CGCTGATGACCAGTGTGTTGATTregX3RPSEQIDNO:295’GCAGCATCAGATCGAGCAGGACregX3探针SEQIDNO:305’ATGGTCCGGCAGCTCTCMPB64FP1SEQIDNO:315’CAACATCAGCCTGCCCAGTTACTACCMPB64RP1SEQIDNO:325’CTTCGCGTGGAGTGGACGATGMPB64探针1SEQIDNO:335’AAGTCGCTGGAAAATTACATrPOBFPaSEQIDNO:345’CGTGGAGGCGATCACACCGCAGACGTTrPOBRPbSEQIDNO:355’CGTTGATCAACATCCGGCCGGTGGTCrPOB探针5SEQIDNO:365’CGGTCTGTCACGTGAGCGTGC实施例3样品灭活本实施例描述了用于进行样品灭活步骤的示例性试剂和方法。灭活试剂(IR)的制备采用的材料:•聚丙烯或玻璃容器•10MNaOH•异丙醇•吐温-20•净化水IR的制备:500mL需要的物质体积10MNaOH20mL净化水179.1mL异丙醇300mL吐温-200.9mL1.将179.1mL水加入空聚丙烯或玻璃容器中(避免使用聚苯乙烯容器)。2.将0.9mL吐温-20加入容器中。3.将20mL10MNaOH加入容器中。4.将300mL异丙醇加入容器中。5.通过反转20次混合所述组分。在环境温度使用或储存至多1个月。灭活程序:1.如果冷冻的话,在15-30℃融化样本。2.估计要灭活的样本的体积。3.将IR以1:3的比率加入(例如,1mL样本+3mLIR)(优选的样本体积是0.3-10mL)。4.反转容器以确保IR和样本之间的接触。5.将混合物涡旋20-30秒。6.将混合物在环境温度温育至少1小时和优选地不超过24小时。将混合物在20-30分钟涡旋最后一次20-30秒进入温育时段。实施例4样品制备方法:实施例1的MTB测定使用Abbott自动化的m2000sp仪器或手工方法来处理痰、BAL以及痰或BAL样品的NALC-NaOH沉淀物,并使用Abbott自动化的m2000rt仪器进行扩增和检测。两种方法能够从样品提取DNA,两种DNA纯化使用来自AbbottmSamplePreparationSystemDNA的DNAGPR(列表6K12-24)样品制备试剂执行。优化样品制备试剂和方法(包括裂解步骤、洗涤步骤、洗脱步骤、尖部重复使用安排等)以减少由于抑制性痰或TB灭活试剂(IR)的遗留引起的对PCR反应的抑制作用:因而离心以除去IR处理过的样品中的IR不是必要的。还优化所述程序以减少从高阳性样品至附近阴性样品的遗留。还优化样品制备以确保TB细胞破裂用于有效的DNA回收和PCR。实时PCR:在96-孔光学反应平板(手工地或经由m2000sp)中的PCR反应组装以后,将96-孔板手工地密封并转移至m2000rt以执行扩增和实时荧光检测反应。患者结果自动地报告在m2000rt工作站上。MTB测定检测内部对照核酸序列作为样品有效对照、样品提取和扩增效率对照。表4提供了示例性的PCR循环条件。表4.阶段循环步骤温度(℃)时间1115010分钟2119410分钟35019435秒26415秒读出36540秒对于在以下实施例中所示的数据,使用42的测定截止值。也就是说,具有<42的Ct值的样品被认为检测到MTB,而具有>42的测定Ct值的样品被认为未检测到MTB。在m2000rt上运行的测定是按照生产商的推荐方案。一个这样的实施例包括以下步骤:1.每次运行执行96个IR-处理的样品。在每次运行中包括1个阴性对照和1个阳性对照,因此允许每次运行处理94个IR-处理的样品的最大值。2.在使用之前,将IR-处理的样品涡旋3-5秒。使用移液器,将IR-处理的样品转移至反应容器。在该步骤中使IR-处理的样品中的可见微粒的转移最小化。3.在2-8℃或15-30℃融化测定对照、IC和扩增试剂。一旦融化,可以在使用之前将IC在2-8℃封闭储存至多14天。一旦融化,可以在使用之前将对照在2-8℃储存至多24小时。如果不使用任选的扩增试剂会延长使用特征:在2-8℃或15-30℃融化新扩增试剂。一旦融化,可以在使用之前将扩增试剂在2-8℃储存至多24小时。如果使用任选的扩增试剂会延长使用特征:选择要在运行中使用的新的和/或部分的扩增试剂包。关于扩增试剂包库存管理的说明书,参考Abbottm2000spOperationsManual(列表号9K20-06或更高),OperatingInstructions。扩增试剂包应当具有相同的批号。4.在使用之前将每个对照涡旋3次,每次持续2-3秒。确保不产生气泡或泡沫。如果发现的话,对于每个试管用新无菌移液器尖部除去它们。通过在工作台上轻敲小瓶以使液体到达瓶底来确保每瓶的内容物在涡旋以后是在底部。5.轻轻地反转AbbottmSamplePreparationSystemDNA瓶子以确保均匀溶液。如果在打开后在任何试剂瓶中观察到晶体,允许试剂在室温平衡直到晶体消失。在晶体已经溶解之前不使用试剂。确保不产生气泡或泡沫;如果存在的话,用无菌移液器尖部除去,为每个瓶子使用新尖部。注:在将mMicroparticlesDNA倒入200mL试剂容器中之前,剧烈混合或涡旋直到mMicroparticlesDNA完全再悬浮。6.在使用之前将IC瓶涡旋3次,每次2-3秒。确保不产生气泡或泡沫;如果存在的话,用无菌移液器尖部除去。7.使用专用于仅内部对照使用的经校准的精确移液器,将180μLIC加入1瓶mLysisDNA缓冲液中。通过轻轻反转容器5-10次进行混合以使起泡最小化。每瓶mLysisDNA缓冲液支持多达48个样品制备。将180μLIC加入49-96样品的第二瓶mLysisDNA缓冲液中。如果使用任选的扩增试剂会延长使用特征,可以将IC的部分小瓶重新盖帽并在2-8℃储存用于第二次使用。8.将25mL美国药典级190-200标准强度的乙醇(95-100%乙醇)加入mLysisDNA缓冲液+IC试剂瓶中。不使用含有变性剂的乙醇。轻轻反转容器以确保均匀溶液。对于49-96样品,将25mL乙醇加入第二瓶mLysisDNA缓冲液+IC。轻轻反转以确保均匀溶液。9.将70mL美国药典级190-200标准强度的乙醇(95-100%乙醇)加入mWash2DNA瓶子。不使用含有变性剂的乙醇。每瓶mWash2DNA支持多达48个反应。轻轻反转以确保均匀溶液。10.将阴性和阳性对照和患者样本放入Abbottm2000sp样品支架中。11.将5mL反应容器放入Abbottm2000sp1mL子系统载体中。12.如在Abbottm2000spOperationsManual,OperatingInstructions中所述,将含有AbbottmSamplePreparationSystemDNA试剂的载体支架和Abbott96-深孔板装载到Abbottm2000sp工作台上。13.从RunSampleExtraction筛,如在Abbottm2000spOperationsManual,OperatingInstructions中所述选择和开始样品提取方案。注:在程序扩增试剂之前更换手套。14.在样品制备完成以后,将扩增试剂包和主混合物瓶(如果需要的话)加载到Abbottm2000sp工作台上。每个扩增试剂包支持多达24个反应。对于1-24样品融化1组试剂,对于25-48样品融化2组试剂,对于49-72样品融化3组试剂,和对于73-96样品融化4组试剂。确保扩增试剂在使用之前彻底融化。通过在工作台的垂直位置轻打小瓶,确保内容物是在小瓶的底部。除去扩增试剂瓶帽。如果使用任选的扩增试剂会延长使用特征,可以使用新和部分试剂包的组合。如果不使用任选的扩增试剂会延长使用特征,可以仅使用新试剂包。在打开扩增试剂之前通过在工作台的垂直位置轻打小瓶确保新扩增试剂包的内容物是在小瓶的底部。不轻打使用第二次的部分扩增试剂包。轻打可能导致帽中主混合物体积的损失。除去帽。如果将新的扩增试剂包储存用于第二次使用,将小瓶重新加帽进行贮存。如果计划重复使用原始帽来给试剂瓶重新加帽,将原始帽保存并使用。如果计划使用新帽来给试剂瓶重新加帽,将原始帽抛弃。将部分扩增包加载到Abbottm2000sp工作台上的新扩增包的左侧。确保扩增试剂包牢固地安放在仪器上。15.从匹配对应样品制备提取的RunMasterMixAddition筛选择适当的深孔板。开始Abbottm2000spMasterMixAddition方案。遵循如在Abbottm2000spOperationsManual,OperatingInstructions部分中所述的指令。注:扩增主混合物和样品洗脱物向Abbott96-WellOpticalReactionPlate中的组装(步骤15)应当在样品制备完成以后1小时内开始。注:Abbottm2000rt方案(步骤20)应当在主混合物添加方案起始的90分钟内开始。注:如果运行由于任何原因在步骤15之后异常中止,要抛弃扩增试剂,并且如果将重复Abbottm2000sp主混合物添加方案(步骤15)应当使用新的96-孔PCR平板。16.在扩增区域中开启并初始化Abbottm2000rt。注:Abbottm2000rt需要15分钟来预热。注:在返回至样品制备区域之前更换实验室外被和手套。17.在Abbottm2000sp仪器已经完成样品和主混合物的添加以后,将Abbott96-WellOpticalReactionPlate放入AbbottSplash-FreeSupportBase。18.根据Abbottm2000spOperationsManual,OperatingInstructions部分密封Abbott96-WellOpticalReactionPlate。将完成的PCR平板结果输出至CD(或经由网络连接直接输出至映射的Abbottm2000rt)。在某些实施方案中,采用手工样品制备方法。这样的方法的一个例子如下:1.在15-30℃或在2-8℃融化扩增试剂。该步骤可以在样品制备程序完成之前开始。2.每组磁性支架处理12个样品。在每个运行中包括阴性对照和阳性对照,因此允许处理10个样本的最大值。通过遵循这些步骤制备样本用于处理:注:在开始样品提取之前,应当将患者样本灭活。3.在15-30℃或在2-8℃融化1试管的MTB阴性对照、1试管的MTB阳性对照和1瓶MTB内部对照。一旦融化,如果没有立即处理IC,在使用之前在2-8℃储存至多14天。一旦融化,如果没有立即处理对照,在使用之前在2-8℃储存至多24小时。在使用之前将对照和IC涡旋3次,每次2-3秒。通过在工作台上轻打小瓶以使液体到达瓶底,确保每瓶的内容物在涡旋以后是在底部。确保不产生气泡或泡沫;如果存在的话,用无菌移液器尖部除去,为每瓶使用新尖部。4.打开AbbottmSamplePreparationSystemDNA试剂包。如果在打开后在任何试剂瓶中观察到晶体,允许试剂在室温平衡直到晶体消失。在晶体已经溶解之前不使用试剂。5.通过将70mL美国药典级190-200标准强度的乙醇(95-100%乙醇)加入mWash2DNA瓶子中,制备mWash2DNA。不使用含有变性剂的乙醇。轻轻反转以确保均匀溶液。注:将mWash2DNA瓶子做标记以指示,已经为长期使用添加乙醇。6.通过将25mL美国药典级190-200标准强度的乙醇(95-100%乙醇)加入mLysisDNA瓶子中,制备mLysisDNA。不使用含有变性剂的乙醇。轻轻反转5-10次以混合和使起泡最小化。注:将mLysisDNA瓶子做标记以指示,已经为长期使用添加乙醇。7.计算手工运行所需的mLysisDNA溶液的体积:(1.85mLmLysisDNA×样品数目)。将所需体积的mLysisDNA溶液移入大到足以容纳整个体积的聚丙烯容器中。计算手工运行所需的IC的体积:(3.51μLIC×样品数目)。使用专用于仅内部对照使用的精确移液器将所需体积的IC加入含有手工运行所需的mLysisDNA溶液的聚丙烯容器中。通过轻轻反转10-15次以使起泡最小化,混合mLysisDNA溶液和IC混合物。最初使用以后,可以将部分IC小瓶在2-8℃储存至多14天并另外使用1次。8.除了mMicroparticlesDNA瓶子和mWash1DNA瓶子以外,在使用之前轻轻反转所有试剂瓶5-10次以确保均匀溶液。将在步骤11中混合mMicroparticlesDNA瓶子。9.打开控温干燥加热块。将第一块设定至58℃。将第二块设定至80℃。注:检查加热块的温度。在加热块处于正确温度之前不进行操作。10.标记所有必要的试管:1个5mL反应容器/样品用于裂解温育和mWash1DNA步骤。1个1.5mL微量离心管/样品用于第一个和第二个mWash2DNA和洗脱步骤。1个1.5mL微量离心管/样品或96-孔聚丙烯平板用于洗脱液。11.将每个样品的标记的5mL反应容器放入未加热的支持架中。通过涡旋或剧烈摇动来再悬浮mMicroparticlesDNA,直到颗粒是在混悬液中且在瓶底上不再看到沉降的颗粒。将颗粒再悬浮以后,使用精确移液器和无菌的200μL气溶胶屏障移液器尖部将50μLmMicroparticlesDNA加入每个反应容器中。12.为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部,将1.75mL(2X875μL)mLysisDNA加入反应容器中。13.为每个样品使用精确移液器和新鲜的无菌的1000μL气溶胶屏障移液器尖部,将0.8mL对照和样本加入适当的反应容器中。通过抽吸和分配800μL体积5-10次,混合每个样品/mLysisDNA混合物,直到得到均匀的混悬液。注:缓慢地抽吸和分配液体以避免起泡。14.将5mL反应容器转移进58℃加热块中。15.开启定时器并温育15分钟。16.为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部温育以后,通过抽吸和分配800μL将混合物混合5次。17.开启定时器并在58℃加热块中温育另外10分钟。18.为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部温育以后,通过抽吸和分配800μL将混合物混合5次。19.开启定时器并在58℃加热块中温育另外10分钟。20.温育结束以后,将反应容器放入磁性捕获支持架中2分钟以允许颗粒被捕获在反应容器的侧壁上。21.当反应容器处于磁性捕获支持架中时,为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部或一次用弃的转移移液器从每个反应容器小心地取出mLysisDNA并将流体抛弃进废液容器中。尽可能完全地取出流体。不扰乱或抽吸捕获的磁性颗粒。22.从磁性支架取出反应容器并转移至非磁性支架。mWash1DNA(洗液)。23.为每个样品使用精确移液器和新鲜的无菌的1000μL气溶胶屏障移液器尖部,将800μLmWash1DNA加入样品中,并通过用移液器尖部抽吸和分配来轻轻混合10次,使磁性颗粒再悬浮于洗涤流体中。如果必要的话,洗涤来自反应容器侧壁的颗粒。注:当添加mWash1DNA洗液时,缓慢地分配液体以避免飞溅。24.将洗涤流体和颗粒转移至标记的1.5mL微量离心管。25.将试管在磁性捕获支持架中放置1分钟以允许颗粒被捕获在试管的侧壁上。26.当试管在磁性捕获支持架中时,为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部以从每个试管小心地取出mWash1DNA并将流体排入废液容器中。尽可能完全地取出流体。不扰乱或抽吸捕获的磁性颗粒。27.从磁性支架取出试管并转移至非磁性支架。mWash2DNA(第一洗液)。28.为每个样品使用精确移液器和新鲜的无菌的1000μL气溶胶屏障移液器尖部,将800μLmWash2DNA加入样品中,并通过用移液器尖部抽吸和分配来轻轻混合5-10次将磁性颗粒再悬浮在洗涤流体中。如果必要的话,洗涤来自试管侧壁的颗粒。注:当加入mWash2DNA洗液时,缓慢地分配液体以避免飞溅。29.将试管在磁性捕获支持架中放置1分钟以允许颗粒被捕获在试管的侧壁上。30.当试管在磁性捕获支持架中时,为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部以小心地从每个试管取出mWash2DNA并将流体排入废液容器中。尽可能完全地取出流体。不扰乱或抽吸捕获的磁性颗粒。31.从磁性支架取出试管并转移至非磁性支架。mWash2DNA(第二洗液)。32.为每个样品使用精确移液器和新鲜的无菌的1000μL气溶胶屏障移液器尖部,将800μLmWash2DNA加入样品中,并通过用移液器尖部抽吸和分配来轻轻混合5-10次,将磁性颗粒再悬浮在洗涤流体中。如果必要的话,洗涤来自试管侧壁的颗粒。注:当加入mWash2DNA洗液时,缓慢地分配液体以避免飞溅。33.将试管在磁性捕获支持架中放置1分钟以允许颗粒被捕获在试管的侧壁上。34.当试管在磁性捕获支持架中时,为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部以小心地从每个试管取出mWash2DNA并将流体排入废液容器中。尽可能完全地取出流体。不扰乱或抽吸捕获的磁性颗粒。35.从磁性支架取出试管并转移至80℃加热块,并在敞开帽的情况下温育15分钟以允许乙醇蒸发。36.为每个样品使用精确移液器和新鲜的无菌的1000μL气溶胶屏障移液器尖部,将250μLmElutionBufferDNA加入样品中并通过用移液器尖部抽吸和分配将磁性颗粒再悬浮在流体中。如果必要的话,洗涤来自试管侧壁的颗粒。37.将试管放入80℃加热块中,开启定时器并温育4分钟。38.从80℃加热块取出试管。为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部,通过抽吸和分配200μL将样品和mElutionBufferDNA混合物混合4次。39.将试管返回至80℃加热块。开启定时器并温育4分钟。40.从80℃加热块取出试管并放入磁性捕获支持架中1分钟以允许颗粒被捕获在试管的侧壁上。41.当试管在磁性捕获支持架中时,为每个样品使用新鲜的无菌的1000μL气溶胶屏障移液器尖部以小心地从试管取出洗脱的样品。不扰乱或抽吸捕获的微粒。可以将洗脱的样品放入新鲜的标记的1.5mL微量离心管或96-孔聚丙烯平板中。注:扩增主混合物和样品洗脱液向Abbott96-WellOpticalReactionPlate中的组装(步骤48)必须在样品制备结束以后1小时内开始。42.启动和初始化Abbottm2000rt仪器。注:Abbottm2000rt需要15分钟来预热。43.建立Abbottm2000rt测试次序。参考Abbottm2000rtOperationsManual的OperatingInstructions部分。从方案(Protocol)筛中,选择AbbottRealTimeMTB测定应用方案。注:在返回至试剂制备区域之前取下手套。44.制备扩增主混合物。注:所有试剂制备应当发生在专用的试剂制备区域中。在程序扩增试剂之前更换手套。不要涡旋或反转扩增试剂包。每个扩增试剂包支持多达24个反应。确保扩增试剂在使用之前彻底融化。在打开扩增试剂之前,通过在工作台的竖直位置轻打扩增试剂包以使液体到达小瓶的底部,确保扩增试剂包的内容物是在底部。如下鉴别扩增试剂:活化试剂(试剂1);MTB扩增试剂(试剂2);DNA聚合酶(试剂3);取下并抛弃帽。使用专用于仅试剂应用的经校准的精确移液器,将298μL活化试剂(试剂1)和418μLMTB扩增试剂(试剂2)加入DNA聚合酶瓶(试剂3)中以制备主混合物。通过轻轻上下吸打5次进行混合。避免产生泡沫。45.将主混合物的内容物从DNA聚合酶瓶移入1.5mL微量离心管(列表编号4J71-50或等同物)。通过轻轻上下吸打5次进行混合。避免产生泡沫。46.将Abbott96-WellOpticalReactionPlate放入AbbottSplash-FreeSupportBase中以防止污染。含有荧光物质的Abbott96-WellOpticalReactionPlate的底部的污染可能干扰MTB测定。Abbott96-WellOpticalReactionPlate应当与AbbottSplash-FreeSupportBase一起保持和运输以使污染最小化。47.使用专用于仅试剂使用的精确移液器,将扩增主混合物的25μL等分试样分配进Abbott96-WellOpticalReactionPlate的将运行样品和对照的每个孔中。可以使用经校准的重复移液器。以从第1列开始的次序(从上至下)加入主混合物,并从左至右向每个连续列移动。用肉眼验证25μL已经分配进每个孔中。将AbbottSplash-FreeSupportBase中的Abbott96-WellOpticalReactionPlate转移至样品制备区域。48.为每个样品使用精确移液器和新鲜的无菌的200μL气溶胶屏障移液器尖部,将25μL每个洗脱的样品转移至Abbott96-WellOpticalReactionPlate。在每个样品的转移过程中,通过上下吸打3-5次来混合最终的反应物。用肉眼验证共50μL已经分配进每个孔中。49.根据Abbottm2000rtOperationsManual,OperatingInstructions部分中的说明书密封Abbott96-WellOpticalReactionPlate。50.将AbbottSplash-FreeSupportBase中的Abbott96-WellOpticalReactionPlate在5000g离心5分钟。51.将AbbottSplash-FreeSupportBase中的Abbott96-WellOpticalReactionPlate转移至扩增区域。注:Abbottm2000rt方案(步骤52)应当在主混合物添加和PCR平板制备的起始以后90分钟内开始(步骤44)。52.将Abbott96-WellOpticalReactionPlate放入Abbottm2000rt仪器中,选择建立的测试次序(步骤43),并开始AbbottRealTimeMTB测定应用方案,如在Abbottm2000rtOperationsManual,OperatingInstructions部分中所述。在运行结束时,将测定结果报告在Abbottm2000rt上。实施例5实验数据-灭活评价IRTB杀伤有效性。在该实验中,对含有MTB的样品(在灭活之前将培养的MTB稀释至已知MTB浓度,以及含有MTB的NALC-NaOH沉淀物)进行实施例3的灭活程序。灭活以后,通过离心/洗涤除去多余的灭活试剂,并将存活细胞放在MGIT培养物中最多42天或6周。该持续时间是为MTB培养物推荐的最长时间;大多数MTB阳性的样本将导致在培养起始的20天内可检测的培养物生长)。下面表5解释了当在灭活以后测试培养的样品时得到的结果。由未灭活的MTB组成的阳性对照(PC)表现出在预期的20-天时间范围内的生长,而阴性对照(NC)没有表现出生长。表5.培养的高浓度MTB细胞的灭活.这些数据证实了所述灭活程序用于灭活MTB的有效性。实施例6分析包容性MTB复合物的8个亚种和20个样品(结核分枝杆菌、非洲分枝杆菌(M.africanum)、牛分枝杆菌(M.bovis)、牛分枝杆菌BCG、卡氏分枝杆菌(M.canettii)、田鼠分枝杆菌(M.microti)、山羊分枝杆菌(M.caprae)、海豹分枝杆菌(M.pinnipedii))得自ATCC(从PublicHealthResearchInstitute接收卡氏分枝杆菌)并以10-100基因组DNA拷贝/反应进行测试(参见表6)。在两个水平检测所有8个亚种。表6.测试的MTB复合亚种以25-100个基因组DNA拷贝/反应测试得自PublicHealthResearchInstitute的46个系统发生上和地理学上不同的MTB分离物DNA(>50%具有MDR)(图2)。检测所有测试的亚种。实施例7分析特异性将来自不同分枝杆菌、病毒和其它微生物(n=80)的纯化核酸在1e5-1e7个基因组/mL的靶浓度和在1x106cfu/mL的培养微生物加入MTB阴性对照中以评价潜在交叉反应物对MTB阴性样本的MTB测定结果的影响。将来自不同分枝杆菌、病毒和其它微生物的纯化核酸在1x106至1x107基因组/毫升的靶浓度和在1x106cfu/mL的培养微生物加入MTB阳性样品中以评价潜在交叉反应物对MTB阳性样本的MTB测定结果的影响。通过将热灭活的MTB细胞储备物在阴性对照中稀释至1000拷贝/mL的靶浓度(使用基因组DNA曲线定量),制备MTB阳性样品。没有检测到用潜在交叉反应物测试的MTB阴性样品。检测到用潜在交叉反应物测试的所有80种MTB阳性样品。表7为了确定分析特异性而测试的微生物实施例8分析灵敏度将MTB组、H37Rv株在40cfu/mL在合并的MTB阴性痰中系列稀释以产生灵敏度组。测试了每个稀释度的16个复制。在所有稀释度160倍和更低,观察到100%的检测率。结果显示在表8中。表8.通过测试MTB组的系列稀释物而确定的分析灵敏度.实施例9临床特异性测试了培养阴性的NALC样品(n=155)、痰(n=23)和BAL(n=28)样品(NALC样品来自MTB疑似群体。痰和BAL样品来自不具有TB征状的患者)以确定临床特异性(参见在下面表10中概述的数据)。痰和BAL样品的特异性是100%。NALC样品的特异性是98.7%,具有99%的总特异性。表9.通过测试TB阴性样品而确定的临床特异性.样本类型特异性限定测试的数目阴性结果阳性结果特异性NALCTB疑似培养阴性155153298.7%痰没有TB征状23230100%BAL没有TB征状28280100%总计206204299%表10.通过相对于另一个比较测定(比较对象)的MTB测定(AM),测试了TB培养阳性的样品(包括涂片阳性物和阴性物).*“未测试”样品是因为体积不够。与比较对象的测定相比,RealTimeMTB在低端样品表现出更好的灵敏度。实施例10MTB测定的分析和临床性能本实施例描述了实时MTB检测测定的分析性能。材料和方法实时MTB测定的工作流描述在图1中。样品灭活通过组合下述组分来制备500mL灭活试剂(IR):20mL10MNaOH,300mL异丙醇,0.9mL吐温-20,和179.1mL净化水。一旦制备好,使IR在室温稳定直到1个月。如果冷冻的话,将样本(未处理的样本或经处理的NALC沉淀物)在15℃至30℃融化。将大约3体积的IR加入每个样品体积(最小可允许的样本体积是0.3mL)。不论样品的类型(未处理的或NALC沉淀物),维持相同的样品:IR体积比。在室温温育的第一小时中将混合物涡旋2次,每次20-30秒。经验证的温育时间是1-24小时。灭活过程发生在生物通风厨下。一旦完成,将灭活的样品从生物通风厨下取出,然后进行生物通风厨外的样品制备。使用培养的MTB在3个不同的实验室证实了灭活过程会有效地减小MTB生存力,所述培养的MTB加入痰的NALC沉淀物、MTB阳性的临床NALC沉淀物和MTB涂片/培养阳性的痰样品中(QiC.,等人,EffectivenessofthesampleinactivationprocedureemployedbythenewAbbottRealTimeassayforthedetectionofMycobacteriumtuberculosis,24thEuropeanCongressofClinicalMicrobiologyandInfectiousDiseases(ECCMID)2014)。样品制备将IR-处理的样本和测定对照加载到m2000sp仪器上,在其中使用硫氰酸胍-磁性微粒技术分离DNA以捕获核酸,随后洗涤以除去未结合的组分。在样品制备开始时加入内部对照(IC)。将结合的核酸洗脱并转移至96深孔板。在样品制备结束时,使用m2000sp建立由AmpliTaqGoldPolymerase、氯化镁活化试剂和寡核苷酸试剂(含有引物、探针和dNTP)组成的扩增主混合物。使用m2000sp将主混合物的25µl等分试样、随后的提取的洗脱液的25µl等分试样分配至96-孔光学反应平板。将平板手工地密封并转移至m2000rt用于实时PCR。作为对m2000sp的替代方案,可以手工地执行样品制备、主混合物制备和PCR平板装配。扩增和检测将m2000rt仪器用于扩增和实时荧光检测。通过使用两组引物实现MTB复合物成员的检测(WarrenRM,等人,IntJTubercLungDis2006;10:818-822),一组引物靶向插入元件IS6110(ThierryD,等人,NucleicAcidsRes1990;18:188)且一组引物靶向PAB基因(AndersonAB,HansenEBInfectImmun1989;57:2481-2488)。使用荧光标记的探针产生MTB复合物检测的信号。将MTB双靶标探针各自在5’末端用荧光团FAM标记和在3’末端用黑洞猝灭剂(BHQ1)标记。因而,在相同FAM通道中检测到来自IS6110和PAB的MTB信号。检测到FAM荧光信号处的扩增循环与存在于原始样品中的MTBDNA浓度的对数成比例。将内部对照(IC)的探针在5’末端用Quasar标记并在3’末端用黑洞猝灭剂BHQ2标记以允许在单个PCR孔中可辨别IC和靶信号。测定对照使用最少阴性对照的一个复制和阳性对照的一个复制确定运行有效性。阴性对照由TE缓冲液和防腐剂组成。阳性对照由含有IS6110和PAB靶序列的质粒DNA组成,所述质粒DNA在含有1.5g/mL聚dA:dT和防腐剂的TE缓冲液中稀释。IC由含有南瓜羟基丙酮酸还原酶(HPR)序列插入物的质粒DNA组成,所述质粒DNA在含有1.5g/mL聚dA:dT和防腐剂的TE缓冲液中稀释。在样品制备开始时加入IC,充当样品制备回收、样品抑制和扩增效率的对照。IC没有控制灭活程序。使用在每个样品和运行对照之间的IC阈值循环(Ct)值差异来评估每个样品结果的有效性。组和临床样本MTB复合亚种:从美国典型培养物保藏中心(ATCC,Manassas,VA)得到19个MTB复合亚种DNA样品,并且一个(卡氏分枝杆菌)由IbisBiosciences(Carlsbad,CA)友好地提供。测试了共计20个MTB复合物菌株,包括非洲分枝杆菌25420、非洲分枝杆菌35711、牛分枝杆菌35735、牛分枝杆菌19274、牛分枝杆菌BCG35746、牛分枝杆菌BCG35747D、卡氏分枝杆菌、山羊分枝杆菌BAA-824D、田鼠分枝杆菌11152、田鼠分枝杆菌19422、海豹分枝杆菌BAA-688D、MTB25177D-5(H37Ra)、MTB25618D-5(H37Rv)、MTBBAA-2236D、MTBBAA-2237D、MTB27294D、MTBBAA-2234D、MTB35822D、MTB35838D、MTBBAA-2235D。另外,从UniversityofMedicineandDentistryNewJersey(Newark,NJ)的BarryKreiswirth博士得到46个MTB亚种菌株,包括3个基本遗传组和9个遗传簇(MathemaB,等人,CurrentInsights,ClinicalMicrobiologyReviews2006;19:658-685)。使用报告的DNA浓度直接测试得自ATCC和Ibis的20个MTB复合亚种的DNA,如通过PicoGreen®NanoDrop方法所确定的。在AbbottMolecular使用PicoGreen®NanoDrop测量结果确定其它46个DNA浓度,除了3个样品以外(其中这样的测量结果由于低体积和杂质不能得到)。将这3个样品以1:600的样品:水比率稀释并直接测试。检测限度[LOD]:由Zeptometrix(Buffalo,NY)制备靶向1x105个菌落形成单位(cfu)/mL的MTBH37Rv组。将Zeptometrix组的三个1mL等分试样组合并在3,000xg离心15分钟以除去上清液中的游离的MTBDNA。将细胞沉淀物再悬浮于3mLTE缓冲液中以维持1x105cfu/mL的浓度。然后将细胞加入使用珠子拍打匀浆化的痰集合中,以制备下述含有MTB的稀释组:80cfu/mL,50cfu/mL,25cfu/mL,10cfu/mL,5cfu/mL,1cfu/mL,0.50cfu/mL,0.10cfu/mL,和0.05cfu/mL。分析特异性:如下收集分析特异性组成员:从AdvancedBiotechnologyInc.(Columbia,MD)得到巨细胞病毒、单纯疱疹病毒1和水痘带状疱疹病毒,从ATCC得到69个分枝杆菌和其它微生物物种,并在AbbottMolecular培养8个细菌分离物。潜在干扰物质:为该测试得到下述物质:血液,来自人细胞的DNA,胃酸,高渗盐水,生理盐水,培养基,NALC沉淀物,5种抗-TB药物(异烟肼、利福平、链霉素、吡嗪酰胺、乙胺丁醇),和牛粘液。遗留:制备2个样品:含有1x107个拷贝/mL的质粒(其含有测定靶序列)的高阳性的MTB样品,和阴性样品。再现性:制备2个样品:含有约3倍声明的测定LOD的MTB浓度的阳性样品,和阴性样品。临床样本:由DiscoveryLifeSciences(LosOsos,CA)从俄罗斯、南非、乌干达和越南的TB疑似患者收集198个痰样本。从FoundationforInnovativeNewDiagnostics(FIND)(Geneva,Switzerland)运行的样本库得到150个来自越南的痰样本。从NorthwesternUniversityMemorialHospital(Chicago,IL)得到234个NALC样本。在伦理指南下收集所有患者样本。未确定患者的HIV状态。对于所有样本,在收集场所附近执行的涂片(当可得到时)和培养测试,而在AbbottMolecular执行AbbottRealTimeMTB测定测试。结果MTB复合亚种检测进行该研究来确定在MTB测定中使用的特异性的引物和探针是否会检测下述8种MTB复合亚种:非洲分枝杆菌、牛分枝杆菌、牛分枝杆菌BCG、卡氏分枝杆菌、山羊分枝杆菌、田鼠分枝杆菌、海豹分枝杆菌和结核分枝杆菌。测试了两组纯化的MTB复合物DNA。第一组20种纯化的DNA含有前述MTB亚种的代表。在2个浓度(100和10基因组/反应)测试每种纯化的DNA,每个浓度测试4个复制。在100MTB基因组/反应水平,检测到20个MTB株中的每一个的所有4个复制。在10MTB基因组/反应水平,检测到17个菌株的所有4个复制。对于3个菌株(2个牛分枝杆菌和1个牛分枝杆菌BCG),检测到4个复制中的2个(图4)。在2个浓度测试来自MTB亚种的46个MTB株的第二集合:100基因组/反应和25基因组/反应。在每个浓度测试每种DNA的4个复制。所有测试的复制在两个浓度是阳性的(图2)。检测限度(LOD)从在玻璃珠匀浆化的痰集合中稀释的MTBH37Rv株细胞制备9-水平稀释系列。将稀释系列中的组成员靶向至下述浓度:80cfu/mL、50cfu/mL、25cfu/mL、10cfu/mL、5cfu/mL、1cfu/mL、0.50cfu/mL、0.10cfu/mL和0.05cfu/mL。使用AbbottRealTimeMTB测定在4个运行中测试每个组成员的20个复制。使用一批MTB测定和对照试剂进行研究。该研究的显著性水平是0.05。为每个靶浓度计算检测率(表11)。使用在SAS中的PROCPROBIT,基于靶浓度和检测率拟合Probit回归模型,其中靶浓度(X)作为自变量,且检测率P(Y=1)作为应答变量。数据的Probit分析确定,以95%概率检测到的MTB的浓度是2.45cfu/mL(95%CI1.44-6.10cfu/mL)。使用MTBH37Rv菌株,在合并的匀浆化的痰中,AbbottRealTimeMTB测定的声称分析灵敏度是17cfu/mL。分析特异性在MTB阳性样品和MTB阴性样品中测试了80种潜在交叉反应物中的每一种。将来自每种潜在交叉反应的分枝杆菌、病毒或其它微生物的核酸在1x105至1x107拷贝或基因组/mL的靶浓度加入MTB阳性样品(含有1,000MTB个基因组/mL)和MTB阴性样品中。将培养的微生物在1x106cfu/mL的靶浓度加入MTB阳性样品和MTB阴性样品中。将所有80个阴性样品的测定结果报告为“未检测到MTB”。将所有80个含有MTB的样品的测定结果报告为“检测到MTB”(表7)。潜在干扰物质用可能存在于呼吸系统中的物质评估测试结果中的干扰潜力。用高水平的牛粘液、血液、来自人细胞的DNA、胃酸、高渗盐水、生理盐水、培养基、NALC沉淀物和5种抗-TB药物(异烟肼、利福平、链霉素、吡嗪酰胺、乙胺丁醇)(表12),在没有或有每种潜在干扰物质存在下测试MTB阴性的和MTB阳性的(500拷贝/mL)样品。结果表明在有高水平的血液、来自人细胞的DNA、胃酸、高渗盐水、生理盐水、培养基、NALC沉淀物和5种抗-TB药物(异烟肼、利福平、链霉素、吡嗪酰胺、乙胺丁醇)存在下,对MTB测定的性能没有干扰。在有8.3%(所有5个复制是假阴性的或受到抑制)和5.0%(5个复制之一是假阴性的)的牛粘液存在下,观察到AbbottRealTimeMTB测定的干扰。在2.5%或更低的牛粘液浓度没有发现干扰。遗留为了评价当使用AbbottRealTimeMTB测定时从高阳性的MTB样品向阴性样品的遗留潜力,运行5个m2000系统,每个由96个样品(阳性对照、阴性对照、46个在1x107拷贝/mL的高阳性样品和46个阴性样品)组成,其中高阳性样品散布在阴性样品中。1x107拷贝/mL的高阳性样品中的MTB浓度产生这样的Ct值:其比从用MTB测定测试的MTB阳性群体的样本得到的结果早95%或更多。所述测定在5个运行中从高阳性样品至230个阴性样品没有表现出任何遗留。96个样品运行在8小时以内结束。再现性执行再现性测试来评价m2000系统中的AbbottRealTimeMTB测定可重复性以及Abbottm2000sp仪器和手工样品制备方法之间的相容性。用1个阳性组(在3倍声明的LOD水平)和1个阴性组执行研究。由四个操作人员使用两批MTB扩增试剂进行研究:两个操作人员使用Abbottm2000sp仪器执行运行,且两个操作人员使用手工样品制备来执行运行。对于每个样品制备方法,两个操作人员各自使用一个独特批次的AbbottRealTimeMTB扩增试剂并以8的复制测试每个组成员,每天1次,持续5天,共计40个复制/组成员(共80个复制/组成员/方法;用m2000sp仪器样品制备测试了共160个,并用手工样品制备测试了共160个)。与预期结果的总一致是100%(159/159,因为仪器错误,一个样品是无效的),对于用Abbottm2000sp仪器或用手工样品制备来制备的样品,具有98.1%的较低95%CI。MTB测定与Abbottm2000sp仪器和Abbott手工样品制备方法相容。临床灵敏度和特异性对582个TB疑似患者中的每一个测试一个痰或一个NALC沉淀物。从俄罗斯、南非、乌干达、美国和越南收集样品。将每个样本拆分以允许在一个等分试样上测试MTB并在第二个等分试样上测试涂片和培养。对测试样品不知情,且最终的结果解码由AM统计组执行。对于MTB测试,两个样本产生了无效IC结果,且另外四个样本结果产生了m2000错误代码。具有通过抑制测量的无效结果的临床样本的频率为0.3%(2/582),而包括抑制和仪器误差的无效率为1.0%(6/582)。将通过本文描述的MTB测定和商购可得的MTBNAAT为阳性的5个培养阴性的样本从分析排除。包括共计571个有效样品用于数据分析。相对于培养的总MTB灵敏度为93%(198/212)。测定灵敏度在涂片阳性的、培养阳性的样本中为99%(147/149),且在涂片阴性的、培养阳性的样品中为81%(51/63)。特异性为97%(348/359)(表13)。76个MTB阴性样品含有非结核性的分枝杆菌(NTM)。在这些中,38个是MAC(鸟分枝杆菌(M.avium)复合物),7个是戈登分枝杆菌(M.gordonae),5个是堪萨斯分枝杆菌(M.kansasii),5个是龟分枝杆菌/脓肿分枝杆菌(M.chelonae/abcessus),3个是蟾分枝杆菌(M.xenopi),且18个含有其它分枝杆菌属物种。利用本文描述的MTB测定,除了2个样品以外,所有NTM样品结果是“未检测到MTB”,所述2个样品产生“检测到MTB”结果,其与40的测定截止相比具有晚CN(>38)值。从测试NTM群体产生的97%的特异性值类似于当测试非-NTM群体时观察到的特异性。此外500个从美国群体内收集的非-TB疑似患者痰样品表现出100%TB阴性的测试结果。表11检测限度AbbottRealTimeMTB数据的probit分析确定,在CN截止40以95%概率检测到的MTB的浓度为2.45cfu/mL(1.44-6.10cfu/mL的95%置信区间)。表12为了确定对干扰物质的敏感性而测试的潜在干扰物质和它们的浓度/百分比表13当测试临床样本时得到的灵敏度和特异性实施例11灭活试剂本实施例描述了用于MTB检测测定的灭活试剂。所述测定是用于检测呼吸样本(痰、支气管肺泡灌洗液(BAL)以及痰和支气管肺泡灌洗液(BAL)的N-乙酰基-L-半胱氨酸(NALC)沉淀物)中的MTB复合物DNA的NAAT。开发了样品灭活试剂和程序以液化粘性样品和降低MTB生存力以允许在生物安全柜外部安全地测试样品。所述研究用于评估样品灭活程序的有效性和确定灭活试剂(IR)的稳定性。对于粘度降低研究,将150个痰样品与IR(0.6%氢氧化钠[w/v]、60%异丙醇[v/v]和1.8%吐温-20[v/v])以1:2或1:3的比率混合。将混合物剧烈涡旋并在室温温育。在温育的20-30分钟以后再次将混合物涡旋。通过温育的30分钟、60分钟和24小时以后的目检,评估粘度的降低。对于灭活研究,使用2个MTB临床分离物和MTBATCC27294分离物如下制备模拟MTB阳性呼吸样品:将1mL在1x106、1x107或1x108cfu/mL浓度的MTB细胞混悬液与4mL合并的MTB阴性NALC处理过的呼吸样品混合。然后将每个模拟MTBNALC样品与IR以1:2或1:3的比率混合。将以1:2的样品与PBS比率用无菌PBS缓冲液处理过的模拟样品用作阳性对照。通过将无菌PBS加入合并的MTB阴性NALC样品(以1:2的PBS与NALC比率)来制备阴性对照。将所有样品/对照剧烈涡旋并在室温温育60分钟。将涡旋重复30分钟进入温育。在温育结束时,将IR处理过的样品转移进新50mL试管中,涡旋并在3000xg离心15分钟。将沉淀物再悬浮于10mL无菌PBS中,并在3000xg离心另外15分钟。将沉淀物各自再悬浮于10mL无菌PBS中。使用1mL混悬液接种分枝杆菌生长指示试管(MycobacterialGrowthIndicatorTube,MGIT)。加入每个MGIT培养物中的最终MTB范围为1-2x104至1-2x106cfu。另外,针对IR处理以后的生长,用相同程序以1:3的样品与IR比率测试了共计51个痰的MTB阳性临床NALC沉淀物,其中20个来自NorthwesternMemorialHospital,31个来自LancetLaboratories。以1:2的样品与IR比率处理20个来自NorthwesternMemorialHospital的样品中的10个。以1:3的样品与IR比率处理剩余的41个样品。用BACTECMGIT960系统(BectonDickinson,Sparks,MD)执行培养42天。用Gen-ProbeAccuprobe®系统(Gen-ProbeInc,SanDiego,CA)鉴别阳性生长。还与在下述段落中描述的IR稳定性研究组合地执行初始研究以证实直接呼吸样品(MTB涂片和培养阳性的痰样品)的灭活效率。为了确定IR的最佳贮存条件,将IR的3个等分试样在玻璃或聚丙烯瓶子中在15-30℃和33-37℃的贮存条件贮存39天。在使用1:3样品与IR比率与12个MTB涂片和培养阳性的痰样品(得自SAGEBioNetworks(Dhaka,孟加拉国)和FoundationforInnovativeNewDiagnostics(FIND)MTB样本库)一起贮存39天以后,将在每种贮存条件的IR的每个等分试样针对外观和体积的变化进行检查,并针对MTB灭活效力进行测试。得自ZeptometrixCorporation(Buffalo,NewYork)的MTBH37Rv株细胞组用作阳性对照。粘度降低研究表明,60分钟的温育足以降低样品的粘度。对于灭活研究,以1:3的样品与IR比率用IR处理以后,用在1x108、1x107和1x106cfu/mL的三种MTB分离物制备的模拟MTB样品都没有表现出MTB生长。1个IR-处理的样品(用1x107cfu/mLMTB制备并以1:2的样品与IR比率用IR处理)在温育的27天以后表现出生长,尽管在相同细菌浓度的2个重复被测试为生长阴性的。在以1:2或1:3的样品与IR比率用IR处理以后,20个MTB阳性的NALC痰沉淀物都没有表现出MTB生长。此外,在接受1:3的样品与IR比率的IR处理以后,31个临床NALC痰沉淀物(其在先前通过培养测试为MTB阳性的)被测试为MTB生长阴性的。39天以后没有观察到贮存以后外观的变化。贮存的39天以后观察到0-6%的体积损失。当在聚丙烯容器中在33-37℃贮存IR时观察到6%的最高体积损失。但是,IR溶液的灭活MTB的效率在贮存以后不受影响。在用在上述各种条件下贮存的IR处理以后,12个MTB阳性痰样品没有表现出生长。注意到临床样品中的一些MTB从推荐的CepheidGeneXpertMTB/RIF样品灭活过程(15分钟温育时段和1:2样品与样品试剂比率)存活下来(Banada,P.P.,等人,2010.J.Clin.Microbiol.48:3551-3557)。作者提示完全MTB灭活可能需要更长的温育时间。由本文描述的研究产生的实验数据证实,使用推荐的涡旋步骤执行60分钟的样品灭活对于完全MTB灭活而言是足够的。当使用1:2样品与IR比率时,1x107MTBcfu/mL培养物(在MGIT培养物中的2x105cfu/mL)的一个复制在MGIT培养物的27天温育以后表现出生长。以前的研究表明,含有10cfu/mLMTB的MGIT培养物在温育的16天以后变成阳性的,结果提示当使用1:2样品与IR比率时非常低数目的MTB从灭活过程存活下来(Tortoli,E.,P.等人,J.Clin.Microbiol.37(11):3578-3582;Wallis,等人,1999.AntimicrobialAgentsandChemotherapy,43:2600-2606)。为了实现最佳灭活效率,将1:3的样品与IR比率用于剩余的灭活实验。综上所述,当以1:3的样品与IR比率用IR处理60分钟时,在该研究中评价的IR能够液化痰样品和实现临床样本中MTB的有效灭活。该灭活程序使这些样品能够在适当灭活程序以后在生物安全柜的外面安全地程序。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种敲除c‑di‑AMP分解酶的重组耻垢分枝杆菌株及其应用的制造方法与工艺
- 检测结核分枝杆菌感染的抗原多肽池及其应用的制造方法与工艺
- 一种猕猴桃分枝定位器的制造方法与工艺
- 一种xanthone类化合物及其单晶的制备方法与作为抗海分枝杆菌药物的应用与制造工艺
- 一种糖肽类抗生素耐药基因检测试剂盒的制造方法与工艺
- 分枝杆菌快速分离培养方法与制造工艺
- 一种用于检测潜在结核的特异性标志物及其应用的制造方法与工艺
- 结核分枝杆菌抗原蛋白Rv2941及其T细胞表位肽的应用的制造方法与工艺
- 一种微流控芯片上基于荧光量子点磁性富集并分离结核分枝杆菌TB的方法及装置与制造工艺
- 二肽meso‑DAP‑D‑Ala和/或四肽L‑Ala‑D‑Glu‑L‑Lys‑D‑Ala的新用途的制造方法与工艺