一种用微生物酶法合成苄基异硫氰酸酯的方法与流程
本发明属于微生物领域,涉及一种用微生物酶法合成苄基异硫氰酸酯的方法。
背景技术:
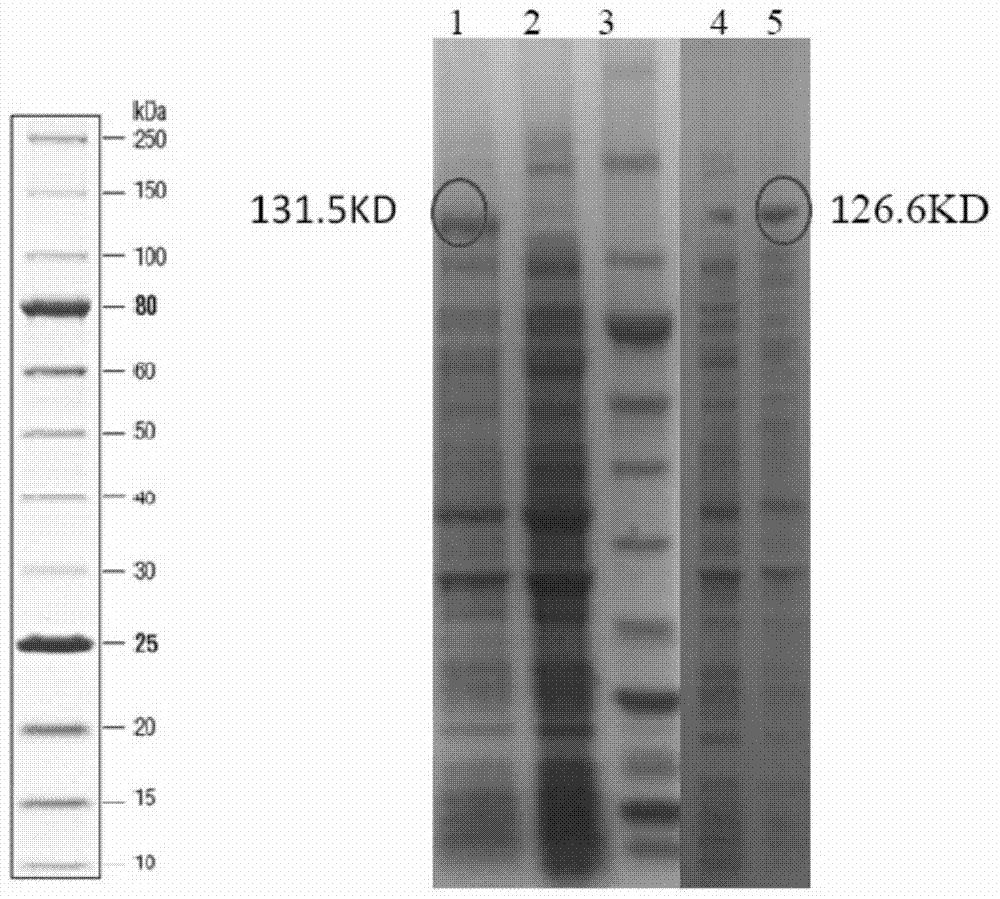
:硫苷是一种含硫的阴离子亲水性植物次生代谢产物,几乎存在于所有的十字花科植物中。硫苷晶体的x射线分析证明:所有的硫苷都具有相同的基本结构,其化学结构通常由一个β-d-硫葡萄糖基、一个硫化肟基团以及一个来源于蛋氨酸、色氨酸或苯丙氨酸等8种氨基酸的可变侧链构成。然而硫苷自身并不具有生物活性,当植物受到外界刺激时硫苷-硫苷酶二元系统会被激活,硫苷在硫苷酶的作用下水解并经过一系列的分子重排形成异硫氰酸酯。异硫氰酸酯的生物活性主要体现在抑菌、抗虫害,近年来研究证明萝卜硫素(sfn)、苄基异硫氰酸酯(bitc)、苯乙基异硫氰酸酯(peitc)等具有很好的抗癌防癌作用。异硫氰酸酯的前体物质-硫苷合成途径比较复杂,主要分为3部分:前体氨基酸侧链延伸;核心结构形成,次级侧链的修饰。其中核心结构形成是所有硫苷合成的共有步骤。由于苄基异硫氰酸酯的合成以苯丙氨酸为底物只经过核心结构形成这一模块,途径相对简单,可以为其他途径复杂的异硫氰酸酯在微生物中的合成奠定基础。植物体内苄基异硫氰酸酯合成途径具体如下:苯丙氨酸由细胞色素p450家族蛋白cyp79a2催化生成苄基醛肟;再由该家族另外一个蛋白cyp83b1催化生成腈类氧化物,该产物为强亲电子产物立刻和谷胱甘肽发生反应生成s-烷基磺肟酸共轭物;c-s裂解酶(sur1)进一步催化反应生成苄基硫肟酸、丙酮酸、nh3;葡糖转移酶(ugt74b1)将尿苷二磷酸葡萄糖苷(udpg)上的葡萄糖基团转移到硫肟酸上形成苄基脱硫硫苷;脱硫硫苷硫酸化酶(sot16)在3-氧-磷酸腺苷-5-磷硫酸(paps)参与下催化脱硫硫苷生成苄基硫苷。苄基硫苷在硫苷酶(myr)的作用下生成苄基异硫氰酸酯(bitc)。目前有实验推测在植物体内第二步反应产物腈类氧化物在谷胱甘肽硫转移酶(gstf)的作用和谷胱甘肽反应生成谷胱甘肽共轭物,在由γ-谷酰基蛋白酶(ggp1)作用下生成半胱氨酸-甘氨酸共轭物,该产物在被sur1催化反应进入后续步骤。植物次生代谢产物通常产量较低,分离纯化工艺复杂,产品纯度低,且纯化过程使用有机试剂会造成环境污染;植物生长周期长,成本高等弊端同样限制了异硫氰酸酯的规模化生产。微生物的生长周期短,成本低等,而且在微生物体内搭建单一植物次生代谢途径可以避免植物本身存在的其他次生代谢途径的竞争问题,实现单一产物的快速、大量表达。技术实现要素:本发明的目的是提供一种用微生物酶法合成苄基异硫氰酸酯的方法。本发明所提供的用微生物酶法合成苄基异硫氰酸酯的方法,为体外合成法,具体可包括如下步骤:将7种反应底物和6种蛋白配制成反应体系,反应后获得所述苄基异硫氰酸酯;所述7种反应底物分别为苯丙氨酸(phenylalanine)、半胱氨酸(cysteine)、腺嘌呤核苷三磷酸(atp)、还原型辅酶ⅱ(nadph)、尿苷二磷酸葡萄糖(udpg)、3′-磷酸腺苷-5′-磷酰硫酸(paps)和磷酸吡哆醛(plp);所述6种蛋白分别为ma2r2蛋白、mb1r2蛋白、metc蛋白、ugt74b1蛋白、sot18蛋白和bmyr蛋白;所述ma2r2蛋白的氨基酸序列如序列表中序列1所示;所述mb1r2蛋白的氨基酸序列如序列表中序列3所示;所述metc蛋白的氨基酸序列如序列表中序列5 所示;所述ugt74b1蛋白的氨基酸序列如序列表中序列7所示;所述sot18蛋白的氨基酸序列如序列表中序列9所示;所述bmyr蛋白的氨基酸序列如序列表中序列11所示。在所述方法中,所述ma2r2蛋白具体可按照包括如下步骤的方法制备获得:将序列表中序列2所示的ma2r2基因导入大肠杆菌进行原核表达,获得所述ma2r2蛋白。所述mb1r2蛋白具体可按照包括如下步骤的方法制备获得:将序列表中序列4所示的mb1r2基因导入大肠杆菌进行原核表达,获得所述mb1r2蛋白。所述metc蛋白具体可按照包括如下步骤的方法制备获得:将序列表中序列6所示的metc基因导入大肠杆菌进行原核表达,获得所述metc蛋白。所述ugt74b1蛋白具体可按照包括如下步骤的方法制备获得:将序列表中序列8所示的ugt74b1基因导入大肠杆菌进行原核表达,获得所述ugt74b1蛋白。所述sot18蛋白具体可按照包括如下步骤的方法制备获得的:将序列表中序列10所示的sot18基因导入大肠杆菌进行原核表达,获得所述sot18蛋白。所述bmyr蛋白具体可按照包括如下步骤的方法制备获得:将序列表中序列12所示的bmyr基因导入大肠杆菌进行原核表达,获得所述bmyr蛋白。在所述方法中,具体是按照图1所示的合成途径完成所述苄基异硫氰酸酯的体外合成的。所述反应的条件为:37℃反应0.5-1h(如1h),加入有机溶剂(如乙酸乙酯或乙醇)后再60℃反应1h。所述反应体系中的溶剂为0.1mph7.0pbs。本发明还保护一种用于体外制备苄基异硫氰酸酯的成套蛋白质或成套基因或产品。本发明所提供的用于体外制备苄基异硫氰酸酯的成套蛋白质,具体由6种蛋白组成;所述6种蛋白分别为ma2r2蛋白、mb1r2蛋白、metc蛋白、ugt74b1蛋白、sot18蛋白和bmyr蛋白;所述ma2r2蛋白的氨基酸序列如序列表中序列1所示;所述mb1r2蛋白的氨基酸序列如序列表中序列3所示;所述metc蛋白的氨基酸序列如序列表中序列5所示;所述ugt74b1蛋白的氨基酸序列如序列表中序列7所示;所述sot18蛋白的氨基酸序列如序列表中序列9所示;所述bmyr蛋白的氨基酸序列如序列表中序列11所示。本发明所提供的用于体外制备苄基异硫氰酸酯的成套基因,具体由6种基因组成;所述6种基因分别为ma2r2基因、mb1r2基因、metc基因、ugt74b1基因、sot18基因和bmyr基因;所述ma2r2基因的核苷酸序列如序列表中序列2所示;所述mb1r2基因的核苷酸序列如序列表中序列4所示;所述metc基因的核苷酸序列如序列表中序列6所示;所述ugt74b1基因的核苷酸序列如序列表中序列8所示;所述sot18基因的核苷酸序列如序列表中序列10所示;所述bmyr基因的氨基酸序列如序列表中序列12所示。本发明所提供的用于体外制备苄基异硫氰酸酯的产品,具体可为如下(a)或(b):(a)含有所述成套蛋白质以及7种反应底物;所述7种反应底物分别为苯丙氨酸(phenylalanine)、半胱氨酸(cysteine)、腺嘌呤核苷三磷酸(atp)、还原型辅酶ⅱ(nadph)、尿苷二磷酸葡萄糖(udpg)、3′-磷酸腺苷-5′-磷酰硫酸(paps)和磷酸吡哆醛(plp);(b)含有所述成套基因、大肠杆菌以及7种反应底物;所述7种反应底物分别为苯丙氨酸(phenylalanine)、半胱氨酸(cysteine)、腺嘌呤核苷三磷酸(atp)、还原型辅酶ⅱ(nadph)、尿苷二磷酸葡萄糖(udpg)、3′-磷酸腺苷-5′-磷酰硫酸(paps)和磷酸吡哆醛(plp)。所述成套蛋白或所述成套基因或所述产品在体外制备苄基异硫氰酸酯中的应用也属于本发明的保护范围。本发明也保护如下蛋白质组或蛋白质。本发明所提供的蛋白质组,具体由ma2r2蛋白和mb1r2蛋白组成;所述ma2r2蛋白的氨基酸序列如序列表中序列1所示;所述mb1r2蛋白的氨基酸序列如序列表中序列3所示。本发明所提供的蛋白质,具体为ma2r2蛋白或mb1r2蛋白;所述ma2r2蛋白的氨基酸序列如序列表中序列1所示;所述mb1r2蛋白的氨基酸序列如序列表中序列3所示。如下任一方法也属于本发明的保护范围:(a1)所述成套蛋白的制备方法,包括如下步骤:将序列表中序列2所示的ma2r2基因导入大肠杆菌进行原核表达,获得所述ma2r2蛋白;将序列表中序列4所示的mb1r2基因导入大肠杆菌进行原核表达,获得所述mb1r2蛋白;将序列表中序列6所示的metc基因导入大肠杆菌进行原核表达,获得所述metc蛋白;将序列表中序列8所示的ugt74b1基因导入大肠杆菌进行原核表达,获得所述ugt74b1蛋白;将序列表中序列10所示的sot18基因导入大肠杆菌进行原核表达,获得所述sot18蛋白;将序列表中序列12所示的bmyr基因导入大肠杆菌进行原核表达,获得所述bmyr蛋白;(a2)所述蛋白质组的制备方法,包括如下步骤:将序列表中序列2所示的ma2r2基因导入大肠杆菌进行原核表达,获得所述ma2r2蛋白;将序列表中序列4所示的mb1r2基因导入大肠杆菌进行原核表达,获得所述mb1r2蛋白;(a3)所述蛋白质的制备方法,包括如下步骤:将序列表中序列2所示的ma2r2基因导入大肠杆菌进行原核表达,获得所述ma2r2蛋白;或将序列表中序列4所示的mb1r2基因导入大肠杆菌进行原核表达,获得所述mb1r2蛋白。在本发明中,将各基因导入大肠杆菌进行原核表达时采用的原核表达载体均具体为pet-28a(+)载体。本发明所提供的用微生物酶法合成苄基异硫氰酸酯的方法,是在现有的植物体内苄基异硫氰酸酯合成途径的基础上,进行改造后获得的。实验证明,该方法可以体外合成出苄基异硫氰酸酯。本发明为其他途径复杂的异硫氰酸酯在微生物中的合成奠定基础。附图说明图1为植物体内苄基异硫氰酸酯合成途径以及本发明微生物酶法体外合成苄基异硫氰酸酯的合成途径示意图。其中,a为植物体内苄基异硫氰酸酯合成途径示意图;b为本发明微生物酶法体外合成苄基异硫氰酸酯的合成途径示意图。图2为ma2r2蛋白和mb1r2蛋白经iptg诱导前后的sds-page结果。其中,1为ma2r2蛋白诱导后;2为ma2r2蛋白诱导前;3为蛋白marker;4为mb1r2蛋白诱导前;5为mb1r2蛋白诱导后。图3为metc蛋白的纯化后sds-page结果。图4为ugt74b1蛋白的纯化后sds-page结果。图5为sot18蛋白的纯化后sds-page结果。图6为bmyr蛋白的纯化后sds-page结果。图7为苄基异硫氰酸酯的gc-ms结果。其中,bitc-std为苄基异硫氰酸酯标准品。图8为ma2r2蛋白中不同长度连接肽的sds-page结果。其中,连接肽(g4s)n,n=0,1,2,3。泳道1,2为n=0时诱导后,诱导前样品;泳道3,4为n=1时诱导后,诱导前样品;泳道5,6为n=2时诱导后,诱导前样品;泳道7,8为n=3时诱导后,诱导前样品。图9为mb1r2蛋白中连接肽后连接不同的还原酶的sds-page结果。其中,泳道1为b1r1未诱导;泳道2为b1r1诱导;泳道3为b1r2未诱导;泳道4为b1r2诱导;b1r1表示连接肽后连接的去掉跨膜区的还原酶为atr1;b1r2表示连接肽后连接的去掉跨膜区的还原酶为atr2。具体实施方式下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、用微生物酶法体外合成苄基异硫氰酸酯的合成途径的设计一、植物体内苄基异硫氰酸酯合成途径植物体内苄基异硫氰酸酯合成途径示意图参见图1中a所示。大致过程如下:苯丙氨酸由细胞色素p450家族蛋白cyp79a2催化生成苄基醛肟;再由该家族另外一个蛋白cyp83b1催化生成腈类氧化物,该产物为强亲电子产物立刻和谷胱甘肽或者半胱氨酸发生反应生成s-烷基磺肟酸共轭物;c-s裂解酶(sur1)进一步催化反应生成苄基硫肟酸、丙酮酸、nh3;葡糖转移酶(ugt74b1)将尿苷二磷酸葡萄糖苷(udpg)上的葡糖基团转移到硫肟酸上形成苄基脱硫硫苷;脱硫硫苷硫酸化酶(sot16)在3-氧-磷酸腺苷-5-磷硫酸(paps)参与下催化脱硫硫苷生成苄基硫苷。苄基硫苷在硫苷酶(myr)的作用下生成苄基异硫氰酸酯(bitc)。目前有实验推测在植物体内第二步反应产物腈类氧化物在谷胱甘肽硫转移酶(gstf)的作用和谷胱甘肽反应生成谷胱甘肽共轭物,在由γ-谷酰基蛋白酶(ggp1)作用下生成半胱氨酸-甘氨酸共轭物,该产物在被sur1催化反应进入后续步骤。二、设计本发明微生物酶法体外合成苄基异硫氰酸酯的合成途径由于植物体内苄基异硫氰酸酯代谢途径比较复杂,同时涉及两个推测的功能基因。因此发明人根据文献报道中关于cyp83b1酶活测定过程中使用半胱氨酸作为底物而非植物体内途径中的底物谷胱甘肽,人工设计苄基异硫氰酸酯代谢途径,从而避免表达上述推测的功能基因,简化该代谢途径。图1中b中的方框内部分即为人工设计的途径,图中ma2r2、mb1r2、metc、ugt74b1、sot18和bmyr蛋白都是经过改造/筛选的,经改造筛选蛋白的获得过程参见实施例2。实施例2、本发明微生物酶法体外合成苄基异硫氰酸酯的合成途径中六种蛋白的改造及表达纯化一、cyp79a2蛋白在大肠杆菌中的改造及表达载体的构建1、cyp79a2蛋白在大肠杆菌中的改造首先,根据大肠杆菌密码子偏好性对cyp79a2基因进行了密码子优化以及基因合成。cyp79a2属于细胞色素p450家族蛋白,在大肠杆菌中表达存在一定的问题,主要体现在一下两个方面:1)膜信号元件不相容性;2)缺少相应的电子转运系统。使用在线分析软件tmhmmserverv.2.0(http://www.cbs.dtu.dk/services/tmhmm/)对cyp79a2蛋白的氨基酸序列进行分析发现其无跨膜序列。cyp79a2蛋白第40-518个氨基酸为功能结构域(http://pfam.xfam.org/protein/q9flc8)。根据相关文献报道,发明人选择了cyp79a1蛋白中的25-74个氨基酸代替cyp79a2中的前39个氨基酸,并且在n端起始位置加上来自哺乳动物的cyp17α蛋白中n端前8个氨基酸即肽段ε。经过改造后可以解决在大肠杆菌中表达中出现的膜信号不相容的问题。对于问题2)主要解决方案在于表达其对应的还原酶。在拟南芥中存在atr1,atr2两 种nadph依赖的细胞色素p450还原酶,文献中数据分析得出这两种酶活力基本一致,其区别在于植物体内的atr2需要在外界刺激下表达。使用在线分析软件tmhmmserverv.2.0(http://www.cbs.dtu.dk/services/tmhmm/)分析atr2氨基酸序列,发现其第73氨基酸以后的序列是膜外序列。因此选择这段序列,并且通过常用连接肽(g4s)3与修饰后的cyp79a2融合表达。即最终得到17α(1-8)79a1(25-74)79a2△(1-39)-atr2△(1-72)(其中“-”代表连接肽(g4s)3),将该组合后的蛋白命名为ma2r2。最终获得的ma2r2蛋白的氨基酸序列如序列表中序列1所示,其编码基因的核苷酸序列如序列表中序列2所示。其中,序列1的第541-555位为连接肽(g4s)3的氨基酸序列。2、ma2r2蛋白在大肠杆菌中的表达载体的构建将序列表中序列2所示的ma2r2基因插入到pet-28a(+)载体的酶切位点sali和xhoi之间,所得重组质粒经测序验证正确后命名为pet-28a-ma2r2。所得重组表达载体pet-28a-ma2r2用于在大肠杆菌中表达ma2r2蛋白。二、cyp83b1蛋白在大肠杆菌中的改造及表达载体的构建1、cyp83b1蛋白在大肠杆菌中的改造cyp83b1同样属于细胞色素p450系列蛋白,在大肠杆菌中表达同样面临步骤一1)中所述两个问题。发明人根据大肠杆菌密码子偏好性对cyp83b1基因进行了密码子优化以及基因合成。cyp83b1蛋白第30-494个氨基酸为其功能结构域(http://pfam.xfam.org/protein/o65782)。细胞色素p450系列蛋白在n端一般分为4个部分:1)短的极性端,通常是1-2个带负电的氨基酸;2)12-32个疏水性氨基酸;3)少量带正电的氨基酸序列;4)脯氨酸富集区。其中脯氨酸富集区高度保守,对于蛋白正确构型具有重要作用,不可以进行删减;文献证明n端的疏水序列至少需要保留12个氨基酸。因此,发明人对cyp83b1蛋白的n端氨基酸序列分析后,去掉前6个氨基酸并将7-15个氨基酸替换为cyp17α蛋白中的肽段ε。对于问题2),发明人同样使用atr2蛋白,连接肽选择(g4s)2,最终得到17α(1-8)83b1△(1-15)-atr2△(1-72)(其中“-”代表连接肽(g4s)2),该组合命名为mb1r2。最终获得的mb1r2蛋白的氨基酸序列如序列表中序列3所示,其编码基因的核苷酸序列如序列表中序列4所示。其中,序列3的第502-511位为连接肽(g4s)2的氨基酸序列;第512-1150位为atr2△(1-72)的氨基酸序列。2、mb1r2蛋白在大肠杆菌中的表达载体的构建将序列表中序列4所示的mb1r2基因插入到pet-28a(+)载体的酶切位点sali和xhoi之间,所得重组质粒经测序验证正确后命名为pet-28a-mb1r2。所得重组表达载体pet-28a-mb1r2用于在大肠杆菌中表达mb1r2蛋白。三、c-s裂解酶的选择及表达载体的构建1、c-s裂解酶的选择由于除了苄基异硫氰酸酯合成途径中cyp79a2底物特异性强之外,其他的蛋白均表现为支链官能团特异性,因此尝试选择其他途径来源的c-s裂解酶来代替催化该步反应。发明人选择了大肠杆菌甲硫氨酸合成途径中可以催化类似反应的metc。metc蛋白的氨基酸序列如序列表中序列5所示,其编码基因的核苷酸序列如序列表中序列6所示。2、metc蛋白在大肠杆菌中的表达载体的构建将序列表中序列6所示的metc基因插入到pet-28a(+)载体的酶切位点bamhi和xhoi之间,所得重组质粒经测序验证正确后命名为pet-28a-metc。所得重组表达载体pet-28a-metc用于在大肠杆菌中表达metc蛋白。四、葡糖转移酶在大肠杆菌中的改造及表达载体的构建1、葡糖转移酶在大肠杆菌中的改造选择西兰花来源的ugt74b1,并根据大肠杆菌密码子偏好性进行密码子优化及基因合成。ugt74b1蛋白的氨基酸序列如序列表中序列7所示,所得其编码基因的核苷酸序列如序列表中序列8所示。2、ugt74b1蛋白在大肠杆菌中的表达载体的构建将序列表中序列8所示的ugt74b1基因插入到pet-28a(+)载体的酶切位点ecori和hindiii之间,所得重组质粒经测序验证正确后命名为pet-28a-ugt74b1。所得重组表达载体pet-28a-ugt74b1用于在大肠杆菌中表达ugt74b1蛋白。五、脱硫硫苷硫酸化酶的选择及表达载体的构建1、脱硫硫苷硫酸化酶的选择拟南芥中的sot18可以催化苯丙氨酸来源的硫苷合成。本发明的发明人根据拟南芥不同种属中sot18酶活活性报道,最终选择了来自哥伦比亚生态型的sot18。sot18蛋白的氨基酸序列如序列表中序列9所示,其编码基因的核苷酸序列如序列表中序列10所示。2、sot18蛋白在大肠杆菌中的表达载体的构建将序列表中序列10所示的sot18基因插入到pet-28a(+)载体的酶切位点ecori和hindiii之间,所得重组质粒经测序验证正确后命名为pet-28a-sot18。所得重组表达载体pet-28a-sot18用于在大肠杆菌中表达sot18蛋白。六、硫苷酶(黑芥子酶)在大肠杆菌中的改造及表达载体的构建1、硫苷酶(黑芥子酶)在大肠杆菌中的改造根据文献报道,以产硫苷植物为食的动物中存在硫苷酶,发明人选择了来自甘蓝蚜虫中的硫苷酶基因,并根据大肠杆菌密码子偏好性进行了密码子优化,并合成基因。为与西兰花来源的硫苷酶区别,将该蛋白命名为bmyr。最终所得的bmyr蛋白的氨基酸序列如序列表中序列11所示,其编码基因的核苷酸序列如序列表中序列12所示。2、硫苷酶(黑芥子酶)在大肠杆菌中的表达载体的构建将序列表中序列12所示的bmyr基因插入到pet-28a(+)载体的酶切位点ncoi和hindiii之间,所得重组质粒经测序验证正确后命名为pet-28a-bmyr。所得重组表达载体pet-28a-bmyr用于在大肠杆菌中表达bmyr蛋白。七、六种蛋白在大肠杆菌中的原核表达及纯化将步骤一至六所得的6种重组表达载体分别导入大肠杆菌bl21(de3)(天根生化科技有限公司,cb105-02)中,挑阳性克隆单菌落于含40μ/ml卡那霉素10mllb培养基中,37℃培养12h后,1%(体积百分含量)接种量接种于含40μ/ml卡那霉素200mllb培养基中,37℃培养至od600为0.6-0.8,添加诱导剂iptg至终浓度为0.1mm,除mb1r2蛋白在37℃诱导5h外,其他蛋白均在16℃诱导12h后收集菌体,并用0.1mph7.0pbs将菌体洗1遍去 除菌体表面培养基,保存于-20℃。ma2r2,mb1r2均为膜蛋白,分离纯化过程较为复杂,因此本发明对这两个蛋白采用粗酶液进行后续实验。具体步骤:1)将冻存的菌体用10ml0.1mph7.0pbs重悬起来,并加入200μl20mg/ml溶菌酶,冰上放置30min;2)超声破碎,10%功率,10min,工作3s,间歇5s,破碎后12000rpm离心10min后取上清溶液0.22μm过膜得到粗酶液,使用100kd超滤管,6000g离心10min,超滤管内的即为浓缩后的粗酶液。ma2r2蛋白和mb1r2蛋白经iptg诱导前后的菌体经上述提取所得粗酶液分别进行sds-page,结果如图2所示。由图可知,与诱导前相比,诱导后的ma2r2蛋白粗酶液样品出现大小约为131.5kd的目的条带,与预期大小一致;与诱导前相比,诱导后的mb1r2蛋白粗酶液样品出现大小约为126.6kd的目的条带,与预期大小一致。可见,步骤一和二改造后的ma2r2和mb1r2成功实现了在大肠杆菌中的可溶性表达。其他4个蛋白均按照常规ni-agarosehis标签蛋白纯化试剂盒(可溶性蛋白)(北京康为世纪生物科技有限公司,cw0894a)将重组蛋白进行纯化。冷冻离心收集菌体12小时以上,用结合液(氯化钠:500mm,咪唑:10mm,tris-hcl:20mm)将菌体重悬,用溶菌酶在冰上处理半小时,超声破碎,10%功率,10min,工作3s,间歇5s,破碎后12000rpm离心10min后取上清溶液0.22μm过膜得到粗酶液。然后将所得粗酶液进行纯化,步骤如下:1)将填料(his镍柱)混匀后加入到层析柱(镍柱)中,用5倍床柱体积的去离子水冲洗装填好的柱子;2)用2.5个床体积的结合缓冲液(配方:氯化钠500mm,咪唑10mm,tris-hcl20mm)平衡柱子;3)将离心得到的上清(即粗酶液)加入到层析柱里,在冰上结合1.5h;4)用分别含不同浓度咪唑的洗脱缓冲液(配方:氯化钠500mm,咪唑80mm或300mm,tris-hcl20mm)进行阶段洗脱(先用咪唑浓度为80mm的洗脱缓冲液洗脱5min,接着用咪唑浓度为300mm的洗脱缓冲液洗脱3min),收集各阶段洗脱峰,用sds-page检测融合蛋白的分子量大小和纯度;5)用结合缓冲液和纯水分别流洗5个柱床体积,再用20%(体积百分含量)的乙醇流洗3个柱床体积,柱子置于4-8℃环境中保存。重组蛋白的大小和纯度检测使用sds-page电泳。将得到的蛋白大小与文献中报道的大小比较,检测纯化蛋白的准确性。sds-page结果如图3-图6所示。图中所示目标蛋白的大小与文献报道一致。可见,经上述步骤三至六筛选的metc蛋白、ugt74b1蛋白、sot18蛋白和bmyr蛋白在大肠杆菌中均成功实现了可溶性表达。实施例3、体外合成苄基异硫氰酸酯一、体外合成苄基异硫氰酸酯的反应按照表1加入7种反应底物,按照表2加入6种蛋白(反应体系中的溶剂为0.1mph7.0pbs)。37℃反应1h,加入等体积的乙酸乙酯60℃反应1h,苄基异硫氰酸酯溶解到乙酸乙酯中,离心后用移液器吸取乙酸乙酯层作为待检测样品。表17种反应底物及在反应体系中的浓度注:atp——腺嘌呤核苷三磷酸、nadph——还原型辅酶ⅱ、udpg——尿苷二磷酸葡萄糖、paps——3′-磷酸腺苷-5′-磷酰硫酸、plp——磷酸吡哆醛。表26种蛋白及在反应体系中的浓度蛋白浓度(g/l)ma2r21mb1r21metc0.1ugt74b10.1sot180.1bmyr0.1注:表中各蛋白的浓度指的是经实施例2纯化后的各蛋白在反应体系中的浓度,其中ma2r2和mb1r2为粗酶液浓度。二、gc-ms鉴定苄基异硫氰酸酯使用gc-ms对步骤一获得的乙酸乙酯层样品进行检测,条件如下:色谱柱hp-5,气化室温度300℃,柱升温程序50℃保持2min,以10℃/min的速率升至190℃,再以20℃/min的速率升至300℃保持5min,接口温度280℃,ei源70ev,200℃,检测器电压350v。将苄基异硫氰酸酯标准品(acrossorganics公司产品,其产品目录号为402130050)以及步骤一获得的乙酸乙酯层样品分别按照如上条件进行gc-ms检测。gc-ms结果如图7所示,在步骤一获得的乙酸乙酯层样品中检测到了产物,根据质谱数据库比对确定该产物为本实验的最终目的产物-苄基异硫氰酸酯。对比例1、ma2r2蛋白相关对照本发明的发明人在完成本发明的过程中,对ma2r2蛋白中的连接肽的长度进行了大量的摸索,摸索了当连接肽为(g4s)n,n=0,1,2,3时,蛋白在大肠杆菌中的表达情况。具体操作参照实施例2步骤一及步骤七进行。其中,当“(g4s)n,n=0”时,目标蛋白的序列为序列表中序列1删除第541-555位后得到的氨基酸序列;当“(g4s)n,n=1”时,目标蛋白的序列为将序列表中序列1的第541-555位替换为“ggggs(此处以大写单字母表示氨基酸)”后得到的氨基酸序列;当“(g4s)n,n=2”时,目标蛋白的序列为将序列表中序列1的第541-555位替换为“ggggsggggs(此处以大写单字母表示氨基酸)”后得到的氨基酸序列;当“(g4s)n,n=3”时,目标蛋白的序列即为将序列表中序列1所示的氨基酸序列。对应于每个(g4s)的编码基因均为ggtggtggtggtagt。结果显示:只在当“(g4s)n,n=3”时,才能实现蛋白融合表达。具体见图8。对比例2、mb1r2蛋白相关对照本发明的发明人在完成本发明的过程中,对mb1r2蛋白中连接肽(g4s)2后去掉跨膜序列的还原酶进行了摸索,摸索了为去掉跨膜序列的还原酶atr1和atr2时,融合蛋白在大肠杆菌中的表达情况。具体操作参照实施例2步骤二及步骤七进行。其中,当连接肽(g4s)2后为去掉跨膜序列的还原酶atr2时,要表达的目标融合蛋白的序列即为序列表中序列3所示的mb1r2蛋白;当连接肽(g4s)2后为去掉跨膜序列的还原酶atr1时,要表达的目标融合蛋白的序列为将序列表中序列3的第512-1150位替换为 genbank:aee84919.1的第47-692位后所得的氨基酸序列。相应的,对应于genbank:aee84919.1的第47-692位的编码基因为genbank:nm_118585.3的第139-2079位。结果显示:在连接肽为(g4s)2时与去掉跨膜序列的还原酶atr2融合表达成功,而与去掉跨膜序列的还原酶atr1未能实现融合表达。具体见图9。对比例3、metc蛋白相关对照1、在植物体内只存在单一c-s裂解酶sur1,并不存在其他同工酶。因此,实验过程中,发明人首先选择了来自西兰花的sur1,通过大肠杆菌密码子偏好性进行密码子优化后基因合成(序列13)。将该基因连接至pet-28a(+)载体的酶切位点bamhi和xhoi之间,得到重组表达载体,然后将其转入大肠杆菌中进行原核表达(参见实施例2步骤七)。结果发现,该蛋白为包涵体,改变诱导条件也均未得到可溶性蛋白。2、以拟南芥cdna为模板pcr扩增拟南芥来源的sur1(genbank:nm_201760.2),同样连接至pet-28a(+)载体的酶切位点ncoi和hindiii之间,得到重组表达载体,然后将其转入大肠杆菌中进行原核表达(参见实施例2步骤七)。结果显示,同样未得到可溶性蛋白。3、将真菌中麦角硫因合成途径中可以催化类似反应的egt2基因,通过大肠杆菌密码子偏好性进行密码子优化后基因合成(序列16)连接至pet-28a(+)载体的酶切位点ecori和hindiii之间,得到重组表达载体,然后将其转入大肠杆菌中进行原核表达(参见实施例2步骤七)。结果显示:egt2在大肠杆菌中可得到可溶性蛋白。但经酶活测定后发现egt2的酶活低于本发明实施例2中选择的metc的酶活,因此,本发明选择大肠杆菌自身同源表达的蛋白metc。对比例4、sot18蛋白相关对照拟南芥中的sot16、sot18都可以催化苯丙氨酸来源的硫苷合成。实验过程中,发明人首先对拟南芥sot16进行大肠杆菌密码子偏好性密码子优化及基因合成(序列14),连接至pet-28a(+)载体的酶切位点bamhi和hindiii之间,得到重组表达载体,然后将其转入大肠杆菌中进行原核表达(参见实施例2步骤七)。结果显示,没有获得可溶性蛋白。对比例5、bmyr蛋白相关对照在植物体内存在多种硫苷酶的同工酶,但所有的硫苷酶都是需要高度糖基化修饰。大肠杆菌的细胞结构比较简单,不能对蛋白质进行次级修饰,因此在大肠杆菌中有活性表达植物来源的硫苷酶是不可能的。本发明的发明人对西兰花来源的硫苷酶基因myr进行大肠杆菌密码子偏爱性密码子优化及基因合成(序列15),连接至pet-28a(+)载体的酶切位点ncoi和xhoi之间,得到重组表达载体,然后将其转入大肠杆菌中进行原核表达(参见实施例2步骤七)。并采用硫苷酶的通用测定方法测定酶活,具体操作如下:采用20mm的磷酸盐缓冲液(ph4.0),体系添加5mm的2-丙烯基芥子油苷作为底物,同时添加10nm的纯化后的myr蛋白,在37℃反应20min,然后95℃加热7min终止反应,依据水解2-丙烯基芥子油苷后释放的葡萄糖来测定酶活。结果显示:采用硫苷酶的通用测定方法没有检测到硫苷酶酶活。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1