一种抑制K-RAS基因表达的siRNA及其前体和应用的制作方法
本发明属于生物医药领域,具体涉及一种抑制k-ras基因表达的sirna及其前体和应用。
背景技术:
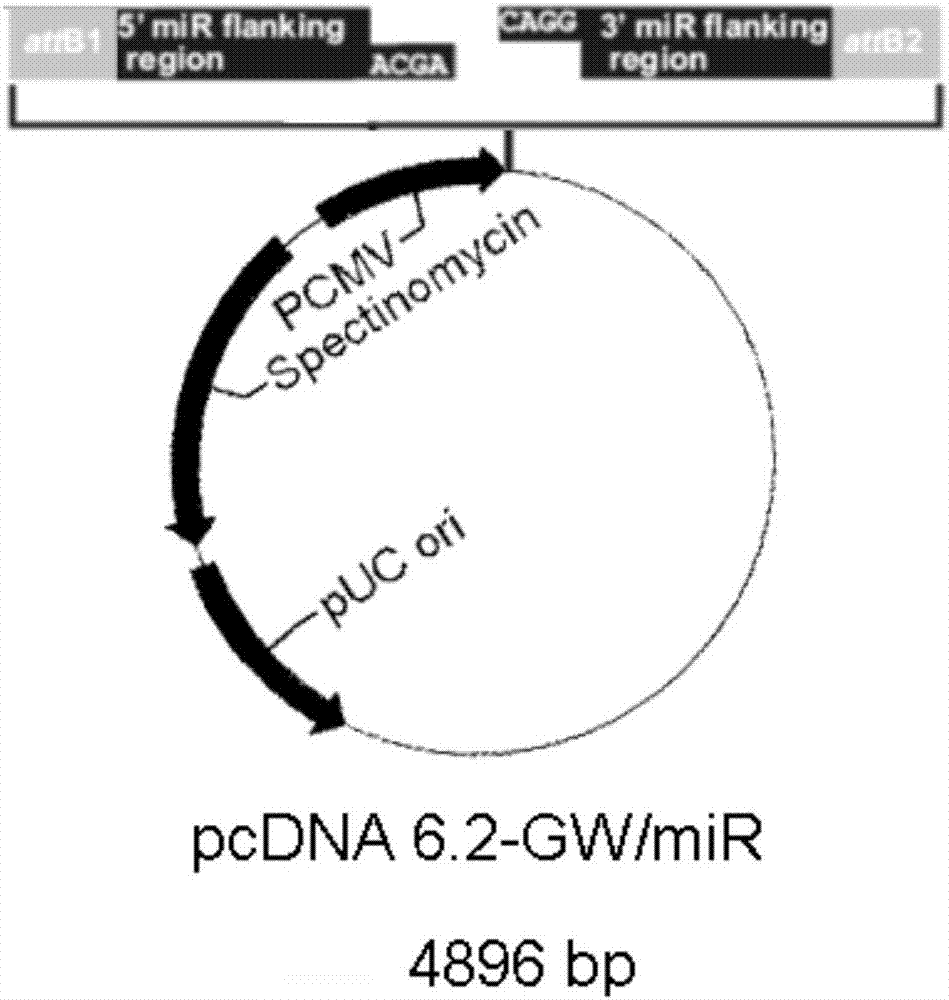
:rna干涉(rnai)在实验室中是一种强大的实验工具,利用具有同源性的双链rna(dsrna)诱导序列特异的目标基因的沉寂,迅速阻断基因活性。sirna在rna沉默通路中起中心作用,是对特定信使rna(mrna)进行降解的指导要素。sirna是rnai途径中的中间产物,是rnai发挥效应所必需的因子。sirna的形成主要由dicer和rde-1调控完成。由于rna病毒入侵、转座子转录、基因组中反向重复序列转录等原因,细胞中出现了dsrna,rde-1(rnai缺陷基因-1)编码的蛋白质识别外源dsrna,当dsrna达到一定量的时候,rde-1引导dsrna与rde-1编码的dicer(dicer是一种rnaseiii活性核酸内切酶,具有四个结构域:argonaute家族的paz结构域,iii型rna酶活性区域,dsrna结合区域以及deah/dexhrna解旋酶活性区)结合,形成酶-dsrna复合体。dicer切割后形成sirna,然后,在atp的参与下,细胞中存在的一种rna诱导的沉默复合体rna-inducedsilencingcomplexrnai干涉的关键步骤是组装risc和合成介导特异性反应的sirna蛋白。sirna并入risc中,然后与靶标基因编码区或utr区完全配对,降解靶标基因,因此说sirna只降解与其序列互补配对的mrna。其调控的机制是通过互补配对而沉默相应靶位基因的表达,所以是一种典型的负调控机制。sirna识别靶序列是有高度特异性的,因为降解首先在相对于sirna来说的中央位置发生,所以这些中央的碱基位点就显得极为重要,一旦发生错配就会严重抑制rnai的效应。sirna作为一种新兴的治疗技术,也已经以一种前所未有的速度迈进了临床试验阶段,k-ras是ras基因家族成员之一,编码k-ras蛋白。与肿瘤的生成,增殖,迁移,扩散以及血管生成均有关系。k-ras蛋白具有gtpase活性,结合gtp时为活化态,结合gdp时为失活态。主要定位于细胞膜上,pkc使k-ras磷酸化后,这种磷酸化过程导致k-ras与细胞膜的结合减弱而改变位置,并移至内质网、高尔基体和粒线体等位置。k-ras具有分子开关作用,在很多信号通路中具有重要作用。研究表明约30%的人类恶性肿瘤与ras基因突变有关,ras突变后的产物可以一直处于活化状态。在白血病,肺癌,直肠癌和胰腺癌中,k-ras突变均很常见,其中直肠癌中30%-35%患者有突变。其与肿瘤细胞的生存,增殖,迁移,扩散,血管生成均有关系。k-ras基因分为突变型和野生型,常见突变位点为k-ras基因2号外显子的12号密码子和13号密码子上,3号外显子的61号密码子,其中有7个突变热点:g12c、g12r、g12s、g12v、g12d、g12a、g13v/d.这7种突变占到了90%以上。目前市面上的egfr的靶向药物主要有:吉非替尼gefitinib(易瑞沙,iressa),厄罗替尼erlotinib(特罗凯,tarceva),西妥昔单抗cetuximab(爱必妥,erbitux)、帕尼单抗panitumumab(vectibix)。但是egfr靶向药物对于k-ras突变型患者疗效很差,因为没有egfr的信号,k-ras也处于活化状态向下游传递信号,故在个性要用药中要先检测k-ras基因状态再选择用药。若k-ras为突变型则不建议使用egfr靶向药物。因此,考虑到如果可以同时靶向egfr和k-ras通路,则可以进而同时抑制通路的上下游,从而使egfr靶向药物对k-ras突变患者产生更好的治疗效果,因此,目前急缺一种可以靶向抑制k-ras基因的治疗方法及对应的药物,以解决目前尚无药物特异性针对k-ras突变、以及k-ras突变导致egfr靶向药物无效等问题。技术实现要素:本发明提供了一种新的抑制k-ras基因的sirna、其前体,及其在治疗肿瘤中的应用。本发明第一方面,提供了一种前体序列,其特征在于,其5’至3’端具有式i所示的结构:b1为所需要的第一核糖核酸序列,其中所述的第一核糖核酸序列包括k-rassirna正义链序列;b2为与b1基本互补或完全互补的序列,且b2与c不互补;c为茎环结构序列,较佳地为:guuuuggccacugacugac;a1和a2分别为无,或任选的由4-5个碱基组成的rna序列;其中,所述k-rassirna正义链的核苷酸序列选自序列表中:seqidno:3、seqidno:26、seqidno:41、seqidno:47、seqidno:52、seqidno:73、seqidno:88、seqidno:98、seqidno:101和seqidno:106或seqidno:263所示序列;在另一优选例中,所述b2与b1有2-8个碱基不互补,较佳地,所述b2与b1有3-5个碱基不互补。在另一优选例中,所述的b2较b1添加或缺失1-2个碱基。在另一优选例中,所述的b2较b1缺失1-2个碱基,更佳地,缺失2个碱基。在另一优选例中,所述的被缺失的1-2个碱基位于b1的中部,即9-14位中的1-2个碱基,如第9-10位,第10-11位,第11-12位,第12-13位或第13-14位。在另一优选例中,所述的a1为ugcug;和/或所述的a2为cagg或cagga。在另一优选例中,a2优选为cagg。本发明第二方面,提供了一种多核苷酸,所述的多核苷酸能被宿主转录形成本发明第一方面中所述的前体序列。本发明第三方面提供一种表达载体,所述的表达载体含有本发明第一方面所述的前体序列或本发明第二方面所述的多核苷酸。在另一优选例中,所述的表达载体包括病毒载体、非病毒载体。在另一优选例中,所述的表达载体为质粒。在另一优选例中,所述的本发明第二方面所述的多核苷酸的上游为启动子,并且其下游为tkpa元件。本发明第四方面,提供了一种药物制剂,所述的制剂含有:(a)用于表达k-rassirna序列的表达载体;以及(b)药学上可接受的载体。在另一优选例中,所述的k-rassirna序列选自下组:seqidno:3、seqidno:26、seqidno:41、seqidno:47、seqidno:52、seqidno:73、seqidno:88、seqidno:98、seqidno:101和seqidno:106或seqidno:263所示序列。在另一优选例中,所述的表达载体所表达的式i所示的前体,b1为所需要的第一核糖核酸序列,其中所述的第一核糖核酸序列包括k-rassirna正义链序列;b2为与b1基本互补或完全互补的序列,且b2与c不互补;c为茎环结构序列;a1和a2分别为无,或任选的由4-5个碱基组成的rna序列;在另一优选例中,第一核糖核酸序列为k-rassirna正义链,而第二核糖核酸序列为k-rassirna反义链。在另一优选例中,所述的制剂为液体剂型。在另一优选例中,所述的制剂为注射剂。在另一优选例中,所述的表达载体包括质粒。在另一优选例中,所述的表达载体或质粒含有启动子、复制起点和标记基因。在另一优选例中,所述的表达载体中含有表达k-rassirna的表达盒。在另一优选例中,所述的表达盒(即多核苷酸)为双链,并且具有以下结构:启动子-attb1-任选的标签蛋白(如gfp或emgfp)-5’sirna侧翼区序列-式i所示的序列-5’sirna侧翼区序列-attb2-任选的tkpa元件。在另一优选例中,所述的制剂为脂质体制剂。本发明第五方面,提供了一种施用药物的方法,包括步骤:将本发明第四方面所述的药物制剂施用于哺乳动物的第一部位,从而使得所述表达载体在所述哺乳动物体内被加工形成微粒子(microvesicle),并被运输到所述哺乳动物的第二部位,并在所述的第二部位表达所述的sirna。在另一优选例中,所述的哺乳动物包括人和非人哺乳动物。在另一优选例中,所述的第一部位包括皮下、静脉或肠胃道。在另一优选例中,所述的第二部位包括肝脏、肺、肾脏。在另一优选例中,所述的施用包括口服、皮下注射、肌内注射、静脉注射。本发明的第六方面,提供了一种抑制k-ras基因表达的sirna,所述sirna的正义链核苷酸序列选自序列表中:seqidno:3、seqidno:26、seqidno:41、seqidno:47、seqidno:52、seqidno:73、seqidno:88、seqidno:98、seqidno:101和seqidno:106或seqidno:263所示序列。在另一优选例中,所述sirna的正义链核苷酸序列如序列表中seqidno:263所示。本发明第七方面,提供了一种药物组合物,所述的药物组合物含有本发明第一方面所述的前体序列、本发明第三方面所述的表达载体,或本发明第六方面所述的sirna,和药学上可接受的载体。在另一优选例中,所述的药物组合物包括k-rassirna质粒。在另一优选例中,所述的药物组合物还包括egfr靶向药物。在另一优选例中,所述的药物组合物为本发明第三方面所述的表达载体,较佳地,为含有本发明第一方面所述前体序列的质粒。在另一优选例中,所述的药物组合物的剂型包括:片剂、胶囊剂、粉剂、丸剂、颗粒剂、糖浆剂、溶液、混悬液、乳剂、混悬剂、注射液、或粉针剂。在另一优选例中,所述的药物组合物的剂型还包括喷雾剂、气雾剂、粉雾剂、挥发性液体、外用溶液剂、洗剂、浇淋剂、搽剂、巴布膏剂、膏药、橡胶膏剂、软膏剂、硬膏剂、糊剂、滴眼剂、滴鼻剂、眼用软膏剂、含漱剂、舌下片剂或栓剂。在另一优选例中,所述的剂型为注射剂,较佳地,为静脉注射剂、腹腔注射剂。本发明第八方面,提供了本发明第一方面所述sirna、第一方面所述前体序列、或本发明第三方面所述表达载体的用途,包括,(i)用于制备k-ras的抑制剂;和/或(ii)用于制备抗k-ras高表达恶性肿瘤的药物组合物。在另一优选例中,所述的恶性肿瘤包括肾癌、口腔上皮癌、头颈癌、膀胱癌、脑瘤、胶质细胞瘤、肝癌、肺癌、胃癌、食管癌、卵巢癌、结肠癌、直肠癌、宫颈癌、胰腺癌、前列腺癌、白血病、或乳腺癌。本发明第九方面,提供了一种体外非治疗性抑制k-ras高表达恶性肿瘤细胞生长的方法,包括步骤:在本发明第七方面所述药物组合物存在情况下培养k-ras高表达恶性肿瘤细胞,从而抑制k-ras高表达恶性肿瘤细胞的生长。本发明第十方面,提供了一种治疗k-ras高表达恶性肿瘤的方法,将安全有效量的本发明第三方面所述的表达载体或本发明第七方面所述的药物组合物施用于所需对象,从而治疗k-ras高表达相关疾病。在另一优选例中,所述施用的剂量为0.05-10mg/kg,较佳地,为0.1-5mg/kg。在另一优选例中,所述施用包括:口服、呼吸道、注射、透皮、粘膜或腔道给药。在另一优选例中,所述施用包括注射质粒。本发明第十一方面,提供了一种治疗k-ras高表达相关疾病的方法,其特征在于,将含有本发明第一方面所述的前体序列的k-rassirna质粒通过静脉注射施用于所需对象,从而治疗k-ras高表达相关疾病。应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。附图说明图1是改造前的质粒的示意图;图2是切除emgfp和blasticidin改造后的质粒;图3是各个组织器官中k-rassirna含量的ct值示意图;图4是肺中k-rasmrna的表达水平示意图;图5是肺中k-ras蛋白的表达水平电泳图;图6是肺中k-ras蛋白的表达水平示意图;图7是小鼠肝脏和肺脏中病理切片结果示意图;图8是结肠癌移植瘤中k-rasmrna的表达水平示意图;图9是结肠癌移植瘤中k-ras蛋白的表达水平示意图;图10是胰脏中k-rasmrna的表达水平示意图;图11是胰脏中k-ras蛋白的表达水平示意图;图12是小鼠肝脏和胰脏中病理切片结果示意图;图13是肺中10条k-rassirna导入后k-rasmrna的表达水平示意图;图14是肺中10条k-rassirna导入后k-ras蛋白的表达水平示意图;图15是肺脏sirnai、sirnaii、本申请sirna作用下k-rasmrna的表达水平。具体实施方式本发明人经过广泛而深入地研究,首次设计制备了一种能够高效表达k-rassirna的前体sirna。本发明前体sirna经过宿主细胞的加工后,能够高效地表达k-rassirna,从而有效地避免了目的序列的反向互补序列对目的序列发挥功能的干扰作用。实验证明,本发明前体sirna能够在体内有效表达k-rassirna序列,并对多种恶性肿瘤都具有更有效的治疗作用。在此基础上,完成了本发明。sirna及其前体如本文所用,所述的“sirna”是指一类rna分子,从可形成sirna前体的转录物加工而来。成熟的sirna通常具有18-26个核苷酸(nt)(更特别的约19-22nt),也不排除具有其它数目核苷酸的sirna分子。sirna通常可被northern印迹检测到。人来源的sirna可被从人细胞中分离。如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。sirna可从前体sirna加工而来,所述的前体sirna可折叠成一种稳定的茎环(发夹)结构,所述的茎环结构长度一般在50-100bp之间。所述的前体sirna可折叠成稳定的茎环结构,茎环结构的茎部两侧包含基本上互补的两条序列。在本发明中,所述的前体sirna为人工合成的前体sirna,且所述的前体sirna具有式i所示的结构:作为代表性的例子,b1为k-rassirna正义链序列;b2为与b1互补(包括基本互补和完全互补)的序列;c为所示的序列(guuuuggccacugacugac);a1和a2分别为无,或任选的由4个-5个碱基组成的核苷酸序列;其中,所示的前体sirna能在宿主中加工形成k-rassirna。在本发明中,形成k-rassirna的前体sirna可被剪切生成调节k-ras的sirna,即k-rassirna(例如seqidno.:263)。在式i中,b2和b1为基本互补。如本文所用,“基本上互补”是指核苷酸的序列是足够互补的,可以以一种可预见的方式发生相互作用,如形成二级结构(如茎环结构)。通常,两条“基本上互补”的核苷酸序列互相之间至少有70%的核苷酸是互补的;优选的,至少有80%的核苷酸是互补的;更优选的,至少有90%的核苷酸是互补的。一般地,两条足够互补的分子之间可以具有最多8个不匹配的核苷酸,优选地,具有1、2、3、4、5个不匹配的核苷酸。如本申请所用,“茎环”结构也被称作“发夹”结构,是指一种核苷酸分子,其可形成一种包括双链区域(茎部)的二级结构,所述的双链区域由该核苷酸分子的两个区域(位于同一分子上)形成,两个区域分列双链部分的两侧;其还包括至少一个“环”结构,包括非互补的核苷酸分子,即单链区域。即使该核苷酸分子的两个区域不是完全互补的,核苷酸的双链部分也可保持双链状态。例如,插入、缺失、取代等可导致一个小区域的不互补或该小区域自身形成茎环结构或其它形式的二级结构,然而,该两个区域仍可基本上互补,并在可预见的方式中发生相互作用,形成茎环结构的双链区域。茎环结构是本领域技术人员所熟知的,通常在获得了一条具有一级结构的核苷酸序列的核酸后,本领域技术人员能够确定该核酸是否能形成茎环结构。本发明中,“茎环结构”可存在于式i所示前体sirna的末端,例如由于b1和b2形成基本互补后,c会形成一固定的末端茎环结构;所述的“茎环结构”还可存在于式i所式前体sirna内部,例如由于b1和b2之间并非完全互补,造成未互补结合的b1或b2的碱基会形成一内部的茎环(internalloop)。本发明所述的k-ras高表达是指:k-ras蛋白高表达,或k-rasmrna高表达。根据本发明所提供的sirna序列,可设计出在被导入后可被加工成可影响相应的mrna表达的sirna的多核苷酸构建物,也即所述多核苷酸构建物能够在体内上调相应的k-rassirna的量,从而降低k-ras的表达量。因此,本发明提供了一种分离的多核苷酸(构建物),所述的多核苷酸(构建物)可被人细胞转录成前体sirna,所述的前体sirna可被人细胞剪切且表达成所述的sirna。多核苷酸构建物作为本发明的一种优选方式,所述的多核苷酸构建物自5’至3’端含有式ii所示的结构:a1-b1-c-b2-a2式ii式ii中,b1为可在细胞中表达成所述的k-rassirna的核苷酸序列,b2为与b1基本上互补或完全互补的核苷酸序列;c为位于b1和b2之间的间隔序列,并且所述间隔序列与b1和b2不互补;a1和a2分别为无,或任选的由4个-5个碱基组成的核苷酸序列;式ii所示的结构在转入细胞后,形成式i所示的二级结构:通常,所述的多核苷酸构建物位于表达载体上。因此,本发明还包括一种载体,它含有所述的sirna,或所述的多核苷酸构建物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。在本发明中,所述表达载体没有特别限制,包括市售的或用常规制备的表达载体。代表性的例子包括(但并不限于):pcdnatm6.2-gw/mir、pcdna3、pmir-reportmirna、padtrack-cmv、pcambia3101+puc-35s、pcmvp-neo-ban、pbi121、pbin438、pcambia1301、psv2、cmv4表达载体、pmir-rb-reporttm、pshok-basic、mmu-mir300-399mirnaselecttm、pshrna-copgfplentivector、gv317、gv309、gv253、gv250、gv249、gv234、gv233、gv232、gv201、gv159或其他gv系列表达载体。在另一优选例中,在所述表达载体中,与所述表达所述前体sirna多核苷酸操作性相连的启动子包括组成型启动子或组织特异性启动子,优选在肝脏组织中特异性启动的启动子。换言之,这些启动子用于驱动前体sirna的表达。代表性的启动子包括(但并不限于):pcmv启动子、u6、h1、cd43启动子、cd45(lca)启动子、cd68启动子、endoglin(cd105)启动子、fibronectin启动子、flt-1(vegfr-1)启动子、gfap启动子、gpiib(integrinαiib)启动子、icam-2(cd102)启动子、mb(myoglobin)启动子、nphsi(nephrin)启动子、spb启动子、sv40/halb启动子、syn1启动子、wasp启动子或其组合。药物组合物及施用方法如本文所用,术语“有效量”或“有效剂量”是指可对人和/或动物产生功能或活性的且可被人和/或动物所接受的量。如本文所用,术语“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,当本发明的活性成分每天以约0.00001mg-50mg/kg动物体重(较佳的0.0001mg-10mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、微粒子(microparticle)、微泡(microvesicle)、外泌体(exosomes)、脱落囊泡(sheddingvesicle)、纳米胶囊(nanocapsules/nanoparticles)、β环糊精胶囊(β-cyclodextriniclusioncompound)蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载体的选择应与给药方式相匹配,这些都是本领域的普通技术人员所熟知的。在本发明中,可将所述的表达载体直接施用于对象,也可将所述的表达载体与药学上可接受的载体制备成药物组合后进行施用。所述的施用包括静脉注射。治疗方法本发明还提供了一种治疗k-rassirna表达量相关疾病的方法,即,将安全有效量的本发明表达载体或药物组合物施用于所需对象,从而治疗k-ras活性相关的疾病。通常,“k-rassirna表达量相关疾病”指的是患有所述疾病的患者中,k-ras蛋白或mrna的表达量(或活性)e1与癌旁组织或正常组织中k-ras的量(或活性)e0相比具有显著性差异,较佳地,所述“高表达”指的是e1≥1.5e0,更佳地e1≥2e0。肿瘤组织中,k-ras是否高表达可以通过常规方法检测。通常,所述的k-ras高表达恶性肿瘤包括(但不限于)肝癌、肺癌、胃癌、食管癌、卵巢癌、结直肠癌、宫颈癌、胰腺癌、前列腺癌、白血病、或乳腺癌。本发明有益效果本发明前体sirna能够有效的避免在过表达目的序列得同时也过表达目的序列得反向互补序列,从而有效避免了目的序列得反向互补序列对目的序列发挥功能的干扰作用。本发明前体sirna能够在体内有效表达k-rassirna序列,并对多种恶性肿瘤都具有有效的治疗作用,从而用于开发新的肿瘤治疗药物。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等人,分子克隆:实验室手册(newyork:coldspringharborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数是重量百分比和重量份数。实施例1表达载体构建根据生物安全性原因,首先对质粒进行改造。通过dna限制性内切酶,切除emgfp和blasticidin等具有生物毒性的元件。图1所示的是改造前的质粒,图2所示的是切除emgfp和blasticidin后的质粒。其中pcmv代表真核启动子,pucori代表在原核核细胞内质粒的复制起始位点,该起始位点不表达插入序列,spectinomycin表示壮观霉素抗性基因,用于质粒的筛选。质粒改造完成后,根据k-ras基因序列设计并合成互补oligodna,k-rassirna序列:5’-ggugacuuagguucuagau-3’(seqidno:263),序列见表1。表1、oligodna序列及其对应的前体sirna元件随后将合成好的寡聚单链dna用ddh2o溶解成100μm,互补单链各取5μl两两混合,按表2给出体系进行退火。将2份oligo混合物在95℃加热5分钟,然后放置室温20分钟,形成双链dna。表2oligodna退火体系100μmtopstrandoligo5μl100μmbottomstrandoligo5μl10×oligoannealingbuffer2μlddh2o8μltotalvolume20μl将退火的双链dna继续稀释成10nm浓度,按表3给出体系在室温连接30分钟。表3酶连接体系5×ligationbuffer4μlpcdna6.2-gw/emgfp-mir2μldsoligo(10nm)4μlt4dnaligase(1u/μl)1μlddh2o9μltotalvolume20μl取10μl连接产物转化100μl感受态细胞,涂lb平板(含50μg/ml壮观霉素)后,37℃孵育。其中感受态细胞的菌种可以使用大肠杆菌dh5α、xl10-gold、bb4、de3、bm25.5、bmh71-18muts、bw313、c-la、c600、dh1、dh5、dp50supf、ed8654、ed8767、er1647、hb101、hms174、jm83、jm101、jm105、jm106、jm107、jm108、jm109、jm110、k802、k803、le392、mc1061、mv1184、mv1193、novablue、rr1、tap90、tg1、tg2、xl1-blue、x1776、y-1088、y-1089、y-1090等。上述菌种中可优先选择大肠杆菌dh5α或xl10-gold,最优先使用大肠杆菌dh5α。每个转化平板分别挑取3个克隆,摇菌抽提质粒后进行测序,以验证重组克隆中插入片段序列是否与设计的寡聚单链dna序列一致。实施例2k-rassirna对小鼠lewis肺癌的治疗作用llc(lewis肺癌)细胞系由南京大学生命科学学院提供。dmem为hyclone公司产品。胎牛血清为gibco公司产品。试验时,llc细胞系用含10%fbs、100ug/ml青霉素和100ug/ml链霉素的dmem完全培养基于37℃、5%co2培养箱中培养。试验动物为c57bl/6小鼠15只,雌雄各半,6周龄,由南京大学模式动物所提供。首先培养lcc细胞,将培养至对数生长期的lcc细胞用胰酶消化后,1000rpm离心,弃上清,用无菌生理盐水洗涤两次,将细胞悬浮于生理盐水中,台盼蓝染色观察细胞活力,并进行细胞计数,调整细胞密度为5×106个/ml。试验时,取健康c57bl/6鼠,按0.2ml/只尾静脉缓慢注射,注射结束后,将所有造模小鼠分为,组1:尾静脉缓慢注射pbs(阴性对照组);组2:尾静脉缓慢注射对照质粒(5mg/kg);组3:尾静脉缓慢注射k-rassirna质粒(5mg/kg)。此外另取一组正常小鼠作为正常对照。造模期间,定期观察c57bl/6小鼠的精神、饮食、排便、体重和活动等情况。第14天开始给药,按0.1ml/10g体重尾静脉注射给药,对照组给予相应的生理盐水。给药期间,每3天给药一次,共7次。末次给药后第3天,小鼠乙醚麻醉,取血、肺及肝脏。将肺、肝脏放10%福尔马林中,做病理切片,观察肺癌成模情况及k-rassirna质粒对肺癌治疗情况。造模期间,所有动物生活状态良好,未见竖毛、目光呆滞、呼吸异常、活动迟缓、粪便异常等不良反应。所有计量资料采用表示。采用spss16.0软件包进行统计学分析处理,多组间比较采用方差分析f检验,组间比较采用成组t检验,p<0.05为具有统计学意义。c57bl/6小鼠lewis肺癌造模两周后静脉注射给予k-rassirnaplasmid治疗,给药期间,每3天一次,于末次给药后的第3天处死动物,采血、肺脏,肝脏及各个组织器官。利用qrt-pcr检测各个组织器官中k-rassirna的含量。图3所示的是各个组织器官中k-rassirna含量的ct值,图3中每组柱状图从左到右依次为normal、pbs、controlplasmid、egfrsirnaplasmid,由测定结果可以看出,k-rassirna进入了除脑和骨骼肌之外的诸如肝脏、肺等其他组织和器官。图4所示的是肺中k-rasmrna的表达水平,结果显示k-rassirna显著降低了肺组织器官内k-ras的mrna水平。图5、图6所示的是提取肺组织蛋白后,利用westernblotting实验检测肺组织内k-ras蛋白的表达水平。除检测分子指标外,其余肺脏与肝脏用福尔马林固定,进行组织病理切片检查该脏器肿瘤状况。病理切片结果见图7,其中所有各组肝脏切片未见有肿瘤灶。在肺部,各治疗组可见不同程度的片状核大深染的肿瘤细胞聚集灶。上述结果显示k-rassirna质粒可以显著降低肺内肿瘤组织的k-ras蛋白表达水平。实施例3k-rassirnaplasmid对小鼠结肠癌的治疗作用结肠癌细胞株:小鼠结肠癌细胞ct-26(balb/c来源,h-2kd):由南京大学生命科学学院提供。建模实验动物:balb/c小鼠,雌性,6-7周龄,由南京大学模式动物所提供。动物模型建立:balb/c小鼠为肿瘤ct-26细胞株同种系动物。将复苏后的ct-26传代培养。待细胞长至一定量时,取对数生长期的细胞加入0.9%生理盐水调整细胞浓度为5×106/ml,按每只小鼠0.2ml的剂量(约1×106cells/只),将肿瘤细胞接种于小鼠右侧腋部皮下,接种后普通饮食饲养。1周后15只balb/c荷瘤小鼠腋部均可见肿瘤长出,即造模成功。选取15只,随机分为:1组:左侧腋部皮下注射pbs(阴性对照组);2组:左侧腋部皮下注射controlplasmid(5mg/kg);3组:左侧腋部皮下注射k-rassirnaplasmid(5mg/kg)。此外另取一组正常小鼠作为正常对照(normal)。造模期间,定期观察balb/c荷瘤小鼠的生活情况、肿瘤大小与外观。第8天开始给药,按0.1ml/10g体重尾静脉注射给药,对照组给予相应的生理盐水。给药期间,每3天给药一次,共7次。末次给药后第3天,脊椎脱臼法处死全部小鼠,于肿瘤生长部位迅速切开皮肤,将肿瘤完整切除。随后验证k-rassirnaplasmid对小鼠结肠癌的治疗作用。1、k-rassirnaplasmid对小鼠结肠癌皮下移植瘤体积的影响用游标卡尺测量肿瘤的长径(a)和短径(b),计算肿瘤体积v(mm3):=1/6πab2。测量后,10%甲醛固定。计算抑瘤率:抑瘤率(%)=(对照组v-实验组v)/对照组v×100%。相较于1组和2组的肿瘤体积,3组体积明显较小(p<0.05),如下表4所示。表4不同组别的实验小鼠的肿瘤体积和抑瘤率*相对于2组,#相对于1组利用qrt-pcr检测移植瘤中k-rassirna的含量,结果显示k-rassirna进入了移植瘤。随后检测个移植瘤中k-rasmrna的表达水平,实验结果显示(图8)k-rassirnaplasmid显著降低了移植瘤中k-ras的mrna水平。提取肿瘤组织蛋白,利用westernblotting实验检测肿瘤组织内k-ras蛋白的表达水平,实验结果(如图9)发现k-rassirnaplasmid可以显著降低肿瘤组织的k-ras蛋白。k-rassirnaplasmid对在体结肠癌有治疗作用,给药期间未见与用药相关的异常反应。实施例4k-rassirnaplasmid对小鼠胰腺癌的治疗作用patu8988人胰腺癌细胞系由atcc提供。rpmi-1640完全培养基、胎牛血清由gibco提供。试验时,将人胰腺癌细胞株放入含10%的rpmi-1640完全培养基中,置于37℃、5%co2培养箱中,每2d换液1次,2~3d,0.25%的胰酶消化,一传三传代培养。试验动物为裸小鼠balb/c(nu/nu)15只,雌雄各半,6周龄,由北京维通利华实验动物技术有限公司提供。待人胰腺癌细胞布满瓶底时,收集单细胞悬液,每只5×106肿瘤细胞,0.2ml,胰腺原位注射胰腺癌细胞,建立肿瘤模型。将胰腺癌小鼠随机分为三组:组1:尾静脉缓慢注射pbs(阴性对照组);组2:尾静脉缓慢注射对照质粒(5mg/kg);组3:尾静脉缓慢注射k-rassirna质粒(5mg/kg)。此外另取一组正常小鼠作为正常对照。造模期间,定期观察裸小鼠balb/c(nu/nu)的精神、饮食、排便、体重和活动等情况。第14天开始给药,按0.1ml/10g体重尾静脉注射给药,对照组给予相应的生理盐水。给药期间,每3天给药一次,共7次。末次给药后第3天,小鼠乙醚麻醉,取血、胰脏及肝脏。将胰脏、肝脏放10%福尔马林中,做病理切片,观察胰腺癌成模情况及k-rassirna质粒对胰腺癌治疗情况。balb/c(nu/nu)小鼠人胰腺癌造模两周后静脉注射给予k-rassirnaplasmid治疗,给药期间,每3天一次,于末次给药后的第3天处死动物,取血、胰脏及肝脏。随后检测植瘤中k-rasmrna的表达水平,实验结果显示(图10)k-rassirnaplasmid显著降低了移植瘤中k-ras的mrna水平。提取肿瘤组织蛋白,利用westernblotting实验检测肿瘤组织内k-ras蛋白的表达水平,实验结果(如图11)发现k-rassirnaplasmid可以显著降低肿瘤组织的k-ras蛋白。病理切片结果见图12,其中所有各组肝脏切片未见有肿瘤灶。在胰脏,各治疗组可见不同程度的片状核大深染的肿瘤细胞聚集灶。实施例5更多k-rassirna序列的设计及验证在实施例1设计的k-rassirna序列的基础上,本实施例进一步针对k-ras基因的多个位点设计了多达260条可能的sirna序列,详见表5。并从上述sirna序列中,进一步通过筛选出了10条稳定性优异、且特异性抑制作用明显的sirna序列进行表达验证,该10条sirna在的序号分别为3、26、41、47、52、73、88、98、101和106号。分别使用实施例1中的表达载体构建方法及实施例2中的验证方法验证k-rasmrna及蛋白表达水平。图13所示的是肺中k-rasmrna的表达水平,结果显示筛选出的10条k-rassirna构建的质粒都降低了肺组织器官内k-ras的mrna水平。图14所示的是提取肺组织蛋白后,利用westernblotting实验检测肺组织内k-ras蛋白的表达水平。上述结果显示筛选出的10条k-rassirna构建的质粒可以显著降低肺内肿瘤组织的k-ras蛋白表达水平。表5k-rassirna的正义链序列对比例1选取美国专利us8008474b2中抑制k-ras表达的两条sirna(命名为sirnai和sirnaii),sirnai:正义链:5’-cgaauaugauccaacaaua-3’;反义链:5’-uauuguuggaucauauucg-3’。sirnaii:正义链:5’-gaugaugccuucuauacau-3’;反义链:5’-auguauagaaggcaucaug-3’。按实施例1的方式构建质粒载体,分别命名为sirnai质粒和sirnaii质粒,按实施例2中的方法应用于小鼠lewis肺癌模型,然后检测个肺中k-rasmrna的表达水平,实验结果显示(图15)示,本申请的k-rassirna质粒相较于sirna质粒i、sirna质粒ii更显著地降低了肺组织器官内k-ras的mrna水平,说明其抑制效果优于现有技术中抑制k-ras的sirna序列。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 一种利用短单链DNA抑制昆虫基因表达的方法与流程
- 特异性抑制Eya2基因表达的siRNA及其重组载体和应用的制作方法与工艺
- 抑制罗汉果CAS基因表达的方法与流程
- 特异性抑制CLDN8基因表达的siRNA及其重组载体和应用的制作方法与工艺
- 抑制小鼠促性腺激素抑制激素基因表达的siRNA及其应用的制作方法与工艺
- 一种抑制梨种子赤霉素合成基因表达的方法与流程
- KPNA2基因的应用和抑制KPNA2基因表达的siRNA的应用的制造方法与工艺
- 特异性抑制PADI2基因表达的siRNA及其重组载体和应用的制造方法与工艺
- 一种高效表达小鼠促性腺激素抑制激素基因的慢病毒载体及其应用的制造方法与工艺
- 一种抑制人黑色素瘤RBM3基因表达的siRNA及其质粒载体的制造方法与工艺
- 大豆低温诱导人工合成启动子SP5及应用的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及gnd基因的表达载体的制造方法与工艺
- 一种棒状杆菌组成型表达载体启动子、含有该启动子及lrp基因的表达载体的制造方法与工艺
- 一种二值卷积神经网络处理器及其使用方法与流程
- 检测NUP214‑ABL1基因相对表达量的试剂盒和方法与流程
- 环介导的级联放大策略用于高灵敏检测DNA甲基转移酶活性的制造方法与工艺
- 一种基于高压静电场来促进作物优质高效安全生产的嫁接方法与流程
- 一种酶性DNA机器用于miRNA检测的方法与流程
- 转基因玉米MON87403品系特异性实时荧光PCR检测引物、探针、方法和试剂盒与流程
- 葡萄早熟基因VvWRKY13在调控植物中乙烯生物合成中的应用的制造方法与工艺