利用人参皂苷糖苷酶的次要人参皂苷的制备方法与流程
本发明涉及一种利用来自微杆菌属(Microbacterium sp.)微生物的人参皂苷糖苷酶(Ginsenoside glycosidase)蛋白的次要人参皂苷的制备方法及包含所述蛋白的次要人参皂苷的转化用组合物。
背景技术:
皂苷是指在广泛存在于植物的配糖体中,非糖部分由多种环状化合物构成的物质。作为主要生理活性成分而包含在人参或红参的皂苷成分即三萜皂苷(triterpene saponin)的化学结构与在其他植物中发现的皂苷不同,因此为了区分这些人参皂苷与其他植物的皂苷,以人参(Ginseng)配糖体(Glycoside)的含义称为人参皂苷(Ginsenoside)。
人参皂苷根据苷元(aglycone)的结构而可分为原人参二醇类(Protopanaxadiol-type,PPD型)人参皂苷、原人参三醇类(Protopanaxatriol-type,PPT型)人参皂苷、及齐墩果酸类(Oleanolic acid型)人参皂苷。这三种人参皂苷再次根据通过糖苷键(glycosidic bond)键合到化合物结构中的环的第3个碳、第6个碳及第20个碳的位置的糖部位(苷元(aglycones)、糖部分(sugar moieties))的位置及数量而分类。PPD型人参皂苷包含Rb1、Rb2、Rb3、Rc、Rd、绞股蓝皂苷(gypenoside,Gyp)XVII、Compound 0、Compound Mc1、F2、Compound Y、Compound MC、Rg3、Rh2及C-K等。PPD型人参皂苷包含Re、Rg1、Rf、Rg2、Rh1及F1等。
另外,占干参中的人参皂苷的90%以上的是主要人参皂苷,但因所述主要人参皂苷的质量接近1000道尔顿而在生物体内的吸产率非常低(Park,J.H.,Food Ind.Nutr.,2004,9:23-27)。因此,为了增大人参皂苷的药效,需要进行将主要人参皂苷转化为吸产率相对较高且药效也更突出的次要人参皂苷的过程(Akao,Kidaetal.1998,Tawab,Bahretal.2003)。即,主要人参皂苷为了在体内(in vivo)有效地表现出生理活性,需要进行去除构成糖的葡萄糖、阿拉伯糖、鼠李糖、木糖等的转化过程(deglycosylated)。主要人参皂苷包含Rg1、Re、Rb1、Rb2、Rc及Rd等,微量的次要人参皂苷(稀有人参皂苷)包含F2、Rg3、Rh1、Rh2、绞股蓝皂苷(gypenoside,Gyp)XVII、绞股蓝皂苷LXXV、Compound K、C-K、Compound Mc及Compound Mc1等。
已知稀有人参皂苷F1具有抗老化及抗氧化功效,且已报告具有保护HaCaT角质细胞不会因UVB(Ultraviolet B,紫外线B)而细胞凋亡(apoptosis)效果(Lee,Cho et al.2003),具有皮肤美白功效及抗癌活性(Han,Lee et al.2014,Kim,Baek et al.2015)。然而,虽然人参皂苷F1具有这些优点,但从1976年被发现之后最近才报告其药理学活性。其原因在于,人参皂苷F1少量存在于人参叶,故而难以获得足够的量用于测定人参皂苷F1的生物学活性。
作为用于生产微量存在于人参的次要人参皂苷F1的方法,提出有化学分解方法、酵素法及利用配糖体合成方法等,但如上所述的方法存在以下问题而在量产中存在极限:1)在制备工序上需经过多个步骤;2)在制备过程中目标成分消失;3)使用不适于食用的催化剂;或4)产率低。尤其,在酵素法中,对利用从多种微生物获得的助酵素、或微生物的主要人参皂苷的生物转化(biotransformation)进行较多的研究。然而,这些方法也无法有效地用作量产方法,具有产生较多费用的问题。
至今为止已报告的F1生产方法是利用糖苷酶(glycosidase)通过生物学方法从0.5g的PPD型混合物生产数百mg的F1、Rh1、Rg2及Rg1、或利用从真菌类分离的β-糖苷酶从Rg1生产F1。另外,作为大量制备人参皂苷F1的最近的技术,报告有成功地利用来自地杆菌属(Terrabacter sp.)微生物的β-糖苷酶(β-glucosidase)以克为单位量产F1的案例(注册专利10-1340079)。
由此,本发明人等为了开发一种用于获取呈微量存在于人参等植物的形态的次要人参皂苷的方法而进行锐意努力,结果确认到如下情形而完成了本发明:与来自地杆菌属的β-糖苷酶相比,来自微杆菌属(Microbacterium sp.)菌株的人参皂苷糖苷酶MT619可非常优异地将主要形态的人参皂苷生物转化成次要形态的人参皂苷。
技术实现要素:
[发明要解决的问题]
本发明的目的在于提供一种次要人参皂苷的制备方法,其包含如下步骤:利用选自由人参皂苷糖苷酶(ginsenoside glycosidase)蛋白、导入有包含对所述蛋白进行编码的核酸的载体的形质转化体、及所述形质转化体培养物构成的群组中的一种以上特异性地水解人参皂苷的第6个碳的糖而转化成去糖基化形态的步骤。
本发明的另一目的在于提供一种次要人参皂苷的转化用组合物,其包含如下步骤:利用选自由人参皂苷糖苷酶(ginsenoside glycosidase)蛋白、导入有包含对所述蛋白进行编码的核酸的载体的形质转化体、及所述形质转化体培养物构成的群组中的一种以上特异性地水解人参皂苷的第6个碳的糖而转化成去糖基化形态的步骤。
本发明的又一目的在于提供一种人参皂苷糖苷酶(Ginsenoside glycosidase)蛋白。
本发明的又一目的在于提供一种对所述蛋白进行编码的核酸、包含所述核酸的载体及导入有所述载体的形质转化体。
[解决问题的方法]
用于达成所述目的的本发明的一实施方式提供一种次要人参皂苷的制备方法,其包含如下步骤:利用选自由人参皂苷糖苷酶(ginsenoside glycosidase)蛋白、导入有包含对所述蛋白进行编码的核酸的载体的形质转化体、及所述形质转化体培养物构成的群组中的一种以上特异性地水解人参皂苷的第6个碳的糖而转化成去糖基化形态的步骤。
在本发明中,术语“人参皂苷糖苷酶(Ginesenoside glycosidase)”是指对葡萄糖苷分子键进行水解的酶,具体是指特异性地水解人参皂苷的第6个碳的糖的酶。即便是属于同一糖苷酶的酶,其酶活性也可像糖苷酶、纤维素酶一样具有各种酶活性,因此需要查明具有特异性地水解人参皂苷的第6个碳的糖的活性的适当的酶。由此,本发明人等筛选具有如上所述的活性的人参皂苷糖苷酶而确认其功能。就本发明的目的而言,所述人参皂苷糖苷酶只要是水解人参皂苷的第6个碳的糖的酶则无限制,具体而言,可为包含以序列1表示的氨基酸序列的人参皂苷糖苷酶。本发明的所述人参皂苷糖苷酶不仅包含具有以序列1记载的氨基酸序列的蛋白,而且还包含具有如下人参皂苷糖苷酶的活性的蛋白:作为与所述序列表现出70%以上、具体而言80%以上、更具体而言90%以上、进而具体而言95%以上、最具体而言98%以上的同源性的氨基酸序列,实际包含以所述序列1表示的氨基酸序列。另外,可知作为具有这种同源性的序列,只要是本发明的实际上具有与人参皂苷糖苷酶相同或相应的生物学活性的氨基酸序列,则具有序列缺失、变形、取代或附加的氨基酸序列的蛋白变异体也包含在本发明。
所述同源性表示与野生(wild type)蛋白的氨基酸序列或对所述野生蛋白进行编码的核酸序列的相似程度,包含与本发明的氨基酸序列或核酸序列具有如上所述的百分比以上的相同序列的序列。这种同源性的比较可以通过肉眼执行或易于购得的比较程序来执行。
包含以所述序列1记载的氨基酸序列的人参皂苷糖苷酶是来自微杆菌属(Microbacterium.sp.)微生物、具体而言来自微杆菌属testceem的酶,在本发明中将所述人参皂苷糖苷酶与MT619混用。所述人参皂苷糖苷酶具有β-糖苷酶(β-glucosidase)活性,可分解Glc(1→2)Glc或rha(1→2)Glc,从而可将在第6个碳上键合有糖的人参皂苷转化成作为次要人参皂苷的F1及PPT。
在本发明的一实施例中,从微杆菌属中筛选具有以序列1表示的氨基酸序列的人参皂苷糖苷酶并将其命名为MT619(实施例1)。对所述MT619进行编码的聚核苷酸包含长度为1857bp的核苷酸,对由619个氨基酸构成的多肽进行编码。
所述人参皂苷糖苷酶对位于人参皂苷的第6个碳的糖具有外侧及内侧葡萄糖、Glc(1→2)Glc或rha(1→2)Glc的选择水解功能。
在本发明的一实施例中,通过确认从人参皂苷Rg1向F1的转化,确认到本发明的人参皂苷糖苷酶可通过对人参皂苷的第6个碳的葡萄糖进行选择性水解而制备人参皂苷F1(图4)。
本发明的人参皂苷糖苷酶蛋白可将在第6个碳上键合有糖的人参皂苷转化成呈易于被人体吸收的形态的可溶性次要人参皂苷,所述蛋白只要可保持活性及稳定性,则可在各种温度及pH值条件下使用,可一同使用选自由CaCl2、CoCl2、DTT、EDTA、KCl、MgCl2、MnCl2、NaCl、SDS及巯基乙醇构成的群组中的一种以上的金属及化学制剂,但并不限制于此。
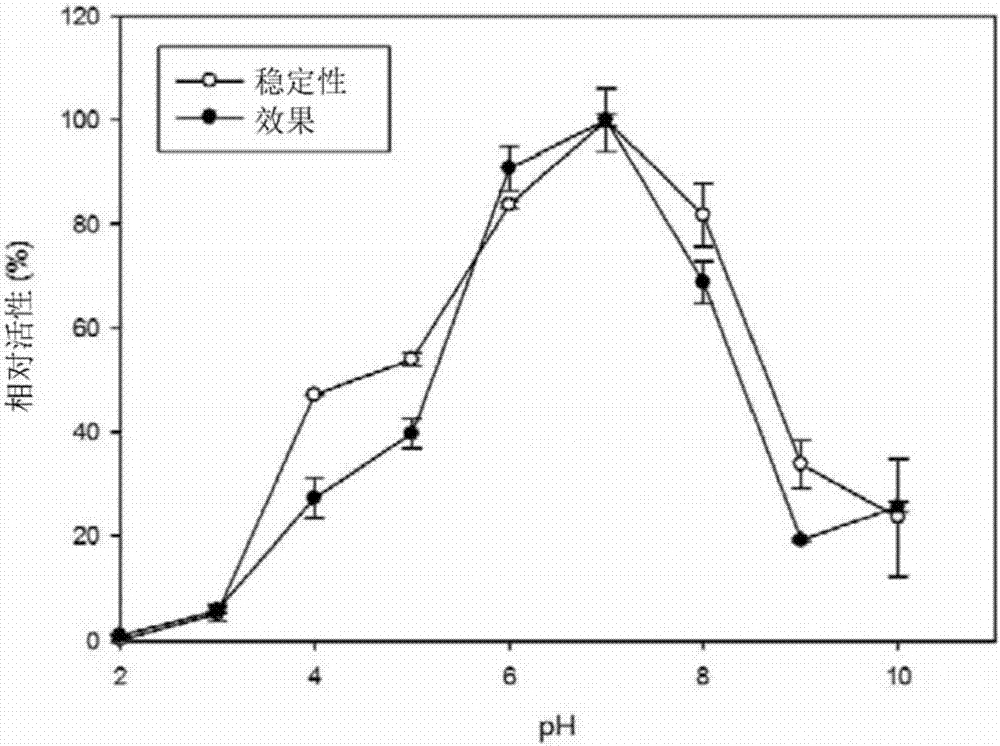
在本发明的一实施例中,对pH值对MT619的活性及稳定性产生的影响进行分析,结果确认到MT619在pH值5至8.0的范围表现出稳定性,具体而言,在pH值7.0下最具稳定性(实施例3-2,图2)。
在本发明的另一实施例中,对温度对MT619的活性及稳定性产生的影响进行分析,结果MT619的活性在30℃~55℃下表现地较高,最佳温度为45℃。另外,MT619的温度稳定性在0~45℃下表现出稳定性,具体而言,在0~30℃温度下表现出优异的稳定性(实施例3-3,图3)。
在本发明的又一实施例中,对金属及其他化学试剂对MT619的活性产生的影响进行分析,结果酶活性在存在Cu2+、Co2+、Hg2+及Zn2+等离子的条件下强烈地下降,但Ca2+、Na+及K+未能大幅增加酶活性(实施例3-4,表1)。
在本发明的又一实施例中,对MT619的基质特异性进行分析,结果MT619对pNP-β-D-吡喃葡萄糖苷表现出最高的基质特异性,还对o-NP-p-D-吡喃葡萄糖苷表现出特异性(实施例4,表2)。
另外,与已知为用于量产F1的来自地杆菌属(Terrabacter.sp)微生物的β-糖苷酶相比,所述人参皂苷糖苷酶对键合在人参皂苷的第6个碳的糖进行水解的活性非常高,因此可有效地用于量产次要人参皂苷。
在本发明的一实施例中,利用MT619对从人参皂苷Rg1生产F1的能力进行评估。将已知为使用人参皂苷Rg1作为基质而生产F1的来自地杆菌属的BgpA用作比较对照组,确认到MT619以Rg1为基质而生产F1的能力非常优异。具体而言,MT619在反应开始后的1小时至3小时内表现出优异的生产能力,具体而言,2小时内的生产能力最突出,与BgpA在0.1mg/ml的酶浓度下生产0.18mg的F1相比,MT619生产1.3mg的F1,从而确认到与BgpA相比,MT619生产大于7陪的F1(图6)。
根据这种结果可知,与公知的人参皂苷糖苷酶BgpA相比,人参皂苷糖苷酶MT619的特异性地水解人参皂苷的第6个碳的糖的能力非常优异。
在本发明中,在第6个碳键合有糖的人参皂苷可为PPD(protopanazadiol)类人参皂苷。所述“PPT(protopanaxatriol)类人参皂苷”作为达玛烷类皂苷,指在第3个、第6个、第12个及第20个碳的位置具有-OH基的PPT或所述PPT的所述-OH基被糖基化的人参皂苷。作为所述达玛烷类皂苷的例,有人参皂苷Re、Rg1、Rf、F1、Rg2、PPT或Rh1。尤其,就本发明的目的而言,所述PPT类人参皂苷包含所有可通过所述人参皂苷糖苷酶的活性转化成人参皂苷F1或PPT的人参皂苷。
在本发明的一实施例中,确认到代表性的Rg1可通过本发明的人参皂苷糖苷酶的活性转化成F1(图4)。具体而言,所述PPT型人参皂苷为Rg1、Rh1、Re、Rg2及Rf,但并不限制于此。
所述PPT类人参皂苷可利用分离及精制形态的人参皂苷,或者还可利用包含在人参、红参的粉末或提取物中的人参皂苷。即,还可将包含人参皂苷的人参、红参的粉末或提取物直接用作起始物质来实施本发明的方法。作为本发明中所利用的人参,可使用公知的各种人参,包含高丽参(Panax ginseng)、花旗参(P.quiquefolius)、三七参(P.notoginseng)、竹节参(P.japonicus)、三叶参(P.trifolium)、喜马拉雅参(P.pseudoginseng)及越南参(P.vietnamensis),但并不限定于此。
在本发明中,术语“次要人参皂苷”是指水解位于难以被人体吸收的主要(major)形态的人参皂苷的第6个碳的糖而产生的易于被人体吸收的次要(minor)形态的人参皂苷。具体而言,所述次要人参皂苷可为F1或PPT,但并不限制于此。
具体而言,在所述人参皂苷糖苷酶为人参皂苷Rg1及Rh1的情况下,具有对人参皂苷Rg1及Rh1的第6个碳进行选择性水解的能力,从而可对位于第6个碳的一个葡萄糖部分(glucose moiety)进行水解而分别转化成人参皂苷F1及PPT。
另外,在所述人参皂苷糖苷酶为人参皂苷Re及Rg2的情况下,可对位于Re及Rg2的第6个碳的rha(1→2)Glc进行水解而转化成F1及PPT。在人参皂苷Rf的情况下,可对位于Rf的第6个碳的Glc(1→2)Glc进行水解而转化成F1。在人参皂苷Rf的情况下,可对位于Rf的第6个碳的Glc(1→2)Glc进行水解而转化成F1。
在本发明中,术语“Glc(1→2)Glc”是指通过α键或β键连接葡萄糖(glucose,Glc)的第一个碳与其他葡萄糖的第二个碳而成的二糖类,具体而言,可为通过α键连接葡萄糖的第一个碳与其他葡萄糖的第二个碳而成的二糖类,但并不限制于此。
在本发明中,术语“rha(1→2)Glc”是指通过α键或β键连接鼠李糖(rhamnose,rha)的第一个碳与葡萄糖的第二个碳而成的二糖类,具体而言,可为通过α键连接鼠李糖的第一个碳与葡萄糖的第二个碳而成的二糖类,但并不限制于此。
具体而言,本发明的次要人参皂苷的制备方法包含选自由从人参皂苷Rg1向人参皂苷F1的转化过程、从Rh1向PPT的转化过程、从Re向F1的转化过程、从Rg2向PPT的转化过程、从Rf向F1的转化过程、及从Rf向F1的转化过程构成的群组中的一个以上的转化过程,但并不限制于此。将这种人参皂苷糖苷酶的转化活性示于图4。
本发明的次要人参皂苷的制备方法可包含如下步骤:使导入有包含对所述人参皂苷糖苷酶蛋白进行编码的核酸的载体的形质转化体或所述形质转化体的培养物、与在第6个碳键合有糖的人参皂苷进行反应的步骤。
在本发明中,术语“载体”作为可在适当的宿主细胞中表达靶蛋白的表达载体,指包含以可使核酸插入物表达的方式进行动作地连接的必要调节要素的核酸调配物。
在本发明中,术语“形质转化”是指将DNA导入到宿主,DNA作为染色体的因子而可通过完成染色体合并来进行复制,且指将外部的DNA导入到细胞内而人为地诱发基因变化的现象。
本发明的形质转化方法可使用任意的形质转化方法,可根据本技术领域的普通方法容易执行。
导入有包含通过所述方法形质转化的对本发明的人参皂苷糖苷酶蛋白进行编码的核酸的载体的形质转化体是指具有可将PPT类人参皂苷转化成人参皂苷F1的活性,优选为具有从PPT类人参皂苷即人参皂苷Re及Rg1向人参皂苷F1的转化活性、从人参皂苷Rh1向PPT的转化活性、从Re向F1的转化活性、从Rg2向PPT的转化活性或从Rf向F1的转化活性的形质转化体,但并不限制于此。另外,所述形质转化体具有可将PPT类人参皂苷转化成人参皂苷F1的活性,但并不限制于此。
在本发明中,宿主只要使本发明的核酸表达,则并无特别限制。作为可使用在本发明的宿主的非限制性的例,有如大肠菌(E.coli)的埃希氏菌(Escherichia)属细胞;如枯草芽胞杆菌(Bacillus subtilis)的杆菌(Bacillus)属细胞;如恶臭假单胞菌(Pseudomonas putida)的假单胞菌(Pseudomonas)属细菌;如酿酒酵母(Saccharomyces cerevisiae)、粟酒裂殖酵母(Schizosaccharomyces pombe)的酵母;动物细胞;及昆虫细胞。
另外,可利用培养所述形质转化体而获取的培养物特异性地水解在第6个碳键合有糖的人参皂苷的第6个碳的糖。具体而言,可转化人参皂苷Rg1、Rh1、Re、Rg2及Rf而制备人参皂苷F1或PPT。
在本发明中,术语“培养物”可指通过公知的微生物培养方法而培养所述形质转化体后获取的产物。所述培养物包含培养上清液或细胞破碎液,且可包含细胞也可不包含细胞。导入有包含对所述人参皂苷糖苷酶进行编码的核酸的表达载体的形质转化体的培养物具有从PPT类人参皂苷的人参皂苷Rg1、Rh1、Re、Rg2及Rf转化成F1或PPT的转化活性,但并不限制于此。
本发明的另一实施方式提供一种特异性地水解人参皂苷的第6个碳的糖而转化成呈去糖基化形态的次要人参皂苷的转化用组合物,所述转化用组合物包含选自由以序列1表示的氨基酸序列定义的人参皂苷糖苷酶(Ginsenoside glycosidase)蛋白、导入有包含对所述蛋白的核酸进行编码的载体的形质转化体、及所述形质转化体的培养物构成的群组中的一种以上作为有效成分。
所述人参皂苷、人参皂苷糖苷酶蛋白、次要人参皂苷、形质转化体及培养物与如上内容相同。
所述人参皂苷糖苷酶蛋白对人参皂苷的第6个碳具有非常高的选择性水解能力,因此可有效地用于量产次要人参皂苷。
本发明的又一实施方式提供一种以序列1记载的氨基酸序列定义的人参皂苷糖苷酶(Ginsenoside glycosidase)蛋白、对所述蛋白进行编码的核酸、包含所述核酸的载体及导入有所述载体的形质转化体。
所述人参皂苷糖苷酶蛋白、对所述蛋白进行编码的核酸、包含所述核酸的载体及导入有所述载体的形质转化体与上述内容相同。
具体而言,对所述人参皂苷糖苷酶蛋白进行编码的核酸可指以序列2表示的核酸,但并不限制于此。对所述人参皂苷糖苷酶进行编码的核酸只要是对具有人参皂苷糖苷酶活性的蛋白进行编码的核酸,则并不限制于此,具体而言,不仅包含以所述序列2表示的核酸序列,而且作为与所述序列具有70%以上、具体而言80%以上、更具体而言90%以上、进而具体而言95%以上、最具体而言98%以上的同源性的序列,实际包含对具有人参皂苷糖苷酶活性的蛋白进行编码的序列。所述同源性与上述内容相同。
[发明的效果]
本发明涉及一种利用来自微杆菌属(Microbacterium testceem)微生物的人参皂苷糖苷酶(Ginsenoside glycosidase)蛋白的次要人参皂苷的制备方法及包含所述蛋白的次要人参皂苷的转化用组合物,所述人参皂苷糖苷酶具有特异性地水解人参皂苷的第6个碳的糖而将人参皂苷转化成易于被人体吸收的形态即次要人参皂苷的非常优异的活性,因此可有效地用于量产人参皂苷。
附图说明
图1是表示利用GST(Glutathione S-transferase,谷胱甘肽巯基转移酶)-结合琼脂糖(Agarose)树脂进行精制后,对重组MT619进行SDS-PAGE(Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis,十二烷基硫酸钠聚丙烯酰胺凝胶电泳)分析的图(M:大小标记,道1:未诱发蛋白表达的粗提取物,道2:通过GST-结合琼脂糖树脂进行精制后的GST-MT619)。
图2是表示重组蛋白的活性及稳定性的pH值的图。
图3是表示重组蛋白的活性及稳定性的温度的图。
图4是表示利用薄层色谱法(TLC)对通过重组MT619实现的向人参皂苷F1的转化进行分析的结果的图(S:人参皂苷标准物质)。
图5是表示通过重组MT619转化成人参皂苷Re、Rg1及Rg2的各转化路径的图。
图6是表示重组MT619的F1生产能力的图(BgpA:来自地杆菌属的糖苷酶)。
具体实施方式
以下,通过实施例而进一步详细地对本发明进行说明。然而,这些实施例仅用于例示本发明,本发明的范围并不限定于这些实施例。
实施例1:包含新颖的人参皂苷糖苷酶的重组表达载体及形质转化微生物的制备
在本发明中,为了制备可将主要人参皂苷转化成次要人参皂苷的新颖的人参皂苷糖苷酶,首先从微杆菌属筛选序列1的人参皂苷糖苷酶(gincenoside glycosidase)并命名为MT619。为了使所述MT619在谷氨酸棒状杆菌(Corynebacterium glutamicum)中表达,委托mutagenex(美国)将MT619的碱基序列最佳化(序列2)。
实施例2:人参皂苷糖苷酶(ginsenoside glycosidase)的制备
为了量产实施例1的人参皂苷糖苷酶,将所述形质转化的菌株接种到具备添加有氨比西林(Ampicillin)的100m1的LB(Lysogeny Broth,溶源性)培养基的三角烧瓶而在37℃温度的振荡培养基中以200rpm实施种菌培养,直至600nm下的吸光度成为0.6为止。在多个温度(18℃、22℃、25℃、30℃、37℃)下确认可溶性蛋白是否表达,以最终浓度成为0.1mM的方式向这里添加IPTG(isopropyl-beta-D-thiogalactoside,异丙基-β-D-硫代半乳糖苷)而诱导本发明的人参皂苷糖苷酶大量地表达。当菌株进入静止期(staionary phase)时,在4℃下以6,000×g对菌株的培养液进行离心分离10分钟,添加100mM的磷酸钠缓冲液(Sodium phosphate buffer,pH值为7.0)而进行悬浮,之后利用破碎机(sonicator)对所述细胞溶液进行破碎。在再次在4℃下以13,000×g对所述细胞破碎物进行离心分离15分钟后,获得可溶性人参皂苷糖苷酶MT619的上清液。对所述上清液进行分离精制,利用SDS-PAGE对MT619进行分析。
其结果,所述人参皂苷糖苷酶MT619的氨基酸数量为619,将所述MT619的氨基酸序列表示为1。另外,确认到GST-MT619的分子量与以氨基酸序列计算出的约94.4kDa相似。(图1)。
实施例3:人参皂苷糖苷酶即MT619酶的特性分析
实施例3-1:MT619活性的分析方法
使用包含作为基质的PNPG(p-nitrophenyl-β-D-glucopyranoside,对硝基苯基-β-D-葡萄糖苷)的50mM的磷酸钠缓冲液(pH值为6.0)在37℃下测定所述精制的MT619的特异活性。在0.1ml的1M Na2CO3中处理5分钟而结束反应,在405nm立即测定对硝基苯酚(p-nitrophenol)的分泌。以对硝基苯酚1μmol/分的分泌量定义活性单元(one unit of activity)。尤其,特异活性是蛋白以毫克(milligram)为单元而表达。使用二喹啉酸(BCA)蛋白分析法(Pierce、Rockford、IL)以牛血清白蛋白(Sigma)的Bio-R为基准而测定蛋白浓度,所有分析法均反复执行三次。
实施例3-2:通过pH值变化产生的活性的评估
为了测定pH值对所述MT619的酶活性产生的影响,使用2.0mM的pNPGlc(p-nitrophenyl-D-glucopyranoside,对硝基苯-D-吡喃葡糖苷;Sigma)作为基质,使用如下所述的缓冲液(50mM)调节pH值。pH值为2至10的范围:KCl-HCl(pH值为2)、甘氨酸-HCl(pH值为3)、乙酸钠(pH值为4及pH值为5)、磷酸钠(pH值为6及pH值为7)、Tris-HCl(pH值为8及pH值为9)及甘氨酸-氢氧化钠(pH值为10)。
另外,对pH值对酶稳定性产生的影响进行测定。在4℃下在所述提及的各缓冲液中培养酶24小时后,在50mM的钾(potassium)缓冲液内对pNPGlc进行分析,由此对通过pH值的变动产生的酶稳定性进行测定。通过标准分析方法对剩余活性进行分析,将其结果以在最佳pH值下获取的活性百分率形式示于图2。
其结果,如图2所示,确认到人参皂苷糖苷酶MT619在pH值为6至pH值为8的范围内表现出活性及稳定性,具体而言,确认到在pH值为7.0下具有最高的活性及稳定性。另外,可知从pH值6.0以下及pH值8.0开始酶活性及稳定性急剧减少。
实施例3-3:通过温度变化产生的活性的评估
为了对温度对所述MT619的酶活性产生的影响进行测定,使用2.0mM的pNPGlc(p-nitrophenyl-β-Dglucopyranoside;Sigma)在4℃至65℃的多个温度下以最佳pH值对50mM的磷酸钾缓冲液内的温度依赖活性进行10分钟的分析。
另外,为了对温度对MT619酶的稳定性产生的效果进行测定,在相同的温度范围内培养50mM的磷酸钾缓冲液中的酶当量30分钟。具体而言,在利用冰块冷却样品10分钟后,确认通过标准分析方法测定到的剩余活性,由此在执行温度稳定性的分析后,将其结果示于图3。
其结果,如图3所示,人参皂苷糖苷酶MT619的活性在30℃~55℃下表现地最高,具体而言,在45℃下表现出最高的活性。另外,MT619的温度稳定性在0℃~45℃的范围内表现出稳定性,具体而言,在0℃~30℃下表现出优异的稳定性。
实施例3-4:通过金属及化学试剂产生的活性的评估
为了对金属及其他化学试剂对人参皂苷糖苷酶MT169的活性产生的影响进行分析,在37℃下连同MT169一并培养10mM的β-巯基乙醇、CaCl2、CoCl2、CuCl2、二硫苏糖醇(DTT)、EDTA、HgCl2、KCl、MgCl2、MnCl2、NaCl、SDS或ZnCl2后,以pNPG为基质而对剩余活性进行测定,以相对于不包含化合物时的活性的百分率表示活性而示于下述表1。
[表1]
其结果,如表1所示,人参皂苷糖苷酶MT619的酶活性在存在Cu2+、Co2+、Hg2+及Zn2+等离子的情况下强烈地下降,但Ca2+、Na+及K+未能大幅增加酶活性。
实施例4:MT619的基质特异性分析
为了对所述MT619的基质特异性进行分析,使用2.0mM的发色邻硝基苯(ONP)及对硝基苯(PNP)作为基质而在37℃下测定5分钟,1活性单位定义为每分钟释出1μmol的邻硝基酚或对硝基苯酚。分析中所使用的基质为pNP-α-L-阿糖胞苷(pNP-α-L-arabinofuranoside)、pNP-β-L-吡喃阿拉伯糖苷(pNP-β-L-arabinopyranoside)、pNP-α-L-D-吡喃岩藻糖苷(pNP-α-L-D-fucopyranoside)、pNP-α-L-鼠李吡喃糖苷(pNP-α-L-rhamnopyranoside)、pNP-α-D-吡喃葡萄糖苷(pNP-α-D-glucopyranoside)、pNP-α-D-吡喃甘露糖苷(pNP-α-D-mannopyranoside)、pNP-β-D-半乳糖苷(pNP-β-D-galactopyranoside)、oNP-β-D-吡喃葡萄糖苷(oNP-β-D-glucopyranoside)、NP-β-D-吡喃岩藻糖苷(oNP-β-D-fucopyranoside)、pNP-β-D-木吡喃糖苷(pNP-β-D-xylopyranoside)、pNP-β-L-阿糖胞苷(pNP-β-L-arabinofuranoside)、oNP-β-D-吡喃岩藻糖苷(oNP-β-D-fucopyranoside)、oNP-α-D-半乳糖苷(oNP-α-D-galactopyranoside)及pNP-β-D-吡喃葡萄糖苷(pNP-β-D-glucopyranoside),从Sigma购得。
[表2]
a:最终基质浓度为2.0mM
b:pNP-β-D-吡喃葡萄糖苷的酶活性基准
其结果,如表2所示,人参皂苷糖苷酶MT619对pNP-β-D-吡喃葡萄糖苷表现出最高的基质特异性,对o-NP-β-D-吡喃葡萄糖苷也表现出基质特异性。对其他基质未表现出活性。
实施例5:MT619的人参皂转化能力的评估
为了对使附着在人参皂苷的第6个碳(C-6)部位的糖水解的酶的特异性及选择性进行分析,将人参皂苷Re、Rg1及Rg2用作基质。
使以2.0mg/ml的浓度存在于50mM的磷酸钠缓冲液(pH值为7.0)中的MT619按照与以2.0mg/ml的浓度存在于50mM的磷酸钠缓冲液(pH值为6.0)中的所述三种基质相同的体积在37℃下反应。为了测定MT619的分解活性,在反应1.5小时后回收所述样品,添加相同的体积的水溶液-饱和丁醇,由此结束反应。干燥正丁醇(n-butanol)分馏而使其蒸发,将残基溶解到CH3OH中而通过TLC(thin layer chromatography)进行分析,将其结果分别示于图4。
其结果,如图4所示,可确认到人参皂苷Re及Rg1转化成人参皂苷F1。这种结果表示通过切割存在于人参皂苷Rg1的第6个碳位置的糖而转化成人参皂苷F1(图5)。
根据如上所述的结果可知,本发明的以序列1表示的人参皂苷糖苷酶可有效地转化次要皂苷而有效地制备可溶性皂苷即人参皂苷F1。
实施例6:MT619的F1生产能力的评估
为了对所述MT619将Rg1用作基质而生产F1的能力进行评估,与来自微杆菌属的人参皂苷糖苷酶比较F1生产能力。
将来自已知为使用人参皂苷Rg1作为基质而生产F1的地杆菌属的BgpA用作比较对照组。
其结果,如图6所示,MT619在精制的0.1mg/ml的酶浓度下,使用Rg1(2.0mg/ml)作为基质生产F1的能力非常优异。与BgpA在反应初期F1的生产能力较低的情况相比,MT619从反应初期开始快速生产F1。MT619从反应开始1小时至3小时内表现出优异的生产能力,具体而言,在2小时的时候生产能力最突出,与BgpA生产0.18mg的F1的情况相比,MT619生产1.3mg的F1,从而确认到与BgpA相比,MT619生产7陪以上的F1。
根据这种结果可知,与公知的人参皂苷糖苷酶BgpA相比,人参皂苷糖苷酶MT619特异性地水解人参皂苷的第6个碳的糖的能力非常优异。
根据以上说明,本发明所属的技术领域的技术人员应可理解可不变更本发明的技术思想或必要特征而以其他具体形态实施。与此相对,以上所记载的实施例应仅理解为在所有方面均为例示,并不具有限定性。本发明的范围相较所述详细说明而应解释为根据随附的权利要求书的含义、范围及其等同的概念导出的所有变更或变形的形态包含在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!