一种针对肝癌的DC‑CTL试剂盒及其制备方法与流程
本发明涉及肿瘤的细胞免疫治疗领域。具体涉及一种针对肝癌治疗的DC-CTL细胞培养试剂盒的制备及使用方法。
背景技术:
肝癌起病隐匿,恶性度高,发病时已多为中晚期,且患者体内天然免疫,尤其是特异性免疫功能低下,放、化疗的疗效差,易发生肝内播散和远处转移,仅有部分患者可接受手术治疗,根治性切除率较低,术后复发率高。20 世纪 90 年代以来, 我国肝癌的发病率已上升到恶性肿瘤的第 2 位,每年约有 13 万人死于肝癌,死亡人数占全球肝癌死亡总人数的 44%。因此,寻找治疗和预防肝癌复发转移的策略及治疗方法具有重要意义。
过继性免疫细胞治疗指将体外培养激活扩增的自体或异体免疫效应细胞输注给患者,杀伤患者体内的肿瘤细胞或激发机体抗肿瘤免疫反应的治疗方法。过继性免疫治疗的优点主要表现在以下几个方面。第一,免疫细胞在体外处理,可以绕过肿瘤患者体内免疫障碍的种种机制。第二,免疫细胞的活化及效应过程由一些细胞因子介导,现在的生物技术可大规模的生产多种细胞因子、肿瘤抗原等,使得体外大量扩增肿瘤免疫细胞成为可能。第三,免疫细胞的体外活化扩增可避免一些生物制剂在体内大量应用而带来的严重毒副作用。近年来,许多临床研究使用免疫细胞作为治疗癌症的一种辅助治疗手段,并取得了良好效果。这些研究显示单独的细胞治疗对实体瘤的治疗效果不大,但对于手术或放化疗后患者的复发和转移率有良好的抑制效果。
目前,比较有效的过继免疫细胞治疗主要为使用树突状细胞(DC)共培养诱导后的CTL细胞治疗,即DC-CTL治疗。DC细胞为目前发现功能最强大的专职抗原递呈细胞(APC),其表面存在丰富的抗原捕获分子、抗原递呈分子、免疫共刺激分子,具有独特的抗原提呈和激发功能。相关免疫学基础研究及肿瘤研究表明,DC 是启动、调控并维持免疫应答的中心环节。在肿瘤细胞和T 淋巴细胞的相互作用中起桥梁和枢纽作用。成熟活化的 DC与初始T 淋巴细胞相互作用可以诱导抗原特异性细胞毒性 T 淋巴细胞(CTL),而细胞毒性T淋巴细胞是对抗原物质具有杀伤作用的一种特异性T细胞。因此,可以以DC 作为载体,经肿瘤抗原体外冲击使其致敏,保证肿瘤抗原被有效摄取、提呈,然后且通过 DC与CTL细胞的共培养使CTL细胞获得特异杀伤肿瘤细胞的能力。
肿瘤负载DC诱导的CTL细胞治疗方法主要缺陷是:目前已知的肿瘤相关抗原(TAA)较少,临床应用受到限制;必须了解患者的MHC背景,明确肿瘤抗原肽的HLA类型,了解相关表位序列;肿瘤细胞的异质性和遗传不稳定性,用已知的抗原多肽未必能诱导出最佳的免疫反应,需要预防肿瘤抗原免疫逃避变异的可能性。此外,由于各个研究单位使用的技术方案不同,导致在DC-CTL培养过程中出现一下几个问题:DC细胞量少,不足以刺激CTL产生特异性;DC细胞未完全成熟,不能有效提呈肿瘤抗原;收获的细胞中CD3+CD8+CD28+的CTL细胞比例较低,回输后不能产生预期疗效。因此,提供一种能使DC-CTL细胞既具有特异性又能达到有效数量的细胞培养方案显得尤为重要。
技术实现要素:
本发明提供一种针对肝癌治疗的DC-CTL试剂盒,所述试剂盒包含LSA-A试剂、LSA-B试剂、LSA-C试剂、DC-A试剂、DC-B试剂、CTL-A试剂、CTL-B试剂。
所述LSA-A试剂为Ficoll分离液,使用其作为外周血单个核细胞的分离试剂。
所述LSA-B试剂为PH=7.3±0.1的磷酸盐缓冲液,使用其作为包被板清洗、血液稀释及细胞洗涤试剂。
所述LSA-C试剂为含200-400ng/mlα-半乳糖神经酰胺(α-Galcer)(优选200ng/ml)及多种肝癌细胞系表面抗原的磷酸盐缓冲液。具体地,该试剂包含的多种肝癌细胞系表面抗原是指400-600ug/ml HepG2肝癌细胞系表面抗原(优选400ug/ml)、400-600ug/ml QGY-7703肝癌细胞系表面抗原(优选400ug/ml)、400-600ug/ml SMMC-7721肝癌细胞系表面抗原(优选400ug/ml)、400-600ug/ml EGHC-9901肝癌细胞系表面抗原(优选400ug/ml)中的一种或几种。更具体地,该试剂包含的多种肝癌细胞系表面抗原通过使用液氮反复冻融的方法获得的。
所述DC-A试剂为含50-500ng/ml 抗CD14单克隆抗体(优选100ng/ml),50-500ng/ml 抗CD11c单克隆抗体(优选100ng/ml)的磷酸盐缓冲液,使用其包被的细胞培养瓶(皿)可作用于DC细胞分选。
所述DC-B试剂为含1000-1500U/ml GM-CSF(优选1200U/ml)、1000-1500U/ml TGF-β(优选1200U/ml)、600-1000U/ml IL-4(优选800U/ml)以及600-1000U/ml IFN-γ(优选800U/ml)的1640培养基,使用其作为诱导DC细胞分化及扩大的培养基。
所述CTL-A试剂为含50-500ng/ml 抗CD3单克隆抗体(优选100ng/ml)和50-500ng/ml 抗CD28单克隆抗体(优选100ng/ml)的磷酸盐缓冲液,使用其包被的细胞培养瓶(皿)可作用于T细胞的刺激活化。
所述CTL-B试剂为含80-100ng/ml 抗CD3单克隆抗体(优选80 ng/ml)、80-100 ng/ml 抗CD28单克隆抗体(优选80 ng/ml)、80-120ng/ml植物血凝素(PHA)(优选80 ng/ml)、200-400U/ml IL-2(优选200U/ml)、50-100U/ml IL-1α(优选80 U/ml)的1640培养基,使用其作诱导CTL发生及扩大的培养基,同时,该试剂也作为DC、CTL合并后的DC-CTL细胞的培养。
共同地,所述针对肝癌治疗的DC-CTL试剂盒所包含的所有试剂均进行细菌、真菌及内毒素含量检测,且细菌、真菌检测均为阴性,内毒素含量<2EU/ml。
本发明的有益效果是:本发明提取了肝癌细胞系HepG2、 QGY-7703、SMMC-7721、 EGHC-9901的表面抗原,使用其为DC细胞提供递呈抗原,使得DC细胞获得多种肝癌细胞的抗原信息,使用该DC细胞诱导的CTL对表达不同抗原的肝癌细胞都有较强的杀伤活性,可用于预防乙肝及肝硬化患者由于病情进展而发生肝癌,也可作为肝癌手术以治疗及放化疗的一种辅助治疗手段,能起到提高治疗效果和防止肝癌复发的作用。进一步地,本发明将体外培养DC-CTL所需的试剂、抗原进行命名并组成试剂盒,同时制定标准的试剂盒制备方法及使用方法作为体外DC-CTL细胞培养的标准操作流程,以适应产业化的要求。
附图说明
图1 为使用BCA蛋白定量试剂盒测定肿瘤细胞系表面抗原蛋白量的标准曲线图。由图可知蛋白浓度(mg/ml)=1.32*样本平均吸光值-0.1821,一般地,本发明所使用的肿瘤细胞系表面抗原的提取方法所提取的抗原量为11.3mg/1*108个细胞。
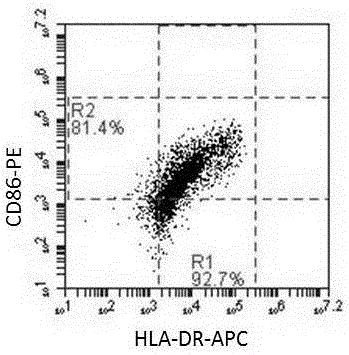
图2 为使用流式细胞术对本发明所述试剂盒培养的DC细胞的表型检测结果。
图3 为使用流式细胞术对本发明所述试剂盒培养的DC-CTL细胞的表型检测结果。
图4本发明所述试剂盒培养的DC-CTL细胞与常规培养的DC-CTL细胞对肝癌细胞系HepG2的杀伤结果统计图。
具体实施方式
下面结合附图及具体实施方式对本发明做进一步详细阐述。实施例中试剂盒具体使用操作按商家推荐的实验步骤进行,所用试剂或仪器未注明生产厂商者,均为可通过市购获得的常规商品
实施例1 肝癌细胞系表面抗原的提取
1.1 肝癌细胞系的培养。本发明所用肝癌细胞系包括HepG2、QGY-7703、SMMC-7721、EGHC-9901,所有细胞系均为贴壁生长细胞且均为本公司肿瘤细胞库复苏培养。HepG2、QGY-7703、EGHC-9901细胞系使用含10% 胎牛血清(Gibco公司,货号:10099141)的 DMEM培养基(Gibco公司,货号:31966047)进行培养,SMMC-7721细胞系使用使用含10% 胎牛血清的 1640培养基(Gibco公司,货号:61870036)。
1.2 肝癌细胞系的传代。细胞培养至汇合度约95%时进行传代。弃掉原细胞培养基,用PBS缓冲液冲洗细胞两遍。加入0.25%胰酶消化液(北京依托华茂生物科技有限公司。货号:PY0018A),使其均匀铺满培养皿。在显微镜下观察细胞形态,当大部分细胞从梭形的贴壁细胞转化为圆形的悬浮细胞时,用手拍打细胞培养瓶使细胞从培养瓶内壁上滑下,再用新鲜的培养液吹壁,使细胞均匀的分布在培养液中,吹匀后细胞分为两份作扩大培养或离心收集进行抗原提取。
1.3 冻融法提取肿瘤细胞系抗原。将消化收集的肿瘤细胞系浓缩至1ml并转入冻存管,细胞浓度为1*108个/ml,将其放入事先准备好的液氮中, 10min后将肿瘤细胞取出放入37℃ 水浴中,至全部溶解后迅速转入液氮中。重复上述冻融实验步骤5-10次后将悬液转入EP管, 10000转离心15分钟,弃去沉淀,收集上清即为肿瘤细胞系抗原蛋白。BCA蛋白定量试剂盒(上海威奥生物科技有限公司,货号:WB0124)检测抗原蛋白含量(图1),并使用0.22um的滤器进行除菌过滤。
实施例2 针对肝癌的DC-CTL试剂盒制备
2.1 LSA-A试剂配制。所述LSA-A试剂为Ficoll分离液(通用电气医疗集团,货号17-5442-02/03)。
2.2 LSA-B试剂配制。所述LSA-B试剂为PH=7.3±0.1的磷酸盐缓冲液,其配制方法为本领域周知:NaCl 137mmol/L,KCl 2.7mmol/L,Na2HPO4 4.3mmol/L, KH2PO4 1.4mmol/L,使用无菌重蒸水混匀并定容至1L,用浓盐酸调节 pH值至7.2。
2.3 LSA-C试剂配制。所述LSA-C试剂为含200ng/mlα-半乳糖神经酰胺(α-Galcer)(广州广州波柏贸易有限公司,货号:KRN7000)及实施例1所述的肝癌肿瘤细胞系抗原。主要包括400ug/ml HepG2肝癌细胞系表面抗原、400ug/ml QGY-7703肝癌细胞系表面抗原、400ug/ml SMMC-7721肝癌细胞系表面抗原、400ug/ml EGHC-9901肝癌细胞系表面抗原。
2.4 DC-A试剂配制。所述DC-A试剂为含100ng/ml 抗CD14单克隆抗体(亚诺法生技公司,货号:PAB4880),100ng/ml 抗CD11c单克隆抗体(亚诺法生技公司,货号:PAB4887)的磷酸盐缓冲液。
2.5 DC-B试剂配制。所述DC-B试剂为含1200U/ml GM-CSF(北京百普赛斯生物科技有限公司,货号:GMF-H4214)、1000-1500U/ml TGF-β(上海伟寰生物科技有限公司,货号:3711S)800U/ml IL-4(Invitrogen公司,货号:RRIL410)以及800U/ml IFN-γ(上海煊翎生物科技有限公司,货号:orb201503)的1640培养基。
2.6 CTL-A试剂配制。所述CTL-A试剂为含100ng/ml 抗CD3单克隆抗体(亚诺法生技公司,货号:MAB4959)和100ng/ml 抗CD28单克隆抗体(亚诺法生技公司,货号:MAB4730)的磷酸盐缓冲液。
2.7 CTL-B试剂配制。所述CTL-B试剂为含80ng/ml 抗CD3单克隆抗体、80ng/ml 抗CD28单克隆抗体、80ng/ml植物血凝素(PHA)(北京达科为生物技术有限公司,货号:CL76003K)、200U/ml IL-2(Invitrogen公司,货号:PA5-46923)、50-100U/ml IL-1α(life公司,货号:LHC0811M)的1640培养基。
实施例3针对肝癌的DC-CTL试剂盒使用方法
3.1 培养瓶包被。使用实施例2所述DC-A试剂和CTL-A试剂各10ml分别加入两个T75细胞培养瓶,置于4℃包被过夜。
3.2 外周血单个核细胞(PBMC)的分离。使用肝素抗凝管采血管静脉采集的50-80ml外周血,2000r/mim离心10min,用移液器吸取上层血清,56摄氏度灭活30min。细胞沉淀用等量实施例2所述LSA-B试剂重悬,缓慢加入至与细胞沉淀等体积实施例2所述的LSA-A试剂中,设置离心机自然升降速度,2000r/min离心20min,离心后吸取中间白膜层细胞,用LSA-B试剂清洗上述两次即得PBMC。
3.3 DC-CTL培养。弃掉包被瓶中的包被液,用LSA-B试剂清洗包被瓶一次,将分离的PBMC用10ml CTL-B试剂重悬并接入DC-A试剂包被瓶,置于37℃ 5% CO2孵箱内培养,2小时后DC细胞会贴壁,此时,小心吸取上层悬浮细胞,接入CTL-A包被瓶进行培养,DC-A包被瓶内的贴壁细胞补加10ml DC-B试剂后继续培养。后续培养中根据细胞生长情况补加培养基,DC细胞培养至第五天时培养体系中加入LSA-C试剂1ml,细胞培养至第七天时DC细胞和CTL细胞合并,并使用CTL-B试剂进行培养,细胞培养至第十四天时进行细菌、真菌、内毒素检测并进行细胞计数,检测合格后收获细胞。
实施例4 细胞表型检测
4.1 DC细胞培养至第七天时取样,使用流式检测抗体PE Mouse Anti-Human CD86(美国BD公司,货号:555658)、APC Mouse Anti-Human HLA-DR (美国BD公司,货号:559866)进行染色,流式细胞仪分析各个细胞群的表达量。实验结果显示表达CD86的细胞为81.4%,表达HLA-DR的细胞为92.7%(图2)。说明本发明所用方法及所用试剂刺激培养的DC细胞成熟度良好。
4.2 DC-CTL细胞培养至第十四天时取样,使用流式检测抗体Percp-CyTM5.5 Mouse Anti-Human CD3(美国BD公司,货号:560835)、APC Mouse Anti-Human CD8(美国BD公司,货号:555369)、PE Mouse Anti-Human CD28(美国BD公司,货号:553297)进行染色,流式细胞仪分析各细胞群的表达量。实验结果显示CD3+细胞比例达97.0%,CD3+CD8+CD28+细胞比例达81.3%(图3)。说明本发明所用方法及所用试剂刺激培养的细胞中CTL细胞比例较大。
实施例5 DC-CTL对肝癌细胞HepG2的杀伤活性检测
5.1 靶细胞接种。使用0.25%的胰酶消化液将处在对数生长期的肝癌细胞系HepG2细胞从培养瓶中消化并转入50ml离心管中,800转离心3min,弃上清。用含10% 胎牛血清的DMEM培养基重悬细胞并计数,调整靶细胞浓度为5*105个/ml,接入24孔板,每孔500ul,接好细胞的培养板置于二氧化碳培养箱5% CO2 37℃孵育24小时。
5.2 效应细胞作用靶细胞。使用本发明所述试剂盒培养至十四天的DC-CTL和常规方法培养的DC-CTL细胞作为靶细胞,每种细胞设三个复孔。1500转离心5min,弃上清,使用CellTracker™ Fluorescent Probes(life公司货号:C34565)工作液重悬细胞,室温孵育20min。离心并弃掉CellTracker™ Fluorescent Probes工作液,用PBS洗细胞3次,加入效应细胞培养所需的培养基重悬计数,按相应的效靶比(1:1、5:1、10:1、20:1)调整细胞浓度,接入含靶细胞的24孔板,每孔500ul。接好细胞的培养板置于5% CO2 37℃孵箱24小时。
5.3 靶细胞凋亡率检测。将培养板中细胞至离心管,并用4℃PBS洗两次,用200ul 1X Binding Buffer(美国BD公司,货号:556454)重悬细胞。取100ul细胞至5ml圆底管,加入5ul PE Annexin V(美国BD公司,货号:556422)和5ul 7-AAD(美国BD公司,货号:559925),避光染色20min后,用1X Binding Buffer洗去多余染色剂,用400 μl的 1X Binding Buffer重悬细胞,进行流式细胞术分析,分析时使用CellTracker™ Deep Red dye圈门,分析CellTracker™ Deep Red dye阴性细胞群中7AAD+Annexin V+细胞的表达量即为靶细胞凋亡率,根据检测结果做凋亡曲线。本实施例实验结果显示使用本发明所述的针对肝癌细胞的DC-CTL试剂盒培养的DC-CTL细胞的对肝癌细胞系HepG2的杀伤效果要明显优于常规培养的DC-CTL细胞。(图4)。
- 还没有人留言评论。精彩留言会获得点赞!