体外多段重组酶系统及其在基因组装中的应用的制作方法
本发明涉及一种体外多段重组酶系统及其在基因组装中的应用。
背景技术:
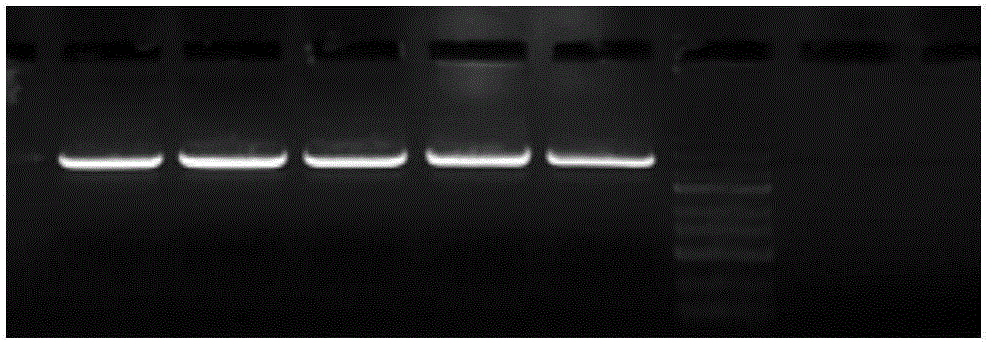
:现代分子生物学在研究基因表达和元件功能时,分子克隆每天都会用到。随着研究基因数量的增加和调控元件序列获取,通过对研究基因的快速克隆进行分析其功能的需求急剧增加。为了满足这一需求,需要选择一种简单、有效、强健、快速且能与任何DNA序列都能进行高通量克隆的方法。目前,已有许多定向克隆及多片段体外组装的方法,包括Gateway,In-fusion,Cold-fusion,T4DNApolymerase-basedLigaseIndependentCloning(LIC),GoldenGate,GibsonAssembly等,考虑到经济及操作的简易性,成功率等因素,目前,最主要的是Gateway技术,GoldenGate,基于Ⅱ型限制性内切酶的连接方法和GibsonAssembly。GibsonAssembly方案的酶系(2x,800ul)配置如下:比例试剂128ulCBARbuffer1ulExoIII20ulTaqDNAligase40ulTaqpolymerase610ulddH2O其中,CBARbuffer(4X)体系的配置如下:比例试剂20%PEG-8000600mMTris-HClpH7.540mMMgCl240mMDTT800mMdNTPs4mMNAD反应温度为一步等温体系,50℃反应15-60min分钟。其中,Gateway技术不依赖限制性内切酶而适用范围广泛,但是由于需要构建入门载体,需要花费大量时间和财力,以及限制DNA片段数量的克隆。GoldenGate适用于多片段基因的组装,然而,它依赖连接酶和Ⅱ型限制性内切酶,此类内切酶长度在6~8bp之间,很容易会出现在需克隆的目的片段序列上;Ⅱ型限制性内切酶的连接方法需要寻找合适的酶切位点,这个需要花费较多精力以及需要相应的限制性内切酶,所花费时间较多,当片段数量多时,需要较长的周期。GibsonAssembly是使用T5外切酶、DNA聚合酶及Taq连接酶而不依赖限制性内切酶点的多段重组方法,反应为一步等温法,这种简单、有效,强健、快速且适用除正向重复以外的DNA片段的组装方法,但是该组装酶价格较高。技术实现要素:本发明所要解决的技术问题是克服现有技术的不足,提供一种成本低的体外多段重组酶系统及其在基因组装中的应用。为解决以上技术问题,本发明采用如下技术方案:本发明的一个目的是提供一种体外多段重组酶系统,按体积百分比计,所述的体外多段重组酶系统包括如下配方:其中,所述的5Xpre-assemblybuffer包括如下配方:占所述的5Xpre-assemblybuffer总体积20~30%的聚乙二醇、450~550mM的三(羟甲基)氨基甲烷、45~55mM的MgCl2、45~55mM的二硫苏糖醇、0.9~1.1mM的dNTPs。优选地,按体积百分比计,所述的体外多段重组酶系统包括如下配方:其中,所述的5Xpre-assemblybuffer包括如下配方:占所述的5Xpre-assemblybuffer总体积23.75~26.25%的聚乙二醇、475~525mM的三(羟甲基)氨基甲烷、47.5~52.5mM的MgCl2、47.5~52.5mM的二硫苏糖醇、0.95~1.05mM的dNTPs。更优选地,按体积百分比计,所述的体外多段重组酶系统包括如下配方:其中,所述的5Xpre-assemblybuffer包括如下配方:占所述的5Xpre-assemblybuffer总体积24.75~25.25%的聚乙二醇、495~505mM的三(羟甲基)氨基甲烷、49.5~50.5mM的MgCl2、49.5~50.5mM的二硫苏糖醇、0.99~1.01mM的dNTPs。优选地,所述的聚乙二醇为聚乙二醇-8000。优选地,所述的三(羟甲基)氨基甲烷的pH为7.4~7.6。本发明中,所述的体外多段重组酶系统为2X体外多段重组酶系统。本发明的另一个目的是提供一种如权利要求1至6中任一项所述的体外多段重组酶系统在基因组装中的应用。具体地,所述的基因组装的制备体系包括:19~21μL的ddH2O、9.5~10.5μL的体外多段重组酶系统、线性化克隆载体和插入片段扩增产物,其中,所述的线性化克隆载体和所述的插入片段扩增产物的每片段最适使用量为(0.02×片段碱基对数)ng。更具体地,所述的基因组装的制备体系在冰水浴中配制。更具体地,将所述的基因组装的制备体系在PCR仪器内,在47.5~52.5℃下反应5~60min。由于上述技术方案的实施,本发明与现有技术相比具有如下优点:本发明的重组酶系统的原料便宜易得,且无需使用NAD,使得整体成本降低,本发明的重组酶系统能够一次性组装多个DNA片段到载体上,大大缩短了组装周期,提高了生产效率,使企业在合成生物学领域提高核心竞争力。说明书附图图1为基因组装的流程图;图2为载体酶切后的电泳图;图3为扩增后的电泳图;图4为培养后的平板图;图5为菌检阳性率的图片。具体实施方式下面结合具体实施例对本发明做进一步详细的说明,但本发明并不限于以下实施例。本发明中若无特别说明,原料均可市购获得,方法为本领域的常规方法。实施例1:试验流程1、重组酶体系的配置:5Xpre-assemblybuffer的配置,其配方如表1:表1比例试剂25%(V/V)聚乙二醇-8000(PEG-8000)500mM三(羟甲基)氨基甲烷Tris-HCl(pH7.5)50mMMgCl250mMDTT1mMdNTPs重组酶系(2X)Mix的配置,其配方如表2:2XHotfusionBuffer(400ul)表2比例试剂160ul5Xpre-assemblybuffer0.5ulT5核酸外切酶20ul高保真Taq酶220ulddH2O2.引物设计插入片段扩增引物设计通过在引物5’端引入同源重组序列,扩增产物之间以及扩增产物与线性化克隆载体之间都具有能够相互同源重组的完全一致的序列(20bp~25bp)。以pUC57作为克隆载体为例、进行三插入片段顺序拼接克隆(5’至3’按克隆顺序依次为:第一片段、第二片段、第三片段)为例,引物具体设计方案如下:第一段的5’端与pUC57-Amp的EcoRⅠ酶切端有一段20~25bp一致的序列,称为重组臂(overlaps,以下用overlaps指重组臂),第一段3’端与第二段5’端有20~25bp一致的序列,依次类推。3.制备线性化载体选择合适的酶切位点,并对克隆载体进行线性化,酶切后使用琼脂糖胶回收。GC含量均匀的区域进行克隆,当载体克隆位点上下游25bp区域内GC含量均在40%~60%范围之内时,重组效率将达到最高。注:经选用无重复序列但GC含量高或低的区域进行阳性对照,其结果证明对重组效率无明显影响单酶切线性化:线性化程度较差。可适当延长酶切时间以降低转化背景。4.插入片段PCR扩增插入片段可用任意PCR酶扩增PCR扩增的反应体系如表3中所示,PCR扩增的反应条件如表4中所示。表3体系组分用量(μL)ddH2O355×PCRbuffer1010mMdNTP1template1primerF1primerR1S15酶1表4PCR结束后,取少量产物进行琼脂糖电泳以检验扩增产量和特异性,将剩余部分进行回收。5.组装反应体系于冰浴中进行,制备体系如表5:表5每片段最适使用量=[0.02×片段碱基对数]ng例如,将长度为0.5kb、1kb、2kb三插入片段克隆至长度为5kb的克隆载体时,各片段最适使用量为:线性化克隆载体最适使用量:0.02×5000=100ng0.5kb插入片段最适使用量:0.02×500=10ng1kb插入片段最适使用量:0.02×1000=20ng2kb插入片段最适使用量:0.02×2000=40ng然后通过步骤4中PCR扩增所测定的每片段的浓度计算出线性化克隆载体和插入片段扩增产物的体积。体系配制完成后,用移液器上下吹打几次混匀各组分,然后瞬离,避免产生气泡(请勿剧烈震荡或者涡旋混匀)。置于PCR仪内50℃反应5~60min。6.反应产物转化、培养取20μl冷却反应液,加入到200μl感受态细胞中,轻弹管壁数下混匀,在冰上放置30min。42℃热激90秒,冰水浴孵育2min。加入400~500μlLB培养基,37℃孵育10min充分复苏。37℃摇菌45min。取100μl菌液均匀涂布在含有适当抗生素的平板上。将平板倒置,于37℃过夜培养。7.菌检用无菌枪头或者牙签挑选单菌落于230μl左右LB培养基中,放入37℃摇床1.5~2h后,取2~3μl菌液进行PCR,剩余菌检继续放入摇床。6h后将检到的菌液送测2~4个,以防止假阳性克隆。实施例2:1、在pUC57-Amp为载体,酶切位点EcoRI和HindIII。其中,片段1的5’端和片段3的3’端分别与载体EcoRI酶切位点后25bp和HindIII酶切位点前25bp序列一致,片段2的5’端与片段1的3’端有25bp一致,片段2的3’端与片段3的5’段有25bp一致,片段1至3的序列参见SEQIDNO.1、SEQIDNO.2、SEQIDNO.3。2、反应酶系的配置与实施例1中相同。3、线性化载体的制备用EcoRI和HindIII限制性酶切位点对pUC57载体进行酶切,其体系如下表6。表6pUC57质粒2ngddH2OUpto50μl10X限制性内切酶Buffer5μlEcoRI2μlHindIII2μl酶切完全后,进行琼脂糖凝胶回收,回收后用分光光度计测定浓度。pUC57载体酶切后电泳图如图2。4、片段的扩增以泓迅高保真酶(S15酶)进行扩增,扩增片段为1.0kb,PCR结束后琼脂糖凝胶电泳回收,回收后用分光光度计测定浓度。其电泳图如图3。5、反应体系同实施例1。6、组装反应于冰浴中进行,制备体系如表7:表7反应条件同实施例1。7、反应的转化、培养取20μl冷却反应液,加入到200μl感受态细胞中,轻弹管壁数下混匀,在冰上放置30min。42℃热激90秒,冰水浴孵育2min。加入400~500μlLB培养基,37℃孵育10min充分复苏。37℃摇菌45min。取100μl菌液均匀涂布在含有适当抗生素的平板上。将平板倒置,于37℃过夜培养,平板图片见图4。8、菌检用无菌枪头或者牙签挑选单菌落于230μl左右LB培养基中,放入37℃摇床1.5~2h后,取2~3μl菌液进行PCR,剩余菌检继续放入摇床。6h后将检到的菌液送测2~4个,以防止假阳性克隆。图5为菌检阳性率,三段组装阳线概率30/32。实施例3基本上与实施例2相同,不同之处在于反应酶系,实施例3的重组酶体系的配置:5Xpre-assemblybuffer的配置,其配方如表8:表8重组酶系(2X)Mix的配置,其配方如表9:2XHotfusionBuffer(400ul)表9比例试剂160ul5Xpre-assemblybuffer0.4ulT5核酸外切酶18ul高保真Taq酶222ulddH2O实施例3的三段组装阳线概率为27/32。实施例4基本上与实施例2相同,不同之处在于反应酶系,实施例4的重组酶体系的配置:5Xpre-assemblybuffer的配置,其配方如表10:表10比例试剂20%(V/V)聚乙二醇-8000(PEG-8000)450mM三(羟甲基)氨基甲烷Tris-HCl(pH7.5)55mMMgCl255mMDTT1mMdNTPs重组酶系(2X)Mix的配置,其配方如表11:2XHotfusionBuffer(400ul)表11实施例4的三段组装阳线概率为27/32。以上对本发明做了详尽的描述,其目的在于让熟悉此领域技术的人士能够了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,且本发明不限于上述的实施例,凡根据本发明的精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1