植酸酶突变体YeAPPA‑L162V及其编码基因和应用的制作方法
本发明涉及基因工程领域,具体涉及植酸酶突变体YeAPPA-L162V及其编码基因和应用。
背景技术:
豆类、谷类等作物动物饲料的主要原料,其中的磷主要以植酸形式存在。植酸不但不能被单胃动物所利用,而且还能够与金属阳离子、氨基酸、蛋白质和淀粉等形成复合物从而抑制营养的吸收、影响动物的生产性能,没有被动物消化吸收的植酸磷排到土壤和水体当中会造成环境污染。在饲料里添加植酸酶能降解植酸生成无机磷和磷酸肌醇,从而提高氨基酸、蛋白质和矿物质元素等营养物质的消化吸收,同时还可以降低植酸所带来的环境污染。因此植酸酶受到世界学术界和商业界的广泛关注。
植酸酶作为饲料添加剂具有广阔的应用前景和巨大的商业价值,而目前所生产销售的植酸酶不能完全满足工业需求,大多具有热稳定性差、催化效率低和pH作用范围窄等缺点。科研工作者多年来致力于基因工程和蛋白质工程研究,希望能改造或合成出综合性质比天然植酸酶更加优良的新型植酸酶。定点突变技术可以改造植酸酶结构和生物学功能,明确特定氨基酸残基在影响植酸酶酶学性质方面的重要功能,深化植酸酶催化机理的认识,并可获得性质改良的新酶,对分子设计具有重要的指导意义。
技术实现要素:
本发明的目的是提供一种催化效率提高且热稳定性改良的植酸酶。
本发明另一目的是提供编码上述催化效率提高且热稳定性改良的植酸酶基因。
本发明的另一目的是提供包含上述催化效率提高且热稳定性改良的植酸酶基因的重组载体。
本发明的另一目的是提供包含上述催化效率提高且热稳定性改良的植酸酶基因的重组菌株。
本发明的另一目的是提供上述催化效率提高且热稳定性改良的植酸酶基因的应用。
本发明对小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)来源植酸酶YeAPPA基因进行定点突变,该植酸酶YeAPPA的成熟蛋白具有如SEQ ID NO.1所示的氨基酸序列,该成熟蛋白是由如SEQ ID NO.2所示的核苷酸序列编码的。
SEQ ID NO.1
MSVAKRNLHLSALTLIMGCFTAGAAPIATPPASYTLERVVILSRHGVRSPTKQTQLMNDVTPDKWPLWPVKAGYLTPRRAELVTLMGGFYGDYFRSQGLLSAGCPVDGSVYAQADVDQRTRLTGQAFLDGIAPDCGLKVHYQADLKKVDPLFHTVEAGVCKLDSAKTHQAVEERLGGPLSDLSQRYAKPFAQMGEVLNFAASPYCKSLQKNGKTCDFATFTANEIKVNEEGTKVSLSGPLALSSTLGEIFLLQDSQAMPDVAWHRLSGEENWVSLLSLRNAQFDLMAKTPYIARHKGTPLLQQIDTALVLQRDAQGQTLPLSPQTKLLFLGGHDTNIANIAGMLGANWQLPQQPDNTPPGGGLVFELWQNPDNHQRYVAVKMFYQTMDQLRNAEKLDMKNNPAKIVPITIEGCENEGDNKLCQLETFQKKVAQVIEPACHI.
SEQ ID NO.2
Atgtcagttgcaaagagaaatctgcacttatccgcactcactttgataatgggctgttttaccgcaggtgctgccccgattgctacaccgccggccagctacacattagagcgtgtggttattttgagtcgacatggtgttcgctccccgacaaaacaaacccagctaatgaatgatgtcacacctgataaatggcccctgtggccagtaaaagcgggctatttaacaccgcgaagggctgagttagtgactttgatggggggattttatggtgattatttccgcagccaagggttgttgtctgcggggtgtccggtagatggctccgtttatgcacaggcagatgttgaccaacgaacccgcttaaccggacaggcattcttggatgggatcgcaccggattgtggtctgaaagtacattatcaggctgatttgaagaaagttgacccgctatttcataccgtcgaagcgggggtctgtaaactggactcagcgaaaactcatcaggctgttgaggagcgattgggcgggccattgagtgatcttagccagcgctatgccaaaccctttgctcagatgggcgaagtgctgaattttgcagcatcgccttattgcaagtcattgcaaaaaaatggaaaaacctgtgattttgcaacttttacggcaaatgaaattaaggtaaacgaagaaggtactaaagtttctctgagtgggccattggcactatcgtcgacattgggtgaaattttcctgttacaagactcacaagctatgccggatgtggcctggcatcggctcagcggtgaagagaactgggtttcgctattgtcgttgcgcaatgcgcaatttgatttgatggccaaaaccccgtatatcgctcgccataaagggaccccgctgttgcaacaaattgatacggcattagtgctgcaacgcgatgcccaagggcaaacactgccgctgtcaccgcaaaccaaattgctgttcctcggcgggcatgacaccaatattgctaatatcgctggtatgttaggggccaattggcaattaccacagcaacctgataataccccgcctggtggcggattagtctttgagctatggcagaacccagataatcatcagcgctatgtcgccgtgaaaatgttctatcaaacgatggatcagctgcgaaatgccgagaaattagatatgaaaaacaacccagctaaaattgttccaattaccattgaaggttgtgagaacgagggtgataacaaactttgccaacttgagactttccaaaagaaagttgcccaagtgatcgagccagcctgccatatttaa
本发明采用定点突变的方法,获得了催化效率提高且热稳定性改良的突变体,命名为YeAPPA-L162V,即YeAPPA的第162位的亮氨酸突变为缬氨酸。
因此根据本发明的催化效率提高且热稳定性改良的植酸酶突变体YeAPPA-L162V,其氨基酸序列如SEQ ID NO.3所示
SEQ ID NO.3
MSVAKRNLHLSALTLIMGCFTAGAAPIATPPASYTLERVVILSRHGVRSPTKQTQLMNDVTPDKWPLWPVKAGYLTPRRAELVTLMGGFYGDYFRSQGLLSAGCPVDGSVYAQADVDQRTRLTGQAFLDGIAPDCGLKVHYQADLKKVDPLFHTVEAGVCKVDSAKTHQAVEERLGGPLSDLSQRYAKPFAQMGEVLNFAASPYCKSLQKNGKTCDFATFTANEIKVNEEGTKVSLSGPLALSSTLGEIFLLQDSQAMPDVAWHRLSGEENWVSLLSLRNAQFDLMAKTPYIARHKGTPLLQQIDTALVLQRDAQGQTLPLSPQTKLLFLGGHDTNIANIAGMLGANWQLPQQPDNTPPGGGLVFELWQNPDNHQRYVAVKMFYQTMDQLRNAEKLDMKNNPAKIVPITIEGCENEGDNKLCQLETFQKKVAQVIEPACHI.
本发明还提供了编码上述催化效率提高且热稳定性改良的植酸酶突变体YeAPPA-L162V的基因序列,其核苷酸序列如SEQ ID NO.4所示。
SEQ ID NO.4
Atgtcagttgcaaagagaaatctgcacttatccgcactcactttgataatgggctgttttaccgcaggtgctgccccgattgctacaccgccggccagctacacattagagcgtgtggttattttgagtcgacatggtgttcgctccccgacaaaacaaacccagctaatgaatgatgtcacacctgataaatggcccctgtggccagtaaaagcgggctatttaacaccgcgaagggctgagttagtgactttgatggggggattttatggtgattatttccgcagccaagggttgttgtctgcggggtgtccggtagatggctccgtttatgcacaggcagatgttgaccaacgaacccgcttaaccggacaggcattcttggatgggatcgcaccggattgtggtctgaaagtacattatcaggctgatttgaagaaagttgacccgctatttcataccgtcgaagcgggggtctgtaaagtggactcagcgaaaactcatcaggctgttgaggagcgattgggcgggccattgagtgatcttagccagcgctatgccaaaccctttgctcagatgggcgaagtgctgaattttgcagcatcgccttattgcaagtcattgcaaaaaaatggaaaaacctgtgattttgcaacttttacggcaaatgaaattaaggtaaacgaagaaggtactaaagtttctctgagtgggccattggcactatcgtcgacattgggtgaaattttcctgttacaagactcacaagctatgccggatgtggcctggcatcggctcagcggtgaagagaactgggtttcgctattgtcgttgcgcaatgcgcaatttgatttgatggccaaaaccccgtatatcgctcgccataaagggaccccgctgttgcaacaaattgatacggcattagtgctgcaacgcgatgcccaagggcaaacactgccgctgtcaccgcaaaccaaattgctgttcctcggcgggcatgacaccaatattgctaatatcgctggtatgttaggggccaattggcaattaccacagcaacctgataataccccgcctggtggcggattagtctttgagctatggcagaacccagataatcatcagcgctatgtcgccgtgaaaatgttctatcaaacgatggatcagctgcgaaatgccgagaaattagatatgaaaaacaacccagctaaaattgttccaattaccattgaaggttgtgagaacgagggtgataacaaactttgccaacttgagactttccaaaagaaagttgcccaagtgatcgagccagcctgccatatttaa
将上述编码催化效率提高且热稳定性改良的植酸酶突变体YeAPPA-L162V的阅读框插入到所述载体的EcoRI和NotI限制性酶切位点之间,使其核苷酸序列可操作的与表达调控序列相连接。本发明优选的载体为pET-22b(+),使该核苷酸序列位于T7启动子的下游并受其调控,得到突变体的重组原核表达质粒。本发明优选的宿主菌为BL21(DE3)。相比于野生型,本发明的植酸酶突变体YeAPPA-L162V的催化效率明显提高,热稳定和酸稳定性及蛋白酶抗性明显改良,有利于发展高效绿色饲料酶工业。
附图说明
图1为改造前后的植酸酶的酶学性质比较;
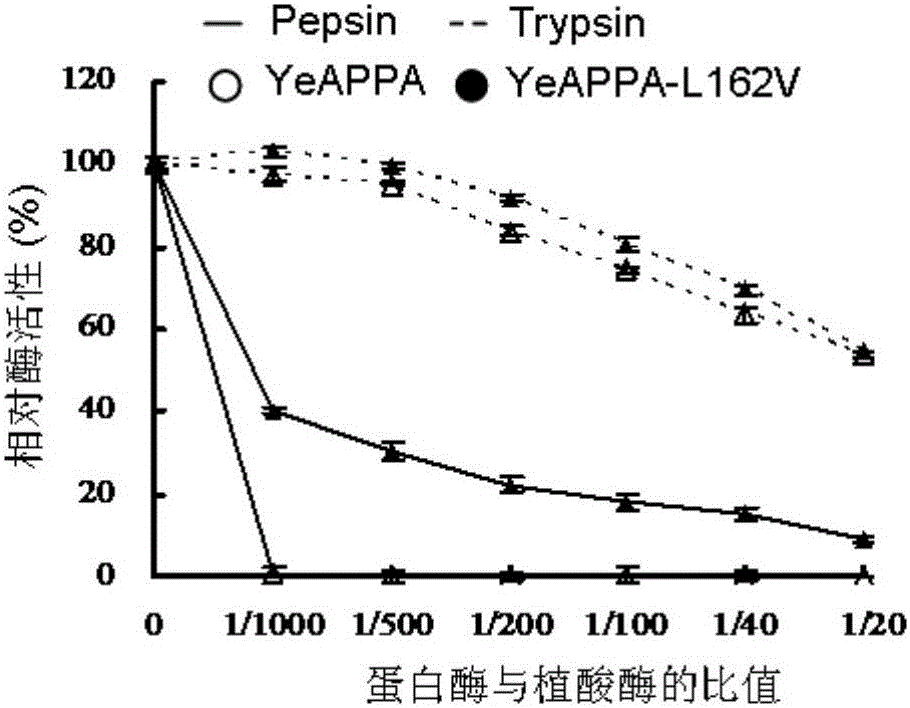
图2为改造前后的植酸酶的蛋白酶抗性比较。
具体实施方式
实验材料
1、菌株及载体:原核表达载体pET-22b(+)购自美国Novagen公司。质粒扩增及原核表达宿主菌是大肠杆菌Trans1-t1和BL21(DE3)细胞,均购自中国天根公司。
2、酶类及其它生化试剂:DNA纯化试剂盒购自日本TaKaRa。Pfu DNA聚合酶、限制性内切酶、T4DNA连接酶购自中国天根。植酸钠和胃蛋白酶(p0685)购自美国Sigma。
实施例1:突变基因的获得
用Overlap PCR方法通过两轮PCR反应在小肠结肠炎耶尔森菌来源植酸酶YeAPPA的基因序列(SEQ IDNO.2)中引入突变,获得突变基因YeAPPA-L162V。PCR模板是pEASY-T3-YeAPPA重组质粒。扩增突变基因完整编码序列的上下游引物分别带有EcoR I和Not I识别序列,分别为YeAPPA Forward:5’-CGCGAATTCGCACCGCTTGCAGCACAATCTAC-3’和YeAPPA Reverse:5’-GATGCGGCCGCTTAAATATGGCAGGCTGGCTCG-3’。在特定位置引入突变的上下游引物分别为YeAPPA L162V Forward:5’-GTCTGTAAAGTGGACTCAGCGAAAACTC-3’和YeAPPA L162V Reverse:5’-GAGTTTTCGCTGAGTCCACTTTACAGAC-3’。所需突变基因连接到pEASY-T3载体上并经公司测序验证。
实施例2:突变酶YeAPPA-L162V与野生酶YeAPPA在细菌中表达与纯化
野生型和突变型植酸酶除去信号肽序列,克隆到表达载体pET-22b(+)的EcoRI和NotI位点之间,并在大肠杆菌BL21(DE3)细胞中受2mM的IPTG(异丙基-β-D-半乳糖苷)诱导表达。粗酶液经镍-次氮基三乙酸(Ni-NTA)柱和二乙基氨基乙基(DEAE)柱进行纯化,纯化酶用10%SDS-PAGE电泳分离分析其表观分子量。野生酶与突变酶全长441个氨基酸,N端23个氨基酸为信号肽序列,成熟蛋白理论分子量为48.6kDa。除去信号肽的编码区序列经原核表达和纯化,在SDS-PAGE电泳上检测均为一条约46kDa的特异性条带(数据未显示)。
实施例3:突变酶与野生酶的酶学性质比较
纯化的野生型和突变植酸酶在不同pH(1-12)和不同温度(30-80℃)下反应30min,根据酶活性来检测其最适pH和最适温度。所用的缓冲液包括0.1mol/L甘氨酸-盐酸缓冲液(pH1-3),0.1mol/L醋酸钠-醋酸缓冲液(pH3-6),0.1mol/L Tris-盐酸缓冲液(pH6-8)和0.1mol/L甘氨酸-氢氧化钠缓冲液(pH8-12)。纯化酶液在pH1-9下37℃处理1h,研究酶的pH稳定性。在一定温度下将纯化酶液分别处理0,2,5,10,20,30,60min后测定其热稳定性。植酸酶活性使用硫酸亚铁钼蓝法测定。以1.5mmol/L植酸钠为底物,在37℃下反应30min,用10%三氯乙酸(TCA)终止反应,并用显色液(1%四水合钼酸铵,3.2%浓硫酸,7.32硫酸亚铁)进行显色。测定700纳米下的吸光度值,计算产生无机磷酸盐的量。一个植酸酶活性单位定义为在测定条件下,每分钟释放1微摩尔的磷酸盐所需的酶量。
对突变酶的酶学性质进行了测定并与野生酶进行了比较(图1)。突变酶的最适pH为5,与野生酶相似。在相同的条件下,突变酶具有更好的酸稳定性,在pH 2.0处理1h后还剩余65.8%酶活。而野生酶在pH 2.0处理1h后只剩余18.4%酶活。突变酶的最适温度为45℃,类似于野生酶。突变酶比野生酶具有更好的热稳定性,在60℃处理30min后还剩余约10.9%。而野生酶在60℃下处理30min后基本失去活性。
实施例4:突变酶与野生酶的动力学常数比较
以0.0625mmol/L植酸钠为底物,在野生酶YeAPPA及其突变体YeAPPA-L162V的最适pH和37℃下反应1、3、5、7、10、15min时加入1mL 10%TCA终止反应,测定酶活性,计算出酶活性与时间的比值,测定Km和Vmax的反应时间。用不同浓度的植酸钠(0.0625、0.1、0.125、0.2、0.25、0.5、1.0和1.5mmol/L)为底物,在最适条件下测定酶活,用米氏方程双倒数法求Km值及Vmax,再根据酶的理论分子量求出kcat值。YeAPPA-L162V的动力学常数Km,Vmax,Kcat和Kcat/Km分别为0.19mM,9.49U mg-1,7.26S-1和38.44S-1mM-1(表1)。这些结果表明YeAPPA第162位氨基酸残基对催化效率具有非常大的影响。
表1野生型YeAPPA和突变酶YeAPPA-L162V的动力学分析
实施例5:突变酶与野生酶的蛋白酶抗性比较
野生型和突变酶分别用不同浓度的胃蛋白酶(0.25M甘氨酸盐酸,pH 2)和胰蛋白酶(0.25M Tris-HCl,pH 7)在37℃下处理2h。蛋白酶和植酸酶的比例在1/1000到1/20范围之间。测定突变酶的蛋白酶抗性并与野生酶进行了比较(图2)。在相同的条件下,突变酶具有更好的胃蛋白酶抗性,用1/1000至1/20的胃蛋白酶在37℃处理2h处理后,可保持8.9%以上的酶活性。而野生酶在1/1000的胃蛋白酶处理时完全失活。突变酶的胰蛋白酶抗性与野生型酶相似,用1/1000和1/500的胰蛋白酶在37℃处理2h时,酶活性基本不变,当胰蛋白酶浓度提高至1/20时,可保持54.6%的酶活性。说明植酸酶YeAPPA的第162位亮氨酸突变为缬氨酸提高了胃蛋白酶抗性,而不影响其胰蛋白酶抗性。
实施例6:不同金属离子及化学试剂对本发明所述的突变酶与野生酶的酶活的影响
在酶促反应体系中加入相应的金属离子及相关化学试剂,研究其对突变酶与野生酶酶活的影响,各种物质的终浓度为1mmol/L,在最适pH、37℃条件下测定。以没有加金属离子和化学试剂的反应为对照。各种金属离子和化学试剂对突变酶与野生酶的活性有不同的影响(表2)。Ca2+激活突变酶的活性,Pd2+、Fe3+、Cu2+、Zn2+、Ag+、Hg2+、SDS强烈抑制突变酶的活性,其它化学物质对突变酶的活性几乎没有影响。植酸酶YeAPPA的第162位亮氨酸突变为缬氨酸降低了Hg2+,Fe3+,Cu2+,Zn2+与Ag+对植酸酶活性的抑制作用。
表2化学试剂对改造前后的植酸酶的酶活的影响
- 还没有人留言评论。精彩留言会获得点赞!
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 降低种子重量的白桦AP2基因及其编码蛋白的制造方法与工艺
- 可编码ArtRD蛋白基因及其蛋白和应用的制造方法与工艺
- 蝎神经毒素AaIT及其编码基因与应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺