一种提高抗体纯度的细胞培养基和培养方法与流程
本发明涉及生物技术领域,具体涉及提高抗体纯度的细胞培养基和培养方法。
背景技术:
在生物医药行业,哺乳动物细胞作为重组蛋白药物的表达载体具有明显的优势,其能够完成重组蛋白后期复杂的翻译后修饰,能够保证产品中二硫键、糖基化等复杂蛋白结构的正确形成,从而能够保证重组蛋白的药性和药效,是一类重要的表达系统。
近年来,用于单抗药物生产的动物细胞大规模培养技术发展迅速。该领域的技术进展主要集中在个性化培养基开发和工艺条件优化等方面。作为生物大分子的重组抗体,同时具备聚体、降解、糖基化修饰、氧化、脱酰基化、异构体、二硫键错配等多种变异形式。纯度作为抗体最重要的质量属性对抗体的分子效应功能具有决定作用。现有的提高抗体纯度的方法主要是上游缩短细胞培养周期或者下游纯化工艺牺牲收率,缩短细胞培养周期会降低抗体表达量,其他的糖基化水平也会改变;下游纯化工艺牺牲收率的方式虽然获得高纯度抗体,但是会增加生产成本。因此,亟需一种既不影响抗体表达量又能显著提高抗体纯度的细胞培养方法。
技术实现要素:
本发明的目的在于:提供一种用于细胞培养尤其是哺乳动物细胞培养中高纯度抗体表达的自制补料培养基和培养方法。
一方面,本发明提供一种用于哺乳动物细胞培养的自制补料培养基,所述自制补料培养基含有90mM~500mM半胱氨酸,优选地,半胱氨酸的浓度为100mM~400mM,更优选地,半胱氨酸的浓度为120mM~300mM。
在本发明的一些实施方式中,所述自制补料培养基中还含有酪氨酸和色氨酸,优选地,酪氨酸的浓度为200mM~400mM,色氨酸的浓度为50mM~150mM。
在本发明的一些实施方式中,所述自制补料培养基为液体培养基,培养基的pH值≥10,优选地pH为10~12。
在本发明的一些实施方式中,所述自制补料培养基的配制方法包括以下步骤:取酪氨酸、半胱氨酸、色氨酸,加入到水中,调节pH至10~12,定容至1L。整个配制过程在搅拌和避光的条件下完成。优选地,用NaOH调节pH值。半胱氨酸的浓度为90mM~500mM,优选地,半胱氨酸的浓度为100mM~400mM,更优选地,半胱氨酸的浓度为120mM~300mM。优选地,酪氨酸的浓度为200mM~400mM,色氨酸的浓度为50mM~150mM。
另一方面,本发明提供一种用于哺乳动物细胞培养中高纯度抗体表达的细胞培养方法,所述细胞培养方法为细胞培养进入增殖期后,补加所述自制补料培养基。
具体地,所述的细胞培养方法包括以下步骤:
(1)在基础培养基中接种包含编码抗体核酸的哺乳动物细胞;
(2)进入细胞增殖期后补加所述自制补料培养基;
(3)监测细胞密度调整培养时间。
具体的,步骤(1)所述的基础培养基,其特征在于具有如下特征:1)无血清、无蛋白成分;2)用于哺乳动物细胞大规模培养。
在本发明的一些实施例中,步骤(1)所述的基础培养基选自以下市售培养基中的一种或多种,Hycell CHO Medium、CD FortiCHOTMAGT TMMedium、DynamicTM AGTTM Medium、CDM4PERMAb、TFS-RDMP-1、TFS-RDMP-9,优选地为CD FortiCHOTMAGT TMMedium、Hycell CHO Medium。
在本发明的一些实施例中,步骤(1)所述的哺乳动物细胞为中国仓鼠卵巢细胞(Chinese Hamster Overy,CHO)。
所述自制补料培养基含有90mM~500mM半胱氨酸,优选地,半胱氨酸的浓度为100mM~400mM,更优选地,半胱氨酸的浓度为120mM~300mM。
在本发明的一些实施方式中,所述自制补料培养基中还含有酪氨酸和色氨酸,优选地,酪氨酸的浓度为200mM~400mM,色氨酸的浓度为50mM~150mM。
在本发明的一些实施方式中,所述自制补料培养基的配制方法包括以下步骤:取酪氨酸、半胱氨酸、色氨酸,加入到水中,调节pH至10~12,定容至1L。整个配制过程在搅拌和避光的条件下完成。优选地,用NaOH调节pH值。半胱氨酸的浓度为90mM~500mM,优选地,半胱氨酸的浓度为100mM~400mM,更优选地,半胱氨酸的浓度为120mM~300mM。优选地,酪氨酸的浓度为200mM~400mM,色氨酸的浓度为50mM~150mM。
在本发明的一些实施例中,进入细胞增殖期后,除补加自制培养基外还补充流加培养基,优选地,所述流加培养基选自浓缩补料培养基CHO CD Efficient FeedTM A、Efficient FeedTM A+AGT Supplement、Efficient FeedTM B、Efficient FeedTM B+AGT Supplement、Efficient FeedTM C、Efficient FeedTM C+AGT Supplement、CellventoTMFeed 200或Acti CHO Feed A,优选地为Acti CHO Feed A CD。
在本发明的一些实施例中,在培养的第三天开始补加自制补料培养基和流加培养基。
在本发明的一些实施例中,在培养第三天开始至培养结束每天或部分天数补加自制补料培养基和流加培养基。
在本发明的一些实施例中,在培养第三天开始隔天补加自制补料培养基和流加培养基,如第3、5、7、9、11天补加自制补料培养基和流加培养基。
在本发明的一些实施例中,每次补加培养基(包括自制补料培养基和流加培养基)加入的量为发酵培养基总体积的1%~10%,优选地为3%~6%。所述发酵培养基总体积为细胞培养过程中发酵罐或发酵瓶中已有培养基的总体积。
在本发明的一些实施例中,自制补料培养基和流加培养基加入的比例为1:10。
在本发明的一些实施例中,细胞密度低于90%时停止培养。
本发明所述的抗体为IgG1抗体,优选地为抗人肿瘤坏死因子(TNFα)抗体、抗人血管内皮生长因子(VEGF)抗体。
半胱氨酸是常见的细胞培养基成分,但是尚未见半胱氨酸的加入量与抗体纯度之间的关系的报道,发明人通过大量创造性劳动开发了自制补料培养基,通过控制自制补料培养基中半胱氨酸的浓度及加入时机、加入量,能显著提高抗体的纯度,发明人发现在补加自制补料培养基后,加强了抗体的二硫键的正确组装,且在提高抗体纯度的同时能够维持抗体表达量和正常的糖基化水平,保证了抗体的药效。本方法操作简单、便于实施,适合工业化生产的需要。
附图说明
图1为实施例1-3细胞培养过程的活细胞密度趋势图。
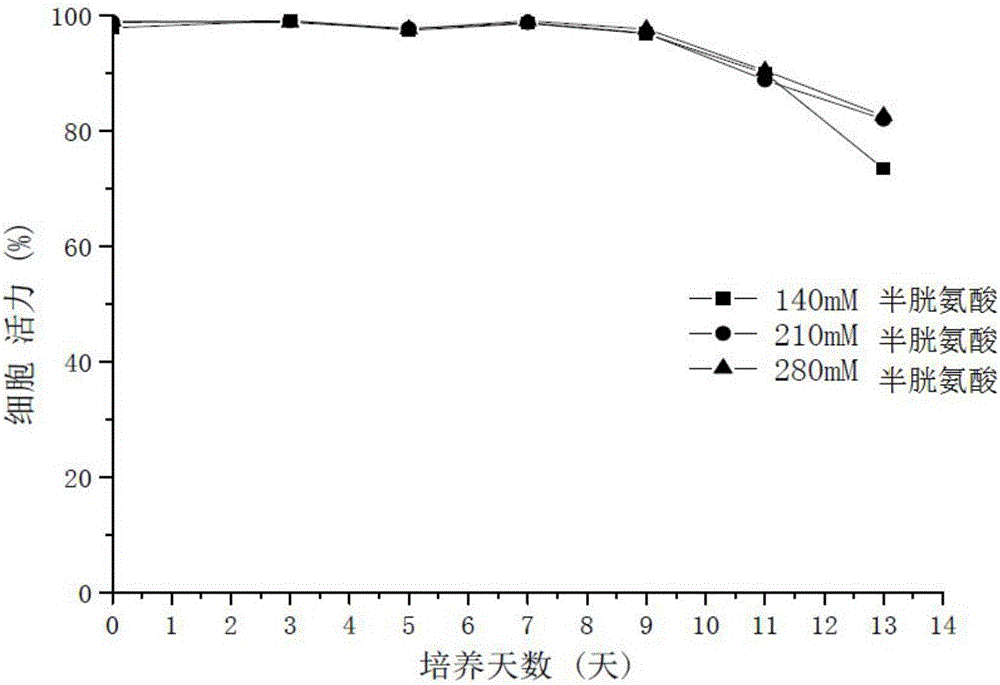
图2为实施例1-3细胞培养过程的细胞活力趋势图。
图3为实施例4-6细胞培养过程的活细胞密度趋势图。
图4为实施例4-6细胞培养过程的细胞活力趋势图。
图5糖型结构示意图。
图6实施例1-3与标准品(阿达木单抗)糖基化检测结果对比图。
图7实施例4-6与标准品(贝伐单抗)糖基化检测结果对比图。
具体实施方式
以下所述的是本发明的优选实施方式,本发明所保护的不限于以下优选实施方式。应当指出,对于本领域的技术人员来说在此发明创造构思的基础上,做出的若干变形和改进,都属于本发明的保护范围。
实施例中所用的基础培养基、流加培养基及标准品均可以通过商业途径获得。酪氨酸、半胱氨酸、色氨酸购自sigma。CHO(中国仓鼠卵巢细胞)细胞株购自lonza公司。
实施例1
基础培养基:为市售培养基Hycell CHO Medium(购自Hyclone)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、280mmol半胱氨酸(121.15g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5MNaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人肿瘤坏死因子(TNFα)抗体核酸的CHO细胞株(参照WO1997029131专利)
在500ml摇瓶中培养,细胞株以0.85×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。糖基化采用LC/MS分析法检测,结果见图6,标准品为阿达木单抗(商品名,修美乐)。细胞培养过程中的活细胞密度(见图1)和细胞活力(见图2)采用台盼蓝(0.2%)染色法进行检测。
实施例2
基础培养基:为市售培养基Hycell CHO Medium(购自Hyclone)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、210mmol半胱氨酸(121.15g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5MNaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人肿瘤坏死因子(TNFα)抗体核酸的CHO细胞株(参照WO1997029131专利)
在500ml摇瓶中培养,细胞株以0.85×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。糖基化采用LC/MS分析法检测,结果见图6,标准品为阿达木单抗(商品名,修美乐)。细胞培养过程中的活细胞密度(见图1)和细胞活力(见图2)采用台盼蓝(0.2%)染色法进行检测。
实施例3
基础培养基:为市售培养基Hycell CHO Medium(购自Hyclone)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、140mmol半胱氨酸(121.15g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5MNaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人肿瘤坏死因子(TNFα)抗体核酸的CHO细胞株(参照WO1997029131专利)
在500ml摇瓶中培养,细胞株以0.85×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。糖基化采用LC/MS分析法检测,结果见图6,标准品为阿达木单抗(商品名,修美乐)。细胞培养过程中的活细胞密度(见图1)和细胞活力(见图2)采用台盼蓝(0.2%)染色法进行检测。
实施例4
基础培养基:为市售培养基Forti CHOAGT(购自Gibco)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、280mmol半胱氨酸(121.15g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5MNaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人血管内皮生长因子(VEGF)抗体核酸的CHO细胞株(参照WO1998045331专利)
在500ml摇瓶中培养,细胞株以1×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。糖基化采用LC/MS分析法检测,结果见图7,标准品为贝伐单抗(商品名,阿瓦斯汀)。细胞培养过程中的活细胞密度(见图3)和细胞活力(见图4)采用台盼蓝(0.2%)染色法进行检测。
实施例5
基础培养基:为市售培养基Forti CHOAGT(购自Gibco)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、210mmol半胱氨酸(121.15g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5MNaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人血管内皮生长因子(VEGF)抗体核酸的CHO细胞株(参照WO1998045331专利)
在500ml摇瓶中培养,细胞株以1×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。糖基化采用LC/MS分析法检测,结果见图7,标准品为贝伐单抗(商品名,阿瓦斯汀)。细胞培养过程中的活细胞密度(见图3)和细胞活力(见图4)采用台盼蓝(0.2%)染色法进行检测。
实施例6
基础培养基:为市售培养基Forti CHOAGT(购自Gibco)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、140mmol半胱氨酸(121.15g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5MNaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人血管内皮生长因子(VEGF)抗体核酸的CHO细胞株(参照WO1998045331专利)
在500ml摇瓶中培养,细胞株以1×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。糖基化采用LC/MS分析法检测,结果见图7,标准品为贝伐单抗(商品名,阿瓦斯汀)。细胞培养过程中的活细胞密度(见图3)和细胞活力(见图4)采用台盼蓝(0.2%)染色法进行检测。
对比例1
基础培养基:为市售培养基Hycell CHO Medium(购自Hyclone)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5M NaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人肿瘤坏死因子(TNFα)抗体核酸的CHO细胞株(参照WO1997029131专利)
在500ml摇瓶中培养,细胞株以0.85×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。
对比例2
基础培养基:为市售培养基Forti CHOAGT(购自Gibco)
自制补料培养基:取300mmol酪氨酸(181.2g/mol)、100mmol色氨酸(204.23g/mol),在搅拌和避光的情况下加入到700ml超纯水中,搅拌40min,加入NaOH(32.1g/L)。继续搅拌30min,用5M NaOH调节pH至10.95~11.2,继续搅拌20min,测定浊度,浊度应小于10NTU,定容至1000ml,搅拌10min以上,0.22μm滤膜过滤至无菌试剂瓶。
流加培养基:为市售培养基Acti CHO FeedACD(购自GE)
细胞株:包含编码抗人血管内皮生长因子(VEGF)抗体核酸的CHO细胞株(参照WO1998045331专利)
在500ml摇瓶中培养,细胞株以1×106cells/mL进行接种,初始培养体积100ml,培养温度37℃,CO2浓度8%,摇床转速130rpm,从培养的第1天开始每天检测细胞密度、活力和各种代谢参数。根据NOVA生化分析仪检测的结果控制葡萄糖浓度在6-8g/L,谷氨酸单钠盐浓度在4-7mM。从第三天开始补充流加培养基和自制补料培养基,以后天数隔天流加,第三天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的3.5%,第5、7、9、11天补加培养基(包括自制补料培养基和流加培养基)的加入量为发酵培养基总体积的5.5%,自制补料培养基和流加培养基加入的比例为1:10。在细胞培养的第13天停止发酵,收取上清,用高效液相色谱(HPLC)的方法,通过ProteinA柱检测抗体的相对表达量和纯度,结果见表1。
表1
- 还没有人留言评论。精彩留言会获得点赞!