一种动物源性成分检测试剂盒的制作方法
本发明涉及检测用品领域,具体而言,涉及一种动物源性成分检测试剂盒。
背景技术:
近年来,市场出现不法分子利用廉价低值肉制品,掺杂在牛肉羊肉驴肉中进行销售,常常以处理猪肉冒充牛肉,以鸡鸭肉掺到牛羊肉中,以老鼠、貂或狐狸肉冒充羊肉做羊肉串,等等,大大损害消费者权益,同时也使人们对食品安全信任度降低,造成不良社会影响。与此同时,在国际贸易进出口贸易中,由疯牛病导致的畜牧业安全隐患依然存在。农业部发布的通知《关于禁止在反刍动物饲料中添加和使用动物源性饲料的通知》等均对饲料中动物源性成分进行强制要求,为更好保证食品安全和我国畜牧业安全生产,急需开发一种快速准确技术和商业化试剂盒来进行动物源性成分的快速高通量筛查,达到执法和商检部门需求。因而,需要建立一种快速准确检测鉴定动物源性成分的方法,对我国食品安全及畜牧业安全产生重要意义。
目前,国内外对于动物源性成分的检测报道主要有显微镜检法、红外光谱法、ELISA、普通PCR、荧光定量PCR等方法,这些技术一般每次仅能检测一种或两种指标,无法全面分析检测食品中所涉及的多种动物源性成分,这些方法不能很好满足快速、大规模、高通量检测的需求。而基因芯片技术目前绝大多数还处于实验室阶段,更多的用于基础性研究而不能平民化应用。目前基因芯片法一般采用玻璃片作为固相支持物,实验过程需要相应的点样仪和芯片识读仪,成本较高。因此研发一种快速、方便、灵敏度高、成本低、可视化和高通量的检测方法将具有非常好的应用前景及市场推广能力。
技术实现要素:
本发明的目的在于提供一种动物源性成分检测试剂盒,该试剂盒能够对食品中的多种动物源性成分检测,且具有成本低、快速、操作方便以及灵敏度高的特点。
本发明解决其技术问题是采用以下技术方案来实现的。
一种动物源性成分检测试剂盒,其包括引物组合,该引物组合包括选自SEQ ID NO.1~2所示的用于检测猪源性成分的引物对、SEQ ID NO.3~4所示的用于检测牛源性成分的引物对、SEQ ID NO.5~6所示的用于检测貉源性成分的引物对、SEQ ID NO.7~8所示的用于检测羊源性成分的引物对、SEQ ID NO.9~10所示的用于检测鸡源性成分的引物对、SEQ ID NO.11~12所示的用于检测鸭源性成分的引物对、SEQ ID NO.13~14所示的用于检测兔源性成分的引物对、SEQ ID NO.15~16所示的用于检测狐源性成分的引物对、SEQ ID NO.17~18所示的用于检测貂源性成分的引物对、SEQ ID NO.19~20所示的用于检测驴源性成分的引物对和SEQ ID NO.21~22所示的用于检测鼠源性成分的引物对中的至少三种的组合,引物组合中的各引物对中的正向引物的5’端或反向引物的5’端带有生物素标记。
本发明提供的动物源性成分检测试剂盒的有益效果是:本发明的动物源性成分检测试剂盒包括引物组合,引物组合包括了SEQ ID NO.1~2所示的用于检测猪源性成分的引物对、SEQ ID NO.3~4所示的用于检测牛源性成分的引物对、SEQ ID NO.5~6所示的用于检测貉源性成分的引物对、SEQ ID NO.7~8所示的用于检测羊源性成分的引物对、SEQ ID NO.9~10所示的用于检测鸡源性成分的引物对、SEQ ID NO.11~12所示的用于检测鸭源性成分的引物对、SEQ ID NO.13~14所示的用于检测兔源性成分的引物对、SEQ ID NO.15~16所示的用于检测狐源性成分的引物对、SEQ ID NO.17~18所示的用于检测貂源性成分的引物对、SEQ ID NO.19~20所示的用于检测驴源性成分的引物对和SEQ ID NO.21~22所示的用于检测鼠源性成分的引物对中的至少三种引物对的组合,这样可对待测样本DNA进行三重或三重以上的PCR,达到可同时扩增三种或三种以上目标DNA序列的目的,并同时在体系中加入不等量的引物,进行非对称PCR扩增,扩增产物与相应的探针杂交显色后,进而可检测出待测样本的动物源性成分,可同时检测猪、牛、羊、鸭、鸡、兔、貉、狐、驴、貂和鼠共11种动物中的至少三种;因此,本发明的动物源性成分检测试剂盒具有单次可检成分多、灵敏度高、速度快以及成本低等特点。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1为本发明的动物源性成分试剂盒的膜芯片上各探针的固定位置模式图;
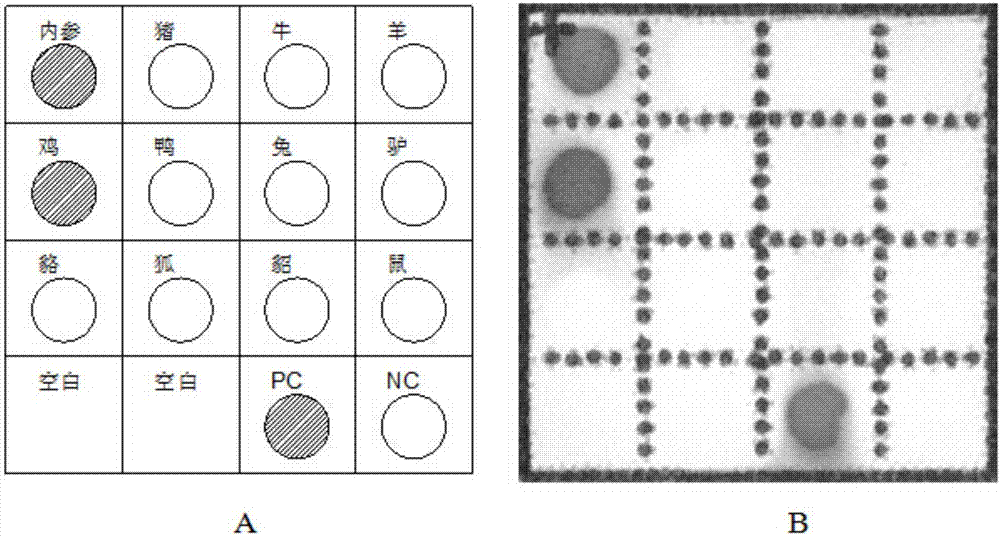
图2为本发明实施例1的待测样本的杂交结果图,其中图2A为膜芯片结果模式图,图2B为待测样本的检测结果图;
图3为本发明实施例2的待测样本的杂交结果图,其中图3A为膜芯片结果模式图,图3B为待测样本的检测结果图;
图4为本发明实施例3的待测样本的杂交结果图,其中图4A为膜芯片结果模式图,图4B为待测样本的检测结果图;
图5为本发明实施例4的待测样本的杂交结果图,其中图5A为膜芯片结果模式图,图5B为待测样本的检测结果图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
下面对本发明实施例的动物源性成分检测试剂盒进行具体说明。
动物源性成分检测试剂盒,其包括用于扩增出单链DNA的Tag引物和引物组合,引物组合包括选自SEQ ID NO.1~2所示的用于检测猪源性成分的引物对、SEQ ID NO.3~4所示的用于检测牛源性成分的引物对、SEQ ID NO.5~6所示的用于检测貉源性成分的引物对、SEQ ID NO.7~8所示的用于检测羊源性成分的引物对、SEQ ID NO.9~10所示的用于检测鸡源性成分的引物对、SEQ ID NO.11~12所示的用于检测鸭源性成分的引物对、SEQ ID NO.13~14所示的用于检测兔源性成分的引物对、SEQ ID NO.15~16所示的用于检测狐源性成分的引物对、SEQ ID NO.17~18所示的用于检测貂源性成分的引物对、SEQ ID NO.19~20所示的用于检测驴源性成分的引物对和SEQ ID NO.21~22所示的用于检测鼠源性成分的引物对中的至少三种引物对的组合,引物组合中的各引物对中的正向引物或反向引物的5’端带有生物素标记。
需要说明的是,引物组合中引物对的组合方式可以是多种,例如可以是选自SEQ ID NO.1~2、SEQ ID NO.3~4、SEQ ID NO.5~6、SEQ ID NO.7~8、SEQ ID NO.9~10、SEQ ID NO.11~12、SEQ ID NO.13~14、SEQ ID NO.15~16、SEQ ID NO.17~18、SEQ ID NO.19~20和SEQ ID NO.21~22所示引物对中的4种、5种、6种、7种、8种、9种、10种,甚至是11种。引物组合中的引物对数量少、成本低、可以节约检测原料;若引物组合中的引物对数量多,可检出的成分指标则多,因此,引物组合中引物对的具体组合方式均可根据实际情况和经济效益进行设计,只要是根据SEQ ID NO.1~2、SEQ ID NO.3~4、SEQ ID NO.5~6、SEQ ID NO.7~8、SEQ ID NO.9~10、SEQ ID NO.11~12、SEQ ID NO.13~14、SEQ ID NO.15~16、SEQ ID NO.17~18、SEQ ID NO.19~20和SEQ ID NO.21~22所示引物对进行组合得到引物组合均属于本发明的保护范围。
上述每种引物对中均包括一正向引物和一反向引物。例如在用于检测猪源性成分的引物对中,SEQ ID NO.1所示的是正向引物的碱基序列,SEQ ID NO.2所示的是反向引物的碱基序列。
在正向引物的5’端或反向引物的5’端标记生物素的作用在于便于得到单链DNA能够更容易和更灵敏地结合到催化酶上。再根据催化酶催化底物的显色和发光来指示检测结果。该催化酶优选为辣根过氧化物酶,底物优选为四甲基联苯胺(TMB)。
较佳地,引物组合中的各引物对中的反向引物的5’端带有生物素标记的。当然,在其他的实施例中也可以是正向引物的5’端带有生物素标记的,均属于本发明的保护范围。
此外,引物组合还包括用于检测内参基因的内参引物对。较佳地,内参基因为18SrRNA基因,内参引物对如SEQ ID NO.23~24所示。SEQ ID NO.23所示的是扩增18SrRNA基因的正向引物,SEQ ID NO.24所示的是扩增18SrRNA基因的反向引物。内参引物对中的反向引物的5’端带有生物素标记。18SrRNA基因是真核生物的保守基因,若检测出18SrRNA基因则说明检测结果相对可靠可信,因此,通过内参引物对的设计,可以提高本发明的试剂盒检测结果的可靠性。需要说明的是,在其他的实施例中,内参基因可以不用是18SrRNA基因,可以是其他的保守基因例如α-珠蛋白的编码基因作为内参基因,再根据内参基因设计出相应的内参引物对即可,也属于本发明的保护范围。
此外,本发明实施例的动物源性成分检测试剂盒还可包括膜芯片,膜芯片为表面固定有探针的支持膜,探针包括SEQ ID NO.25所示的内参探针、SEQ ID NO.26~36所示的检测探针、SEQ ID NO.37所示的阳性探针以及SEQ ID NO.38所示的阴性探针。其中,支持膜可以是硝酸纤维素膜或尼龙膜,或者是聚丙烯膜,或者是硅片等能够起到固相支撑的作用的物质。较佳地,支持膜为硝酸纤维素膜。
另外,SEQ ID NO.26~36中所示的检测探针分别是:SEQ ID NO.26所示的是猪探针,SEQ ID NO.27所示的是牛探针,SEQ ID NO.28所示的是貉探针,SEQ ID NO.29所示的是羊探针,SEQ ID NO.30所示的是鸡探针,SEQ ID NO.31所示的是鸭探针,SEQ ID NO.32所示的是兔探针,SEQ ID NO.33所示的是狐探针,SEQ ID NO.34所示的是貂探针,SEQ ID NO.35所示的是驴探针,SEQ ID NO.36所示的是鼠探针。每种探针与其对应的PCR产物杂交结合,例如猪探针与检测猪源性成分的引物对扩增的PCR产物杂交结合,进而检测出猪源性成分,牛探针与检测牛源性成分的引物对扩增的PCR产物杂交结合,检测出牛源性成分。
本发明的动物源性成分检测试剂盒通过提供多种引引物对的组合进行多重PCR扩增的同时进行非对称PCR扩增技术(Asymmetric PCR)用以提高检测灵敏度。非对称PCR扩增技术是指在PCR扩增过程中采用不等量的正向引物和反向引物(或是扩增延伸条件不同的正向引物和反向引物),PCR扩增后产生大量的单链DNA,该单链DNA可以有效的和固定在支持膜上的探针杂交,从而提高检测灵敏度。
本发明提供的动物源性成分检测试剂盒通过5’端带有生物素标记序列的反向引物或正向引物结合到模板上并延伸扩增得到大量的5’端带有生物素标记的单链DNA,该5’端带有生物素标记的单链DNA通过碱基互补原则对应地与探针杂交,经显色处理后,显示出相应颜色,进而得到检测结果。其检测结果具有特异强、假阳性率低、可视化程度高等特点。其中,阳性探针和阴性探针可用于评判显色结果的可靠性。
较佳地,动物源性成分检测试剂盒还包括辅料,辅料包括dNTPs、EX-Taq聚合酶、5’端带生物素标记的阳性寡核苷酸(positive oligo)单链DNA,阳性寡核苷酸单链DNA的碱基序列如SEQ ID NO.40所示。其中,5’端带生物素标记的阳性寡核苷酸单链DNA可与阳性探针结合,而不与阴性探针结合。因此,在膜芯片上的阳性探针位置有斑点而阴性探针位置没有斑点说明杂交结果可靠,检测结果可信。需要说明的是,动物源性成分检测试剂盒可以包括辅料,也可以不包括辅料,均可根据实际情况进行配置。
较佳地,动物源性成分检测试剂盒还包括配液,配液包括:10×PCR缓冲液(PCR buffer、含镁离子)、预杂交液、杂交液、洗液、封闭液、链霉亲和素标记辣根过氧化物酶和四甲基联苯胺显色液。
其中,链霉亲和素标记的辣根过氧化物酶即为催化酶,四甲基联苯胺为该酶的催化底物,链霉亲和素标记的辣根过氧化物酶,催化甲基联苯胺进行反应而显色,使得检测结果可视化。当然,在其他的实施例中,催化酶可以不是链霉亲和素标记的辣根过氧化物酶,可以是链霉亲和素标记的碱性磷酸酶、链霉亲和素标记的葡萄糖氧化酶等,将四甲基联苯胺换成其相应的底物即可,均属于本发明的保护范围。
综上,本发明采用基于反向斑点杂交的可视化膜芯片技术进行多种动物源性成分检测,其工作原理是首先将针对各种物种特异性序列的单链探针按顺序排列固定于支持膜表面的特定区域,再将待测的多重PCR产物与其杂交,这样PCR产物中的特异性序列单链DNA就会和支持膜上的探针杂交,经洗涤去除未结合的DNA样品,由于待测PCR产物的DNA上带有生物素标记,结合了待测DNA的探针点就偶联上了生物素标记物,再经过相应的显色反应就能读取对应的杂交信号,这样一张膜芯片上就可以同时检测多种动物源性成分。本发明的检测探针为寡核苷酸探针,其顺序排列于支持膜表面的特殊区域,形成低密度探针阵列。膜芯片同待测样本杂交后经底物显色可形成肉眼可视化的检测结果。
因此,本发明的动物源性成分检测试剂盒具有了以下益效果是:1)操作简单,经过一次样本前处理,单管PCR扩增,单芯片杂交就可以同步检测样本中多种动物源性成分,具有平行分析和多重判断的特点;2)检验对象完备,包含了当前市面上常见、常检的动物源性成分检测指标,并且可以很方便的加入新的检测指标;3)系统在多重PCR扩增过程同时进行了非对称PCR扩增,提高了系统的灵敏度和准确性;4)试剂盒采用了可视化膜芯片的检测方式,提高了系统的检测通量,并且检测结果可以直接用肉眼判断,方便,快捷;5)试剂盒操作简单,经济,无需特殊的昂贵仪器,适用于食品中动物源性成分的大规模检测。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例的动物源性成分检测试剂盒包括引物组合以及膜芯片。
其中,本实施例的引物组合包括12种引物对,各引物对的正向引物和反向引物的碱基序列5’-3’如下:
用于检测猪源性成分的引物对:
正向引物:ACCGTAGGAATAGACGTG(SEQ ID NO.1),反向引物:TGAAGCCCAGAGCTCATAG(SEQ ID NO.2);
用于检测牛源性成分的引物对:
正向引物:TTACAACAATTATCAACATAA(SEQ ID NO.3),反向引物:CCGGGTCGAAGAAGGTTGTA(SEQ ID NO.4);
用于检测貉源性成分的引物对:
正向引物:GCCTGAAGTGTACCTCTT(SEQ ID NO.5),反向引物:TGTGATCATGGGCTGATT(SEQ ID NO.6);
用于检测羊源性成分的引物对:
正向引物:GGCCTATACTATGGATCATATAC(SEQ ID NO.7),反向引物:AATTGCTGAAAGGAGGTTGGT(SEQ ID NO.8);
用于检测鸡源性成分的引物对:
正向引物:CCACCTCACCTTCCTACAC(SEQ ID NO.9),反向引物:GAAATGGAATTTTGTCA(SEQ ID NO.10);
用于检测鸭源性成分的引物对:
正向引物:ACAGAAGGAAACCGAA(SEQ ID NO.1),反向引物:TCCGATGATCACGTGGAGTCC(SEQ ID NO.2);
用于检测兔源性成分的引物对:
正向引物:GAAACTGGCTCCAACAAC(SEQ ID NO.13),反向引物:AAGGAAACCTAGGGTGTCTTTG(SEQ ID NO.14);
用于检测狐源性成分的引物对:
正向引物:TTTGCCCACTGATTCCCCTT(SEQ ID NO.15),反向引物:CATGTTCACCCCTACGAATAT(SEQ ID NO.16);
用于检测貂源性成分的引物对:
正向引物:GTCATCTCAGCACTAGCAG(SEQ ID NO.17),反向引物:TAGGGGTGAAAGGGGATTT(SEQ ID NO.18);
用于检测驴源性成分的引物对:
正向引物:TACGCTCCATTCCCAACAAA(SEQ ID NO.19),反向引物:TTTTGACATGTGTAGGGTAGGG(SEQ ID NO.20);
用于检测鼠源性成分的引物对:
正向引物:ACATACGAAAAACACACC(SEQ ID NO.21),反向引物:TCCTAGAAGGGACCCAA SEQ ID NO.22);
用于检测18SrRNA基因的内参引物对:
正向引物:AGCCTGAGAAACGGCTACC(SEQ ID NO.23),反向引物:TGCTGGCACCAGACTTGC(SEQ ID NO.24)。
其中,每个引物对中的反向引物的5’端带有生物素标记。
另外,膜芯片为表面固定有探针的支持膜。支持膜是硝酸纤维素膜,探针包括14种,各探针的碱基序列5’-3’如下:
内参探针:TGCGCGCCTGCTGCCTTCCT(SEQ ID NO.25)。
检测探针包括如下:
猪探针:
GAGCATACTTTACATCTGCCACAATAATCATTGCTATTCCC(SEQ ID NO.26);
牛探针:AACCCCTCTATTCGTATGATCCG(SEQ ID NO.27);
貉探针:CGAGAAACCATCAACCCTTGCCTGAAG(SEQ ID NO.28);
羊探针:TGGATCATATACCTTCCTAGAAACATG(SEQ ID NO.29);
鸡探针:CCTAGGCATCTCATCCGACTC(SEQ ID NO.30);
鸭探针:ACCGCCCTACAAGCAATAGAGTACCATG(SEQ ID NO.31);
兔探针:ACAACCCCACAGGAATTCCTTCAAAC(SEQ ID NO.32);
狐探针:GGGCTACACCCTAAATGACACCTG(SEQ ID NO.33);
貂探针:GGAATCCCATCTGATTCAGAC(SEQ ID NO.34);
驴探针:GCCCTTATCCTTTCCATCTTAATCCTAG(SEQ ID NO.35);
鼠探针:AAAATTATTAACCACTCAT(SEQ ID NO.36)。
阳性探针(positive probe):
GCATCCAGATCAGAAGCAATAATGAGCAGTGCGAGAAGAACGAGTGTCCAAAGTACCAG(SEQ ID NO.37)
阴性探针(negative probe):
GGTTCCTTGAGAAATGTTTTACGGGATTACTTCCATGTTTGTTGGATGATCCTATTTTC(SEQ ID NO.38)。
上述14种探针按图1所示的位置顺序地分别固定在支持膜上的相应位置。在其他的实施例中,探针的固定顺序可与本实施例有所不同。
通过相应的多重PCR引物设计,采用固相亚磷酰胺三酯法合成得到上述用于12重PCR的引物对。根据多重PCR扩增产物设计检测探针,采用固相亚磷酰胺三酯法合成探针,以及可与阳性探针杂交结合的5’端带生物素标记的阳性寡核苷酸单链DNA,5’端带生物素标记的阳性寡核苷酸单链DNA(positive oligo)的碱基序列如下:
5'-biotin-CTGGTACTTTGGACACTCGTTCTTCTCGCACTGCT CATTATTGCTTCTGATCTGGATGC-3'(SEQ ID NO.39)。
本实施例以市面上购得的鸡肉粉,作为待测样本,用本实施例提供的动物源性成分检测试剂盒检测其动物源性成分。具体步骤如下。
1.制备膜芯片
将支持膜裁成1.2cm×1.8cm的膜条,裁好的膜条于双蒸水中浸泡15min,再用15×SSC浸泡15min,取出,置于滤纸上,60℃烘1.5hour,待膜条降温到室温后,将内参探针(5uM)、11种检测探针(5uM)、阳性探针(5uM)以及阴性探针(5uM),按图1所示(图1中,“内参”代表内参探针的固定位置、“猪”代表猪探针的固定位置、“牛”代表牛探针的固定位置、“羊”代表羊探针的固定位置、“鸡”代表鸡探针的固定位置、“鸭”代表鸭探针的固定位置、“兔”代表兔探针的固定位置、“驴”代表驴探针的固定位置、“貉”代表貉探针的固定位置、“狐”代表狐探针的固定位置、“貂”代表貂探针的固定位置、“鼠”代表鼠探针的固定位置、“PC”代表阳性探针的固定位置、“NC”代表阴性探针的固定位置)的顺序将各探针点在膜条相应的位置上,膜条晾干后,置于80℃烘2小时以固定探针,处理好的膜芯片室温干燥处保存。
2.多重PCR
2.1按照CTAB法提取待测样本的基因组DNA,每50mg待测样本经DNA提取后,并用微量核酸测定仪将DNA溶液稀释至同一质量浓度(100-200ng/μl),得到待测样本的DNA模板(100-200ng/μl)。
2.2多重PCR体系和条件
PCR扩增的反应体系:
10×PCR Buffer:5μl;
dNTP(2.5mM each):5μl;
正向引物(20μM):0.5μl,
反向引物(20μM):0.6μl,(本实施例的引物组合12种引物对都加入至一个体系中);
EX-Taq Polymerase(Takara,5U/μl):0.5μl;
待测样本的DNA模板(100ng/μl):2μl;
加ddH2O至总体积50μl。
对上述反应体系进行PCR循环扩增,PCR反应条件如下:
预变性:温度95℃、时间10分钟;变性:温度95℃、时间45秒,退火:温度55℃、时间30秒,延伸:温度72℃、时间30秒,30个循环;最后延伸:温度72℃、时间10分钟。得到多重PCR产物。
3得到多重PCR产物后,进行膜芯片斑点杂交检测,具体如下。
3.1预杂交:膜条于42℃预杂交液(5×SSC,0.1%SDS(十二烷基磺酸钠),10×Denhardt’s)中预杂交1小时,之后将膜条放于2ml杂交液(5×SSC,0.1%SDS,5×Denhardt’s,50%去离子甲酰胺,100μg/ml酵母tRNA)中42℃,1小时。
3.2杂交:取40μl多重PCR产物,并加入1μl上述的5’端生物标记的阳性寡核苷酸单链DNA(10uM),100℃水浴变性5分钟后置于冰上,之后加入2ml杂交液中,42℃杂交16小时。用洗液1(2×SSC,0.1%SDS)、洗液2(0.5×SSC,0.1%SDS)42℃各洗膜条两次,每次10分钟。
3.3封闭:将膜条置于封闭液(3%BSA(牛血清白蛋白),100mM Tris-HCl,PH7.5,150mM NaCl)中37℃封闭30分钟,之后将膜条放到酶联液(用封闭液1:5000稀释链霉亲和素标记的辣根过氧化物酶)中37℃,30分钟。
3.4显色:用洗液3(100mM Tris-HCl,PH7.5,150mM NaCl)、洗液4(100mM Tris-HCl,PH9.5,100mM NaCl,100mM MgCl2)各漂洗膜条3次,每次5分钟,之后将膜条放入TMB显色液(100mM柠檬酸钠PH5.4,0.1mg/ml四甲基联苯胺TMB,1:1600体积比的H2O2(3%))中,避光显色10~15分钟,依照杂交点的显色情况判定结果,检测结果如图2所示。
由图2B可知,膜芯片在含鸡探针的位置有斑点,同时含内参探针和阳性探针的位置也有斑点,说明本实施例中待测样本中含鸡肉成分,不含猪、牛、羊、鸭、兔、驴、狐、貂以及鼠成分,检测结果可靠可信。
需要说明的是,本实施例中所用辅料(dNTPs、EX-Taq聚合酶、5’端带生物素标记的阳性寡核苷酸单链DNA)和配液(PCR缓冲液、预杂交液、杂交液、洗液、封闭液、链霉亲和素标记辣根过氧化物酶和四甲基联苯胺显色液)为外购或自配,百分比为重量百分比。还有,在其他的实施例中,动物源性成分检测试剂盒可以进包括引物组合。
实施例2
本实施例的动物源性成分检测试剂盒包括引物组合、膜芯片、以及辅料。其中,辅料包括dNTPs、EX-Taq聚合酶(Polymerase)和5’端带生物素标记的阳性寡核苷酸单链DNA以及PCR缓冲液(含镁离子),该5’端带生物素标记的阳性寡核苷酸单链DNA的碱基序列如SEQ ID NO.39所示。其余同实施例1。
采用本实施例的动物源性成分检测试剂盒对待测样本-香肠(市面所购)进行检测,检测步骤同实施例1,检测结果如图3所示。由图3B可知,膜芯片上含猪探针的位置有斑点,同时含内参探针和阳性探针的位置也有斑点,说明本实施例中待测样本中含猪肉成分,不含牛、羊、鸡、鸭、兔、驴、狐、貂以及鼠成分,检测结果可靠。
实施例3
本实施例的动物源性成分检测试剂盒包括引物组合、膜芯片、辅料和配液。配液包括预杂交液、杂交液、洗液、封闭液、链霉亲和素标记的辣根过氧化物酶和四甲基联苯胺(TMB)显色液。
其中,预杂交液为5×SSC,0.1%SDS和10×Denhardt’s;杂交液为5×SSC,0.1%SDS,5×Denhardt’s,50%去离子甲酰胺和100μg/ml酵母tRNA。
洗液包括洗液1、洗液2、洗液3、以及洗液4。其中,洗液1:2×SSC和0.1%SDS,洗液2:0.5×SSC和0.1%SDS,洗液3:100mM Tris-HCl,PH7.5,150mM NaCl,洗液4:100mM Tris-HCl,PH9.5,100mM NaCl和100mM MgCl2。
封闭液为3%BSA,100mM Tris-HCl,PH7.5,150mM NaCl;四甲基联苯胺显色液由四甲基联苯胺显色液A液和四甲基联苯胺显色液B液混合得到。其中,四甲基联苯胺显色液A液:200mM柠檬酸钠PH5.4,0.2mg/ml四甲基联苯胺;四甲基联苯胺显色液B液:3%H2O2用800体积的双蒸水稀释液,使用前A液和B液等量混合配成四甲基联苯胺显色液。其余同实施例1。
采用本实施例的动物源性成分检测试剂盒对待测样本-火腿肠进行检测,检测步骤同实施例1,检测结果如图4所示。由图4B可知,膜芯片在含猪针的位置和鸡探针的位置有斑点,同时含内参位置和阳性探针的位置也有斑点,说明本实施例中待测样本中同时含猪肉成分和鸡肉,检测结果可靠。
实施例4
本实施例的动物源性成分检测试剂盒包括引物组合、膜芯片、辅料和配液。具体地,本实施例的动物源性成分检测试剂盒包括:
多重PCR扩增试剂一管600μl,每48μl试剂可检测一个DNA样本,每48μl扩增体系构成如下:
10×PCR Buffer(含镁离子):5μl,
dNTP(2.5mM each):5μl,
12种引物(20μM):上游引物各0.5μl、下游引物各0.6μl,
EX-Taq Polymerase(5U/μl):0.5μl,
ddH2O加至48μl。
每一样本检测需要吸取48μl扩增试剂,加入2μl待测样本的DNA(约50ng/μl)。
5’端生物素标记的阳性寡核苷酸单链DNA(10uM)一管15μl。
预杂交液(5×SSC,0.1%SDS,10×Denhardt’s液)一瓶30ml。杂交液(5×SSC,0.1%SDS,5×Denhardt’s液,50%去离子甲酰胺,100μg/ml酵母tRNA)一瓶30ml。
洗液1(2×SSC,0.1%SDS)10倍浓缩液一瓶12ml,使用前加108ml ddH2O。洗液2(0.5×SSC,0.1%SDS)10倍浓缩液一瓶12ml,使用前加108ml ddH2O。洗液3(100mM Tris-HCl,PH7.5,150mM NaCl)10倍浓缩液一瓶18ml,使用前加162ml ddH2O。洗液4(100mM Tris-HCl,PH9.5,100mM NaCl,100mM MgCl2)10倍浓缩液一瓶18ml,使用前加162ml ddH2O。
封闭液/酶联液(3%BSA,100mM Tris-HCl,PH7.5,150mM NaCl)一瓶60ml。链霉亲和素标记的辣根过氧化物酶(1mg/ml)一管5μl,使用前用封闭液1:5000稀释成酶联液。
TMB显色液A液(200mM柠檬酸钠PH5.4,0.2mg/ml四甲基联苯胺TMB)一瓶15ml。TMB显色液B液(1:800体积比的H2O2(3%))一瓶15ml。使用前A液B液等量混合配成TMB显色液。
采用本实施例的动物源性成分检测试剂盒对待测样本-羊肉串(市购)检测,检测结果如图5所示。由图5B可知,膜芯片在含猪探针的位置和羊探针的位置有斑点,同时含内参探针和阳性探针的位置也有斑点,说明本实施例中待测样本中同时含猪肉成分和羊肉成分,检测结果可靠。
综上所述,本发明提供的动物源性成分试剂盒能够同时对猪、牛、貉、羊、鸡、鸭、兔、狐、貂、驴以及鼠等11种动物源成分进行检测,11对引物对能够进行11重PCR,而不发生非特异性扩增,特异性强,探针能够与对应的PCR产物特异性杂交,灵敏度高,假阳性率非常低,且通过内参探针、阳性探针和阴性探针的设置,确保检测结果可靠可信,且检测结果可视化程度高,直接用肉眼即可进行判断,成本低,适用于各种食品的动物源成分的大规模检测。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!