检测禽流感病毒亚型的荧光定量PCR引物、探针和试剂盒及检测方法与流程
本发明属于生物工程技术领域,具体涉及检测禽流感病毒的荧光定量PCR引物、探针和试剂盒及检测方法。
背景技术:
流感病毒(influenza virus)属正粘病毒科,其基因组为分节段的单股负链RNA,按照M蛋白和NP蛋白的特征,流感病毒分为甲(A)、乙(B)、丙(C)型,其中A型流感病毒除了感染人外,还可感染家禽,使感染的家禽患禽流感(avian influenza,AI)。根据AIV的血凝素(HA)和神经氨酸酶(NA)抗原差异,AIV可分为16个HA亚型(H1~H16)和9个NA亚型(N1~N9)。1918年西班牙流感由H 1N1亚型引起,造成约5000万人死亡;1957年由H2N2亚型引起的“亚洲流感”造成约280万人死亡;1968年由H3N2引起的“香港流感”造成约100万人死亡。因此,流感病毒能给人类、自然和社会带来严重的危害,所以,对流感病毒的鉴定和早期诊断是非常有重要的。
随着分子生物的发展,荧光定量PCR技术广泛应用于实验室病毒病的诊断中,例如,张磊等人报道为了预防和控制北京地区甲型流感蔓延,采用实时荧光定量检测方法对流感样病例咽拭子中检测甲型流感病毒,以了解甲型流感病毒在该地区的流行情况(2009~2010年北京地区甲型流感检测分析,张磊,中国病原生物学杂志,2011,6(2),104~107)。而家禽中,主要流行的是H9N2、H5N1以及H7N3亚型流感病毒,具有致病性强,危害极大,高致病性禽流感可导致高达100%的发病率和病死率,并可直接感染人并致人死亡。秦智峰等人对致病性强的H5、H7、H9亚型禽流感病毒进行同时集成化快速检测,结果与经典检测方法的符合率达100%,但是检测结果H5、H7、H9亚型的敏感性分别为1000、1000、500个拷贝数,敏感性较低。
技术实现要素:
有鉴于此,本发明的目的在于提供一种检测禽流感病毒的引物、探针和荧光定量PCR检测方法及应用,检测敏感性高、特异性好,并且同时能进行H5、H7及H9亚型流感病毒分型鉴定。
为了实现上述发明目的,本发明提供以下技术方案:
本发明提供了检测H5、H7和H9亚型流感病毒的多重荧光定量PCR引物和探针,所述引物和探针包括以下序列:
所述H9亚型流感病毒的探针具有如SEQ ID No.1所示的核苷酸序列;
所述H9亚型流感病毒的正向引物具有如SEQ ID No.2所示的核苷酸序列;
所述H9亚型流感病毒的反向引物具有如SEQ ID No.3所示的核苷酸序列;
所述H7亚型流感病毒的探针具有如SEQ ID No.4所示的核苷酸序列;
所述H7亚型流感病毒的正向引物具有如SEQ ID No.5所示的核苷酸序列;
所述H7亚型流感病毒的反向引物具有如SEQ ID No.6所示的核苷酸序列;
所述H5亚型流感病毒的探针具有如SEQ ID No.7所示的核苷酸序列;
所述H5亚型流感病毒的正向引物具有如SEQ ID No.8所示的核苷酸序列;
所述H5亚型流感病毒的反向引物具有如SEQ ID No.9所示的核苷酸序列。
本发明还提供了一种同时检测H5、H7和H9亚型流感病毒的多重荧光定量PCR试剂盒,包括2×缓冲液、阳性质粒标准品和权利要求1所述的H5、H7和H9亚型流感病毒的引物对和探针。
优选的,还包括流感病毒M基因的正向引物、流感病毒M基因的反向引物和流感病毒M基因的探针。
优选的,所述流感病毒M基因的如SEQ ID No.10所示的探针核苷酸序列;所述M基因正向引物如SEQ ID No.11所示的核苷酸序列;所述M基因的反向引物如SEQ ID No.12所示的核苷酸序列。
优选的,包括2×缓冲液10ml,4nmol/μl正向引物4μl,4nmol/μl反向引物4μl,1nmol/μl探针4μl,共4种探针,阳性质粒标准品1ml。
本发明还提供了所述引物和探针或者所述的试剂盒检测H5、H7和H9亚型流感病毒的方法,包括以下步骤:
(1)提取待检测样品的RNA,将所述RNA经反转录得到cDNA;
(2)以所述步骤(1)中的cDNA或者阳性质粒为模板,与探针建立反应体系,进行多重荧光定量PCR扩增,得到荧光曲线和Ct值;
(3)根据所述步骤(2)中得到的荧光曲线和Ct值,得到样品中的流感病毒亚型类别。
优选的,所述多重荧光定量PCR扩增的反应体系:2×缓冲液10μl,40pmol/μl正向引物0.4μl,40pmol/μl反向引物0.4μl,10pmol/μl探针各0.2μl/种,共4种探针,阳性质粒标准品或样品cDNA 1μl,补DEPC水至20μl。
优选的,所述多重荧光定量PCR扩增的反应程序:95℃变性5min,以95℃5s,54℃20s,40个循环,在54℃进行荧光检测。
优选的,所述阳性质粒标准品的制备方法包括以下步骤:
A、分别提取H5、H7和H9亚型流感病毒样本的总RNA;
B、将所述步骤A中得到的H5、H7和H9亚型流感病毒的总RNA分别进行反转录,得到H5、H7和H9亚型流感病毒的cDNA;
C、采用SEQ IDNo.13和SEQ ID No.14所示的核苷酸序列分别作为上游引物和下游引物扩增H5亚型流感病毒特异性目标片段,采用SEQ ID No.15和SEQ ID No.16所示的核苷酸序列分别作为上游引物和下游引物扩增H7亚型流感病毒特异性目标片段,采用SEQ ID No.17和SEQ ID No.18所示的核苷酸序列分别作为上游引物和下游引物扩增H9亚型流感病毒特异性目标片段,采用SEQ ID No.19和SEQ ID No.20所示的核苷酸序列分别作为上游引物和下游引物扩增流感病毒M基因的特异性目标片段,得到H5,H7,H9亚型流感病毒和流感病毒M基因特异性目的片段;
D、将所述步骤C得到的H5、H7特异性目的片段融合成H5-H7融合片段,将得到的H9和M基因特异性目的片段融合成一条H9-M融合片段,再将H5-H7融合片段和H9-M融合片段融合成一条H5-H7-H9-M片段,将所述H5-H7-H9-M片段连接到pMD18T载体上转入大肠杆菌中,得到阳性质粒标准品。
优选的,所述步骤D中H5-H7融合片段的融合的体系为:2mmol/L超高保真DNA聚合酶缓冲液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L dNTP(每种)1μl,100ng/μl的H5亚型流感病毒的特异性目的片段1μl,100ng/μlH7亚型流感病毒的特异性目的片段1μl,10μmol/L上下游引物各2μl,灭菌水17μl,总体系为50μl。
优选的,所述步骤D中H9-M融合片段的融合的体系优选为用2mmol/L的超高保真DNA聚合酶缓冲液25μl,1U/μl超高保真DNA聚合酶1μl,10mmol/L的dNTP(每种)1μl,100ng/μl的H9亚型流感病毒的特异性目的片段1μl,100ng/μl的流感病毒M基因的特异性目的片段1μl,10μmol/L上下游引物各2μl,灭菌水17μl,总体系为50μl。
优选的,所述步骤D中H5-H7-H9-M片段的融合的体系优选为用2mmol/L超高保真DNA聚合酶缓冲液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L的dNTP(每种)1μl,100ng/μl的H5-H7融合片段1μl,100ng/μl的H9-M融合片段1μl,10μmol/L的上下游引物各2μl,灭菌水17μl,总体系为50μl。
本发明提供了检测H5、H7和H9亚型流感病毒的多重荧光定量PCR引物和探针,所述引物结合探针能采用多重荧光定量PCR同时检测H5、H7和H9亚型流感病毒具体为哪种亚型,不同亚型的引物之间互相没有影响,并且特异性强,检测灵敏度为10~50拷贝数,对靶序列可以准确定量、定性检测,重复性好,可信度高。
本发明提供的一种同时检测H5、H7和H9亚型流感病毒的多重荧光定量PCR试剂盒,包括缓冲液、引物对、探针和阳性质粒标准品,所述试剂盒能准确同时检测待测样品为H5、H7和H9亚型流感病毒中的哪种亚型;所述试剂盒检测灵敏度为10~50拷贝数,敏感度高,特异性强,不仅能够定性检测还能定量检测,满足高标准的要求;所述试剂盒中各引物和探针不交叉,对检测结果没有任何影响。
本发明提供的所述引物和探针或者所述的试剂盒检测H5、H7和H9亚型流感病毒的方法,具有特异性强,灵敏度高的特点,同时具有良好的稳定性。另外,本发明提供的方法采用基因融合的质粒做阳性标准品,避免多次更换阳性标准品的繁琐操作,大大缩短检测时间和检测次数,样品可在2小时内完成检测,同时采用标准阳性质粒得到的标准曲线其相关系数R2=0.999,扩增效率均是109%,说明得到的标准曲线的线性关系很好,确保得到准确地检测结果。
附图说明
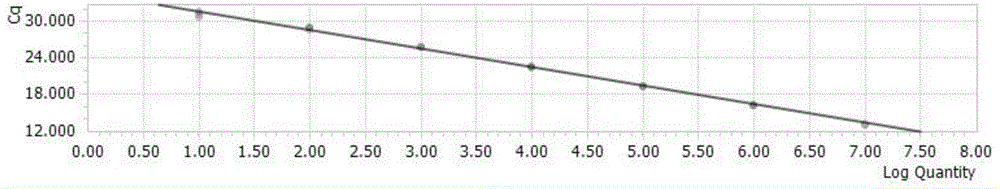
图1为本发明实施例1中H9亚型流感病毒标准曲线;
图2为本发明实施例1中H7亚型流感病毒标准曲线;
图3为本发明实施例1中H5亚型流感病毒标准曲线;
图4为本发明实施例1中流感病毒M基因的标准曲线;
图5为本发明实施例1中H9亚型流感病毒的扩增曲线;
图6为本发明实施例1中H7亚型流感病毒的扩增曲线;
图7为本发明实施例1中H5亚型流感病毒的扩增曲线;
图8为本发明实施例1中流感病毒M基因的扩增曲线;
图9为本发明实施例3中引物探针具有特异性。
具体实施方式
本发明提供了检测H5、H7和H9亚型流感病毒的多重荧光定量PCR引物和探针,所述引物和探针包括以下序列:
所述H9亚型流感病毒的探针具有如SEQ ID No.1所示的核苷酸序列;
所述H9亚型流感病毒的正向引物具有如SEQ ID No.2所示的核苷酸序列;
所述H9亚型流感病毒的反向引物具有如SEQ ID No.3所示的核苷酸序列;
所述H7亚型流感病毒的探针具有如SEQ ID No.4所示的核苷酸序列;
所述H7亚型流感病毒的正向引物具有如SEQ ID No.5所示的核苷酸序列;
所述H7亚型流感病毒的反向引物具有如SEQ ID No.6所示的核苷酸序列;
所述H5亚型流感病毒的探针具有如SEQ ID No.7所示的核苷酸序列;
所述H5亚型流感病毒的正向引物具有如SEQ ID No.8所示的核苷酸序列;
所述H5亚型流感病毒的反向引物具有如SEQ ID No.9所示的核苷酸序列。
本发明提供了检测H5、H7和H9亚型流感病毒的多重荧光定量PCR引物和探针,所述引物具有特异性强、灵敏度高,对靶序列准确定性检测,重复性好,可信度高的特点。
本发明中,所述引物和探针的来源均是利用引物设计软件得到的。本发明中,所述引物设计优选包括以下步骤:根据GenBank中禽流感病毒AIV的H5、H7和H9亚型禽流感病毒血凝素基因序列,用DNAMAN软件进行同源性分析,采用Primer Express5.0软件,在其保守区域设计特异性引物和TaqMan荧光探针。
在本发明中,本发明对引物合成没有特殊限制,采用本领域技术人员所熟知的合成方法即可。在本发明实施例中,所述特异性引物的合成委托专业的引物合成机构合成得到。
在本发明中,所述探针为TaqMan荧光探针。所述的TaqMan荧光探针标记一个报告荧光基团和一个淬灭荧光基团。
本发明中,所述报告荧光基团优选为FAM,JOE,Cy5和ROX,且4种探针标记不同的报告基团以区别不同亚型流感病毒荧光定量PCR的荧光信号;所述淬灭荧光基团优选为BHQ1和BHQ2。
本发明还提供了一种同时检测H5、H7和H9亚型流感病毒的多重荧光定量PCR试剂盒,包括缓冲液、阳性质粒标准品和权利要求1所述的H5、H7和H9亚型流感病毒的引物对和探针。
本发明提供的所述试剂盒能准确同时检测待测样品为H5、H7和H9亚型流感病毒中的哪种亚型,所述试剂盒检测敏感度高,特异性强,不仅能够定性检测还能定量检测,满足高标准检测的要求。
在本发明中,所述试剂盒还包括流感病毒M基因的正向引物、流感病毒M基因的反向引物和流感病毒M基因的探针。所述流感病毒M基因的探针具有如SEQ ID No.10所示的核苷酸序列;所述M基因正向引物如SEQ IDNo.11所示的核苷酸序列;所述M基因的反向引物如SEQ ID No.12所示的核苷酸序列。所述M基因引物及探针参照禽流感病毒实验室操作标准获得。
在本发明中,所述试剂盒包括2×缓冲液。本发明对所述缓冲液的pH值没有特殊要求,采用本领域技术人员所熟知的用于荧光定量PCR的缓冲液的pH值即可。
在本发明中,所述2×缓冲液优选包含Taq酶和dNTP的荧光定量PCR用缓冲液。本发明对所述缓冲液的种类没有特殊限制,采用本领域技术人员所熟知的缓冲液的种类即可。本发明实施例中,所述缓冲液选用TaKaRa公司的Premix Ex Taq(probe qPCR)缓冲液,货号为RR390。
在本发明中,所述试剂盒中提供了各组分的规格。本发明中,所述各组分的体积优选为2×缓冲液10ml,4nmol/μl正向引物4μl,4nmol/μl反向引物4μl,1nmol/μl探针各4μl,共4种探针,阳性质粒标准品1ml。
在本发明中,所述阳性质粒标准品的来源为发明人制备得到。
在本发明中,所述阳性质粒标准品的制备方法优选包括以下步骤:
A、分别提取H5、H7和H9亚型流感病毒样本的总RNA;
B、将所述步骤A中得到的H5、H7和H9亚型流感病毒的总RNA分别进行反转录,得到H5、H7和H9亚型流感病毒的cDNA;
C、以所述步骤B得到的cDNA为模版,采用SEQ ID No.13和SEQ ID No.14所示的核苷酸序列分别作为上游引物和下游引物扩增H5亚型流感病毒特异性目标片段,采用SEQ ID No.15和SEQ ID No.16所示的核苷酸序列分别作为上游引物和下游引物扩增H7亚型流感病毒特异性目标片段,采用SEQ ID No.17和SEQ ID No.18所示的核苷酸序列分别作为上游引物和下游引物扩增H9亚型流感病毒特异性目标片段,采用SEQ ID No.19和SEQ ID No.20所示的核苷酸序列分别作为上游引物和下游引物扩增流感病毒M基因特异性目标片段,得到H5,H7,H9亚型流感病毒和流感病毒M基因特异性目的片段;
D、将所述步骤C得到的H5、H7特异性目的片段融合成H5-H7融合片段,将得到的H9和M基因特异性目的片段融合成一条H9-M融合片段,再将H5-H7融合片段和H9-M融合片段融合成一条H5-H7-H9-M融合片段,将所述H5-H7-H9-M片段连接到pMD18T载体上转入大肠杆菌中,得到阳性质粒标准品。
在本发明中,所述步骤D中H5-H7融合片段的融合体系优选为:2mmol/L超高保真DNA聚合酶缓冲液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L dNTP(每种)1μl,100ng/μl的H5亚型流感病毒的特异性目的片段1μl,100ng/μl H7亚型流感病毒的特异性目的片段1μl,10μmol/L上下游引物各2μl,灭菌水17μl,总体系为50μl。
在本发明中,所述步骤D中H9-M融合片段的融合的体系优选为用2mmol/L的超高保真DNA聚合酶缓冲液25μl,1U/μl超高保真DNA聚合酶1μl,10mmol/L的dNTP(每种)1μl,100ng/μl的H9亚型流感病毒的特异性目的片段1μl,100ng/μl的流感病毒M基因的特异性目的片段1μl,10μmol/L上下游引物各2μl,灭菌水17μl,总体系为50μl。
在本发明中,所述步骤D中H5-H7-H9-M片段的融合的体系优选为用2mmol/L超高保真DNA聚合酶缓冲液25μl,1U/μl的超高保真DNA聚合酶1μl,10mmol/L的dNTP(每种)1μl,100ng/μl的H5-H7融合片段1μl,100ng/μl的H9-M融合片段1μl,10μmol/L的上下游引物各2μl,灭菌水17μl,总体系为50μl。
在本发明中,所述步骤D中融合的程序具体优选为:95℃预变30s;95℃变性15s,54℃退火15s,72℃延伸1min,扩增30个循环;72℃总延伸5min。
在本发明中,所述融合成H5-H7融合片段所用的引物优选为SEQ ID No.14所示的核苷酸序列和SEQ ID No.15所示的核苷酸序列进行融合。
在本发明中,所述融合成H9-M基因融合片段所用的引物优选为SEQ ID No.18所示的核苷酸序列和SEQ ID No.19所示的核苷酸序列进行融合。
在本发明中,H5-H7-H9-M融合片段所用的引物优选为SEQ ID No.16所示的核苷酸序列和SEQ ID No.17所示的核苷酸序列进行融合。
在本发明中,所述阳性质量标准品通过菌落PCR的方法进行验证。本发明对所述菌落PCR的方法没有特殊限制,采用本领域技术人员所熟知的菌落PCR的方法进行验证即可。
得到阳性菌后,本发明将得到的阳性质粒标准品送样测序以确定得到的阳性质粒标准品为包含有H5-H7-H9-M融合片段的阳性质粒,然后对阳性菌进行质粒提取,得到阳性质粒标准品。
得到阳性质粒标准品后,本发明对所述阳性质粒标准品进行浓度测定,得到一定拷贝数的阳性质粒标准品。
在本发明中,所述测定质粒浓度没有特殊限制,采用本领域技术人员所熟知的质粒测定浓度的方法即可。在本发明,实施例中测定质粒浓度通过采用Eppendorf公司公司生产的型号为NanoDrop2000的核酸测定仪进行测定质粒浓度。
在本发明中,所述一定拷贝数的阳性质粒的计算公式优选为拷贝数(copies)=(质量/分子量)×6.0×1023。所述一定拷贝数的阳性质粒标准品的浓度为以10倍系列稀释阳性质粒标准品至下限达100拷贝数/ul,上限达107拷贝数/ul。
在本发明中,所述正向引物是包括H5、H7和H9亚型禽流感病毒血凝素基因的正向引物和禽流感病毒M基因的正向引物。所述H5、H7和H9亚型禽流感病毒血凝素基因的正向引物和禽流感病毒M基因的正向引物盛装在正向引物试剂瓶中,形成体积为4μl,质量浓度为4nmol/μl的正向引物,每种正向引物的浓度为1nmol/μl。
在本发明中,所述反向引物是包括H5、H7和H9亚型禽流感病毒血凝素基因的反向引物和禽流感病毒M基因的反向引物。所述H5、H7和H9亚型禽流感病毒血凝素基因的反向引物和禽流感病毒M基因的反向引物盛装在一个反向引物的试剂瓶中,形成体积为4μl,质量浓度为4nmol/μl的正向引物,每种反向引物的浓度为1nmol/μl。
在本发明中,所述探针是包括H5、H7和H9亚型禽流感病毒血凝素基因的探针和禽流感病毒M基因的探针。所述H5、H7和H9亚型禽流感病毒血凝素基因的探针和禽流感病毒M基因的探针分别盛装在单独的试剂瓶中,共4瓶探针,每瓶探针的体积为1μl,质量浓度为1nmol/μl的探针。
本发明还提供了所述引物和探针或者所述的试剂盒检测H5、H7和H9亚型流感病毒的方法,包括以下步骤:
(1)提供待检测样品的RNA,将所述RNA经反转录得到cDNA;
(2)以所述步骤(1)中的cDNA或者阳性质粒标准品为模板,与引物对和探针建立反应体系,进行多重荧光定量PCR扩增,得到荧光曲线和Ct值;
(3)根据所述步骤(2)中得到的荧光曲线和Ct值,得到样品中的流感病毒亚型类别。
本发明提供的所述引物和探针或者所述的试剂盒检测H5、H7和H9亚型流感病毒的方法,所述方法具有特异性强,灵敏度高、稳定性好的特点;同时检测时间短,检测次数少,得到的检测结果准确度好。
首先提取待检测样品的RNA,将所述RNA经反转录得到cDNA。
在本发明的实施例中,所述检测样品为2015年4月到2016年1月采自浙江余姚地区的100份鸡病变组织。
在本发明中,所述RNA提取的方法没有特殊限制,采用本领域技术人员所熟知的RNA提取方法即可。本发明实施例中,所述RNA提取的方法采用的是Trizol法。
在本发明中,所述反转录具体步骤优选为:取总RNA 10.5μl加入20μl反转录体系中,所述反转录体系包含4μl 5×反转录缓冲液、2μl 10mmol/L dNTP、1μl 50mmol/L反转录引物、2μl 5μ/μl反转录酶和0.5μl 40μ/μl RNA酶抑制剂,轻轻混匀后于42℃水浴1h,最后冰浴2min,得到cDNA。
得到cDNA后,本发明以cDNA或阳性质粒标准品为模版,与引物对和探针建立反应体系,进行多重荧光定量PCR扩增,得到荧光曲线和Ct值。
在本发明中,所述引物对包括序列表中H9亚型流感病毒中SEQ ID No.2、SEQ IDNo.3所示核苷酸序列,H7亚型流感病毒中SEQ ID No.5、SEQ ID No.6所示核苷酸序列、H5亚型流感病毒中SEQ ID No.8、SEQ ID No.9所示核苷酸序列和流感病毒M基因中SEQ ID No.11、SEQ ID No.12所示核苷酸序列。
在本发明中,所述探针包括序列表中H9亚型流感病毒中SEQ ID No.1所示核苷酸序列、H7亚型流感病毒中SEQ ID No.3所示核苷酸序列、H5亚型流感病毒中SEQ IDNo.6所示核苷酸序列和流感病毒M基因中SEQ ID No.10所示核苷酸序列。
在本发明中,所述多重荧光定量PCR扩增的反应体系优选为:2×缓冲液10μl,40pmol/μl正向引物0.4μl,40pmol/μl反向引物各0.4μl,10pmol/μl探针0.2μl/种,共4种探针,阳性质粒标准品或样品cDNA 1μl,补DEPC水至20μl。
在本发明中,所述多重荧光定量PCR扩增的反应程序优选为:95℃变性5min;以95℃5s,54℃20s,共40个循环,在54℃进行荧光检测。
在本发明中,所述阳性质粒包含H5、H7和H9亚型流感病毒特异性片段和流感病毒M基因的特异性片段。
在本发明中,所述多重荧光定量PCR扩增优选在LightCycler96荧光定量PCR仪上,产自Roche Diagnostics公司。
得到荧光曲线和Ct值后,本发明根据得到的荧光曲线和Ct值,判断样品中的流感病毒亚型类别。
在本发明中,所述根据荧光曲线判断样品中的流感病毒亚型类别优选根据不同荧光曲线的荧光信号颜色和信号强度来判断属于流感病毒亚型的类别。
在本发明中,所述判断的方法优选当Ct值>35循环为阴性,Ct值≤35循环为阳性。
下面结合实施例对本发明提供的检测禽流感病毒亚型的荧光定量PCR引物、探针和试剂盒及检测方法进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
实施例1
引物设计
根据GenBank中AIV的M基因以及H5、H7和H9亚型禽流感病毒血凝素基因序列,用DNAMAN软件进行同源性分析,采用Primer Express5.0软件,在其保守区域设计特异性引物和TaqMan荧光探针。其中,M基因引物及探针参照禽流感病毒实验室操作标准获得。将设计得到H5、H7和H9亚型禽流感病毒的引物对和探针和M基因引物对及探针委托上海生物工程公司进行合成。
RNA提取
取适量鸡胚尿囊液,12000rpm离心5min,取500μl上清,向其中加入700μlTrizol,振荡混匀,静置10min,4℃12000rpm离心15min,取上清加入500μl异丙醇中,混匀,4℃静置15min,15000rpm离心10min,弃上清,温和用1mL75%乙醇洗涤沉淀,勿将沉淀重悬,7500rpm离心5min,控干尽量弃净液体,加入20μl无核酸酶水,涡旋混匀,置于-80℃保存。
反转录
取总RNA 10.5μl加入20μl反转录体系中,其中包含4μl 5×反转录Bμffer、2μl dNTPmix(10mmol/L)、1μl 12bp引物(50mmol/L,5’-AGCAAAAGCAGG-3’)、2μlAMV反转录酶(5U/μl)和0.5μl RNA酶抑制剂(40U/μl),轻轻混匀后于42℃水浴1h,最后冰浴2min,然后用于荧光定量PCR或置20℃保存备用。
重组质粒的构建
M基因特异性引物和H5、H7、H9亚型特异性引物分别扩增各段基因,切胶回收,将4段基因按照H5、H7、H9和M基因的顺序进行融合,首先将H5基因和H7基因融合,融合体系为:高保真酶缓冲液25μl,高保真酶1μl,dNTP 1μl,H5的特异性目的片段1μl,H7的特异性目的片段1μl,灭菌水21μl,总体系为50μl,按照下列程序进行融合:95℃预变30s,95℃变性15s,54℃退火15s,72℃延伸1min,扩增30个循环,72℃总延伸5min,切胶回收获得H5-H7融合产物。H9基因和M基因按照以上体系及条件进行融合,获得H9-M融合产物。将H5-H7融合产物和H9-M融合产物继续按照如上所述条件进行融合,最终得到H5-H7-H9-M融合产物,并连接到pMD-18T载体上,菌液PCR验证阳性者送测序。按照质粒提取说明书操作,抽提质粒。通过NanoDrop2000(Eppendorf公司)测定质粒浓度,测定DNA浓度后,按公式计算标准品的拷贝数,拷贝数(copies)=(质量/分子量)×6.0×1023。以10倍系列稀释质粒标准品至下限达100拷贝数/μl,上限达到107拷贝数/μl。
用10倍系列稀释质粒标准品,经荧光定量PCR仪检测后,计算Ct值并绘制标准曲线。取浓度为1.0×101拷贝数/μl~1.0×107拷贝数/μl的标准品模板进行荧光定量PCR扩增并建立标准曲线;多重荧光定量PCR反应体系,2×缓冲液10μl,40pmol/μl正向引物0.4μl,40pmol/μl反向引物0.4μl,10pmol/μl探针0.2μl,共4种探针,阳性质粒标准品1μl,补DEPC水至20μl;反应程序为95℃变性5min;以95℃5s,54℃20s,40个循环,在54℃进行荧光检测。
得到如图1-4的标准曲线,其中图1为H9亚型流感病毒荧光定量PCR的标准曲线方程为:y=-3.11×LOG(10X)+35.14;图2的标准曲线方程为H5亚型流感病毒荧光定量PCR的标准曲线方程为y=-3.14×LOG(10X)+35.98;图3为H7亚型流感病毒荧光定量PCR的标准曲线方程为y=-3.12×LOG(10X)+35.14;图4为流感病毒M基因荧光定量PCR的标准曲线方程为y=-3.13×LOG(10X)+34.65。从四个标准曲线和线性方程来看,相关系数R2=0.999;扩增效率均是109%,说明有较好的线性关系。
实施例2
将通用载体重组质粒按照10倍梯度稀释,得到1×100拷贝数/μl~1×107拷贝数/μl系列稀释质粒分别进行检测分析,以期获得其检测下限。获得不同浓度标准品的Ct值判断该方法所能检测的模板最小拷贝数,同时,以上述不同浓度的模板做常规PCR方法的检测,PCR产物用1%琼脂糖凝胶电泳鉴定。各特异性目的片段的扩增曲线如图5~8所示。
研究发现,当Ct值>35循环为阴性,Ct值≤35循环为阳性。所建立的荧光定量PCR方法检测H5、H7、H9流感病毒和流感病毒M基因的检测限度均为10拷贝数。
实施例3
为验证SEQ ID No.1~SEQ ID No.12的多重荧光定量PCR引物对和探针的特异性,选择同一病毒属的H1、H2、H3、H4、H6、H8、H10、H11、H12、H13亚型流感病毒,以及有相同临床症状的IBV、IBDV、NDV病毒为检测对象,分别如实施例1所述的方法进行RNA提取,反转录和荧光定量PCR检测,得到扩增曲线如图9所示。
检测结果表明同一病毒属的其它亚型流感病毒除M基因为阳性外,其它所有检测对象的结果均呈阴性,这表明新设计的SEQ ID No.1~SEQ ID No.12所述的引物探针具有特异性。
实施例4
选择3个梯度1×103拷贝数/μl~1×105拷贝数/μl系列稀释质粒为模板,批间试验变异系数由单个浓度模板重复3次荧光定量PCR结果确定,批内试验变异系数由单次实验平行试验结果确定。稳定性分析实验结果是对4个不同浓度样品重复检测3次得到的Ct值进行汇总,并且通过计算Ct值的平均值以及标准差,进一步得到各检测项目的变异系数。4个检测样品均能够判定为阳性,并且Ct值变异系数在合理范围内,最大为3.32%,均小于5%。可以得出结论:构建的多重荧光定量PCR检测方法具有良好的稳定性,为定量分析奠定了基础。
实施例5
初步应用建立的方法检测临床样品100份:对2015年4月到2016年1月采自浙江余姚等地区的100份鸡病变组织单独进行研磨,利用荧光定量PCR检测分析携带该病毒的状况。
将100份病料研磨液分别接种SPF胚进行病毒分离;TaqManPCR检测以Ct值≤35并且扩增曲线呈S形为阳性的判定原则荧光定量PCR检测结果显在100份病料中,鉴定到H9亚型病毒10株,H5亚型病毒3株、H7亚型病毒1株;与病毒分离结果鉴定到H9亚型病毒10株,H5亚型病毒3株、H7亚型病毒1株相同。
从上述结果可以看出,病毒的TaqMan PCR检测方法与病毒分离方法比较具有用时短的特点,病毒分离的阳性结果在荧光定量PCR检测均为阳性。通过本实验初步证实了该方法在病毒的检测方面具有可行性,灵敏度与病毒分离方法相同。
由以上实施例可知,本发明设计得到的H5、H7、H9亚型流感病毒特异性引物和探针具有较强的特异性,对检测除H5、H7、H9亚型流感病毒以外的病毒都为阴性;建立的荧光定量PCR方法检测H5、H7、H9流感病毒和流感病毒M基因,当Ct值>35循环为阴性,Ct值≤35循环为阳性,检测限度为10~50拷贝数。批间批内实验表明构建的多重荧光定量PCR检测方法具有良好的稳定性。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用
- 兔中型艾美耳球虫荧光定量pcr检测引物和试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测屎肠球菌的dpo引物、方法及试剂盒的制作方法
- 荧光定量pcr法检测top2a基因表达的引物、探针及试剂盒的制作方法
- 对虾tsv和imnv荧光定量检测引物和探针及试剂盒的制作方法
- 牛乳中沙门氏菌的直接荧光定量pcr的检测引物、探针及检测方法
- 一种鉴定光慈菇的方法及其专用引物对的制作方法
- 基于dpo引物的实时荧光pcr检测植物乳杆菌的方法、引物及试剂盒的制作方法
- 基于dpo引物的实时荧光pcr检测鼠李糖乳杆菌的方法、引物及试剂盒的制作方法
- 一种貉的荧光pcr检测方法及其扩增引物和探针的制作方法
- 鉴定白木香的荧光定量pcr方法、引物和探针及其应用