基于金纳米粒子的靶向表皮生长因子受体EGFR的人工抗体及其制备方法与流程
本发明涉及一种靶向表皮生长因子受体EGFR(epidermal growth factor receptor)的人工抗体及其制备方法。特征是一种基于金纳米粒子的靶向表皮生长因子受体EGFR的人工抗体及其制备方法。
背景技术:
定向输送纳米颗粒到达肿瘤部位对于纳米药物在生物体内分子成像和靶向治疗等领域至关重要。近年来,为了解决纳米颗粒和靶点位置结合力差和特异性低的问题,人们越来越多的通过将天然抗体结合到纳米颗粒上,利用抗体和抗原的高特异性和强结合力的性质,从而将纳米颗粒定向输送到靶点位置并且可以延长纳米颗粒在体内的循环时间。
研究发现在许多实体肿瘤中存在EGFR的高表达,EGFR与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡都有一定的关系。因此,EGFR作为一个靶向肿瘤细胞的重要靶点被越来越多的研究和利用,并且EGFR的天然抗体西妥昔单抗和帕尼单抗已经被成功地应用到肿瘤的临床治疗中。然而天然抗体存在自身的缺陷,例如稳定性差、价格昂贵,因此合成一种稳定性好并且能够特异性结合EGFR的人工抗体对于纳米药物在生物体内分子成像、靶向治疗和药物载带具有重要价值。
由于纳米金具有生物相容性好、比表面积大和易于表面修饰等优良特性,这使其在细胞检测、药物合成和运输、光化学治疗等方面具有广泛的应用价值。因此通过功能化纳米粒子制备能够靶向EGFR的纳米药物已经被广泛的研究,然而这些纳米药物主要是通过将具有特异性识别EGFR功能的蛋白质抗体修饰到纳米粒子表面,利用修饰的蛋白质抗体的肿瘤靶向性从而将纳米药物输送到肿瘤部位。虽然这种方法合成的纳米药物具有较好的肿瘤靶向性,但是由于大分子蛋白质抗体提取困难并且稳定性差,使得这种方法合成的纳米药物与EGFR的结合力低、稳定性差并且制备成本高。
技术实现要素:
本发明的目的之一在于提供一种基于金纳米粒子的靶向表皮生长因子受体EGFR的人工受体。
本发明的目的之二在于提供该人工受体的制备方法。
为达到上述目的,本发明采用如下技术方案:
一种基于金纳米粒子的靶向表皮生长因子受体EGFR的人工受体,由金纳米粒子以及多肽组成,其特征在于所述的多肽由识别区、两个调控区和两个固定区组成;所述的识别区的两端各连接一个调控区;而在调控区的两端各连接一个固定区;该多肽通过其两端的固定区固定在金纳米粒子表面从而形成环状结构;
所述的调控区用来调节多肽的长度,由0~8个非半胱氨酸的氨基酸序列随机排列组成;
所述的固定区通过巯基和纳米金表面自发形成S-Au键,从而将所述多肽两端固定在金纳米粒子表面,每1nm2金纳米粒子表面积上固定0.05~2个所述多肽,从而使多肽在金纳米粒子表面形成环状构象。
上述的识别区的氨基酸序列为AWYGTLYEYD、AWYGTVYEYD、SWYGTLYEYD或AWYGSLYEYD。
上述的固定区为:半胱氨酸或将带有巯基的聚乙二醇通过脱水缩合修饰在调控区的两端形成固定区。
上述的组成调控区的氨基酸为:甘氨酸、丝氨酸、丙氨酸、谷氨酰胺和天冬酰胺。。
一种基于金纳米粒子的靶向表皮生长因子受体EGFR的人工抗体的制备方法,其特征在于该方法的具体步骤为:按照每1nm2金纳米粒子表面积上固定0.05~2个多肽的比例,将多肽溶液滴加入纳米金溶胶中,在常温下混合反应1-180min,即得到具有靶向表皮生长因子受体EGFR的纳米金人工抗体。
按照上述的方法只要保证多肽在纳米金表面具有特定的环状构象,可以将多肽修饰在不同形状和大小的金纳米粒子表面,如:直径为2-200nm的纳米金球、长度为20-200nm,直径为5-100nm的纳米金棒或10-200nm的星型纳米金。
由于该人工抗体具有特异性识别EGFR的性能,并且结合力强、稳定性好,因此可以利用这种人工抗体特异性的靶向肿瘤细胞表面过表达或异常表达的EGFR。所以这种具有特异性识别EGFR功能的人工抗体在疾病诊断、靶向治疗、光热治疗和药物载带等领域具有广阔的应用前景。
本发明将设计的多肽通过S-Au键修饰到纳米金表面,设计的多肽在纳米金表面形成特定环状构象,从而制备出具有靶向蛋白质EGFR(epidermal growth factor receptor)的纳米人工抗体。由于许多肿瘤细胞表面EGFR都是过表达的,可以利用合成的这种纳米金抗体特异性地靶向肿瘤细胞表面高表达的EGFR。因此,本方法合成得到的纳米人工抗体在疾病诊断、靶向治疗、光热治疗和药物载带等领域具有广阔的应用前景。
附图说明
图1为基于金纳米粒子的靶向表皮生长因子受体EGFR的人工抗体的示意图。
图2为实施例一检测人工抗体AuNP(4nm)+P1与蛋白质EGFR特异性结合性能。
图3为实施例一表征人工抗体AuNP(4nm)+P1与EGFR结合的动力学性能。
图4为实施例一检测人工抗体AuNP(4nm)+P1的热力学稳定性。
图5为实施例二检测人工抗体AuNP(4nm)+P2与蛋白质EGFR特异性结合性能。
图6为实施例二表征人工抗体AuNP(4nm)+P2与EGFR结合的动力学性能。
图7为实施例二检测人工抗体AuNP(4nm)+P2的热力学稳定性。
图8为实施例三检测人工抗体AuNP(4nm)+P3与EGFR特异性结合性能。
图9为实施例三表征人工抗体AuNP(4nm)+P3与EGFR结合的动力学性能。
图10为实施例三检测人工抗体AuNP(4nm)+P3的热力学稳定性。
图11为实施例四检测人工抗体AuNP(30nm)+P1与蛋白质EGFR特异性结合性能。
图12为实施例四表征人工抗体AuNP(30nm)+P1与EGFR结合的动力学性能。
图13为实施例四检测人工抗体AuNP(30nm)+P1的热力学稳定性。
图14为实施例五检测人工抗体AuNP(30nm)+P2与蛋白质EGFR特异性结合性能。
图15为实施例五表征人工抗体AuNP(30nm)+P2与EGFR结合的动力学性能。
图16为实施例五检测人工抗体AuNP(30nm)+P2的热力学稳定性。
图17为实施例六检测人工抗体AuNP(30nm)+P3与蛋白质EGFR特异性结合性能。
图18为实施例六表征人工抗体AuNP(30nm)+P3与EGFR结合的动力学性能。
图19为实施例六检测人工抗体AuNP(30nm)+P3的热力学稳定性。
图20为实施例七检测人工抗体AuNP(4nm)+P4和AuNP(4nm)+P2与蛋白质EGFR特异性结合性能。
图21为实施例八检测人工抗体AuNP(4nm)+P5和AuNP(4nm)+P2与蛋白质EGFR特异性结合性能。
具体实施方式
下面给出实施例以对本发明作进一步说明。有必要在此指出的是以下实施例不能理解为对本发明保护范围的限制,如果该领域的技术熟练人员根据上述本发明内容对本发明做出一些非本质的改进和调整,例如对设计的多肽部分氨基酸序列进行微小的突变,仍属于本发明保护范围。
实施例一:
1、多肽片段的设计
直接将识别区和固定区结合,调节区氨基酸个数为0,设计了多肽P1:CAWYGTLYEYDC,如图1所示。设计的多肽P1可以通过两端的半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体AuNP(4nm)+P1的制备
按照1nm2纳米金球表面积上固定0.05-2个多肽的比例,多肽通过S-Au键固定在4nm的纳米金球表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(4nm)+P1。
3、表征人工抗体AuNP(4nm)+P1与蛋白质EGFR的特异性结合性能
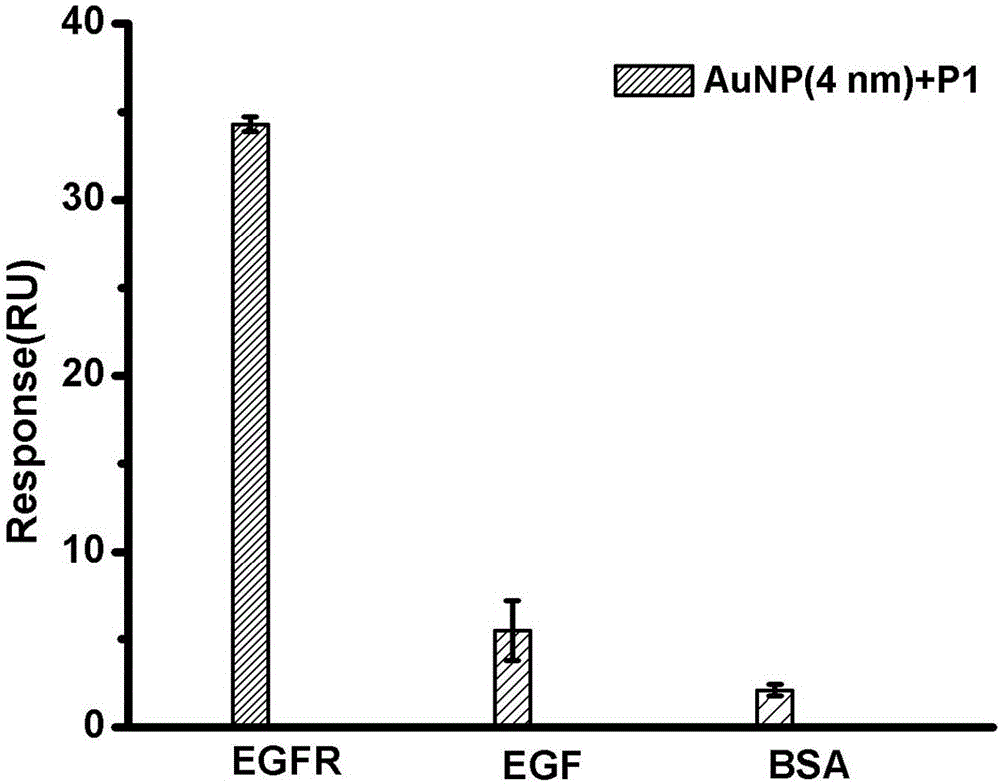
为了检测人工抗体AuNP(4nm)+P1与EGFR特异性结合的能力,我们测定了AuNP(4nm)+P1和EGFR、EGF和BSA的结合,如图2所示。人工抗体AuNP(4nm)+P1与EGFR有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(4nm)+P1具有与EGFR特异性结合的性能。
4、表征人工抗体AuNP(4nm)+P1与EGFR结合的动力学性能
为了表征合成的纳米金抗体AuNP(4nm)+P1与EGFR结合的动力学性能,我们测定了AuNP(4nm)+P1与EGFR结合的动力学谱图和结合常数KD值,如图3中所示。人工抗体AuNP(4nm)+P1与EGFR的结合常数KD=1.89E-11,通过对比发现人工抗体AuNP(4nm)+P1与EGFR的结合常数比天然抗体与EGFR的结合常数高出三个数量级。这些证明了人工抗体AuNP(4nm)+P1具有比天然抗体更好的结合EGFR的动力学性能。
5、检测AuNP(4nm)+P1的热力学稳定性
为了证明人工抗体比天然抗体具有更好的热力学稳定性,我们将人工抗体AuNP(4nm)+P1放入沸水中水浴1h,然后测定水浴前后两种抗体结合EGFR的性能,如图4所示。通过对比人工抗体AuNP(4nm)+P1水浴前后与EGFR的结合性能,发现水浴之后的人工抗体结合EGFR的性能相比于水浴之前没有明显的降低,然而大多数天然抗体经过沸水加热之后,抗体结构会发生不可逆的变化从而失去活性。因此该人工抗体相比于天然抗体具有优越的热力学稳定性。
实施例二:
1、多肽片段的设计
在识别区两端的两个调节区各添加一个丝氨酸和一个甘氨酸,设计了多肽P2:CSAWYGTLYEYDGC,如图1所示。设计的多肽可以通过两个固定区半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体的制备
按照1nm2金纳米粒子表面积上固定0.05-2个多肽的比例,多肽通过S-Au键固定在4nm的纳米金球表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(4nm)+P2。
3、表征人工抗体AuNP(4nm)+P2与蛋白质EGFR的特异性结合性能
为了检测人工抗体AuNP(4nm)+P2与EGFR特异性结合的能力,我们测定了AuNP(4nm)+P2和EGFR、EGF和BSA的结合,如图5所示。人工抗体AuNP(4nm)+P2与EGFR有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(4nm)+P2具有与EGFR特异性结合的性能。
4、表征人工抗体AuNP(4nm)+P2与EGFR结合的动力学性能
为了表征合成的纳米金抗体AuNP(4nm)+P2与EGFR结合的动力学性能,我们测定了AuNP(4nm)+P2与EGFR结合的动力学谱图和结合常数KD值,如图6中所示。人工抗体AuNP(4nm)+P2与EGFR的结合常数KD=4.04E-11。通过对比发现人工抗体AuNP(4nm)+P2与EGFR的结合常数比天然抗体与EGFR的结合常数高出三个数量级。这些证明了人工抗体AuNP(4nm)+P2具有比天然抗体更好的结合EGFR的动力学性能。
6、检测AuNP(4nm)+P2的热力学稳定性
为了证明人工抗体比天然抗体具有更好的热力学稳定性,我们将人工抗体AuNP(4nm)+P2放入沸水中水浴1h,然后测定水浴前后两种抗体结合EGFR的性能,如图7所示。通过对比人工抗体AuNP(4nm)+P2水浴前后与EGFR的结合性能,发现水浴之后的人工抗体结合EGFR的性能相比于水浴之前没有明显的降低,然而大多数天然抗体经过沸水加热之后,抗体结构会发生不可逆的变化从而失去活性。因此该人工抗体相比于天然抗体具有优越的热力学稳定性。
实施例三:
1、多肽片段的设计
在识别区两端的两个调节区各添加5氨基酸,设计了多肽P3:CGAGASAWYGTLYEYDGSASAC,如图1所示。设计的多肽可以通过两个固定区半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体的制备
按照1nm2金纳米粒子表面积上固定0.05-2个多肽的比例,将多肽通过S-Au键固定在4nm的纳米金球表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(4nm)+P3。
3、表征人工抗体AuNP(4nm)+P3与蛋白质EGFR的特异性结合性能
为了检测人工抗体AuNP(4nm)+P3与EGFR特异性结合的能力,我们测定了AuNP(4nm)+P3和EGFR、EGF和BSA的结合,如图8所示。人工抗体AuNP(4nm)+P3与EGFR有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(4nm)+P3具有与EGFR特异性结合的性能。
4、表征人工抗体AuNP(4nm)+P3与EGFR结合的动力学性能
为了表征合成的纳米金抗体AuNP(4nm)+P3与EGFR结合的动力学性能,我们测定了AuNP(4nm)+P3与EGFR结合的动力学谱图和结合常数KD值,如图9中所示。人工抗体AuNP(4nm)+P3与EGFR的结合常数KD=5.96E-11。通过对比发现人工抗体AuNP(4nm)+P3与EGFR的结合常数比天然抗体与EGFR的结合常数高出三个数量级。这些证明了人工抗体AuNP(4nm)+P3具有比天然抗体更好的结合EGFR的动力学性能。
7、检测AuNP(4nm)+P3的热力学稳定性
为了证明人工抗体比天然抗体具有更好的热力学稳定性,我们将人工抗体AuNP(4nm)+P3放入沸水中水浴1h,然后测定水浴前后两种抗体结合EGFR的性能,如图10所示。通过对比人工抗体AuNP(4nm)+P3水浴前后与EGFR的结合性能,发现水浴之后的人工抗体结合EGFR的性能相比于水浴之前没有明显的降低,然而大多数天然抗体经过沸水加热之后,抗体结构会发生不可逆的变化从而失去活性。因此该人工抗体相比于天然抗体具有优越的热力学稳定性。
实施例四:
1、多肽片段的设计
直接将识别区和固定区结合,调节区氨基酸个数为0,设计了多肽P1:CAWYGTLYEYDC,如图1所示。设计的多肽P1可以通过两端的半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体AuNP(30nm)+P1的制备
按照1nm2金纳米粒子表面积上固定0.05-2个多肽的比例,多肽通过S-Au键固定在30nm的金纳米粒子表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(4nm)+P1。
3、表征人工抗体AuNP(30nm)+P1与蛋白质EGFR的特异性结合性能
为了检测人工抗体AuNP(30nm)+P1与EGFR特异性结合的能力,我们测定了AuNP(30nm)+P1和EGFR、EGF和BSA的结合,如图11所示。人工抗体AuNP(30nm)+P1与EGFR有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(30nm)+P1具有与EGFR特异性结合的性能。
4、表征人工抗体AuNP(30nm)+P1与EGFR结合的动力学性能
为了表征合成的纳米金抗体AuNP(30nm)+P1与EGFR结合的动力学性能,我们测定了AuNP(30nm)+P1与EGFR结合的动力学谱图和结合常数KD值,如图12中所示。人工抗体AuNP(30nm)+P1与EGFR的结合常数KD=9.80E-11。通过对比发现人工抗体AuNP(30nm)+P1与EGFR的结合常数比天然抗体与EGFR的结合常数高出三个数量级。这些证明了人工抗体AuNP(30nm)+P1具有比天然抗体更好的结合EGFR的动力学性能。
5、检测AuNP(30nm)+P1的热力学稳定性
为了证明人工抗体比天然抗体具有更好的热力学稳定性,我们将人工抗体AuNP(30nm)+P1放入沸水中水浴1h,然后测定水浴前后两种抗体结合EGFR的性能,如图13所示。通过对比人工抗体AuNP(30nm)+P1水浴前后与EGFR的结合性能,发现水浴之后的人工抗体结合EGFR的性能相比于水浴之前没有明显的降低,然而大多数天然抗体经过沸水加热之后,抗体结构会发生不可逆的变化从而失去活性。因此该人工抗体相比于天然抗体具有优越的热力学稳定性。
实施例五:
1、多肽片段的设计
在识别区两端的两个调节区各添加一个丝氨酸和一个甘氨酸,设计了多肽P2:CSAWYGTLYEYDGC,如图1所示。设计的多肽可以通过两个固定区半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体的制备
按照1nm2金纳米粒子表面积上固定0.05-2个多肽的比例,将多肽通过S-Au键固定在4nm的金纳米粒子表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(30nm)+P2。
3、表征人工抗体AuNP(30nm)+P2与蛋白质EGFR的特异性结合性能
为了检测人工抗体AuNP(30nm)+P2与EGFR特异性结合的能力,我们测定了AuNP(30nm)+P2和EGFR、EGF和BSA的结合,如图14所示。人工抗体AuNP(30nm)+P2与EGFR有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(30nm)+P2具有与EGFR特异性结合的性能。
4、表征人工抗体AuNP(30nm)+P2与EGFR结合的动力学性能
为了表征合成的纳米金抗体AuNP(30nm)+P2与EGFR结合的动力学性能,我们测定了AuNP(30nm)+P2与EGFR结合的动力学谱图和结合常数KD值,如图15中所示。人工抗体AuNP(30nm)+P2与EGFR的结合常数KD=4.92E-11。通过对比发现人工抗体AuNP(30nm)+P2与EGFR的结合常数比天然抗体与EGFR的结合常数高出三个数量级。这些证明了人工抗体AuNP(30nm)+P2具有比天然抗体更好的结合EGFR的动力学性能。
8、检测AuNP(30nm)+P2的热力学稳定性
为了证明人工抗体比天然抗体具有更好的热力学稳定性,我们将人工抗体AuNP(30nm)+P2放入沸水中水浴1h,然后测定水浴前后两种抗体结合EGFR的性能,如图16所示。通过对比人工抗体AuNP(30nm)+P2水浴前后与EGFR的结合性能,发现水浴之后的人工抗体结合EGFR的性能相比于水浴之前没有明显的降低,然而大多数天然抗体经过沸水加热之后,抗体结构会发生不可逆的变化从而失去活性。因此该人工抗体相比于天然抗体具有优越的热力学稳定性。
实施例六:
1、多肽片段的设计
在识别区两端的两个调节区各添加5氨基酸,设计了多肽P3:CGAGASAWYGTLYEYDGSASAC,如图1所示。设计的多肽可以通过两个固定区半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体的制备
按照1nm2金纳米粒子表面积上固定0.05-2个多肽的比例,将多肽通过S-Au键固定在30nm的金纳米粒子表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(30nm)+P3。
3、表征人工抗体AuNP(30nm)+P3与蛋白质EGFR的特异性结合性能
为了检测人工抗体AuNP(30nm)+P3与EGFR特异性结合的能力,我们测定了AuNP(30nm)+P3和EGFR、EGF和BSA的结合,如图17所示。人工抗体AuNP(30nm)+P3与EGFR有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(4nm)+P3具有与EGFR特异性结合的性能。
4、表征人工抗体AuNP(30nm)+P3与EGFR结合的动力学性能
为了表征合成的纳米金抗体AuNP(30nm)+P3与EGFR结合的动力学性能,我们测定了AuNP(30nm)+P3与EGFR结合的动力学谱图和结合常数KD值,如图18中所示。人工抗体AuNP(30nm)+P3与EGFR的结合常数KD=7.38E-11。通过对比发现人工抗体AuNP(30nm)+P3与EGFR的结合常数比天然抗体与EGFR的结合常数高出三个数量级。这些证明了人工抗体AuNP(30nm)+P3具有比天然抗体更好的结合EGFR的动力学性能。
5、检测AuNP(30nm)+P3的热力学稳定性
为了证明人工抗体比天然抗体具有更好的热力学稳定性,我们将人工抗体AuNP(30nm)+P3放入沸水中水浴1h,然后测定水浴前后两种抗体结合EGFR的性能,如图19所示。通过对比人工抗体AuNP(30nm)+P3水浴前后与EGFR的结合性能,发现水浴之后的人工抗体结合EGFR的性能相比于水浴之前没有明显的降低,然而大多数天然抗体经过沸水加热之后,抗体结构会发生不可逆的变化从而失去活性。因此该人工抗体相比于天然抗体具有优越的热力学稳定性。
实施例七:
1、多肽片段的设计
保证识别区中AWYGTLYEYD关键氨基酸残基YEYD不变,对识别区中其他的氨基酸进行单点突变得到AWYGTVYEYD;在识别区两端的两个调节区各添加一个丝氨酸和一个甘氨酸,设计了多肽P4:CSAWYGTVYEYDGC,如图1所示。设计的多肽可以通过两个固定区半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体的制备
按照1nm2金纳米粒子表面积上固定0.05-2个多肽的比例,多肽通过S-Au键固定在4nm的纳米金球表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(4nm)+P4。
3、表征人工抗体AuNP(4nm)+P4和AuNP(4nm)+P2与蛋白质EGFR的特异性结合性能
为了检测对多肽识别区进行单点突变后对人工抗体AuNP(4nm)+P4与EGFR特异性结合影响不大,我们测定了AuNP(4nm)+P4和AuNP(4nm)+P2分别与EGFR、EGF和BSA的结合,如图20所示。人工抗体AuNP(4nm)+P4和AuNP(4nm)+P2与EGFR都有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(4nm)+P4具有与EGFR特异性结合的性能。
实施例八:
1、多肽片段的设计
在识别区两端的两个调节区各添加一个丝氨酸和一个甘氨酸,将带有巯基的聚乙二醇(0.3K)通过脱水缩合修饰在多肽的两端形成固定区,设计了多肽P5:SH-PEGSAWYGTVYEYDGPEG-SH,如图1所示。设计的多肽可以通过两个固定区半胱氨酸中的巯基固定在纳米金表面,从而形成特定的构象。
2、具有靶向EGFR性能的金纳米人工抗体的制备
按照1nm2金纳米粒子表面积上固定0.05-2个多肽的比例,多肽通过S-Au键固定在4nm的纳米金球表面,每个纳米金表面有10-150个多肽。从而得到能够和EGFR特异性结合的人工抗体AuNP(4nm)+P5。
3、表征人工抗体AuNP(4nm)+P5和AuNP(4nm)+P2与蛋白质EGFR的特异性结合性能
为了检测多肽固定区改变对人工抗体AuNP(4nm)+P5与EGFR特异性结合的影响,我们测定了AuNP(4nm)+P5和AuNP(4nm)+P2分别与EGFR、EGF和BSA的结合,如图21所示。人工抗体AuNP(4nm)+P6和AuNP(4nm)+P2与EGFR都有明显的结合,但是与EGF和BSA没有明显的结合,说明人工抗体AuNP(4nm)+P5具有与EGFR特异性结合的性能。
<110> 上海大学
<120> 基于金纳米粒子的靶向表皮生长因子受体EGFR的人工抗体及其制备方法
<160> 4
<210> 1
<211> 10
<212> 单链DNA
<213> 人工序列
<400> 1
AWYGT LYEYD 10
<210> 2
<211> 10
<212> 单链DNA
<213> 人工序列
<400> 2
AWYGT VYEYD 10
<210> 3
<211> 10
<212> 单链DNA
<213> 人工序列
<400> 3
SWYGT LYEYD 10
<210> 4
<211> 10
<212> 单链DNA
<213> 人工序列
<400> 4
AWYGS LYEYD 10
1
- 还没有人留言评论。精彩留言会获得点赞!
- 一种阿法替尼有关物质的分离检测方法与流程
- 用于检测人血清中HER2含量的ELISA试剂盒、使用方法及用途与流程
- 用于预防或治疗皮疹的药物组合物的制造方法与工艺
- 用于汽车内饰表皮的30ST/R双面布的制造方法与工艺
- 检测EGFR耐药性突变的方法和组合物与制造工艺
- 一种肝素结合表皮生长因子的单域抗体及其应用的制造方法与工艺
- 3‑[(3‑{[4‑(4‑吗啉基甲基)‑1H‑吡咯‑2‑基]亚甲基}‑2‑氧代‑2,3‑二氢‑1H‑吲哚‑5‑基)甲基]‑1,3‑噻唑烷‑2,4‑二酮和EGFR TYR激酶抑制剂的组合的制造方法与工艺
- 一种二甲苯磺酸拉帕替尼片剂及其制备方法与制造工艺
- 苯并咪唑衍生物作为ERBB酪氨酸激酶抑制剂用于治疗癌症的制造方法与工艺
- 包含STP和生长因子的活性组合物及其化妆品或护肤品的制造方法与工艺
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法