化合物、连接子‑药物、及配体‑药物耦合体的制作方法
本揭露系有关于一种化合物,特别是有关于一种海兔毒素衍生物(auristatinederivative)、新颖连接子、以及包含该海兔毒素衍生物的连接子--药物、及配体-药物耦合体。
背景技术:
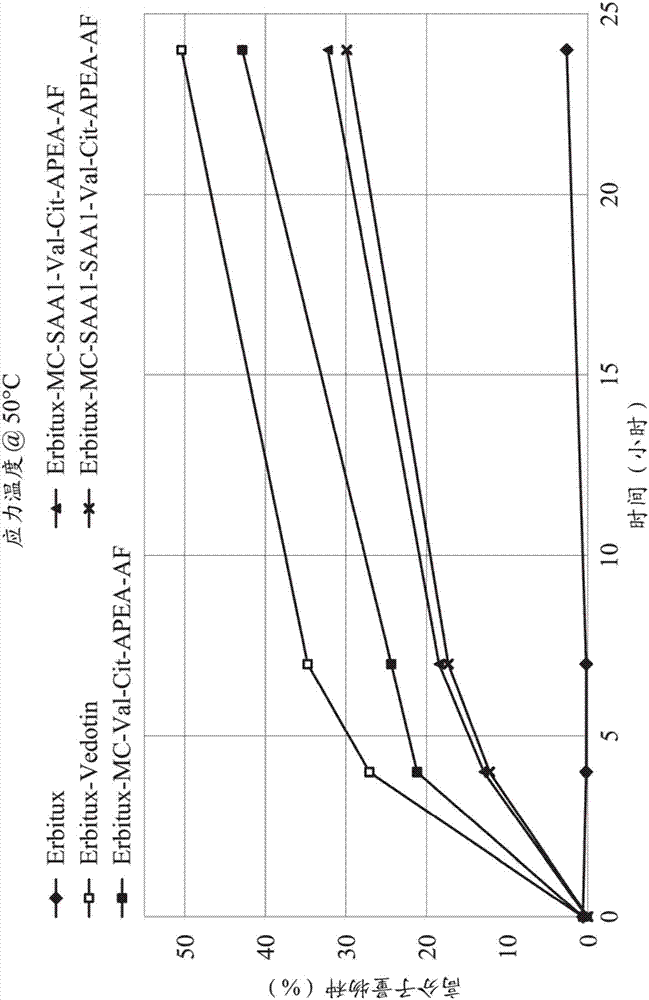
:抗体对于与之相对应的抗原具有高度的辨识能力,加上许多具有细胞毒性的药物分子因无法选择性毒杀癌症细胞而无法用于癌症治疗,有鉴于此,将抗体与高毒杀性的药物(例如毒素)设计为连结在一起,成为具有高度选择性、专一性的耦合体药物。由于耦合体药物具有选择性毒杀癌症细胞的特性,可望成为临床上实用的药物。抗体-药物耦合体(antibody-drugconjugates,adcs)的概念在30年前就已经被提出。世界各大药厂及许多小至中型的生技公司皆投入大量资金人物力或藉由合作方式来进行新颖性adcs药物的开发。目前,已有超过40个adcs药物在进行不同阶段的临床试验。各种adcs药物在临床上成功使用的结果,显示开发新颖性adcs药物是协助人类满足抗癌医疗需求的重要工作。技术实现要素:本揭露的一实施例提供一种具有式(i)的化合物或其药学上可接受的盐类或溶剂化物:式(i)中,每一r1、r2与r3独立地为氢、胺基、硝基、卤素、羟基、c1-c6烷氧基、羧基、c1-c6烷氧基羰基、c1-c6胺基、c1-c6胺基羰基、c1-c6烷基、c1-c6分支型烷基、c1-c6环烷基、c1-c6杂环基、芳基或杂芳基,r1与r3至少其中之一为胺基。本揭露的另一实施例提供一种具有式(ii)的化合物或其药学上可接受的盐类或溶剂化物:式(ii)中,每一r4、r5与r6独立地为氢、胺基、硝基、卤素、羟基、c1-c6烷氧基、羧基、c1-c6烷氧基羰基、c1-c6胺基、c1-c6胺基羰基、c1-c6烷基、c1-c6分支型烷基、c1-c6环烷基、c1-c6杂环基、芳基或杂芳基。本揭露的又一实施例提供一种具有式(iii)的连接子--药物或其药学上可接受的盐类或溶剂化物:c-saas-aas-d(iii)式(iii)中,c-为一耦合单元,选自由以及所组成的族群,其中r7选自由-c1-c10亚烷基-、-c3-c8碳环基-、-o-(c1-c8烷基)-、-亚芳基-、-c1-c10亚烷基-亚芳基-、-亚芳基-c1-c10亚烷基-、-c1-c10亚烷基-(c3-c8碳环基)-、-(c3-c8碳环基)-c1-c10亚烷基-、-c3-c8杂环基-、-c1-c10亚烷基-(c3-c8杂环基)-、-(c3-c8杂环基)-c1-c10亚烷基-、-(伸乙氧基)r-以及-(伸乙氧基)r-亚甲基-所组成的族群,以及r为1-10之整数。式(iii)中,-saas-为一具有式(iv)的糖胺基酸单元:式(iv)中,x为1-8之整数,y为1-4之整数,为四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃,每一r8与r10独立地为单键、亚甲基、羟基亚甲基、伸乙基、亚乙基、羟基伸乙基、羟基亚乙基、二羟基伸乙基、二羟基亚乙基、伸乙烯基、亚乙烯基、伸丙基(propylene)、亚丙基、三亚甲基(trimethylene)、羟基伸丙基(hydroxypropylene)、羟基亚丙基、羟基三亚甲基(hydroxytrimethylene)、二羟基伸丙基(dihydroxypropylene)、二羟基亚丙基、二羟基三亚甲基(dihydroxytrimethylene)、三羟基伸丙基(trihydroxypropylene)、三羟基亚丙基或三羟基三亚甲基(trihydroxytrimethylene),每一r9独立地为羟基、甲基、羟甲基、乙基、羟乙基、二羟乙基、丙基、羟丙基、二羟丙基或三羟丙基、或同一环中任意两r9与其连接之碳原子形成羰基、或任意两r9、r8与任意一r9、或r10与任意一r9形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之第二个四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃、或任意两r9、r8与任意一r9、或r10与任意一r9与一亚甲基、亚乙基、1-亚丙基、2-亚丙基或苯亚甲基形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之环状缩醛或缩酮。式(iii)中,-aas-为一具有式(v)的胜肽单元:式(v)中,z为0-10之整数,r11为-(ch2)3nhc(=nh)nh2、-(ch2)3nh2、-(ch2)3nhconh2、-(ch2)4nhc(=nh)nh2、-(ch2)4nh2或-(ch2)4nhconh2,r12为氢、甲基、乙基、丙基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、苯基或苯甲基,r13为氢、甲基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、环己基、苯基、苯甲基、p-羟基苯甲基、-ch2oh、-ch(oh)ch3、-ch2ch2sch3、-ch2conh2、-ch2cooh、-ch2ch2conh2、-ch2ch2cooh、-(ch2)3nhc(═nh)nh2、-(ch2)3nh2、-(ch2)3nhcoch3、-(ch2)3nhcho、-(ch2)4nhc(═nh)nh2、-(ch2)4nh2、-(ch2)4nhcoch3、-(ch2)4nhcho、-(ch2)3nhconh2、-(ch2)4nhconh2、-ch2ch2ch(oh)ch2nh2、2-吡啶甲基、3-吡啶甲基或4-吡啶甲基。式(iii)中,-d为一细胞毒性剂,选自由鹅膏蕈碱(amanitins)、蒽环类物(anthracyclines)、海兔毒素(auristatins)、浆果赤霉素(baccatins)、刺孢霉素(calicheamicins)、喜树碱(camptothecins)、西地霉素(cemadotins)、秋水仙碱(colchicines)、秋水仙胺(colcimids)、考布他汀(combretastatins)、隐花素(cryptophysins)、蒂克霉素(discodermolides)、多卡霉素(duocarmycins)、棘霉素(echinomycins)、艾榴塞洛素(eleutherobins)、埃博霉素(epothilones)、雌莫司汀(estramustines)、偏端霉素(lexitropsins)、美登木素生物碱(maytansinoids)、纺锤霉素(netropsins)、嘌呤霉素(puromycins)、吡咯并苯并二氮杂(pyrrolobenzodiazepines)、根霉素(rhizoxins)、紫杉烷(taxanes)、小管素(tubulysins)以及长春花生物碱(vincaalkaloids)所组成的族群。本揭露的再一实施例提供一种具有式(vi)的配体--药物耦合体:l-(c-saas-aas-d)p(vi)式(vi)中,p为1-20之整数,l-为一配体单元,选自由全长抗体、抗体片段、蛋白质、小分子量蛋白质、多肽、寡肽、适体、凝集素、醣蛋白、脂蛋白、醣脂、维生素、营养传输分子、激素、寡糖、多醣以及任何其他细胞结合分子或物质所组成的族群。式(vi)中,l-进一步连接至上述式(iii)c-saas-aas-d。为让本发明之上述目的、特征及优点能更明显易懂,下文特举一较佳实施例,并配合所附的图式,作详细说明如下。附图说明图1显示erbitux-mht-71的hic态样;以及图2显示erbitux与erbitux-adcs于50℃的热应力稳定性试验结果。实施方式本揭露化合物具有苯胺基团之海兔毒素衍生物本揭露提供一种新颖的海兔毒素衍生物,其特征在于以一苯胺基团为连接点与连接子、配体或传输分子连接,且使该毒素具备更高抗癌活性的潜力,对抗一系列人类癌细胞株。在一实施例中,该海兔毒素衍生物为具有式(i)包含苯胺基团的化合物。本揭露亦提供该海兔毒素衍生物的药学上可接受盐类或溶剂化物。式(i)中,每一r1、r2与r3可独立地为氢、胺基、硝基、卤素、羟基、c1-c6烷氧基、羧基、c1-c6烷氧基羰基、c1-c6胺基、c1-c6胺基羰基、c1-c6正烷基、c1-c6分支型烷基、c1-c6环烷基、c1-c6杂环基、芳基或杂芳基,r1与r3至少其中之一为胺基。在一实施例中,r1为氢,r2为氢、羧基、c1-c6烷氧基羰基、c1-c6胺基羰基或c1-c6烷基,以及r3为胺基。在另一实施例中,该海兔毒素f衍生物为具有式(ii)包含苯胺基团的化合物。本揭露亦提供该海兔毒素f衍生物的药学上可接受盐类或溶剂化物:式(ii)中,每一r4、r5与r6可独立地为氢、胺基、硝基、卤素、羟基、c1-c6烷氧基、羧基、c1-c6烷氧基羰基、c1-c6胺基、c1-c6胺基羰基、c1-c6烷基、c1-c6分支型烷基、c1-c6环烷基、c1-c6杂环基、芳基或杂芳基。在一实施例中,r4、r5与r6为氢。包含糖胺基酸之连接子本揭露提供一种新颖的包含糖胺基酸的连接子,其特征在于其c端具有可被组织蛋白酶b(cathepsinb)辨识的双肽,以及其n端具有高亲水性的糖胺基酸基团,以提升该连接子或含连接子物质的水溶性。连接子c端的羧基与n端的胺基均可作为连接点,与间隔物、连接子、配体、药物、毒素、成像分子、抗体、胜肽或传输分子连接。本揭露连接子单元包括一糖胺基酸单元(-saas-)以及一胜肽单元(-aas-)。胜肽单元可为二肽、三肽、四肽、五肽、六肽、七肽、八肽、九肽、十肽、十一肽或十二肽。在一实施例中,糖胺基酸单元(-saas-)具有式(iv):式(iv)中,x为1-8的整数,y为1-4的整数,可为四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃,每一r8与r10可独立地为单键、亚甲基、羟基亚甲基、伸乙基、亚乙基、羟基伸乙基、羟基亚乙基、二羟基伸乙基、二羟基亚乙基、伸乙烯基、亚乙烯基、伸丙基(propylene)、亚丙基、三亚甲基(trimethylene)、羟基伸丙基(hydroxypropylene)、羟基亚丙基、羟基三亚甲基(hydroxytrimethylene)、二羟基伸丙基(dihydroxypropylene)、二羟基亚丙基、二羟基三亚甲基(dihydroxytrimethylene)、三羟基伸丙基(trihydroxypropylene)、三羟基亚丙基或三羟基三亚甲基(trihydroxytrimethylene),每一r9可独立地为羟基、甲基、羟甲基、乙基、羟乙基、二羟乙基、丙基、羟丙基、二羟丙基或三羟丙基、或同一环中任意两r9与其连接之碳原子形成羰基、或任意两r9、r8与任意一r9、或r10与任意一r9形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之第二个四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃、或任意两r9、r8与任意一r9、或r10与任意一r9与一亚甲基、亚乙基、1-亚丙基、2-亚丙基或苯亚甲基形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之环状缩醛或缩酮。在本揭露中,糖胺基酸的例子包括但不限于以下所述:在一实施例中,胜肽单元(-aas-)具有式(v):式(v)中,z为0-10的整数,r11可为-(ch2)3nhc(=nh)nh2、-(ch2)3nh2、-(ch2)3nhconh2、-(ch2)4nhc(=nh)nh2、-(ch2)4nh2或-(ch2)4nhconh2,r12可为氢、甲基、乙基、丙基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、苯基或苯甲基,r13可为氢、甲基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、环己基、苯基、苯甲基、p-羟基苯甲基、-ch2oh、-ch(oh)ch3、-ch2ch2sch3、-ch2conh2、-ch2cooh、-ch2ch2conh2、-ch2ch2cooh、-(ch2)3nhc(═nh)nh2、-(ch2)3nh2、-(ch2)3nhcoch3、-(ch2)3nhcho、-(ch2)4nhc(═nh)nh2、-(ch2)4nh2、-(ch2)4nhcoch3、-(ch2)4nhcho、-(ch2)3nhconh2、-(ch2)4nhconh2、-ch2ch2ch(oh)ch2nh2、2-吡啶甲基、3-吡啶甲基或4-吡啶甲基。可藉由一或多种酵素对胜肽单元进行酵素截切,例如藉由肿瘤相关蛋白酶,以释放药物单元(-d)。连接子-药物本揭露的一实施例提供一种具有式(iii)的连接子--药物或其药学上可接受盐类或溶剂化物:c-saas-aas-d(iii)式(iii)中,c-为一耦合单元,选自由以及所组成的族群,其中r7选自由-c1-c10亚烷基-、-c3-c8碳环基-、-o-(c1-c8烷基)-、-亚芳基-、-c1-c10亚烷基-亚芳基-、-亚芳基-c1-c10亚烷基-、-c1-c10亚烷基-(c3-c8碳环基)-、-(c3-c8碳环基)-c1-c10亚烷基-、-c3-c8杂环基-、-c1-c10亚烷基-(c3-c8杂环基)-、-(c3-c8杂环基)-c1-c10亚烷基-、-(伸乙氧基)r-以及-(伸乙氧基)r-亚甲基-所组成的族群,以及r为1-10的整数。式(iii)中,-saas-为一具有式(iv)的糖胺基酸单元:式(iv)中,x为1-8的整数,y为1-4的整数,可为四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃,每一r8与r10可独立地为单键、亚甲基、羟基亚甲基、伸乙基、亚乙基、羟基伸乙基、羟基亚乙基、二羟基伸乙基、二羟基亚乙基、伸乙烯基、亚乙烯基、伸丙基(propylene)、亚丙基、三亚甲基(trimethylene)、羟基伸丙基(hydroxypropylene)、羟基亚丙基、羟基三亚甲基(hydroxytrimethylene)、二羟基伸丙基(dihydroxypropylene)、二羟基亚丙基、二羟基三亚甲基(dihydroxytrimethylene)、三羟基伸丙基(trihydroxypropylene)、三羟基亚丙基或三羟基三亚甲基(trihydroxytrimethylene),每一r9可独立地为羟基、甲基、羟甲基、乙基、羟乙基、二羟乙基、丙基、羟丙基、二羟丙基或三羟丙基、或同一环中任意两r9与其连接之碳原子形成羰基、或任意两r9、r8与任意一r9、或r10与任意一r9形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之第二个四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃、或任意两r9、r8与任意一r9、或r10与任意一r9与一亚甲基、亚乙基、1-亚丙基、2-亚丙基或苯亚甲基形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之环状缩醛或缩酮。式(iii)中,-aas-为一具有式(v)的胜肽单元,:式(v)中,z为0-10的整数,r11可为-(ch2)3nhc(=nh)nh2、-(ch2)3nh2、-(ch2)3nhconh2、-(ch2)4nhc(=nh)nh2、-(ch2)4nh2或-(ch2)4nhconh2,r12可为氢、甲基、乙基、丙基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、苯基或苯甲基,r13可为氢、甲基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、环己基、苯基、苯甲基、p-羟基苯甲基、-ch2oh、-ch(oh)ch3、-ch2ch2sch3、-ch2conh2、-ch2cooh、-ch2ch2conh2、-ch2ch2cooh、-(ch2)3nhc(═nh)nh2、-(ch2)3nh2、-(ch2)3nhcoch3、-(ch2)3nhcho、-(ch2)4nhc(═nh)nh2、-(ch2)4nh2、-(ch2)4nhcoch3、-(ch2)4nhcho、-(ch2)3nhconh2、-(ch2)4nhconh2、-ch2ch2ch(oh)ch2nh2、2-吡啶甲基、3-吡啶甲基或4-吡啶甲基。式(iii)中,-d为一细胞毒性剂,选自由鹅膏蕈碱(amanitins)、蒽环类物(anthracyclines)、海兔毒素(auristatins)、浆果赤霉素(baccatins)、刺孢霉素(calicheamicins)、喜树碱(camptothecins)、西地霉素(cemadotins)、秋水仙碱(colchicines)、秋水仙胺(colcimids)、考布他汀(combretastatins)、隐花素(cryptophysins)、蒂克霉素(discodermolides)、多卡霉素(duocarmycins)、棘霉素(echinomycins)、艾榴塞洛素(eleutherobins)、埃博霉素(epothilones)、雌莫司汀(estramustines)、偏端霉素(lexitropsins)、美登木素生物碱(maytansinoids)、纺锤霉素(netropsins)、嘌呤霉素(puromycins)、吡咯并苯并二氮杂(pyrrolobenzodiazepines)、根霉素(rhizoxins)、紫杉烷(taxanes)、小管素(tubulysins)以及长春花生物碱(vincaalkaloids)所组成的族群。在一实施例中,c-为耦合单元,选自由以及所组成的族群,其中r7选自由-1,5-伸戊基-、-1,6-伸己基-、-1,4-伸环己基-、-(伸乙氧基)r-ch2-以及-(伸乙氧基)r-亚甲基-亚甲基-所组成的族群,以及r为2-5的整数。在一实施例中,-saas-为糖胺基酸单元,选自由以及所组成的族群。在一实施例中,-aas-为胜肽单元,选自由-缬胺酸-瓜胺酸-、-缬胺酸-离胺酸-、-缬胺酸-鱼精胺酸-、-苯丙胺酸-瓜胺酸-、-苯丙胺酸-离胺酸-以及-苯丙胺酸-鱼精胺酸-所组成的族群。在一实施例中,-d为细胞毒性剂,选自由以及所组成的族群,其中每一r1、r2、r3、r4、r5与r6独立地为氢、胺基、硝基、卤素、羟基、甲氧基、乙氧基、羧基、甲氧基羰基、乙氧基羰基、甲基胺基、二甲基胺基、乙基胺基、二乙基胺基、1-吡咯啶基、1-哌啶基、1-哌嗪基、胺基羰基、甲基胺基羰基、二甲基胺基羰基、乙基胺基羰基、二乙基胺基羰基、1-吡咯啶基羰基、1-哌啶基羰基、1-哌嗪基羰基、甲基、乙基、丙基、异丙基或苯基。配体--药物耦合体本揭露的一实施例提供一种具有式(vi)的配体--药物耦合体或其药学上可接受盐类或溶剂化物:l-(c-saas-aas-d)p(vi)式(vi)中,p为1-20的整数,l-为一配体单元,选自由全长抗体、抗体片段、蛋白质、小分子量蛋白质、多肽、寡肽、适体、凝集素、醣蛋白、脂蛋白、醣脂、维生素、营养传输分子、激素、寡糖、多醣以及任何其他细胞结合分子或物质所组成的族群。式(vi)中,c-为一耦合单元,选自由以及所组成的族群,其中r7选自由-c1-c10亚烷基-、-c3-c8碳环基-、-o-(c1-c8烷基)-、-亚芳基-、-c1-c10亚烷基-亚芳基-、-亚芳基-c1-c10亚烷基-、-c1-c10亚烷基-(c3-c8碳环基基)-、-(c3-c8碳环基)-c1-c10亚烷基-、-c3-c8杂环基-、-c1-c10亚烷基-(c3-c8杂环基)-、-(c3-c8杂环基)-c1-c10亚烷基-、-(伸乙氧基)r-以及-(伸乙氧基)r-亚甲基-所组成的族群,以及r为1-10的整数。式(vi)中,-saas-为一具有式(iv)的糖胺基酸单元:式(iv)中,x为1-8的整数,y为1-4的整数,可为四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃,每一r8与r10可独立地为单键、亚甲基、羟基亚甲基、伸乙基、亚乙基、羟基伸乙基、羟基亚乙基、二羟基伸乙基、二羟基亚乙基、伸乙烯基、亚乙烯基、伸丙基(propylene)、亚丙基、三亚甲基(trimethylene)、羟基伸丙基(hydroxypropylene)、羟基亚丙基、羟基三亚甲基(hydroxytrimethylene)、二羟基伸丙基(dihydroxypropylene)、二羟基亚丙基、二羟基三亚甲基(dihydroxytrimethylene)、三羟基伸丙基(trihydroxypropylene)、三羟基亚丙基或三羟基三亚甲基(trihydroxytrimethylene),每一r9可独立地为羟基、甲基、羟甲基、乙基、羟乙基、二羟乙基、丙基、羟丙基、二羟丙基或三羟丙基、或同一环中任意两r9与其连接之碳原子形成羰基、或任意两r9、r8与任意一r9、或r10与任意一r9形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之第二个四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃、或任意两r9、r8与任意一r9、或r10与任意一r9与一亚甲基、亚乙基、1-亚丙基、2-亚丙基或苯亚甲基形成与原四氢呋喃、二氢呋喃、四氢哌喃或二氢哌喃融合之环状缩醛或缩酮。式(vi)中,-aas-为一具有式(v)的胜肽单元:式(v)中,z为0-10的整数,r11可为-(ch2)3nhc(=nh)nh2、-(ch2)3nh2、-(ch2)3nhconh2、-(ch2)4nhc(=nh)nh2、-(ch2)4nh2或-(ch2)4nhconh2,r12可为氢、甲基、乙基、丙基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、苯基或苯甲基,r13可为氢、甲基、异丙基、环丙基、丁基、仲丁基、异丁基、叔丁基、环丁基、环己基、苯基、苯甲基、p-羟基苯甲基、-ch2oh、-ch(oh)ch3、-ch2ch2sch3、-ch2conh2、-ch2cooh、-ch2ch2conh2、-ch2ch2cooh、-(ch2)3nhc(═nh)nh2、-(ch2)3nh2、-(ch2)3nhcoch3、-(ch2)3nhcho、-(ch2)4nhc(═nh)nh2、-(ch2)4nh2、-(ch2)4nhcoch3、-(ch2)4nhcho、-(ch2)3nhconh2、-(ch2)4nhconh2、-ch2ch2ch(oh)ch2nh2、2-吡啶甲基、3-吡啶甲基或4-吡啶甲基。式(vi)中,-d为一细胞毒性剂,选自由鹅膏蕈碱(amanitins)、蒽环类物(anthracyclines)、海兔毒素(auristatins)、浆果赤霉素(baccatins)、刺孢霉素(calicheamicins)、喜树碱(camptothecins)、西地霉素(cemadotins)、秋水仙碱(colchicines)、秋水仙胺(colcimids)、考布他汀(combretastatins)、隐花素(cryptophysins)、蒂克霉素(discodermolides)、多卡霉素(duocarmycins)、棘霉素(echinomycins)、艾榴塞洛素(eleutherobins)、埃博霉素(epothilones)、雌莫司汀(estramustines)、偏端霉素(lexitropsins)、美登木素生物碱(maytansinoids)、纺锤霉素(netropsins)、嘌呤霉素(puromycins)、吡咯并苯并二氮杂(pyrrolobenzodiazepines)、根霉素(rhizoxins)、紫杉烷(taxanes)、小管素(tubulysins)以及长春花生物碱(vincaalkaloids)所组成的族群。在一实施例中,配体单元(l-)为与抗原结合的抗体。在一实施例中,抗体可为嵌合抗体、人源化抗体或其功能活性片段。在一实施例中,抗体藉由该抗体的半胱氨酸残基连接至耦合单元。式(vi)中,p为2-8的整数,或为整数4。在一实施例中,配体单元可为叶酸、甲氨蝶呤(methotrexate)或与叶酸受体结合的叶酸受体结合配体。在一实施例中,配体单元可为促黄体激素释放激素(lhrh)、促黄体激素释放激素促效剂、促黄体激素释放激素拮抗剂或与促黄体激素释放激素受体结合的促黄体激素释放激素受体结合配体。在一实施例中,式(vi)中的c-为耦合单元,选自由以及所组成的族群,其中r7选自由-1,5-伸戊基-、-1,6-伸己基-、-1,4-伸环己基-、-(伸乙氧基)r-亚甲基-以及-(伸乙氧基)r-亚甲基-亚甲基-所组成的族群,以及r为2-5的整数。在一实施例中,式(vi)中的-saas-为糖胺基酸单元,选自由以及所组成的族群。在一实施例中,式(vi)中的-aas-为胜肽单元,选自由-缬胺酸-瓜胺酸-、-缬胺酸-离胺酸-、-缬胺酸-鱼精胺酸-、-苯丙胺酸-瓜胺酸-、-苯丙胺酸-离胺酸-以及-苯丙胺酸-鱼精胺酸-所组成的族群。在一实施例中,式(vi)中的-d为细胞毒性剂,选自由以及所组成的族群,其中每一r1、r2、r3、r4、r5与r6独立地为氢、胺基、硝基、卤素、羟基、甲氧基、乙氧基、羧基、甲氧基羰基、乙氧基羰基、甲基胺基、二甲基胺基、乙基胺基、二乙基胺基、1-吡咯啶基、1-哌啶基、1-哌嗪基、胺基羰基、甲基胺基羰基、二甲基胺基羰基、乙基胺基羰基、二乙基胺基羰基、1-吡咯啶基羰基、1-哌啶基羰基、1-哌嗪基羰基、甲基、乙基、丙基、异丙基或苯基。本揭露亦提供配体--药物耦合体,用于药物的标的传输。配体--药物耦合体包括一配体单元,共价连接于至少一药物单元。药物单元可直接或藉由一连接子单元共价连接配体单元。耦合单元耦合单元可将一配体单元连接至一连接子单元至一药物单元。天然或经化学手段存在于配体中有用的官能基团包括但不限定于巯基、胺基、羟基、羰基、甲酰基及羧基。适合的官能基团为巯基及胺基。在一实施例中,可藉由还原配体中的分子内二硫键形成巯基。在另一实施例中,可藉由配体中的离胺酸的胺基与traut’s试剂或其他巯基产生试剂反应形成巯基。在一特定实施例中,配体为一重组抗体,且经工程化以携带一或多个离胺酸或半胱胺酸。在一实施例中,耦合单元与配体单元中的一硫原子形成一键结。上述硫原子可来自配体的一巯基。在另一实施例中,耦合单元与配体单元中的两硫原子形成两键结。上述两硫原子可来自配体的两巯基。上述两巯基可来自配体的一双硫键。在部分实施例中,药物单元可为刺孢霉素(calicheamicin)、喜树碱(camptothecin)、美登木素生物碱(maytansinoid)、或蒽环类物(anthracycline)。在部分实施例中,药物单元可为紫杉烷(taxane)、拓朴异构酶抑制剂(topoisomeraseinhibitor)、长春花生物碱(vincaalkaloid)或其类似物。在部分典型实施例中,适合的细胞毒性剂包括,例如,dna小沟结合物(例如烯二炔类(enediynes)及偏端霉素(lexitropsins),cbi化合物,参见美国专利us6,130,237)、多卡霉素(duocarmycins)、紫杉烷(taxanes)(例如紫杉醇(paclitaxel)及多西紫杉醇(docetaxel))、嘌呤霉素(puromycins)及长春花生物碱(vincaalkaloids)。其他细胞毒性剂包括,例如,cc-1065、sn-38、拓朴替康(topotecan)、多柔比星(doxorubicin)、根瘤菌素(rhizoxin)、氰基吗啉代-多柔比星(cyanomorpholino-doxorubicin)、棘霉素(echinomycin)、考布他汀(combretastatin)、纺锤菌素(netropsin)、埃博霉素(epothilone)、雌莫司汀(estramustine)、隐花素(cryptophysin)、西地霉素(cemadotin)、美登木素生物碱(maytansinoid)、蒂克霉素(discodermolide)、艾榴塞洛素(eleutherobins)或米托蒽醌(mitoxantrone)。药物单元在部分实施例中,药物单元可为抗微管蛋白剂。抗微管蛋白剂的例子包括海兔毒素(auristatin)、紫杉烷(taxane)及长春花生物碱(vincaalkaloid)。其他抗微管蛋白剂包括,例如,浆果赤霉素(baccatin)衍生物、西地霉素(cemadotin)、秋水仙碱(colchicine)、秋水仙胺(colcimid)、考布他汀(combretastatins)、隐花素(cryptophysins)、蒂克霉素(discodermolide)、艾榴塞洛素(eleutherobin)、雌莫司汀(estramustine)、美登木素生物碱(maytansinoid)、诺考达唑(nocodazole)或紫杉烷类似物。在特定实施例中,细胞毒性剂可为美登木素生物碱(maytansinoids)或另一群组的抗微管蛋白剂。例如,在特定实施例中,美登木素生物碱(maytansinoid)为美登素(maytansine)或dm-1(immunogen,inc.;参见charietal.,1992,cancerres.52:127-131)。在特定实施例中,细胞毒性剂或细胞抑制剂可为多拉司他汀(dolastatin)。在特定实施例中,细胞毒性剂或细胞抑制剂为海兔毒素类。因此,在特定实施例中,细胞毒性剂或细胞抑制剂为海兔毒素(mmae)。配体单元耦合体化合物的配体单元包括任何与受体、抗原或其他给定靶细胞群(giventarget-cellpopulation)有关的接受性基团产生键结或反应性结合或复合作用的配体单元。配体为与欲成为标的之细胞群之基团相结合、错合或反应的分子。在一观点来看,配体单元扮演将药物单元传输至与配体单元反应的特定标的细胞群的角色。该等配体包括但不限定于,大分子量蛋白质(例如全长抗体)、抗体片段、蛋白质、小分子量蛋白质、多肽、寡肽、凝集素、适体、醣蛋白、非肽类、维生素、营养传输分子(例如,但不限定于转铁蛋白)或任何其他细胞结合分子或物质。配体单元可与一连接子单元或一药物单元形成键结。配体单元可藉由该配体的一异原子与一连接子单元形成键结。可存在于配体单元上的异原子包括硫原子(在一实施例中,来自配体的巯基)、氧原子(在一实施例中,来自配体的羰基、羧基或羟基)及氮原子(在一实施例中,来自配体的一级或二级胺基)。该些异原子可以配体的自然状态存在于配体上,例如天然存在的抗体,或可藉由化学修饰导入配体中。在一实施例中,配体具有一巯基,且该配体藉由该巯基的硫原子与连接子单元连接。在另一实施例中,配体具有一或多个离胺酸残基,可藉由化学修饰导入一或多个巯基。配体单元藉由巯基与连接子单元连接。可用于修饰离胺酸的试剂包括但不限定于n-琥珀酰亚胺基-s-乙酰基硫代乙酸酯(sata)及2-亚胺基硫烷盐酸盐(traut's试剂)。在另一实施例中,配体具有一或多个醣基,可藉由化学修饰形成一或多个巯基。配体单元藉由巯基的硫原子与连接子单元连接。在另一实施例中,配体具有一或多个醣基,可经氧化提供醛基(—cho)(参见laguzzaetal.,1989,j.med.chem.32(3):548-55)。此相对应的醛可与位于一部分连接子单元上的反应区形成键结。可与配体上的羰基反应的反应区包括但不限定于肼及羟胺。其他为连接或联合药物单元而修饰蛋白质的方案描述于coligan等人(currentprotocolsinproteinscience,vol.2,johnwiley&sons(2002)),已并入此案以供参考。配体单元包括,例如,蛋白质,多肽或肽,但不限定于转铁蛋白、表皮生长因子(“egf”)、铃蟾肽、胃泌素、胃泌素释放肽、血小板衍生生长因子、il-2、il-6、转化生长因子(“tgf”)(例如tgf-α或tgf-β)、牛痘生长因子(“vgf”)、胰岛素及胰岛素样生长因子i、ii、凝集素及来自低密度脂蛋白的载脂蛋白。配体单元亦包括抗体,例如多株抗体或单株抗体。抗体可为特定的抗原决定位,包括例如:癌症细胞抗原、病毒抗原、微生物抗原、蛋白质、胜肽、碳水化合物、化学物质、核酸、或其片段。多株抗体的制造方法为本
技术领域:
所习知。单株抗体(mab)至感兴趣的抗原可利用任何本
技术领域:
习知的技术制备而成。这些技术包括但不限于例如最初由和milstein所描述的融合瘤技术(1975,nature256,495-497)、人类b细胞融合瘤技术(kozboretal.,1983,immunologytoday4:72)、ebv-融合瘤技术(coleetal.,1985,单株抗体及癌症疗法,alanr.liss,inc.,pp.77-96)。这种抗体可为任何一种免疫球蛋白类型,包括igg、igm、ige、iga、及igd,及其任何亚型。本揭露中由融合瘤所产生之单株抗体(mab)可于体外(invitro)或体内(invivo)进行培养。单株抗体可为例如:人类单株抗体、人类化单株抗体、抗体片段、或嵌合抗体(例如:人类-小鼠抗体)。人类单株抗体可由任何本
技术领域:
习知的技术制造(例如:tengetal.,1983,proc.natl.acad.sci.usa80:7308-7312;kozboretal.,1983,immunologytoday4:72-79;andolssonetal.,1982,meth.enzymol.92:3-16)。抗体也可为一双特异性抗体。双特异性抗体的制造方法为本
技术领域:
所习知。全长双特异性抗体的传统制造方法是基于两个免疫球蛋白的重链-轻链对的共现性(coexpression),其中这两个链具有不同的特异性(参见例如:milsteinetal.,1983,nature305:537-539;国际公开号no.wo93/08829,trauneckeretal.,1991,emboj.10:3655-3659)。根据不同的方式(approach),具有结合特异性的抗体变异区域(抗体-抗原结合位)融合至免疫球蛋白恒定区域的序列所述融合较佳具有一免疫球蛋白重链恒定区域,包括至少一部份的铰链区域、ch2区域、及ch3区域。较佳具有第一重链恒定区域(ch1),其包含轻链结合所必须的位点,存在于至少一个融合中。具有编码免疫球蛋白重链融合以及,若需要,免疫球轻链的核酸,被插入至单独的表现载体中,并且共同转染至合适的宿主生物(organism)。当使用了比例不均等的三个多胜肽链之构筑提供最佳产量时,其提供了调整三个多胜肽片段于实施例中相互比例的弹性。然而,当至少两个多胜肽链的表现为相等比例导致高产量或当各比例没有特别明显时,有可能在一个表现载体中插入两个或所有三个多胜肽链的编码序列。例如,双特异性抗体可具有一杂交免疫球蛋白链,在其中一臂中具有第一结合特异性,且在另外一臂中具有一杂交免疫球蛋白重链-轻链对(提供第二结合特异性)。这种不对称的结构有助于所期望的双特异性化合物从不想要的免疫球蛋白链结合中分离,由仅存在于一个半的双特异性分子中的免疫球蛋白轻链提供容易的分离方式(国际公开号no.wo94/04690),其整体并入本文做为参考。更详细之双特异性抗体的产生可参见例如sureshetal.,1986,methodsinenzymology121:210;rodriguesetal.,1993,j.immunology151:6954-6961;carteretal.,1992,bio/technology10:163-167;carteretal.,1995,j.hematotherapy4:463-470;merchantetal.,1998,naturebiotechnology16:677-681。利用这些技术,可制备出双特异性抗体用于治疗或避免此处所定义之疾病。双功能抗体也被描述于欧洲专利公开号epa0105360。如此参考文献所揭露,杂交或双功能抗体可生物性地(即,藉由细胞融合技术)或化学性地衍生,特别系透过交联剂或是二硫化桥键形成试剂,且可包括整个抗体或其片段。获得这种杂交抗体的方法揭露于例如:国际公开号wo83/03679及欧洲专利公开号epa0217577,两者皆在此并入本文作为参考。抗体也可为功能性活性片段、抗体的衍生物或类似物,其中该抗体免疫特异性地结合至目标抗原(例如:癌症抗原、病毒抗原、微生物抗原、或其他结合至细胞或基质的抗体)。在此,“功能性活性”代表所述片段、衍生物或类似物可辨认衍生自片段,衍生物或类似物的抗体所辨认相同的抗原。特别地,于一实施例中,免疫球蛋白分子的遗传性型(idiotype)的抗原性可藉由删除框架及cdr序列而提升,所述cdr序列为c-端的cdr序列,其专一性地辨认抗原。为了判断哪一个cdr序列结合至抗原,可在结合试验(bindingassay)中使用包含cdr序列的合成胜肽,以及任何结合试验中本
技术领域:
所习知的抗原(例如:biacoreassay)(参见例如:kabatetal.,1991,sequencesofproteinsofimmunologicalinterest,fifthedition,nationalinstituteofhealth,bethesda,md.;kabatetal.,1980,j.immunology125(3):961-969)。其他有用的抗体包括抗体的片段,例如但不限于:f(ab’)2片段、fab片段、fab’、fv片段及抗体的重链及轻链二聚体、或其任何最小片段像是fvs或单链抗体(scas)(例如:u.s.pat.no.4,946,778;bird,1988,science242:423-42;hustonetal.,1988,proc.natl.acad.sci.usa85:5879-5883;andwardetal.,1989,nature334:544-54中所述)。也可使用重组抗体,像是嵌合或人类化单株抗体,包括人类和非人类蛋白质,皆可利用标准重组dna技术制备(参见例如u.s.pat.no.4,816,567;及u.s.pat.no.4,816,397)。人源化抗体为来自非人类物种的抗体分子,具有来自非人类物种的一或多种互补决定区(complementaritydeterminingregions;cdrs)以及来自人类免疫球蛋白分子的框架区域(参见例如u.s.pat.no.5,585,089)。嵌合和人类化单株抗体可藉由本
技术领域:
习知的重组dna技术产生,例如使用国际公开号wo87/02671;欧洲专利公开号0184187;欧洲专利公开号0171496;欧洲专利公开号0173494;国际公开号wo86/01533;u.s.pat.no.4,816,567;欧洲专利公开号012023;berteretal.,1988,science240:1041-1043;liuetal.,1987,proc.natl.acad.sci.usa84:3439-3443;liuetal.,1987,j.immunol.139:3521-3526;sunetal.,1987,proc.natl.acad.sci.usa84:214-218;nishimuraetal.,1987,cancer.res.47:999-1005;woodetal.,1985,nature314:446-449;shawetal.,1988,j.natl.cancerinst.80:1553-1559;morrison,1985,science229:1202-1207;oietal.,1986,biotechniques4:214;u.s.pat.no.5,225,539;jonesetal.,1986,nature321:552-525;verhoeyanetal.,1988,science239:1534;andbeidleretal.,1988,j.immunol.141:4053-4060所述的方法。也可使用完整的人类抗体。人类抗体可利用例如无法表现内源性免疫球蛋白重链和轻链基因的转基因小鼠,但其可以表现人类重链和轻链基因。转基因小鼠以正常方式以经选择之抗原进行免疫,例如:本发明全部或部分的多胜肽。直接对抗抗原的单株抗体可利用传统融合瘤技术获得。转基因小鼠包含的人类免疫球蛋白转基因在b细胞分化时重新排序(rearrange),且接着进行类型转换及体细胞突变。因此,利用这种技术,将可能产生有治疗效果的igg、iga、igm及ige抗体。综观产生人类抗体的技术可参见lonbergandhuszar(1995,int.rev.immunol.13:65-93)。关于产生人类抗体的技术及产生此种抗体的规定之更详细讨论可参见例如:u.s.pat.nos.5,625,126;5,633,425;5,569,825;5,661,016;以及5,545,806。其他人类抗体可藉由商业上获得,例如来自abgenix,inc.(freemont,calif.)以及genpharm(sanjose,calif.)。可利用称为“定向选择(guidedselection)”的技术产生辨认经选择的抗原决定位(epitope)的人类抗体。在此方式中,经选择的非人类单株抗体,例如:小鼠抗体,用来定向(guide)会辨认相同抗原决定位的完整人类抗体的选择(参见例如:jespersetal.,1994,biotechnology12:899-903)。也可利用各种本
技术领域:
习知的技术产生人类抗体,包括噬菌体展示库(参见例如:hoogenboomandwinter,1991,j.mol.biol.227:381;marksetal.,1991,j.mol.biol.222:581;quanandcarter,2002,“theriseofmonoclonalantibodiesastherapeutics,”inanti-igeandallergicdisease,jardieu,p.m.andfickjr.,r.b,eds.,marceldekker,newyork,n.y.,chapter20,pp.427-469)。于其他实施例中,抗体为抗体的融合蛋白、或其功能性活性片段。例如,抗体可藉由非抗体的另一个蛋白质(或其部分,像是蛋白质的至少10、20或50个胺基酸)的胺基酸序列的n-端或c-端共价键进行融合(例如:胜肽键)。抗体也包括经修饰或未经修饰(亦即,藉由任何分子的共价连接)的类似物和衍生物,只要这样的共价连接允许抗体保留其抗原结合免疫特异性。例如但不限于:抗体的类似物和衍生物,包括经过进一步修饰,例如:醣基化、乙酰化、聚乙二醇化、磷酸化、酰胺化、藉由习知的保护/阻隔基衍生化、蛋白酶切割、连接至细胞抗体单元或其他蛋白质等。可利用习知技术实现任何大量的化学修饰,包括但不限于专一性化学切割、乙酰化、甲酰化、衣霉素存在下的代谢合成等。此外,类似物或衍生物可包括一种或多种非天然胺基酸。抗体可在与fc受体作用的胺基酸残基中具有修饰(例如:取代、删除或增加)。特别地,抗体包括在胺基酸残基中具有修饰的抗体,经辨认为包含在抗fc区域和fcrn受体之间的交互作用中(参见例如:国际公开号wo97/34631,其整体在此并入本文作为参考)。对于目标抗原的抗体免疫特异性可从商业上获得或是来自其他来源或利用本
技术领域:
具有通常知识者所习知的方法产生,像是例如:化学合成或重组表现技术。编码对于癌症抗原之抗体特异性的核苷酸序列可经由例如:genbank数据库或类似的数据库、公开文献、或是例行的基因选殖(cloning)及定序而获得。实施例本揭露藉由以下实施例做更详细说明。mmae(已知的毒素)、海兔毒素f(af,已知的毒素)与vedotin(已知的连接子-毒素)购自concortisbiotherapeutics。根据文献合成z-val-cit-oh、z-phe-cit-oh及各种糖胺基酸。用于连接子、毒素与连接子-毒素的缩写及其相对应的化学结构列于表1。表1<毒素>实施例1npea-af及apea-af之合成将hatu(101mg,0.2654mmol)加入含海兔毒素(165mg,0.2212mmol)、4-硝基苯乙胺盐酸盐(45mg,0.2212mmol)、dipea(0.155ml,0.8847mmol)、dmf(0.100ml)以及二氯甲烷(1ml)的搅拌溶液中。于室温搅拌12小时后,移除溶剂,并以制备型反相hplc对残留物进行纯化。之后,进行冻干,以获得白色粉末的npea-af(188mg,95%)。lc-ms:npea-af(c48h75n7o9)required[mh+]=894.6,found[mh+]=895.6。将npea-af(188mg,0.2103mmol)溶于乙醇(50ml),并混入hcl(0.4206mmol)及钯催化剂(22mg)。于氢气气氛下,对混合物进行搅拌16小时。将催化剂滤除,并以20ml乙醇清洗之。于减压环境下,移除溶剂。将残留物与水(10ml)混合,之后,进行冻干,以获得白色粉末的apea-af(178mg,98%)。lc-ms:apea-af(c48h77n7o9)required[mh+]=864.6,found[mh+]=865.5。实施例2npea(coome)-af及npea(cooh)-af之合成将海兔毒素f(200mg,0.26mmol)溶于少量dmf(1ml),并以dcm(10ml)进行稀释。将溶液浸于冰浴中,并加入l-(4-硝基)苯基丙胺酸甲酯盐酸盐(67mg,0.26mmol)及hatu(117mg,0.31mmol)。于加入dipea(0.18ml)后,将反应混合物自冰浴中移出,并于室温搅拌过夜。于减压环境下,蒸馏溶剂,并以制备型hplc(46%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对残留物进行纯化,以获得白色固体的npea(coome)-af(175mg,72%)。lc-ms:npea(coome)-af(c50h77n7o11)required[mh+]=952.6,found[mh+]=952.5。将npea(coome)-af(20mg)溶于thf与水的混合液(1:1,10ml),并以氢氧化钠(2.5mg)处理之。于2小时后,于减压环境下,蒸馏thf。水溶液以2n盐酸进行酸化,并予以冷冻干燥。以制备型hplc(46%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的npea(cooh)-af(15mg,75%)。lc-ms:npea(cooh)-af(c49h75n7o11)required[mh+]=938.6,found[mh+]=939.3。实施例3apea(coome)-af及apea(cooh)-af之合成将npea(coome)-af(100mg,0.105mmol)溶于包含2n盐酸(15μl)的乙醇(10ml)。于加入催化剂pd/c(10%,17mg)后,反应以氢气球进行,并搅拌过夜。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。以制备型hplc(33%acn/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的apea(coome)-af(36mg)。lc-ms:apea(coome)-af(c50h79n7o9)required[mh+]=922.6,found[mh+]=923.5。将apea(coome)-af(25mg)溶于thf与水的混合液(1:1,10ml),并以氢氧化钠(2.1mg)处理之。于2小时后,于减压环境下,蒸馏thf。水溶液以2n盐酸进行酸化,并予以冷冻干燥。以制备型hplc(29%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的apea(cooh)-af(14mg,58%)。lc-ms:apea(cooh)-af(c49h77n7o9)required[mh+]=908.6,found[mh+]=909.5。实施例4pea-anf及pea-aaf之合成将boc-l-对硝基苯基丙胺酸(4.66g,15mmol)及苯乙胺(1.94g,16mmol)加入含有二氯甲烷(200ml)的烧瓶中,并加入偶联剂n-乙氧基羰基-2-乙氧基-1,2-二氢喹啉(eedq,17g,17mmol),于室温搅拌混合物过夜。以tlc(etoac/n-hex=1:1,产物rf=0.5)确认反应。于减压环境下,蒸馏dcm。以正己烷(200ml)煮沸固体产物,并同时过滤。以热的正己烷(50ml)清洗固体产物2次,并吸气干燥,以获得白色粉末的boc-(nitro)phe-pea(4.81g,77.6%)。将boc-(nitro)phe-pea(4.80g,11.6mmol)溶于二氯甲烷(150ml),并混入三氟乙酸(6.84g,4.6ml,60mmol)。将溶液于室温静置过夜。于减压环境下,蒸馏二氯甲烷。将残留物与thf(50ml)混合,并再次蒸馏。残留物以1n碳酸钠溶液(250ml)进行处理,并以二氯甲烷(100ml)萃取2次。以无水硫酸镁对有机溶液进行干燥,并过滤之。于减压环境下,蒸馏滤液,并以正己烷(50ml)搅拌浅黄色残留物,直至固体形成。于减压环境下,蒸馏正己烷,并于高真空环境下,干燥产物,以获得定量(nitro)phe-pea。将多拉普林钾盐(dolaprolinepotassiumsalt)(325mg,1.0mmol)溶于甲醇(20ml),并以四乙基溴化铵(232mg,1.1mmol)进行处理。于3小时后,于减压环境下,蒸馏甲醇。以二氯甲烷(10ml)处理残留物,并过滤以移除溴化钾。将滤液与(nitro)phe-pea(422mg,1.1mmol)及hatu(456mg,1.2mmol)混合。于室温搅拌过夜后,于减压环境下,蒸馏二氯甲烷,并以制备型hplc(70%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对残留物进行纯化,以获得白色固体的boc-dap-(nitro)phe-pea(527mg,产率90%)。lc-ms:boc-dap-(nitro)phe-pea(c31h42n4o7)required[mh+]=583.3,found[mh+]=584.4。将boc-dap-(nitro)phe-pea(527mg,0.9mmol)溶于二氯甲烷(20ml),并以三氟乙酸(7ml)进行处理。于4小时后,于减压环境下,移除溶剂。将残留物与乙酸乙酯(50ml)混合,并再次蒸馏。将残留物与水(20ml)混合,并予以冷冻干燥,以获得白色粉末的dap-(nitro)phe-pea(426mg,98%)。lc-ms:dap-(nitro)phe-pea(c26h34n4o5)required[mh+]=483.3,found[mh+]=484.3。将dov-val-dil(64.5mg,0.15mmol)、dap-(nitro)phe-pea(72mg,0.15mmol)及hatu(68mg,0.18mmol)溶于二氯甲烷(20ml),并以dipea(86mg,0.66mmol)进处理。于室温搅拌过夜后,于减压环境下,蒸馏二氯乙烷,并以制备型hplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对残留物进行纯化,以获得白色固体的pea-anf(96.7mg,产率72%)。lc-ms:pea-anf(c48h75n7o9)required[mh+]=894.6,found[mh+]=895.6。将pea-anf(20mg,0.022mmol)溶于乙醇(30ml),并混入盐酸(0.067mmol)。于加入催化量(16mg)的10%pd/c后,将反应混合物导入氢气球并搅拌过夜。以硅藻土垫将催化剂滤除后,于减压环境下,蒸馏滤液,以获得白色固体的pea-aaf(24.2mg,51%)。lc-ms:pea-aaf(c48h77n7o7)required[mh+]=864.6,found[mh+]=865.6。实施例53aq-anf及3aq-aaf之合成将boc-(nitro)phe(46.55g,0.15mol)溶于二氯甲烷(1l),并加入n-羟基琥珀酰亚胺(17.26g,0.15mol)及edci(28.76g,0.15mol)。于4小时后,加入3aq(21.63g,0.15mol)及乙基吗啉(17.28g,0.15mol),并于室温搅拌3天。于减压环境下,蒸馏二氯甲烷。残留物与柠檬酸溶液(1m,500ml)及乙酸乙酯(500ml)搅拌30分钟。过滤固体产物,并以水(200ml)清洗2次。将湿的粗产物溶于热的丙酮(1.5l),并以无水硫酸镁干燥及过滤。于减压环境下,蒸馏滤液,以获得boc-(nitro)phe-3aq(31.52,48.1%)。将boc-(nitro)phe-3aq(30.55g,0.07mol)溶于二氯甲烷(300ml),并以三氟乙酸(50ml,74.45g,653mmol)进行处理。于室温搅拌过夜后,于减压环境下,蒸馏反应混合物。于油状残留物中,加入乙酸乙酯(100ml),并于减压环境下,进行蒸馏。上述步骤重复两次以上,并于油状产物中,加入乙醚(300ml),以迫使三氟乙酸酯析出。固体产物悬浮于碳酸钠溶液(1m,500ml)与甲醇(500ml)的混合液中,并搅拌直至悬浮均匀。于减压环境下,蒸馏甲醇,并过滤固体产物,以水(200ml)清洗2次。将湿的产物予以冷冻干燥,以获得(nitro)phe-3aq(20.35g,86.4%)。将多拉普林钾盐(487.5mg,1.5mmol)溶于甲醇(50ml),并以四乙基溴化铵(316.4mg,1.4mmol)进行处理。于4小时后,于减压环境下,蒸馏甲醇。残留物以二氯甲烷(10ml)进行处理,并过滤以移除溴化钾。将滤液与(nitro)phe-3aq(556mg,1.65mmol)及hatu(685mg,1.8mmol)混合。于室温搅拌过夜后,于减压环境下,蒸馏二氯甲烷,并以制备型hplc(42%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化,以获得白色固体的boc-dap-(nitro)phe-3aq(781mg,产率86%)。lc-ms:boc-dap-(nitro)phe-3aq(c32h39n5o7)required[mh+]=606.3,found[mh+]=607.4。将boc-dap-(nitro)phe-3aq(606mg,1mmol)溶于二氯甲烷(10ml),并以三氟乙酸(6ml)进行处理。于2小时后,于减压环境下,移除溶剂。残留物与乙酸乙酯(50ml)混合,并再次蒸馏。残留物与水(20ml)混合,并予以冷冻干燥,以获得白色粉末的dap-(nitro)phe-3aq(500mg,99%)。lc-ms:dap-(nitro)phe-3aq(c27h31n5o5)required[mh+]=506.2,found[mh+]=507.1。将dov-val-dil(200mg,0.466mmol)、dap-(nitro)phe-3aq(236mg,0.466mmol)与hatu(213mg,0.56mmol)溶于二氯甲烷(5ml),并以dipea(267mg,2.05mmol)进行处理。于室温搅拌过夜后,于减压环境下,蒸馏二氯甲烷,并以制备型preparativehplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对残留物进行纯化,以获得白色固体的3aq-anf(345.2mg,产率82%)。lc-ms:3aq-anf(c49h72n8o9)required[mh+]=917.5,found[mh+]=918.5。将3aq-anf(105mg,0.114mmol)溶于乙醇(30ml)。于加入催化量(10mg)的10%pd/c后,将反应混合物导入氢气球,并搅拌4小时。以硅藻土垫将催化剂滤除后,于减压环境下,蒸馏滤液,并以制备型hplc(36%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对残留物进行纯化。于减压环境下,蒸馏含有3aq-anf的分馏物,以移除乙腈。将酸性水溶液以碳酸钠进行碱化,并过滤之,以获得3aq-aaf(80mg,79%)。lc-ms:3aq-aaf(c49h74n8o7)required[mh+]=887.6,found[mh+]=888.5。<糖胺基酸>实施例6糖胺基酸1(saa1)及糖胺基酸2(saa2)衍生物之合成将核糖衍生物n3-saa1(x)-ome(3.6g)溶于甲醇。于加入催化量的pd/c后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂滤除后,于减压环境下,蒸馏甲醇,以获得淡黄色液体的saa1(x)-ome(3.14g)。将z-osu(9.75g)及dipea(6.8ml)加入saa1(x)-ome(8.72g)/dcm(300ml)溶液。于17小时后,以1n碳酸钠清洗反应混合物。有机层以无水硫酸镁进行干燥。于减压环境下,蒸馏二氯甲烷,以获得棕色液体的粗产物z-saa1(x)-ome(13.6g)。将粗产物z-saa1(x)-ome(1g)溶于thf(50ml),并以1n氢氧化钾(6ml)进行处理。于3小时后,于减压环境下,蒸馏thf。将粗产物水溶液与dcm(100ml)混合,并以柠檬酸溶液小心酸化,直至ph达约3-4。以水清洗有机溶液数次,并以无水硫酸镁进行干燥。于移除二氯甲烷后,以制备型hplc(45%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x500mm;流速55ml/min;z-saa1(x)-ohrt11min;z-saa2(x)-ohrt12min)对粗产物液体进行纯化。于收集z-saa1(x)-oh及z-saa2(x)-oh溶液后立即碱化。于移除乙腈后,将z-saa1(x)-oh及z-saa2(x)-oh水溶液与二氯甲烷混合,并以柠檬酸溶液小心酸化,直至ph达约3-4。以二氯甲烷对z-saa1(x)-oh及z-saa2(x)-oh溶液进行萃取,并以无水硫酸镁对有机层进行干燥。于移除二氯甲烷后,获得半固体的416mg的z-saa1(x)-oh及104mg的z-saa2(x)-oh。<中间体>实施例7val-cit-apea-af之合成将z-val-cit(16.34g,40mmol)及apea-boc(5.91g,25mmol)加入二氯甲烷(1.5l)与异丙醇(0.5l)的混合液中,并搅拌3小时,之后,加入eedq(9.89g,40mmol)。于室温对混浊溶液进行搅拌。由于产物的析出,未溶的z-val-cit逐渐消失,且于1日后,溶液逐渐混浊。于48小时后,以hplc测试反应完成。于减压环境下,蒸馏反应混合物,直至形成厚的糊状物。对混合物进行过滤,并以异丙醇(400ml)清洗2次,以水(400ml)清洗2次。固体产物悬浮于水(800ml)中,并予以冷冻干燥,以获得白色粉末的z-val-cit-apea-boc(16.62g,61%)。将z-val-cit-apea-boc(18.80g,30mmol)加入二氯甲烷(200ml)中,并以三氟乙酸(15ml)进行处理过夜。于减压环境下,蒸馏二氯甲烷。于油状残留物中,加入乙酸乙酯(100ml),并于减压环境下,进行蒸馏。上述步骤重复两次以上,并于油状产物中,加入乙醚(300ml),以迫使三氟乙酸酯析出。将乙醚溶液倒出。固体产物以乙酸乙酯(500ml)进行搅拌,并过滤之。固体产物悬浮于碳酸钠溶液(1m,500ml)中,并搅拌直至悬浮均匀。将混合物离心,并倒出上清液。固体重悬浮于水(500ml)中,并进行离心。上述步骤进行两次。将灰白色湿的固体产物再悬浮于水(500ml)中,并予以冷冻干燥,以获得z-val-cit-apea(9.87g,63%)。将海兔毒素f盐酸盐(626mg,0.8mmol)溶于dmf(10ml)与二氯甲烷(10ml)的混合液中。于加入z-val-cit-apea(506mg,0.96mmol,1.2eq)及hatu(365mg,0.96mmol,1.2eq)后,将反应混合物浸于冰浴中,之后,加入dipea(351mg,2.72mmol,3.4eq)。于30分钟后,移开冰浴,于室温搅拌反应混合物过夜。之后,于减压环境下,蒸馏溶剂,并以制备型hplc(45%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对粗产物进行纯化,以获得白色固体的z-val-cit-apea-af(574mg,51%)。lc-ms:z-val-cit-apea-af(c67h103n11o12)required[mh+]=1254.8,found[mh+]=1256.1。将z-val-cit-apea-af(502mg,0.42mmol)溶于包含2n盐酸(630μl)的乙醇(30ml)。于加入pd/c(10%,30mg)后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(10ml)混合,并予以冷冻干燥,以获得白色固体的val-cit-apea-af(420mg,83%)。lc-ms:val-cit-apea-af(c59h97n11o10)required[mh+]=1121.5,found[mh+]=1121.5。<连接子-毒素>实施例8mc-val-cit-apea-af之合成将val-cit-apea-boc(65mg)与mc-opfp(50mg)溶于dmf(5ml),并加入dipea(0.023ml)。于5小时后,于减压环境下,移除dmf与dipea。以制备型hplc(50%乙腈/水/0.1%tfa;uv210nm;ods-3管柱50x500mm;流速80ml/min;rt13.60min)对粗产物进行纯化,以获得白色固体的mc-val-cit-apea-boc(40mg)。lc-ms:mc-val-cit-apea-boc(c34h51n7o8)required[mh+]=686.4,found[mh+]=687.3。于室温,将mc-val-cit-apea-boc(40mg)/dcm(5ml)以tfa(300l)进行处理。于17小时后,于减压环境下,移除dcm与tfa,以获得淡黄色固体的mc-val-cit-apea(46mg)。lc-ms:mc-val-cit-apea(c29h43n7o6)required[mh+]=586.3,found[mh+]=586.7。将mc-val-cit-apea(37mg)与海兔毒素f(47mg)溶于dcm与dmf(10:1,3.7ml)的混合液中。之后,加入hbtu(37mg)与dipea(0.037ml)。于17小时后,于减压环境下,移除dcm与dmf以制备型hplc(40%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min;rt14min)对粗产物进行纯化,以获得白色固体的mc-val-cit-apea-af(9mg)。lc-ms:mc-val-cit-apea-af(c70h109n11o13)required[mh+]=1312.8,found[mh+]=1315.2。实施例9mc-saa1-phe-cit-apea-af之合成将z-phe-cit(9.13g,20mmol)加入二氯甲烷(750ml)及异丙醇(250ml)的混合液中,并搅拌直至双肽完全溶解。之后,加入apea-boc(7.09g,30mmol)及eedq(7.42g,30mmol),并于室温搅拌混合物3天。于减压环境下,移除溶剂,并加入乙醚(300ml)于残留物中。过滤混合物,并将粗产物再悬浮于乙醚(300ml)中。上述步骤重复3次。于真空环境下,对收集的固体产物进行干燥,以获得z-phe-cit-apea-boc(9.53g,产率70.6%)。产物以pmr进行鉴定。将z-phe-cit-apea-boc(2.02g,3mmol)溶于thf(250ml)与甲醇(50ml)的混合液中。于加入催化量的pd/c(10%)后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂滤除后,于减压环境下,蒸馏滤液,以获得白色固体的phe-cit-apea-boc(1.61g,99%)。将hbtu(1.118g)与dipea(1.02ml)加入n3-saa1(x)-oh(633mg)与phe-cit-apea-boc(1.33g)溶于dcm与dmf(10:1,110ml)的混合液中。于17小时后,于减压环境下,移除dcm。于剩余的粗dmf溶液中,加入水与乙醚,于过滤后,获得米色固体。以浓柠檬酸水溶液清洗固体数次,以移除大部分的hobt与dmf。以制备型hplc(50%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm)对n3-saa1(x)-phe-cit-apea-boc进行纯化。于减压环境下,蒸馏乙腈,并对剩余的水溶液进行冷冻干燥,以获得含有n3-saa1(x)-phe-cit-apea-boc与n3-saa1-phe-cit-apea-boc的白色固体(1g)。lc-ms:n3-saa1(x)-phe-cit-apea-boc(c38h53n9o9)required[mh+]=780.9,found[mh+]=781.8;n3-saa1-phe-cit-apea-boc(c35h49n9o9)required[mh+]=740.8,found[mh+]=741.7。将n3-saa1(x)-phe-cit-apea-boc与n3-saa1-phe-cit-apea-boc的混合物(100mg)溶于甲醇(50ml)。于加入催化量的pd/c(10%)后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂滤除后,于减压环境下,移除甲醇,以获得含有saa1(x)-phe-cit-apea-boc与saa1-phe-cit-apea-boc的白色固体(78mg)。将mc-opfp(103mg)加入saa1(x)-phe-cit-apea-boc/saa1-phe-cit-apea-boc(210mg)/甲醇(50ml)的溶液中,之后,加入dipea(0.047ml)。于17小时后,对反应混合物进行浓缩。以制备型hplc(50%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x500mm;流速40ml/min)对粗产物进行纯化,以获得mc-saa1(x)-phe-cit-apea-boc与mc-saa1-phe-cit-apea-boc的溶液。以浓盐酸(10eq.)对mc-saa1(x)-phe-cit-apea-boc与mc-saa1-phe-cit-apea-boc的溶液进行处理。反应由分析型hplc进行监测,直至水解完成。于减压环境下,移除乙腈,并于水溶液进行冷冻干燥后,获得固体的mc-saa1-phe-cit-apea。lc-ms:mc-saa1-phe-cit-apea(c40h54n8o10)required[mh+]=807.4,found[mh+]=809.1。将mc-saa1-phe-cit-apea(110mg)溶于dcm与dmf(10:1,10ml)的混合液中,并分别加入海兔毒素f(93mg)、hbtu(55mg)与dipea(0.077ml)。于17小时后,于减压环境下,移除dcm、dmf及dipea。以制备型hplc(35%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速40ml/min)对粗产物进行纯化。于减压环境下,移除标的分馏物中的乙腈,并对剩余的水溶液进行冷冻干燥,以获得白色固体的mht-47(20mg)。lc-ms:mc-saa1-phe-cit-apea-af(c80h119n13o17)required[mh+]=1534.9,found[mh+]=1538.0。实施例10mc-saa1-val-cit-apea-af之合成将hbtu(32.5mg)与dipea(0.029ml)分别加入z-saa1(x)-oh(26.1mg)与val-cit-apea-af(80mg)溶于dcm与dmf(10:1,4.4ml)的混合液中。于18小时后,于减压环境下,移除溶剂,并以制备型hplc(45%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x500mm;流速65ml/min;rt11min)对粗产物进行纯化。于移除乙腈后,将水溶液置于冰箱中过夜,直至z-saa1(x)-val-cit-apea-af完全转变为z-saa1-val-cit-apea-af。对水溶液进行冷冻干燥,以获得白色固体的z-saa1-val-cit-apea-af(63mg,两步骤以上的产率63%)。将z-saa1-val-cit-apea-af(63mg)溶于甲醇(5ml),之后,加入催化剂pd/c。将反应混合物导入氢气球,并搅拌3小时。以硅藻土垫将pd/c滤除后,于减压环境下,蒸馏滤液,以获得白色固体的saa1-val-cit-apea-af(52.5mg)。将dipea(0.0056ml)加入saa1-val-cit-apea-af(40mg)/mc-opfp(11.6mg)/甲醇(4ml)的溶液中。反应搅拌过夜,并于减压环境下,进行蒸馏。以制备型hplc(35%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x500mm;流速70ml/min;rt18min)对粗产物进行纯化,以获得白色固体的mc-saa1-val-cit-apea-af(mht-71)(27mg,47%)。lc-ms:mc-saa1-val-cit-apea-af(c76h120n13o17)required[mh+]=1486.9,found[mh+]=1487.2。实施例11cl2mc-saa1-val-cit-apea-af之合成将3,4-二氯-呋喃-2,5-二酮(10.34g,0.0619mol)与6-胺基己酸(8.13g,0.0619mmol)混合于冰醋酸(50ml)中。混合物回流12小时。于减压环境下,蒸馏溶剂后,以快速管柱色层分析(乙酸乙酯/己烷=2/3)对残留物进行纯化,以获得白色粉末的cl2mc(12.48g,72%)。lc-ms:cl2mc(c10h11cl2no4)required[m-co2]+=235.0,found[m-co2]+=235.0。将dcc(0.83g,4.0mmol)加入cl2mc(1.06g,3.8mmol)/五氟苯酚(0.84g,4.5mmol)/二氯甲烷(25ml)的溶液中。于室温搅拌反应混合物12小时,并过滤以移除不溶性的dcu。于减压环境下,蒸馏反应混合物,直至体积达到约10ml。将溶液储存于4℃冰箱2小时。滤除不溶性材料,并将滤液以快速管柱色层分析(乙酸乙酯/己烷=1/30-1/20)进行纯化,以获得白色固体的cl2mc-opfp(1.39g,82%)。将dipea(0.002ml,0.0116mmol)加入saa1-val-cit-apea-af(5.0mg,0.0039mmol)/cl2mc-opfp(2.0mg,0.0046mmol)/dmf(1ml)的溶液中。于室温搅拌混合物1小时,并于减压环境下,进行蒸馏。以制备型hplc(35%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速25ml/min)对粗产物进行纯化,以获得白色固体的cl2mc-saa1-val-cit-apea-af(3.0mg,50%)。lc-ms:cl2mc-saa1-val-cit-apea-af(c76h117cl2n13o17)required[m+2h]2+=777.9,found[m+2h]2+=779.4。实施例12br2mc-saa1-val-cit-apea-af之合成将氯甲酸甲酯(0.303ml,3.92mmol)加入3,4-二溴-吡咯-2,5-二酮(1.00g,3.92mmol)/n-甲基吗啉(0.431ml,3.92mmol)/thf(35ml)的溶液中。于室温搅拌反应混合物3小时,之后,加入二氯甲烷(40ml),并以水(40ml)清洗有机相3次。以无水硫酸镁对有机溶液进行干燥,并于减压环境下,进行蒸馏,以获得粉色粉末的3,4-二溴-2,5-二氧代-2,5-二氢-吡咯-1-羧酸甲酯(1.13g,93%)。将6-胺基己酸(476.0mg,3.6mmol)溶于乙腈与水的混合溶液(3:2,50ml)中。溶液于冰浴中冷却,并以饱和碳酸氢钠溶液(1ml)进行处理,之后,加入3,4-二溴-2,5-二氧代-2,5-二氢-吡咯-1-羧酸甲酯(1.13g,3.6mmol)。于室温搅拌混合物12小时,并以柠檬酸溶液调整ph至3-4。于减压环境下,蒸馏混合物,以移除乙腈。以快速管柱色层分析(乙酸乙酯/己烷,2/3)对残留物进行纯化,以获得白色粉末的br2mc(1.33g,99%)。lc-ms:br2mc(c10h11br2no4)required[m+h]+=369.9,found[m+h]+=371.0。将dcc(0.79g,3.8mmol)加入br2mc(1.33g,3.86mmol)/五氟苯酚(0.80g,4.3mmol)/二氯甲烷(40ml)的溶液中。于室温搅拌反应混合物12小时,并过滤以移除不溶性的dcu。于减压环境下,蒸馏反应混合物,直至体积达到约10ml。将溶液储存于4℃冰箱2小时。滤除不溶性材料,并将滤液以快速管柱色层分析(乙酸乙酯/己烷=1/30-1/20)进行纯化,以获得白色固体的br2mc-opfp(1.50g,78%)。将dipea(0.0036ml,0.0206mmol)加入saa1-val-cit-apea-af(8.9mg,0.0069mmol)/br2mc-opfp(4.5mg,0.0083mmol)/dmf(1ml)的溶液中。于室温搅拌混合物1小时,并于减压环境下,进行蒸馏。以制备型hplc(35%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速25ml/min)对粗产物进行纯化,以获得白色固体的br2mc-saa1-val-cit-apea-af(5.6mg,50%)。lc-ms:br2mc-saa1-val-cit-apea-af(c76h117br2n13o17)required[m+h]+=1644.7,found[m+h]+=1645.1。实施例13mc-saa1-val-cit-apea(coome)-af之合成将z-val-cit-oh(3.24g,7.93mmol)加入二氯甲烷与甲醇的混合液(3:1,80ml)中。于加入apea(coome)-boc(2.8g,9.52mmol)后,加入偶联剂eedq(2.47g,9.52mmol),并于室温对混浊溶液进行搅拌。未溶的z-val-cit逐渐消失,溶液逐渐清澈。于48小时后,以hplc测试反应完成。于减压环境下,蒸馏反应混合物,直至形成厚的糊状物。对混合物进行过滤,并以正己烷(50ml)清洗2次,以水(50ml)清洗2次,以乙醚(50ml)清洗2次。于真空环境下,对固体产物进行干燥,以获得棕色粉末的z-val-cit-apea(coome)-boc(75.0mg,1.4%)。将z-val-cit-apea(coome)-boc(75.0mg,0.11mmol)加入二氯甲烷(8ml)中,并于室温以三氟乙酸(0.09ml)进行处理。于4小时后,于减压环境下,蒸馏溶剂。将残留物与水(10ml)混合,并予以冷冻干燥,以获得白色粉末的z-val-cit-apea(coome)(96.0mg)。将海兔毒素f(80.0mg,0.102mmol)溶于少量dmf(1ml),并以dcm(10ml)进行稀释。将溶液浸于冰浴中,并加入z-val-cit-apea(coome)(71.4mg,0.102mmol)及hatu(43.0mg,0.113mmol)。于加入dipea(0.071ml)后,移开冰浴。于室温搅拌混合物4小时后,于减压环境下,蒸馏溶剂,并以制备型hplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化,以获得白色固体的z-val-cit-apea(coome)-af(82.0mg,61%)。将z-val-cit-apea(coome)-af(82.0mg,0.062mmol)溶于包含盐酸(0.24mmol)的乙醇(10ml)。于加入pd/c(10%,10mg)后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将残留物与水(10ml)混合,并予以冷冻干燥,以获得白色粉末的val-cit-apea(coome)-af(72.8mg,96%)。lc-ms:val-cit-apea(coome)-af(c61h99n11o12)required[mh+]=1178.8,found[mh+]=1179.7。将z-saa1(x)-oh(22.0mg,0.06mmol)溶于二氯甲烷(10ml)。于加入hatu(25.3mg,0.066mmol)后,将反应混合物浸于冰浴中,之后,加入dipea(0.032ml,0.06mmol)。于10分钟后,移开冰浴,并将val-cit-apea(coome)-af(72.8mg,0.06mmol)/dmf(3ml)溶液于室温加入反应混合物中。于3小时后,于减压环境下,蒸馏溶剂,并以制备型hplc(45%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,以使z-saa1(x)-val-cit-apea(coome)-af完全水解。将水溶液予以冷冻干燥,以获得白色固体的z-saa1-val-cit-apea(coome)-af(43.5mg,两步骤以上的产率49%)。lc-ms:z-saa1-val-cit-apea(coome)-af(c79h120n12o18)required[mh+]=1525.9,found[mh+]=1526.8。将z-saa1-val-cit-apea(coome)-af(43.5mg,0.029mmol)溶于包含盐酸(0.06mmol)的乙醇(5ml)。于加入pd/c(10%,4.7mg)后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将残留物与水(5ml)混合,并予以冷冻干燥,以获得白色粉末的saa1-val-cit-apea(coome)-af(38.4mg,94%)。将dipea(0.004ml)加入saa1-val-cit-apea(coome)-af(15.0mg,0.011mmol)/mc-opfp(4.5mg,0.012mmol)/dmf(4ml)的溶液中。于室温搅拌混合物1小时,并于减压环境下,进行蒸馏。以制备型hplc(36%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的mc-saa1-val-cit-apea(coome)-af(10.0mg,60%)。lc-ms:mc-saa1-val-cit-apea(coome)-af(c78h121n13o19)required[mh+]=1544.9,found[mh+]=1545.8。实施例14mc-saa1-saa1-val-cit-apea-af之合成将z-saa1(x)-oh(28.0mg,0.076mmol)溶于二氯甲烷(1ml)。于加入hatu(23.4mg,0.061mmol)后,将反应混合物浸于冰浴中,之后,加入dipea(7.9mg,0.061mmol)。于10分钟后,移开冰浴,并将saa1-val-cit-apea-af(70.0mg,0.051mmol)/dmf(3ml)溶液于室温加入反应混合物中。于1小时后,于减压环境下,蒸馏溶剂,并以制备型hplc(39%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对粗产物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,以使z-saa1(x)-saa1-val-cit-apea-af完全水解。将水溶液予以冷冻干燥,以获得白色固体的z-saa1-saa1-val-cit-apea-af(64mg,两步骤以上的产率78%)。lc-ms:z-saa1-saa1-val-cit-apea-af(c81h125n13o20)required[mh+]=1602.0,found[mh+]=1601.5。将z-saa1-saa1-val-cit-apea-af(64.0mg,0.042mmol)溶于包含盐酸(0.136mmol)的乙醇(20ml)。于加入pd/c(10%,6.5mg)后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(10ml)混合,并予以冷冻干燥,以获得白色固体的saa1-saa1-val-cit-apea-af(60.0mg,97%)。lc-ms:saa1-saa1-val-cit-apea-af(c73h119n13o18)required[mh+]=1466.9,found[mh+]=1467.5。将saa1-saa1-val-cit-apea-af(30.0mg,0.019mmol)与dipea(7.4mg,0.057mmol)溶于dmf(2ml)。将反应混合物浸于冰浴后,加入mc-opfp(9.0mg,0.023mmol)。于10分钟后,移开冰浴,并于室温搅拌混合物1小时。于减压环境下,蒸馏溶剂,并以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对粗产物进行纯化,以获得白色固体的mc-saa1-saa1-val-cit-apea-af(18.5mg,53%)。lc-ms:mc-saa1-saa1-val-cit-apea-af(c83h130n14o21)required[mh+]=1660.0,found[mh+]=1660.7。实施例15cl2mc-saa1-saa1-val-cit-apea-af之合成将saa1-saa1-val-cit-apea-af(3.0mg,0.00065mmol)与dipea(0.003ml,0.0164mmol)溶于dmf(1ml)。将反应混合物浸于冰浴后,加入cl2mc-opfp(3.0mg,0.0065mmol)。于10分钟后,移开冰浴,并于室温搅拌混合物1小时。于减压环境下,蒸馏溶剂,并以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对粗产物进行纯化,以获得白色固体的cl2mc-saa1-saa1-val-cit-apea-af(2.8mg,30%)。lc-ms:cl2mc-saa1-saa1-val-cit-apea-af(c83h128cl2n14o21)required[m+h]+=1727.9,found[m+h]+=1729.6。实施例16cl2mc-saa1-saa1-saa1-val-cit-apea-af之合成将dcc(0.133g,0.6411mmol)加入z-saa1(x)-oh(0.221g,0.6048mmol)/五氟苯酚(0.134g,0.7258mmol)/二氯甲烷(20ml)的溶液中。于室温搅拌反应混合物12小时,并过滤以移除不溶性的dcu。于减压环境下,蒸馏反应混合物,直至体积达到约10ml。将溶液储存于4℃冰箱2小时。滤除不溶性材料,并将滤液以快速管柱色层分析(乙酸乙酯/己烷=1/4-1/2)进行纯化,以获得白色固体的z-saa1(x)-opfp(0.201g,63%)。lc-ms:z-saa1(x)-opfp(c24h22f5no7)required[m+h]+=532.1,found[m+h]+=533.1。将saa1-saa1-val-cit-apea-af(4.8mg,0.0090mmol)与dipea(0.004ml,0.0225mmol)溶于dmf(1ml)。将反应混合物浸于冰浴后,加入z-saa1(x)-opfp(4.8mg,0.009mmol)。于10分钟后,移开冰浴,并于室温搅拌混合物3小时。于减压环境下,蒸馏溶剂,并以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对粗产物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,以水解缩丙酮基。将水溶液予以冷冻干燥,以获得白色固体的z-saa1-saa1-saa1-val-cit-apea-af(13.0mg,两步骤以上的产率97%)。lc-ms:z-saa1-saa1-saa1-val-cit-apea-af(c88h136n14o24)required[m+h]+=1774.0,found[m+h]+=1774.9。将z-saa1-saa-saa1-val-cit-apea-af[fcw-043](13.0mg,0.0075mmol)溶于包含盐酸(0.0126mmol)的乙醇(10ml)。于加入pd/c(10%,0.8mg)后,将反应混合物导入氢气球,并搅拌过夜。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(5ml)混合,并予以冷冻干燥,以获得白色固体的saa1-saa1-saa1-val-cit-apea-af(9.0mg,75%)。lc-ms:saa1-saa1-saa1-val-cit-apea-af(c80h130n14o22)required[m+h]+=1640.0,found[m+h]+=1640.9。将saa1-saa1-saa1-val-cit-apea-af(5.0mg,0.0031mmol)与dipea(0.002ml,0.0092mmol)溶于dmf(1ml)。将反应混合物浸于冰浴后,加入cl2mc-opfp(2.0mg,0.0037mmol)。于10分钟后,移开冰浴,并于室温搅拌混合物3小时。于减压环境下,蒸馏溶剂,并以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min)对粗产物进行纯化,以获得白色固体的cl2mc-saa1-saa1-saa1-val-cit-apea-af(1.0mg,17%)。lc-ms:cl2mc-saa1-saa1-saa1-val-cit-apea-af(c90h139cl2n15o25)required[m+h]+=1901.0,found[m+h]+=1902.8。实施例17mc-saa3-val-cit-apea-af之合成将hatu(22.0mg,0.0572mmol)与dipea(0.027ml,0.156mmol)分别加入z-saa3(x)-oh(18.2mg,0.052mmol)与val-cit-apea-af(60.0mg,0.052mmol)溶于dcm与dmf(10:1,6ml)的混合液中。于18小时后,于减压环境下,移除溶剂,并以制备型hplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,直至缩丙酮基完全移除。将水溶液予以冷冻干燥,以获得白色固体的z-saa3-val-cit-apea-af(48.0mg,两步骤以上的产率65%)。将z-saa3-val-cit-apea-af(48.0mg,0.034mmol)溶于包含盐酸(0.014ml)的乙醇(5ml)。于加入pd/c(10%,4.7mg)后,将反应混合物导入氢气球,并搅拌5小时。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(5ml)混合,并予以冷冻干燥,以获得白色固体的saa3-val-cit-apea-af(42.0mg,94%)。将dipea(0.006ml)加入saa3-val-cit-apea-af(20.0mg,0.015mmol)/mc-opfp(6.3mg,0.0165mmol)/dmf(4ml)的溶液中。反应于室温搅拌1小时,并于减压环境下,进行蒸馏。以制备型hplc(36%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的mc-saa3-val-cit-apea-af(12.2mg,55%)。lc-ms:mc-saa3-val-cit-apea-af(c75h117n13o17)required[mh+]=1473.8,found[mh+]=1473.6。实施例18mc-saa3-saa3-val-cit-apea-af之合成将hatu(17.3mg,0.045mmol)与dipea(0.02ml,0.123mmol)分别加入z-saa3(x)-oh(14.5mg,0.041mmol)与saa3-val-cit-apea-af(54.5mg,0.041mmol)溶于dcm与dmf(10:1,6ml)的混合液中。于18小时后,于减压环境下,蒸馏溶剂,并以制备型hplc(41%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,直至缩酮基完全移除。将水溶液予以冷冻干燥,以获得白色固体的z-saa3-saa3-val-cit-apea-af(21.3mg,两步骤以上的产率33%)。将z-saa3-saa3-val-cit-apea-af(21.3mg,0.0135mmol)溶于包含盐酸(0.052mmol)的乙醇(5ml)。于加入pd/c(10%,2.5mg)后,将反应混合物导入氢气球,并搅拌5小时。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(5ml)混合,并予以冷冻干燥,以获得白色固体的saa3-saa3-val-cit-apea-af(16.1mg,81%)。将dipea(0.004ml)加入saa3-saa3-val-cit-apea-af(16.1mg,0.0109mmol)/mc-opfp(4.5mg,0.012mmol)/dmf(5ml)的溶液中。于室温搅拌反应混合物1小时,并于减压环境下,进行蒸馏。以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的mc-saa3-saa3-val-cit-apea-af(9.2mg,52%)。lc-ms:mc-saa3-saa3-val-cit-apea-af(c81h126n14o21)required[mh+]=1633.0,found[mh+]=1633.2。实施例19mc-saa4-val-cit-apea-af之合成将hatu(18.1mg,0.0473mmol)与dipea(0.023ml,0.129mmol)分别加入z-saa4(x)-oh(15.2mg,0.043mmol)与val-cit-apea-af(50.0mg,0.043mmol)溶于dcm与dmf(10:1,6ml)的混合液中。于18小时后,于减压环境下,移除溶剂,并以制备型hplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,直至丙酮基完全移除。将水溶液予以冷冻干燥,以获得白色固体的z-saa3-val-cit-apea-af(32.4mg,两步骤以上的产率53%)。将z-saa3-val-cit-apea-af(32.4mg,0.0229mmol)溶于包含盐酸(0.09mmol)的乙醇(5ml)。于加入pd/c(10%,4.0mg)后,将反应混合物导入氢气球,并搅拌5小时。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(5ml)混合,并予以冷冻干燥,以获得白色固体的saa4-val-cit-apea-af(30.0mg,98%)。将dipea(0.006ml)加入saa4-val-cit-apea-af(20.0mg,0.015mmol)/mc-opfp(6.3mg,0.0165mmol)/dmf(4ml)的溶液中。反应于室温搅拌1小时,并于减压环境下,进行蒸馏。以制备型hplc(36%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的mc-saa4-val-cit-apea-af(15.6mg,70%)。lc-ms:mc-saa4-val-cit-apea-af(c75h117n13o17)required[mh+]=1473.8,found[mh+]=1473.6。实施例20mc-saa5-val-cit-apea-af之合成将hatu(40mg,0.1060mmol)加入val-cit-apea-af(99mg,0.0884mmol)、z-saa5-oh(36mg,0.1060mmol)与dipea(0.046ml,0.2651mmol)溶于dmf(2ml)与二氯甲烷(20ml)的搅拌溶液中。于室温搅拌12小时后,蒸馏溶剂,并以制备型hplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,直至丙酮基完全移除。将水溶液予以冷冻干燥,以获得白色粉末的z-saa5-val-cit-apea-af(33mg,26%)。lc-ms:z-saa5-val-cit-apea-af(c75h115n11o17)required[m+2h]2+=721.9,found[m+2h]2+=723.6。将z-saa5-val-cit-apea-af(35.0mg,0.024mmol)溶于包含盐酸(0.048mmol)的乙醇(8ml)。于加入pd/c(10%,2.6mg)后,将反应混合物导入氢气球,并搅拌16小时。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(10ml)混合,并予以冷冻干燥,以获得白色固体的saa5-val-cit-apea-af(30.0mg,95%)。lc-ms:saa5-val-cit-apea-af(c67h109n11o15)required[m+2h]2+=654.9,found[m+2h]2+=656.6。将dipea(0.0066ml,0.0378mmol)加入saa5-val-cit-apea-af(16.5mg,0.0126mmol)/mc-opfp(5.7mg,0.0151mmol)/dmf(3ml)的溶液中。反应于室温搅拌3小时,并于减压环境下,进行蒸馏。以制备型hplc(36%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30x250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的mc-saa5-val-cit-apea-af(12.0mg,63%)。lc-ms:mc-saa5-val-cit-apea-af(c77h120n12o18)required[m+2h]2+=751.4,found[m+2h]2+=753.1。实施例21mc-saa6-val-cit-apea-af之合成将质子海绵(63mg)与hbtu(170mg)加入z-saa6(x)-oh(100mg)/二氯甲烷(10ml)的溶液中。之后,加入val-cit-apea-boc(150mg)/dmf(1ml)溶液,并静置过夜。于移除溶剂后,以制备型hplc(50%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*500mm;流速70ml/min;rt15min)对粗产物进行纯化。于移除乙腈后,将水溶液于室温静置过夜,直至丙酮基完全移除。将水溶液予以冷冻干燥,以获得白色固体的z-saa6(x)-val-cit-apea-boc(122.1mg)。lc-ms:z-saa6(x)-val-cit-apea-boc(c40h57n7o11)required[mh+]=812.42,found[mh+]=813.2。将z-saa6(x)-val-cit-apea-boc(50mg)溶于甲醇(2ml),之后,加入催化剂pd/c。将反应混合物导入氢气球,并静置17小时。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏甲醇,以获得白色固体的saa6(x)-val-cit-apea-boc(37.4mg)。将saa6(x)-val-cit-apea-boc(47mg)与mc-opfp(28mg)溶于dmf(4ml)。加入dipea(0.0141ml)于反应混合物中。于5小时后,于减压环境下,移除dmf与dipea。以制备型hplc(50%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*500mm;流速45-50ml/min;rt10.8min)对粗产物进行纯化,以获得白色固体的mc-saa6(x)-val-cit-apea-boc(42.5mg)。lc-ms:mc-saa6(x)-val-cit-apea-boc(c42h62n8o12)required[mh+]=871.46,found[mh+]=871.5。以tfa(0.1ml)于室温对mc-saa6(x)-val-cit-apea-boc(42.5mg)/dcm(10ml)进行处理。于17小时后,于减压环境下,移除dcm与tfa,以获得淡黄色固体的[00358]mc-saa6(x)-val-cit-apea(40mg)。lc-ms:mc-saa6(x)-val-cit-apea(c37h54n8o10)required[mh+]=771.40,found[mh+]=771.9。将mc-saa6(x)-val-cit-apea(32mg)与海兔毒素f(27mg)溶于dcm与dmf(10:1,12ml)的混合液中。之后,分别加入hbtu(20.5mg)与dipea(0.022ml)。于17小时后,于减压环境下,移除dcm与dmf。以制备型hplc(40%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*500mm;流速30ml/min)对粗产物进行纯化,以获得白色固体的mc-saa6(x)-val-cit-apea-af(15mg)。lc-ms:mc-saa6(x)-val-cit-apea-af(c77h119n13o17)required[mh+]=1498.89,found[mh+]=1500.7。实施例22mc-saa7-val-cit-apea-af之合成将val-cit-apea-boc(2.46g,5mmol)与z-saa7-oh(1.71g,5mmol)溶于dmf(100ml)。之后,将dipea(646.2mg,5mmol)与hatu(1.90g,5mmol)加入反应混合物中。于室温搅拌混合物16小时后,于减压环境下,蒸馏溶剂。以乙酸乙酯(200ml)搅拌残留物数小时,直至细白色粉末形成。滤除固体产物。以水(200ml)煮沸白色粉末15分钟,并同时过滤。以热水(50ml)清洗产物2次,并于真空下干燥,以获得z-saa7-val-cit-apea-boc。将z-saa7-val-cit-apea-boc(200mg)溶于甲醇(50ml),之后,加入催化剂pd/c。将反应导入氢气球,并静置17小时。以硅藻土垫将催化剂滤除,并于减压环境下,蒸馏甲醇,以获得白色固体的saa7-val-cit-apea-boc(148mg)。将saa7-val-cit-apea-boc(240mg)、mc-opfp(144mg)与dipea(0.072ml)溶于dmf(20ml)。于5小时后,于减压环境下,移除dmf与dipea。将残留物与45%乙腈/水(20ml)混合,并进行离心。于移除液体部分后,获得白色固体的mc-saa7-val-cit-apea-boc(200mg)。lc-ms:mc-saa7-val-cit-apea-boc(c41h62n8o13)required[mh+]=875.5,found[mh+]=875.8。以tfa(0.5ml)于室温对mc-saa7-val-cit-apea-boc(200mg)/dcm(30ml)进行处理。于17小时后,于减压环境下,移除dcm与tfa,以获得淡黄色固体的mc-saa7-val-cit-apea(180mg)。lc-ms:mc-saa7-val-cit-apea(c36h54n8o11)required[mh+]=775.4,found[mh+]=776.0。将mc-saa7-val-cit-apea(80mg)与海兔毒素f(77mg)溶于dcm与dmf(10:1,16.6ml)的混合液中。之后,分别加入hbtu(64mg)与dipea(0.064ml)。于17小时后,于减压环境下,移除dcm与dmf。以制备型hplc(40%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速25ml/min;rt10.42min)对粗产物进行纯化,以获得白色固体的mc-saa7-val-cit-apea-af(50.9mg)。lc-ms:mc-saa7-val-cit-apea-af(c77h120n12o18)required[mh+]=1503.0,found[mh+]=1504.1。实施例23mc-saa8-val-cit-apea-af之合成将质子海绵(63mg)与hbtu(170mg)加入z-saa8(x)-oh(100mg)/dcm(10ml)的溶液中。之后,加入val-cit-apea-boc(150mg)/dmf(1ml)溶液,并将反应混合物静置过夜。于移除溶剂后,以制备型hplc(55%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*500mm;流速60ml/min;rt13min)对残留物进行纯化,以获得白色固体的z-saa8(x)-val-cit-apea-boc(144.6mg)。lc-ms:z-saa8(x)-val-cit-apea-boc(c40h57n7o11)required[mh+]=812.4,found[mh+]=813.4。将z-saa8(x)-val-cit-apea-boc(70mg)溶于甲醇(10ml),之后,加入催化剂pd/c。将反应导入氢气球,并静置17小时。以硅藻土垫将催化剂滤除,并于减压环境下,蒸馏滤液,以获得白色固体的saa8(x)-val-cit-apea-boc(54mg)。将saa8(x)-val-cit-apea-boc(44mg)与mc-opfp(24.2mg)溶于dmf(4ml)。之后,加入dipea(0.0141ml)。于5小时后,于减压环境下,移除dmf与dipea。以制备型hplc(45%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速35-40ml/min;rt13min)对残留物进行纯化,以获得白色固体的mc-saa8(x)-val-cit-apea-boc(40mg)。lc-ms:mc-saa8(x)-val-cit-apea-boc(c42h62n8o12)required[mh+]=871.5,found[mh+]=872.0。以tfa(0.1ml)于室温对mc-saa8(x)-val-cit-apea-boc(40mg)/dcm(2ml)进行处理。于17小时后,于减压环境下,移除dcm与tfa,以获得淡黄色固体的mc-saa8(x)-val-cit-apea(40mg)。lc-ms:mc-saa8(x)-val-cit-apea(c37h54n8o10)required[mh+]=771.4,found[mh+]=771.9。将mc-saa8(x)-val-cit-apea(25.6mg)与海兔毒素f(24.5mg)溶于dcm与dmf(10:1,5.5ml)的混合液中。之后,分别加入hbtu(20.5mg)与dipea(0.022ml)。于17小时后,于减压环境下,移除dcm与dmf。以制备型hplc(40%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速35-40ml/min)对残留物进行纯化,以获得白色固体的mc-saa8(x)-val-cit-apea-af(3.3mg)。lc-ms:mc-saa8(x)-val-cit-apea-af(c78h120n12o17)required[mh+]=1497.9,found[mh+]=1500.5。实施例24mc-val-cit-aaf-3aq之合成将aaf-3aq(30.8mg,0.035mmol)溶于etoh(10ml)与dcm(10ml)的混合液中。于加入z-val-cit(15.7mg,0.038mmol)与eedq(13mg,0.052mmol)后,于室温搅拌混合物7天。于减压环境下,蒸馏反应混合物,并以制备型hplc(34%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)纯化之,以获得白色固体的z-val-cit-aaf-3aq(4.83mg,10.7%)。lc-ms:z-val-cit-aaf-3aq(c69h101n11o12)required[mh+]=1277.6,found[mh+]=1278.9。将z-val-cit-aaf-3aq(4.8mg,0.00376mmol)溶于乙醇(10ml)。于加入pd/c(10%,16mg)后,将反应混合物导入氢气球,并搅拌4小时。以硅藻土垫将催化剂pd/c滤除,并于减压环境下,蒸馏滤液。将产物与水(5ml)混合,并予以冷冻干燥,以获得白色固体的val-cit-aaf-3aq(4.2mg,98%)。lc-ms:val-cit-aaf-3aq(c61h95n11o10)required[mh+]=1143.5,found[mh+]=1144.7。将val-cit-aaf-3aq(4.8mg,0.00367mmol)与mc-opfp(1.67mg,0.0044mmol)溶于dmf(0.5ml)。加入dipea(1.9mg,0.0147ml)于反应混合物中。于3小时后,于减压环境下,移除dmf与dipea。以制备型hplc(32%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对粗产物进行纯化,以获得白色固体的mc-val-cit-aaf-3aq。lc-ms:mc-val-cit-aaf-3aq(c71h106n12o13)required[mh+]=1336.7,found[mh+]=1337.7。<效力试验>实施例25海兔毒素衍生物之效力将fadu细胞以2500细胞/孔的密度接种于corningcellbind96-孔盘中。于培养24小时后,移除旧的培养基,并将细胞培养于包含mmae、海兔毒素或海兔毒素衍生物,且浓度为10-12m至10-6m(对数连续稀释)的培养基中120小时。之后,将细胞漂洗一次,并以mtt方法测定细胞存活率。将旧的培养基吸出,并于每孔加入包含100μl、0.5mg/mlmtt的培养基。于培养4小时后,移除mtt试剂,并将沈淀物溶于dmso。以吸收波长570nm的微量盘式分析仪(multiskanascent,thermolabsystems)测量细胞的光度强度。以下列方程式计算细胞存活率。细胞存活率(%)=(ins-inb)/(inc-inb)×100%方程式中,“ins”为以既定毒素培养的细胞的光度强度,“inb”为未接种细胞的空白井的强度,以及“inc”为仅以培养基培养的细胞的强度(正控制)。于不同药物浓度(n=6)下,曝露于毒素达120小时后,纪录fadu细胞的体外存活率,并利用origin软体的sigmoidal模型进行数据拟合,以获得ic50值。表2显示fadu细胞中apea-af、pea-af、pea-anf、pea-aaf、3aq-anf、3aq-aaf、npea(coome)-af及apea(coome)-af的效力与已知毒素mmae相当,明显优于另一已知毒素-海兔毒素f(af)。结果指出本揭露新颖的海兔毒素衍生物不但提升对细胞膜的通透性,亦维持对微管蛋白聚合的抑制效果。再者,npea(cooh)-af具有与海兔毒素相近的效力,且apea(cooh)-af显示为最低效力,此结果显示羧基可能会干扰毒素穿过细胞膜的通透性。本揭露新颖毒素的此种行为进一步用于构建无旁观者效应的新颖药物。表2toxinic50(nm)mmae0.38af15.2apea-af0.70pea-af0.43pea-anf1.26pea-aaf0.393aq-anf0.353aq-aaf0.49npea(coome)-af0.44npea(cooh)-af23.2apea(coome)-af0.93apea(cooh)-af>>100<抗体-药物耦合体(adcs)>实施例26erbitux衍生之adcs之制备以2.4莫耳当量tcep/0.025m硼酸钠/0.025m氯化钠/1mmdtpa(ph=8)于37℃对erbitux进行处理2小时。未进一步纯化,将反应混合物冷却至0℃。之后,以5.5莫耳当量连接子-毒素于0℃对部分还原的erbitux进行烷基化反应30分钟。以半胱氨酸(终浓度1mm)淬灭任何未反应、过量的连接子-毒素。以脱盐管柱(thermofisherscientific,mwco:40k)对adcs进行纯化。于冲提过程中,将缓冲液更换为dulbecco's磷酸盐缓冲盐水(thermofisherscientific,pbs)。以hic分析adcs的耦合体分布,并计算平均药物-抗体比(dar)。图1显示本揭露新颖的连接子-毒素mc-saa1-val-cit-apea-af成功地与erbitux形成耦合体,且以hic所测定的平均药物-抗体比为3.8。<热应力试验>实施例27adcs之热应力试验将500μl、3mg/ml的erbitux与adcs/pbs培养于50℃的水浴中。之后,于0、4、7及24小时对抗体与adcs采样,进行sec分析。利用waterspda996hplc的yarra3μmsec-3000(300x7.8mm)管柱依大小分离抗体单体与集合产物。流动相由0.020m磷酸钾、0.025m氯化钾与5%(v/v)异丙醇组成,ph6.95。将30μl样品以0.5ml/min的流速注入管柱中,并于等位条件下分离。于280nm检测吸光度。一并整合于主峰前冲堤出的所有物种,并称为高分子量物种(hmws)。图2显示其连接子包含糖胺基酸单元的erbitux-mc-saa1-val-cit-apea-af及erbitux-mc-saa1-saa1-val-cit-apea-af较其连接子不包含任何糖胺基酸单元的erbitux-vedotin及erbitux-val-cit-apea-af具有较低的hmws百分比。因此,此试验显示具有糖胺基酸单元的连接子不但增加亲水性,亦大幅提升adcs的热稳定性。<胜肽-药物耦合体(pdcs)>实施例28zoptarelin-ga-saa1-val-cit-apea-af之合成将dipea(0.071ml,0.4070mmol)加入zoptarelin(170mg,0.1356mmol)/戊二酸酐(17mg,0.1492mmol)/dmf(4ml)的搅拌溶液中。于室温搅拌12小时后,移除溶剂,并以制备型hplc对残留物进行纯化,以获得白色粉末的zoptarelin-ga(100mg,54%)。lc-ms:zoptarelin-ga(c64h90n18o16),required[mh+]=1367.7,[m+2h+]=684.4;found[mh+]=1368.7,[m+2h+]=685.5。将dcc(1.8mg,0.0088mmol)加入zoptarelin-ga(10mg,0.0073mmol)/五氟苯酚(1.6mg,0.0088mmol)/dmf(1ml)的溶液中。于室温搅拌反应混合物12小时,之后,加入saa1-val-cit-apea-af(9mg,0.0072mmol)/dipea(0.0038ml,0.0216mmol)/dmf(1ml)。再经12小时后,移除溶剂,并以制备型hplc对残留物进行纯化,以获得白色粉末的zoptarelin-ga-saa1-val-cit-apea-af(8mg,43%)。lc-ms:zoptarelin-ga-saa1-val-cit-apea-af(c130h196n30o29),required[m+2h+]=1322.6,[m+3h+]=882.1,[m+4h+]=661.8;found[m+2h+]=1323.7,[m+3h+]=882.7,[m+4h+]=662.6。<小分子-药物耦合体(smdcs)>实施例29fa-c-apea-af之合成将zc-apea(10.2mg,0.027mmol)加入海兔毒素(20.8mg,0.027mmol)/dmf(0.5ml)/dcm(1ml)的溶液中。加入额外的dmf(1ml)与hatu(10.7mg,0.028mmol)于反应混合物中。混合物于冰浴中冷却,并加入dipea(8.03mg,0.062mmol)。于室温反应2小时后,于减压环境下,蒸馏混合物。以制备型hplc(45%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化,以获得白色固体的zc-apea-af(18.2mg,51.1%)。lc-ms:zc-apea-af(c62h94n8o10)required[mh+]=1111.7,found[mh+]=1112.5。将10%pd/c(3mg)与2m盐酸(0.016ml,0.032mmol)加入zc-apea-af(18.2mg,0.014mmol)/etoh(5ml)的溶液中。系统中的空气以氢气替代。反应于环境大气下进行。当zc-apea-af完全消耗时,以滤纸自反应混合物中移除催化剂,并浓缩滤液,之后,与水(5ml)混合,并进行冻干,以获得c-apea-af(14.5mg,99%)。于冰浴中,使叶酸(8.0mg,0.018mmol)与edci(6.2mg,0.040mmol)/nhs(2.6mg,0.026mmol)/dmf(2ml)进行反应。于30分钟后,加入c-apea-af(17.4mg,0.017mmol)与dipea(8.8mg,0.068mmol)。于hplc指示c-apea-af几乎消耗后,自混合物中移除dmf,并以制备型hplc(36%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。将特定分馏物进行浓缩并冻干,以获得黄色固体的fa-c-apea-af(5.4mg,23.3%)。lc-ms:fa-c-apea-af(c73h105n15o13)required[mh+]=1400.8,found[mh+]=1401.8。实施例30fa-val-cit-apea-af之合成将dipea(6.5mg,0.050mmol)、val-cit-apea-af(20.9mg,0.018mmol)、nhs(3.0mg,0.026mmol)与edci(4.0mg,0.026mmol)加入叶酸(11.5mg,0.026mmol)/dmf(1.5ml)的溶液中。反应混合物搅拌过夜。自反应混合物中移除dmf后,以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。将特定分馏物进行浓缩并冻干,以获得黄色固体的fa-val-cit-apea-af(11.6mg,37.4%)。lc-ms:fa-val-cit-apea-af(c78h114n18o14)required[mh+]=1543.9,found[mh+]=1544.8。实施例31fa-c-val-cit-apea-af之合成将zc(9.2mg,0.037mmol)、hatu(16.0mg,0.042mmol)与dipea(9.0mg,0.069mmol)加入val-cit-apea-af(35.6mg,0.029mmol)/dmf(1ml)/dcm(3ml)的溶液中。于室温搅拌混合物过夜。移除溶剂,以制备型hplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。将特定分馏物进行浓缩并冻干,以获得黄色固体的zc-val-cit-apea-af(19.0mg,42.9%)。lc-ms:zc-val-cit-apea-af(c73h114n12o13)required[mh+]=1367.9,found[mh+]=1368.9。将5%pd/c(4.4mg)与2m盐酸(0.015ml,0.030mmol)加入zc-val-cit-apea-af(19.0mg,0.014mmol)/etoh(5ml)的溶液中。系统中的空气以氢气替代。反应于环境大气下进行过夜。当zc-val-cit-apea-af完全消耗时,以滤纸自反应混合物中移除催化剂,并于旋转蒸发器上进行滤液浓缩,之后,进行冻干,以获得c-val-cit-apea-af(17.7mg,99%)。将dipea(2.7mg,0.021mmol)、c-val-cit-apea-af(9.0mg,0.069mmol)、nhs(1.2mg,0.010mmol)与edci(1.6mg,0.010mmol)加入叶酸(5.0mg,0.011mmol)/dmf(0.75ml)的溶液中。反应混合物搅拌过夜。以hplc监测反应进程。自反应混合物中移除dmf后,以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。将特定分馏物进行浓缩并冻干,以获得黄色固体的fa-c-val-cit-apea-af(4.5mg,34.7%)。lc-ms:fa-c-val-cit-apea-af(c84h125n19o16)required[mh+]=1657.0,found[mh+]=1657.9。实施例32fa-saa1-val-cit-apea-af之合成将dipea(5.8mg,0.045mmol)、saa1-val-cit-apea-af(22.3mg,0.018mmol)、nhs(3.0mg,0.026mmol)与edci(4.0mg,0.026mmol)加入叶酸(11.2mg,0.025mmol)/dmf(1.5ml)的溶液中。反应混合物搅拌过夜。以hplc监测反应进程。自反应混合物中移除dmf后,以制备型hplc(33%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。将特定分馏物进行浓缩并冻干,以获得黄色固体的fa-saa1-val-cit-apea-af(11.8mg,37.4%)。lc-ms:fa-saa1-val-cit-apea-af(c85h125n19o19)required[mh+]=1716.9,found[mh+]=1717.9(m+h)。实施例33fa-c-saa1-val-cit-apea-af之合成将zc(15.0mg,0.057mmol)、hatu(16.8mg,0.044mmol)与dipea(11.5mg,0.089mmol)加入saa1-val-cit-apea-af(44.0mg,0.029mmol)/dmf(1ml)/dcm(3ml)的溶液中。搅拌混合物过夜。于旋转蒸发器上进行溶剂移除,并以制备型hplc(43%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。收集分馏物,并进行浓缩及冻干,以获得白色固体的zc-saa1-val-cit-apea-af(30.0mg,62.5%)。lc-ms:zc-saa1-val-cit-apea-af(c80h125n13o17)required[mh+]=1540.9,found[mh+]=1541.8。将5%pd/c(5.2mg)与2m盐酸(0.019ml,0.038mmol)加入zc-saa1-val-cit-apea-af(30.0mg,0.018mmol)/etoh的溶液中。系统中的空气以氢气替代。反应于环境大气下进行过夜。当zc-saa1-val-cit-apea-af完全消耗时,以滤纸自反应混合物中移除催化剂,并于旋转蒸发器上进行滤液浓缩,之后,进行冻干,以获得c-saa1-val-cit-apea-af(24.9mg,92.8%)。lc-ms:c-saa1-val-cit-apea-af(c72h119n13o15)required[m+2h]2+=704.0,found[m+2h]2+=705.1。将dipea(2.70mg,0.021mmol)、c-saa1-val-cit-apea-af(11.0mg,0.007mmol)、nhs(1.2mg,0.010mmol)与edci(1.6mg,0.010mmol)加入叶酸(4.5mg,0.013mmol)/dmf(0.7ml)的溶液中。反应混合物搅拌过夜。以hplc监测反应进程。自反应混合物中移除dmf后,以制备型hplc(31%乙腈/水/0.1%tfa;uv210nm;ods-3管柱30*250mm;流速24ml/min)对残留物进行纯化。将特定分馏物进行浓缩并冻干,以获得黄色固体的fa-c-saa1-val-cit-apea-af(3.9mg,25.5%)。lc-ms:fa-c-saa1-val-cit-apea-af(c91h136n20o20)required[mh+]=1830.1,found[mh+]=1831.0。虽然本发明已以数个较佳实施例揭露如上,然其并非用以限定本发明,任何所属
技术领域:
中具有通常知识者,在不脱离本发明之精神和范围内,当可作任意之更动与润饰,因此本发明之保护范围当视后附之权利要求所界定者为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1